一种模拟微生态的益生菌的筛选方法、修复剂及其应用与流程
本发明涉及污染土壤的再生
技术领域:
,尤其涉及一种模拟微生态的益生菌的筛选方法、修复剂及其应用。
背景技术:
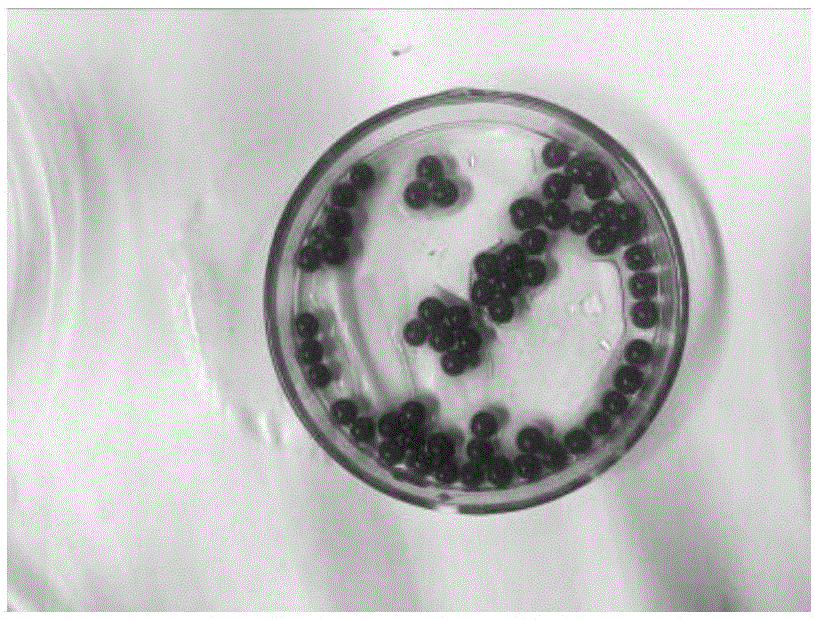
:土壤微生物在土壤生物中占据主导地位。土壤中存在着数目庞大、结构复杂的微生物群落。土壤微生物在与植物共进化过程中形成共生关系,在促进植物生长、防控植物疾病、减少土壤与农作物有机无机污染、调节酸碱度等方面发挥重要作用。工业益生菌的获得有很多方法,常用方法为:富集分离、纯化—小试规模验证功能—通过毒理试验—扩大试验规模验证功能—获得工程化数据—注册,生产。相比而言,益生菌在农业上的应用具有更大的难度,原因是农业生态多变、不具有工业那样的人为可控制性,如土壤、土壤中的生物(含植物、微生物与小型动物)皆受到多变的环境影响。因此普遍的现象就是,农用益生菌田间效果不稳定,与实验室的效果相差甚远,导致多数的实验室工作白废。另外,现有技术得到新型有效微生物的机率越来越低,重要的原因是获取微生物的过程中微生物脱离了原生态的物理化学生物环境:模拟环境不可能复制真实环境,如养分浓度过高,活性氧毒害,微生物间的相互作用如共生、互生缺失,等等。技术实现要素:本发明针对现有技术存在的问题,提供一种模拟微生态的益生菌的筛选方法、修复剂及其应用,采用反向筛选模型的方法筛选生物菌,将离体筛选模型和活体筛选模型相结合,并采用固定化的方法将筛选的生物菌及其他成分固定在小球载体内施于被重金属污染的土壤中,从而显著地降低土壤活性态重金属,并使杂交水稻铅、镉的含量达标。本发明所述的技术问题是以如下技术方案解决的:一种模拟微生态的益生菌的筛选方法,包括如下步骤:a、微生物益生菌培养:100g重金属污染土壤与灭菌蒸馏水按质量比1:1进行浸提,得到重金属污染土壤浸提液,将海藻酸钠、黄原胶、重金属污染土壤、黏土矿物、生物炭、腐植酸、肉汤培养基(nb)和植物培养基(ms)按比例加入浸提液中,混合均匀,并加入水稻种子,向混合物中加入质量分数为1-2%的cacl2,进行固化,培养7-10天,长出微生物;将培养的微生物进行分离纯化,筛选得到16种益生菌,剔除溶血实验阳性的10株菌,保藏6株菌;b、微生物益生菌固定化胶球的制备:将100g重金属污染土壤与灭菌蒸馏水按质量比1:1进行浸提,得到重金属污染土壤浸提液;以浸提液按比例分别配置4%的海藻酸钠、肉汤培养基(nb)、马铃薯培养基(pdb)和植物培养基(ms),将各培养基进行等量混合,向混合培养基中按比例加入黏土矿物、生物炭和腐植酸;将步骤a培养的微生物益生菌和保藏号为cgmccno.5155的环状芽孢杆菌(bacilluscirculans)一同加入到混合培养基中,同时将以步骤a培养的微生物益生菌进行浸泡露白的拟南芥种子加入混合培养基中,混合均匀,将混合液通过枪头注入到2%的cacl2溶液中,留置4h,制成固定化胶球;c、微生物益生菌耐重金属性驯化:将步骤b制备的微生物益生菌固定化胶球装入层析柱中,向柱内连续流入0.6mg/kg的镉和256mg/kg的铅,稀释率d为0.1,停留时间为10个循环的时间,测定流出液中镉、铅的含量,并以肉汤培养基、马铃薯培养基分离流出液中的微生物益生菌;然后,逐次增加镉和铅的含量,镉分别由2mg/kg、8mg/kg至16mg/kg、铅分别对应由512mg/kg、1028mg/kg至2048mg/kg,三轮稀释率d仍为0.1,停留时间仍为10个循环的时间,分离流出液中的微生物益生菌;d、耐重金属益生菌检测:将分离出的微生物益生菌进行活性检测,确定强耐重金属的微生物益生菌均为芽孢杆菌,分别为环状芽孢杆菌、蜂房类芽孢杆菌和芽孢杆菌,所述环状芽孢杆菌(bacilluscirculans)原初分离时成半颗玻璃珠状,经多次诱变驯化后,呈厚的较粘稠状态,仍为圆形,表面粗糙不透明,呈污白色,其保藏号为cgmccno.5155,于2011年8月17日保藏于中国科学院微生物研究所菌种保藏管理中心(地址北京市朝阳区北辰西路1号院3号);所述蜂房类芽孢杆菌(paenibacillusalvei)呈圆形或近圆形,稍有光泽的白色菌落,其保藏号为cgmccno.13007,于2016年9月13日保藏于中国科学院微生物研究所菌种保藏管理中心(地址北京市朝阳区北辰西路1号院3号);所述芽孢杆菌(bacillussp.)呈圆形,粗糙类似毛玻璃状,可对重金属进行生物矿化,其保藏号为cgmccno.15612,于2018年4月12日保藏于中国科学院微生物研究所菌种保藏管理中心(地址北京市朝阳区北辰西路1号院3号);e、耐重金属益生菌反向筛选最佳配比:以肉汤培养基融化海藻酸钠,按比例加入黏土矿物、生物炭和腐植酸,放至40℃,将步骤d得到的微生物菌株按不同比例加入到培养基中,混匀,利用蠕动泵将混合物滴入2%的cacl2溶液中,在4℃条件下硬化储藏,制备成土壤修复剂胶球,盆栽试验确定菌株的最佳配比。上述模拟微生态的益生菌的筛选方法,所述步骤a中,海藻酸钠:黄原胶:重金属污染土壤:黏土矿物:生物炭:腐植酸的配比为6:1:1:1.5:6:1.5,相对应的肉汤培养基和植物培养基的体积为20ml。上述模拟微生态的益生菌的筛选方法,所述步骤a、b中,黏土矿物:生物炭:腐植酸的配比为1:2-5:1。上述模拟微生态的益生菌的筛选方法,其特征在于:所述修复剂的效能用盆栽试验法测定,盆栽土壤选择与微生物培养用土相同,将土壤复合修复剂胶球施于盆栽土中,将经过益生菌培养基溶液浸种至露白的杂交水稻种子移入盆栽土中进行栽培,观察作物生长状况,并对其进行重金属含量的检测,即可得到修复剂的效能参数。一种由模拟微生态益生菌制备的修复剂,所述复合修复剂为固定化胶体小球,由如下质量份的组分组成:核心微生物10-15份,营养成分1-5份,胶体物质4-10份,生物炭10-50份,黏土矿物5-20份,腐植酸10-20份。上述模拟微生态益生菌制备的修复剂,所述核心微生物包括环状芽孢杆菌,所述环状芽孢杆菌的保藏号为cgmccno.5155;蜂房类芽孢杆菌,所述蜂房类芽孢杆菌的保藏号为cgmccno.13007;及芽孢杆菌,所述芽孢杆菌的保藏号为cgmccno.15612;三种益生菌的质量比cgmccno.5155:cgmccno.13007:cgmccno.15612为1:3:3,环状芽孢杆菌cgmccno.5155的有效活菌数为5-10×108cfu/g,蜂房类芽孢杆菌cgmccno.13007的有效活菌数为1-3×108cfu/g,芽孢杆菌cgmccno.15612的有效活菌数为2-5×108cfu/g,三种益生菌的总有效活菌数≥8-18×108cfu/g;所述黏土矿物:生物炭:腐植酸为1:2-5:1。上述模拟微生态益生菌制备的修复剂,所述胶体物质为海藻酸钠与黄原胶的混合物。上述模拟微生态益生菌制备的修复剂,所述黏土矿物为凹凸棒土或者膨润土。上述模拟微生态益生菌制备的修复剂,所述营养成分为植物培养基(ms)、肉汤培养基(nb)和马铃薯培养基(pdb)三种培养基等量混合的混合物。一种模拟微生态益生菌制备的修复剂的应用,所述修复剂适用于适合农田及集中式饮水源地周边土壤的修复。本发明微生物益生菌筛选采用模拟根-土-植物构成的复杂微生态系统,进行反向筛选,不仅考虑到微生物益生菌间的相互作用,也考虑到益生菌与其他功效成分的复配,通过引入原生境的土壤、植物及理化条件,实现益生菌的高效分离,组合优化益生菌。土壤复合修复剂将筛选的微生物益生菌与营养成分等其他成分通过固定化制成胶体小球,保护微生物,使活性益生菌在重金属污染土壤中存活时间长,增加营养成分,为益生菌生长繁殖提供大量能量,有利于活性益生菌在土壤中迅速定植生长及繁殖,且胶体小球方便施入重金属污染的土壤中;核心微生物采用环状芽孢杆菌cgmccno.5155、蜂房类芽孢杆菌cgmccno.13007及芽孢杆菌cgmccno.15612,能够迅速在土壤中定植生长形成强大的菌落,直接吸附重金属离子到微生物细胞壁或细胞内加以固化、钝化,使土壤有机质含量增多,杂交水稻的重金属含量明显降低,铅镉均达到国家标准要求的0.2ppm;三种益生菌加入比例cgmccno.5155:cgmccno.13007:cgmccno.15612为1:3:3时,水稻苗、根部中的重金属含量最低、修复效果最好;另外,对土壤复合修复剂对土壤水分含量检测,得出本发明土壤复合修复剂对土壤具有一定的保水性。附图说明图1为微生物复合土壤修复剂固定化胶球;图2为固定化团聚体筛选耐重金属微生物实验图;图3为拟南芥培育生长状况图。具体实施方式以下结合实施例对本发明作进一步说明。实施例1称取100g重金属污染土壤与灭菌蒸馏水按质量比1:1进行浸提,得到重金属污染土壤浸提液,将海藻酸钠、黄原胶、重金属污染土壤、黏土矿物、生物炭、腐植酸、肉汤培养基(nb)和植物培养基(ms)按6:1:1:1.5:6:1.5:20的比例加入浸提液中,混合均匀,并加入水稻种子,向混合物中加入质量分数为1-2%的cacl2,进行固化,培养7-10天,长出微生物;将培养的微生物进行分离纯化,筛选得到16种益生菌,剔除溶血实验阳性的10株菌,保藏6株菌;微生物益生菌固定化胶球的制备:将100g重金属污染土壤与灭菌蒸馏水按质量比1:1进行浸提,得到重金属污染土壤浸提液;以浸提液分别配置4%的海藻酸钠、肉汤培养基(nb)、马铃薯培养基(pdb)和植物培养基(ms),将各培养基进行等量混合,向混合培养基中按1:10:2的比例加入黏土矿物、生物炭和腐植酸;将步骤a培养的微生物益生菌和保藏号为cgmccno.5155的环状芽孢杆菌一同加入到混合培养基中,同时将以步骤a培养的微生物益生菌进行浸泡露白的拟南芥种子加入混合培养基中,混合均匀,将混合液通过枪头注入到2%的cacl2溶液中,留置4h,制成固定化胶球;微生物耐重金属性驯化:将步骤b制备的微生物益生菌固定化胶球装入层析柱中,向柱内连续流入0.6mg/kg的镉和256mg/kg的铅,稀释率d为0.1,停留时间为10个循环的时间,测定流出液中镉、铅的含量,并以肉汤培养基、马铃薯培养基分离流出液中的微生物益生菌;然后,逐次增加镉和铅的含量,镉分别由2mg/kg、8mg/kg至16mg/kg、铅分别对应由512mg/kg、1028mg/kg至2048mg/kg,三轮稀释率d仍为0.1,停留时间仍为10个循环的时间,分离流出液中的微生物益生菌;耐重金属益生菌检测:将分离出的微生物益生菌进行活性检测,确定强耐重金属的微生物益生菌为环状芽孢杆菌、蜂房类芽孢杆菌和芽孢杆菌,所述环状芽孢杆菌的保藏号为cgmccno.5155,所述蜂房类芽孢杆菌的保藏号为cgmccno.13007,所述芽孢杆菌的保藏号为cgmccno.15612;cgmcc13007的16srdna序列(1444bp)为:cctggtcacctttaggcggctggctccaaaaggttaccccaccgacttcgggtgttacaaactctcgtggtgtgacgggcggtgtgtacaaggcccgggaacgtattcaccgcggcatgctgatccgcgattactagcgattccagcttcatgtaggcgagttgcagcctacaatccgaactgagaacggttttatgagattagctccacctcgcggtcttgcagctctttgtaccgtccattgtagcacgtgtgtagcccaggtcataaggggcatgatgatttgacgtcatccccaccttcctccggtttgtcaccggcagtcaccttagagtgcccaactaaatgatggcaactaagatcaagggttgcgctcgttgcgggacttaacccaacatctcacgacacgagctgacgacaaccatgcaccacctgtcactctgctcccgaaggagaagccctatctctagggttgtcagaggatgtcaagacctggtaaggttcttcgcgttgcttcgaattaaaccacatgctccaccgcttgtgcgggcccccgtcaattcctttgagtttcagccttgcggccgtactccccaggcggagtgcttaatgcgttaacttcagcactaaagggcggaaaccctctaacacttagcactcatcgtttacggcgtggactaccagggtatctaatcctgtttgctccccacgctttcgcgcctcagtgtcagttacagaccagaaagtcgccttcgccactggtgttcctccatatctctacgcatttcaccgctacacatggaattccactttcctcttctgcactcaagtctcccagtttccaatgaccctccacggttgagccgtgggctttcacatcagacttaagaaaccacctgcgcgcgctttacgcccaataattccggataacgcttgccacctacgtattaccgcggctgctggcacgtagttagccgtggctttctggttaggtaccgtcaaggtgccagcttattcaactagcacttgttcttccctaacaacagagttttacgacccgaaagccttcatcactcacgcggcgttgctccgtcagactttcgtccattgcggaagattccctactgctgcctcccgtaggagtctgggccgtgtctcagtcccagtgtggccgatcaccctctcaggtcggctacgcatcgttgccttggtgagccgttacctcaccaactagctaatgcgacgcgggtccatccataagtgacagccgaagccgcctttcaatttcgaaccatgcggttcaaaatgttatccggtattagccccggtttcccggagttatcccagtcttatgggcaggttacccacgtgttactcacccgtccgccgctaacttcataagagcaagctcttaatccattcgctcgacttgcatgtatagca综合培养特征与菌体形态观察、生理生化特性鉴定、遗传特性鉴定的结果,判定cgmccno.13007属于蜂房类芽孢杆菌。耐重金属益生菌反向筛选最佳配比:以肉汤培养基融化海藻酸钠,将黏土矿物、生物炭、腐植酸和海藻酸钠按1:1:1:2的比例混合,放至40℃,将保藏的的微生物益生菌按cgmccno.5155:cgmccno.13007:cgmcc1no.5612比为1:3:3加入到培养基中,混匀,利用蠕动泵将混合物滴入2%的cacl2溶液中,在4℃条件下硬化储藏备用,制备成胶球,盆栽试验确定菌株的最佳配比。实施例2土壤复合修复剂胶球的制备:以肉汤培养基融化海藻酸钠,将黏土矿物、生物炭、腐植酸和海藻酸钠按1:1:1:2的比例混合,放至40℃,将保藏的微生物益生菌按cgmcc515:cgmcc13007:cgmcc15612比为1:1:1加入到培养基中,混匀,利用蠕动泵将混合物滴入2%的cacl2溶液中,在4℃条件下硬化储藏备用,制备成胶球,盆栽试验确定菌株的最佳配比,其他步骤同实施例1。实施例3土壤复合修复剂胶球的制备:以肉汤培养基融化海藻酸钠,将黏土矿物、生物炭、腐植酸和海藻酸钠按1:1:1:2的比例混合,放至40℃,将保藏的微生物益生菌按cgmcc515:cgmcc13007:cgmcc15612比为3:1:3加入到培养基中,混匀,利用蠕动泵将混合物滴入2%的cacl2溶液中,在4℃条件下硬化储藏备用,制备成胶球,盆栽试验确定菌株的最佳配比,其他步骤同实施例1。实施例4土壤复合修复剂胶球的制备:以肉汤培养基融化海藻酸钠,将黏土矿物、生物炭、腐植酸和海藻酸钠按1:1:1:2的比例混合,放至40℃,将保藏的微生物益生菌按cgmcc515:cgmcc13007:cgmcc15612比为3:3:1加入到培养基中,混匀,利用蠕动泵将混合物滴入2%的cacl2溶液中,在4℃条件下硬化储藏备用,制备成胶球,盆栽试验确定菌株的最佳配比,其他步骤同实施例1。实施例5土壤复合修复剂胶球的制备:以肉汤培养基融化海藻酸钠,将黏土矿物、生物炭、腐植酸和海藻酸钠按1:1:1:2的比例混合,放至40℃,只将cgmcc13007加入到培养基中,混匀,利用蠕动泵将混合物滴入2%的cacl2溶液中,在4℃条件下硬化储藏备用,制备成胶球,盆栽试验确定菌株的最佳配比,其他步骤同实施例1。实施例6土壤复合修复剂胶球的制备:以肉汤培养基融化海藻酸钠,将黏土矿物、生物炭、腐植酸和海藻酸钠按1:1:1:2的比例混合,放至40℃,将cgmcc15612加入到培养基中,混匀,利用蠕动泵将混合物滴入2%的cacl2溶液中,在4℃条件下硬化储藏备用,制备成胶球,盆栽试验确定菌株的最佳配比,其他步骤同实施例1。分别对土壤复合修复剂进行如下试验:1、盆栽试验盆栽土壤选择与微生物培养用土相同,每盆土重1000g,正交试验筛选出修复剂中三种益生菌的最佳配比,将添加不同微生物的土壤复合修复剂胶球施于盆栽土中,加入量如表1所示,将经过益生菌培养基溶液浸种至露白的杂交水稻种子移入盆栽土中进行栽培,观察作物生长状况,并对其进行重金属含量的检测。表1盆栽试验正交设计l4(23)注:abc分别为加入cgmcc515、cgmcc13007、cgmcc15612菌的修复剂重量表2l4(23)数据分析参看表1-2,在生物炭、凹凸棒土、腐植酸加入量不变的条件下,得到修复剂最佳菌株配比为cgmcc515:cgmcc13007:cgmcc15612=1:3:3。2、dpta活化态与全铅镉(mg/kg)含量测定gb/t23739--2009土壤质量有效态铅和镉提取方法。dtpa(二乙三胺五乙酸)成分为0.005mol/ldtpa-0.01mol/lcacl2-0.1mol/ltea(三乙醇胺)。称取1.967gdtpa溶于14.92gtea和少量水中;再将1.47gcacl2·2h2o溶于水,一并转入1000ml容量瓶中,加水至约950ml,用6mol/lhcl调节ph至7.30(每升浸提液加入6mol/l的hcl8.5ml),最后用水定容。浸提手续:称取25.00g风干过20目筛的土样放入150ml硬质玻璃三角瓶中,加入50.0mldtpa浸提剂,在25℃用水平振荡机振荡提取2h,干滤纸过滤,滤液用于分析。土壤全pb、cd提取测定方法,按gb/t17141-1997土壤质量铅、镉的测定石墨炉原子吸收分光光度法进行。植物全pb、cd提取方法分别按食品中pb测定gb5009.12-2017、gb5009.15-2014食品安全国家标准食品中镉的测定进行。取水稻0.500克试样放入100ml聚四氟乙烯坩埚中,用蒸馏水湿润后再加入5.0ml的浓hcl,在通风橱内的电热板上先低温加热,使试样得到初步分解,当溶液蒸发约2~3ml时,取下稍冷,然后再加入5.0ml的浓hno3溶液,4.0ml的hf,2.0ml的hclo4,盖上盖子后在电热板上先中温加热约1h,然后在打开盖子,当加热到冒浓厚hclo4白烟时,加上盖子,使黑色的有机碳化物得到充分分解。等到坩埚上的黑色有机物完全消失后,再开盖来驱赶白烟并且蒸至内容物呈粘稠状。再加入2.0ml浓hno3,2.0mlhf,1.0mlhclo4的溶液,并重复上述消解过程。当白烟再次基本上冒尽时并且内容物呈粘稠状,取下坩埚冷却,用蒸馏水冲洗坩埚的内壁和盖子,并且加入1.0mlhno3(1:5)溶液温热溶解剩余的残渣。然后将溶液转移至25ml容量瓶中,加入3.0ml的(nh4)2hpo4溶液,等到冷却后定容,摇匀。将石墨炉原子吸收分光光度仪(北京普析tas–990superafg)性能调至最佳状态:波长283.3nm、228.8nm狭缝0.5nm,灯电流5ma,干燥温度120℃,20s。吸取铅、cd混合标准使用液10.0μg/l,20.0μg/l,40.0μg/l,60.0μg/l,80.0μg/l各10μl,注入石墨炉,测吸光值并算线性回归方程。参看表3,同时加入三种微生物益生菌制备的复合修复剂盆栽试验中,水稻植株、稻谷中铅镉的含量最低,稻谷中的铅含量均低至0.20mg/kg,镉的含量低至0.12mg/kg;土壤中的铅镉含量也比单加入一种微生物的低,铅镉含量均达到国家标准。修复剂中含有的腐殖酸具有疏松“海绵状”结构,比表面积为330~340m2/g;凹凸棒土比表面积为140m2/g,生物炭多孔、比表面积(87-91)m2/g,锁定重金属降低其迁移性;凹凸棒土在固定化包埋中起物理交联作用,适量时,可增加胶球的机械强度,修饰海藻酸钠等大分子胶的网络孔径,有利于所述材料构陷重金属离子。固定化的有机、无机载体对微生物起物理保护作用,其中的培养基及腐殖酸可提供微生物存活的食料。表3盆栽试验土壤dpta活化态与全铅镉(mg/kg)含量注:钝化剂包括黏土矿物、生物炭和腐植酸3、益生菌对pd、cd的耐受量试验将制备的微生物益生菌固定化胶球装入层析柱中,向柱内连续流入镉铅,镉铅的浓度逐渐增高至pb为2048ppm,cd为16ppm,稀释率d为0.1,每轮驯化停留时间达到12h,测定流出液中镉、铅的含量,以营养琼脂分离流出液中的益生菌。采用微量mh肉汤稀释法测定益生菌对pd、cd的耐受量。在96孔板每个孔加入mh肉汤培养基100μl,在a/b/c三排的第一孔加配好的重金属液100μl,然后对药物进行二倍稀释。第一孔中加入药液后用移液枪充分吹打(至少三次以上)使药物与肉汤充分混匀,然后吸取100μl加入第二孔再充分吹打使之与肉汤充分混匀,照此重复直至最后一孔,第12列吸出100ul扔掉,再在每一孔中加入稀释好的菌液100μl,重复做三次(a/b/c三排样品)在同一块板上的g排上做一排阴性对照(仅加空白肉汤不加菌液)和在h排上做一排阳性对照(加菌液不加重金属液)。将96孔板放入37℃恒温培养箱16~20小时后,观察结果。有菌生长孔底部有沉淀,没有沉淀的最后一孔对应的重金属浓度,为该菌的耐受量。不同种群的微生物共处于一个环境中,相互之间的关系之间相互关系是以是以彼此使一方或双方受益、一方或双方受害、双方互不影响的后果而划分的,一般认为益生菌之间具有一方或双方受益的共生关系。在一定稀释率下,系统达到稳态后,包括ph在内的各种环境因素均稳定不变,连续培养使分批培养难以控制的各种细胞的相对含量在高效的过程控制下能维持不变,处于稳定状态的三种菌之间的比例也保持基本不变,因而连续培养系统是研究混菌培养菌际关系、获得重金属抗逆性的较好模型。从表4所示的结果三株菌对重金属pb、cd的耐受量比较原始状态分别高出2-4倍与5-10倍,满足了农田修复剂以及场地修复剂所需,高出或与现有报道的修复菌株耐受量持平。表4三种保藏益生菌对pd、cd的耐受量(mg/kg)cgmccno.5155cgmccno.13007cgmccno.15612pb102420481024cd41684、土壤复合修复剂保水性检测:本发明方法制备的修复剂具有保水性能,盆栽实验在停止加水之后的四个月后,土壤水分含量仍然搞到33.22%。推测原因为微生物产生了保水的聚谷氨酸、多糖等,如cgmcc5155属于环状芽孢杆菌,有报道,环状芽孢杆菌产生的聚谷氨酸具有保水作用,时腐植酸、生物炭、凹凸棒石粘土均具有保水作用。参看图1,本发明制备的土壤复合修复剂胶体小球成型性良好;参看图2,可见发芽的杂交水稻与在重金属土壤里生长的微生物菌苔,由此可见本发明制备的固定化胶体小球,可以保护微生物,使活性益生菌在重金属污染土壤中存活时间长;增加营养成分,为益生菌生长繁殖提供大量能量,使其可以大量繁殖;参看图3,左图为在海藻酸钠包埋耐重金属益生菌与拟南芥的固定化胶球,生长出的拟南芥苗;右图为生长的拟南芥对照。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1