扩增子测序文库的构建方法及引物组和试剂盒与流程
本发明属于基因测序技术领域,具体涉及一种扩增子测序文库的构建方法及引物组和试剂盒。
背景技术
随着近年来资讯通量的激增,高通量测序技术在生命科学及医学领域方面的研究和应用越来越广泛,特别是在疾病诊断及预防中发挥重要作用,其主要表现在产前筛查、肿瘤诊断、重大疾病预防、健康相关宏基因组分析等方面。虽然人类全基因组测序从测序时间和资金花费上已有了巨大的飞跃,但庞大的数据分析和遗传信息提取将费时费力,相比较而言,全外显子测序、基因panel的测序将直击可能引起疾病的大部分基因序列,而扩增子测序更强的目的性及快速的数据分析和少量资金花费等优点将更有利于用于临床疾病检测,如作为新生儿筛查的二线检测,采用illumina第二代高通量测序平台对新生儿样本进行某些先天代谢疾病基因深度测序,能灵敏地将那些携带先天疾病的新生儿在临床症状尚未表现之前或表现轻微时检测出来,通过筛查,得以早期诊断、早期治疗,防止机体组织器官发生不可逆的损伤。
聚合酶链反应(即pcr)是一种广泛运用于分子遗传和诊断的技术,用于放大扩增特定的dna片段,可看作是生物体外的特殊dna复制。pcr的最大特点是将样品中微量的dna大幅增加,达到可检测的水平。扩增子测序则是对特定长度的pcr产物或者捕获的片段进行测序,由于低廉的价格和简便的操作,多重pcr是目标区段富集技术的重要手段。面对大量复杂基因组样本的目标区段捕获,多重pcr技术由于特异性强、价格低、重复性好等优点,已成为首选技术。
目前,基于illumina测序平台的扩增子建库主要采用传统的两步扩增建库方法,即使用两对引物进行两轮pcr进行建库。两对引物的两步扩增方法虽然可以直接使用illumina相配套的试剂进行测序,但建库过程中当样本量较多时,而且,由于在第一轮扩增时没有加入样本标签,使后续操作繁琐且容易引起样本间的交叉污染。即常用的两轮pcr扩增子建库方法一方面需对每个样本单独建库,不能将大批量的样本合并统一处理,操作繁琐、建库效率低,易引起样本间的交叉污染;另一方面,在多重pcr反应中,随着引物对数的增加,引物二聚体和非特异扩增产物会急剧增加,进而导致不同目标片段的拷贝数差异巨大,无法得到均一的产物;再次,采用的建库引物合并了公用序列,使引物合成时不仅需要合成大量的特异性引物,还需合成等量的公用序列,耗费成本大,同时由于引物序列太长,降低了pcr扩增效率,文库的覆盖度及均一性受到影响。
技术实现要素:
本发明的目的在于克服现有技术的上述不足,提供一种扩增子测序文库的构建方法及引物组和试剂盒,旨在解决现有扩增子两步建库法的效率低、成本高,以及文库的覆盖度和均一性差的技术问题。
为实现上述发明目的,本发明采用的技术方案如下:
本发明一方面提供一种扩增子测序文库的构建方法,包括如下步骤:
获得样本dna;
利用第一引物、第二引物和第三引物对所述样本dna进行第一pcr扩增,得到扩增产物;
利用第四引物和第五引物对所述扩增产物进行第二pcr扩增,得到扩增子测序文库;
其中,
所述第一引物从5’端到3’端依次为第一测序标签序列和扩增子特异性正向引物;
所述第二引物从5’端到3’端依次为第二测序标签序列和扩增子特异性反向引物;
所述第三引物从5’端到3’端依次为第二测序接头序列、样本标签序列和所述第二测序标签序列;
所述第四引物从5’端到3’端依次为第一测序接头序列和所述第一测序标签序列;
所述第五引物为所述第二测序接头序列。
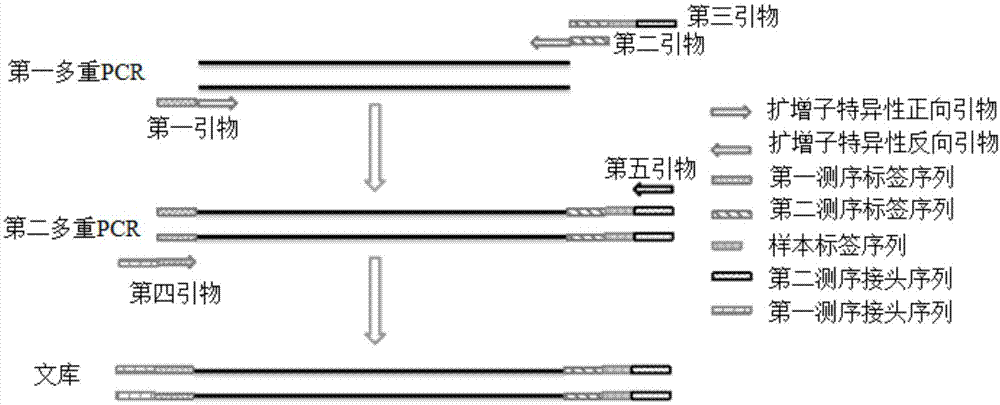
本发明提供的扩增子测序文库的构建方法中,首先提取样本dna,然后利用本发明设计的引物组进行两轮pcr扩增得到;在两轮pcr扩增中:先以第一引物、第二引物和第三引物进行第一轮pcr得到所有扩增子目的片段,该过程中对不同样本来源的所有扩增子目的片段的5’端加上第一测序标签序列,3’端加上依次连接的第二测序标签序列、样本标签序列和第二测序接头序列,因样本标签序列可标记不同的样本,所以第一轮pcr扩增完成后即可将所有样本的扩增产物合并为一管,然后以第一轮pcr的纯化产物为模板,用第四引物和第五引物进行第二轮pcr,将第一测序接头序列添加到第一轮pcr扩增产物的5’端,从而完成扩增子测序文库的构建。该构建方法可大大地节省试剂和工作量,降低成本,而且两轮pcr的扩增效率都很高,最终构建的扩增子测序文库具有更好的覆盖度和均一性。
本发明另一方面提供一种用于扩增子测序文库构建的引物组,所述引物组包括:用于第一pcr扩增的第一引物、第二引物和第三引物,以及用于第二pcr扩增的第四引物和第五引物;其中,
所述第一引物从5’端到3’端依次为第一测序标签序列和扩增子特异性正向引物;
所述第二引物从5’端到3’端依次为第二测序标签序列和扩增子特异性反向引物;
所述第三引物从5’端到3’端依次为第二测序接头序列、样本标签序列和所述第二测序标签序列;
所述第四引物从5’端到3’端依次为第一测序接头序列和所述第一测序标签序列;
所述第五引物为所述第二测序接头序列。
本发明提供的用于扩增子测序文库构建的引物组,第一引物、第二引物和第三引物用于第一pcr扩增,第四引物和第五引物用于第二pcr扩增;该引物组用于扩增子测序文库构建时,在第一轮pcr扩增过程中,可通过该特有结构的三条引物(第一引物、第二引物和第三引物)使所有扩增子目的片段的5’端加上第一测序标签序列,3’端加上依次连接的第二测序标签、样本标签序列和第二测序接头序列,因样本标签序列可标记不同的样本,所以第一pcr扩增完成后即可将所有样本的扩增产物合并为一管,然后直接用第四引物和第五引物进行第二pcr扩增,完成测序文库构建,这样可大大地节省试剂和减少工作量;而且第三引物中的第二测序接头序列、样本标签序列和第二测序标签序列与扩增子引物(即扩增子特异性正向引物和扩增子特异性反向引物)分开,这使得第三引物的使用更加灵活,当一个样本检测n个扩增子时,需要n对特异性引物即第一引物和第二引物,但只需一条第三引物,即只需合成2n+1条引物,可见当扩增子数量和样本量较大时,本发明用于建库的引物组将大大的降低引物合成的成本,而且该引物组中的引物相对现有的引物可以更短,这样可进一步提高pcr扩增效率,可构建具有更好的覆盖度和均一性的扩增子测序文库。
最后,本发明还提供一种用于扩增子测序文库构建的试剂盒,所述试剂盒包括本发明的上述引物组。
本发明的试剂盒中含有本发明特有的引物组,用该试剂盒进行扩增子测序文库构建时,可节省试剂和工作量,降低成本,而且可进一步提高pcr扩增效率,可构建具有更好的覆盖度和均一性的扩增子测序文库。
附图说明
图1为本发明扩增子测序文库的建构流程示意图;
图2为本发明实施例1的扩增子测序深度结果图,其中,横坐标为均一化测序深度(实际测序深度除以扩增子深度的中位数),纵坐标为大于等于该测序深度的扩增子的比例。
具体实施方式
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
需要说明的是,术语“第一”、“第二”仅用于描述发明目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
一方面,本发明实施例提供了一种扩增子测序文库的构建方法,包括如下步骤:
s01:获得样本dna;
s02:利用第一引物、第二引物和第三引物对所述样本dna进行第一pcr扩增,得到扩增产物;
s03:利用第四引物和第五引物对所述扩增产物进行第二pcr扩增,得到扩增子测序文库;
其中,
所述第一引物从5’端到3’端依次为第一测序标签序列和扩增子特异性正向引物;
所述第二引物从5’端到3’端依次为第二测序标签序列和扩增子特异性反向引物;
所述第三引物从5’端到3’端依次为第二测序接头序列、样本标签序列和所述第二测序标签序列;
所述第四引物从5’端到3’端依次为第一测序接头序列和所述第一测序标签序列;
所述第五引物为所述第二测序接头序列。
本发明实施例提供的扩增子测序文库的构建方法中,首先提取样本dna,然后利用本发明实施例设计的引物组进行两轮pcr扩增得到;在两轮pcr扩增中:先以第一引物、第二引物和第三引物进行第一轮pcr得到所有扩增子目的片段,该过程中对不同样本来源的所有扩增子目的片段的5’端加上第一测序标签序列,3’端加上依次连接的第二测序标签序列、样本标签序列和第二测序接头序列,因样本标签序列可标记不同的样本,所以第一pcr扩增完成后即可将所有样本的扩增产物合并为一管,然后以第一轮pcr的纯化产物为模板,用第四引物和第五引物进行第二轮pcr,将第一测序接头序列添加到第一轮pcr扩增产物的5’端,从而完成扩增子测序文库构建。该构建方法可大大地节省试剂和工作量,降低成本,而且两轮pcr的扩增效率都很高,最终构建的扩增子测序文库具有更好的覆盖度和均一性。
现有扩增子测序建库构建时使用两对引物进行,第一轮pcr扩增,引物由测序标签序列与扩增子特异性引物组成,当需同时检测多个样本,如96个样本,第一轮pcr扩增完成后,需要对每个样本进行单独的磁珠纯化,纯化后的产物用于第二轮pcr时,需配制96份反应体系,逐个加入模板,即后续的磁珠纯化和第二轮pcr需要处理多个样本,相当于对每个样本单独建库,需要重复大量工作,操作繁琐且耗费试剂。而本发明实施例在第一轮pcr时,如图1所示,给所有样本加上了相同的第一测序标签序列、第二测序标签序列和第二测序接头序列,同时在不同样本目的片段3’端加上不同的样本标签序列,相同的第一测序标签序列和第二测序标签序列便于第二轮pcr通过一对引物(第四引物和第五引物)将测序接头加上,第一轮pcr扩增结束后,可将所有样本的pcr产物合并为一管,然后进行纯化,这就避免了实验中人为的操作误差、pcr仪的孔位差异以及样本间可能存在的交叉污染,能更真实有效的反应样本的测试结果,而且能够节省后续磁珠用量,可由原来纯化96个样本简化为纯化一个样本,大大的减少了工作量;同时,合并后纯化的产物即可作为一个样本用于第二轮pcr,即第二轮pcr配制一个样本的反应体系就可完成,这也将节省试剂并减少工作量。
进一步地,在上述步骤s01中,样本dna可以来自各种生物体的基因组dna样本,如来自人的血液、唾液和组织等,最终获得每个样本dna的重量可为200-300ng。
进一步地,在上述步骤s03中,按所述第一引物、所述第二引物和所述第三引物的摩尔比为3:1:3,对所述样本dna进行第一pcr扩增,在该条件下可更好地提高扩增效率。本发明实施例中,第一pcr扩增为多重pcr扩增,利用该三种引物进行第一轮pcr是为了得到5’端带有第一测序标签序列,3’端具有第二测序标签序列、样本标签序列(index)及第二测序接头序列的特异的扩增子片段。扩增过程如下:首先第一引物与第二引物以样本dna为模板扩增得5’端带有第一测序标签序列,3’端带有第二测序标签序列的特异性扩增子中间产物(这一中间产物并不是我们的目的产物);然后第一引物与第三引物以该特异性扩增子中间产物为模板扩增得到目的片段。可见,该反应过程中,第一引物消耗最大,同时由于pcr扩增的随机性反应过程中会产生只有第一引物和第二引物扩增的中间产物,所以为保证尽可能多地将中间产物转化为目的片段,需加大第一引物和第三引物的浓度,促使该反应的进行。另一方面,我们验证了不同的第一引物、第二引物和第三引物的引物浓度比(如“2:1:2”、“3:1:3”、“5:1:5”和“10:1:10”)进行对比分析,结果表明“按所述第一引物、所述第二引物和所述第三引物的摩尔比为3:1:3,对所述样本dna进行第一pcr扩增”时,扩增所得的目的片段占比最大,扩增效率最大。
更进一步地,在所述第一pcr扩增的步骤之后,还包括第一磁珠纯化的步骤。优选地,利用ampurexpbeads纯化2次。而所述第二pcr扩增的步骤之后,还包括第二磁珠纯化的步骤,优选地,利用ampurexpbeads纯化1次。
更进一步地,在所述第一pcr扩增的步骤中,退火和延伸合并为一步,且每个循环中设置三个退火温度,这样可进一步提高扩增子测序文库的覆盖度。
根据扩增子的个数,可设计多对扩增子特异性正向引物和扩增子特异性反向引物,因此第一pcr可以是针对多个扩增子(可高达上百个,如六百多个扩增子)的超高多重pcr反应,即反应体系有六百多对特异性引物,不同的引物退火温度有所差异,设置三个梯度的退火温度,可使各引物能在最佳退火温度找到模板,如此可增大扩增效率;同时,将退火与延伸合并在一步进行,延长退火/延伸时间,使更多的引物能够匹配到相应模板,同时得到有效延伸。优选地,在一优选实施例中,可以在58-62℃范围的选择三个平行梯度的退火温度,本发明实施例中,优选62℃、60℃和58℃三个退火温度,最终得到扩增子测序文库的覆盖度最佳。
另一方面,本发明实施例还提供了一种用于扩增子测序文库构建的引物组,所述引物组包括:用于第一pcr扩增的第一引物、第二引物和第三引物,以及用于第二pcr扩增的第四引物和第五引物;其中,
所述第一引物从5’端到3’端依次为第一测序标签序列和扩增子特异性正向引物;
所述第二引物从5’端到3’端依次为第二测序标签序列和扩增子特异性反向引物;
所述第三引物从5’端到3’端依次为第二测序接头序列、样本标签序列和所述第二测序标签序列;
所述第四引物从5’端到3’端依次为第一测序接头序列和所述第一测序标签序列;
所述第五引物为所述第二测序接头序列。
本发明实施例提供的用于扩增子测序文库构建的引物组,第一引物、第二引物和第三引物用于第一pcr扩增,第四引物和第五引物用于第二pcr扩增;该引物组用于扩增子测序文库构建时,在第一轮pcr扩增过程中,可通过该特有结构的三条引物(第一引物、第二引物和第三引物)使所有扩增子目的片段的5’端加上第一测序标签序列,3’端加上依次连接的第二测序标签、样本标签序列和第二测序接头序列,因样本标签序列可标记不同的样本,所以第一pcr扩增完成后即可将所有样本的扩增产物合并为一管,然后直接用第四引物和第五引物进行第二pcr扩增,完成测序文库构建,这样可大大地节省试剂和减少工作量;而且第三引物中的第二测序接头序列、样本标签序列和第二测序标签序列与扩增子引物(即扩增子特异性正向引物和扩增子特异性反向引物)分开,这使得第三引物的使用更加灵活,当一个样本检测n个扩增子时,需要n对特异性引物即第一引物和第二引物,但只需一条第三引物,即只需合成2n+1条引物,可见当扩增子数量和样本量较大时,本发明实施例用于建库的引物组将大大的降低引物合成的成本,而且该引物组中的引物相对现有的引物可以更短,这样可进一步提高pcr扩增效率,可构建具有更好的覆盖度和均一性的扩增子测序文库。
具体地,本发明实施例的引物组中,扩增子特异性正向引物和扩增子特异性反向引物是根据扩增子序列设计的特异性引物,可与扩增子特异性结合;样本标签序列(即index)由碱基按不同的排列组合形成,不同的样本对应的样本标签序列不同,即样本标签序列与样本具有唯一对应关系。而第一测序标签序列和第二测序标签序列,第一测序接头序列和第二测序接头序列为测序时所使用的序列。
优选地,本发明实施例中的第一测序接头序列和第二测序接头序列为illumina测序平台的接头序列p5、p7,具体第一测序接头序列(p5)如seqidno.1所示,第二测序接头序列(p7)如seqidno.2所示。更优选地,由于引物合成量大,合成成本较高,本发明实施例中引入的第一测序标签序列和第二测序标签序列并非illumina测序平台的测序标签,而是比其碱基数更少的cs1、cs2,具体第一测序标签序列(cs1)如seqidno.3所示,第二测序标签序列(cs2)如seqidno.4所示。
更进一步地,本发明实施例的引物组中,所述第一引物、所述第一引物和所述第三引物的摩尔比为3:1:3。在该摩尔比的条件下,第一引物、第一引物和第三引物进行的第一pcr扩增的效率最高。
最后,本发明实施例还提供一种用于扩增子测序文库构建的试剂盒,所述试剂盒包括本发明实施例的上述引物组。
本发明实施例的试剂盒中含有本发明实施例特有的引物组,用该试剂盒进行扩增子测序文库构建时,可节省试剂和工作量,降低成本,而且可进一步提高pcr扩增效率,可构建具有更好的覆盖度和均一性的扩增子测序文库。
进一步地,所述试剂盒还包括pcr缓冲液、dna聚合酶。
本发明先后进行过多次试验,现举一部分试验结果作为参考对发明进行进一步详细描述,下面结合具体实施例进行详细说明。
实施例1
1、引物设计及合成
应用ionampliseqtmdesigner软件根据目的基因pah、pts、slc25a13、slc22a5、mmachc、mut、pcca、pccb、mccc1、mccc2、ivd和otc的外显子区设计特异性引物(即扩增子特异性正向引物和扩增子特异性反向引物),在扩增子特异性正向引物5’端加上第一测序标签序列(即cs1)即为第一引物;扩增子特异性反向引物5’端加上第二测序标签序列(即cs2)即为第二引物;由第二测序接头(即p7)、样本标签序列(即index)、第二测序标签序列组合为第三引物;第四引物由第一测序接头(即p5)与第一测序标签序列组成;第五引物为第二测序接头序列。因本实施例有275个扩增子,需合成第一引物、第二引物各275条,第三引物3暂合成96条、第四引物与第五引物各合成1条,cs1序列、cs1反向互补序列、cs2序列、cs2反向互补序列各1条。引物设计完成后,由invitrogen公司合成。
本发明中的第一测序接头序列p5和第二测序接头序列p7为illumina测序平台的接头序列;另外,由于引物合成量大,合成成本较高,本实施例中引入的测序标签并非illumina测序平台的测序标签,而是比其碱基数更少的第一测序标签序列cs1、第二测序标签序列cs2,序列如下:
p5序列(seqidno.1):aatgatacggcgaccaccgagatct;
p7序列(seqidno.2):caagcagaagacggcatacgagat;
cs1序列(seqidno.3):acactgacgacatggttctaca;
cs2序列(seqidno.4):tacggtagcagagacttggtct。
2、样本dna提取
选自人的血液、唾液和组织等样本dna均可用于扩增。在用核酸自动提取仪提取样本dna后,用qubitflurometer3.0定量,检测每一个样本需要dna模板约200~300ng。
3、第一轮pcr反应
采用以下表1和表2的pcr反应体系及表3的pcr程序对获得的每份基因组的样本dna做多重pcr扩增。该轮多重pcr共包含275个扩增子,分2管进行,其中多重pcr反应体系1(表1:反应体系总体积25ul)包含139个扩增子,多重pcr反应体系2(表2:反应体系总体积25ul)包含136个扩增子。配制96个样本所需扩增子上游引物(第一引物)混合池、下游引物(第二引物)混合池,其中各引物终浓度为1μm;96个不同样本标签的对应第三引物终浓度定为50μm。反应体系中每个扩增子三种引物的浓度比为,第一引物:第二引物:第三引物=3:1:3,同一个样本的2个多重pcr反应体系中加入相同样本标签的第三引物,具体反应体系如下:
表1
表2
将上述反应体系的成分加入将pcr管中,然后置于pcr仪中,进行如下表3的pcr程序:
表3
4、第一轮pcr产物纯化
第一轮pcr反应完成后,将96个样本的pcr产物,每管取10μl合并为1管,震荡混匀后取500μl用0.8倍体积的ampurexpbeads纯化2次,然后溶于50μl的te。
5、第二轮pcr反应
利用上述第一轮pcr纯化产物,进行第二轮pcr反应,此轮pcr只需两条引物:第四引物和第五引物。pcr反应体系50ul,如下表4:
表4
将上述反应体系的成分加入将pcr管中,然后置于pcr仪中,进行如下表5所示的pcr程序。
表5
6、第二轮pcr产物纯化
第二轮pcr反应完成后,pcr产物用0.8倍体积的ampurexpbeads纯化1次,溶于50μl的te,完成测序用文库构建。
7、文库定量、上机测序
参考qubitflurometer3.0说明书,对二轮pcr后建立的扩增子测序文库进行准确定量。产物经文库检测合格后,使用illumina测序平台进行pe150上机测序,步骤严格按照供应商要求使用。
8、测序数据信息分析
对测序所得的数据进行低质量序列以及接头序列过滤后,利用比对软件bwa将其比对到参考基因组(grch37/hg19)上,通过分析不同扩增子的测序深度(reads)来判断多重pcr建库的性能及均一性。
9、测序结果
通过本实施例的方法建库,测序分析结果如下:
不同扩增子的测序深度如图2所示,96个样本的275个扩增子至少有1个测定序列数(reads),95.3%的扩增子测序深度在30×以上,可重复性100%,并且本实施例检测到的所有扩增子深度分布集中,大部分测定的序列数差异在1~2个数量级。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
序列表
<110>深圳联合医学科技有限公司
<120>扩增子测序文库的构建方法及引物组和试剂盒
<160>4
<170>siposequencelisting1.0
<210>1
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>1
aatgatacggcgaccaccgagatct25
<210>2
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>2
caagcagaagacggcatacgagat24
<210>3
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>3
acactgacgacatggttctaca22
<210>4
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>4
tacggtagcagagacttggtct22
- 还没有人留言评论。精彩留言会获得点赞!