一种外周血单个核细胞分离管及其制备方法与流程
本发明属于血液取样、分离、纯化细胞成分领域,具体涉及一种外周血单个核细胞分离管及其制备方法。
背景技术:
外周血单个核细胞(peripheralbloodmononuclearcells,pbmcs)是指外周血中具有单个细胞核的细胞,包括多种淋巴细胞和单核细胞,是免疫系统的重要组成部分。具体地,外周血单个核细胞包括约15%的b淋巴细胞、约70%的t淋巴细胞、约10%的自然杀伤细胞,以及约5%的单核细胞。
目前,从全血分离得到pbmcs最经典的方法是ficoll-hypaque密度梯度离心法。ficoll-hypaque分层液是ge公司的产品,是一种具有一定粘度和比重的,近似于等渗的溶液。具体地,ficoll-hypaque分层液是一种含有ficollpm400(一种蔗糖和环氧氯丙烷聚合物,易溶于水,其分子量是400000)和泛影酸钠、依地酸钙钠的混合水溶液。其中,ficollpm400具有粘度,易于聚集细胞;并且由于其分子量大并具有较低的渗透压,因此其不会透过细胞膜破坏细胞结构,也不会使细胞渗透失水。泛影酸钠的分子式如附图2所示,全称为3,5-双(乙酰胺基)-2,4,6-三碘苯甲酸的钠盐,分子量为635.92,具有光敏性。由于泛影酸钠分子量较小且为钠盐,属于离子类物质,能够对细胞的渗透压造成一定的影响,能够去除单个核细胞层中其他细胞所需的最佳密度和渗透压,从而提高单个核细胞的纯度。常用的ficoll-hypaque分层液的比重为1.077。
ficoll-hypaque分层液分离提取血液中的pbmcs的原理为:人类静脉血中的各种细胞的比重不同,其中,红细胞的比重为1.093~1.096,粒细胞的比重为1.087~1.092,单个核细胞的比重为1.076~1.090之间,血浆的比重为1.025到1.030之间;通过离心使得血液中的各种细胞按照密度大小分层,红细胞、粒细胞位于ficoll-hypaque分层液下方,单个核细胞位于ficoll-hypaque分层液上方,从而实现单个核细胞的分离提取。
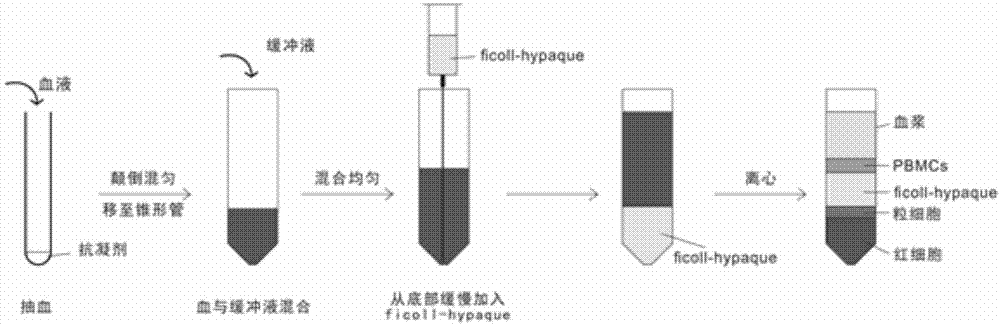
而ficoll-hypaque密度梯度离心法的操作过程,如附图1所示,包括以下步骤:
1)静脉取血后,将血液使用含有抗凝剂的真空采血管从志愿者的静脉中抽取一定量的血液,然后轻轻的颠倒采好血的真空采血管8-10次,使抗凝剂和血液完全混合均匀;
2)使用移液器将抗凝血转移到锥形管中;
3)向锥形管中加入一定体积的缓冲液稀释抗凝血;
4)使用移液器把ficoll-hypaque溶液小心的加入到稀释血液的下方,注意不要使ficoll-hypaque溶液和稀释血液混合;
5)离心使得抗凝血分层,从下到上每层的成分依次是红细胞、粒细胞、ficoll-hypaque溶液、pbmcs和血浆,即离心得到pbmcs层;
6)从液体界面处小心吸取pbmcs层,收集得到pbmcs。
ficoll-hypaque分层液能够分离提取血液中的pbmcs的原理如下所示,
从上述步骤中,可以看到ficoll-hypaque密度梯度离心法存在以下几点不足:1)操作程序多且耗时长;2)把ficoll-hypaque溶液小心放入到稀释血液的下方,而且二层要避免混合,此步骤要有很熟练的操作技能;3)离心条件的不一致,会使pbmcs的回收率和纯度存在差别;4)不同操作者即使用同样的方法分离得到pbmcs的纯度和回收率也会有不一样,重复性较差。
技术实现要素:
为了克服上述技术问题,本发明的目的是提供一种外周血单个核细胞分离管,以简化外周血单个核细胞的提取步骤、降低提取难度并提高可重复性。
本发明的外周血单个核细胞分离管,包括管体和管塞,所述管体内部从底往上,按照比重由大到小,依次包括ficoll-hypaque分层液层、分离胶层和抗凝剂层;所述管体中,分离胶层的上方空间用于容置样品血液。
相对于现有技术,使用本发明的外周血单个核细胞分离管无需进行将血液从真空采集管中转移到锥形管中的操作,也无需进行将ficoll-hypaque分层液小心地注入血液下方的操作,吸取pbmcs层时也无需从液体界面小心地吸取而是可以放心大胆地从固体的分离胶界面和黄色的血浆之间吸取。从而减少了实验用具,简化了操作的过程,降低了操作的难度,也降低了不同操作者之间的不一致性。
进一步地,所述分离胶的比重为1.050-1.080。
进一步地,所述分离胶层中的分离胶是通过向基体树脂中加入比重调节剂和有机凝胶剂制成,基体树脂、比重调节剂和有机凝胶剂的重量比为100:2-7:0.5-5;所述基体树脂由α-烯烃和马来酸二烷基酯两种单体在引发剂作用下聚合而成,α-烯烃、马来酸二烷基酯和引发剂的质量比为1:1-1.4:0.04-0.12;所述基体树脂的比重为1.030~1.060。
α-烯烃和马来酸二烷基酯的密度差别大,可以通过调整两者的用量比例得到不同比重值的基体树脂,即得到不同比重的分离胶。另外,α-烯烃是指碳碳双键在分子链终端的烯烃,烯烃可以在引发剂的作用下进行自由基聚合反应。而在自由基聚合反应中,聚合温度可以影响聚合的速率,从而影响合成聚合物的粘度。因此,在本发明中可以简单地通过控制聚合温度控制分离胶的粘度。
进一步地,所述引发剂为过氧化物,所述比重调节剂为粒径为5-50nm的纳米二氧化硅;所述有机凝胶剂为分子量500~10000的聚氧乙烯聚丙烯醚。无论是亲水二氧化硅还是疏水二氧化硅颗粒的表面都覆有羟基,颗粒表面的羟基会与基体树脂上带有孤对电子对的官能团,如酯基和氨基,形成氢键,从而赋予了分离胶触变性能,即在静止状态下,分离胶为固体,在振动摇晃状态下,如离心,分离胶为流体;调节分离胶中纳米二氧化硅的用量可以调节分离胶的触变性能。另外,纳米二氧化硅的比重约为2.2,远高于基体树脂的比重1.030~1.060,因此,也可以通过调节纳米二氧化硅颗粒和基体树脂的用量比例,得到不同比重的分离胶。但是,如果纳米二氧化硅量过多,在分离管离心过程中,纳米二氧化硅会从分离胶中甩出来,残留在分离得到的pbmcs层上面形成油滴,影响使用效果。聚氧乙烯聚氧丙烯醚可以通过分子间作用力,如氢健、范德华力、π-π健堆积等,自组装形成纤维状结构,这些自组装形成的纤维结构又能够缠绕在一起形成三维网络结构,以固定基底树脂形成凝胶。并且,其还能够与基体树脂、纳米二氧化硅形成氢健,从而提高分离胶中氢健的密度,有助于改善胶体的触变性能。因此,在使用聚氧乙烯聚氧丙烯醚的情况下,可以减少纳米二氧化硅的量,以使分离胶具备足够的触变性能,也避免了纳米二氧化硅甩出污染产物pbmcs层。
优选地,所述基体树脂中的α-烯烃的碳原子数为6~20,马来酸二烷基酯的酯基的碳原子数为1~14。α-烯烃的碳原子多于20个时,合成的共聚物在室温下是固态;而α-烯烃的碳原子小于6个时,其沸点较低,在较高的聚合温度时易挥发,不利用共聚反应的进行。马来酸二烷基酯的酯基碳原子超过14个时,合成的共聚物具有过高的凝固点,在室温下就会成固态,并且随着酯基的碳原子个数增加时,会逐渐增加从共聚物总蒸馏出未参与聚合反应的马来酸二烷基酯的难度。
优选地,所述引发剂为过氧化苯甲酸叔丁酯;所述抗凝剂为浓度为0.10~0.15mol/l的柠檬酸钠溶液。ca2+作为一种凝血因子,在其缺失的情况下,凝血酶原无法被激活,导致血液不能凝固;而柠檬酸根离子可与血液中的ca2+相络合,形成不易离解的可溶性络合物,而使血液中ca2+浓度降低,从而达到阻止血液凝固效果。
进一步地,所述管体内壁上还设置有一层仿生膜,所述仿生膜为改性硅氧烷。仿生膜会使离体的血液犹如在血管壁中,利于血液保持流体不凝固,也利于血液中各种细胞保持更好地活性。具体地,本发明中使用的改性硅氧烷为聚醚改性硅氧烷。
本发明还提供所述外周单个核细胞分离管的制备方法,包括以下步骤:
s1合成分离胶的基体树脂:按重量比称取α-烯烃、马来酸二烷基酯和引发剂;将α-烯烃和马来酸二烷基酯混合均匀并加热至140~160℃后,以滴加方式加入引发剂,滴加时间为3-4h;滴加完毕后,于140~160℃保温2-3h,得到基体树脂;
s2合成分离胶:按重量比称取和混匀基体树脂、比重调节剂和有机凝胶剂后,于真空条件下分散调和1-2h得到分离胶;
s3制备分离管:将管体中先加入1.5-2.5mlficoll-hypaque分层液,再加入1-3g分离胶,于1500g离心力下离心5min后,加入0.8-1.2ml浓度为0.10~0.15mol/l的抗凝剂;然后真空压塞制得单个核细胞分离管;
在本制备过程中,所用试剂和管体、管塞均经过灭菌处理。
本发明还提供一种胶体,通过向基体树脂中加入比重调节剂和有机凝胶剂制成,基体树脂、比重调节剂和有机凝胶剂的重量比为100:2-7:0.5-5;所述基体树脂由碳原子数为6~20的α-烯烃和酯基的碳原子数为1~14的马来酸二烷基酯两种单体在引发剂作用下聚合而成,碳原子数为6~20的α-烯烃、酯基的碳原子数为1~14的马来酸二烷基酯和引发剂的质量比为1:1-1.4:0.04-0.12。
进一步地,所述引发剂为过氧化物,所述比重调节剂为粒径为5-50nm的纳米二氧化硅;所述有机凝胶剂为分子量500~10000的聚氧乙烯聚丙烯醚。
本发明还提供一种高分子聚合物,所述高分子聚合物由碳原子数为6~20的α-烯烃和酯基的碳原子数为1~14的马来酸二烷基酯两种单体在引发剂作用下聚合而成,碳原子数为6~20的α-烯烃、酯基的碳原子数为1~14的马来酸二烷基酯和引发剂的质量比为1:1-1.4:0.04-0.12;所述引发剂为过氧化苯甲酸叔丁酯。
为了更好地理解和实施,下面结合附图详细说明本发明。
附图说明
图1为现有技术的ficoll-hypaque密度梯度离心法提取pbmcs的流程示意图;
图2为ficoll-hypaque分层液的主要成分——泛影酸钠的化学结构式;
图3为本发明的外周血单个核细胞分离管的结构示意图;
图4为使用本发明的外周血单个核细胞分离管提取pbmcs的流程示意图;
图5为本发明中,α-烯烃和马来酸二烷基酯两种单体在引发剂作用下聚合生成α-烯烃-马来酸二烷基酯共聚物,即基体树脂的化学方程式;
图6为纳米二氧化硅颗粒的结构示意图,其中,a为亲水二氧化硅颗粒的结构示意图,b为疏水二氧化硅颗粒的结构示意图,r代表疏水官能团;
图7为本发明的外周血单个核细胞分离管的制备流程图;
图8为使用本发明的外周血单个核细胞分离管提取的pbmcs的台盼蓝染色镜检图,400倍放大。
具体实施方式
请参阅图3,其为本发明的外周血单个核细胞分离管的结构示意。本发明的外周血单个核细胞分离管,包括管体和管塞,所述管体为玻璃管或者塑料管,所述管塞为橡胶管塞。所述管体的底部从下而上依次包括ficoll-hypaque分层液层、分离胶层和抗凝剂层,抗凝剂层上方的空间用于容置样品血液。其中,按照比重由大到小,ficoll-hypaque分层液的比重大于分离胶,分离胶的比重大于抗凝剂。
具体地,所述分离胶层中设置有分离胶,所述分离胶比重为1.050-1.080。所述分离胶是通过向基体树脂,即α-烯烃-马来酸二烷基酯共聚物中加入比重调节剂和有机凝胶剂制成的具有一定的比重、粘度和良好的触变性能的胶体物质。其中,所述基体树脂是由α-烯烃和马来酸二烷基酯两种单体在引发剂作用下聚合而成的高分子聚合物,比重为1.030-1.060。其中,基体树脂、比重调节剂和有机凝胶剂的重量比为100:2-7:0.5-5;α-烯烃和马来酸二烷基酯的质量比为1:1-1.4,引发剂与α-烯烃和马来酸二烷基酯的总质量比为0.02-0.05:1,即α-烯烃、马来酸二烷基酯和引发剂的质量比为1:1-1.4:0.04-0.12。在本发明中,优选比重调节剂为5-50nm粒径的纳米二氧化硅颗粒,包括疏水纳米二氧化硅和亲水纳米二氧化硅;优选有机凝胶剂为聚氧乙烯聚氧丙烯醚;优选引发剂为过氧化苯甲酸叔丁酯,优选碳原子数为1~16的α-烯烃和酯基碳原子数为1~14的马来酸二烷基酯。更加优选的,酯基碳原子数为1~8的马来酸二烷基酯。
所述ficoll-hypaque分层液层中设置有ficoll-hypaque分层液。ge公司的ficoll-hypaque分层液产品有三种,比重分别为1.077、1.084和1.073,其中,比重为1.077的ficoll-hypaque分层液,用于从人类静脉血中分离中单个核细胞;比重为1.084的ficoll-hypaque分层液,用于分离出更高密度的人类的单核细胞,也可以从老鼠血液中分离得到血细胞;比重为1.073的ficoll-hypaque分层液,用于低密度的人类单个核细胞,例如:间充质干细胞或者单核细胞。此三种ficoll-hypaque分层液均可用于本发明的分离管中。
所述抗凝剂层中设置有抗凝剂,所述抗凝剂的比重约为1.01。本发明中优选的抗凝剂为0.10-0.15mol/l的柠檬酸钠溶液。血液在分离管中与抗凝剂反应,避免了血液凝固,得到抗凝血。
请参阅图4,其为使用本发明的外周血单个核细胞分离管提取pbmcs的流程示意图。使用本发明的外周血单个核细胞分离管提取单个核细胞的操作,包括以下步骤:
1)将病人静脉中的血液抽入本发明的分离管中;
2)轻轻颠倒分离管8~10次使血液和抗凝剂充分混匀,阻止血液凝固,得到抗凝血;
3)于1500g离心力下离心20min使血液分层,每层中的组分自下而上依次为红细胞、粒细胞、ficoll-hypaque分层液(该层主要为ficoll-hypaque分层液中的泛影酸钠组分)、分离胶、混有ficoll-hypaque分层液的pbmcs(该层混有的ficoll-hypaque分层液主要为ficollpm400组分)和血浆,得到pbmcs层,该pbmcs层位于在本发明的分离胶的上方。
4)吸取本发明的分离胶上方与黄色血浆之间pbmcs层,收集得到pbmcs。
可见,相对于现有的ficoll-hypaque密度梯度离心法,使用本发明的外周血单个核细胞分离管无需进行将血液从真空采集管中转移到锥形管中的操作,也无需进行将ficoll-hypaque分层液小心地注入血液下方的操作,吸取pbmcs层时也无需从液体界面小心地吸取而是可以放心大胆地从固体的分离胶界面和黄色的血浆之间吸取。从而减少了实验用具,简化了操作的过程,降低了操作的难度,也降低了不同操作者之间的不一致性。
本发明的分离管的工作原理如下所示:吸取血液,颠倒混匀得到抗凝血后,抗凝血位于本发明的分离胶上方,ficoll-hypaque分层液位于分离胶下方。随着离心的进行,具有触变性能的分离胶成为可以流动的流体,抗凝血中比重较大的红细胞、粒细胞穿过分离胶和和ficoll-hypaque分层液到达分离管底部,而抗凝血中比重较小的单个核细胞和血浆留在分离胶上方。实际上,本发明的分离胶的比重为1.050-1.080小于单个核细胞的比重1.076-1.090,理论上,单个核细胞应该位于分离胶的下方。但是由于ficoll-hypaque分层液中的比重较小的ficollpm400组分与分离胶的比重差值(1.050-1.080~1.020)远大于单个核细胞与分离胶的比重差值,从而使得在离心的过程中,ficollpm400组分穿过分离胶胶体上升的速度快于单个核细胞穿过分离胶胶体下降的速度,而上升到分离胶上方的ficollpm400组分利用自身的高粘度迅速使大量尚停留在分离胶上方的单个核细胞聚集起来,从而使得单个核细胞层停留在分离胶上方。这是原理上的解释,实际上ficoll-hypaque分层液中的ficollpm400组分和泛影酸钠组分相互充分的融合在一起,因此,穿到分离胶上方的不止ficollpm400组分还有泛影酸钠组分,只是ficollpm400组分的比例更高;留在分离胶下方的也不止比重较大的泛影酸钠组分还有ficollpm400组分,只是泛影酸钠组分的比例更高。
由于无论是使用本发明的分离管分离得到的pbmcs层,还是使用传统的ficoll-hypaque密度梯度离心法分离得到的pbmcs层,均含有除了单个核细胞之外的其他物质,如血小板和红细胞等,而本发明的分离管分离得到的pbmcs层中还混有ficoll-hypaque分层液,主要是混有ficoll-hypaque分层液中比重较轻的ficollpm400组分。因此,在分离得到pbmcs层之后,需要除去pbmcs层中的其他物质,以纯化pbmcs。以下为具体地pbmcs层纯化步骤:
1)将pbmcs层取出放入试管中,加入乙酸使红细胞溶解;
2)加入一定体积的pbs缓冲液并颠倒混匀,使pbs缓冲液和单核细胞混合均匀;
3)在300g的离心力下,离心15min后,尽量吸去上清液,不扰动细胞层;
4)重复步骤2)和3)直至血小板和ficoll-hypaque分层液去除干净。
以下具体介绍,本发明的外周血单个核细胞的制备方法,包括以下步骤:
预备工作:将φ16(mm)*125(mm)的玻璃管管体内壁浸涂一层聚醚改性硅氧烷,然后于120-150℃烘干2h得到管体内壁的仿生膜。
s1合成分离胶的基体树脂:按重量比称取α-烯烃、马来酸二烷基酯和过氧化苯甲酸叔丁酯;将α-烯烃和马来酸二烷基酯混合均匀后,加入四口烧瓶中加热至140~160℃后,以滴加方式加入过氧化苯甲酸叔丁酯,滴加时间为3-4h;滴加完毕后,于140~160℃保温2-3h后,将温度上升至190℃,然后减压蒸馏蒸出具有挥发性的物质和没有反应掉的单体,得到基体树脂;
s2合成分离胶:按重量比称取和混匀基体树脂、纳米二氧化硅和聚氧乙烯聚氧丙烯醚后,投入行星分散剂中,于真空条件下分散调和1-2h得到分离胶;
s3制备分离管:向涂覆了仿生膜之后的管体中先加入2mlficoll-hypaque分层液,再加入2-3g分离胶,于1500g离心力下离心5min后,加入0.8-1.2ml浓度为0.10~0.15mol/l的柠檬酸钠溶液;然后真空压塞制得单个核细胞分离管;其中,真空度设为8ml的抽血量;
在本制备过程中,所用试剂和管体、管塞均经过灭菌处理。此处仅记录了制备分离管的关键步骤,还有贴标、质检、包装等工业化流程此处不再赘述,可以参阅附图7,了解分离管的制作全过程。另外,所述管体可以为玻璃管体,也可为塑料管体。
按照上述制备过程,进行以下具体实施例。
效果测试
使用实施例一-实施三的制备方法制得的分离管进行采血和pbmcs分离提取,效果如下表所示:
其中,单个核细胞的回收率=(pbmcs层体积*pbmcs层单个核细胞的浓度)/(全血的体积*全血单个核细胞的浓度)×100%
单个核细胞的纯度=(pbmcs层体积*pbmcs层单个核细胞的浓度)/(pbmcs层体积*pbmcs层白细胞的浓度)×100%
利用台盼蓝实验计算单个核细胞的存活率,单个核细胞的存活率=活的单个核细胞的个数/总的单个核细胞个数×100%
由上表可知,运用本发明的外周血单个核细胞分离管收集的单个核细胞的纯度和存活率都很高,回收率也达到70%以上,尤其是按照实施例二的制备方法制得的分离管,对于单个核细胞的回收率高达90%以上。
另外,本发明的提供的一种胶体,与本发明的分离管中的分离胶成分、结构、性能及制备方法相同,此处不再赘述。本发明的一种胶体可以用于外周血单个核细胞的分离,也可以有其他用途。
本发明并不局限于上述实施方式,如果对本发明的各种改动或变形不脱离本发明的精神和范围,倘若这些改动和变形属于本发明的权利要求和等同技术范围之内,则本发明也意图包含这些改动和变形。
- 还没有人留言评论。精彩留言会获得点赞!