一种新型主链含环状结构的双接枝聚合物及其制备方法与流程
本发明属于高分子合成技术领域,涉及一种新型主链含环状结构的双接枝聚合物及其制备方法。
背景技术:
接枝聚合物是一类由一个中心骨架和众多侧链构建而成的拓扑结构聚合物,接枝聚合物可以通过调控主/侧链化学组分、侧链数量、侧链链长等改善聚合物物理化学性能,在润滑剂、药物输送材料、生物传感器、纳米材料等领域具有广阔的应用前景。接枝聚合物的合成策略主要分为:(1)“graftingthrough”,即大分子单体聚合;(2)“graftingonto”,即众多侧链通过高效的反应嫁接到主链上;(3)“graftingfrom”,即众多侧链从主链上伸长出来。基于这三大合成策略,各式各样的接枝聚合物被成功合成并表征。根据中心骨架的种类区分,接枝聚合物可细分为:线型、星型、环型、多接枝型、支化型等接枝聚合物。
在众多类型接枝聚合物中,多接枝型接枝聚合物,其重复单元由双或者多聚合物链构成,常称之为“双(多)接枝聚合物”。在双(多)接枝聚合物的构建中,具体讲,一方面可以先通过聚合技术构建中心骨架,再利用聚合物重复单元上原本含有的或者后修饰上去的活性位点,进行聚合伸长或者侧链高效地嫁接制备而成;另一方面可以先制备含双(多)链大分子单体,然后通过聚合而成。
环状聚合物由于无末端官能团的存在,较之于线性前体,在很多方面体现出优异的性能优势。受限于环状聚合物本身的不易合成,主链含环状结构的接枝聚合物(即环接枝聚合物)的合成难度一定程度上有所增加,而再将侧链进行多样化,制备主链含环状结构的双(多)接枝聚合物更是难上加难。目前,对主链含环状结构的双(多)接枝聚合物的成功构建寥寥无几。因此,不断发掘新合成技术来制备新型主链含环状结构的双(多)接枝聚合物,并赋予接枝聚合物材料不同的性能,是高分子研究领域的课题之一,不断丰富着聚合物拓扑结构的研究。
技术实现要素:
针对上述情况,本发明设计并合成出羟基的线性聚合物双链,对其进行叠氮化修饰得到含叠氮基的线性聚合物双链,再通过高效的点击化学将聚合物双链嫁接到功能化环状聚合物上,制备出新型的主链含环状结构双接枝聚合物,并且该接枝聚合物保持窄分子量分布指数的特点。
为了达到上述目的,本发明采用如下技术方案:
一种新型主链含环状结构的双接枝聚合物的制备方法,包括如下步骤:
(1)惰性气体氛围下,溶剂中,在18-冠醚-6、碳酸钾(k2co3)存在下,溴炔试剂与3,5-二羟基苯甲醇制备3,5-双(炔丙氧基)苄醇;
(2)惰性气体氛围下,溶剂中,在配体、铜盐、少量铜粉存在下,3,5-双(炔丙氧基)苄醇与线性叠氮化的聚苯乙烯(l-ps-n3)反应制备含羟基的线性聚苯乙烯双链(l-ps-phoh);
(3)在溶剂中,在1,8-二氮杂二环十一碳-7-烯(dbu)存在下,含羟基的线性聚苯乙烯双链(l-ps-phoh)与叠氮磷酸二苯酯(dppa)反应制备含叠氮基的线性聚苯乙烯双链(l-ps-phn3);
(4)在惰性气体下,溶剂中,在配体、铜、铜盐存在下,含叠氮基的线性聚苯乙烯双链(l-ps-phn3)与功能化的环状聚合物反应制备新型主链含环状结构的双接枝聚合物。
进一步的,在步骤(1)中,所述3,5-二羟基苯甲醇、溴炔试剂、18-冠醚-6、碳酸钾(k2co3)的摩尔比为(0.5~2):(2~4):(0.05~0.2):(2~4),优选1:2.2:0.1:2.5;溴炔试剂选自溴丙炔、tms-溴丙炔、tbs-溴丙炔、tips-溴丙炔中一种或两种的组合物,优选tms-溴丙炔,反应温度为60~100℃,时间为24~72小时,具体反应时间的确定根据薄层色谱分析,当原料产物3,5-双(炔丙氧基)苄醇反应完全后停止反应。
溴炔试剂最优选用tms-溴丙炔的原因在于:相比于溴丙炔,在反应过程中tms-溴丙炔的使用可大大减少副反应的生成,明显提高反应产率;相比于tbs-溴丙炔和tips-溴丙炔,保护集团tms属于易离去基团,相比于tbs-溴丙炔、tips-溴丙炔,在反应或者后处理过程中保护基团tms更容易离去,无需后期的保护基团脱除处理。
进一步的,在步骤(2)中,所述3,5-双(炔丙氧基)苄醇、线性叠氮化的聚苯乙烯(l-ps-n3)、配体、铜盐、铜粉的摩尔比为(0.5~2):(2~4):(2~4):(2~4):(0.5~2),优选1:2.05:2.05:2.05:1,反应时间为1~4小时,溶剂为甲苯,配体为n,n,n’,n’,n’五甲基二乙烯三胺(pmdeta),铜盐为溴化亚铜(cubr)、氯化亚铜(cucl)中任意一种,优选溴化亚铜(cubr)。
进一步的,步骤(3)中,所述含羟基的线性聚苯乙烯双链(l-ps-phoh)、叠氮磷酸二苯酯(dppa)、1,8-二氮杂二环十一碳-7-烯(dbu)的摩尔比为(0.5~2):(10~30):(10~30),优选1:20:20,溶剂为n,n-二甲基甲酰胺(dmf),反应温度为60~100℃,时间为12~48小时。
上述技术方案中,步骤(4)中,所述功能化环状聚合物、含叠氮基的线性聚苯乙烯双链(l-ps-phn3)、配体、铜盐、铜粉的摩尔比为(0.5~2):(20~40):(40~80):(40~80):(40~80),优选1:32.4:64.8:64.8:54,反应时间为12~36小时,溶剂四氢呋喃(thf)与n,n-二甲基甲酰胺(dmf)之间的体积比1~3:0.5~1.5,优选2:1,配体为n,n,n’,n’,n’五甲基二乙烯三胺(pmdeta),铜盐为溴化亚铜(cubr)、氯化亚铜(cucl)中任意一种,优选溴化亚铜(cubr)。
如上所述的新型主链含环状结构的双接枝聚合物的制备方法,具体包括如下反应步骤:
(1)合成3,5-双(炔丙氧基)苄醇:
惰性气体氛围下,将3,5-二羟基苯甲醇、tms-溴丙炔、18-冠醚-6、碳酸钾(k2co3)、丙酮加入反应容器中,反应溶液置于为60~100℃油浴中,回流反应24~72小时。抽滤除去不溶物,滤液浓缩,用二氯甲烷(ch2cl2)溶解,并用1mhcl和饱和食盐水洗涤,得到3,5-双(炔丙氧基)苄醇。其中,3,5-二羟基苯甲醇、tms-溴丙炔、18-冠醚-6、碳酸钾(k2co3)的摩尔比为(0.5~2):(2~4):(0.05~0.2):(2~4)
(2)合成分子量为3000~8000g/mol的含羟基的线性聚苯乙烯双链(l-ps-phoh):
将3,5-双(炔丙氧基)苄醇、线性叠氮化的聚苯乙烯(l-ps-n3)、n,n,n’,n’,n’五甲基二乙烯三胺(pmdeta)、cubr(i)、cu粉、甲苯加入反应容器中,反应溶液在室温下搅拌反应1~4小时,得到粗的含羟基的线性聚苯乙烯双链(l-ps-phoh)。使用吸铜树脂除去铜盐,并利用循环制备级sec除去微过量的线性叠氮化的聚苯乙烯(l-ps-n3),得到最终的含羟基的线性聚苯乙烯双链(l-ps-phoh),其中3,5-双(炔丙氧基)苄醇、线性叠氮化的聚苯乙烯(l-ps-n3)、配体、铜盐、铜的摩尔比为(0.5~2):(2~4):(2~4):(2~4):(0.5~2)。
(3)含羟基的线性聚苯乙烯双链(l-ps-phoh)经叠氮化修饰制备含叠氮基的线性聚苯乙烯双链(l-ps-phn3):
惰性气体和避光条件下,将含羟基的线性聚苯乙烯双链(l-ps-phoh)、n,n-二甲基甲酰胺(dmf)、叠氮磷酸二苯酯(dppa)、1,8-二氮杂二环十一碳-7-烯(dbu)加入反应容器中,反应溶液置于为60~100℃油浴中,回流反应12~48小时,得到粗的含叠氮基的线性聚苯乙烯双链(l-ps-phn3),其中线性聚苯乙烯双链、dppa、dbu的摩尔比为(1~2):(10~30):(1~30)。
(4)合成分子量为20000~50000g/mol的新型主链含环状结构双接枝聚合物(c-p2-g-ph-ps):
惰性气体氛围下,将功能化环状聚合物(c-p2)、含叠氮基的线性聚苯乙烯双链(l-ps-phn3)、n,n,n’,n’,n’五甲基二乙烯三胺(pmdeta)、溴化亚铜(cubr)、铜粉、四氢呋喃(thf)、n,n-二甲基甲酰胺(dmf)加入反应容器中,反应溶液在室温下搅拌反应12~36小时,得到粗的主链含环状结构双接枝聚合物(c-p2-g-ph-ps)。使用吸铜树脂除去铜盐,并利用循环制备级sec除去过量的含叠氮基的线性聚苯乙烯双链(l-ps-phn3),得到最终的主链含环状结构双接枝聚合物(c-p2-g-ph-ps)。其中,功能化环状聚合物、含叠氮基的线性聚苯乙烯双链(l-ps-phn3)、配体、铜盐、铜的摩尔比为(0.5~2):(20~40):(40~80):(40~80):(40~80)。
进一步的,所述惰性气体选自氮气、氦气、氖气中的任意一种,优选氮气。
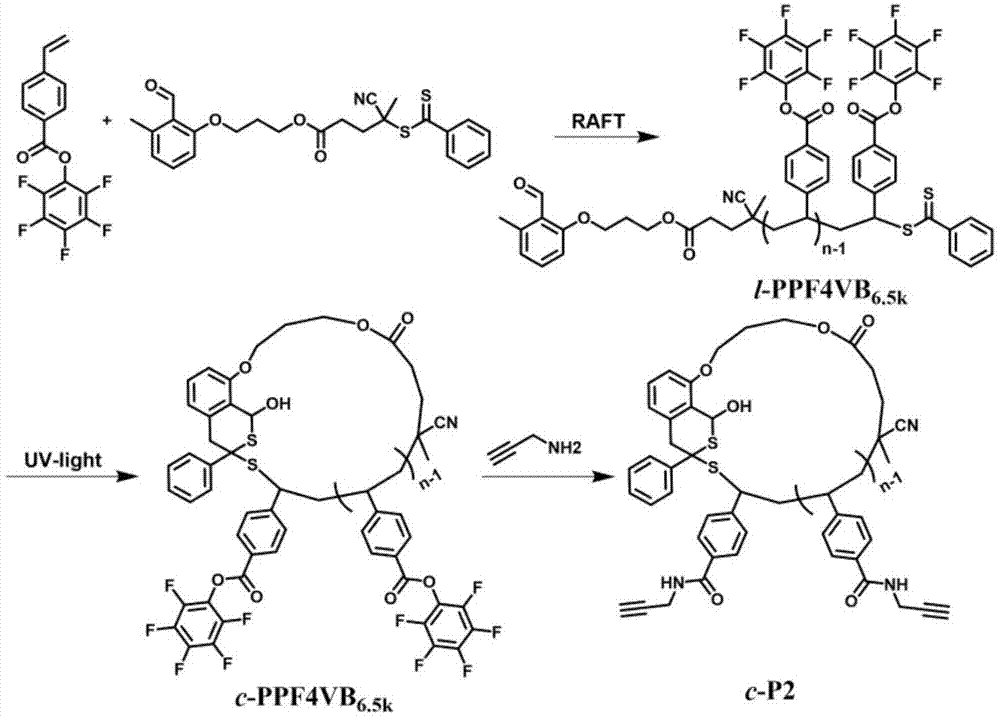
进一步的,所述的步骤(4)中的功能化环状聚合物(c-p2)的合成过程如下:以五氟苯基4-乙烯基苯甲酸酯单体、光敏raft试剂在甲苯中进行热引发聚合,得到线性的聚(五氟苯基4-乙烯基苯甲酸酯)(l-ppf4vb6.5k);将线性的聚(五氟苯基4-乙烯基苯甲酸酯)(l-ppf4vb6.5k)置于二氯甲烷(ch2cl2)与乙腈的混合溶剂中,在紫外光照下进行环化,得到环状的聚(五氟苯基4-乙烯基苯甲酸酯)(c-ppf4vb6.5k);环状的聚(五氟苯基4-乙烯基苯甲酸酯)(c-ppf4vb6.5k)在四氢呋喃(thf)溶剂中与炔丙胺进行酯交换反应,得到功能化的环状聚合物(c-p2)。
由于上述技术方案的实施,本发明与现有技术相比具有下列优点:
(1)本发明首次利用铜催化叠氮端炔环加成(cuaac)方法,将聚合物双链嫁接到环状聚合物上,成功构建出新型的主链含环状聚合物双接枝聚合物的拓扑结构;
(2)本发明利用铜催化叠氮端炔环加成(cuaac)方法成功合成了含羟基的线性聚苯乙烯双链(l-ps-phoh),并在1,8-二氮杂二环十一碳-7-烯(dbu)/叠氮磷酸二苯酯(dppa)条件下,实现了将羟基完全转化成叠氮基团,制备了含叠氮基的线性聚苯乙烯双链(l-ps-phn3),作为双接枝聚合物的侧链;
(3)得到的主链含环状聚合物双接枝聚合物,依然保持着窄分子量分布指数的显著特点。
附图说明
图1为功能性环状聚合物(c-p2)的合成路线图;
图2为主链含环状结构双接枝聚合物(c-p2-g-ph-ps)的合成路线图;
图3为线性聚(五氟苯基4-乙烯基苯甲酸酯)(l-ppf4vb6.5k)、环状聚(五氟苯基4-乙烯基苯甲酸酯)(c-ppf4vb6.5k)和功能性环状聚合物(c-p2)的核磁共振氢谱图;
图4为线性聚(五氟苯基4-乙烯基苯甲酸酯)(l-ppf4vb6.5k)、环状聚(五氟苯基4-乙烯基苯甲酸酯)(c-ppf4vb6.5k)和功能性环状聚合物(c-p2)的sec流出曲线图;
图5为叠氮化线性聚合物(l-ps-n3)和含羟基的线性聚苯乙烯双链(l-ps-phoh)的核磁共振氢谱图;
图6为叠氮化线性聚合物(l-ps-n3)和含羟基的线性聚苯乙烯双链(l-ps-phoh)的sec流出曲线图;
图7为含羟基的线性聚苯乙烯双链(l-ps-phoh)的质谱图;
图8为含叠氮基的线性聚苯乙烯双链(l-ps-phn3)和主链含环状结构双接枝聚合物(c-p2-g-ph-ps)的核磁氢谱图;
图9为含叠氮基的线性聚苯乙烯双链(l-ps-phn3)的质谱图;
图10为功能性环状聚合物(c-p2)、含叠氮基的线性聚苯乙烯双链(l-ps-phn3)和主链含环状结构双接枝聚合物(c-p2-g-ph-ps)的sec流出曲线图。
如下具体实施方式将结合上述附图进一步说明本发明。
具体实施方式
具体实施案例1:功能性环状聚合物(c-p2)的合成
具体合成路线如图1所示,方法如下:将五氟苯基4-乙烯基苯甲酸酯单体(6.28g,20mmol)、光敏raft试剂(91.1mg,0.2mmol)溶解在10ml的甲苯中。聚合管在真空线上冷冻-抽气-解冻循环三次,置于110℃的油浴中反应7.5小时。将聚合管置于冰水中快速降温,然后在200ml正己烷中沉淀。抽滤并真空干燥24小时,得到最终的线性聚(五氟苯基4-乙烯基苯甲酸酯)(l-ppf4vb6.5k,1.46g,转化率:23.0%,mn,sec=6500g/mol,mw/mn=1.05)。
将线性的聚(五氟苯基4-乙烯基苯甲酸酯)(l-ppf4vb6.5k,15mg)和二氯甲烷(ch2cl2)(100ml)/乙腈(300ml)加入到500ml的圆底烧瓶中。室温下,溶液在紫外光源下光照反应12小时。溶液浓缩,并在50ml冰正己烷中沉淀。沉淀的线性的聚(五氟苯基4-乙烯基苯甲酸酯)(c-ppf4vb6.5k)通过抽滤得到,30℃下真空干燥24小时(12.3mg,产率:82%,mn,sec=6200g/mol,mw/mn=1.06)。得到的粗的环状聚合物通过循环制备级sec进行纯化,除去少量的多倍分子量的副产物。低压汞灯(120w,cel-lph120-254)作为紫外光照光源。
氮气氛围下,将线性的聚(五氟苯基4-乙烯基苯甲酸酯)(c-ppf4vb6.5k)(45mg,5×10-3mmol)、四氢呋喃(thf)(600μl)和炔丙胺(29.74mg,0.54mmol)依次加入2ml安瓿瓶中并封管。溶液在室温下搅拌12小时。然后在正己烷中沉淀(反复沉淀3次)。功能化的环状聚合物(c-p2)经抽滤得到,30℃下真空干燥24小时(24.2mg,mn,sec=4400g/mol,mw/mn=1.08)。
具体实施案例2:含叠氮基的线性聚苯乙烯双链(l-ps-phn3)的合成
具体合成路线如图2所示,方法如下:将苯乙烯(9.06g,87.00mmol)、2-溴-2-甲基丙酸乙酯(ebib)(339.4mg,1.74mmol)、溴化亚铜(cubr)(111.7mg,0.05mmol)、n,n,n’,n’,n’五甲基二乙烯三胺(pmdeta)(173.30mg,1.5mmol)、抗坏血酸(aa)(176.13mg,1.0mmol)和10ml的溶剂苯甲醚加入到25ml的schlenk瓶中,并在90℃的油浴中反应2.5小时。反应液快速降温,用四氢呋喃(thf)溶解并通过短小的中性氧化铝柱中,收集浓缩。聚合物线性聚苯乙烯(l-ps-br)在甲醇中沉淀,抽滤得到,在30℃下真空干燥24小时(3.23g,转化率:34.4%,mn,sec=2400g/mol,mw/mn=1.06)。
线性聚苯乙烯(l-ps-br)(1.2g,0.5mmol)、叠氮化钠(nan3)(488.0mg,7.5mmol)和8ml的n,n-二甲基甲酰胺(dmf)加入到一个圆底烧瓶中,室温下搅拌24小时。聚合物用少量四氢呋喃(thf)溶解,并通过短小的中性氧化铝柱中除去过量的叠氮化钠(nan3),收集浓缩。线性叠氮化的聚苯乙烯(l-ps-n3)在甲醇中沉淀,抽滤得到,在30℃下真空干燥24小时(974.8mg,产率:81.2%,mn,sec=2500g/mol,mw/mn=1.05)。
将3,5-二羟基苯甲醇(1.4g,10mmol),tms-溴丙炔(4.20g,22mmol),18-冠醚-6(264mg,1mmol)和80ml丙酮加入一个100ml的圆底烧瓶中,鼓泡法除氧5min。将碳酸钾(k2co3)(3.45g,25mmol)缓慢加入反应混合液中,继续通气10分钟。反应溶液置于80℃油浴中,回流反应48小时。抽滤除去不溶物,滤液浓缩,用二氯甲烷(ch2cl2)溶解,并用1mhcl和饱和食盐水洗涤。无水硫酸镁干燥并抽滤,滤液浓缩,用硅胶柱层析纯化,淋洗剂为石油醚/乙酸乙酯=4/1(v/v),最终产物为白色粉末固体(1.2g,产率:57.3%)。(相对于溴丙炔而言,tms-溴丙炔的使用会大大提高反应产率,且保护基团(tms)在反应或者后处理过程中容易脱除)。
将3,5-双(炔丙氧基)苄醇(10.81mg,0.05mmol),叠氮化的线性聚苯乙烯(l-ps-n3,257.5mg,0.103mmol),n,n,n’,n’,n’五甲基二乙烯三胺(pmdeta)(17.84mg,0.103mmol)和5ml甲苯加入一个带搅拌子的10ml安瓿瓶中,鼓泡法除氧10分钟。cubr(i)(14.8mg,0.103mmol)和铜粉(3.18mg,0.05mmol)加入体系中,继续通气10分钟后,室温下搅拌反应1.5小时。反应液用四氢呋喃(thf)稀释,并加入吸铜树脂搅拌除去铜盐,抽滤浓缩得到粗的含羟基的线性聚苯乙烯双链(l-ps-phoh)。含羟基的线性聚苯乙烯双链(l-ps-phoh)用少量thf溶解,在150ml甲醇中沉淀,抽滤并在30℃下真空干燥24小时,得249.4mg白色粉末状固体,即为粗的含叠氮基的线性聚苯乙烯双链。最后通过循环制备级sec除去微过量的线性叠氮化的聚苯乙烯(l-ps-n3)(mn,sec=5000g/mol,mw/mn=1.04)。
氮气和避光条件下,将含羟基的线性聚苯乙烯双链(l-ps-phoh)(100mg,0.02mmol)和n,n-二甲基甲酰胺(dmf)(1ml)加入一个带搅拌子的5ml安瓿瓶中。叠氮磷酸二苯酯(dppa)(110.08mg,0.4mmol)和1,8-二氮杂二环十一碳-7-烯(dbu)(60.90mg,0.4mmol)分别加入安瓿瓶中,通气5分钟后,反应溶液置于80℃油浴中,回流反应24小时。反应液用四氢呋喃(thf)稀释,通过短的中性al2o3柱后浓缩,在80ml的甲醇中沉淀,抽滤并在30℃下真空干燥24小时(93.4mg,mn,sec=5000g/mol,mw/mn=1.04)。
具体实施案例3:主链含环状结构双接枝聚合物(c-p2-g-ph-ps)的合成
将环状聚合物(c-p2,2.2mg,5×10-4mmol),含叠氮基的线性聚苯乙烯双链(l-ps-phn3,81mg,1.62×10-2mmol),n,n,n’,n’,n’五甲基二乙烯三胺(pmdeta,5.62mg,3.24×10-2mmol)和四氢呋喃(thf)/n,n-二甲基甲酰胺(dmf,v/v=2/1,3ml)加入一个带搅拌子的10ml安瓿瓶中。通氮气5分钟,向反应体系中加入cubr(i)(4.64mg,3.24×10-2mmol)和铜粉(1.72mg,2.7×10-2mmol),继续通氮气10分钟后封管,在室温下搅拌24小时。反应液用四氢呋喃(thf)稀释,加入吸铜树脂搅拌除去体系中的铜盐,抽滤浓缩得到粗的聚合物(c-p2-g-ph-ps)。粗的聚合物(c-p2-g-ph-ps)随即用少量四氢呋喃(thf)溶解,在甲醇中沉淀,抽滤并在30℃下真空干燥24小时。得到粗的环接枝聚合物(c-p2-g-ph-ps),最后通过循环制备级sec除去过量未反应的含叠氮基的线性聚苯乙烯双链(l-ps-phn3)。(c-p2-g-ph-ps,33.6mg,mn,sec=30700g/mol,mw/mn=1.04)。
图3为线性聚(五氟苯基4-乙烯基苯甲酸酯)(l-ppf4vb6.5k)、环状聚(五氟苯基4-乙烯基苯甲酸酯)(c-ppf4vb6.5k)和功能性环状聚合物(c-p2)的核磁共振氢谱图,从图中可明显看出线性聚(五氟苯基4-乙烯基苯甲酸酯)l-ppf4vb6.5k的末端官能团出峰位置,在环化之后,与苯甲醛上醛基-archo(10.62ppm,a)对应的化学特征峰明显消失,且在5.34ppm处出现新的化学位移,是与羟基相邻的次甲基氢(a’)的特征峰,这直接说明了环状聚(五氟苯基4-乙烯基苯甲酸酯)c-ppf4vb6.5k的成功合成。而且sec流出曲线(图4)上看出,环状聚(五氟苯基4-乙烯基苯甲酸酯)c-ppf4vb6.5k具有更长的流出时间,这符合环状聚合物相比于同分子量的线性前体具有更小的流体力学体积这一特征。利用炔丙胺进行酯交换反应之后,图4显示环状聚合物c-p2的流出曲线与环状聚(五氟苯基4-乙烯基苯甲酸酯)c-ppf4vb6.5k相比,明显向低分子量区域发生平移,且依然保持窄分子量分布指数的特点(mw/mn=1.08)。在图3中,环状聚合物c-p2的1hnmr谱图可以明显观察到,来自于炔基和酰胺基团上氢(c,d,e)的特征峰,且在a(-arh),b(-arh),c(-conh-),d(-ch2-)和e(-cch)处的积分比值约为2/2/1/2/1,这直接说明了酯交换反应的高效性,几乎为定量反应。基于以上表明,功能化环状聚合物(c-p2)的成功合成。
图5为叠氮化线性聚合物(l-ps-n3)和含羟基的线性聚苯乙烯双链(l-ps-phoh)的核磁共振氢谱图。铜催化叠氮端炔环加成(cuaac)反应之后,与三氮唑相邻的次甲基(-ch(ph)-,f)从原先的3.8-4.1ppm处完全位移到4.9-5.2ppm,且在4.6ppm处出现新的特征峰,经分析为中心位点上的苄位氢(-ch2-,i)的化学归属,说明双链聚合物的成功合成。图6为两者的sec流出曲线图,含羟基的线性聚苯乙烯双链(l-ps-phoh)的数均分子量(mn=5000g/mol)是线性叠氮化的聚苯乙烯(l-ps-n3)分子量的两倍,这也直接说明双链聚合物的成功合成。
图7为含羟基的线性聚苯乙烯双链(l-ps-phoh)的大分子质谱图,实验值(4715.97da)与40个苯乙烯重复单元加上钠离子的理论计算值([42m+na]+,4715.74da),且相邻的两组峰正好是一个苯乙烯的荷质比,且无线性叠氮化的聚苯乙烯(l-ps-n3)对应的峰值,进一步说明双链聚合物的成功合成。
图8(1)为含叠氮基的线性聚苯乙烯双链(l-ps-phn3)的核磁氢谱图,相较于含羟基的线性聚苯乙烯双链(l-ps-phoh)的1hnmr谱(图5),整体的谱图没有太大的变化,对于中心位点上的苄位氢(-ch2-,i)明显从4.6ppm完全转移到4.2ppm,这暗示了叠氮化反应的完全,即为含叠氮基的线性聚苯乙烯双链(l-ps-phn3)的成功合成。图9为含叠氮基的线性聚苯乙烯双链(l-ps-phn3)的大分子质谱图,实验值(4712.91da)与40个重复单元除去n2加上钠离子的理论值([40m-n2+ag]+,4712.74da)相吻合,相邻两组峰的差值正好是一个苯乙烯的荷质比,且无含羟基的线性聚苯乙烯双链(l-ps-phoh)对应的峰,这直接说明将含羟基的线性聚苯乙烯双链(l-ps-phoh)成功转化成含叠氮基的线性聚苯乙烯双链(l-ps-phn3)。
图8(2)为主链含环状结构双接枝聚合物(c-p2-g-ph-ps)的核磁氢谱图,重复单元上与三氮唑相邻的次甲基(-ch(ph)-,f)和亚甲基(-ch2-,h),以及与苯环相邻的亚甲基(-ch2-,i)汇集在4.2-5.5ppm处。与含叠氮基的线性聚苯乙烯双链(l-ps-phn3)相比较,在铜催化叠氮端炔环加成方法(cuaac)反应前后,与苯环相邻的亚甲基(-ch2-,i)对应的化学位移发生了明显变化。此外,图10为功能性环状聚合物(c-p2)、含叠氮基的线性聚苯乙烯双链(l-ps-phn3)和主链含环状结构双接枝聚合物(c-p2-g-ph-ps)的sec流出曲线图,不难看出,聚合物c-p2-g-ph-ps(mn=30700g/mol)的分子量明显远高于c-ps和含叠氮基的线性聚苯乙烯双链(l-ps-phn3)且保持窄分子量分布指数(mw/mn=1.04)的特征,这说明主链含环状结构的双接枝聚合物(c-p2-g-ph-ps)的成功合成。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!