一种微流控芯片和基于该芯片的肿瘤转移模型及模型构建方法和应用与流程
本发明属细胞生物学和组织工程的方法,特别涉及一种微流控芯片和基于该芯片的肿瘤转移模型及模型构建方法和应用。
背景技术:
肿瘤是对人类健康危害极大的疾病之一,据统计肿瘤致死病人中有90%都与肿瘤转移有关。但是人和动物复杂的生理环境,使人们对肿瘤细胞的转移机制仍知之甚少。开发有效的肿瘤转移实时监测平台对充分了解肿瘤细胞转移过程、机制和开发有效的抗肿瘤转移方法显得尤为重要。传统的动物模型,由于与人存在根本的种属差异,使得抗肿瘤药物的研发周期长、花费高。而现有传统的体外模型结构简单,缺乏生理相关性,结果往往不可靠。开发新的有效的肿瘤转移研究平台成为研究热点。
在过去几年里,微流控芯片技术作为近年来飞速发展的一门新兴技术,依靠其尺度微小、材料和制作工艺多样、设计灵活多变等特点,被广泛应用到了生物医学领域、转化医学领域等多种临床医学和基础研究的相关领域。尽管许多科研工作者已经借助微流控芯片技术进行肿瘤细胞迁移、侵袭等研究,但是却鲜有对肿瘤转移全过程的模拟和抗肿瘤药物筛选的研究。我们开发出一种新的三维肿瘤-血管微流控体外模型,不仅可以观察肿瘤细胞的增殖、迁移和侵袭过程,同时可以用于抗肿瘤药物的筛选。
技术实现要素:
本发明的目的是提供一种微流控芯片和基于该芯片的肿瘤转移模型及模型构建方法和应用。本发明具有操作简单、集成度高的特点,同时在细胞水平上模拟肿瘤血管内环境,具备接近体内生理环境的肿瘤转移模型。
为达到上述目的,本发明采用了如下的技术方案:
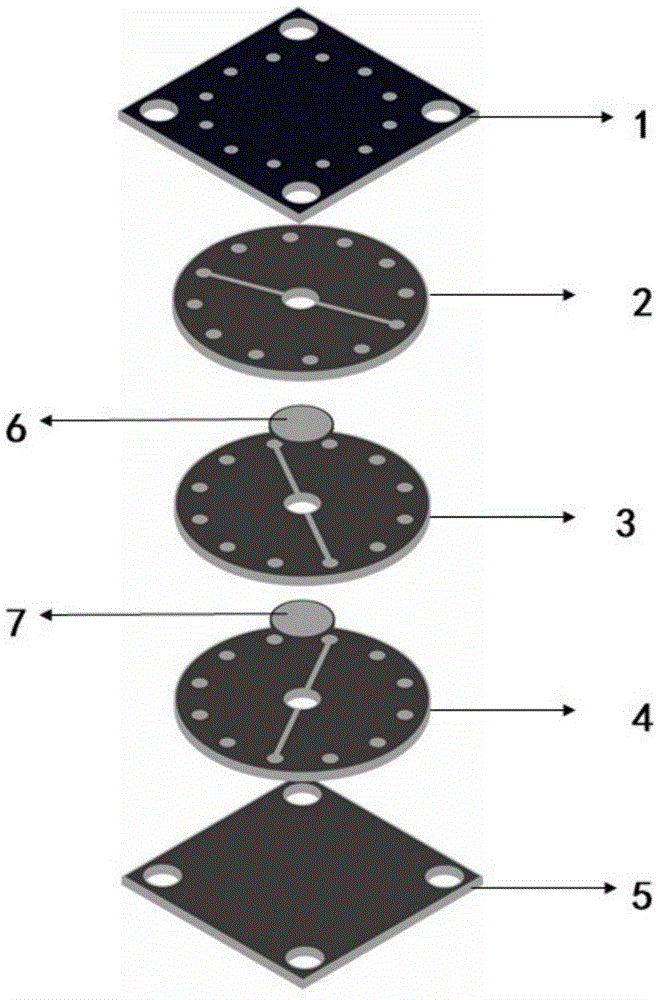
一种微流控芯片,所述微流控芯片包括三层芯片层和两层多孔膜;其中,第一层多孔膜6夹在第一层芯片层2和第二层芯片层3之间,第二层多孔膜7夹在第二层芯片层3和第三层芯片层4之间;
三层芯片层中的每一层芯片均设置流体入口8、微流体通道9、细胞培养室10和流体出口11,其中,微流体通道9的两端分别为流体入口8和流体出口11,细胞培养室10设置在微流体通道9上;不同层中的细胞培养室通过多孔膜进行交流。
进一步地,所述微流控芯片还包括两层固定板,三层芯片层和两层多孔膜固定在两层固定板之间。
优选地,所述第一层芯片层2的厚度为0.5-10mm;第二层芯片层3和第三层芯片层4的厚度为0.2-5mm,多孔膜的厚度为0.1-30μm,多孔膜的孔径为0.1-20μm。
优选地,所述微流体通道9的高度为10-500μm,宽度为0.1-10mm;流体入口8和流体出口11的直径均为0.1-5mm。
优选地,两层固定板的厚度均为0.5-10mm;第一固定板1设有若干个输液管道插入孔13,输液管道插入孔的直径均为0.1-5mm。
优选地,芯片层的材料为聚二甲基硅氧烷(pdms),多孔膜的材料为聚碳酸酯,固定板的材料为pmma。
本发明还提供了一种基于微流控芯片的肿瘤转移模型,微流控芯片中的多孔膜采用胶原包被形成三维微环境;第二层芯片层的微流体通道采用血管内皮细胞灌注形成体外致密血管腔;肿瘤细胞以连续灌流的方式注入第一层芯片层的微流体通道中。
本发明同时提供了上述肿瘤转移模型的构建方法,所述构建方法包括以下步骤:
步骤1:芯片内胶原的灌注
配置终浓度为0.1-10mg/ml的胶原,以连续灌注流的方式将胶原从每层芯片层的流体入口灌入微流体通道内,培养孵育胶原包被多孔膜形成三维微环境;
步骤2:芯片上血管腔构建
将培养好的血管内皮细胞消化为单细胞悬液,将0.1×106-10×106个/ml单细胞悬液以连续灌流的方式注入第二层芯片层微流体通道内,灌满单细胞悬液后培养,在第二层芯片层的细胞培养室的下表面形成致密细胞层;之后将芯片倒置,二次灌注单细胞悬液使第二层芯片层细胞培养室的上表面形成致密细胞层,驱动单细胞悬液继续培养血管内皮细胞,形成体外致密血管腔;
步骤3:建立肿瘤转移模型
将培养好的肿瘤细胞消化为单细胞悬液,将0.1×106-10×106个/ml单细胞悬液以连续灌流的方式注入第一层芯片层微流体通道内,灌满肿瘤细胞悬液后,继续培养,形成肿瘤转移模型。
本发明更进一步提供了上述的微流控芯片或肿瘤转移模型在肿瘤细胞转移研究和抗肿瘤药物筛选中的应用。
优选地,肿瘤细胞转移研究和抗肿瘤药物筛选所涉及的肿瘤细胞为乳腺癌细胞或肝癌细胞。
本发明提供了一种微流控芯片,该芯片每层聚二甲基硅氧烷芯片有独立的微流体通道,有独立的液体入口和出口,有独立的细胞培养室可通过聚碳酸酯多孔膜进行交流。
本发明的两层固定板、三层芯片层和两层多孔膜组合在一起构成一组芯片系统。
本发明中,第一固定板上的管道输液插入孔与芯片层的流体入口和流体出口分别一一对应,用于将液体输入微流体通道。需要说明的是,当第一固定板上的管道输液插入孔需要与第二层芯片层的流体入口和流体出口连通时,需要在第一层芯片层的对应位置打孔;同理,当第一固定板上的管道输液插入孔需要与第三层芯片层的流体入口和流体出口连通时,需要在第一层芯片层和第二层芯片层的对应位置打孔。
本发明提供了胶原包被的多孔膜,胶原使用浓度为0.1-10mg/ml,形成细胞培养室的面积为0.0314-314mm2。
优选地,本发明上层固定板有12个输液管道插入孔;两层固定板四角均有用于螺丝固定的固定孔14、15,直径均为0.3-8mm。
具体地,一种基于微流控芯片的肿瘤转移模型的建立方法,采用上述微流控芯片,按照以下步骤进行:
步骤1:芯片内胶原的灌注
配置终浓度为0.1-10mg/ml的胶原,用注射泵以连续灌注流的方式将胶原从每层芯片通道入口灌入三维通道通道内,将芯片置于37℃培养环境中2小时,孵育凝胶包被聚碳酸酯多孔膜形成三维微环境;
步骤2:芯片上血管腔构建
将培养好的血管内皮细胞(eahy926)消化为单细胞悬液,用注射泵将单细胞悬液(0.1-10*106个/ml)以连续灌流的方式注入第二层芯片层的微流体通道内,灌满细胞悬液后,将芯片置于37℃培养箱中2小时,第二层芯片层的细胞培养室下表面形成致密细胞层;之后将芯片倒置,二次灌注细胞悬液使上表面形成致密细胞层,随后用注射泵驱动液体继续培养血管内皮细胞3天,形成体外致密血管腔;
步骤3:建立肿瘤转移模型
将培养好的肿瘤细胞消化为单细胞悬液,用注射泵将单细胞悬液(0.1-10*106个/ml)以连续灌流的方式注入第一层芯片层的微流体通道内,灌满细胞悬液后,在培养箱中继续培养,形成肿瘤转移模型。
基于微流控芯片的肿瘤转移模型的应用,可用于不同肿瘤细胞转移特征的研究,具体为:显微镜下观察贴附于血管腔上表面的肿瘤细胞增殖能力、迁移能力、侵入和侵出血管腔的能力,每24小时采集数据,统计肿瘤细胞的细胞数量和移动距离。
不同肿瘤细胞转移特征的研究,所研究的肿瘤细胞有乳腺癌细胞(mda-mb-231)、肝癌细胞(hepg-2)。
抗肿瘤药物的筛选,具体为:将不同浓度的药物加入血管腔流动液中,可以观察药物通过血管传递对肿瘤细胞增殖、迁移和侵袭能力的抑制效果。
附图说明
图1为本发明微流控芯片的结构示意图;
图2为本发明每层芯片层的结构示意图;
图3为本发明多孔膜的平面示意图;
图4为本发明固定板的结构示意图;
图5为本发明一种基于微流控芯片的肿瘤转移模型的结构原理图;
图6为本发明一种基于微流控芯片的肿瘤转移模型的肿瘤细胞mda-mb-231增殖、迁移、侵袭全过程图;
图7为本发明一种基于微流控芯片的肿瘤转移模型的肿瘤细胞迁移设计及肿瘤细胞hepg2和mda-mb-231迁移效果图;
图8为本发明一种基于微流控芯片的肿瘤转移模型的肿瘤细胞hepg2和mda-mb-231侵袭效果及侵袭方式对比图;
图9为本发明一种基于微流控芯片的肿瘤转移模型的5fu抑制肿瘤细胞hepg2和mda-mb-231增殖、迁移、侵袭与传统模型的统计对比图;
其中,1:第一固定板;2:第一层芯片层;3:第二层芯片层;4第三层芯片层;5:第二固定板;6:第一层多孔膜;7:第二层多孔膜;8:流体入口;9:微流体通道;10:细胞培养室;11:流体出口;12:微孔;13:流体管道插入孔;14:固定孔;15:固定孔。
具体实施方式
本说明书中公开得任一特征,除非特别叙述,均可被其他等效或具有类似目的的替代特征加以替换。除非特别叙述,每个特征只是一系列等效或者类似特征中的一个例子而已。所述仅仅是为了帮助理解本发明,不应该视为对本发明的具体限制。
下面结合实施例对本发明的技术方案进行详细说明。以下采用的试剂和生物材料如未特别说明,均为商业化产品。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。
实施例1微流控芯片
如图1所示,一种微流控芯片,所述微流控芯片包括三层芯片层和两层多孔膜;其中,第一层多孔膜6夹在第一层芯片层2和第二层芯片层3之间,第二层多孔膜7夹在第二层芯片层3和第三层芯片层4之间;
如图2所示,三层芯片层中的每一层芯片均设置流体入口8、微流体通道9、细胞培养室10和流体出口11,其中,微流体通道9的两端分别为流体入口8和流体出口11,细胞培养室10设置在微流体通道9上;不同层中的细胞培养室通过多孔膜进行交流。
所述微流控芯片还包括两层固定板(第一固定板1和第二固定板5),三层芯片层和两层多孔膜固定在两层固定板之间。
所述第一层芯片层2的厚度为0.5-10mm;第二层芯片层3和第三层芯片层4的厚度为0.2-5mm,多孔膜的厚度为0.1-30μm,多孔膜的微孔12的孔径为0.1-20μm。
所述微流体通道9的高度为10-500μm,宽度为0.1-10mm;流体入口8和流体出口11的直径均为0.1-5mm。
如图4所示,两层固定板的厚度均为0.5-10mm;第一固定板1设有若干个输液管道插入孔13,两层固定板四角均有用于螺丝固定的固定孔14、15,输液管道插入孔的直径均为0.1-5mm。
芯片层的材料为聚二甲基硅氧烷(pdms),多孔膜的材料为聚碳酸酯,固定板的材料为pmma。
应用自己设计和制作的所述微流控芯片建立具有生理相关性的体外肿瘤转移模型,采用软光刻技术用su-8胶做模板制作pdms芯片,制作好的芯片用打孔笔打出流体入口、流体出口和细胞培养室,之后由两层亚克力固定板夹持、固定,构成一组芯片系统,如图1-4所示。
实施例2基于微流控芯片的肿瘤转移模型及其构建方法
如图5所示,一种基于微流控芯片的肿瘤转移模型,微流控芯片中的多孔膜采用胶原包被形成三维微环境;第二层芯片层的微流体通道采用血管内皮细胞灌注形成体外致密血管腔;肿瘤细胞以连续灌流的方式注入第一层芯片层的微流体通道中。
上述肿瘤转移模型的构建方法,所述构建方法包括以下步骤:
步骤1:芯片内胶原的灌注
配置终浓度为0.1-10mg/ml的胶原,用注射泵以连续灌注流的方式将胶原从每层芯片通道入口灌入三维通道通道内,将芯片置于37℃培养环境中2小时,孵育凝胶包被聚碳酸酯多孔膜形成三维微环境;
步骤2:芯片上血管腔构建
将培养好的血管内皮细胞(eahy926)消化为单细胞悬液,用注射泵将单细胞悬液(0.1-10*106个/ml)以连续灌流的方式注入第二层芯片层的微流体通道内,灌满细胞悬液后,将芯片置于37℃培养箱中2小时,第二层芯片层的细胞培养室下表面形成致密细胞层;之后将芯片倒置,二次灌注细胞悬液使上表面形成致密细胞层,随后用注射泵驱动液体继续培养血管内皮细胞3天,形成体外致密血管腔;
步骤3:建立肿瘤转移模型
将培养好的肿瘤细胞消化为单细胞悬液,用注射泵将单细胞悬液(0.1-10*106个/ml)以连续灌流的方式注入第一层芯片层的微流体通道内,灌满细胞悬液后,在培养箱中继续培养,形成肿瘤转移模型。
实施例3肿瘤转移全过程的实时监测
应用实施例1-2中所述微流控芯片建立的肿瘤转移模型,将培养好的血管内皮细胞(eahy926)消化为单细胞悬液,用注射泵将细胞悬液(0.2*106个/ml)以连续灌流的方式注入第二层芯片层微流体通道内,灌满细胞悬液后,将芯片置于37℃培养箱中2小时,第二层芯片层的细胞培养室下表面形成致密细胞层;之后将芯片倒置,二次灌注细胞悬液使上表面形成致密细胞层,随后用注射泵驱动液体继续培养血管内皮细胞3天,形成体外致密血管腔。将培养好的肿瘤细胞消化为单细胞悬液,用注射泵将细胞悬液(0.1*106个/ml)以连续灌流的方式注入第一层芯片,通道内灌满细胞悬液后,静置3h,细胞贴壁后,上层流动无胎牛血清(fbs)dmem/f12培养液,下层流动含10%fbsdmem/f12培养液,在培养箱中继续培养24小时,可观察到肿瘤细胞增殖、迁移、侵袭全过程,如图6所示。
实施例4不同肿瘤细胞细胞迁移特征
应用实施例1中所述的微流控芯片,将培养好的血管内皮细胞(eahy926)消化为单细胞悬液,用注射泵将细胞悬液(0.2*106个/ml)以连续灌流的方式注入第二层芯片,通道内灌满细胞悬液后,将芯片置于37℃培养箱中2小时,第二层芯片层的细胞培养室下表面形成致密细胞层;之后将芯片倒置,二次灌注细胞悬液使上表面形成致密细胞层,随后用注射泵驱动液体继续培养血管内皮细胞3天,形成体外致密血管腔。之后拆分芯片,将另外一个pdms芯片(长4mm,宽4mm,高1mm)置于上层多孔膜6上表面上,该芯片上打有6个直径为0.5mm的孔,如图7a(1)(2)所示;肿瘤细胞悬液(0.2*106个/ml)接种于该pdms芯片层表面,静置3h后,取下该另一个pdms芯片,形成直径为0.5mm细胞团(该细胞团基于所打的孔形成),如图7a(3)(4)所示;最后组装芯片并在多孔膜6上层流动无胎牛血清(fbs)dmem/f12培养液,下层流动含10%fbsdmem/f12培养液,培养箱中继续培养12小时,可观察到肿瘤细胞沿着培养液流动的方向发生迁移。如图7b所示。
实施例5不同肿瘤细胞侵袭特征
应用实施例1中所述微流控芯片,将培养好的血管内皮细胞(eahy926)消化为单细胞悬液,用注射泵将细胞悬液(0.2*106个/ml)以连续灌流的方式注入第二层芯片层,通道内灌满细胞悬液后,将芯片置于37℃培养箱中2小时,第二层芯片层的细胞培养室下表面形成致密细胞层;之后将芯片倒置,二次灌注细胞悬液使上表面形成致密细胞层。将培养好的肝肿瘤细胞(hepg2)和乳腺癌细胞(mda-mb-231)消化为细胞悬液,用注射泵将细胞悬液(0.2*106个/ml)以连续灌流的方式注入第一层芯片层,微流体通道内灌满细胞悬液后,静置3h,细胞贴壁后,上层流动无胎牛血清(fbs)dmem/f12培养液,下层流动含10%fbsdmem/f12培养液,在培养箱中继续培养18小时,可观察到hepg2细胞直接破坏细胞外基质穿过血管细胞进入血管腔,而mda-mb-231细胞破坏胞间蛋白通过细胞间隙侵入血管腔,如图8a所示,通过三维层扫,可进一步观察到此现象,如图8b所示,白色较亮部分为肿瘤细胞。
实施例65-fu抗肿瘤转移活性评价
应用实施例1-5中所述微流控芯片建立的肿瘤增殖、迁移、侵袭模型,在第二层流动培养液(dmem/f12+10%fbs)中加入不同浓度的五氟尿嘧啶(5-fu;0、0.1、1、10、100ug/ml),在培养箱中继续培养48小时,统计肿瘤细胞的细胞数量,可发现5-fu对hepg2细胞和mda-mb-231细胞的增殖都有明显的抑制作用,如图9a所示;通过统计肿瘤细胞迁移距离,可发现5-fu对hepg2细胞和mda-mb-231细胞的迁移有明显的抑制作用,如图9b所示;通过统计肿瘤细胞侵入血管腔的细胞数量,可发现5-fu对两种细胞的侵袭同样有明显的抑制作用。此外,通过与静态装置plate和transwell对比,芯片动态培养条件下5-fu对肿瘤细胞转移有更明显的抑制效果,如图9a、9b、9c所示。
本发明的工艺参数(如温度、时间等)区间上下限取值以及区间值都能实现本法,在此不一一列举实施例。
本发明未详细说明的内容均可采用本领域的常规技术知识。
最后所应说明的是,以上实施例仅用以说明本发明的技术方案而非限制。尽管参照实施例对本发明进行了详细说明,本领域的普通技术人员应该理解,对本发明的技术方案进行修改或者等同替换,都不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!