用于快速再生血管化组织的人工结构体及构建方法与应用与流程
本发明涉及生物技术领域,具体地说,涉及一种可用于快速再生血管化组织的人工结构体及其构建方法与应用。
背景技术:
20世纪80年代组织工程开始应用于医学领域的研究,其目标是开发和最终应用生物代用品,以恢复、维持或改善组织功能。通过组织工程,可在实验室设计和制备生物工程化组织。可以将所述工程化组织植入体内以达到恢复、替代、维持或提高组织器官功能的目的。
工程化组织的体内移植方式可分为创伤性移植和微创手术两种。临床使用时,工程化组织必须具有厘米级的较大体积,并且包裹大量细胞才能完成修复或替换体内受损组织的作用。大体积植入物对手术方式提出了较高要求,目前常用的仍是创伤性移植手术方式。注射式的微创手术方式由于其创伤小、疼痛感低、手术复杂度低、伤口隐蔽等特点受到医生和患者欢迎。
大体积植入物在体内存活的另一个重大挑战则是快速、充分的血管再生,因为当每个细胞距离最近的血管的距离大于200μm时,就存在营养供给不足的问题,最终导致细胞坏死。而在没有外界条件干预的情况下,血管长入植入物的速度极慢,一般在几毫米/天的量级。血管化问题被认为是限制组织工程发展的瓶颈问题之一。目前成功的组织工程产品主要是皮肤植入物,其特点是二维尺寸较大,但在高度方向上尺度较小,对血管化要求不高。
目前亟需可用于微创注射移植和快速体内血管化的工程化组织。
技术实现要素:
本发明的目的是提供一种可用于快速再生血管化组织的人工结构体及构建方法与应用。
为了实现本发明目的,第一方面,本发明提供一种可用于快速再生血管化组织的人工结构体的构建方法,包括以下步骤:
s1、组织细胞水凝胶微球的制备;
s2、组织细胞水凝胶微球在细胞培养液内培养得到组织细胞微球,微球中细胞增殖和/或分化为离散细胞或呈细胞团簇状态;
s3、将涂覆材料均匀涂覆在s2制备的组织细胞微球表面,得到具有涂层的组织细胞微球;
s4、将血管化细胞a与s3制备的具有涂层的组织细胞微球混合,在血管细胞培养液内培养3-5天,得到含血管细胞层的组织细胞微球;
s5、血管化生长因子1缓释微球的制备;
s6、人工结构体的制备:将s4制备的含血管细胞层的组织细胞微球、s5制备的血管化生长因子1缓释微球、血管化生长因子2、血管化细胞b、组织细胞与载体材料混合,在含血管细胞培养液与组织细胞培养液的混合培养液内培养,即得可用于快速再生血管化组织的人工结构体。
其中,所述血管化生长因子1、2为相同或不同的血管化生长因子;所述血管化细胞a、b为相同或不同的血管化细胞。
本发明中,所述血管化生长因子为任意促进毛细血管发生和促进血管成熟的细胞因子。所述血管化生长因子1、2选自血管内皮细胞生长因子、碱性成纤维细胞生长因子、表皮生长因子、血小板衍生生长因子、转化生长因子、血管生成素-1等血管相关生长因子中的至少一种,优选血管内皮细胞生长因子、碱性成纤维细胞生长因子、表皮生长因子、血小板衍生生长因子;
更优选地,所述血管化生长因子1为碱性成纤维细胞生长因子和血管内皮细胞生长因子,所述血管化生长因子2为表皮生长因子。
在一些实施方案中,血管化生长因子的包裹方式包括但不限于被载体材料直接包裹、采用缓释载体包裹等,优选的包裹方式为采用缓释载体包裹。
本发明中,所述血管化细胞a、b选自血管内皮细胞、血管内皮祖细胞、微血管内皮细胞、血管平滑肌细胞、血管成纤维细胞、间充质干细胞、周细胞等中的至少一种,这些细胞可以是组织中提取获得的,也可以是干细胞分化而来的,优选血管内皮细胞、间充质干细胞;
更优选地,所述血管化细胞a、b为脐静脉血管内皮细胞、间充质干细胞或内皮祖细胞。
本发明中,所述涂覆材料为生物可降解的,且具有生物活性、细胞粘附性和生物相容性天然生物材料,包括但不限于胶原、纤维蛋白原、matrigel。
本发明中,所述载体材料为具有生物相容性的天然生物材料和/或人工合成生物材料。
所述天然生物材料选自明胶、明胶衍生物、藻酸盐、藻酸盐衍生物、纤维素、纤维素衍生材料、琼脂、基质胶、胶原、胶原衍生物、氨基酸、氨基酸衍生物、蛋白多糖、蛋白多糖衍生物、糖蛋白及衍生材料、透明质酸、透明质酸衍生物、壳聚糖、壳聚糖衍生物、dna水凝胶材料、层连接蛋白、纤连接蛋白、纤维蛋白、纤维蛋白衍生物、丝素蛋白、丝素蛋白衍生物等中的至少一种,优选藻酸钠、明胶或胶原。
所述人工合成生物材料选自聚丙烯、聚苯乙烯、聚丙烯酰胺、聚丙交酯、聚乙交酯、聚乳酸、聚乳酸-羟基乙酸共聚物、聚羟基酸、聚乳酸醇酸共聚物、聚二甲基硅氧烷、聚酸酐、聚酸酯、聚酰胺、聚氨基酸、聚缩醛、聚氰基丙烯酸酯、聚氨基甲酸酯、聚吡咯、聚酯、聚甲基丙烯酸酯、聚乙烯、聚碳酸酯、聚氧化乙烯等中的至少一种,优选聚乳酸或乳酸-羟基乙酸共聚物。
所述组织细胞选自肿瘤细胞、成纤维细胞、全能干细胞、多能干细胞、专能干细胞、免疫细胞、软骨细胞、骨来源细胞、肌腱细胞、骨骼肌细胞、脂肪细胞、肝实质细胞、肝巨噬细胞、星状细胞、胆管上皮细胞、肿瘤细胞、肝窦内皮细胞、胰腺细胞、心肌细胞、神经细胞、皮肤细胞、毛囊细胞、汗腺细胞以及其他各种组织和器官来源细胞中的至少一种,优选神经细胞、胰腺细胞、心肌细胞、皮肤细胞或肝实质细胞。
前述方法中s1制备的微球平均直径为50-1000μm,s5制备的微球平均直径为10nm-100μm,且s5制备的微球平均直径小于s1制备的微球。例如s1制备的微球的平均直径可以为50μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm、1000μm或其间的任意数值。例如s4制备的微球的平均直径为10nm、100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1μm、10μm、20μm、30μm、40μm、50μm、100μm或其间的任意数值。
在形成水凝胶微球后,将涂覆材料与组织细胞水凝胶微球均匀混合,在一定的培养空间内静置培养或动态培养,直至所述涂覆材料与所述微球表面充分结合。所述培养空间可选择各种本领域常用的培养用具所形成的空间,如离心管、12孔板等。所述动态培养方法可选择本领域常用的仪器,如微重力培养装置、灌流培养装置和生物反应器、搅拌培养装置和生物反应器、波浪式培养装置和生物反应器等。
在血管细胞培养液内,将步骤s3制备的具有涂层的组织细胞团进行静态培养或动态培养,使血管化细胞附着在所述材料涂敷层上,形成血管细胞层。所述培养空间可选择各种本领域常用的培养用具所形成的空间,如离心管、12孔板等。所述动态培养方法可选择本领域常用的仪器,如微重力培养装置、灌流培养装置和生物反应器、搅拌培养装置和生物反应器、波浪式培养装置和生物反应器等。采用的培养基和培养条件是本领域培养血管化细胞和/或组织细胞常用的,由本领域技术人员依据本领域的公知技术决定。
前述方法中s5优选以藻酸钠为成囊材料制备微球。所述微球中藻酸钠的最终浓度为0.5%-10%,例如为1.5%、2%、3%、4%、5%、6%、7%、8%、9%或10%等。
本发明中,可采用悬滴法、非粘附自组装法、高压静电喷射法等制作微球。s1和s5优选都采用非接触式高压静电法制备微球。有关非接触式高压静电法制备微球可采用cn200910079726.8的非接触式高压静电发生器进行。
在组织细胞水凝胶微球之间的间隙天然形成贯通通道。所述形成的贯通通道可以作为体内血管再生的起点和空间保障,并与体内血管快速连接。
不同类型的组织细胞微球的构建方法具体如下:
一、胰岛细胞/水凝胶微球的制备
取常规培养的人胰腺细胞,采用藻酸钠/胶原混合物作为载体材料,用高压静电喷射制备装置制成胰腺细胞/水凝胶微球:
1.将藻酸钠(sigma-aldrich,a0682)的溶液和胶原溶液(sigma,c7661)混合为最终浓度分别为2%-6%(w/w)和0.1-2mg/ml(w/v)的载体材料溶液。
2.将人胰腺细胞(pricells,hum-cell-0058)以1×105-5×107个/ml的密度与载体材料溶液均匀混合后装入容积为1-20ml的一次性注射器。
3.连接高压静电喷射细胞微球制备装置,高压静电发生装置采用sa167-y(天津)高压电场发生器,输出电压7-12kv;将步骤2的注射器装夹在推进装置:longerpump公司ts2-60型注射泵中,针尖与铜片间距离为10-30mm,推进速度为5-50ml/h,采用内径为100-500μm的针头,收集器为直径60mm的一次性塑料培养皿(各种尺寸的塑料、玻璃培养皿都可以),固化液为100-400mmol/l氯化钙溶液(或氯化钡溶液)。
4.在5min内收集细胞微球,用生理盐水洗涤两次后观察记录,细胞微球形状圆整光滑,平均直径为300μm。
5.采用胰岛细胞培养液(dmem培养基(gibco,11965)和dmem/f-12培养基(gibco,11320)中,加入5-50mmnicotinamide(sigma,72340),0.5-10nmactivina(r&d,294-hg),1-100nmexendin-4(sigma,e7144),1-100nmpentagastrin(sigma,b1636),10-1000pmhepatocytegrowthfactor(sigma,srp6014),2%b-27supplement(gibco,17504),1%n-2supplement(gibco,a13707),1%青链霉素(gibco,15140122))于37℃、5%的co2饱和湿度培养箱内培养胰岛细胞/水凝胶微球1-20天,得到含有高密度胰岛细胞的藻酸钠/胶原水凝胶微球。
采用以下步骤将胶原材料均匀涂覆在微球表面。
6.将胶原溶液(sigma,c7661,原液)与步骤5得到的细胞微球以5:1-1:5混合均匀后装入离心管,此时细胞微球由于密度较大沉于底部。600-1500r/min的转速离心2-10min,使得胶原溶液充分与底部的胰岛细胞微球接触。在离心管中静置培养12~72h,使得胶原溶液均匀分布在微球表面并通过自组装作用将局部微球连接成整体,同时形成局部贯通通道作为形成血管网络的空间。
采用以下步骤使血管化细胞均匀贴敷在胶原材料表面。
7.人体脂肪来源间充质干细胞(sciencell,hmsc-ad)常规培养在干细胞培养液(含有10%胎牛血清和双抗的高糖dmem培养基)中,取传代第2-10代的干细胞,以106-108个/ml的密度重悬在培养液,以1:1的体积比与步骤6中得到的微球混合,在37℃、5%co2、饱和湿度的细胞培养箱内静置培养1-10天,形成含有血管化生长因子的工程化胰腺组织。
二、肝实质细胞/水凝胶微球的制备
取常规培养的人肝实质细胞采用藻酸钠/明胶体系作为载体材料,用高压静电喷射细胞微球制备装置制成肝细胞/水凝胶微球:
1.将藻酸钠(sigma-aldrich,a0682)的溶液和明胶(sigma-aldrich,g1890)溶液(溶剂pbs缓冲溶液或生理盐水)混合为最终浓度分别为1%-6%(w/w)和2%-6%(w/w)的载体材料溶液。
2.将肝实质细胞(pricells,hum-cell-0036)以1×105-5×107个/ml的密度与载体材料溶液均匀混合后装入容积为1-20ml的一次性注射器。
3.连接高压静电喷射细胞微球制备装置,高压静电发生装置采用sa167-y(天津)高压电场发生器,输出电压7-12kv;将步骤2的注射器装夹在推进装置:longerpump公司ts2-60型注射泵中,针尖与铜片间距离为10-30mm,推进速度为5-50ml/h,采用内径为100-500μm的针头,收集器为直径60mm的一次性塑料培养皿(各种尺寸的塑料、玻璃培养皿都可以),固化液为100-400mmol/l氯化钙溶液(或氯化钡溶液)。
4.在5min内收集细胞微球,用生理盐水洗涤两次后观察记录,细胞微球形状圆整光滑,平均直径约为400μm。
5.采用肝实质细胞培养液(高糖dmem,10%胎牛血清,0.5mmol/l抗坏血酸,0.5-10μmol/l地塞米松,12μmol/l胰岛素,1%青链霉素原液)于37℃、5%的co2饱和湿度培养箱内培养肝实质细胞微球1-20天,得到藻酸钠/明胶包裹的高浓度肝实质细胞团簇。
采用以下步骤将胶原材料均匀涂覆在微球表面。
6.将胶原溶液(sigma,c7661)与肝实质细胞微球以5:1-1:5混合均匀后装入离心管,此时细胞微球由于密度较大沉于底部。600-1500r/min的转速离心2-10min,使得胶原溶液充分与底部的肝实质细胞微球接触。在离心管中静置培养24~72h,使得胶原溶液均匀分布在微球表面。
采用以下步骤使血管化细胞均匀贴敷在胶原材料表面。
7.内皮细胞(atcc,huvec)常规培养在内皮细胞培养液(含有2%胎牛血清,0.1mg/ml肝素钠和0.04mg/ml内皮细胞生长辅助物ecgs的f12培养基)中,取生长状态良好的细胞以106-108个/ml的密度重悬在内皮细胞培养液中。
8.采用微重力生物反应器制备内皮细胞层:将重悬的内皮细胞以1:5-5:1的体积比与步骤6得到的微球混合,将5-100ml混合物从细胞接口接种至微重力生物反应器(synthecon,rccstm)内,排空反应器内气泡并封闭排气口。将生物反应器装置置于37℃、5%co2、饱和湿度的细胞培养箱内,以10-100rpm旋转速度(以使微球悬浮不下沉的最小速度为宜)培养1-10天,每天半量换液,内皮细胞在微球表面均匀贴敷生长,获得成熟期的肝实质细胞/水凝胶微球。
三、宫颈癌肿瘤细胞/水凝胶微球的制备
取常规培养的宫颈癌肿瘤,制备人宫颈癌肿瘤细胞/水凝胶微球,采用藻酸钠/玻连蛋白体系作为微球材料:
1.将藻酸钠溶液和玻连蛋白溶液混合为最终浓度分别为1%-6%和0.1-10mg/ml的溶液,作为微球材料前体溶液。
2.将宫颈癌肿瘤细胞(atcc,h1hela)以1×105-5×107个/ml的密度与载体材料前体溶液均匀混合后装入容积为1-20ml的一次性注射器。
3.参照上述二中步骤3制备宫颈癌肿瘤细胞/藻酸钠/玻连蛋白微球。
4.在5min内收集细胞微球,用生理盐水洗涤两次后观察记录,细胞微球形状圆整光滑,平均直径为450μm。
5.采用肿瘤细胞培养液(高糖dmem,10%胎牛血清,0.1%青-链霉素)于37℃、5%的co2饱和湿度培养箱内培养微球1-10天,得到藻酸钠/玻连蛋白包裹的高浓度肿瘤细胞微球。
6.参照上述二中的步骤制备涂敷材料涂敷层。
7.内皮细胞(atcc,huvec)常规培养在内皮细胞培养液(含有2%胎牛血清,0.1mg/ml肝素钠和0.04mg/ml内皮细胞生长辅助物ecgs的f12培养基)中,人脑血管外膜成纤维细胞(atcc,hbvaf)常规培养在成纤维细胞培养液(含有10%胎牛血清的,不含hepes的rpmi1640培养基)中。取生长状态良好的内皮细胞和以人脑血管外膜成纤维细胞,均以106-108个/ml的密度重悬在内皮-成纤维细胞培养液(内皮细胞培养液和成纤维细胞培养液1:1体积比混合)中。
8.采用微重力生物反应器制备血管化细胞层:将重悬的内皮细胞和成纤维细胞以1:1的体积比与步骤6中得到的微球混合,将5-100ml混合物从细胞接口接种至微重力生物反应器(synthecon,rccstm)内,排空反应器内气泡并封闭排气口。将生物反应器装置置于37℃、5%co2、饱和湿度的细胞培养箱内,以10-100rpm旋转速度(以使微球悬浮不下沉的最小速度为宜)培养1-10天,每天半量换液,血管化细胞在微球表面均匀贴敷生长,获得成熟期的癌细胞/水凝胶微球。
四、皮肤细胞/水凝胶微球的制备
1.将人体皮肤成纤维细胞(atcc,hsf)、人体皮肤黑色素细胞(sciencell,hm)和人体表皮角化细胞(atcc,adultepidermalkeratinocytes)与微球前体溶液胶原(sigma,c7661)均匀混合,两种细胞的终浓度均为105-108个/ml,前体溶液终浓度为0.1-10mg/ml。
2.将步骤1所得混合物装载到喷墨式细胞打印机上(celllink,bioxprinter,ink-jetprinthead),将含有细胞的胶原载体材料呈微滴式打印到非粘附的塑料底面上,在37℃、5%co2、饱和湿度的细胞培养箱内倒置培养2h,完成微球制备过程。
3.收集皮肤细胞微球,用生理盐水洗涤两次后培养在皮肤细胞培养基中(含有10%胎牛血清、4mm谷氨酰胺、100u/ml青霉素、100u/ml链霉素、0.1-20μg/ml氢化可的松、1-50μg/ml转铁蛋白、1-50μg/ml胰岛素、1-100ng/ml表皮生长因子的dmem/f-12培养基)培养1-15天,每天半量换液。
4.参照上述三中的步骤将内皮细胞层涂敷到皮肤细胞微球表面,得到成熟期皮肤细胞/水凝胶微球。
生长因子缓释微球的构建方法具体如下:
采用高压静电装置将血管内皮细胞生长因子(abcam,ab9571)和碱性成纤维细胞生长因子(abcam,ab9596)包裹在材料微球中形成缓释体系。具体步骤如下:
1.将藻酸钠用生理盐水配置成1-8%(w/w)的溶液。
2.将碱性成纤维细胞生长因子和血管内皮细胞生长因子以1-100ng/ml和1-100ng/ml的浓度与藻酸钠溶液均匀混合后装入容积为1-20ml的一次性注射器。
3.连接高压静电细胞微球制备装置,工作电压10-17kv,针尖与铜片间距离为15-30mm,推进速度为50-50ml/h,采用内径为30-300μm的针头,收集器为直径60mm的一次性塑料培养皿(各种尺寸的塑料、玻璃培养皿都可以),固化液为100-400mmol/l氯化钙溶液(或氯化钡溶液)。
4.在5min内收集血管化生长因子缓释微球,用生理盐水洗涤两次后观察记录,血管化生长因子缓释微球的形状圆整光滑,平均直径为30μm。
5.注意在整个过程中尽量保持低温。
可用于快速再生血管化组织的人工结构体的构建方法具体如下:
(一)类肿瘤组织人工结构体的制备
1、将质量分数3%-20%的明胶(sigma-aldrich,g1890)溶液(溶剂pbs缓冲溶液)和胶原溶液(sigma,c7661)按照体积比1:5-5:1均匀混合形成载体材料前体溶液。
2、将上述三中获得的含血管细胞层的肿瘤细胞/水凝胶微球、上述获得的血管化生长因子缓释微球、表皮生长因子(abcam,ab9697)、脐静脉血管内皮细胞(atcc,huvec)和宫颈癌细胞(atcc,h1hela)分别以体积比5:1-20:1、1:5-5:1、5~50ng/ml、105-107个/ml和105-107个/ml的浓度与步骤1获得的载体材料前体溶液均匀混合后,以50-200ml/孔的体积移入96孔板中,在37℃、5%co2、饱和湿度的细胞培养箱内静置0.5-2h,完成载体材料交联过程。
3、采用血管细胞培养液和肿瘤细胞培养液1:1体积比均匀混合作为培养液(血管细胞培养液为:含有2%胎牛血清,0.1mg/ml肝素钠和0.04mg/ml内皮细胞生长辅助物ecgs的f12培养基;肿瘤细胞培养液为:高糖dmem,10%胎牛血清,0.1%青-链霉素)培养步骤2获得的人工结构体,每2-3天换液,培养2-20天。形成类肿瘤组织人工结构体。
(二)类神经组织人工结构体制备
使用高压静电装置制备神经干细胞/水凝胶微球,取常规培养的神经干细胞(atcc,acs-5006)采用藻酸钠/基质胶体系作为载体材料:
1.将藻酸钠的溶液和基质胶原液(bdsciencecs,356234)在低温下以3:1的体积比均匀混合,其中海藻酸的浓度为2%-8%(w/w)。
2.将人神经干细胞(atcc,acs-5006)以1×105-5×107个/ml的密度与步骤1获得的溶液均匀混合后装入容积为1-20ml的一次性注射器。
3.连接高压静电喷射细胞微球制备装置,高压静电发生装置采用sa167-y(天津)高压电场发生器,输出电压7-12kv;将步骤2的注射器装夹在推进装置:longerpump公司ts2-60型注射泵中,针尖与铜片间距离为10-30mm,推进速度为5-50ml/h,采用内径为100-500μm的针头,收集器为直径60mm的一次性塑料培养皿(各种尺寸的塑料、玻璃培养皿都可以),固化液为100-400mmol/l氯化钙溶液(或氯化钡溶液)。
4.在5min内收集细胞微球,用生理盐水洗涤两次后观察记录,细胞微球形状圆整光滑,平均直径为380μm。
5.采用神经细胞分化培养液(高糖dmem,5%胎牛血清,10-300mg/mlnahco3,5-50mmol/ld-葡萄糖,25u/ml青-链霉素,0.5mmol/ll-谷氨酰胺,1-10μmol/l阿糖胞苷)于37℃、5%co2饱和湿度培养箱内诱导分化神经干细胞微球5-15天,得到藻酸钠/基质胶包裹的高浓度神经细胞团簇。
6.参照上述一中所述步骤涂敷材料涂敷层制备。
7.参照上述一中所述步骤步骤粘附血管化细胞层,获得神经干细胞/水凝胶微球。
8.将胶原溶液(sigma,c7661)和层连蛋白溶液(sigma,l6274)按照体积比1:5-5:1均匀混合形成载体材料前体溶液。
9.将步骤7获得的神经干细胞/水凝胶微球、上述获得的血管化生长因子缓释微球、表皮生长因子(abcam,ab9697)、脐静脉血管内皮细胞(atcc,huvec)和神经干细胞(atcc,acs-5006)分别以体积比5:1-20:1、1:5-5:1、5~50ng/ml、105-107个/ml和105-107个/ml的浓度与步骤8获得的载体材料前体溶液均匀混合后,以50-200ml/孔的体积移入96孔板中,在37℃、5%co2、饱和湿度的细胞培养箱内静置0.5-8h,完成载体材料交联过程。
10.采用血管细胞培养液和神经细胞培养液1:1体积比均匀混合作为培养液(血管细胞培养液为:含有2%胎牛血清,0.1mg/ml肝素钠和0.04mg/ml内皮细胞生长辅助物ecgs的f12培养基;神经细胞培养液为:高糖dmem,5%胎牛血清,10-300mg/mlnahco3,5-50mmol/ld-葡萄糖,25u/ml青-链霉素,0.5mmol/ll-谷氨酰胺,1-10μmol/l阿糖胞苷)培养步骤9获得的人工结构体,每2-3天换液,培养2-20天。形成类神经组织人工结构体。
第二方面,本发明提供按上述方法构建得到的人工结构体。所述人工结构体包含细胞/水凝胶微球、组织相关细胞、血管化细胞、生长因子缓释微球和载体材料。其中,细胞/水凝胶微球内部均匀分布组织相关细胞,微球外部含有血管化细胞层;载体材料中均匀分布细胞/水凝胶微球、组织相关细胞、血管化细胞、生长因子缓释微球。其中,载体材料可包裹生长因子,作为一级因子缓释体系;因子缓释微球直径更小,作为二级因子缓释体系。本发明的人工结构体可通过生物反应器培养获得具有类血管网络结构的血管化组织前体,或移植入体内再生血管化功能组织。获得的组织前体或功能组织具有一定生理功能,可用于组织发育、疾病发生、药物开发与检测、组织再生和修复等体内和体外研究。本发明可用于组织工程、再生医学、体外生理模型/病理模型/药理模型构建、组织/器官/人体芯片、细胞生物学或药物研究等方面。
第三方面,本发明提供所述人工结构体在血管化组织构建中的应用。所述人工结构体可通过生物反应器培养获得具有类血管网络结构的血管化组织前体,或移植(包括但不限于注射移植)入体内再生血管化功能组织。对于一些不需要注射移植的情况,例如开放性伤口,也可以将该组织快速注射到病损区,而不影响手术方案。
第四方面,本发明提供一种构建血管化组织的方法,将所述人工结构体在装有含血管细胞培养液与组织细胞培养液的混合培养液的生物反应器内培养1-30天(优选8-12天)。
本发明的目的还可以采用以下的技术措施来进一步实现。
本发明的可用于快速再生血管化组织的人工结构体,其为可用于微创移植以及快速再生体内血管化组织的工程化组织,所述工程化组织包含多于一个结构单元,其中所述结构单元包含载体材料;组织细胞以及血管化生长因子(也可以没有生长因子,只有组织细胞)分布在所述载体材料中;所述载体材料外周涂敷有材料涂敷层(也可以没有涂敷层),在所述材料涂敷层外粘附有血管细胞层,并且在所述结构单元之间的间隙形成贯通通道。所述形成的贯通通道可以作为体内血管再生的起点和空间保障,并与体内血管快速连接。
本发明的工程化组织为注射式工程化组织。在一些实施方案中,通过注射式施用的方式将本发明的工程化组织移植入体内,并在体内快速实现血管再生。优选地,使用一次性注射器将本发明的工程化组织移植入体内。
在一些实施方案中,所述结构单元为球状。
在一些实施方案中,所述结构单元为微米级结构单元。
在一些实施方案中,所述结构单元的平均直径为50μm~1000μm。例如所述结构单元的平均直径可以为50μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm、1000μm或其间的任意数值。
在一些实施方案中,所述载体材料为天然生物材料和/或人工合成生物材料,其为生物可降解的和具有生物相容性的材料。
上述工程化组织可按照如下方法制备得到:将组织细胞采用天然生物材料和/或人工合成生物材料包裹制成微米级球状结构单元,利用结构单元之间的间隙作为形成血管的贯通通道并在结构单元外涂敷材料层(也可以没有)和血管细胞层,以实现快速体内血管再生,所述方法包括以下步骤:
(1)将组织细胞和血管化生长因子(也可以没有因子,只有组织细胞)包裹在载体材料中,形成组织细胞微球,(或将干细胞和/或没有血管化生长因子包裹在载体材料中,然后在培养基中加入定向诱导分化因子,将干细胞诱导分化成为所需组织细胞后,形成组织细胞微球);
(2)在所述组织细胞微球外层均匀涂敷由生物材料形成的材料涂敷层(也可以没有材料涂敷层);
(3)在所述材料涂敷层外粘附血管细胞层。
可采用多种本领域技术人员已知的方法将组织细胞或血管化生长因子包裹在载体材料中,如悬滴法、非粘附自组装法、高压静电喷射法等,优选高压静电喷射法,过程如下:将组织细胞以106~107个/ml的密度和1~5000ng/ml血管化生长因子(也可以没有血管化生长因子)与载体材料混合后通过注射泵挤出,经过高压静电场的拉力滴入固化液中,制成组织细胞微球,含有或者不含有血管化生长因子。
在一些实施方案中,所述载体材料为天然生物材料和/或人工合成生物材料,其为生物可降解的和具有生物相容性的材料。
在一些实施方案中,基于藻酸钠的水凝胶材料可以是藻酸钠、藻酸钠/胶原、藻酸钠/明胶、藻酸钠/纤维蛋白原等中的至少一种。
在一些实施方案中,基于藻酸钠的微球材料的最终浓度为0.5%-10%,例如为1.5%、2%、3%、4%、5%、6%、7%、8%、9%或10%等。
在一些实施方案中,所述固化液为含二价阳离子的盐溶液,如氯化钙、氯化钡等,优选氯化钙溶液。
在一些实施方案中,所用氯化钙溶液的浓度为100mm-500mm,例如100mm、150mm、200mm、250mm、300mm、350mm、400mm、450mm或500mm等。
另一个方面,本发明涉及工程化组织在制备用于快速体内血管化组织之药物中的用途。
另一个方面,本发明涉及根据本发明方法制备的工程化组织在制备用于快速体内血管化组织之药物中的用途。
另一个方面,本发明涉及工程化组织在制备用于构建生理/病理/药理模型、药物学研究、治疗疾病以及恢复、替代、维持或提高组织器官功能的植入物中的用途。
另一个方面,本发明涉及根据本发明方法制备的工程化组织在制备用于构建生理/病理/药理模型、药物学研究、治疗疾病以及恢复、替代、维持或提高组织器官功能的植入物中的用途。
另一个方面,本发明涉及工程化组织快速再生体内血管化组织的方法,所述方法包括将本发明工程化组织通过微创的注射式方式移植入体内,并在体内快速实现血管化组织再生。
在一些实施方案中,所述方法包括通过使用一次性注射器将本发明工程化组织移植入体内,并在体内快速实现血管再生。
另一个方面,本发明涉及在体内再生具有功能血管网络的组织的方法,所述方法包括将本发明工程化组织通过微创的注射式方式移植入体内,从而在体内形成具有功能血管网络的组织。
在一些实施方案中,所述方法包括使用一次性注射器将本发明工程化组织移植入体内,从而在体内形成具有功能血管网络的组织。
借由上述技术方案,本发明至少具有下列优点及有益效果:
(一)含有两级生长因子缓释体系。生长因子缓释微球的平均直径在10nm-100μm之间,可实现某种生长因子的缓慢释放;载体材料中可包裹另一种生长因子,且释放速率大于缓释微球,故而可实现多种生长因子的分级递送。
(二)可注射微创移植。本发明的基本结构单元为水凝胶微球,平均直径在50μm~1000μm之间,当采用可注射材料作为载体材料时,可实现注射微创移植,创伤小,术后恢复快,易于被患者接受。
(三)可实现快速体内血管再生。基本结构单元之间天然存在的贯通通道和外层涂敷的血管化细胞作为体内血管再生的起点和空间保障,可与体内血管快速连接,在短时间内实现功能性血管网络再生。此外,人工结构体中还包含两级生长因子缓释体系,可以促进毛细血管发生和促进血管成熟,从而进一步促进体内血管再生,可使血管再生速度最高达约8mm2/天的量级。
(四)可实现大体积组织的体内再生。通过对基本结构单元\生长因子缓释微球个数的控制,可一次性注射数百至数万量级的球状结构单元,结构单元空隙之间再生的大量功能性血管可保证厘米量级,临床应用相关尺寸组织的体内存活、重塑和再生。
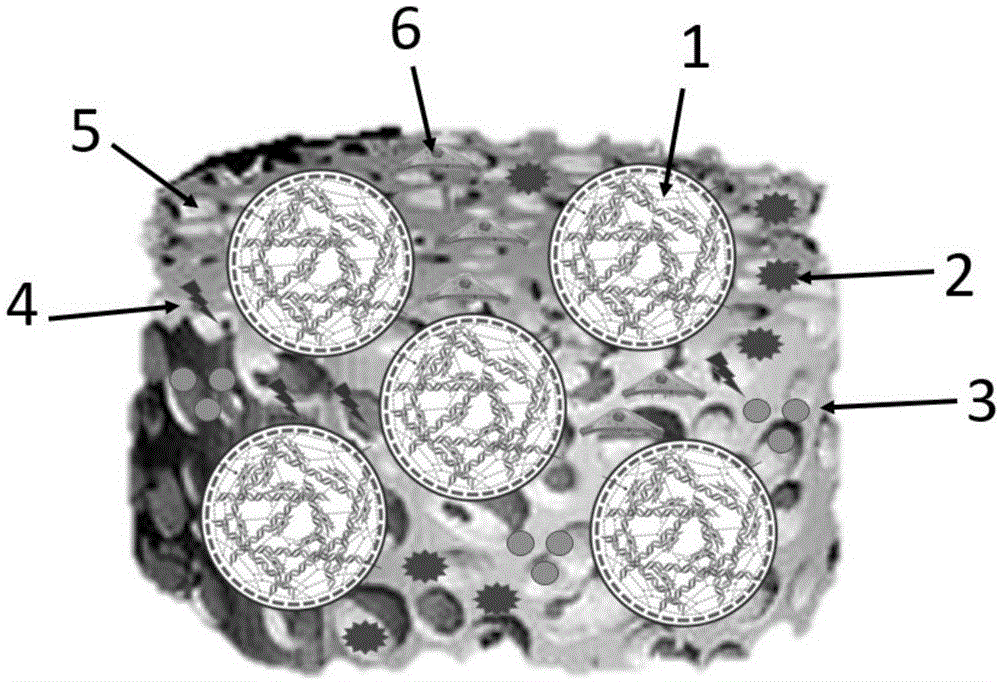
附图说明
图1为本发明人工结构体结构示意图。其中,1:细胞/水凝胶微球;2:组织相关细胞;3:生长因子缓释微球;4:生长因子;5:载体材料;6:血管化细胞。
图2为本发明实施例1和4中制备的人工结构体实物图。其中,a:光学显微镜观察细胞/水凝胶微球形成初期,胰岛细胞(黑色箭头所示)被包裹在海藻酸钠和胶原组成的载体材料微球中,载体材料表面有胶原涂敷层,血管内皮细胞(白色箭头所示)粘附在胶原材料涂敷层表面。b:扫描电子显微镜观察胶原涂敷层的微观结构。c:细胞/水凝胶微球形成成熟期,肝实质细胞(黑色箭头所示)被包裹在海藻酸钠和明胶组成的载体材料中,间充质干细胞(白色箭头所示)呈层状均匀粘附在载体材料表面。d:人工结构体实物图,其中包括宫颈癌细胞/水凝胶微球(黑色箭头所示)、血管化生长因子缓释微球(白色箭头所示)、血管化细胞、癌细胞。标尺:200μm。
图3为本发明实施例9中人工结构体体内移植28天后再生血管化组织的he染色效果。其中,a:植入物切片he染色显示体内再生胰腺组织。b:植入物切片he染色显示体内再生神经组织,红色功能性的再生血管,其中含有大量红细胞,如黑色三角箭头所示。c:植入物切片he染色显示体内再生宫颈癌肿瘤组织,红色功能性的再生血管,其中含有大量红细胞,如黑色三角箭头所示。d:免疫荧光染色显示植入物体内再生肝脏的效果,白蛋白(albumin)阳性染色为再生的功能性肝细胞。
图4为本发明实施例9中人工结构体体内移植28天后再生血管化组织的定量检测结果。其中,a:本发明人工结构体及对照组体内再生血管密度鉴定。b:本发明人工结构体及对照组体内再生血管化组织情况鉴定。**代表p<0.01,***代表p<0.001。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
术语:
本发明使用的“工程化组织移植”是指通过移植经组织工程技术制备的、含有活性细胞的组织,来修复、改善或重建患者的组织或器官的结构和/或功能的技术。“工程化组织”是指经工程技术制备的、含有活性细胞的组织。所述活性细胞优选人体细胞,更优选自体细胞。
术语“血管化”和“形成功能血管网络”在本发明中可以互换使用,是指在身体组织中形成血管和毛细血管的过程。
本发明使用的“血管再生”是指包括血管发生和血管生成两种机制。前者通过激活血管化细胞(特别是血管内皮细胞)的前体细胞形成新生血管。后者又成为血管新生,是指已经存在的毛细血管的血管细胞发生增殖而形成新生血管网的过程。本发明所述的“血管化生长因子”在这两种机制中均发挥着重要作用。
术语“基本单元”、“基本结构单元”和“结构单元”在本发明中可以互换使用,其为本发明工程化组织的基本构成单元,结构如图1所示,并且本发明工程化组织包含多于一个所述单元。
本发明使用的“组织细胞”指的是形成人体或动物体中基本结构或器官的形态功能类似的细胞,其不包括血管化细胞。本发明使用的“血管化细胞”指的是形成血管的细胞。
本发明使用的“血管化生长因子缓释微球”是指仅将血管化生长因子包裹在载体材料中形成的球体。
本发明使用的“均匀”是指使材料或物质的性质、厚度、密度等一致或近似一致。
本发明使用的“水凝胶”具有三维网络结构,在水中能够吸收大量的水分溶胀,并在溶胀后继续保持其原有结构而不被溶解。水凝胶类似于生命组织材料,表面粘附蛋白质及细胞能力很弱,在与血液、体液及人体组织相接触时,表现出良好的生物相容性。它在性质上类似于细胞外基质部分,吸水后可减少对周围组织的摩擦和机械作用,显著改善了材料的生物学功能。
术语例如“包含”、“含”、“含有”和“包括”不意在限制。此外,除非另有说明,没有数词修饰时包括复数形式,以及“或”、“或者”是指“和/或”。除非本发明另有定义,本发明使用的所有技术和科学术语的意思与本领域技术人员通常理解的相同。
以下实施例中使用的脉动生物反应器可参见cn200910079726.8。
实施例1胰岛细胞/水凝胶微球的制备
取常规培养的人胰腺细胞,采用藻酸钠/胶原混合物作为载体材料,用高压静电喷射制备装置制成胰腺细胞/水凝胶微球:
1.将藻酸钠(sigma-aldrich,a0682)的溶液和胶原溶液(sigma,c7661)混合为最终浓度分别为2%(w/w)和1mg/ml(w/v)的载体材料溶液。
2.将人胰腺细胞(pricells,hum-cell-0058)以106个/ml的密度与载体材料溶液均匀混合后装入容积为5ml的一次性注射器。
3.连接高压静电喷射细胞微球制备装置,高压静电发生装置采用sa167-y(天津)高压电场发生器,输出电压10kv;将步骤2的注射器装夹在推进装置:longerpump公司ts2-60型注射泵中,针尖与铜片间距离为10mm,推进速度为20ml/h,采用内径为191μm的针头,收集器为直径60mm的一次性塑料培养皿(各种尺寸的塑料、玻璃培养皿都可以),固化液为200mmol/l氯化钙溶液(或氯化钡溶液)。
4.在5min内收集细胞微球,用生理盐水洗涤两次后观察记录,细胞微球形状圆整光滑,平均直径为300μm。
5.采用胰岛细胞培养液(dmem培养基(gibco,11965)和dmem/f-12培养基(gibco,11320)中,加入10mmnicotinamide(sigma,72340),2nmactivina(r&d,294-hg),10nmexendin-4(sigma,e7144),10nmpentagastrin(sigma,b1636),100pmhepatocytegrowthfactor(sigma,srp6014),2%b-27supplement(gibco,17504),1%n-2supplement(gibco,a13707),1%青链霉素(gibco,15140122))于37℃、5%的co2饱和湿度培养箱内培养胰岛细胞/水凝胶微球5天,得到含有高密度胰岛细胞的藻酸钠/胶原水凝胶微球。
采用以下步骤将胶原材料均匀涂覆在微球表面。
6.将胶原溶液(sigma,c7661,原液)与步骤5得到的细胞微球以1:1混合均匀后装入离心管,此时细胞微球由于密度较大沉于底部。1000r/min的转速离心4min,使得胶原溶液充分与底部的胰岛细胞微球接触。在离心管中静置培养24h,使得胶原溶液均匀分布在微球表面并通过自组装作用将局部微球连接成整体,同时形成局部贯通通道作为形成血管网络的空间。
采用以下步骤使血管化细胞均匀贴敷在胶原材料表面。
7.人体脂肪来源间充质干细胞(sciencell,hmsc-ad)常规培养在干细胞培养液(含有10%胎牛血清和双抗的高糖dmem培养基)中,取传代第3代的干细胞,以107个/ml的密度重悬在培养液,以1:1的体积比与步骤6中得到的微球混合,在37℃、5%co2、饱和湿度的细胞培养箱内静置培养3天,形成含有血管化生长因子的工程化胰腺组织。静止培养1天后,光学显微镜下观察,如图2a所示。
实施例2肝实质细胞/水凝胶微球的制备
取常规培养的人肝实质细胞采用藻酸钠/明胶体系作为载体材料,用高压静电喷射细胞微球制备装置制成肝细胞/水凝胶微球:
1.将藻酸钠(sigma-aldrich,a0682)的溶液和明胶(sigma-aldrich,g1890)溶液(溶剂pbs缓冲溶液或生理盐水)混合为最终浓度分别为2%(w/w)和3%(w/w)的载体材料溶液。
2.将肝实质细胞(pricells,hum-cell-0036)以106个/ml的密度与载体材料溶液均匀混合后装入容积为10ml的一次性注射器。
3.连接高压静电喷射细胞微球制备装置,高压静电发生装置采用sa167-y(天津)高压电场发生器,输出电压10kv;将步骤2的注射器装夹在推进装置:longerpump公司ts2-60型注射泵中,针尖与铜片间距离为10mm,推进速度为20ml/h,采用内径为191μm的针头,收集器为直径60mm的一次性塑料培养皿(各种尺寸的塑料、玻璃培养皿都可以),固化液为200mmol/l氯化钙溶液(或氯化钡溶液)。
4.在5min内收集细胞微球,用生理盐水洗涤两次后观察记录,细胞微球形状圆整光滑,平均直径约为400μm。
5.采用肝实质细胞培养液(高糖dmem,10%胎牛血清,0.5mmol/l抗坏血酸,1μmol/l地塞米松,12μmol/l胰岛素,1%青链霉素原液)于37℃、5%的co2饱和湿度培养箱内培养肝实质细胞微球1天,得到藻酸钠/明胶包裹的高浓度肝实质细胞团簇。
采用以下步骤将胶原材料均匀涂覆在微球表面。
6.将胶原溶液(sigma,c7661)与肝实质细胞微球以1:1混合均匀后装入离心管,此时细胞微球由于密度较大沉于底部。1000r/min的转速离心4min,使得胶原溶液充分与底部的肝实质细胞微球接触。在离心管中静置培养48h,使得胶原溶液均匀分布在微球表面。
采用扫描电镜观察胶原涂覆情况。将经过涂覆的细胞微球采用含有2%戊二醛、3%多聚甲醛和5%蔗糖的1mol/l二甲砷酸钠缓冲液固定后,采用feiquanta200扫描电镜(荷兰)观察微球表面胶原层形貌。结果显示微球表面均匀涂覆一层胶原纤维,如图2b所示。
采用以下步骤使血管化细胞均匀贴敷在胶原材料表面。
7.内皮细胞(atcc,huvec)常规培养在内皮细胞培养液(含有2%胎牛血清,0.1mg/ml肝素钠和0.04mg/ml内皮细胞生长辅助物ecgs的f12培养基)中,取生长状态良好的细胞以107个/ml的密度重悬在内皮细胞培养液中。
8.采用微重力生物反应器制备内皮细胞层:将重悬的内皮细胞以1:1的体积比与步骤6得到的微球混合,将20ml混合物从细胞接口接种至微重力生物反应器(synthecon,rccstm)内,排空反应器内气泡并封闭排气口。将生物反应器装置置于37℃、5%co2、饱和湿度的细胞培养箱内,以20rpm旋转速度(以使微球悬浮不下沉的最小速度为宜)培养3天,每天半量换液,内皮细胞在微球表面均匀贴敷生长,获得成熟期的肝实质细胞/水凝胶微球。如图2c所示。
实施例3宫颈癌肿瘤细胞/水凝胶微球的制备
取常规培养的宫颈癌肿瘤,制备人宫颈癌肿瘤细胞/水凝胶微球,采用藻酸钠/玻连蛋白体系作为微球材料:
1.将藻酸钠溶液和玻连蛋白溶液混合为最终浓度分别为2%和1mg/ml的溶液,作为微球材料前体溶液。
2.将宫颈癌肿瘤细胞(atcc,h1hela)以107个/ml的密度与载体材料前体溶液均匀混合后装入容积为10ml的一次性注射器。
3.参照实施例2中步骤3制备宫颈癌肿瘤细胞/藻酸钠/玻连蛋白微球。
4.在5min内收集细胞微球,用生理盐水洗涤两次后观察记录,细胞微球形状圆整光滑,平均直径为450μm。
5.采用肿瘤细胞培养液(高糖dmem,10%胎牛血清,0.1%青-链霉素)于37℃、5%的co2饱和湿度培养箱内培养微球3天,得到藻酸钠/玻连蛋白包裹的高浓度肿瘤细胞微球。
6.参照实施例2中的步骤制备涂敷材料涂敷层。
7.内皮细胞(atcc,huvec)常规培养在内皮细胞培养液(含有2%胎牛血清,0.1mg/ml肝素钠和0.04mg/ml内皮细胞生长辅助物ecgs的f12培养基)中,人脑血管外膜成纤维细胞(atcc,hbvaf)常规培养在成纤维细胞培养液(含有10%胎牛血清的,不含hepes的rpmi1640培养基)中。取生长状态良好的内皮细胞和以人脑血管外膜成纤维细胞,均以106个/ml的密度重悬在内皮-成纤维细胞培养液(内皮细胞培养液和成纤维细胞培养液1:1体积比混合)中。
8.采用微重力生物反应器制备血管化细胞层:将重悬的内皮细胞和成纤维细胞以1:1的体积比与步骤6中得到的微球混合,将20ml混合物从细胞接口接种至微重力生物反应器(synthecon,rccstm)内,排空反应器内气泡并封闭排气口。将生物反应器装置置于37℃、5%co2、饱和湿度的细胞培养箱内,以20rpm旋转速度(以使微球悬浮不下沉的最小速度为宜)培养3天,每天半量换液,血管化细胞在微球表面均匀贴敷生长,获得成熟期的癌细胞/水凝胶微球。
实施例4皮肤细胞/水凝胶微球的制备
1.将人体皮肤成纤维细胞(atcc,hsf)、人体皮肤黑色素细胞(sciencell,hm)和人体表皮角化细胞(atcc,adultepidermalkeratinocytes)与微球前体溶液胶原(sigma,c7661)均匀混合,两种细胞的终浓度均为106个/ml,前体溶液终浓度为1mg/ml。
2.将步骤1所得混合物装载到喷墨式细胞打印机上(celllink,bioxprinter,ink-jetprinthead),将含有细胞的胶原载体材料呈微滴式打印到非粘附的塑料底面上,在37℃、5%co2、饱和湿度的细胞培养箱内倒置培养2h,完成微球制备过程。
3.收集皮肤细胞微球,用生理盐水洗涤两次后培养在皮肤细胞培养基中(含有10%胎牛血清、4mm谷氨酰胺、100u/ml青霉素、100u/ml链霉素、0.4μg/ml氢化可的松、5μg/ml转铁蛋白、5μg/ml胰岛素、10ng/ml表皮生长因子的dmem/f-12培养基)培养3天,每天半量换液。
4.参照实施例3中的步骤将内皮细胞层涂敷到皮肤细胞微球表面,得到成熟期皮肤细胞/水凝胶微球。
实施例5生长因子缓释微球的制备
采用高压静电装置将血管内皮细胞生长因子(abcam,ab9571)和碱性成纤维细胞生长因子(abcam,ab9596)包裹在材料微球中形成缓释体系。具体步骤如下:
1.将藻酸钠用生理盐水配置成1.5%(w/w)的溶液。
2.将碱性成纤维细胞生长因子和血管内皮细胞生长因子以2ng/ml和10ng/ml的浓度与藻酸钠溶液均匀混合后装入容积为10ml的一次性注射器。
3.连接高压静电细胞微球制备装置,工作电压12kv,针尖与铜片间距离为20mm,推进速度为30ml/h,采用内径为191μm的针头,收集器为直径60mm的一次性塑料培养皿(各种尺寸的塑料、玻璃培养皿都可以),固化液为200mmol/l氯化钙溶液(或氯化钡溶液)。
4.在5min内收集血管化生长因子缓释微球,用生理盐水洗涤两次后观察记录,血管化生长因子缓释微球的形状圆整光滑,平均直径为30μm。
5.注意在整个过程中尽量保持低温。
实施例6类肿瘤组织人工结构体的制备
1、将质量分数10%的明胶(sigma-aldrich,g1890)溶液(溶剂pbs缓冲溶液)和胶原溶液(sigma,c7661)按照体积比1:1均匀混合形成载体材料前体溶液。
2、将实施例3中获得的含血管细胞层的肿瘤细胞/水凝胶微球、实施例5中获得的血管化生长因子缓释微球、表皮生长因子(abcam,ab9697)、脐静脉血管内皮细胞(atcc,huvec)和宫颈癌细胞(atcc,h1hela)分别以体积比10:1、2:1、10ng/ml、106个/ml和106个/ml的浓度与步骤1获得的载体材料前体溶液均匀混合后,以100ml/孔的体积移入96孔板中,在37℃、5%co2、饱和湿度的细胞培养箱内静置1h,完成载体材料交联过程。
3、采用血管细胞培养液和肿瘤细胞培养液1:1体积比均匀混合作为培养液(血管细胞培养液为:含有2%胎牛血清,0.1mg/ml肝素钠和0.04mg/ml内皮细胞生长辅助物ecgs的f12培养基;肿瘤细胞培养液为:高糖dmem,10%胎牛血清,0.1%青-链霉素)培养步骤2获得的人工结构体,每2-3天换液,培养10天。
实施例7类神经组织人工结构体的制备
使用高压静电装置制备神经干细胞/水凝胶微球,取常规培养的神经干细胞(atcc,acs-5006)采用藻酸钠/基质胶体系作为载体材料:
1.将藻酸钠的溶液和基质胶原液(bdsciencecs,356234)在低温下以3:1的体积比均匀混合,其中海藻酸的浓度为3%(w/w)。
2.将人神经干细胞(atcc,acs-5006)以106个/ml的密度与载体材料溶液均匀混合后装入容积为5ml的一次性注射器。
3.连接高压静电喷射细胞微球制备装置,高压静电发生装置采用sa167-y(天津)高压电场发生器,输出电压10kv;将步骤2的注射器装夹在推进装置:longerpump公司ts2-60型注射泵中,针尖与铜片间距离为10mm,推进速度为20ml/h,采用内径为191μm的针头,收集器为直径60mm的一次性塑料培养皿(各种尺寸的塑料、玻璃培养皿都可以),固化液为200mmol/l氯化钙溶液(或氯化钡溶液)。
4.在5min内收集细胞微球,用生理盐水洗涤两次后观察记录,细胞微球形状圆整光滑,平均直径为380μm。
5.采用神经细胞分化培养液(高糖dmem,5%胎牛血清,100mg/mlnahco3,20mmol/ld-葡萄糖,25u/ml青-链霉素,0.5mmol/ll-谷氨酰胺,2μmol/l阿糖胞苷)于37℃、5%co2饱和湿度培养箱内诱导分化神经干细胞微球8天,得到藻酸钠/基质胶包裹的高浓度神经细胞团簇。
6.参照实施例1中所述步骤涂敷材料涂敷层制备。
7.参照实施例1中所述步骤步骤粘附血管化细胞层,获得神经干细胞/水凝胶微球。
8.将胶原溶液(sigma,c7661)和层连蛋白溶液(sigma,l6274)按照体积比1:1均匀混合形成载体材料前体溶液。
9.将步骤7获得的神经干细胞/水凝胶微球、实施例5获得的血管化生长因子缓释微球、表皮生长因子(abcam,ab9697)、脐静脉血管内皮细胞(atcc,huvec)和神经干细胞(atcc,acs-5006)分别以体积比10:1、2:1、10ng/ml、106个/ml和106个/ml的浓度与步骤8获得的载体材料前体溶液均匀混合后,以100ml/孔的体积移入96孔板中,在37℃、5%co2、饱和湿度的细胞培养箱内静置1h,完成载体材料交联过程。
10.采用血管细胞培养液和神经细胞培养液1:1体积比均匀混合作为培养液(血管细胞培养液为:含有2%胎牛血清,0.1mg/ml肝素钠和0.04mg/ml内皮细胞生长辅助物ecgs的f12培养基;神经细胞培养液为:高糖dmem,5%胎牛血清,100mg/mlnahco3,20mmol/ld-葡萄糖,25u/ml青-链霉素,0.5mmol/ll-谷氨酰胺,2μmol/l阿糖胞苷)培养步骤9获得的人工结构体,每2-3天换液,培养10天。形成类神经组织人工结构体。
实施例8生物反应器培养人工结构体
脉动生物反应器可参见cn200910079726.8。
采用产自崇州市崇阳众诚不锈钢配件服务部的蠕动泵jd-200来提供相应的循环动力,设定其工作电压为12v,流速为60ml/min;直流电机选用产自北京艾克斯公司的电机zgb37rh52i,设定其工作电压为12v、转速为100r/min;采用100ml的注射器;将自制导杆和滑块导轨,以及各部件,如直流电机、导杆、滑块导轨、注射器用自制的支架固定在底板上,连接各部件。
培养液循环部分由培养液瓶、蠕动泵和培养盒构成,各部分由硅胶管连接,培养液经硅胶管由蠕动泵从培养液瓶泵入培养盒(内置工程化组织),然后经硅胶管流回培养液瓶;导轨滑块、注射器和直流电机构成脉动部分,直流电机与导轨滑块连接推动注射器活塞往复运动,注射器与蠕动泵的出液端连接后和培养盒连接,由此形成脉动流;压力表设置在培养盒上,检测置于培养盒内的组织内的培养液压力。
在进行体外培养以前,先拆卸脉动生物反应器的连接管、注射器,利用高温高压灭菌。然后接通脉动生物反应器,蠕动泵和直流电机接通,首先在培养液瓶中加入少量75%的酒精,利用酒精在脉动循环系统中流动灭菌;倒掉酒精然后在培养液瓶中加入一定量已灭菌的pbs溶液,利用该溶液冲洗残余酒精。
关掉电源,然后在培养液瓶中加入待培养需使用的培养液,用灭菌好的镊子夹住实施例6制备的类肿瘤组织人工结构体接到培养盒的接头上。为使工程化组织牢固地接在接头上,用已灭菌的细线固定工程化组织的两头。待脉动生物反应器系统完全连接好后,接通电源,调整蠕动泵的电压为12v,调节人造组织处所受压力到0.1mpa,然后就可以持续运行脉动生物反应器对工程化组织进行脉动培养了。
在培养过程中保持上述电压和组织的压力,使线性控制脉动培养过程中脉动频率在100次/min。
直流电机运行平稳后,带动滑块在导轨上推动注射器活塞往复运动,活塞拉出的时候从培养液瓶中吸取培养液,挤出时把吸入的培养液注入蠕动泵形成的循环系统中流经培养盒中的工程化组织流回培养液瓶。通过调节注射器每次吸入、挤出的培养液的量可调节培养工程化组织处的压力。由此,蠕动泵和直流电机持续运动,脉动生物反应器就提供了一个脉动循环的培养液流实现了对工程化组织的脉动培养。
采用以上方法脉动培养人工结构体1-30天(优选5天),每天半换液,获得类胰腺、类肝脏、类神经、类肿瘤和类皮肤人工结构体。
采用ck40倒置光学显微镜(日本)观察人工结构体形态。镜下可见,载体材料中均匀分布肿瘤细胞/水凝胶微球、生长因子缓释微球、血管化细胞和肿瘤细胞,如图2d所示。血管再生速度可达约8mm2/天的量级。
实施例9人工结构体移植后的效果
将实施例8制备的类胰腺、类肝脏、类肿瘤和类神经人工结构体移植入免疫缺陷裸鼠(北京维通利华实验动物技术有限公司,balb/c-nude,n=4)皮下。对照组的材料和细胞种类、浓度和数量与实验组一致,只是缺少细胞微球结构和生长因子缓释微球结构。在植入28天后,挑选注射部位样品取出,石蜡切片,并进行免疫组化he(sigma)染色,在光学显微镜(dp70,olympus)下观察植入物切片,如图3a-d所示。由体内移植结果可见,本发明提供的工程化组织明显在体内快速再生多种组织,这些组织具有对应组织的形态特征和蛋白表达,并且观察到大量红细胞的存在,证明再生了丰富的功能性血管。每个样品选取3个随机视野,根据he染色图片定量分析得到结构体中生成的血管密度,如图4a所示。每个样品选取3个随机视野,根据he染色图片定量分析得到结构体中生成的新生组织占视野的比例,如图4b所示。由检测结果可见,本发明提供的人工结构体明显在体内再生血管化组织,新生血管密度和新生组织比例与对照组都有显著性差异。血管再生速度可达约8mm2/天的量级。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!