炭疽杆菌双重荧光定量PCR检测试剂盒及检测方法与流程
本发明属于基因检测领域,更具体而言涉及炭疽杆菌的荧光定量pcr检测。
背景技术:
炭疽杆菌(bacillusanthracis)是一种革兰氏阳性芽孢杆菌,可引起人畜共患的炭疽病,是世界动物卫生组织(oie)确立的必须通报的动物疫病。炭疽杆菌抵抗力强,形成芽孢后可在动物皮毛和土壤等环境中长期存在。炭疽杆菌具有高致病性,对人和动物的健康和生命构成极大威胁,常被用作生物恐怖战剂,其快速而精确的诊断一直备受重视。炭疽杆菌诊断的金标准是分离到炭疽杆菌,但传统的检测方法耗时较长,难以适应疫情控制的需要。
炭疽杆菌与蜡样芽孢杆菌(bacilluscereus)、苏云金芽孢杆菌(b.thuringiensis)、蕈状芽孢杆菌(b.mycoides)和魏氏芽孢杆菌(b.pseudomycoides)等具有相同的形态及生化特征,均属于蜡样芽孢杆菌群。细菌的高度相似性导致了在适当的温度、湿度和ph值条件下物种之间基因水平转移的可能性,基因转移导致了诊断困难。大多数诊断方法,包括oie推荐的炭疽杆菌pcr方法,都以毒力因子pxo1和pxo2质粒上的基因片段为检测对象,通过检测毒力因子判断是否检出炭疽杆菌。但是由于基因转移现象的存在,即使pcr方法也很难将炭疽杆菌和其他蜡样芽孢杆菌区分开来,经常出现交叉反应。
近年来本发明人所在的课题组发现,在皮毛炭疽监测中,oie推荐的pcr诊断方法中的引物可与蜡样芽孢杆菌和苏云金芽孢杆菌发生交叉反应,给炭疽诊断带来困扰。因此,仅仅基于炭疽杆菌毒力因子质粒的分子鉴定是不够的,还需要新的检测方法。
由此可见,本领域急需一种新的炭疽杆菌基因检测方法,其可以消除炭疽杆菌与其他蜡样芽孢杆菌的pcr交叉反应,快速、稳定和准确地检测炭疽杆菌,同时可以判定毒力。
技术实现要素:
为了解决现有技术的缺陷及不足,本发明提供了一种炭疽杆菌双重荧光定量pcr特异性引物和探针及检测试剂盒,并建立一种简便、高效、实用的炭疽杆菌基因检测方法。该方法可用于炭疽杆菌的快速检测及强弱毒株的区分,应用前景广阔。
在本发明的一个方面中,本发明提供了一种用于炭疽杆菌双重荧光定量pcr检测的特异性引物和探针,包括炭疽杆菌ba5345基因的正向引物ba5345-f、反向引物ba5345-r和探针ba5345-p;和炭疽杆菌pa基因的正向引物pa-f、反向引物pa-r和探针pa-p,所述的引物和探针的核苷酸序列如下所示:
引物ba5345-f:5'-atggggataccaggatgggt-3';
引物ba5345-r:5'-gcattacataccccaaaggt-3';
探针ba5345-p:
5'-fam-tccaaaccccaatgaccagag-tamra-3';和
引物pa-f:5'-tggtgggagtgtatctgcagga-3';
引物pa-r:5'-gtagattggagccgtcccag-3';
探针pa-p:5'-vic-tcttgaacccgactttgttacc-tamra-3'。
在本发明的第二方面中,本发明提供了一种炭疽杆菌双重荧光定量pcr检测试剂盒,其包括:
荧光定量pcr反应液;
本发明第一方面所述的引物ba5345-f、引物ba5345-r、探针ba5345-p和引物pa-f、引物pa-r、探针pa-p;
阳性对照:所述阳性对照为含有炭疽杆菌ba5345基因或其片段的重组质粒puc57-ba5345和含有炭疽杆菌pa基因或其片段的重组质粒puc57-pa;和阴性对照。
在本发明第二方面的优选实施方案中,荧光定量pcr反应液为2×taqmanuniversalmastermix。
在本发明第二方面的优选实施方案中,所述重组质粒puc57-ba5345含有510bp的ba5345基因片段和所述重组质粒puc57-pa含有1406bp的pa基因片段。
在本发明第二方面的优选实施方案中,所述阴性对照为去离子水。
在本发明的第三方面中,提供了一种炭疽杆菌双重荧光定量pcr检测方法,包括以下步骤:
用本发明第二方面所述的引物和探针对其中所述的阳性对照和阴性对照进行双重荧光定量pcr,并建立所述阳性对照和阴性对照的荧光定量pcr扩增曲线;
测定所述阳性对照的d260nm值和d280nm值,用本发明第二方面所述的引物和探针对d260nm/d280nm值在1.8~2.0之间的所述阳性对照进行双重荧光定量pcr,制作所述阳性对照的双重荧光定量pcr扩增标准曲线;
用本发明第二方面所述的引物和探针对待测样品的dna进行双重荧光定量pcr,并建立所述待测样品的荧光定量pcr扩增曲线;和
通过比较所述pcr扩增曲线,判断所述待测样品中是否存在炭疽杆菌ba5345和pa基因,若存在,则表示所述待测样品中存在炭疽杆菌。
在本发明的炭疽杆菌双重荧光定量pcr检测方法中,双重荧光定量pcr的反应体系为:2×taqmanuniversalmastermix,12.5ml;20pmol/μl的正向引物ba5345-f和pa-f,各0.5μl;20pmol/μl的反向引物ba5345-r和pa-r,各0.5μl;10.0pmol/μl的探针ba5345-p和pa-p,各0.5μl;dna模板2.0μl;ddh2o7.5μl,总体积25μl。
在本发明的炭疽杆菌双重荧光定量pcr检测方法中,所述双重荧光定量pcr的反应条件为:预变性处理为95℃,10mins;然后pcr反应操作40个循环:变性处理95℃,15s,退火/延伸/收集荧光信号处理60℃,60s。
在本发明的炭疽杆菌双重荧光定量pcr检测方法中,所述方法还包括,如果存在炭疽杆菌,则可以根据pa基因的扩增情况,判断炭疽杆菌的毒力。
与现有技术相比,本发明至少具有以下有益技术效果。
本发明与现有技术相比具有明显的有益效果。借由上述技术方案,本发明的检测炭疽杆菌双重荧光定量pcr检测试剂盒及检测方法,以炭疽杆菌染色体基因ba5345和位于毒素质粒pxo1上的保护性抗原pa基因为靶标,建立了炭疽杆菌染色体基因ba5345和毒力因子pa基因特异性的双重荧光定量pcr检测试剂盒和检测方法。本发明的方法能有效区分炭疽芽孢杆菌和蜡样芽胞杆菌群的其他芽孢杆菌,并能通过pa基因判断炭疽杆菌毒力强弱,可以准确、简便、高效、快速地检测炭疽杆菌,应用前景广阔。
附图说明
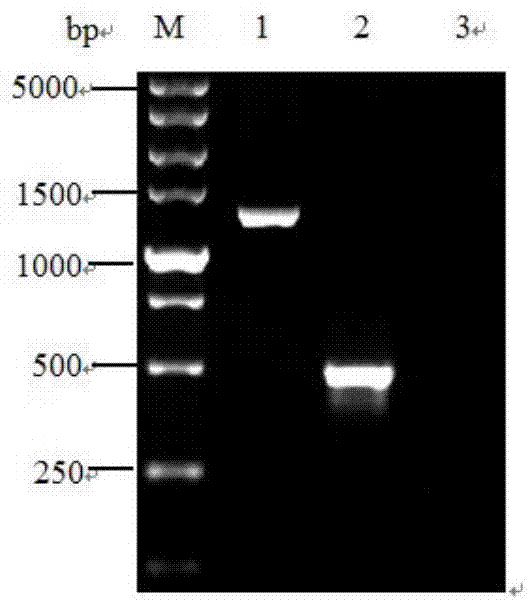
图1显示了炭疽杆菌ba5345基因和pa基因的pcr扩增结果,其中m.dl5000相对分子质量标准;1:pa基因条带;2:ba5345基因条带;3:阴性对照。
图2显示了ba5345基因和pa基因的双重荧光定量pcr扩增标准曲线,图2a:puc57-ba5345,图2b:puc57-pa。
图3显示了双重荧光定量pcr检测的特异性试验结果,其中图3a:ba5345基因,图3b:pa基因,在图3中,1表示puc57-ba5345重组质粒,2表示炭疽杆菌疫苗株(a16r),3表示puc57-pa重组质粒;4-8分别为蜡样芽孢杆菌、苏云金芽孢杆菌、蕈状芽孢杆菌、魏氏芽孢杆菌和阴性对照。
图4显示了双重荧光定量pcr的敏感性试验结果,图4a中,1-6表示8.0×105copies/μl~8.0×100copies/μl的puc57-ba5345重组质粒,7、8表示阴性对照;在图4b中,1-6表示7.8×105copies/μl~7.8×100copies/μl的puc57-pa重组质粒,7、8表示阴性对照。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,进而可依照说明书的内容予以实施,并且为了让本发明的上述目的和其他目的、特征和优点能够更明显易懂,特举以下较佳实施例,并配合附图,详细说明如下。
具体实施方式
在本申请的实施例中,所用到的材料,包括试剂和仪器,如下:
细菌菌株及核酸样品
炭疽杆菌疫苗株(a16r)购自兰州生物制品有限公司;蜡样芽孢杆菌(bncc124613)、苏云金芽孢杆菌(bncc221700)、蕈状芽孢杆菌(bncc184427)和魏氏芽孢杆菌(bncc189983)购自国家兽医微生物菌种保藏中心。按照quick-dnatm提取和纯化试剂盒说明书提取细菌菌株基因组dna。
主要试剂和仪器
quick-dnatm提取和纯化试剂盒购自美国zymoresearch公司;质粒提取试剂盒、puc57vector、大肠杆菌dh5α和amp购自上海生工生物工程有限公司;
实施例1.引物和探针的设计
炭疽杆菌染色体基因ba5345是炭疽杆菌特异性鉴定基因,能有效区分蜡样芽孢杆菌群中的近缘种;pa基因是炭疽杆菌毒力因子pxo1质粒上较为保守的基因。本实施例以ba5345基因和pa基因为靶标,进行引物和探针的设计。
为了对炭疽杆菌染色体基因组进行检测,根据genbank中登录的炭疽杆菌ba5345基因(fj694154.1),应用primerexpress3.0.1软件设计了ba5345基因的引物和探针,并使用fam荧光素标记ba5345基因的探针。ba5345基因的正向引物、反向引物和探针分别如下:
ba5345-f:5'-atggggataccaggatgggt-3',
ba5345-r:5'-gcattacataccccaaaggt-3',
ba5345-p:5'-fam-tccaaaccccaatgaccagag-tamra-3'。
为了对炭疽杆菌毒力因子进行检测,根据genbank中登录的炭疽杆菌pa基因(ay921578.1),应用primerexpress3.0.1软件设计了pa基因的引物和探针,并使用vic荧光素标记pa探针。pa基因的正向引物、反向引物以及探针分别如下:
pa-f:5'-tggtgggagtgtatctgcagga-3',
pa-r:5'-gtagattggagccgtcccag-3',
pa-p:5'-vic-tcttgaacccgactttgttacc-tamra-3'。
要求两靶基因的引物和探针之间无非特异性反应,使用primer5.0进行多重比对和引物、探针设计,由上海华大基因科技有限公司合成。
实施例2.炭疽杆菌常规pcr方法的建立
设计并合成了炭疽杆菌ba5345基因和pa基因的常规pcr特异性引物。具体序列为:
ba5345-f:5'-tggattgcgtatgcagttctac-3',
ba5345-r:5'-ttgtaattcaccattgaagcaa-3'和
pa-f:5'-gatgttgcacaatggttgatgaa-3',
pa-r:5'-gatcccgttggtactatcc-3'。
以提取的炭疽杆菌疫苗株dna为模版,分别扩增ba5345基因和pa基因。在50μl反应体系中依次加入:10×pcr缓冲液5.0μl、dntps(10.0mmol/l)1.0μl、mgcl2(25mmol/l)2.0μl,正向、反向引物(25pmol/μl)各1.0μl、taqdna聚合酶(5u/μl)0.4μl、模板dna4.0μl,最后加灭菌去离子水补至50.0μl。按如下程序进行扩增:94℃、3min;94℃、30s,55.0℃、30s,72℃、45s,35个循环;72℃、10min;4℃结束反应。
用常规pcr方法对提取的炭疽杆菌基因组dna进行特异性扩增,扩增产物长度分别为510bp(ba5345)和1406bp(pa)。将ba5345基因片段和pa基因片段分别克隆至puc57载体后,经pcr和序列测定分析,与genbank中相应序列完全一致。重组质粒经nanodrop2000测定,ba5345质粒浓度为45μg/ml,通过公式换算得到重组质粒的拷贝数为8.0x1010拷贝/μl,pa质粒浓度为120μg/ml,通过公式换算得到重组质粒的拷贝数为7.8x1010拷贝/μl。图1为重组质粒pcr鉴定图。
实施例3阳性对照即质粒标准品的制备
将“1.2”部分扩增的ba5345基因和pa基因片段按照凝胶回收试剂盒说明书回收,将目的片段分别与puc57载体连接,转化大肠杆菌dh5α-感受态细胞,挑取阳性菌落经pcr和测序鉴定无误后,通过nanodrop2000测定质粒的od值,用公式转换成拷贝数,作为puc57-ba5345和puc57-pa的质粒标准品即阳性对照备用。
实施例4双重荧光定量pcr反应体系及反应条件优化
试验使用abi7500荧光定量pcr仪进行扩增和分析,以
经反应体系与反应条件优化,最终确定了炭疽杆菌荧光定量pcr反应体系为
实施例5.puc57-ba5345和puc57-pa重组质粒荧光定量pcr扩增标准曲线制作
测定阳性对照即puc57-ba5345和puc57-pa重组质粒的d260nm值和d280nm值,由于d260nm/d280nm值在1.8-2.0之间时质粒纯度比较高,因此选择d260nm/d280nm值在1.8-2.0之间的质粒用于制作双重荧光定量pcr扩增标准曲线。根据d260nm值计算质粒浓度,并换算成拷贝数,以去离子水10倍系列分别稀释成7个浓度梯度(puc57-ba5345:8.0×108-8.0×102copies/μl;puc57-pa:7.8×108copies/μl~7.8×102copies/μl),以此为模板,根据实施例4建立的25μl双重荧光定量pcr反应体系和反应条件,在荧光pcr仪上扩增。反应结束后,计算机利用分析软件得到所述重组质粒的荧光定量pcr扩增标准曲线。本发明中,荧光pcr仪自带软件分析显示,在102~108copies/μl的范围内,构建的2个标准品的荧光定量pcr扩增标准曲线均呈现良好的线性关系,线性关系表达式分别为:y=-3.812x+46.603和y=-3.951x+47.302,相关系数r2均在0.99以上,扩增效率均高于90%。荧光定量pcr扩增标准曲线比较理想。
图2a和图2b分别显示了puc57-ba5345和puc57-pa的双重荧光定量pcr扩增标准曲线。
实施例6.双重荧光定量pcr检测炭疽杆菌的特异性测试
本实施例探讨实施例1所述引物和探针的特异性。使用实施例1所述的引物和探针利用双重荧光定量pcr方法,对炭疽杆菌疫苗株(a16r)、蜡样芽孢杆菌、苏云金芽孢杆菌、蕈状芽孢杆菌、魏氏芽孢杆菌的基因组dna进行特异性检测。具体而言,以puc57-ba5345和puc57-pa的质粒标准品作为阳性对照,以去离子水作阴性对照,使用实施例1所述的引物和探针,根据实施例4最终确定的炭疽杆菌荧光定量pcr反应体系和反应条件,对上述菌株的dna和阳性对照、阴性对照进行荧光定量pcr,并通过计算机分析软件得到上述菌株及阳性对照和阴性对照的荧光定量pcr扩增曲线。将上述菌株的荧光定量pcr扩增曲线与阳性对照的荧光定量pcr扩增曲线进行比较,来判断是否有效检测出炭疽杆菌。
如图3所示,使用实施例1所述的引物和探针通过荧光定量pcr能够明显区分炭疽杆菌疫苗株(a16r)、蜡样芽孢杆菌、苏云金芽孢杆菌、蕈状芽孢杆菌、魏氏芽孢杆菌。
实施例7.puc57-ba5345和puc57-pa质粒双重荧光定量pcr检测的敏感性测试
将浓度分别为8.0×105、8.0×104、8.0×103、8.0×102、8.0×101、8.0×100copies/μl的puc57-ba5345质粒标准品和浓度分别为7.8×105、7.8×104、7.8×103、7.8×102、7.8×101、7.8×100copies/μl的puc57-pa质粒标准品作为模板,进行双重荧光定量pcr,评价该检测方法的敏感性。结果显示,双重荧光定量pcr对puc57-ba5345质粒的最低检测浓度为8.0copies/μl;对puc57-pa质粒的最低检测浓度为7.8copies/μl。
图4显示了双重荧光定量pcr的敏感性试验结果。从图4可以看出,本发明所建立的炭疽杆菌双重荧光定量pcr检测方法对puc57-ba5345质粒的最低检测限是8.0copies/μl;对puc57-pa质粒的最低检测限是7.8copies/μl。
实施例8.双重荧光定量pcr检测的重复性试验
将1.5制备的质粒标准品10倍倍比稀释,使用4个浓度梯度进行重复试验,将同一批不同稀释度的标准品按建立的方法重复3次进行组内重复试验,对3次不同时间段稀释的同一浓度的标准品进行组间重复试验,对试验结果进行统计,分析此方法的重复性。同时设置去离子水为阴性对照。
为验证所建立的检测方法的重复性,对同一批稀释的标准品按建立的方法重复3次进行组内重复试验,并对3次不同时间稀释的同一浓度的标准品进行组间重复试验,结果显示,ba5345和pa基因组内检测的变异系数为0.18~1.49,组间检测的变异系数为0.16~1.31,表明该方法具有较高的可重复性。
表1ba5345基因荧光定量pcr的组内、组间重复性实验结果
表2pa基因荧光定量pcr的组内、组间重复性实验结果
实施例9模拟皮毛样品检测
本实施例的目的,是用本发明的引物和探针来检测皮毛样品中是否存在炭疽杆菌。
将3x106cfu/ml炭疽杆菌疫苗株芽孢悬液,10倍倍比稀释后各取200μl随机加入到1g生牛皮(毛)样品中,振荡混匀1min,4℃放置过夜,使芽孢与皮毛充分吸附,即为污染皮毛,共制备25份样品,其中21份添加炭疽杆菌,炭疽杆菌的添加浓度为3x106cfu/ml~3x100cfu/ml,共3组,每组7份样品,另外设置4份不添加细菌的皮毛为阴性对照。
根据实施例6所建立的方法,用puc57-ba5345和puc57-pa质粒标准品作阳性对照,用去离子水作阴性对照,使用实施例1所述的引物和探针,根据所述4所最终确定的炭疽杆菌荧光定量pcr反应体系和反应条件,分别对25份样品和阳性对照、阴性对照进行双重实时荧光定量pcr,制作样品、阳性对照、阴性对照的荧光定量pcr扩增曲线,根据荧光定量pcr扩增曲线判断样品中是否存在炭疽杆菌ba5345基因和pa基因,若存在则表示样品中存在炭疽杆菌。
同时使用oie推荐的常规pcr方法进行平行检测,来评价实时荧光定量pcr方法的临床效果。
结果显示,常规pcr方法的检出率较双重荧光定量pcr检测方法检出率低。在对25份污染样品进行检测时,双重荧光定量pcr检测方法ba5345基因的检出率为64.0%(16/25),pa基因的检出率为72.0%(18/25),并且ba5345基因阳性样品的pa基因检测也都为阳性。常规pcr检测方法的ba5345基因的检出率为36.0%(9/25),pa的检出率为40.0%(10/25),常规pcr检测的阳性样品,双重荧光定量pcr检测也都为阳性。对两种pcr方法结果进行对比,显示定量结果中模板量大于等于100拷贝数的样品,双重荧光定量pcr和常规pcr结果都为阳性;定量结果为1~100拷贝数的样品中,双重荧光定量pcr方法pa基因比ba5345基因检出率高,常规pcr检出率为0.00%。在对40份送检皮毛样品进行检测时,双重荧光定量pcr和常规pcr方法都没有检出炭疽杆菌阳性样品。
当需要对上述样品中检测到的炭疽杆菌ba5345基因和pa基因进行定量时,还可以将样品的荧光定量pcr扩增曲线与实施例5所建立的荧光定量pcr扩增标准曲线进行比较,从而判断定量样品中存在的炭疽杆菌。炭疽杆菌的主要致病基因位于质粒pxo1上,质粒丢失则失去合成毒素的能力,使炭疽杆菌成为弱毒株或无毒株。因此,本发明还可以根据检测到的炭疽杆菌pa基因,判断炭疽杆菌的毒力,确定所检测样品中检测到的炭疽杆菌是否具有毒力。
因此,本发明选择炭疽杆菌染色体ba5345基因和pxo1质粒保护性抗原pa基因作为检测靶基因,建立了一种双重实时荧光定量pcr方法,提高了检测方法的特异性,检测2个不同靶基因的pcr方法不但可以有效保证检测结果的准确性,也能区分炭疽杆菌的强弱毒株。对临床样品的检测发现双重荧光定量pcr和常规pcr的符合率为100%,双重荧光定量pcr检出率更高。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!