吡咯-咪唑类杂环多肽、包含吡咯-咪唑类杂环多肽的药物及应用的制作方法
本发明涉及医药技术领域,尤其是涉及一种吡咯-咪唑类杂环多肽、包含吡咯-咪唑类杂环多肽的药物及应用。
背景技术:
自身免疫性疾病(autoimmunediseases)是指机体对自身抗原发生免疫反应而导致自身组织损害所引起的疾病,可造成较高的发病率和死亡率。其中,较为常见的疾病包括类风湿关节炎、系统性红斑狼疮、强直性脊柱炎等。实验性自身免疫性脑脊髓炎(experimentalautoimmuneencephalomyelitis,eae)和人类炎症性脱髓鞘疾病多发性硬化症(multiplesclerosis,ms)是由il-23刺激th17细胞分泌il-17等细胞因子介导发生的,针对il-12/23p40从而下调th1和th17应答是治疗eae和ms的一条潜在途径。银屑病是一种由免疫异常导致的慢性炎症性增生性皮肤病,由多基因因素和环境因素共同影响。研究认为il-23/il-17轴是发病的关键,由抗原呈递细胞产生的il-23诱导维持th17细胞分化,而th17细胞产生的促炎性细胞因子如il-17,介导表皮增生、角质细胞免疫活化和银屑病固有的组织炎症。
然而,目前在对eae或银屑病等自身免疫性疾病的预防治疗研究中,大多数是基于免疫学或神经生物学干预治疗自身免疫性疾病的途径,并且,大量的研究都证实利用免疫调节途径可以治疗和改善自身免疫性疾病,但由于在自身免疫性疾病中免疫系统和免疫机制极其复杂,由于相关动物模型与人类相关疾病的复杂性和差别仍然难以明确,一些药物难以做到完全适用于治疗,某些试验成功的治疗方法仍需重新评估。例如,目前已经被批准并广泛应用的人类炎症性脱髓鞘疾病多发性硬化症(multiplesclerosis,ms)治疗策略ifn-beta(干扰素β)、ga(醋酸格拉替雷)和抗vla-4(迟现抗原4)抗体等,均已在所有eae模型中经过研究验证,但同时也有许多eae治疗成功的案例并没有转化为类似的ms治疗成功。又如通过免疫抑制的系统性治疗途径(如糖皮质激素等),由于非特异性的免疫抑制,长期使用会出现严重的副作用。
此外,多肽类药物的研究是新药研发的重要方向,然而许多天然大分子多肽,由于其分子量大、结构复杂等特点,代谢不稳定且生物利用度低,在临床用药方面受到限制。近年来,小分子多肽类药物因其具有分子量小、生物活性高以及结构易修饰等特点,开启了多肽类药物研发的新热点,并有多个此类药物已上市或已进入临床研究阶段。但是,在基因靶向疗法中,很多小分子药物往往会干扰正常基因的转录与翻译,具有广泛的细胞毒性,这也是研发基因靶向药物中的难题。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一个目的在于提供一种吡咯-咪唑类杂环多肽,以至少缓解现有技术中存在的技术问题之一。
本发明的第二个目的在于提供包含上述吡咯-咪唑类杂环多肽的药物,该药物与吡咯-咪唑类杂环多肽具有相同的有益效果,且疗效显著、代谢稳定、生物利用度高且无毒副作用。
本发明的第三个目的在于提供上述吡咯-咪唑类杂环多肽或药物的应用。
本发明提供了一种吡咯-咪唑类杂环多肽,所述吡咯-咪唑类杂环多肽能够特异性结合il-23p19启动子中c-rel结合位点。
进一步地,所述吡咯-咪唑类杂环多肽选自具有n-甲基吡咯、n-甲基咪唑、n-甲基-3-羟基吡咯芳香氨基酸中的两种或三种的偶联物。
进一步地,所述吡咯-咪唑类杂环多肽选自具有n-甲基吡咯和n-甲基咪唑的偶联物。
进一步地,所述吡咯-咪唑类杂环多肽具有如式i所示的结构:
本发明还提供了包含上述的吡咯-咪唑类杂环多肽的药物。
进一步地,所述药物还包括药学上可接受的辅料;
优选地,所述药物的剂型为注射制剂;
优选地,所述注射制剂包括注射液或粉针剂。
进一步地,所述药物的有效给药剂量为每千克体重给予10-30nmol。
本发明还提供了上述的吡咯-咪唑类杂环多肽或药物在制备il23-p19的抑制剂中的应用。
另外,本发明还提供了上述的吡咯-咪唑类杂环多肽或药物在制备预防和/或治疗与il23-p19相关的疾病的药物中的应用。
进一步地,所述与il23-p19相关的疾病包括自身免疫性疾病;
优选地,所述自身免疫性疾病包括实验性自身免疫性脑脊髓炎、银屑病、类风湿性关节炎、系统性红斑狼疮、系统性血管炎、甲状腺自身免疫病、硬皮病或混合性结缔组织病中的一种或至少两种。
本发明提供的吡咯-咪唑类杂环多肽,能够特异性结合il-23p19启动子中c-rel结合位点。该吡咯-咪唑类杂环多肽是针对c-rel结合位点的特定dna序列设计得到的,是il-23p19的特异性靶向药物,特异型强、性质稳定。由于其能够提高对特定致病基因的选择性,降低对正常基因的毒性,因此能够避免系统性免疫抑制带来的副作用,并且具有分子量小、生物活性高、结构易修饰等优点,给药方式较大分子单抗类药物方便,可以在体内稳定发挥治疗作用。同时,与反义寡核苷酸相比,吡咯-咪唑类杂环多肽不易被酶降解、细胞通透性较好,而且对dna序列具有高度的选择性与亲和性,能有效地抑制或激活相关基因的表达。
本发明提供的包含上述吡咯-咪唑类杂环多肽的药物,与吡咯-咪唑类杂环多肽具有相同的有益效果,在此不再赘述。同时还具有疗效显著、代谢稳定、生物利用度高且无毒副作用的优点。
本发明还提供了上述的吡咯-咪唑类杂环多肽或药物在制备il23-p19的抑制剂中的应用。通过特异性地结合目标基因序列来抑制转录因子与dna的相互作用,特异性强,能够有效调控相关基因的表达水平。通过利用与il-23p19基因启动子上的c-rel结合位点特异性结合的小分子多肽来阻断c-rel与il-23p19基因启动子的结合,从而阻断il23-p19的表达,降低致病th17细胞的数量,最终达到治疗与th17相关的自身免疫性疾病的目的。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例1提供的吡咯-咪唑类杂环多肽抑制il-23p19表达的示意图;
图2为本发明实施例2提供的吡咯-咪唑类杂环多肽处理降低树突状细胞中il-23p19mrna的表达水平的结果图(**p<0.01,***p<0.001);
图3为本发明实施例2提供的吡咯-咪唑类杂环多肽处理降低树突状细胞中il-23p1蛋白的表达水平的结果图(**p<0.01);
图4为本发明实施例3提供的吡咯-咪唑类杂环多肽处理不影响bmdc细胞il-12的表达的结果图;
图5a为发明实施例3提供的吡咯-咪唑类杂环多肽处理不影响bmdm细胞tnf-α的表达的结果图;
图5b为发明实施例3提供的吡咯-咪唑类杂环多肽处理不影响bmdm细胞il-1β的表达的结果图;
图5c为发明实施例3提供的吡咯-咪唑类杂环多肽处理不影响bmdm细胞il-6的表达的结果图;
图6a为发明实施例3提供的吡咯-咪唑类杂环多肽处理不影响bmdm细胞il-17a的表达的结果图;
图6b为发明实施例3提供的吡咯-咪唑类杂环多肽处理不影响bmdm细胞ifn-γ的表达的结果图;
图6c为发明实施例3提供的吡咯-咪唑类杂环多肽处理不影响bmdm细胞il-2的表达的结果图;
图7a为发明实施例4提供的吡咯-咪唑类杂环多肽处理对bmdm细胞生长没有明显毒性作用的结果图;
图7b为发明实施例4提供的吡咯-咪唑类杂环多肽处理对bmdc细胞生长没有明显毒性作用的结果图;
图7c为发明实施例4提供的吡咯-咪唑类杂环多肽处理对293t细胞生长没有明显毒性作用的结果图;
图7d为发明实施例4提供的吡咯-咪唑类杂环多肽处理对raw264.7细胞生长没有明显毒性作用的结果图;
图7e为发明实施例4提供的吡咯-咪唑类杂环多肽处理对b16细胞生长没有明显毒性作用的结果图;
图7f为发明实施例4提供的吡咯-咪唑类杂环多肽处理对β-tc-6细胞生长没有明显毒性作用的结果图;
图8a为发明实施例5提供的吡咯-咪唑类杂环多肽处理能有效下调eae小鼠体内il-17a的表达的结果图(*p<0.05,**p<0.01);
图8b为发明实施例5提供的吡咯-咪唑类杂环多肽处理能有效下调eae小鼠体内il-23的表达的结果图(*p<0.05,**p<0.01);
图9为发明实施例5提供的吡咯-咪唑类杂环多肽处理能有效降低eae小鼠血清中炎症因子表达的结果图(*p<0.05);
图10为发明实施例5提供的吡咯-咪唑类杂环多肽处理能有效降低eae小鼠脊髓中炎症因子表达的结果图(*p<0.05);
图11为发明实施例5提供的吡咯-咪唑类杂环多肽处理能有效预防和改善eae症状的结果图(*p<0.05);
图12a为发明实施例6提供的吡咯-咪唑类杂环多肽处理能有效下调银屑病小鼠体内il-17a的表达的结果图(*p<0.05,**p<0.01);
图12b为发明实施例6提供的吡咯-咪唑类杂环多肽处理能有效下调银屑病小鼠体内il-23的表达的结果图(*p<0.05,**p<0.01);
图13为发明实施例6提供的吡咯-咪唑类杂环多肽处理能显著降低小鼠皮肤中炎症因子的表达的结果图(*p<0.05,**p<0.01);
图14为发明实施例6提供的吡咯-咪唑类杂环多肽处理能有效预防和改善银屑病症状的结果图(*p<0.05,**p<0.01)。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种吡咯-咪唑类杂环多肽,所述吡咯-咪唑类杂环多肽能够特异性结合il-23p19启动子中c-rel结合位点。
吡咯-咪唑类杂环多肽(pyrrole-imidazolepolyamide)是一类从天然抗生素纺锤菌素(netropsin)和偏端霉素(distamycin)结构衍生而来的dna小沟结合分子。与反义寡核苷酸相比,吡咯-咪唑类杂环多肽不易被酶降解、细胞通透性较好,而且对dna序列具有高度的选择性与亲和性,能有效地抑制或激活相关基因的表达。
吡咯-咪唑类杂环多肽调控基因表达的机制是通过竞争性地结合到转录因子的dna结合位点,从而抑制转录因子-dna复合物的形成,干扰rna聚合酶以dna为模板转录rna,调控相关基因的表达水平。针对某一转录因子结合位点的特定dna序列设计相应的吡咯-咪唑类杂环多肽分子,通过特异性地结合目标基因序列来抑制转录因子与dna的相互作用,能够调控疾病相关基因的表达水平。
本发明提供的吡咯-咪唑类杂环多肽,是针对c-rel结合位点的特定dna序列设计得到的,是il-23p19的特异性靶向药物,特异型强、性质稳定。由于其能够提高对特定致病基因的选择性,降低对正常基因的毒性,因此能够避免系统性免疫抑制带来的副作用,并且具有分子量小、生物活性高、结构易修饰等优点,给药方式较大分子单抗类药物方便,可以在体内稳定发挥治疗作用。
在一些优选的实施方式中,所述吡咯-咪唑类杂环多肽选自具有n-甲基吡咯(py)、n-甲基咪唑(im)或n-甲基-3-羟基吡咯(hp)的两种或三种的偶联物。例如可以为n-甲基吡咯(py)与n-甲基咪唑(im)二者的偶联物、n-甲基咪唑(im)与n-甲基-3-羟基吡咯(hp)二者的偶联物、n-甲基吡咯(py)与n-甲基-3-羟基吡咯(hp)二者的偶联物或n-甲基吡咯(py)、n-甲基咪唑(im)与n-甲基-3-羟基吡咯(hp)。
在一些优选的实施方式中,所述吡咯-咪唑类杂环多肽选自具有n-甲基吡咯(py)和n-甲基咪唑(im)的偶联物。
其中,n-甲基吡咯(py)和n-甲基咪唑(im),分别类似于天然抗生素netropsin和distamycin。
在一些优选的实施方式中,所述吡咯-咪唑类杂环多肽具有如式i所示的结构:
该吡咯-咪唑类杂环多肽的化学式为c79h92n28o11,精确质量为1608.7500,分子量为1609.7568。
在一个具体的实施方式中,本发明提供的吡咯-咪唑类杂环多肽的制备方法包括:
首先用树脂和4-叔丁氧羰基氨基-1-甲基-1h-吡咯-2-羧酸、4-叔丁氧羰基氨基-1-甲基-1h-咪唑-2-羧酸进行缩合反应;然后与r-2-(9-芴甲氧羰基氨基)-4-叔丁氧羰基氨基丁酸进行缩合反应;之后再与4-叔丁氧羰基氨基-1-甲基-1h-吡咯-2-羧酸、4-叔丁氧羰基氨基-1-甲基-1h-咪唑-2-羧酸进行缩合反应。随后脱去芴甲氧羰基保护基,以醋酸铜、n-溴代丁二酰亚胺和氧气中的一种或多种的组合为氧化剂,以nh2-(ch2)n-ch3或其衍生物为切割剂,氧化和切割树脂基团,得到抑制剂。
本发明还提供了包含上述的吡咯-咪唑类杂环多肽的药物。
本发明提供的包含上述的吡咯-咪唑类杂环多肽的药物,与吡咯-咪唑类杂环多肽具有相同的有益效果,在此不再赘述。同时还具有疗效显著、代谢稳定、生物利用度高且无毒副作用的优点。
在一些优选的实施方式中,所述药物还包括药学上可接受的辅料。
药学上可接受的辅料是指生产药品和调配处方时,使用的的赋形剂和附加剂,是指除活性成分外,在安全性方面已进行了合理的评估,并且包含在药物制剂中的物质。同一药用辅料可用于不同给药途径的药物制剂,且有不同的作用和用途。在本发明提供的药物中添加的药学上可接受的辅料,能够起到赋型、充当载体或提高稳定性的作用,此外,还具有增溶、助溶或缓控释等重要功能。
典型但非限制性的药学上可接受的辅料包括:溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、湿润剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏着剂、抗氧剂、螯合剂、渗透促进剂、ph调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂或释放阻滞剂中的一种或多种。
优选地,所述药物的剂型为注射制剂。
当以注射的形式给药时,上述药物可制成任意注射可接受的制剂形式,例如可以为,但不限于注射液或粉针剂。
其中,可使用的载体和溶剂包括水、林格氏溶液和等渗氯化钠溶液。另外,灭菌的非挥发油也可用作溶剂或悬浮介质,如单甘油酯或二甘油酯。
在一些优选的实施方式中,所述药物的有效给药剂量为每千克提供给予10-30nmol,例如可以为,但不限于10nmol、15nmol、20nmol、25nmol或30nmol。
在些个优选的实施方式中,给药频率例如可以为每天一次,但不限于每天一次。或者,可以以缓释制剂的形式给予本发明提供的药物,在这种情况下,需要较少的给药频率,例如每两天一次。
给药剂量和频率根据制剂在用药者体内的半衰期而不同,此外,也可以根据是预防性处理还是治疗性处理而不同。在预防性应用中,以相对低频率的间隔长期给予相对低的剂量。在治疗性应用中,有时需要以相对短的间隔给予相对高的剂量,直至疾病的进展被延缓或停止,并优选地直至个体表现出疾病症状的部分或完全改善,在此之后,可以给予患者预防方案。
优选给药剂量为每千克体重给予20nmol。
当给药的有效剂量在优选范围内时,吡咯-咪唑类杂环多肽的治疗作用更明显,见效更快。
本发明还提供了上述的吡咯-咪唑类杂环多肽或药物在制备il23-p19的抑制剂中的应用。
吡咯-咪唑类杂环多肽调控基因表达的机制是通过竞争性地结合到转录因子的dna结合位点,即c-rel结合位点,从而抑制转录因子-dna复合物的形成,干扰rna聚合酶以dna为模板转录rna,调控il-23p19基因的表达水平。通过特异性地结合目标基因序列来抑制转录因子与dna的相互作用,特异性强,能够有效调控相关基因的表达水平。
另外,本发明还提供了上述的吡咯-咪唑类杂环多肽或药物在制备预防和/或治疗与il23-p19相关的疾病的药物中的应用。
通过利用与il-23p19基因启动子上的c-rel结合位点特异性结合的小分子多肽来阻断c-rel与il-23p19基因启动子的结合,从而阻断il23-p19的表达,降低致病th17细胞的数量,最终达到治疗与th17相关的自身免疫性疾病的目的。
进一步地,所述与il23-p19相关的疾病包括自身免疫性疾病;
优选地,所述自身免疫性疾病包括实验性自身免疫性脑脊髓炎、银屑病、类风湿性关节炎、系统性红斑狼疮、系统性血管炎、甲状腺自身免疫病、硬皮病或混合性结缔组织病中的一种或至少两种。
为了有助于更清楚的理解本发明的内容,现结合具体的实施例详细介绍如下。
如无特别说明,本发明实施例中使用的细胞、药品及试剂均来源为正规而易购渠道:
酶联免疫检测仪器:ultiskanm3,美国thermo公司;
37℃5%二氧化碳细胞培养温箱:thermo371,美国thermo公司;
轮转式石蜡切片机:rm2235,德国leica公司;
烤片机:hi1220,德国leica公司;
包埋机:eg1150,德国leica公司;
台式高速离心机:5810-r,德国eppendorf公司;
正置显微镜:bx53,日本olympus公司;
微量移液器:德国eppendorf公司;
pcr仪:mastercyclernexusgradient,美国bio-rad公司;
电泳槽:s-1000,美国bio-rad公司;
紫外凝胶成像仪:wealtecdolphinplus,美国威泰克生物公司;
小鼠il-17aeliasa试剂盒:ebioscience,美国;
小鼠il-23eliasa试剂盒:ebioscience,美国;
胎牛血清:gibco,美国;
rpmi1640培养基:corning,美国;
cd3抗体:biolegend,美国;
cd28抗体:biolegend,美国;
murineil-4:peprotech,美国;
murinegm-csf:peprotech,美国。
实施例1设计并优化能有效并特异性减低il-23p19的吡咯-咪唑类杂环多肽
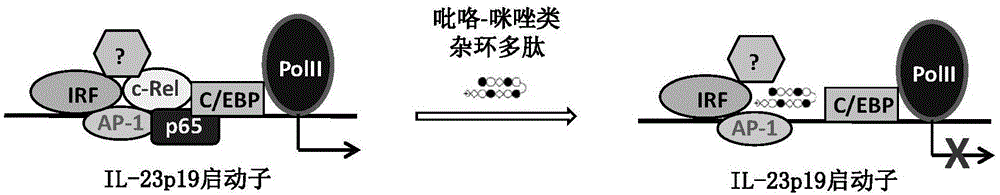
转录因子c-rel可与il-23p19基因启动子上的结合位点特异性结合从而激活il-23p19的表达,并且c-rel在调控il-23p19表达过程中起着决定性的作用。本实施例通过利用与il-23p19基因启动子上的c-rel结合位点特异性结合的小分子多肽来阻断c-rel与il-23p19基因启动子的结合,从而阻断il23-p19的表达(如图1所示)。
具体地,首先用树脂和4-叔丁氧羰基氨基-1-甲基-1h-吡咯-2-羧酸、4-叔丁氧羰基氨基-1-甲基-1h-咪唑-2-羧酸进行缩合反应;然后与r-2-(9-芴甲氧羰基氨基)-4-叔丁氧羰基氨基丁酸进行缩合反应;之后再与4-叔丁氧羰基氨基-1-甲基-1h-吡咯-2-羧酸、4-叔丁氧羰基氨基-1-甲基-1h-咪唑-2-羧酸进行缩合反应。随后脱去芴甲氧羰基保护基,以醋酸铜、n-溴代丁二酰亚胺和氧气中的一种或多种的组合为氧化剂,以nh2-(ch2)n-ch3或其衍生物为切割剂,氧化和切割树脂基团,得到抑制剂。
实施例2体外确定靶向il-23p19的吡咯-咪唑类杂环多肽对il-23p19的抑制效果
从正常小鼠的股骨分离骨髓并在体外用gmcsf和il-4处理来诱导树突状细胞,然后随机分为6组,实验组使用本发明实施例1提供的吡咯-咪唑类杂环多肽处理,空白对照组不作处理,其中实验组中吡咯-咪唑类杂环多肽的浓度分别为0nm、1nm、10nm、100nm和1000nm。24小时后实验组用lps刺激4小时,然后利用逆转录pcr检测il-23p19mrna的表达水平。结果如图2所示,从图中可以看出lps能够使细胞中il-23p19基因表达量增多,随着吡咯-咪唑类杂环多肽的使用浓度增加,il-23p19基因的表达量减少。说明吡咯-咪唑类杂环多肽能够有效抑制il-23p19基因的表达量。
为了检测il-23p19的蛋白表达水平,经过吡咯-咪唑类杂环多肽处理的树突状细胞将用lps刺激12小时,然后收集细胞培养上清液并利用酶联免疫吸附实验(elisa)检测其中il-23蛋白的浓度。结果如图3所示,从图中可以看出lps能够使细胞中il-23p19蛋白表达量增多,随着吡咯-咪唑类杂环多肽的使用浓度增加,il-23p19蛋白的表达量减少。说明吡咯-咪唑类杂环多肽能够有效抑制il-23p19蛋白的表达量。
实施例3体外确定靶向il-23p19的小分子多肽特异性抑制il-23表达
从正常小鼠的股骨分离骨髓并在体外用gmcsf和il-4处理来诱导树突状细胞(bmdc),然后随机分为6组,实验组使用本发明实施例1提供的吡咯-咪唑类杂环多肽处理,空白对照组不作处理,其中实验组中吡咯-咪唑类杂环多肽的浓度分别为0nm、1nm、10nm、100nm和1000nm。24小时后实验组用lps刺激12小时,然后收集细胞培养上清液并利用酶联免疫吸附实验(elisa)检测bmdc上清中il-12蛋白的浓度。结果如图4所示,从图中可以看出lps能够使细胞中il-12表达量增多,随着吡咯-咪唑类杂环多肽的使用浓度增加,il-12的表达量无明显变化。说明吡咯-咪唑类杂环多肽处理不影响bmdc细胞il-12的表达。
用含有l929细胞上清液的培养基诱导巨噬细胞(bmdm),然后随机分为6组,实验组使用本发明实施例1提供的吡咯-咪唑类杂环多肽处理,空白对照组不作处理,其中实验组中吡咯-咪唑类杂环多肽的浓度分别为0nm、1nm、10nm、100nm和1000nm。24小时后实验组用lps刺激12小时,然后收集细胞培养上清液并利用酶联免疫吸附实验(elisa)检测bmdm上清中tnf-α、il-1β、il-6蛋白浓度。结果如图5a、5b和5c所示,从图中可以看出,lps能够使细胞中tnf-α、il-1β和il-6表达量增多,随着吡咯-咪唑类杂环多肽的使用浓度增加,tnf-α、il-1β和il-6的表达量无明显变化。说明吡咯-咪唑类杂环多肽处理不影响bmdm细胞tnf-α、il-1β和il-6的表达。
同时,从取正常小鼠脾脏制备细胞悬液,然后随机分为6组,其中5组为实验组用含有anti-cd3及anti-cd28的培养基培养,实验组使用本发明实施例1提供的吡咯-咪唑类杂环多肽处理,空白对照组不作处理,其中实验组中吡咯-咪唑类杂环多肽的浓度分别为0nm、1nm、10nm、100nm和1000nm。然后获取细胞上清液,elisa检测il-17a、ifn-γ、il-2蛋白浓度。结果如图6a、6b和6c所示,从图中可以看出,anti-cd-(3+28)能够使细胞中il-17a、ifn-γ和il-2表达量增多,随着吡咯-咪唑类杂环多肽的使用浓度增加,il-17a、ifn-γ和il-2的表达量无明显变化。说明吡咯-咪唑类杂环多肽处理不影响bmdm细胞il-17a、ifn-γ和il-2的表达。
实施例4体外确定靶向il-23p19的小分子多肽对细胞生长没有明显毒性作用
本实施例取细胞株(293t、raw264.7、b16和β-tc-6)和原代细胞(bmdc和bmdm),分别随机分为6组,实验组使用本发明实施例1提供的吡咯-咪唑类杂环多肽处理,空白对照组不作处理,其中实验组中吡咯-咪唑类杂环多肽的浓度分别为0nm、1nm、10nm、100nm和1000nm。然后进行实验细胞的活力测定(mts法),结果显示吡咯-咪唑类杂环多肽对于细胞没有毒性,如图7a、7b、7c、7d、7e和7f所示。
实施例5体内检测靶向il-23p19的小分子多肽在实验性自身免疫性脑脊髓炎小鼠模型中的作用效果
本实施例采用mog(髓鞘少突胶质细胞糖蛋白)多肽片段在c57bl/6小鼠中诱导eae,目前国际上认为该方法诱导的eae模型更能从发病机制上模拟ms。mog是一种表达在中枢神经系统少突胶质细胞表面的跨膜糖蛋白,它仅占总髓鞘蛋白的0.01%-0.05%,但它具有高度免疫原性。mog亦存在于少突胶质细胞前体细胞的细胞膜上,有研究表明少突胶质细胞前体细胞的破坏是eae模型引起脱髓鞘的主要始动因素,说明mog相关抗体在引起eae病理方面具有重要作用。
在本实验中,我们首先在c57bl/6小鼠中建立eae模型,然后隔天对治疗组小鼠腹腔注射20nmol的靶向il-23p19的吡咯-咪唑类杂环多肽进行治疗,并通过对表型评分评估eae的严重程度。结果发现,针对il-23p19的吡咯-咪唑类杂环多肽处理能有效下调eae小鼠体内il-23和il-17a的表达(如图8a和图8b所示),能显著降低eae小鼠血清(如图9所示)及脊髓(如图10所示)中炎症因子的表达,并且能有效预防和改善eae症状(如图11所示)。
实施例6体内检测靶向il-23p19的小分子多肽在银屑病小鼠模型中的作用效果
用imq涂抹于小鼠背部皮肤可诱导小鼠出现银屑病样皮肤损伤及病理生理变化,与人类银屑病的病理变化有较多相似之处,是研究银屑病的理想动物模型。
在实施例将6周雌性balb/c小鼠随机分为预防组和对照组,将小分子多肽溶液或dmso用0.9%生理盐水稀释成200nmol/ml,对照组小鼠隔天腹腔给予20nmol的dmso溶液;预防组小鼠隔天腹腔给予20nmol的吡咯-咪唑类杂环多肽溶液,持续给药14天。在给药的第五天剔除小鼠背部毛发,第六天每只小鼠背部涂imq软膏65mg/天,连涂4天后改剂量为80mg/天,连涂2天后改剂量为100mg/天,涂两天,涂药期间观察症状并评分。结果发现,针对il-23p19的吡咯-咪唑类杂环多肽处理能有效下调银屑病鼠体内il-23和il-17a的表达(如图12a和12b所示),能显著降低小鼠皮肤中炎症因子的表达(如图13所示),并且能有效预防和改善银屑病症状(如图14所示)。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!