用于前列腺癌的诊断、预后和评估治疗性/预防性治疗的材料和方法与流程
交叉引用相关申请
本申请要求2011年12月30日提交的美国临时专利申请号61/582,212的优先权,所述申请的内容在此通过引用完整地并入。
本公开涉及癌症、特别是前列腺癌的诊断、预后和评估治疗性或预防性治疗,表型和基因型异常的检测,免疫荧光和原位杂交的方法,以及可用于此类方法中的探针组和试剂盒。
背景
前列腺癌是男性中最常见的恶性肿瘤,而且是肺癌之后男性中死亡的第二大原因。在2010年估计有217,730个新病例,导致32,050人死亡(www.cancer.gov)。大多数肿瘤局限于前列腺。其它在临床上位于前列腺区周围,但延伸通过前列腺囊,并可能涉及精囊。剩余肿瘤是转移性的。
实现当局限于前列腺时肿瘤的早期和准确检测的可靠诊断标记物以及实现疾病进展的预测的预后标记物的缺乏是前列腺癌的管理中的一个基本问题。前列腺癌的早期检测和诊断目前依靠直肠指检(dre)、前列腺特异性抗原(psa)测量、经直肠超声检查(trus)和经直肠针吸活检(trnb)。领先的诊断方法采用dre和血清psa测量的组合;然而,这种方法具有很大局限性。psa水平的评估的检测比特异性的更灵敏(thompson等人,nejm350:2239-2246(2004))。因此,更多人由于psa筛选而不必进行针吸活检,不幸的是,前列腺癌的病灶性质导致针吸活检取样误差,在诊断过程中的假阴性率为15-30%(campos-fernandes等人,eur.urol.55:600-609(2009))。每年在美国经历前列腺活检的约1.2百万患者中,70-80%接受阴性结果,但不能得到保证,因为癌症可能已经由于取样误差而错过(nonn等人,prostate69:1470-1479(2009))。
因此,因为psa水平连续升高,重复活检(第二次、第三次或第四次)是必要的(campos-fernandes等人(2009),同上)。
除了psa,已经鉴定了其它标记物和方法。例如,已经公开了通过荧光原位杂交(fish)测量her-2/neu基因的扩增的水平是一种测定前列腺癌的严重性的方法(国际专利申请公开号wo1998/045479)。已经公开了确定扩增的8q24.1-24.2染色体带区段的存在是一种诊断前列腺癌进展的方法(美国专利号5,658,730)。已经公开了确定8p21-22基因座的丢失、8号染色体的增加和c-myc拷贝数相对于着丝粒拷贝数的额外增加是一种预测前列腺癌的方法(美国专利号6,613,510)。也已经公开了确定染色体探针组(包含针对8p基因座诸如8p21-22的探针和针对8q24基因座的探针)的杂交模式和将杂交模式与前列腺癌诊断相关联(美国专利申请公开号2003/0091994)。也已经描述了8q24(c-myc)的增加和8p21-22(lpl)(bova等人,cancerres.53:3869-3873(1993);kagan等人,oncogene11:2121-2126(1995);和emmert-buck等人,cancerres.55:2959-2962(1995))以及10q23(pten)(yoshimoto等人,br.j.cancer97(5):678-685(sept.3,2007;epubaug.14,2007)的杂合性丢失。已经公开了测试染色体1-22中的一个或多个上一个或多个基因座处杂合性丢失作为一种检测具有肿瘤或肿瘤前表型的细胞的方法(美国专利申请公开号2003/0165895)。已经公开了检测20p1f12/tmprss2基因的表达水平的增加作为一种鉴定前列腺癌的方法(美国专利号7,037,667)。已经公开了使用fish检测smrt基因座处人染色体12q24的序列中的断裂作为一种确定前列腺癌转移的可能性的方法(美国专利号7,425,414)。已经公开了确定组成诸如ptenrna的水平作为用于评估前列腺癌的存在的方法(国际专利申请公开号wo2008/121132)。已经公开了检测acsl3-ets基因融合体作为一种诊断前列腺癌的方法(国际专利申请公开号wo2009/144460)。已经公开了检测具有来自tmprss2基因的转录调控区的5'部分和来自erg、etv1或etv4基因的3'部分的基因融合体的存在作为一种鉴定前列腺癌(美国专利号7,718,369)以及预测复发、进展和转移潜能(国际专利申请公开号wo2010/056993)的方法。已经公开了检测pitx2的过表达作为一种诊断前列腺癌的存在或风险的方法(国际专利申请公开号wo2010/099577)。已经公开了鉴定选自oct3/4、nanog、sox2、c-myc、if4、角蛋白8、和upar的核酸或多肽的增加水平作为一种鉴定前列腺癌的方法(国际专利申请公开号2011/037643)。
除了上述以外,几个组已经研究了前列腺癌“场效应”。使用数字图像分析,研究人员已经鉴定了邻近前列腺癌的组织学良性组织中核形态的微妙变化(qian等人,hum.pathol.28:143-148(1997);和veltri等人,clin.cancerres.10:3465-3473(2004))。使用cdna微阵列,报道了前列腺癌的邻近正常组织和从器官捐献者获得的正常组织之间基因表达概况的差异(chandran等人,bmccancer5(1):45(2005);yu等人,j.clin.oncol.22(14):2790-2799(2004);和rizzi等人,plosone3(10):e3617(2008))。使用免疫组织化学,在附近和远处正常和高级前列腺上皮内瘤变(hgpin)腺体中注意到多种生物标记物的蛋白表达变化。这些标记物包括mcm-2和ki67(ananthanarayanan等人,bmccancer6:73(2006);santinelli等人,am.j.clin.pathol.128(4):657-666(2007)),α-甲基酰基-coa消旋酶(amacr)(santinelli等人(2007),同上;和ananthanarayanan等人,prostate63(4):341-346(2005)),和雄激素受体(ar)(olapade-olaopa等人,clin.cancerres.5(3):569-576(1999))等。使用激光捕获显微解剖和定量甲基化特异性pcr,多个组还发现了前列腺致癌作用中通过高甲基化基因沉默的场效应(mehrothra等人,prostate68(2):152-160(2008);和aitchison等人,prostate67(6):638-644(2007))。这些基因包括gstp1、apc、rassf1a、hin-1和rarb2。
鉴于上述情况,在前列腺癌的管理中仍然需要更可靠且信息量大的诊断和预后方法。本公开寻求提供标记物组,以及使用方法和包含该标记物组的试剂盒,其用于癌症、特别是前列腺癌的诊断、预后和评估治疗性或预防性治疗。这个和其它目的和优点,以及本发明的特征,将从本文提供的详细描述变得显而易见。
概述
提供了检测患者中的前列腺癌的方法。根据所述方法鉴定并测定前列腺肿瘤(恶性肿瘤;本文中命名为“肿瘤目标区域(roi)”)或前列腺的邻近、明显良性区域(本文中命名为“良性roi”),诸如前列腺的一个或多个组织切片中的基因组异常。在一个实施方案中,所述方法包括在杂交条件下将来自患者的前列腺细胞样品与可检测标记的探针组接触,所述可检测标记的探针组包含针对myc的基因座特异性探针、针对磷酸酶和张力蛋白同源物(pten)的基因座特异性探针、针对8号染色体的着丝粒探针和针对7号染色体的着丝粒探针,和确定染色体异常的存在,其中来自患者前列腺的肿瘤目标区域(roi)或良性roi的前列腺细胞样品中大于35(范围为2至50)的myc%增加(%增加是具有myc>2个信号的细胞的%)、大于33(范围为29至33)的pten%丢失(%丢失是具有<2个信号的细胞的%)、大于34(范围为32至34)的8号染色体%增加(%增加是具有>2个信号的细胞的%)和大于28(范围为24至29)的7号染色体%异常(%异常是具有>2个或<2个信号的细胞的%)表明所述患者具有前列腺癌。
在另一个实施方案中,所述方法包括在杂交条件下将来自患者的前列腺细胞样品与可检测标记的探针组接触,所述可检测标记的探针组包含针对myc的基因座特异性探针、针对脂蛋白脂肪酶(lpl)的基因座特异性探针、针对pten的基因座特异性探针和针对8号染色体的着丝粒探针,和确定染色体异常的存在。来自患者前列腺的肿瘤目标区域(roi)的前列腺细胞样品中大于14(范围为12至22)的myc/lpl%增加(%增加是具有myc/lpl>1的细胞的%)、大于34(范围为26至40)的8号染色体%异常(%异常是具有>2个或<2个信号的细胞的%)、大于44(范围为22至54)的pten%丢失(%丢失是具有<2个信号的细胞的%)、或大于16(范围为10至18)的myc/8号染色体%增加(%增加是具有myc/8号染色体>1的细胞的%)表明所述患者具有前列腺癌。在目标表现的区域中选择对于肿瘤roifish参数的组合的“myc/lpl%增加或cep8%异常或pten%丢失或myc/cep8%增加”的截止值:97.1%灵敏度和96.2%特异性之间的象限。来自患者前列腺的良性roi的前列腺细胞样品中大于18(范围为12至19)的myc/lpl%增加、大于32(范围为25至34)的8号染色体%异常、大于26(范围为22至28)的pten%丢失、或大于16(范围为9至18)的myc/8号染色体%增加表明所述患者具有前列腺癌。在目标表现的区域中选择对于良性roifish参数的组合的“myc/lpl%增加或cep8%异常或pten%丢失或myc/cep8%增加”的截止值:80.8%灵敏度和82.4%特异性之间的象限。
前列腺细胞的样品可以是患者前列腺的切片。可以将切片福尔马林固定并石蜡包埋,并放置在显微镜载玻片上。在确定染色体异常的存在之前,所述方法可以进一步包括形态学评估切片并鉴定至少一个肿瘤roi、至少一个良性roi,或至少一个肿瘤roi和至少一个良性roi。或者,在确定染色体异常的存在之前,所述方法可以进一步包括通过免疫荧光评估切片并鉴定至少一个肿瘤roi。通过免疫荧光评估切片可以包括将切片与可检测标记的抗-α-甲基酰基辅酶a消旋酶(amacr)抗体接触,并检测amacr的过表达,其中切片区域中amacr的过表达表明肿瘤roi的存在。通过免疫荧光评估切片之前,所述方法可以进一步包括用热诱导抗原决定簇修复处理切片。
还提供了探针组。在一个实施方案中,所述探针组包含针对myc的基因座特异性探针、针对pten的基因座特异性探针、针对8号染色体的着丝粒探针和针对7号染色体的着丝粒探针,其中所述探针组任选进一步包含可以被可检测地标记的抗-amacr抗体。在另一个实施方案中,所述探针组包含针对myc的基因座特异性探针、针对lpl的基因座特异性探针、针对pten的基因座特异性探针和针对8号染色体的着丝粒探针。探针组任选进一步包含可以被可检测地标记的抗-amacr抗体。
还提供了试剂盒。在一个实施方案中,所述试剂盒包含(a)能够诊断患者中的前列腺癌的探针组,其中所述探针组包含针对myc的基因座特异性探针、针对pten的基因座特异性探针、针对8号染色体的着丝粒探针和针对7号染色体的着丝粒探针,和(b)用于诊断患者中的前列腺癌的说明书,其中所述说明书包含确定从患者获得的前列腺细胞样品中染色体异常的存在。来自患者前列腺的肿瘤目标区域(roi)或良性roi的前列腺细胞样品中大于35(范围为2至50)的myc%增加(%增加是具有myc>2个信号的细胞的%)、大于33(范围为29至33)的pten%丢失(%丢失是具有<2个信号的细胞的%)、大于34(范围为32至34)的8号染色体%增加(%增加是具有>2个信号的细胞的%)和大于28(范围为24至29)的7号染色体%异常(%异常是具有>2个或<2个信号的细胞的%)表明所述患者具有前列腺癌。在另一个实施方案中,所述试剂盒包含(a)能够诊断患者中的前列腺癌的探针组,其中所述探针组包含针对myc的基因座特异性探针、针对lpl的基因座特异性探针、针对pten的基因座特异性探针和针对8号染色体的着丝粒探针,和(b)用于诊断患者中的前列腺癌的说明书,其中所述说明书包含确定从患者获得的前列腺细胞样品中染色体异常的存在。来自患者前列腺的肿瘤目标区域(roi)的前列腺细胞样品中大于14(范围为12至22)的myc/lpl%增加(%增加是具有myc/lpl>1的细胞的%)、大于34(范围为26至40)的8号染色体%异常(%异常是具有>2个或<2个信号的细胞的%)、大于44(范围为22至54)的pten%丢失(%丢失是具有<2个信号的细胞的%)、或大于16(范围为10至18)的myc/8号染色体%增加(%增加是具有myc/8号染色体>1的细胞的%)表明所述患者具有前列腺癌。来自患者前列腺的良性roi的前列腺细胞样品中大于18(范围为12至19)的myc/lpl%增加、大于32(范围为25至34)的8号染色体%异常、大于26(范围为22至28)的pten%丢失、或大于16(范围为9至18)的myc/8号染色体%增加表明所述患者具有前列腺癌。所述试剂盒可以进一步包含用于在确定染色体异常的存在之前形态学评估来自患者的前列腺的切片并鉴定至少一个肿瘤roi、至少一个良性roi、或至少一个肿瘤roi和至少一个良性roi的说明书。或者,所述试剂盒可以进一步包含用于在确定染色体异常的存在之前通过免疫荧光评估来自患者的前列腺的切片并鉴定肿瘤roi的存在的说明书,其中所述试剂盒可以进一步包含可以被可检测地标记的抗-amacr抗体,并且用于通过免疫荧光评估来自患者的前列腺的切片的说明书可以进一步包括将切片与可检测标记的抗-amacr抗体接触,并检测amacr的过表达,其中切片区域中amacr的过表达表明肿瘤roi的存在。所述说明书可以进一步包括在通过免疫荧光评估来自患者的前列腺的切片之前用热诱导抗原决定簇修复处理切片。
附图简述
图1a是良性前列腺增生(bph)和癌样本(肿瘤roi的肿瘤目标区域)中相比于染色体计数探针(cep)8的基因座的%丢失和%增加的图。
图1b是bph和癌样本(良性roi)中相比于染色体计数探针(cep)8的基因座的%丢失和%增加的图。
图2a是对于肿瘤roi相比于1-特异性(受试者工作特征(receiveroperatingcharacteristic,roc)曲线)的灵敏度的图,其中,(■)是对于染色体计数探针8的百分比异常(cep8%异常),(▲)是myc/脂蛋白脂肪酶(lpl)的百分比增加(myc/lpl%增加),(●)是myc/cep8的百分比增加(myc/cep8%增加),且(□)是磷酸酶和张力蛋白同源物(pten)的百分比丢失(pten%丢失),且(o)是cep8、myc、lpl和pten的组合截止值(4探针截止值)。
图2b是对于良性roi相比于1-特异性(roc曲线)的灵敏度的图,其中,(■)是对于染色体计数探针8的百分比异常(cep8%异常),(▲)是myc/脂蛋白脂肪酶(lpl)的百分比增加(myc/lpl%增加),(●)是myc/cep8的百分比增加(myc/cep8%增加),且(□)是磷酸酶和张力蛋白同源物(pten)的百分比丢失(pten%丢失),且(o)是cep8、myc、lpl和pten的组合截止值(4探针截止值)。
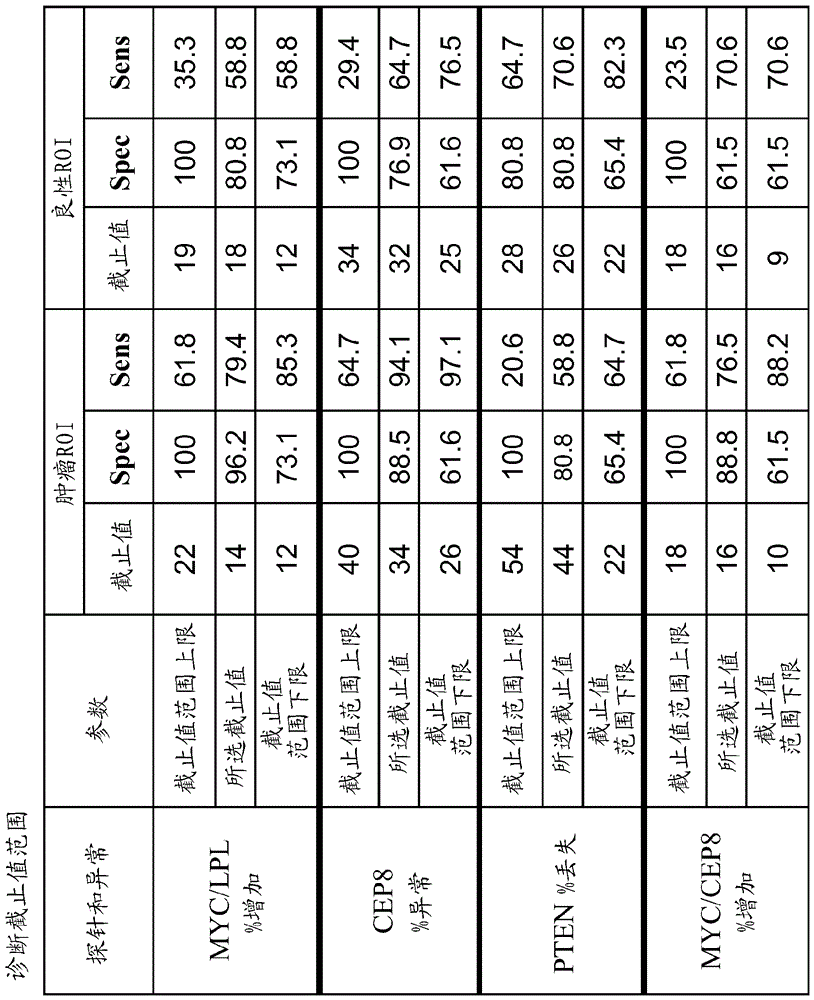
图3是对于cep8%异常、myc/lpl%增加、myc/cep8%增加和pten%丢失的诊断截止值的表。
图4是对于个别fish参数(pten%丢失、cep7%异常、myc%增加和cep8%增加)和四探针组合的相比于1-特异性(roc曲线)的灵敏度的图。从17份良性roi和26份bph样本的fish评估计算数据。对于四探针组合的roc图基于33份肿瘤roi和26份bph样本。roc曲线的最大auc显示在表中。
图5是对于pten%丢失、cep7%异常、myc%增加和cep8%增加的诊断截止值的表。
详述
本公开提供了标记物组,以及使用方法和包含该标记物组的试剂盒,其用于癌症、特别是前列腺癌的诊断、预后和评估治疗性或预防性治疗。以下术语与本公开相关:
“约”是指离设定值约+/-10%变化。应当理解的是,此类变化总是包括本文中提供的任何给定值中,无论是否特定引用它。
“生物标记物”,如美国国立卫生研究院定义,是“作为正常生物过程、致病过程或对治疗干预的药物反应的指标客观测量和评估的特征。”。
“染色体计数探针(cep)”或“着丝粒探针”是使得细胞中特定染色体的数目被计数的任何探针。染色体计数探针通常识别并结合特定染色体的着丝粒附近(称为“着丝粒周围”)或着丝粒处的区域,通常是重复dna序列(例如,α卫星dna)。染色体的着丝粒通常被认为代表该染色体,因为着丝粒是细胞分裂过程中可靠分离(faithfulsegregation)所需的。可以通过比较对应于特定基因座的信号数(拷贝数)与对应于着丝粒的信号数而将特定染色体区域的缺失或扩增与其通常存在于其内的整个染色体(异倍体)的丢失或增加相区别。一种用于进行这种比较的方法是将代表基因座的信号数除以代表着丝粒的信号数。小于一的比率表明该基因座的相对丢失或缺失,并且大于一的比率表明该基因座的相对增加或扩增。类似地,比较可以在相同染色体上的两个不同基因座、例如染色体的两个不同臂上进行,以表明染色体内的不平衡增加或丢失。代替染色体的着丝粒探针,本领域技术人员将认识到染色体臂探针可以替代地用于接近于全染色体缺失或增加。然而,此类探针在计数染色体时是不准确的,因为对于此类探针的信号损失并不总是表明整个染色体的丢失。染色体计数探针的实例包括购自abbottmolecular,inc.,desplaines,il(formerlyvysis,inc.,downersgrove,il)的cep®探针。
“拷贝数”是dna的测量值,无论是单个基因座、一个或多个基因座或整个基因组的dna的测量值。二的“拷贝数”在人类中是“野生型”(因为二倍体,除了性染色体)。在人类中除了二以外的“拷贝数”(除了性染色体)从野生型偏离。此类偏离包括扩增,即拷贝数增加,和缺失,即拷贝数减少,甚至拷贝数不存在。
“标记的”、“用可检测标记标记的”和“可检测地标记的”在本文可互换使用,以表明一种实体(例如,探针)可被检测。“标记”和“可检测标记”是指连接至实体以使得该实体可检测的部分,诸如连接至探针以使得探针在结合至目标序列之后可检测的部分。部分,本身,可能是无法检测的,但在与又另一个部分反应之后可以变得可检测的。使用术语“可检测地标记的”旨在涵盖此类标记。可选择可检测标记以便所述标记产生可被测量并且强度与结合的实体的量成比例的信号。用于标记和/或检测分子,诸如核酸,例如探针的多种系统是公知的。可通过掺入或缀合可利用分光镜方法、光化学方法、生物化学方法、免疫化学方法、电学方法、光学方法、化学方法或其它方法直接或间接检测的标记来制备标记的核酸。合适的可检测的标记包括放射性同位素、荧光团、生色团、化学发光剂、微粒、酶、磁性颗粒、电子致密颗粒、质量标记、自旋标记、半抗原等。荧光团和化学发光剂在本文中是优选的。
“基因座特异性探针”和“基因座特异性标识符(lsi)”在本文中可以互换使用来指选择性结合染色体上区域中特定基因座、例如已经被确定为在转移中经历增加/丢失的基因座的探针。探针可以靶向编码或非编码区,或者两者,包括外显子、内含子和/或调节序列,诸如启动子序列等。
“核酸样品”是指包含适合用于与探针杂交形式的核酸的样品,诸如包含核或从此类核分离或纯化的核酸的样品。核酸样品可以包含全部或部分(例如,一条或多条特定染色体)基因组dna、全部或部分mrna(例如,一条或多条特定染色体或一个或多个基因)、或一条或多条选择的序列。凝聚染色体(诸如存在于间期或中期的凝聚染色体)适合用于作为原位杂交诸如fish中的目标。
“预定截止值(cutoff)”和“预定水平”一般指测定截止值,其用于通过将测定的结果与预定截止值/水平比较,来评估诊断/预后/治疗功效结果,其中预定截止值/水平已经与各种临床参数(例如疾病严重程度、进展/非进展/改进等)联系或相关。
“探针”,在本公开的上下文中,是在允许或促进选择性杂交的条件下可以选择性杂交至目标序列的至少一部分的寡核苷酸或多核苷酸。通常,探针可以是与dna的编码或有义(+)链互补的或与dna的非编码或反义(-)链互补的(有时也称为“反向互补的”)。探针的长度可以显著差异。约10至约100个核苷酸,诸如约15至约75个核苷酸,例如约15至约50个核苷酸的长度在一些申请中可以是优选的,然而,约50-1x105个核苷酸的长度对于染色体探针可以是优选的,且约25,000至约800,000个核苷酸的长度对于基因座特异性探针可以是优选的。
“前列腺癌”包括所有类型的前列腺癌,诸如腺癌、小细胞癌、鳞状细胞癌、肉瘤和移行细胞癌。大多数前列腺癌(95%左右)是腺癌。前列腺癌不同于前列腺上皮内瘤形成(pin,其进一步区分为低级或高级),后者是前列腺癌的前体。小细胞癌和鳞状细胞癌的性质趋于非常有侵略性,且不会导致前列腺特异性抗原(psa)的增加。移行细胞癌很少在前列腺中发生,但衍生自膀胱和/或尿道中的原发性肿瘤。
“选择性杂交至”(以及“选择性杂交”、“特异性杂交至”和“特异性杂交”),在本公开的上下文中,是指在严格条件下核酸分子优先结合、双链化或杂交至特定核苷酸序列。术语“严格条件”是指探针将优先杂交至其目标序列、并且在较小程度上或完全不杂交至其它非目标序列的条件。“严格杂交”和“严格杂交洗涤条件”,在核酸杂交的上下文中(例如,如在阵列中、southern杂交、northern杂交或fish)是序列依赖性的,并且在不同条件下不同。核酸杂交的广泛指导见于,例如tijssen,laboratorytechniquesinbiochemistryandmolecularbiology--hybridizationwithnucleicacidprobes,parti,ch.2,"overviewofprinciplesofhybridizationandthestrategyofnucleicacidprobeassays,"elsevier,ny(1993)("tijssen")。通常,选择高度严格的杂交和洗涤条件为在确定的离子强度和ph下比特定序列的热解链点(tm)低约5℃。tm是50%的目标序列杂交至完全匹配的探针的温度(在确定的离子强度和ph下)。非常严格的条件被选择为等于对于特定探针的tm。在阵列上或在southern或northern印迹中的滤膜上对于具有超过100个互补残基的互补核酸的杂交的严格杂交条件的实例为使用标准杂交溶液的42℃(参见,例如,sambrook和russell,molecularcloning:alaboratorymanual,3rded.,vol.1-3,coldspringharborlaboratory,coldspringharborpress,ny(2001))。
“目标序列”、“目标区域”和“核酸目标”是指存在于其丢失和/或增加例如正在确定的特定染色体位置处的核苷酸序列。
本文中使用的术语仅用于描述特定实施方案的目的,且不旨在以其它方式进行限制。
前列腺癌的检测、诊断、预测和监测治疗性/预防性治疗的疗效的方法
提供了检测患者中的前列腺癌的方法。在一个实施方案中,所述方法包括在杂交条件下将来自患者的前列腺细胞样品与可检测标记的探针组接触,所述可检测标记的探针组包含针对myc的基因座特异性探针、针对磷酸酶和张力蛋白同源物(pten)的基因座特异性探针、针对8号染色体的着丝粒探针和针对7号染色体的着丝粒探针,和确定染色体异常的存在,其中来自患者前列腺的肿瘤目标区域(roi)或良性roi的前列腺细胞样品中大于35(范围为2至50)的myc%增加(%增加是具有myc>2个信号的细胞的%)、大于33(范围为29至33)的pten%丢失(%丢失是具有<2个信号的细胞的%)、大于34(范围为32至34)的8号染色体%增加(%增加是具有>2个信号的细胞的%)和大于28(范围为24至29)的7号染色体%异常(%异常是具有>2个或<2个信号的细胞的%)表明所述患者具有前列腺癌。在另一个实施方案中,所述方法包括在杂交条件下将来自患者的前列腺细胞样品(诸如组织切片或从其获得的细胞)与可检测标记的探针组接触,所述可检测标记的探针组包含针对myc的基因座特异性探针、针对脂蛋白脂肪酶(lpl基因座)的基因座特异性探针、针对pten基因座的基因座特异性探针和针对8号染色体的着丝粒探针,和确定染色体异常的存在。来自患者前列腺的肿瘤roi的前列腺细胞样品中大于14(范围为12至22)的myc/lpl%增加(%增加是具有myc/lpl>1的细胞的%)、大于34(范围为26至40)的8号染色体%异常(%异常是具有>2个或<2个信号的细胞的%)、大于44(范围为22至54)的pten%丢失(%丢失是具有<2个信号的细胞的%)、或大于16(范围为10至18)的myc/8号染色体%增加(%增加是具有myc/8号染色体>1的细胞的%)表明所述患者具有前列腺癌。来自患者前列腺的良性roi的前列腺细胞样品中大于18(范围为12至19)的myc/lpl%增加、大于32(范围为25至34)的8号染色体%异常、大于26(范围为22至28)的pten%丢失、或大于16(范围为9至18)的myc/8号染色体%增加表明所述患者具有前列腺癌。在目标表现的区域中选择对于肿瘤roifish参数的组合的“myc/lpl%增加或cep8%异常或pten%丢失或myc/cep8%增加”的截止值:97.1%灵敏度和96.2%特异性之间的象限。在目标表现的区域中选择对于良性roifish参数的组合的“myc/lpl%增加或cep8%异常或pten%丢失或myc/cep8%增加”的截止值:80.8%灵敏度和82.4%特异性之间的象限。
该探针组可以进一步包含以下中的一种或多种:针对p16(9p21)、tmprss2-erg或etv1融合体(21q22;7p21基因座)的基因座特异性探针、针对3号染色体的着丝粒探针、针对7号染色体的着丝粒探针、针对10号染色体的着丝粒探针、和针对17号染色体的着丝粒探针。该可检测标记的探针组可以进一步包含以下中的一种或多种:针对细胞周期蛋白依赖性激酶抑制剂p27kip1(4q43)的基因座特异性探针,针对细胞周期蛋白依赖性激酶2(cdk2;12q13)的基因座特异性探针,针对细胞周期蛋白e(ccne1;19q12和ccne2;8q22)的基因座特异性探针,针对视网膜母细胞瘤1(rb1;13q14)的基因座特异性探针,针对nk3同源框1(nkx3.1;8p21.2)的基因座特异性探针,针对表皮生长因子受体(egfr;7p11)的基因座特异性探针,针对磷酸肌醇-3-激酶(pi3k;3q26)的基因座特异性探针,针对akt1激酶(akt1;14q32)的基因座特异性探针,针对fkhr(foxo1;13q14.11)的基因座特异性探针,针对p53结合蛋白同源物(mdm2;12q14.3-12q15)的基因座特异性探针,针对p53(17p13.1)的基因座特异性探针,针对v-ki-ras2kirsten大鼠肉瘤病毒癌基因同源物(kras;12p12.1)的基因座特异性探针,针对v-raf鼠肉瘤病毒癌基因同源物b1(braf;7q34)的基因座特异性探针,针对细胞周期蛋白d1(ccnd1;11q13)的基因座特异性探针,针对b细胞cll/淋巴瘤2(bcl2;18q21.3/18q21.33)的基因座特异性探针和针对雄激素受体(ar;xq12)的基因座特异性探针。
提供了对于前列腺癌的组织学样品预处理和杂交的方法。将ffpe(福尔马林固定、石蜡包埋的)组织学样本载玻片(切片)在56℃烘烤2-24小时,然后在室温在hemo-de(scientificsafetysolvents)或xyline中预处理两至三次,每次5至10分钟,随后在室温在100%乙醇中冲洗两次1分钟,在室温在45%甲酸/0.3%过氧化氢中孵育15分钟,并且然后在去离子水中冲洗3–10分钟。然后将载玻片在80+/-5℃在预处理溶液(1xssc,ph6.3)中孵育35-50分钟,在去离子水中冲洗3分钟,在37℃在0.1nhcl溶液中0.15%胃蛋白酶中孵育22+/-5分钟,并且在去离子水中再次冲洗3分钟。将载玻片在70%、85%和100%乙醇中各脱水1分钟,然后在空气中干燥。将10微升各分别的探针杂交混合物(lsi®缓冲液、封闭dna、标记探针)添加至样本,施加盖玻片并用橡胶胶水密封。将载玻片在73+/-2℃共变性5分钟,并在37℃在thermobrite(vysis/abbottmolecular,inc.)上杂交10-24小时。杂交之后,去除盖玻片。可以将样品放置在由0.3x-2xssc和0.3%-0.5%np-40组成的洗涤溶液中,并且可以将样品的温度升高至约73℃,持续约2-5分钟。然后可以将携带样品的支持物用核dna结合染料,诸如4',6-二脒基-2-苯基吲哚(dapi)在溶液中或在黑暗中在干燥样品之后进行复染。在后者情况下,将样品用约10µldapi复染,并且将新的盖玻片放置在样品上。然后可以观察或,例如,在约-20℃,储存样品。
提供了前列腺ffpe载玻片if-fish程序的方法。对于在相同ffpe前列腺实体瘤组织载玻片上同时fish和免疫荧光(if)的测定,开发样本预处理/抗原修复方案并针对if-fish在ffpe组织上的最佳结果进行优化。
该程序的第一步是抗原修复。将前列腺癌ffpe载玻片在56℃烘烤两小时至过夜。通过在hemo-de中浸没两次(各10分钟)而脱石蜡。在100%乙醇中孵育两次,每次两分钟。通过放置在85%、70%、50%、和30%乙醇中各2分钟而水合。在分子级milli-q水中浸泡五分钟。将水浴用含有柠檬酸钠缓冲液(柠檬酸钠缓冲液:10mm柠檬酸钠,0.05%tween20,ph6.0)的coplin缸预热,直到温度达到96+/-4℃。孵育20-60分钟。在桌上在室温冷却20-40分钟。将载玻片在milli-q水中洗涤五分钟。在磷酸盐缓冲盐水(pbs)中冲洗一次五分钟。
第二步是用amacr抗体免疫荧光(if)和酪酰胺信号放大测定(34)。根据制备商说明书使用酪酰胺溶液测定(tsa)试剂盒和随后alexafluor488tsa(酪酰胺信号放大)试剂盒编号2(invitrogen,molecularprobes)。通过在室温在3%过氧化氢中孵育30分钟而封闭内源性过氧化物酶活性。添加封闭试剂(100μl/载玻片),并在室温在湿润箱中孵育30分钟。添加100ul稀释的amacr兔抗体(以1:100稀释于1%封闭试剂中),并且在室温孵育一小时。将载玻片在pbs/0.1%tween20中洗涤3次,每次五分钟。将储存的hrp缀合物溶液以1:100稀释在1%封闭溶液中。100µl体积的该工作溶液足以覆盖标准的22×22mm盖玻片。在室温孵育30分钟。在pbs/0.1%tween20中洗涤3次,每次五分钟。在pbs中洗涤一次。每个载玻片添加100µl酪酰胺溶液,随后在室温在黑暗中孵育10分钟。将载玻片在pbs中洗涤五分钟。将载玻片在milli-q水中洗涤五分钟。继续进行fish。
第三步是fish测定。将载玻片在乙醇(70%、85%和100%,各1分钟)中脱水,并使其完全风干。将10µl探针溶液添加至各载玻片,并且用橡胶胶水将盖玻片密封在载玻片上。将探针和目标dna在73℃共变性五分钟,随后在37℃杂交过夜。可以将样品放置在由0.3x-2xssc和0.3%-0.5%np-40组成的洗涤溶液中,并且可以将样品的温度升高至约73℃,持续约2-5分钟。然后可以将携带样品的支持物用核dna结合染料,诸如4',6-二脒基-2-苯基吲哚(dapi)在溶液中或在黑暗中在干燥样品之后进行复染。在后者情况下,将样品用约10µldapi复染,并且将新的盖玻片放置在样品上。然后可以观察或,例如,在约-20℃,储存样品。
关于所有上述方法,探针的性质/大小将取决于,至少部分取决于用于确定特定参数,例如,拷贝数、拷贝数比率或目标基因的百分比增加的方法。当通过原位杂交诸如fish进行上述诊断/预后方法时,例如,探针可以是相对大的。当通过另一种方法进行上述诊断/预后方法时,探针可以比用于原位杂交诸如fish的探针更小,甚至明显更小,在该情况下,探针优选杂交至目标基因内的序列。
鉴于上述情况,用于通过原位杂交诸如fish检测涉及myc的参数(例如,诸如myc的拷贝数,涉及myc的拷贝数比率,或myc的百分比增加)的探针,优选杂交至包含myc基因的8号染色体的8q24区域。探针也可以杂交至位于8q24的着丝粒侧上的邻近区域,位于8q24的端粒侧的邻近区域,或两者。优选的探针覆盖8q24的约820kb,诸如821kb,并且位于myc基因的中心。用于通过另一种方法检测涉及myc的参数的探针可以比用于原位杂交诸如fish的探针更小,甚至明显更小,在该情况下,探针优选杂交至myc基因内的序列(序列信息可在线获得自来源诸如genbank(www.ncbi.nlm.nih.gov/genbank)和genecards®(www.genecards.org))。“myc”在本文中用来指可用于确定涉及myc的参数的任何和所有探针,无论拷贝数,拷贝数比率,百分比增加,等,不论用于确定参数的具体方法。
如“myc”,“lpl”在本文中用来指可用于确定涉及lpl的参数的任何和所有探针,无论拷贝数,拷贝数比率,百分比增加等,不论用于确定参数的具体方法。“lpl”包括优选杂交至包含lpl基因的8号染色体的p22区域的探针。lpl探针也可以杂交至位于8p22的着丝粒侧上的邻近区域,位于8p22的端粒侧的邻近区域,或两者。优选的lpl探针覆盖8p22的约170kb,并且位于lpl基因的中心。“pten”在本文中用来指可用于确定涉及pten的参数的任何和所有探针,无论拷贝数,拷贝数比率,百分比增加等,不论用于确定参数的具体方法。“pten”包括优选杂交至包含pten基因的10号染色体的q23区域的探针。pten探针也可以杂交至位于10q23的着丝粒侧上的邻近区域,位于10q23的端粒侧的邻近区域,或两者。优选的pten探针覆盖10q23的约365-370kb,诸如368kb,并且位于pten基因的中心。ptene基因的邻近区域包括在着丝粒侧的sts标记物d10s215和在端粒侧的rh93626。如上面所解释的探针名称的用法适用于本文讨论的方法、探针和试剂盒。相同用法适用于本文记载的其它探针名称。如上面对于myc基因所指出,对于本文记载基因的序列信息可在线获得自来源诸如genbank(www.ncbi.nlm.nih.gov/genbank)和genecards®(www.genecards.org))。
前列腺细胞的样品是患者前列腺的切片。样品,诸如组织切片,可以通过手术切除、针吸活检、经尿道前列腺切除术(turp)或类似技术获得。可以将切片福尔马林固定并石蜡包埋,并放置在显微镜载玻片上。
或者,可以使用通过其它方式诸如冷冻保存的切片。
在确定染色体异常的存在之前,所述方法可以进一步包括形态学评估切片并鉴定至少一个肿瘤roi、至少一个良性roi、或至少一个肿瘤roi和至少一个良性roi。或者,在确定染色体异常的存在之前,所述方法可以进一步包括通过免疫荧光评估切片并鉴定至少一个肿瘤roi。通过免疫荧光评估切片可以包括将切片与可检测标记的抗-α-甲基酰基辅酶a消旋酶(amacr)抗体接触,并检测amacr的过表达,其中切片区域中amacr的过表达表明肿瘤roi的存在。通过免疫荧光评估切片之前,所述方法可以进一步包括用热诱导抗原决定簇修复处理切片。
上述方法可以使用本领域中已知的任何合适的检测方法来进行。优选地,上述方法使用原位杂交诸如荧光原位杂交(fish)进行。优选地,每个探针用不同标记、诸如不同荧光团可检测标记。或者,可以使用如本文所述的放射性标记的核苷酸检测(原位杂交(ish))、染色粒杂交检测(chromomerichybridizationdetection)等。
当上述方法通过原位杂交(其中每个探针用不同标记可检测标记,诸如通过fish,其中每个探针用不同荧光团标记)进行时,所述方法可以在前列腺细胞样品上进行,所述样品是新鲜的,诸如来自前列腺活检的新鲜细胞(新鲜细胞可以培养1-3天,并且可以将阻断剂,诸如秋水仙胺,添加至培养物以阻断中期的细胞,在此过程中染色体高度凝聚,并且可以可视化),冷冻的,或固定的(例如,在福尔马林中固定并在石蜡中包埋),处理的(例如,用rnase和胃蛋白酶),以增加目标核酸(例如dna)的可接近性并降低非特异性结合,然后与一个或多个探针进行杂交,洗涤以去除任何未结合的探针,并检测杂交的探针。例如,可以将细胞悬浮液作为单层施加至载玻片上,并且细胞密度可以通过光学或相差显微镜来测量。细胞也可以获得自其它来源,诸如体液,例如尿液或精液,在固定剂诸如甲醇-乙酸(卡诺依氏试剂)中保存,并施加至载玻片或类似支持物用于显微镜检查和分析。
或者,可以将组织切片(厚度约4-6µm),诸如前列腺组织的福尔马林固定、石蜡包埋(ffpe)样品的切片封固在载玻片诸如superfrostplus带正电荷载玻片(可得自thermoshandon,pittsburgh,pa),在56℃烘烤2小时至24小时(过夜)。对于fish测定,然后将切片通过在室温在hemo-de(scientificsafetysolvents,keller,tx)或xyline中预处理两至三次(每次5至10分钟),随后在室温在100%乙醇中冲洗两次(每次冲洗一分钟),在室温在45%甲酸/0.3%过氧化氢中孵育15分钟,然后在去离子水中冲洗3-10分钟而脱石蜡。然后将载玻片在80+/-5℃在预处理溶液(1xssc,ph6.3)中孵育35-50分钟,在去离子水中冲洗3分钟,在37℃在0.1nhcl溶液中0.15%胃蛋白酶中孵育22+/-5分钟,并且在去离子水中再次冲洗3分钟。然后将载玻片在70%、85%和100%乙醇中各脱水1分钟,然后在空气中干燥。
将各十微升分别的探针杂交混合物(lsi®缓冲液、封闭dna和标记探针)添加至样本,施加盖玻片并用橡胶胶水密封。将载玻片在73+/-2℃共变性五分钟,并在37℃在thermobrite(vysis/abbottmolecular,inc.)上杂交10-24小时。杂交之后,去除盖玻片。将样品放置在由0.3x-2xssc和0.3%-0.5%np-40组成的洗涤溶液中,并且将样品的温度升高至约73℃,持续约2-5分钟。然后可以将携带样品的支持物用核dna结合染料,诸如4',6-二脒基-2-苯基吲哚(dapi)在溶液中或在黑暗中在干燥样品之后进行复染。在后者情况下,将样品用约10µldapi复染,并且将新的盖玻片放置在样品上。然后可以观察或,例如,在约-20℃,储存样品。
在这方面,可以进行热诱导的抗原决定簇修复(hier),从而允许同时进行免疫荧光和fish。对于在相同ffpe前列腺实体瘤组织载玻片上同时fish和免疫荧光(if)的测定,开发样本预处理/抗原修复方案并针对if-fish在ffpe组织上的最佳结果进行优化。
该程序的第一步是抗原修复。前列腺癌ffpe载玻片在56℃烘烤2小时至过夜。然后通过在hemo-de中浸没两次(各10分钟)将载玻片脱石蜡。然后将载玻片在100%乙醇中孵育两次,每次2分钟。将载玻片通过放置在85%、70%、50%、30%乙醇中各2分钟和在分子级milli-q水中最终浸没5分钟而水合。将水浴用含有柠檬酸钠缓冲液(10mm柠檬酸钠,0.05%tween20,ph6.0)的coplin缸预热,直到温度达到96+/-4℃。然后将载玻片孵育20-60分钟,并在桌上在室温冷却20-40分钟。将载玻片在milli-q水中洗涤五分钟,并且在pbs中冲洗一次五分钟。
第二步是用amacr抗体免疫荧光(if)和酪酰胺信号放大测定。根据制备商说明书使用酪酰胺溶液测定(tsa)试剂盒和alexafluor488tsa(酪酰胺信号放大)试剂盒编号2(invitrogen,molecularprobes)。通过在室温在3%过氧化氢中孵育30分钟而封闭内源性过氧化物酶活性。添加封闭试剂(100μl/载玻片),并在室温将载玻片在湿润箱中孵育30分钟。添加一百微升稀释的amacr兔抗体(以1:100稀释于1%封闭试剂中),并且将载玻片在室温孵育1小时。将载玻片在pbs/0.1%tween20中洗涤3次,每次五分钟。将储存的hrp缀合物溶液以1:100稀释在1%封闭溶液中。100µl体积的该工作溶液足以覆盖标准的22×22mm盖玻片。将载玻片在室温孵育30分钟,然后在pbs/0.1%tween20中洗涤三次,每次五分钟,随后在pbs中洗涤一次。将酪酰胺溶液(100µl)添加至每个载玻片,并且将载玻片在室温在黑暗中孵育十分钟。将载玻片在pbs中洗涤五分钟,然后在milli-q水中洗涤五分钟。
第三步是fish测定。将载玻片在乙醇(70%、85%和100%,各1分钟)中脱水,并使其完全风干。将探针溶液(10µl)添加至各载玻片,并且用橡胶胶水将盖玻片密封在载玻片上。将探针和目标dna在73℃变性五分钟,随后在37℃杂交过夜。然后可以将样品放置在由0.3x-2xssc和0.3%-0.5%np-40组成的洗涤溶液中,并且可以将样品的温度升高至约73℃,持续约2-5分钟。然后可以将携带样品的支持物用核dna结合染料,诸如4',6-二脒基-2-苯基吲哚(dapi)在溶液中或在黑暗中在干燥样品之后进行复染。在后者情况下,将样品用约10µldapi复染,并且将新的盖玻片放置在样品上。然后可以观察或,例如,在约-20℃,储存样品。
在检测之前,可以任选地基于明显的细胞学异常预先选择细胞样品。预先选择鉴定可疑细胞,从而使得将筛选聚焦在那些细胞。预先选择允许更快筛选并增加不会错过阳性结果的可能性。优选地,通过使用if和抗amacr抗体检测α-甲基酰基辅酶a消旋酶(amacr)的过表达鉴定前列腺样本载玻片上的目标区域。或者,可以将来自生物样品的细胞放置在显微镜载玻片上,并在视觉上扫描通常与发育异常和肿瘤细胞相关的细胞学异常。此类异常包括通常在探针与它们的目标dna杂交之后通过用核酸染料或染料,诸如碘化丙啶或4,6-二脒基-2-苯基吲哚二盐酸盐(dapi)复染核而评估的核大小、核形状和核染色的异常。通常,肿瘤细胞具有扩大且形状不规则的核,和/或显示出斑驳的染色模式。通常在约0.4µg/ml至约5µg/ml的浓度使用的碘化丙啶是可以在614nm的发射峰波长观察到的发红色荧光的dna特异性染料。通常在约125ng/ml至约1,000ng/ml的浓度使用的dapi是可以在低放大倍数用dapi滤光片在452nm的发射峰波长观察到的发蓝色荧光的dna特异性染料。在这种情况下,只有那些预先选择用于检测的细胞进行针对染色体丢失和/或增加的计数。优选地,选择数量上至少20、更优选至少30-40的数量级的预先选择的细胞评估染色体丢失和/或增加。
或者,证明一定水平的发育不良或可疑病变的区域可以使用的低放大倍数dapi滤光片进行定位,并且彻底检查具有任何探针的异常拷贝数的核的存在。在正常细胞中,将检测到两个拷贝的给定探针。在异常细胞中,将检测到更多或更少拷贝的给定探针。优选选择具有最显著拷贝数变化的区域用于计数。只要有可能,选择三个异常区域,并且,在每个异常区域内,在高倍(64x或100x物镜)下分析10个随机的核。优选地,核是不重叠的且具有足够明亮的信号。
或者,可以独立于细胞学或组织学特征选择用于检测的细胞。例如,可以评估显微镜载玻片上一个或多个给定区域中所有非重叠细胞的染色体丢失和/或增加。作为进一步的实例,选择载玻片上的细胞,例如,在显微镜载玻片上以连续数量级出现的数量上至少50、更优选至少约100的数量级的显示出改变形态学的细胞用于评估染色体丢失和/或增加。
计数myc(8p24)、lpl(8p22)、pten(10q23)和8号染色体的拷贝,单独或进一步组合p16(9p21)、3号染色体、7号染色体、10号染色体和17号染色体一种或多种的拷贝,以及tmprss2-erg或etv1融合体(21q22;7p21)和其缺失和/或易位。此外,计数以下中的一种或多种的拷贝:p27kip1(4q43)、cdk2(12q13)、细胞周期蛋白e(ccne1;19q12和ccne2;8q22),针对视网膜母细胞瘤1(rb1;13q14)的基因座特异性探针,针对nk3同源框1(nkx3.1;8p21.2)的基因座特异性探针,针对表皮生长因子受体(egfr;7p11)的基因座特异性探针,针对磷酸肌醇-3-激酶(pi3k;3q26)的基因座特异性探针,针对akt1激酶(akt1;14q32)的基因座特异性探针,针对fkhr(foxo1;13q14.11)的基因座特异性探针,针对p53结合蛋白同源物(mdm2;12q14.3-12q15)的基因座特异性探针,针对p53(17p13.1)的基因座特异性探针,针对v-ki-ras2kirsten大鼠肉瘤病毒癌基因同源物(kras;12p12.1)的基因座特异性探针,针对v-raf鼠肉瘤病毒癌基因同源物b1(braf;7q34)的基因座特异性探针,针对细胞周期蛋白d1(ccnd1;11q13)的基因座特异性探针,针对b细胞cll/淋巴瘤2(bcl2;18q21.3/18q21.33)的基因座特异性探针和针对雄激素受体(ar;xq12)的基因座特异性探针。
因此,此类方法包括在允许(或促进)探针与其目标核酸序列选择性结合并形成稳定杂交复合物的条件下将从患者获得的前列腺细胞样品(例如,核酸样品)与可检测标记的探针组接触,所述可检测标记的探针组包含针对myc(8p24)的基因座特异性探针、针对lpl(8p22)的基因座特异性探针、针对pten(10q23)的基因座特异性探针和针对8号染色体的基因座特异性探针,单独或进一步组合针对p16(9p21)、tmprss2-erg或etv1融合体(21q22;7p21)的基因座特异性探针、针对3号染色体的着丝粒探针、针对7号染色体的着丝粒探针、针对10号染色体的着丝粒探针、和针对17号染色体的着丝粒探针中的一种或多种,其中该可检测标记的探针组可以包含以下中的一种或多种:针对p27kip1(4q43)、cdk2(12q13)、细胞周期蛋白e(ccne1;19q12和ccne2;8q22)的基因座特异性探针,针对视网膜母细胞瘤1(rb1;13q14)的基因座特异性探针,针对nk3同源框1(nkx3.1;8p21.2)的基因座特异性探针,针对表皮生长因子受体(egfr;7p11)的基因座特异性探针,针对磷酸肌醇-3-激酶(pi3k;3q26)的基因座特异性探针,针对akt1激酶(akt1;14q32)的基因座特异性探针,针对fkhr(foxo1;13q14.11)的基因座特异性探针,针对p53结合蛋白同源物(mdm2;12q14.3-12q15)的基因座特异性探针,针对p53(17p13.1)的基因座特异性探针,针对v-ki-ras2kirsten大鼠肉瘤病毒癌基因同源物(kras;12p12.1)的基因座特异性探针,针对v-raf鼠肉瘤病毒癌基因同源物b1(braf;7q34)的基因座特异性探针,针对细胞周期蛋白d1(ccnd1;11q13)的基因座特异性探针,针对b细胞cll/淋巴瘤2(bcl2;18q21.3/18q21.33)的基因座特异性探针和针对雄激素受体(ar;xq12)的基因座特异性探针。此类方法进一步包括检测杂交复合物的形成和计数杂交复合物的数目。鉴于包含myc(8p24)、lpl(8p22)、pten(10q23)和8号染色体的杂交复合物的数目,单独或进一步组合p16(9p21)、tmprss2-erg或etv1融合体(21q22;7p21)、3号染色体、7号染色体、8号染色体、10号染色体和17号染色体的一种或多种杂交复合物的数目,单独或进一步鉴于包含p27kip1(4q43)、cdk2(12q13)、细胞周期蛋白e(ccne1;19q12和ccne2;8q22),针对视网膜母细胞瘤1(rb1;13q14)的基因座特异性探针,针对nk3同源框1(nkx3.1;8p21.2)的基因座特异性探针,针对表皮生长因子受体(egfr;7p11)的基因座特异性探针,针对磷酸肌醇-3-激酶(pi3k;3q26)的基因座特异性探针,针对akt1激酶(akt1;14q32)的基因座特异性探针,针对fkhr(foxo1;13q14.11)的基因座特异性探针,针对p53结合蛋白同源物(mdm2;12q14.3-12q15)的基因座特异性探针,针对p53(17p13.1)的基因座特异性探针,针对v-ki-ras2kirsten大鼠肉瘤病毒癌基因同源物(kras;12p12.1)的基因座特异性探针,针对v-raf鼠肉瘤病毒癌基因同源物b1(braf;7q34)的基因座特异性探针,针对细胞周期蛋白d1(ccnd1;11q13)的基因座特异性探针,针对b细胞cll/淋巴瘤2(bcl2;18q21.3/18q21.33)的基因座特异性探针和针对雄激素受体(ar;xq12)的基因座特异性探针中的一种或多种的杂交复合物的数目,所述方法进一步包括确定myc(8p24)、lpl(8p22)、pten(10q23;参见,例如,美国专利号6,262,242;6,482,795;和7,217,795)和8号染色体的拷贝数,单独或进一步组合p16(9p21)、3号染色体、7号染色体、10号染色体和17号染色体以及tmprss2-erg或etv1融合体(21q22;7p21)的一种或多种的拷贝数及其缺失和/或易位,单独或进一步组合p27kip1(4q43)、cdk2(12q13)、细胞周期蛋白e(ccne1;19q12和ccne2;8q22),针对视网膜母细胞瘤1(rb1;13q14)的基因座特异性探针,针对nk3同源框1(nkx3.1;8p21.2)的基因座特异性探针,针对表皮生长因子受体(egfr;7p11)的基因座特异性探针,针对磷酸肌醇-3-激酶(pi3k;3q26)的基因座特异性探针,针对akt1激酶(akt1;14q32)的基因座特异性探针,针对fkhr(foxo1;13q14.11)的基因座特异性探针,针对p53结合蛋白同源物(mdm2;12q14.3-12q15)的基因座特异性探针,针对p53(17p13.1)的基因座特异性探针,针对v-ki-ras2kirsten大鼠肉瘤病毒癌基因同源物(kras;12p12.1)的基因座特异性探针,针对v-raf鼠肉瘤病毒癌基因同源物b1(braf;7q34)的基因座特异性探针,针对细胞周期蛋白d1(ccnd1;11q13)的基因座特异性探针,针对b细胞cll/淋巴瘤2(bcl2;18q21.3/18q21.33)的基因座特异性探针和针对雄激素受体(ar;xq12)的基因座特异性探针中的一种或多种的拷贝数。如果需要,可以将该拷贝数与预先确定的截止值比较,其中拷贝数大于预先确定的截止值(即,对于增加)和拷贝数小于预先确定的截止值(即,对于丢失),视情况而定,表明患者具有前列腺癌。当约20%或更多的来自患者的被检查前列腺细胞具有涉及tmprss2-erg或etv1融合体(21q22;7p21)的易位和/或缺失时,患者被认为具有前列腺癌。
尽管也可以根据本领域中已知的方法进行脱蜡、预处理、染色和常规载玻片洗涤,然而,使用自动化系统,诸如vp2000process(abbottmolecular,inc.,desplaines,il)减少了制备用于评估的载玻片所需要的时间量。与标准coplin缸用于杂交后洗涤时的小批量(例如,4个载玻片)相反,可以大批量(例如,50个载玻片)制备载玻片。此外,载玻片的评分可以使用自动化成像充分自动化,从而降低了样品分析所需的实际操作时间量。全自动化还允许使用更频繁且一致地捕获更多异常细胞的成像算法。此外,尽管可以使用本领域中已知的任何合适的制备载玻片的方法,但优选使用thinprep2000(hologic,inc.,bedford,ma)制备载玻片,其生成更均匀且一致的细胞单层。
现有技术中已经知道或目前正在开发的其它方法可以需要或优选使用不同于在福尔马林中固定并在石蜡中包埋的细胞的前列腺细胞的样品,例如新鲜或冷冻的细胞,匀浆的细胞,裂解的细胞,或从前列腺细胞分离或纯化的核酸(例如,“核酸样品”,诸如dna)(如本文中使用的“前列腺细胞样品”旨在涵盖各种形式的前列腺细胞样品,使得能够测定拷贝数和增加/丢失)。也可以从石蜡包埋样本的厚切片提取核,以减少截断伪影(truncationartifacts)并消除无关的包埋材料。通常,生物样品,一旦获得,在杂交前使用本领域中已知的标准方法收获并处理。此类处理通常包括蛋白酶处理和额外在醛溶液诸如甲醛中固定。
本文中可以使用的方法的实例包括,但不限于,定量聚合酶链式反应(q-pcr)、实时q-pcr(appliedbiosystems,fostercity,ca)、pcr产物的光密度扫描、数字pcr,任选组合拷贝数待测定的基因和/或染色体区域的前扩增(参见,例如,vogelstein等人,pnasusa96:9236-9241(1999);美国专利申请公开号2005/0252773;和美国专利申请公开号2009/0069194)、比较基因组杂交(cgh;参见,例如,kallioniemi等人,science258:818-821(1992);和国际专利申请公开号wo93/18186)、微卫星或southern等位基因型分析、斑点印迹、阵列、微阵列(carter,naturegeneticssupplement39:s16-s21(july2007))、多重可扩增探针杂交(maph)、多重连接依赖的探针扩增(mlpa;参见,例如,schouten等人,nucleicacidsres.30:e57(2002))、变性高效液相层析(dhplc;kumar等人,j.biochem.biophys.methods64(3):226-234(2005))、动态等位基因特异性杂交(dash)、测量组合基因组dna上的荧光探针长度(herrick等人,pnas97(1):222-227(2000))、参考查询焦磷酸测序(rqps;liu等人,coldspringharb.protoc.doi:10.1101/pdb.prot5491(2010))、将f黏粒定位到参考序列(基于毛细管的技术)、微电泳和纳米孔测序(参见,例如,service,science311:1544-1546(2006);和shendure等人,nat.rev.genet.5:335-344(2004))等。
通常以使得保持细胞形态的方式进行核酸目标的变性,用于通过原位杂交和类似方法分析。例如,染色体dna可以通过高ph、热(例如,约70-95℃的温度)、有机溶剂(例如,甲酰胺)及其组合来变性。在另一方面,探针可以在约数分钟内通过热来变性。
变性后,进行杂交。用于将探针特异性杂交至其核酸目标的条件通常包括可用于给定杂交程序中以产生特定杂合体的条件、可以由本领域普通技术人员容易确定的条件的组合。此类条件通常涉及控制的温度、液相、和探针和目标之间的接触。杂交条件根据许多因素(包括探针浓度、目标长度、目标和探针g-c含量、溶剂组成、温度和孵育持续时间)而变化。在探针与目标接触之前可以有至少一个变性步骤。或者,探针和目标可以在彼此接触的同时一起经受变性条件,或者在探针与生物样品接触之后经受变性条件。杂交可以在例如2-4xssc和甲酰胺的约50:50体积比混合物的液相中,在约25至约55℃范围的温度持续说明性约0.5至约96小时范围内的时间,或更优选在约32至约40℃的温度持续约2至约16小时范围内的时间通过与探针/样品的随后孵育来实现。为了增加特异性,可以使用封闭剂,诸如如美国专利号5,756,696(其内容完整地通过引用并入本文,并且具体用于说明使用封闭核酸)中所述的未标记封闭核酸。其它条件可以容易地用于将探针特异性杂交至样品中存在的其目标核酸,如对于本领域技术人员所显而易见。杂交方案描述于,例如,pinket等人,pnasusa85:9138-9142(1988);insituhybridizationprotocols,methodsinmolecularbiology,vol.33,choo,ed.,humanapress,totowa,nj(1994);和kallioniemi等人,pnasusa89:5321-5325(1992)。
在合适的孵育期完成后,染色体探针与样品dna的非特异性结合可以通过一系列洗涤去除。可以针对期望的严格性合适地选择温度和盐浓度。需要的严格性水平取决于特定探针序列相对于基因组序列的复杂性,并且可以通过将探针系统地杂交至已知基因组成的样品来确定。通常,高严格洗涤可以在约65至约80℃范围内的温度用约0.2x至约2xssc和约0.1%至约1%的非离子型去污剂诸如nonidetp-40(np40)来进行。如果需要低严格性洗涤,则洗涤可以在较低温度用增加浓度的盐进行。
当使用荧光团标记的探针或探针组合物时,检测方法可以涉及荧光显微镜、流式细胞术、或用于确定探针杂交的其它方式。任何合适的显微成像方法可以与本文所述的用于观察多个荧光团的方法结合使用。在使用荧光显微镜下的情况下,杂交的样品可以在适合于激发各荧光团的光下且使用一个或多个适当的滤光片来观察。或者可以使用自动化数字成像系统,诸如metasystems、bioview或appliedimaging系统,连同信号计数和数据采集算法。
根据所采用的方法,数字图象分析系统可以用来促进结果的显示,并改进检测荧光强度的小差异的灵敏度。示例性系统是quips(定量图像处理系统的缩写),这是基于配备自动化台、聚焦控制和滤光片轮的标准荧光显微镜的自动图像分析系统(ludlelectronicproducts,ltd.,hawthorne,ny)。滤光片轮被安装在显微镜的荧光激发路径中用于选择激发波长。二色块中的特殊滤光片(chromatechnology,brattleboro,vt)允许多种染料的激发,而没有图像配准偏移。显微镜具有两个相机端口,其中一个具有用于灵敏高速视频图像显示的增强型ccd相机(quantexcorp.,sunnyvale,ca),其用于寻找载玻片上的感兴趣区域以及用于聚焦。另一个相机端口具有一个冷却ccd相机(photometricsltd.,tucson,az的型号200),其用于以高分辨率和灵敏度实际采集图像。冷却ccd相机通过vme总线界面化到sun4/330工作站(sunmicrosystems,inc.,mountainview,ca)。多彩色图像的完整采集使用图像处理软件包scil-image(delftcentreforimageprocessing,delft,netherlands)进行控制。
在阵列cgh(acgh)中,将探针固定在基片上的不同位置,并且没有标记(参见,例如,国际专利申请公开号wo96/17958)。相反,标记样品核酸,其包含一种或多种目标核酸。将样品核酸在杂交之前标记,或者将杂交复合物可检测标记。在双色或多色acgh中,将探针阵列同时或依次杂交至差异标记的目标核酸的两个或更多个集合。
优选地,生物标记物表达通过免疫荧光(if)评估以定位用于通过fish分析的区域。if结果与使用本文所述的探针以及肿瘤的形态学评估鉴定的fish异常密切相关。
上述方法可用于将患者分层为需要重复活检或密集随访的患者和不需要如此的患者。上述方法也可用于区分前列腺癌和良性状况诸如良性前列腺增生(bph)。此类方法可以与其它方法,诸如组织学组织评估、前列腺特异性抗原(psa)检测、诺模图(例如,卡坦诺模图)、甲基化和突变结合使用。在这方面,所述方法也可用于确认根治性前列腺切除术后的诊断和区分前列腺癌和前列腺中的癌前病变(例如,前列腺中非典型小腺泡增生(asap),低级前列腺上皮内瘤变(pin)和高级pin)和区分前列腺中的癌前病变和良性状况诸如bph。所述方法可以帮助诊断通过活检、经尿道切除术(turp)或外科手术,例如,根治性前列腺切除术获得的样本中的腺癌。上述方法,特别是在检测和诊断的情况下的优点在于,指示前列腺癌的染色体异常可以在肿瘤周围的细胞(即“场效应”细胞)中检测到。因此,即使肿瘤活检过程中错过,其存在仍可以根据上述方法检测到,从而降低了假阴性结果和重复活检的需求。所述方法也可用于预后前列腺癌,监测前列腺癌的预防性或治疗性治疗(例如,激素或放射治疗)的疗效,和监测前列腺癌的复发。所述方法可用于确认与基于尿或血液的检测方法获得的结果。具有癌前病变的患者中癌症的风险以及癌症的攻击性(例如,场效应细胞中更多染色体异常和/或更广泛的染色体异常)可以通过此类方法进行评估。此类方法也可用于辅助治疗决定,例如,主动监控,外科手术或用激素或辐射治疗,和辅助治疗决定,诸如在根治性前列腺切除术的背景下。
因此,所述方法可以进一步包括由其获得测试样品的患者的诊断、预后或评估治疗性/预防性治疗的疗效。如果所述方法进一步包括评估由其获得测试样品的患者的治疗性/预防性治疗的疗效,则所述方法任选进一步包括根据需要改变患者的治疗性/预防性治疗以改善疗效。可以将所述方法调整以用于自动化系统或半自动化系统。
通常,预定水平可以用作针对其评估测定前列腺细胞样品的染色体异常之后获得的结果的的基准。通常,在进行此类比较中,通过在适当条件下运行足够次数的特定测定从而使得可以进行特定染色体异常(存在或水平)与疾病、病症或状况(例如,先兆子痫或心血管疾病)的特定阶段或终点或与特定标记连接或关联而获得预定水平。通常,用参考受试者(或受试者群体)的测定获得预定水平。
具体地,关于作为用于监测疾病进展和/或治疗的预定水平,染色体异常(存在或水平)可以是“不变的”、“有利的”(或“有利地改变的”)或“不利的”(或“不利地改变的”)。“升高的”或“增加的”是指前列腺细胞样品中染色体异常的水平比典型或正常水平或范围(例如,预定水平)更高,或比另一个参考水平或范围(例如,较早或基线样品)更高。术语“降低的”或“减少的”是指前列腺细胞样品中染色体异常的水平比典型或正常水平或范围(例如,预定水平)更低,或比另一个参考水平或范围(例如,较早或基线样品)更低。术语“改变的”是指前列腺细胞样品中染色体异常的水平比典型或正常水平或范围(例如,预定水平)或比另一个参考水平或范围(例如,较早或基线样品)是改变的(增加的或减少的)。
根据标准实践定义对于给定染色体异常的典型或正常水平或范围。因为在一些情况下染色体异常的水平将非常低,所谓改变的水平或改变可以被视为在与典型或正常水平或范围或参考水平或范围相比存在任何净变化时已经存在,这不能通过实验误差或样品差异来解释。因此,将特定样品中测量的水平与来自所谓正常受试者的类似样品中测定水平或水平范围进行比较。在该背景下,分别地,例如,“正常受试者”是没有可检测的疾病的个体,“正常”或“对照”患者或群体是表现出没有可检测的疾病的患者或群体。此外,鉴于染色体异常通常不以高水平存在于大多数人群体中,“正常受试者”可以被认为是没有任何显著可检测增加水平的给定染色体异常的个体,并且“正常”(有时被称为“对照”)患者或群体是表现出没有任何显著可检测增加水平的给定染色体异常的患者或群体。“表面上正常的受试者”是其中染色体异常还没有评估或正在评估的受试者。当染色体异常通常检测不到,但在测试样品中被检测到时,以及当分析物以高于正常水平存在于测试样品中时,给定染色体异常的水平被称为是“升高的”。因此,本发明尤其提供了筛选具有前列腺癌或者处于具有前列腺癌的风险的受试者的方法。
所述方法也可以涉及其它标记物等的检测。例如,所述方法还可以涉及例如前列腺特异性抗原(psa)的检测。
本文所述的方法还可以用来确定受试者是否具有前列腺癌或处于发展前列腺癌的风险。具体地,此类方法可以包括以下步骤:
(a)确定来自受试者的前列腺细胞的样品中的染色体异常(例如,使用本文所述的方法,或本领域已知的方法);和
(b)将步骤(a)中确定的染色体异常水平与预定水平比较,其中,如果步骤(a)中确定的染色体异常水平相对于预定水平是有利的,则受试者被确定为不具有前列腺癌或不处于前列腺癌的风险中。然而,如果步骤(a)中确定的染色体异常水平相对于预定水平是不利的,则受试者被确定为具有前列腺癌或处于前列腺癌的风险中。
此外,本文提供了监测受试者中前列腺癌进展的方法。最佳地,所述方法包括以下步骤:
(a)确定来自受试者的前列腺细胞的样品中的染色体异常;
(b)确定来自受试者的前列腺细胞的随后样品中的染色体异常水平;和
(c)将步骤(b)中确定的染色体异常水平与步骤(a)中确定的染色体异常水平比较,其中如果步骤(b)中的水平相比于步骤(a)中确定的水平是不变或不利的,则受试者中前列腺癌被确定为已经继续、进展或恶化。通过比较,如果步骤(b)中确定的水平相比于步骤(a)中确定的水平是有利的,则受试者中前列腺癌被确定为已经停止、消退或改善。
任选地,所述方法进一步包括将步骤(b)中确定的染色体异常水平(例如)与预定水平比较。
进一步,任选地,如果所述比较显示步骤(b)中确定的水平(例如)相比于预定水平不利地改变,则所述方法包括用例如一种或多种药物组合物、辐射、和/或激素治疗治疗受试者一段时间。
仍进一步,所述方法可用于监测接受例如用一种或多种药物组合物、辐射和/或激素治疗治疗的受试者中的治疗。具体地,此类方法涉及在治疗受试者之前提供来自受试者的前列腺细胞的第一样品。接下来,确定前列腺细胞的第一样品中的染色体异常水平(例如,使用本文所述或本领域已知的方法)。确定染色体异常水平之后,任选地,然后将所述水平与预定水平比较。如果前列腺细胞的第一样品中确定的水平低于预定水平,则受试者不用治疗。然而,如果前列腺细胞的第一样品中确定的水平高于预定水平,则治疗受试者一段时间。治疗受试者的时间段可以由本领域技术人员确定(例如,时间段可以为约七(7)天到约两年,优选约十四(14)天至约一(1)年)。
在治疗进程过程中,然后从受试者获得前列腺细胞的第二样品和后续样品。样品的数目和从受试者获得样品的时间并不关键。例如,第二样品可以在首次治疗受试者之后七(7)天获得,第三样品可以在首次治疗受试者之后两(2)周获得,第四样品可以在首次治疗受试者之后三(3)周获得,第五样品可以在首次治疗受试者之后四(4)周获得,等等。
从受试者获得各第二或后续样品之后,确定第二或后续样品中的染色体异常水平(例如,使用本文所述或本领域已知的方法)。然后将第二和后续样品中每一份中确定的水平与第一样品(例如,最初任选与预定水平比较的样品)中确定的水平比较。如果步骤(c)中确定的水平当相比于步骤(a)中确定的水平是有利的,则前列腺癌被确定为已经停止、消退或改善,且受试者应当继续治疗。然而,如果步骤(c)中确定的水平当相比于步骤(a)中确定的水平是不变或不利的,则前列腺癌被确定为已经继续、发展或恶化,且受试者应当用更高剂量的药物组合物、辐射或激素治疗,例如,受试者应当差异治疗。
通常,对于其中可以进行重复测试(例如,监控疾病进展和/或对治疗的应答)的测定法,在已经从受试者获得第一测试样品之后一段时间获得第二或后续测试样品。具体地,在已经从受试者获得第一测试样品之后数分钟、数小时、数天、数周或数年从受试者获得第二测试样品。例如,可以在从受试者获得第一测试样品之后约1分钟、约5分钟、约10分钟、约15分钟、约30分钟、约45分钟、约60分钟、约2小时、约3小时、约4小时、约5小时、约6小时、约7小时、约8小时、约9小时、约10小时、约11小时、约12小时、约13小时、约14小时、约15小时、约16小时、约17小时、约18小时、约19小时、约20小时、约21小时、约22小时、约23小时、约24小时、约2天、约3天、约4天、约5天、约6天、约7天、约2周、约3周、约4周、约5周、约6周、约7周、约8周、约9周、约10周、约11周、约12周、约13周、约14周、约15周、约16周、约17周、约18周、约19周、约20周、约21周、约22周、约23周、约24周、约25周、约26周、约27周、约28周、约29周、约30周、约31周、约32周、约33周、约34周、约35周、约36周、约37周、约38周、约39周、约40周、约41周、约42周、约43周、约44周、约45周、约46周、约47周、约48周、约49周、约50周、约51周、约52周、约1.5年、约2年、约2.5年、约3.0年、约3.5年、约4.0年、约4.5年、约5.0年、约5.5.年、约6.0年、约6.5年、约7.0年、约7.5年、约8.0年、约8.5年、约9.0年、约9.5年或约10.0年的时间段从受试者获得第二测试样品。
此外,本发明还涉及确定易患或患有前列腺癌的受试者是否将受益于治疗的方法。具体地,本发明涉及协同诊断方法和产品。因此,本文所述的“监测受试者中疾病治疗”的方法也可以进一步最优涵盖选择或鉴定用于治疗的候选者。
因此,在具体实施方案中,本发明还提供了确定具有前列腺癌或者处于具有前列腺癌的风险中的受试者是否是用于治疗的候选者的方法。通常,受试者是已经经历一些疾病症状或已经实际上被诊断为具此类疾病或者处于具有此类疾病的风险中和/或表明如本文所述的染色体异常的不利水平的受试者。
所述方法任选包括如本文所述的测定法,其中在治疗受试者之前和之后评估染色体异常的水平。治疗之后染色体异常的不利水平的观察确认受试者将不会受益于接受进一步或继续治疗,然而治疗之后染色体异常的有利水平的观察确认受试者将受益于接受进一步或继续治疗。该确认有助于管理临床研究和提供改善的患者护理。
探针
还提供了探针组。在一个实施方案中,该探针组包含针对myc(8q24)的基因座特异性探针、针对磷酸酶和张力蛋白同源物(pten;10q23)的基因座特异性探针、针对8号染色体的着丝粒探针和针对7号染色体的着丝粒探针,其中该探针组任选进一步包含抗-α-甲基酰基辅酶a消旋酶(amacr)抗体,其可以被可检测地标记。在另一个实施方案中,该探针组包含针对myc(8q24)的基因座特异性探针、针对脂蛋白脂肪酶(lpl;8p22)的基因座特异性探针、针对pten的基因座特异性探针和针对8号染色体的着丝粒探针。该探针组任选进一步包含抗-amacr抗体,其可以被可检测地标记。针对myc(8q24)的基因座特异性探针优选覆盖位于myc基因中心上的约820kb,诸如821kb,并且包括整个myc基因以及邻近区域(参见上述方法部分中“myc”的讨论)。针对lpl(8p22)的基因座特异性探针优选覆盖位于lpl基因中心上的约170kb,并且包括整个lpl基因以及邻近区域(参见上述方法部分中“lpl”的讨论)。针对pten(10q23)的基因座特异性探针优选覆盖位于pten基因中心上的约365至370kb,诸如368kb,并且包括整个pten基因以及邻近区域,诸如着丝粒侧的sts标记物d10s215和端粒侧的rh93626(参见上述方法部分中“pten”的讨论)。该探针组可以任选进一步包含以下中的一种或多种:针对p16(9p21)、tmprss2-erg或etv1融合体(21q22;7p21基因座)的基因座特异性探针、针对3号染色体的着丝粒探针、针对7号染色体的着丝粒探针、针对10号染色体的着丝粒探针、和针对17号染色体的着丝粒探针。该探针组可以进一步包含以下中的一种或多种:针对细胞周期蛋白依赖性激酶抑制剂p27kip1(4q43)的一种基因座特异性探针,针对cdk2;12q13)的基因座特异性探针,针对细胞周期蛋白e(ccne1;19q12和ccne2;8q22)的基因座特异性探针,针对视网膜母细胞瘤1(rb1;13q14)的基因座特异性探针,针对nk3同源框1(nkx3.1;8p21.2)的基因座特异性探针,针对表皮生长因子受体(egfr;7p11)的基因座特异性探针,针对磷酸肌醇-3-激酶(pi3k;3q26)的基因座特异性探针,针对akt1激酶(akt1;14q32)的基因座特异性探针,针对fkhr(foxo1;13q14.11)的基因座特异性探针,针对p53结合蛋白同源物(mdm2;12q14.3-12q15)的基因座特异性探针,针对p53(17p13.1)的基因座特异性探针,针对v-ki-ras2kirsten大鼠肉瘤病毒癌基因同源物(kras;12p12.1)的基因座特异性探针,针对v-raf鼠肉瘤病毒癌基因同源物b1(braf;7q34)的基因座特异性探针,针对细胞周期蛋白d1(ccnd1;11q13)的基因座特异性探针,针对b细胞cll/淋巴瘤2(bcl2;18q21.3/18q21.33)的基因座特异性探针和针对雄激素受体(ar;xq12)的基因座特异性探针。
合适用作基因座特异性探针的探针杂交至含有基因的染色体上的特定区域。针对基因myc(8p24)的基因座特异性探针可以杂交至8号染色体上p24处(即,8p24)的所有或部分myc基因。针对基因lpl(8p22)的基因座特异性探针可以杂交至8号染色体上p22处(即,8p22)的所有或部分lpl基因。针对基因pten(10q23)的基因座特异性探针可以杂交至10号染色体上q23处(即,10q23)的所有或部分pten基因。类似地,针对p27kip1(4q43)的基因座特异性探针可以杂交至4号染色体上q43处(即,4q43)的所有或部分p27kip1基因,针对cdk2(12q13)的基因座特异性探针可以杂交至12号染色体上q13处(即,12q13)的所有或部分cdk2基因,针对细胞周期蛋白e(ccne1;19q12和ccne2;8q22)的基因座特异性探针可以杂交至19号染色体上q12处的所有或部分ccne1基因或者8号染色体上q22处的所有或部分ccne2基因,针对视网膜母细胞瘤1(rb1;13q14)的基因座特异性探针可以杂交至13号染色体上q14处的所有或部分rb1基因,针对nk3同源框1(nkx3.1;8p21.2)的基因座特异性探针可以杂交至8号染色体上p21.2处的所有或部分nkx3.1基因,针对表皮生长因子受体(egfr;7p11)的基因座特异性探针可以杂交至7号染色体上p11处的所有或部分egfr基因,针对磷酸肌醇-3-激酶(pi3k;3q26)的基因座特异性探针可以杂交至3号染色体上q26处的所有或部分pi3k基因,针对akt1激酶(akt1;14q32)的基因座特异性探针可以杂交至14号染色体上q32处的所有或部分akt1基因,针对fkhr(foxo1;13q14.11)的基因座特异性探针可以杂交至13号染色体上q14.11处的所有或部分foxo1基因,针对p53结合蛋白同源物(mdm2;12q14.3-12q15)的基因座特异性探针可以杂交至12号染色体上q14.3-q15处的所有或部分mdm2基因,针对p53(17p13.1)的基因座特异性探针可以杂交至17号染色体上p13.1处的所有或部分p53基因,针对v-ki-ras2kirsten大鼠肉瘤病毒癌基因同源物(kras;12p12.1)的基因座特异性探针可以杂交至12号染色体上p12.1处的所有或部分kras基因,针对v-raf鼠肉瘤病毒癌基因同源物b1(braf;7q34)的基因座特异性探针可以杂交至7号染色体上q34处的所有或部分braf基因,针对细胞周期蛋白d1(ccnd1;11q13)的基因座特异性探针可以杂交至11号染色体上q13处的所有或部分ccnd1基因,针对b-细胞cll/淋巴瘤2(bcl2;18q21.3/18q21.33)的基因座特异性探针可以杂交至18号染色体上q21.3-q21.33处的所有或部分bcl2基因,以及针对雄激素受体(ar;xq12)的基因座特异性探针可以杂交至x染色体上q12处的所有或部分ar基因。
合适用作断开式(break-away)探针的探针杂交至tmprss2(21q22),从而能够检测易位和/或缺失。
合适用作染色体探针的探针与染色体的着丝粒相关的重复dna杂交。灵长类动物染色体的着丝粒含有dna的长串联重复的复杂家族,其由被称为α-卫星dna的约171个碱基对(bp)的单体重复长度构成。染色体探针通常约50-1x105个核苷酸长。较长探针通常被片段化为约100-600个核苷酸长。针对3号染色体的探针可以杂交至位于3号染色体的着丝粒的α卫星dna,而针对7号染色体的探针可以杂交至位于7号染色体的着丝粒的α卫星dna,针对8号染色体的探针可以杂交至位于8号染色体的着丝粒的α卫星dna,针对10号染色体的探针可以杂交至位于10号染色体的着丝粒的α卫星dna,且针对17号染色体的探针可以杂交至位于17号染色体的着丝粒的α卫星dna。此类探针的实例包括cep3、cep7、cep8、cep10和cep17。
靶向染色体区域或亚区域的染色体计数探针(cep)和基因座特异性探针可以商业获得或由本领域技术人员容易地制备。此类探针可以商业获得自abbottmolecular,inc.(desplaines,il)、molecularprobes,inc.(eugene,or)或cytocell(oxfordshire,uk)。染色体探针可以从,例如,蛋白核酸(pna)、克隆的人dna诸如质粒、细菌人工染色体(bac)和含有人dna序列的插入物的p1人工染色体(pac)来制备。
目标区域可以经由pcr扩增或克隆获得。在另一个实施方案中,染色体探针可以是寡核苷酸探针。或者,染色体探针可以根据本领域已知的方法合成制备。
当期望靶向特定基因基因座时,沿着靶向基因的全长杂交的探针可以是优选的,尽管不是必需的。基因座特异性探针可以设计成杂交至癌基因或肿瘤抑制基因,所述癌基因或肿瘤抑制基因的遗传畸变与转移相关,例如,myc。
探针可以通过本领域中已知的任何方法来制备。探针可以合成或重组产生。此类探针的长度范围可以为约25,000个碱基对至约800,000个碱基对。
优选地,探针是可检测标记的,且每个探针不同地标记。优选地,探针是用荧光团可检测标记的,且每个探针不同地标记。优选的荧光团的实例包括,但不限于,7-氨基-4-甲基香豆素-3-乙酸(amca)、5-羧基-x-罗丹明、6-羧基-x-罗丹明、丽丝胺罗丹明b、5-羧基荧光素、6-羧基荧光素、荧光素-5-异硫氰酸酯(fitc)、7-二乙氨基香豆素-3-羧酸、四甲基罗丹明-5-异硫氰酸酯、四甲基罗丹明-6-异硫氰酸酯、5-羧基四甲基罗丹明、6-羧基四甲基罗丹明、7-羟基香豆素-3-羧酸、n-4,4-二氟-5,7-二甲基-4-硼-3a,4a-二氮杂-3-引达省丙酸(indacenepropionicacid)、曙红-5-异硫氰酸酯、赤藓红-5-异硫氰酸酯、spectrumred(abbottmolecular,inc.)、spectrumgold(abbottmolecular,inc.)、spectrumgreen(abbottmolecular,inc.)、spectrumaqua(abbottmolecular,inc.)、texasred(molecularprobes,inc.)、荧光黄和cascade蓝乙酰叠氮化物(molecularprobes,inc.)。所使用的特定标记并不关键;然而,理想地,特定标记不干扰探针的原位杂交和在任何其它探针上标记的检测。标记期望地在尽可能低的拷贝数是可检测的,以最大限度增加测定的灵敏度和相比于任何背景信号是可检测的。还期望地,标记提供了高度局部化的信号,从而提供了高度空间分辨率。
荧光团与核酸探针的连接是本领域中众所周知,并且可以通过任何可用的方法来完成。荧光团可以使用标准技术诸如缺口平移、随机引发(rigby等人,j.mol.biol.113:237(1997))、pcr标记、末端标记、通过特定残基诸如胞嘧啶残基的化学修饰的直接标记(美国专利号5,491,224)等共价连接至特定核苷酸,例如,掺入探针的标记的核苷酸。或者,荧光团可以,例如,经由连接至已经转氨的探针的脱氧胞苷核苷酸的接头,共价连接至已经被掺入探针的具有活化接头臂的核苷酸。标记探针的方法描述于美国专利号5,491,224和morrison等人,molecularcytogenetics:protocolsandapplications,chapter2,"labelingfluorescenceinsituhybridizationprobesforgenomictargets,"pp.21-40,fan,ed.,humanapress(2002),其两者都通过引用其标记探针的描述并入本文中。
本领域技术人员将认识到,其它试剂或染料可以用来代替荧光团作为含有标记的部分。发光试剂包括,例如,辐射发光、化学发光、生物发光和含有磷光标记的部分。用可见光可检测到的试剂包括花青染料。或者,可以使用通过间接方式可视化的检测部分。例如,探针可以使用本领域已知的常规方法用生物素或地高辛标记,然后进一步处理用于检测。含生物素的探针的可视化可以经由随后结合缀合至可检测标记物的抗生物素蛋白来实现。可检测的标记物可以是荧光团,在这种情况下,探针的可视化和鉴别可以如下所述来实现。
或者,杂交至目标区域的染色体探针可以通过标记部分与用于产生不溶性颜色产物的合适底物的酶反应来可视化。每个探针可以通过选择不同的标记部分而与组内的其它探针区分。组内的含生物素的探针可以经由随后与缀合至碱性磷酸酶(ap)或辣根过氧化物酶(hrp)的抗生物素蛋白和合适底物的孵育来检测。5-溴-4-氯-3-吲哚磷酸盐和硝基四氮唑蓝(nbt)充当碱性磷酸酶的底物,而二氨基苯甲酸盐充当hrp的底物。
试剂盒
还提供了试剂盒。在一个实施方案中,所述试剂盒包含(a)能够诊断患者中的前列腺癌的探针组,其中所述探针组包含针对myc的基因座特异性探针、针对磷酸酶和张力蛋白同源物(pten)的基因座特异性探针、针对8号染色体的着丝粒探针和针对7号染色体的着丝粒探针,和(b)用于诊断患者中的前列腺癌的说明书,其中所述说明书包含确定从患者获得的前列腺细胞样品中染色体异常的存在。来自患者前列腺的肿瘤目标区域(roi)或良性roi的前列腺细胞样品中大于35(范围为2至50)的myc%增加(%增加是具有myc>2个信号的细胞的%)、大于33(范围为29至33)的pten%丢失(%丢失是具有<2个信号的细胞的%)、大于34(范围为32至34)的8号染色体%增加(%增加是具有>2个信号的细胞的%)和大于28(范围为24至29)的7号染色体%异常(%异常是具有>2个或<2个信号的细胞的%)表明所述患者具有前列腺癌。在另一个实施方案中,所述试剂盒包含(a)能够诊断患者中的前列腺癌的探针组,和(b)用于患者中的前列腺癌的检测、诊断、预后、或评估治疗性/预防性治疗的说明书。因此,所述试剂盒包含(a)能够诊断患者中的前列腺癌的探针组,其中所述探针组包含针对myc的基因座特异性探针、针对脂蛋白脂肪酶(lpl)的基因座特异性探针、针对pten的基因座特异性探针和针对8号染色体的着丝粒探针,和(b)用于诊断患者中的前列腺癌的说明书,其中所述说明书包含确定从患者获得的前列腺细胞样品中染色体异常的存在。来自患者前列腺的肿瘤roi的前列腺细胞样品中大于14(范围为12至22)的myc/lpl%增加(%增加是具有myc/lpl>1的细胞的%)、大于34(范围为26至40)的8号染色体%异常(%异常是具有>2个或<2个信号的细胞的%)、大于44(范围为22至54)的pten%丢失(%丢失是具有<2个信号的细胞的%)、或大于16(范围为10至18)的myc/8号染色体%增加(%增加是具有myc/8号染色体>1的细胞的%)表明所述患者具有前列腺癌。来自患者前列腺的良性roi的前列腺细胞样品中大于18(范围为12至19)的myc/lpl%增加、大于32(范围为25至34)的8号染色体%异常、大于26(范围为22至28)的pten%丢失、或大于16(范围为9至18)的myc/8号染色体%增加表明所述患者具有前列腺癌。所述探针组可以进一步包含以下中的一种或多种:针对p16(9p21)、tmprss2-erg或etv1融合体(21q22;7p21基因座)的基因座特异性探针、针对3号染色体的着丝粒探针、针对7号染色体的着丝粒探针、针对10号染色体的着丝粒探针、和针对17号染色体的着丝粒探针。所述探针组可以进一步包含以下中的一种或多种:针对细胞周期蛋白依赖性激酶抑制剂p27kip1(4q43)的基因座特异性探针,针对cdk2;12q13)的基因座特异性探针,针对细胞周期蛋白e(ccne1;19q12和ccne2;8q22)的基因座特异性探针,针对视网膜母细胞瘤1(rb1;13q14)的基因座特异性探针,针对nk3同源框1(nkx3.1;8p21.2)的基因座特异性探针,针对表皮生长因子受体(egfr;7p11)的基因座特异性探针,针对磷酸肌醇-3-激酶(pi3k;3q26)的基因座特异性探针,针对akt1激酶(akt1;14q32)的基因座特异性探针,针对fkhr(foxo1;13q14.11)的基因座特异性探针,针对p53结合蛋白同源物(mdm2;12q14.3-12q15)的基因座特异性探针,针对p53(17p13.1)的基因座特异性探针,针对v-ki-ras2kirsten大鼠肉瘤病毒癌基因同源物(kras;12p12.1)的基因座特异性探针,针对v-raf鼠肉瘤病毒癌基因同源物b1(braf;7q34)的基因座特异性探针,针对细胞周期蛋白d1(ccnd1;11q13)的基因座特异性探针,针对b细胞cll/淋巴瘤2(bcl2;18q21.3/18q21.33)的基因座特异性探针和针对雄激素受体(ar;xq12)的基因座特异性探针。所述试剂盒可以进一步包含用于在确定染色体异常的存在之前形态学评估来自患者的前列腺的切片并鉴定至少一个肿瘤roi、至少一个良性roi、或至少一个肿瘤roi和至少一个良性roi的说明书。
或者,所述试剂盒可以进一步包含用于在确定染色体异常的存在之前通过免疫荧光评估来自患者的前列腺的切片并鉴定肿瘤roi的存在的说明书,其中所述试剂盒可以进一步包含可以被可检测地标记的抗-α-甲基酰基辅酶a消旋酶(amacr)抗体,并且用于通过免疫荧光评估来自患者的前列腺的切片的说明书可以进一步包括将切片与可检测标记的抗-amacr抗体接触,并检测amacr的过表达,其中切片区域中amacr的过表达表明肿瘤roi的存在。所述说明书可以进一步包括在通过免疫荧光评估来自患者的前列腺的切片之前用热诱导抗原决定簇修复处理切片。此类试剂盒可以进一步包括封闭剂或其它探针,促进探针的检测的各种标记或标记试剂,用于杂交的试剂(例如,缓冲液)、中期涂片(metaphasespread)等。
实施例
以下实施例用来说明本发明。实施例不意在以任何方式限制本发明的范围。
实施例1
本实施例描述了使用探针和荧光原位杂交(fish)的各种组合分析前列腺样本。
在rushmedicalcenter,chicago,il收集来自16位具有前列腺腺癌的患者的根治性前列腺切除样本。可从九位患者获得两组福尔马林固定、石蜡包埋(ffpe)的载玻片:一组含有由病理学家记录(scribed)的肿瘤区域(肿瘤目标区域(roi)),另一组含有肿瘤远处的区域(远处roi)。通过经尿道前列腺切除术(turp)收集来自11位具有良性前列腺增生(bph)的患者的载玻片并用作对照。
将载玻片通过在1×ssc(15mm柠檬酸和0.15mnacl)中孵育和随后的胃蛋白酶消化进行预处理。将载玻片通过多色fish与以下探针组杂交:myc、lpl、和染色体计数探针(cep)8;pten、cep10®、和cep7®;tmprss2-erg或etv1融合体;和cep3®、cep7®、cep17®、和p16。评估几个视场。计数二十五至50个细胞/样本的对于组中每种探针的荧光信号的数目。对于tmprss2断开式(break-away)探针观察并记录所有重排模式和拷贝数变化。扫描来自远处roi的载玻片的最异常fish信号模式,并计数含有这些模式和邻近区域的视场。
来自根治性前列腺切除术的样本中的肿瘤roi具有染色体异常,包括myc扩增/增加、lpl丢失、pten丢失、tmprss2重排和异倍体。在含有远处roi的良性载玻片中也观察到显著的染色体异常。分析统计结果,以确定对于每个单独探针或对于衍生分类项,诸如两个探针的比率(这将最好地区分与癌症相关的异常模式与bph样本中表面上良性组织中的模式)的截止值。截止值基于含有基因组异常的细胞的百分比。使用小于良性平均信号计数减去3倍标准偏差的信号计数的固定截止值来确立丢失,然而大于良性平均信号计数加上三倍标准偏差的信号计数的固定截止值被用来确立增加。tmprss2重排的截止值超过含有重排的评估区域内的细胞的约20%。基于固定截止值,在15/16肿瘤roi中发现myc的增加和异倍体,并且在11/16肿瘤roi中发现tmprss2重排,而在2/9远处roi中发现myc的增加和异倍体,并且在5/9远处roi中发现tmprss2重排。分析的结果进一步表明,在选择的截止值检测几种染色体异常对于来自腺癌患者的样本是高度特异性的。
实施例2
本实施例描述了使用探针的各种组合用fish分析前列腺样本。
总共六个探针用于评估。这六个探针由对于7号染色体、8和10的三个着丝粒探针(cep®)以及三个位点特异性标识符(lsi®)探针(myc(8q24)、lpl(8p21-22)和pten(10q23))组成。探针的选择基于揭示前列腺癌中的频繁异常的文献综述(bova等人,cancerres.53:3869-3873(1993);kagan等人,oncogene11:2121-2126(1995);emmert-buck等人,cancerres.55:2959-2962(1995);yoshimoto等人(2007),同上;和kazunari等人,j.nat'lcancerinst.9(18):1574-1580(1999))。lsi®和cep®探针从vysis/abbottmolecular,inc.(desplaines,il)获得。将包括用于随后评估的探针组合成两个探针组。第一探针组是provysion®,其由myc8q24(spectrumgreen™)、lpl8p21-22(spectrumorange™)和cep8®(spectrumaqua™)组成。第二个探针组(pten组)包括pten(spectrumorange™)、cep7®(spectrumaqua)和cep10®(spectrumgreen)。
来自具有前列腺腺癌的患者的三十三份前列腺切除术(rp)样本从rushuniversitymedicalcenter,chicago,il获得。对于每份样本,由病理学家记录4-6µm的组织切片以标记肿瘤区域。对于33个rp例中的17个,可获得仅有组织学良性组织的第二切片。二十六份良性前列腺增生(bph)样本充当对照(nakayama等人,j.cellbiochem.91(3):540-552(2004))。在50-100个细胞/切片中计数6个探针中每一个的fish信号。
对于每份样本,由病理学家记录5µm的组织切片以标记肿瘤区域,如果存在的话。将ffpe组织切片载玻片在56℃烘烤2-24小时,在室温在hemo-de(scientificsafetysolvents)中预处理三次,每次5分钟,在室温在100%乙醇中冲洗两次,每次一分钟,在室温在45%甲酸/0.3%过氧化氢中孵育15分钟,然后在去离子水中冲洗三分钟。然后将载玻片在80℃在预处理溶液(1xssc,ph6.3)中孵育35分钟,在去离子水中冲洗三分钟,在37℃在0.1nhcl溶液中0.15%胃蛋白酶中孵育22分钟,并且在去离子水中再次冲洗3分钟。将载玻片在70%、85%和100%乙醇中各脱水1分钟,然后使其风干。将各10微升分别的探针杂交混合物(lsi®缓冲液、封闭dna和标记探针)添加至样本,施加盖玻片并用橡胶胶水密封。将载玻片在73℃共变性五分钟,并在37℃在thermobrite(vysis/abbottmolecular,inc.)上杂交16-24小时。杂交后,将盖玻片去除,并在73℃将载玻片在2xssc/0.3%np-40中洗涤两分钟,并随后在室温在2xssc/0.1%np-40中洗涤一分钟。将十微升dapii复染液放置在载玻片上,并施加盖玻片。
杂交后,进行fish信号计数。使用对于dapi(4,6-二脒基-2-苯基吲哚)、spectrumorange™、spectrumgreen™和spectrumaqua™特异性的单一带通滤光片(abbottmolecular,desplaines,il)在荧光显微镜下分析各样本。在目标区域中最少50个连续不重叠、完整间期核(诸如约50-100个细胞的核)中记录对于每种探针的fish信号数目,其通过相对于对应h&e染色组织的核的dapi染色进行鉴定。对于每个探针考虑的异常参数如下:增加:[信号计数]>2,丢失:[信号计数]<2,和异常:[信号计数]>2或<2.固定截止值计算为“26份bph样本中%异常细胞计数的平均值+3s.d.”。样本异常被定义为“%异常细胞>截止值。
对于myc、lpl、cep8®、pten、cep10®和cep7®在载玻片上观察异常的fish信号。不仅在来自根治性前列腺切除术的样本的肿瘤目标区域(roi)中,而且在一些良性roi中,观察到myc扩增/增加、lpl和pten丢失、和异倍体的染色体异常。表1显示计数数据的总结。33份样本中的二十二份具有用provysion®探针组检测到的异常(66.7%),且33份样本中的20份具有用pten探针组检测到的异常(60.6%)。用provysion®+pten探针组对于肿瘤roi检测到的总异常率为23/33,也就是69.7%。更重要地,在含有距肿瘤远处的roi(“远处roi”)的17个载玻片中的8个(8/17=47.1%;对于provysion®,4/17=23.5%;6/17=35.3%pten探针组)中,观察到明显数量的染色体异常(表1)。在分析的大多数前列腺癌病例中,在一个样本中同时观察到8号染色体的增加和丢失。
表1.来自fish计数数据的染色体异常
pos=阳性
neg=阴性。
使用sas8.2版(sca#s05020002)通过受试者工作特征(roc曲线)进一步分析计数结果。为了选择探针并确定产生最高灵敏度和特异性的最佳fish分析算法,以下参数被认为用于每个探针:
•%增加,具有>2个信号的细胞百分比,
•%丢失,具有<2个信号的细胞百分比,
•%异常,具有>2或<2个信号的细胞百分比,和
•对于2个探针比(探针a/探针b),%增加是a/b比>1的细胞百分比,%丢失是a/b比<1的细胞百分比。
所记肿瘤区域内myc/lpl%增加、pten%丢失、myc/cep8®%增加和cep8®%异常参数的组合鉴定了97.1%(33/34)的rp样本中的腺癌,相对于bph的特异性为96.2%(25/26)(χ2p<0.001)。当在正常组织学的区域中检测时,这些异常与82.4%(14/17rp样本,相对于bph,χ2p<0.001)中的腺癌相关。表2是对于每个探针和探针组合的auc(曲线下面积)、最佳特异性和灵敏度的roc分析总结。
表2.roc分析
auc=曲线下面积
spec=特异性
sens=灵敏度。
我们还使用另一种方法来分析数据集,其首先来使用两种样品t检验通过比较不同样本组(肿瘤roi相比于bph,和良性roi相比于bph)来筛选潜在的重要fish探针。选择具有来自t检验的显著p值(p值<0.05)的fish参数用于进一步检查。
评估衍生自通过fish检测的基因组拷贝数的十六个参数。这些参数为cep10%异常,cep10%增加,cep7%异常,cep7%增加,cep8%异常,cep8%增加,cep8%丢失,myc%增加,lpl%异常,lpl%丢失,pten%丢失,pten/cep10%丢失,cep7/cep10%增加,lpl/cep8%丢失,myc/cep8%增加和myc/lpl%增加。
来自t检验分析的结果表明,对于所有16种fish参数,它们的平均值在肿瘤和bph组之间具有统计学差异(表3)。
表3.比较肿瘤和bph的t检验
来自良性roi和bph数据的t检验的结果显示,如图4中显示的10/16种参数对于场效应具有统计学差异。这十种fish参数为cep10%异常,cep10%增加,cep7%异常,cep7%增加,cep8%异常,cep8%增加,myc%增加,lpl%异常,pten%丢失和pten/cep10%丢失。
表4.比较良性和bph的t检验
十种fish参数,其显示基于两份样品t检验的bph和肿瘤或良性roi组之间的显著差异,被选择用于进一步评估。应用roc方法来鉴定这些fish参数的最佳截止值。表5总结了对于这十种fish参数中每一种在区分肿瘤roi与bph以及区分良性roi与bph中的灵敏度、特异性和auc。基于它们在区分良性roi样本相比于bph的场效应中的auc值选择前五种fish单一参数。它们是pten/cep10%丢失,pten%丢失,cep7%异常,myc%增加和cep8%增加,如表5中显示。
表5.前五种fish单一参数的选择
将前五种单一探针参数以四探针组的所有可能组合进行分组,然后针对截止值、auc以及最小dfi使用sas通过受试工作特征(roc曲线)进行分析,截止值范围为5%至35%,在良性样本上为1%。对于多探针组合,对于每个参数独立地改变截止值生成图上的点场,并且在每个特异性值具有最高灵敏度值的点被用来定义roc曲线。尽管使用统计方法来生成可能组合和截止值,但是使用科学判断来衡量各种权衡因素(trades-offs)以导致截止值和探针组合的最终决定。
表6中的分析显示,探针组3具有0.938的最大auc,而探针组1的auc是0.917的第二大值,具有最小dfi、最佳灵敏度和特异性。探针组3只有一个lsi探针,即pten,而探针组1具有两个lsi探针,即pten和myc。cep探针被用来检测异倍体,而lsi探针通常被用来检测特定基因的缺失、重复或扩增。基于该分析,选择探针组1,包括pten%丢失,cep7%异常,myc%增加和cep8%增加。探针组1的对应的灵敏度和特异性分别为0.882和0.846。
表6.来自前五种单一fish参数的四探针组合的roc分析
对于最佳四探针组合和四种单一fish参数(包括pten%丢失,cep7%异常,myc%增加,cep8%增加)的roc曲线图显示在图4中。从17份良性roi和26份bph样本的fish评估获得数据。33种肿瘤roi和26份bph样本的四探针组合的计算也显示在roc图中。roc曲线的auc显示在roc图下的表格中。
表7是4探针组合表现的总结。四种个别探针参数选择的截止值为pten%丢失>33,cep7%异常>28,myc%增加>35和cep8%增加>34。4探针组合的灵敏度为100%,并且对于肿瘤roi相比于bph的特异性为84.6%。尽管比较良性roi与bph,探针组合得到88.2%的灵敏度和84.6%的特异性。
表7.四探针组合与截止值的总结
*组合:pten%丢失,cep7%异常,myc%增加,cep8%增加
**截止值1pten%丢失33;截止值2cep7%异常28;截止值3myc%增加35;截止值4cep8%增加34。
图5中显示的roc分析进一步定义了选择的探针组的每个单一fish参数的截止值范围。
比较psa检测,在同时系列中血清psa水平高于4.0ng/ml的患者的灵敏度为约20%,且psa检测的特异性为约60%至70%(prostate-specificantigenbestpracticestatement,2009年更新,americanurologicalassociation)。对于本研究中选择的使用4探针组的fish测试,对于肿瘤样本达到100%灵敏度和84.6%特异性。因此,fish测定具有胜过psa检测的潜力。具有高灵敏度,阴性结果可以排除癌症的可能性,并可以避免进一步的活检。此外,psa在具有有症状bph的男性中具有较差的区分能力(meigs等人,j.gen.intern.med.11:505(1996)),而本文中所述的fish测定法具有基于场效应检测良性roi的潜力,具有88.2%的灵敏度和84.6%的特异性。
用于前列腺癌诊断的另一种测定法是pca3检测(vlaeminck-guillem等人,urology75:447(2010))。在用不确定psa(2.5至10.0ng/ml)评估患者的四项研究中,灵敏度范围为53至84%,特异性范围为71至80%。在具有至少200位患者且提供关于先前阴性活检后pca3表现的数据的三项研究中,灵敏度范围为47至58%,特异性范围为71至72%。尽管在独立预测阳性活检中pca3具有比psa更好的表现,但本文所述的四探针fish测定法的表现比psa和pca3测试两者都更好,对于肿瘤样本具有100%灵敏度和84.6%特异性,且对于良性roi具有88.2%灵敏度和84.6%特异性。
除了上述以外,fish测定法也可以在来自冷冻样本或细胞学样本的细胞上使用。评估包括经由显微镜或图像采集的信号检测,信号计数,和随后的数据分析算法。fish测定法使用稳定dna用于检测大染色体变化(缺失,扩增,异倍体,和易位),使得分子评估与组织形态学相组合,可以检测多病灶和异质癌症中的罕见异常,可以检测如组织学评估评价不含实际肿瘤的活检样本中癌症的存在,可以用作独立测试或用作其它测试(例如,组织学、psa、诺模图、甲基化和突变)的辅助,并且通过组合探针,能够与单一分析物测定法相比增加待实现的灵敏度和特异性。
该方法可以帮助病理组织评估,以区分癌症与困难良性状况(bph),区分良性组织与癌前期病变,并且可以帮助活检、经尿道切除术(turp)或外科手术(根治性前列腺切除术)样本中腺癌的诊断。
在这项具有rp样本组的研究中,在肿瘤区域以及延伸超出组织学上明显的肿瘤的正常组织学区域内观察到染色体异常,这证实了前列腺癌的场癌变效应。场癌变的fish检测可以通过在与活检错过的现有癌症分开的场细胞中发现细胞染色体异常而减小诊断活检取样面积。因此,基于fish来测量myc、cep8、pten、和cep7的分子测试可以允许检测否则由组织病理学检查错过的癌症,因此,通过减少前列腺针吸活检的取样误差而改善前列腺癌的诊断。
实施例3
本实施例描述了使用探针的各种组合用免疫荧光(if)和fish分析前列腺样本。
相同ffpe前列腺实体瘤组织载玻片(korac等人,j.clin.pathol.58:1336-1338(2005))通过免疫荧光和fish进行分析。开发样本预处理/抗原修复方案并针对ffpe组织上的最佳结果进行优化。
该程序的第一步是热诱导的抗原决定簇修复(hier)。ffpe载玻片用hemo-de(scientificsafetysolvents,keller,tx)处理10分钟,用d-柠檬烯处理10分钟,用100%乙醇处理两次,持续两分钟,用85%乙醇处理两分钟,用70%乙醇处理两分钟,用50%乙醇处理两分钟,用30%乙醇处理两分钟,并用水处理五分钟。然后,将载玻片在100℃在柠檬酸钠缓冲液ph6.0中加热30分钟,在柠檬酸钠缓冲液ph6.0中冷却20分钟,在水中浸泡5分钟,然后在磷酸盐缓冲盐水(pbs)中浸泡五分钟。
第二步是使用抗α-甲基酰基辅酶a消旋酶(amacr)抗体的if(zhong等人,am.j.clin.pathol.123:231-236(2005))和酪酰胺信号放大测定法(sokolova等人,j.molec.diag.9(5):604-611(2007))。根据制备商说明书使用酪酰胺溶液测定试剂盒和alexafluor488tsatm(酪酰胺信号放大)试剂盒编号2与辣根过氧化物酶(hrp)(目录号t20912;invitrogen,carlsbad,ca;molecularprobes,eugene,or)。通过在室温在3%过氧化氢中孵育30分钟而封闭内源性过氧化物酶活性。添加封闭试剂(100μl/载玻片),并在室温将载玻片在湿润箱中孵育30分钟。添加稀释的抗amacr抗体(100µl;兔;p504s;克隆13h4;sigma,st.louis,mo)(以1:100稀释于1%封闭试剂中)溶液,并且将载玻片在室温孵育1小时。将载玻片在pbs/0.1%tween20中洗涤3次,持续五分钟。将储存的hrp缀合物溶液以1:100稀释在1%封闭溶液中。100-µl体积的该工作溶液足以覆盖标准的22×22mm盖玻片。将载玻片在室温孵育30分钟,在pbs/0.1%tween20中洗涤三次,持续五分钟,并在pbs中洗涤一次。将酪酰胺溶液(100µl/每载玻片)添加至每个载玻片,并且将载玻片在室温在黑暗中孵育10分钟。将载玻片在pbs中洗涤五分钟,然后在milli-q水中洗涤五分钟。
第三步是fish。将载玻片在乙醇(70%、85%和100%,各1分钟)中脱水,并使其完全风干。将探针溶液(10µl)添加至各载玻片,并且用橡胶胶水将盖玻片密封在载玻片上。将探针和目标dna在73℃共变性5分钟,并在37℃过夜杂交至载玻片。通过在室温浸泡在2xssc/0.1%np-40中而去除盖玻片。将载玻片在73℃在2xssc/0.3%np-40中洗涤2分钟,在室温在2xssc/0.1%np-40中洗涤一分钟,然后用水洗涤,并在黑暗中使其完全风干。将载玻片用dapi复染。
使用用抗amacr抗体组合pten(spectrumorangetm)和cep7®(spectrumaquatm)fish探针的酪酰胺介导的if,处理并评估七份样本。amacr是癌细胞的特异性标记物。其在前列腺癌上皮中一致地过表达。其表达在癌前病变(前列腺上皮内瘤形成)中也增加(zhong等人(2005,同上)。amacr染色在肿瘤roi中是强阳性的,表明amacr蛋白是过表达的。该区域中的大部分细胞通过fish测定法只具有pten的一个等位基因,表明pten缺失,和cep7的两个等位基因,表明7号染色体是完整的。七份样本的分析结果显示于表8中。该表显示,来自if染色(amacr阳性+或阴性-)的七份样本的14个区域中的12个(12/14=85.7%)与测试探针的fish信号异常,以及与训练的病理学家对肿瘤的形态学评估相关。在异质和多病灶性前列腺癌中,amacr抗体染色鉴定用于fish评估的目的区域。
表8.免疫荧光和fish分析。
实施例4
本实施例描述了对于前列腺癌的组织学样品预处理和杂交的方法。
将ffpe(福尔马林固定、石蜡包埋的)组织学样本载玻片(切片)在56℃烘烤2-24小时,然后在室温在hemo-de(scientificsafetysolvents)或xyline中预处理两至三次,每次5至10分钟,随后在室温在100%乙醇中冲洗两次1分钟,在室温在45%甲酸/0.3%过氧化氢中孵育15分钟,并且在去离子水中冲洗3–10分钟。然后将载玻片在80+/-5℃在预处理溶液(1xssc,ph6.3)中孵育35-50分钟,在去离子水中冲洗3分钟,在37℃在0.1nhcl溶液中0.15%胃蛋白酶中孵育22+/-5分钟,并且在去离子水中再次冲洗3分钟。将载玻片在70%、85%和100%乙醇中各脱水1分钟,然后在空气中干燥。将各10微升分别的探针杂交混合物(lsi®缓冲液、封闭dna、标记探针)添加至样本,施加盖玻片并用橡胶胶水密封。将载玻片在73+/-2℃共变性5分钟,并在37℃在thermobrite(vysis/abbottmolecular,inc.)上杂交10-24小时。
杂交之后,去除盖玻片。将样品放置在由0.3x-2xssc和0.3%-0.5%np-40组成的洗涤溶液中,并且将样品的温度升高至约73℃,持续约2-5分钟。然后将携带样品的支持物用核dna结合染料,诸如4',6-二脒基-2-苯基吲哚(dapi)在溶液中或在黑暗中在干燥样品之后进行复染。在后者情况下,将样品用约10µldapi复染,并且将新的盖玻片放置在样品上。然后观察或,例如,在约-20℃,储存样品。
实施例5
本实施例描述了前列腺ffpe载玻片if-fish程序的方法。
对于相同ffpe前列腺实体瘤组织载玻片上同时fish和免疫荧光(if)的测定,开发样本预处理/抗原修复方案,并针对用于if-fish的ffpe组织上的最佳结果进行优化。
该程序的第一步是抗原修复。前列腺癌ffpe载玻片在56℃烘烤2小时至过夜。然后通过在hemo-de中浸没两次(各10分钟)将载玻片脱石蜡。然后将载玻片在100%乙醇中孵育两次2分钟。将载玻片通过放置在85%、70%、50%、和30%乙醇中各2分钟而水合。在分子级milli-q水中进行最后5分钟浸泡。将水浴用含有柠檬酸钠缓冲液(10mm柠檬酸钠,0.05%tween20,ph6.0)的coplin缸预热,直到温度达到96+/-4℃。将载玻片孵育20-60分钟。将载玻片在桌上在室温冷却20-40分钟。将载玻片在milli-q水中洗涤五分钟,并且在pbs中冲洗一次五分钟。
第二步是用amacr抗体免疫荧光(if)和酪酰胺信号放大测定。根据制备商说明书使用酪酰胺溶液测定(tsa)试剂盒和alexafluor488tsa(酪酰胺信号放大)试剂盒编号2(invitrogen,molecularprobes)。通过在室温在3%过氧化氢中孵育30分钟而封闭内源性过氧化物酶活性。添加封闭试剂(100μl/载玻片),并在室温在湿润箱中孵育30分钟。添加100µl稀释的amacr兔抗体(以1:100稀释于1%封闭试剂中),并且在室温孵育1小时。将载玻片在pbs/0.1%tween20中洗涤3次,持续五分钟。将储存的hrp缀合物溶液以1:100稀释在1%封闭溶液中。100µl体积的该工作溶液足以覆盖标准的22×22mm盖玻片。将载玻片在室温孵育30分钟。将载玻片在pbs/0.1%tween20中洗涤三次,每次五分钟,并在pbs洗涤一次。每个载玻片添加100µl酪酰胺溶液,随后在室温在黑暗中孵育10分钟。然后将载玻片在pbs中洗涤五分钟,且在milli-q水中洗涤五分钟。
第三步是fish测定。将载玻片在乙醇(70%、85%和100%,各1分钟)中脱水,并使其完全风干。将10µl探针溶液添加至各载玻片,并且用橡胶胶水将盖玻片密封在载玻片上。将探针和目标dna在73℃变性5分钟,随后在37℃杂交过夜。将样品放置在由0.3x-2xssc和0.3%-0.5%np-40组成的洗涤溶液中,并且将样品的温度升高至约73℃,持续约2-5分钟。然后将携带样品的支持物用核dna结合染料,诸如4',6-二脒基-2-苯基吲哚(dapi)在溶液中或在黑暗中在干燥样品之后进行复染。在后者情况下,将样品用约10µldapi复染,并且将新的盖玻片放置在样品上。然后观察或,例如,在约-20℃,储存样品。
本说明书中提到的所有专利、专利申请出版物、期刊文章、教科书和其它出版物表明本公开涉及的本领域技术人员的技术水平。所有此类出版物都以相同程度通过引用并入本文,如同每一单独的出版物明确地且单独地被说明通过引用并入。
本文举例说明性描述的本发明可以适当地在不存在本文未具体公开的任何一种或多种要素、一种或多种限制的情况下实践。因此,例如在本文的每种情况下,术语“包括”、“基本上由……组成”和“由……组成”中的任何一种都可以由其它2个术语中的任一替换。同样,单数形式“一个(a)”、“一个(an)”和“该(the)”包括复数引用,除非上下文另有明确规定。因此,例如,提及“该方法”包括本文中描述和/或在阅读本公开内容之后对于本领域普通技术人员变得显而易见的该类型的一种或多种方法和/或步骤。
已采用的术语和表达作为描述性而不是限制性术语使用。在这方面,当某些术语在“定义”下定义,并且在“详述”中其它地方以其它方式定义、描述或讨论时,所有此类定义、描述和讨论旨在归因于这些术语。在使用此类术语和表达中还不旨在排除显示和描述的特征任何等价物或其部分。此外,尽管在“详述”中使用副标题,例如“定义”,但此类使用仅仅为了便于引用,并不旨在将一个部分中进行的任何公开仅限制在该部分;相反,在一个副标题进行的任何公开旨在构成各自和每个其它副标题下的公开内容。
应认识到,各种修改在要求保护的发明的范围之内是可能的。因此,应当理解,尽管本发明已经在优选的实施方案和任选特征的上下文中被具体公开,但本领域技术人员可以诉诸本文公开的概念的修改和变化。此类修改和变化被认为在本文要求保护的发明的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!