一种维持和回复毛乳头细胞干性的外泌体制剂的制作方法
本发明属于生物技术技术领域,具体涉及一种维持和回复毛乳头细胞干性的外泌体制剂。
背景技术:
毛乳头细胞(dpc)对毛囊生长至关重要,可发出信号启动毛囊发育和毛发的周期性更替。目前常见的男女脱发都表现为包括毛乳头组织在内的进行性毛囊微型化,导致毛发生长周期缩短,毛囊周期紊乱,生长期缩短,毛发变稀疏、变短。
目前有研究者分离出对毛囊再生起关键作用的dpc,发现体外培养条件下,代数较低的较原始的dpc呈聚集性生长,表达碱性磷酸酶(alkalinephosphatase,alp)和α-平滑肌蛋白(α-sma)等特有的标记分子。随传代次数增加,alp和α-sma的表达降低,dpc的干性(分化能力)和诱导毛发发育及再生的能力或逐渐消失。同时由于毛囊样本来源于人体,样本较难得,已经dpc制备获取过程繁琐,这就给毛囊部位dpc的研究带来困难。针对这一问题,有学者利用培养过低传代dpc的条件培养基成分来培养高传代dpc,发现其中的wnt10b等成分可以逆转高传代dpc的细胞干性,但对其中的有效成分进行分析获知,不同批次细胞间有效成分的表达水平有差异,实际应用时效果不稳定。
另,国外研究发现,cd4+cd25+foxp3+treg细胞通过旁分泌jag1蛋白,上调毛囊干细胞中的notch信号通路的表达,活化在毛囊再生中发挥中枢作用的dpc(包括wnt信号通路得激活等),进而启动毛囊再生;在毛发进入生长期前,去除cd4+cd25+foxp3+treg细胞会阻断毛发再生。但想直接通过细胞移植的方法将t细胞应用在临床脱发治疗中存在伦理难通过,机体免疫源性高等方面的问题;而且想通过常规的共培养方式,如transwell共培养来回复高传代dpc的干性,存在着成本极高的问题。
技术实现要素:
针对现有技术中存在的问题,本发明设计的目的在于提供一种维持和回复毛乳头细胞干性的外泌体制剂。
本发明通过以下技术方案加以实现:
所述的一种维持和回复毛乳头细胞干性的外泌体制剂,其特征在于该制剂采用以下方法制备和应用:
1)dpc的分离获取,采集患者后枕部区域单位毛囊组织,采用改良二步酶消化法进行实验室dpc的分离培养;
2)外周血单个核细胞的分离,抽取肝素抗凝静脉血30ml,取6个15ml离心管,每管小心加入淋巴细胞分离液5ml,将5ml外周血沿管壁缓慢置于淋巴细胞分离液层面之上,2000r/min20℃离心20min,收集淋巴细胞层中的淋巴细胞,pbs洗涤2次备用;
3)cd4+cd25+foxp3+treg细胞筛选,macs分选上述步骤获得的外周血单个核细胞进行细胞计数,加pbs洗涤,1200r/min离心后弃上清,以macsbuffer90μl/每107个细胞重悬,加入cd4+t细胞biotin⁃antibody10μl/每107个细胞,混匀,进行第一次孵育,第一次孵育结束后加入20μlanti⁃biotinmicrobeads/每107个细胞,混匀,进行第二次孵育,第二次孵育结束后,以macsbuffer将细胞调整至500μl体积,过ld柱,收集过柱后流下来的细胞悬液为cd4+t细胞(阴选),将细胞洗涤离心后,以macsbuffer90μl/每107个细胞重悬,加入cd25microbeads,混匀,进行第三次孵育,第三次孵育结束后,加入1-2mlmacsbuffer洗涤离心,弃去上清,重悬至500μl,过ms柱,把separator移开,放置1mlmacsbuffer于ms柱上,迅速将细胞打下,收集流下的为cd4+cd25+t细胞(阳选);
4)cd4+cd25+foxp3+treg细胞条件培养基的获取,将筛选获取的cd4+cd25+treg细胞接种于细胞培养袋,培养15d后,吸取培养基于250ml离心管,800g离心10min,上清液即为cd4+cd25+foxp3+treg细胞条件培养基;
5)dpc诱导培养基的配置,将步骤4)中所获取的cd4+cd25+foxp3+treg细胞条件培养基与dpc培养基混合,所得培养基即为dpc诱导培养基;
6)dpc的诱导培养,待第三代dpc铺满率为70%时,换dpc培养基为dpc条件培养基,培养48h后,更换培养基为dmem基础培养基;
7)外泌体制剂的制备,在不含血清的dmem基础培养基中培养48h后,收集细胞培养上清液,经超速离心法获取外泌体;用生理盐水或dmem溶解为含dpc外泌体浓度为1*1010颗粒/ml的溶液,即得外泌体制剂;
其中,外泌体制剂培养基的制备,将外泌体制剂按1:49的比例添加于dpc培养基(基础培养基+10%胎牛血清+10ng/mlegf+10ng/mlbfgf)即得外泌体制剂培养基。
所述的一种维持和回复毛乳头细胞干性的外泌体制剂,其特征在于步骤1)中改良二步酶消化法的步骤为:
1)经过手术后的单个毛囊置于毛囊采集液中于4℃环境保存,用含1%双抗的pbs溶液清洗毛囊组织2~3次;
2)显微镜下用1ml注射器针头将毛球部组织整个分离出来,将残留的毛母质清除干净,用移液枪将组织移至新的含pbs溶液的培养皿中;
3)将pbs清洗一次后加入0.2%胶原酶iv,在37℃温度下消化1h~2h,间隔10min观察消化状态,同时用吸管吹打组织,待有毛乳头组织周边的真皮鞘组织全部解离出来后,在显微镜下用移液枪挑选出单个毛乳头组织,放置入一个新的培养皿中;
4)dpc的贴壁培养:将步骤1)中获得的毛乳头组织进行贴壁培养:毛乳头组织在37℃、5%co2培养箱中进行贴壁培养,待组织全部贴壁并有细胞爬出后更换培养基,以后每间隔3天更换一次培养基,待细胞生长融合达到80%进行消化收集获取原代dpc。
所述的一种维持和回复毛乳头细胞干性的外泌体制剂,其特征在于4)中培养基为:基础培养基+10%胎牛血清+10ng/mlegf+10ng/mlbfgf。
所述的一种维持和回复毛乳头细胞干性的外泌体制剂,其特征在于步骤3)中第一次孵育、第二次孵育、第三次孵育的温度均为2-8℃,第一次孵育时间为5min,第二次孵育时间为10min,第三次孵育时间为15min。
所述的一种维持和回复毛乳头细胞干性的外泌体制剂,其特征在于步骤5)中dpc诱导培养基中cd4+cd25+foxp3+treg细胞条件培养基体积占比为30%-70%,优选的dpc诱导培养基中cd4+cd25+foxp3+treg细胞条件培养基体积占比为50%;
所述的一种维持和回复毛乳头细胞干性的外泌体制剂,其特征在于dpc细胞培养上的应用。
本发明与现有技术相比,具有以下有益效果:
1)针对cd4+cd25+foxp3+treg细胞可以激活毛囊再生,对cd4+cd25+foxp3+treg细胞进行培养后收集其细胞条件培养基,过滤去除大的细胞膜碎片,然后作用于dpc。本方法避免cd4+cd25+foxp3+treg细胞在直接应用(细胞移植)中的免疫排斥和替代方法(transwell)中的共培养成本费用高的问题;
2)本发明采用特定的cd4+cd25+foxp3+treg细胞条件培养基进行刺激诱导,有利于dpc分泌特定的对毛囊再生起作用的成分,一定程度上减少外泌体的用量,减少外泌体其他成分的副作用;
3)本发明采用特定的cd4+cd25+foxp3+treg细胞刺激诱导dpc后获取的外泌体,可明显逆转真皮乳头细胞的原始干性,回复其原始形态,这为延长真皮乳头细胞的使用代次提供可能。
附图说明
图1为p3dpc的α-sma免疫组化染色鉴定;
图2为磁珠分选前后treg纯度对比图;
图3为treg条件培养基中jag1的蛋白表达检测;
图4外泌体电镜观察及不同处理组与对照组所获取的外泌体中wnt10b蛋白表达检测;
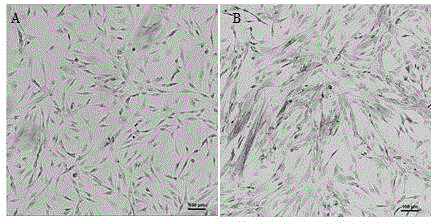
图5为外泌体制剂培养基与dpc培养基培养p10代dpc6d后的状态观察对比图;
图6为外泌体制剂培养基与dpc培养基培养的p10代dpc向成骨、成脂和成软骨细胞诱导后染色观察;
图7为外泌体制剂培养基与dpc培养基培养的p10代dpc中alp(碱性磷酸酶)蛋白表达检测。
具体实施方式
以下结合说明书附图对本发明做进一步详细描述,并给出具体实施方式。
本发明一种维持和回复毛乳头细胞干性的外泌体制剂,该外泌体制剂可以用于配置培养基,外泌体制剂采用以下方法制备及应用:
1)dpc的分离获取,采集患者后枕部区域单位毛囊组织,采用改良二步酶消化法进行实验室dpc的分离培养,具体为:(1)经过手术后的单个毛囊置于毛囊采集液中于4℃环境保存,用含质量分数1%的双抗pbs溶液清洗毛囊组织2~3次;(2)显微镜下用1ml注射器针头将毛球部组织整个分离出来,将残留的毛母质清除干净,用移液枪将组织移至新的含pbs溶液的培养皿中;(3)将pbs清洗一次后加入0.2%胶原酶iv,在37℃温度下消化1h~2h,间隔10min观察消化状态,同时用吸管吹打组织,待有毛乳头组织周边的真皮鞘组织全部解离出来后,在显微镜下用移液枪挑选出单个毛乳头组织,放置入一个新的培养皿中;(4)dpc的贴壁培养:将步骤1)中获得的毛乳头组织进行贴壁培养:毛乳头组织在37℃、5%co2培养箱中进行贴壁培养,待组织全部贴壁并有细胞爬出后更换培养基,以后每间隔3天更换一次培养基,dpc培养基成分:基础培养基+10%胎牛血清+10ng/mlegf+10ng/mlbfgf,待细胞生长融合达到80%进行消化收集获取原代dpc。
如图1所示,a、b分别为对照(成纤维细胞)及dpcα-sma免疫组化染色鉴定。阳性细胞呈棕黄色。注:α-sma为dpc的特异性表面标志物,染色时会被染成棕黄色,而其他细胞不着色。
2)外周血单个核细胞的分离,抽取肝素抗凝静脉血30ml,取6个15ml离心管,每管小心加入淋巴细胞分离液5ml,将5ml外周血沿管壁缓慢置于淋巴细胞分离液层面之上,2000r/min20℃离心20min,收集淋巴细胞层中的淋巴细胞,pbs洗涤2次备用;
3)cd4+cd25+foxp3+treg细胞筛选,macs分选上述步骤获得的外周血单个核细胞进行细胞计数,加pbs洗涤,1200r/min离心后倾上清,以macsbuffer90μl/每107个细胞重悬,加入cd4+t细胞biotin⁃antibody10μl/每107个细胞,混匀,置于2-8℃进行第一次孵育5min,第一次孵育结束后加入20mlanti⁃biotinmicrobeads/每107个细胞,混匀,置于2-8℃进行第二次孵育10mim,第二次孵育结束后,以macsbuffer将细胞调整至500μl体积,过ld柱,收集过柱后流下来的细胞悬液为cd4+t细胞(阴选),将细胞洗涤离心后,以macsbuffer90μl/每107个细胞重悬,加入cd25microbeads,混匀,置于2-8℃进行第三次孵育15min,第三次孵育结束后,加入1-2mlmacsbuffer洗涤离心,弃去上清,重悬至500μl,过ms柱,把separator移开,放置1mlmacsbuffer于ms柱上,迅速将细胞打下,收集流下的为cd4+cd25+t细胞(阳选);
如图2所示,分选前人外周血cd4+cd25+foxp+treg占cd4+t细胞比例约为(8.73±1.65),经过磁珠分选后,cd4+cd25+foxp3+treg细胞的纯度可达(96.46±0.73)%。
4)cd4+cd25+foxp3+treg细胞条件培养基的获取,将筛选获取的cd4+cd25+foxp3+treg细胞接种于细胞培养袋(购于takara),培养15d后,吸取培养基于250ml离心管,800g离心10min,上清液即为cd4+cd25+foxp3+treg细胞条件培养基;
如图3所示,获取的cd4+cd25+foxp3+treg细胞条件培养基中jag1的表达检测,发现所获取的条件培养基中有较多的jag1蛋白表达,而jag1是treg细胞作用于dpc的关键蛋白。
5)dpc诱导培养基的配置,将步骤4)中所获取的cd4+cd25+foxp3+treg细胞条件培养基与dpc培养基按比例进行混合,所得培养基即为dpc诱导培养基;其中,实施例1~3中cd4+cd25+foxp3+treg细胞条件培养基占dpc诱导培养基的体积比分别为:30%,50%,70%;对照组1-2中cd4+cd25+foxp3+treg细胞条件培养基占dpc诱导培养基的体积比10%,90%;对照3为dpc培养基。
6)dpc的诱导培养,待第三代dpc铺满率为70%时,换dpc培养基为dpc诱导培养基,培养48h后,更换培养基为dmem基础培养基;
如图4所示,外泌体电镜观察及不同处理组与对照组所获取的外泌体中wnt10b蛋白表达检测。结果发现,对照组1,2诱导培养基培养获取的dpc外泌体中wnt10b的蛋白含量与对照组3相比表达降低;实施例1,2,3外泌体中wnt10b的蛋白含量与对照组3相比表达增高,其中实施例1较对照组3无显著差异(p>0.05),实施例2,3较对照组3差异极显著(p<0.01),实施例2效果最好。即实施例1,2,3所用的dpc诱导培养基均能促进dpc表达wnt10b蛋白,而对照组1,2所用dpc诱导培养基无效果或者效果相反。注:wnt10b为活化dpc,诱导启动毛囊再生的关键蛋白;图中具有相同字母的组别间对比无差异(p>0.05),具有不同字母的组别间对比差异极显著(p<0.01)。
7)外泌体制剂的制备,在不含血清的基础培养基中培养48h后,收集细胞培养上清液,经超速离心法获取外泌体;用生理盐水或dmem溶解为含dpc外泌体浓度为1*1010颗粒/ml的溶液,即得外泌体制剂;
8)外泌体制剂培养基的制备,将外泌体制剂按1:49的比例添加于dpc培养基(基础培养基+10%胎牛血清+10ng/mlegf+10ng/mlbfgf)即得外泌体制剂培养基。
如图5所示,外泌体制剂培养基与dpc培养基培养6d后的p10代dpc状态观察。结果发现,正常培养的p10代dpc(对照组)已经开始出现细胞形态变化,生长速度变缓,老化等现象;而在培养基中添加外泌体制剂处理后的高代dpc,细胞一定程度上恢复低代dpc特性(细胞的增殖速度,细胞形态,凝集性等)。
如图6所示,外泌体制剂培养基与dpc培养基培养的p10代dpc向成骨、成脂和成软骨细胞诱导后染色观察。处理组成骨、成脂、成软骨诱导后染色,显示出明显的诱导分化能力;对照组没有对应的着色,表明用正常培养的dpc的干性,在p10代时已经丢失干性;而添加外泌体制剂处理后,可明显逆转高代dpc的原始干性。
如图7所示,外泌体制剂培养基与dpc培养基培养的p10代dpc中alp(碱性磷酸酶)蛋白表达检测。结果:处理组细胞中的alp蛋白表达水平明显高于对照组,表明经添加外泌体制剂培养基培养后的高代dpc一定程度上恢复了细胞的原始特性(可能也包括dpc的毛发再生能力)。注:alp基因是dpc的一种凝集能力和干性的标志基因。
- 还没有人留言评论。精彩留言会获得点赞!