环丙烷类化合物及其制备方法和应用与流程
本发明涉及一种环丙烷类化合物及其制备方法和应用。
背景技术:
环丙烷类化合物广泛存在于多种天然产物和药物分子中(chem.soc.rev.1978,7,473.;tetrahedron2001,57,8589.;chem.rev.2003,103,1625.;chem.rev.2007,107,4493.)。目前,该类化合物的制备方法主要为,在钯催化下,亲核试剂与烯丙基底物进行反应。上述方法是构建此类化合物的一种行之有效的方法。但是,现有的成熟的反应体系较少,底物适用性窄,故其应用也受到了限制。因此,开发一种新型、简便、应用面广的方法合成环丙烷化合物具有重要的工业意义。
现有技术中,一般采用含有α-h的酯、酮或者酰胺等羧酸衍生物与烯丙基化合物进行反应制备环丙烷化合物(j.am.chem.soc.1998,120,10391.;tetrahedronlett.1999,40,3597.;j.am.chem.soc.2009,131,8734.;j.org.chem.2014,79,12010.;asianj.org.chem.2017,6,1769.)。文献(angew.chem.,int.ed.engl.1992,31,234.)报道了2-丙氰与金属络合物来制备氰基环丙烷化合物,其中得到的产物中苯基位于环丙烷的同侧;但是含有氰基的底物适用性窄,另一底物还需为金属络合物1,而且合成步骤较多,反应效率不高,生产成本较大。其反应过程如下:
在现有的方法中,烯丙基化合物多为芳基或者烯基取代烯丙基化合物,种类单一。
鉴于环丙烷类化合物的重要性,亟须开发一种底物适用性广、合成步骤少、反应收率高的环丙烷类化合物制备方法,从而高效制备结构类型多样化的环丙烷类化合物。
技术实现要素:
本发明所要解决的技术问题是为了克服现有技术中钯催化环丙烷化反应中反应体系复杂、产物结构单一、生产成本大和收率不高等缺陷,而提供了一种如式i所示的环丙烷类化合物及其制备方法和应用。本发明如式i所示的环丙烷类化合物的制备方法具有底物适用广、反应条件温和后处理简单,能够简单、高效地得到多种类型的环丙烷类化合物。本发明如式i所示的环丙烷类化合物可用来制备环丙烷伯胺类化合物、环丙烷酮类化合物或者环内酰胺类化合物。
本发明通过以下技术方案解决上述技术问题。
本发明提供了一种如式i所示的环丙烷类化合物,
其中,r1和r2独立地为直链c1-10烷基、r1-1取代的直链c1-10烷基、支链c3-10烷基、r1-2取代的支链c3-10烷基、c3-10环烷基、r1-3取代的c3-10环烷基、c3-10杂环烷基、或、r1-4取代的c3-10杂环烷基;所述c3-10杂环烷基为杂原子选自n、o和s中一种或多种,杂原子数为1~4个的c3-10杂环烷基;所述r1-4取代的c3-10杂环烷基中的c3-10杂环烷基为杂原子选自n、o和s中一种或多种,杂原子数为1~4个的c3-10杂环烷基;
r1-1和r1-2独立地为卤素或羟基;r1-3和r1-4独立地为卤素、羟基、直链c1-10烷基、支链c3-10烷基或c1-10烷氧基;
或者,r1、r2及与它们相连的碳一起形成c3-10环烷基、r2-1取代的c3-10环烷基、c3-10杂环烷基、或、r2-2取代的c3-10杂环烷基;所述c3-10杂环烷基为杂原子选自n、o和s中一种或多种,杂原子数为1~4个的c3-10杂环烷基;所述r2-2取代的c3-10杂环烷基中的c3-10杂环烷基为杂原子选自n、o和s中一种或多种,杂原子数为1~4个的c3-10杂环烷基;
r2-1和r2-2独立地为卤素、羟基、直链c1-10烷基、支链c3-10烷基、c1-10烷氧基、氨基或
r3为c1-10烷氧基、c6-30芳基、r3-1取代的c6-30芳基、c3-30杂芳基、r3-2取代的c3-30杂芳基、c2-10炔基、r3-3取代的c2-10炔基、
r3-1和r3-2独立地为直链c1-10烷基、支链c3-10烷基、c1-10烷氧基、卤素、硝基或氰基;r3-3独立地为卤素、c2-10烯基、c1-10烷氧基、c6-30芳基、苯氧基或r3-3-1取代的c6-30芳基;r3-4独立地为c6-30芳基、或、r3-4-1取代的c6-30芳基;r3-5a、r3-5b和r3-5c独立地为直链c1-10烷基或支链c3-10烷基;
r3-3-1和r3-4-1独立地为直链c1-10烷基、支链c3-10烷基、c1-10烷氧基或卤素;
r1-1、r1-2、r1-3、r1-4、r2-1、r2-2、r3-1、r3-2、r3-3、r3-3-1和r3-4-1的个数独立地为1个或多个;当r1-1、r1-2、r1-3、r1-4、r2-1、r2-2、r3-1、r3-2、r3-3、r3-3-1和r3-4-1的个数独立地为多个时,r1-1、r1-2、r1-3、r1-4、r2-1、r2-2、r3-1、r3-2、r3-3、r3-3-1和r3-4-1独立地相同或不同。
所述如式i所示的环丙烷类化合物可为如下所示:
r1和r2中,所述直链c1-10烷基优选直链c1-6烷基,更优选直链c1-3烷基。所述直链c1-3烷基为甲基、乙基或正丙基,优选甲基或乙基。
r1和r2中,所述r1-1取代的直链c1-10烷基中的直链c1-10烷基优选直链c1-6烷基,更优选直链c1-3烷基。
r1和r2中,所述支链c3-10烷基和r1-2取代的支链c3-10烷基中的支链c3-10烷基独立地优选支链c3-6烷基。
r1和r2中,所述c3-10环烷基优选c4-10环烷基,更优选c4-7环烷基。所述c4-7环烷基进一步优选环丁基、环戊基、环己基或环庚基,优选环己基或环庚基。
r1和r2中,所述r2-1取代的c3-10环烷基中的c3-10环烷基优选c4-10环烷基,更优选c4-7环烷基。
r1和r2中,所述c3-10杂环烷基和所述r1-4取代的c3-10杂环烷基中的c3-10杂环烷基独立地优选c4-10杂环烷基,更优选c4-6杂环烷基。
当r1为直链c1-10烷基、r1-1取代的直链c1-10烷基、支链c3-10烷基或r1-2取代的支链c3-10烷基时,r1和r2相同。
当r1、r2及与它们相连的碳一起形成c3-10环烷基时,所述c3-10环烷基优选c4-10环烷基,更优选c4-7环烷基。
当r1、r2及与它们相连的碳一起形成c3-10杂环烷基时,所述c3-10杂环烷基优选c4-10杂环烷基,更优选c4-6杂环烷基,进一步优选杂环己基。
当r1、r2及与它们相连的碳一起形成c3-10杂环烷基时,所述c3-10杂环烷基中的杂原子优选o和/或n,更优选o。
当r1、r2及与它们相连的碳一起形成c3-10杂环烷基时,所述c3-10杂环烷基中的杂原子的个数优选1个或2个,更优选1个。当所述杂原子为多个时,杂原子可相同或不同。
当r1、r2及与它们相连的碳一起形成r2-2取代的c3-10杂环烷基时,所述r2-2取代的c3-10杂环烷基中的c3-10杂环烷基优选c4-10杂环烷基,更优选c4-6杂环烷基,进一步优选杂环己基。
当r1、r2及与它们相连的碳一起形成r2-2取代的c3-10杂环烷基时,所述r2-2取代的c3-10杂环烷基中的杂原子优选o和/或n,更优选n。
当r1、r2及与它们相连的碳一起形成r2-2取代的c3-10杂环烷基时,所述r2-2取代的c3-10杂环烷基中的杂原子的个数为1或2,更优选1。当所述杂原子为多个时,杂原子可相同或不同。
当r1、r2及与它们相连的碳一起形成r2-2取代的c3-10杂环烷基时,所述r2-2取代的c3-10杂环烷基中的c3-10杂环烷基优选c4-10杂环烷基,优选的c4-6杂环烷基,进一步哌啶基。
当r1、r2及与它们相连的碳一起形成r2-2取代的c3-10杂环烷基时,所述r2-2独立地优选卤素、直链c1-10烷基、支链c3-10烷基、c1-10烷氧基或
当r1、r2及与它们相连的碳一起形成r2-2取代的c3-10杂环烷基时,所述r2-2的个数优选1、2或3,更优选1。当所述r2-2为多个时,r2-2可相同或不同。
r1、r2及与它们相连的碳一起形成r2-2取代的c3-10杂环烷基,所述r2-2取代的c3-10杂环烷基优选“卤素、直链c1-10烷基、支链c3-10烷基、c1-10烷氧基或
r3中,所述c6-30芳基和所述r3-1取代的c6-30芳基中的c6-30芳基独立地可为c6-14芳基,优选c6-10芳基,进一步优选苯基或萘基。
r3中,所述r3-1取代的c6-30芳基中的r3-1独立地优选卤素、直链c1-10烷基、支链c3-10烷基或c1-10烷氧基,优选直链c1-10烷基。
r3中,所述r3-1取代的c6-30芳基中的r3-1的个数优选1、2或3个,更优选1个。当所述r3-1为多个时,所述r3-1相同或不同。
r3中,所述r3-1取代的c6-30芳基中的r3-1取代位置优选“芳基与其它基团连接位点”的邻位和/或对位,更优选对位。
r3中,所述r3-1取代的c6-30芳基优选“卤素、直链c1-10烷基、支链c3-10烷基或c1-10烷氧基,个数为1、2或3个,“芳基与其它基团连接位点”的邻位和/或对位”取代的c6-14芳基,更优选“直链c1-10烷基,个数为1个,对位”取代的c6-10芳基,进一步优选
r3-1中,所述直链c1-10烷基优选直链c1-6烷基,更优选直链c1-3烷基,进一步优选甲基。
r3-1中,所述支链c3-10烷基优选支链c3-6烷基,更优选支链c3-4烷基,进一步优选异丙基。
r3-1中,所述c1-10烷氧基优选c1-6烷氧基,更优选c1-3烷氧基,进一步优选甲氧基。
r3中,所述c3-30杂芳基优选c6-14杂芳基,更优选c6-10杂芳基。
r3中,所述c3-30杂芳基中的杂原子的种类优选n和/或o,更优选o。
r3中,所述c3-30杂芳基中的杂原子的个数优选1或2,更优选1。当所述杂原子的个数为多个时,杂原子可相同或不同。
r3中,所述c3-30杂芳基优选“杂原子为n或o,个数为1或2个”的c3-14杂芳基,更优选“杂原子为o,个数为1个”的c3-10杂芳基,进一步优选
r3中,所述c2-10炔基优选c2-7炔基,更优选c4-7炔基,进一步优选
r3中,所述r3-3取代的c2-10炔基中c2-10炔基优选c2-7炔基,更优选c2-5炔基,进一步优选乙炔基、丙炔基、丁炔基或戊炔基。
r3中,所述r3-3取代的c2-10炔基中的r3-3优选卤素、c2-10烯基、c6-30芳基或苯氧基,更优选卤素或c2-10烯基。
r3中,所述r3-3取代的c2-10炔基中的r3-3的个数为1、2或3,优选1个。当所述r3-3的个数为多个时,r3-3可相同或不同。
r3中,所述r3-3取代的c2-10炔基优选“卤素、c2-10烯基、c6-30芳基或苯氧基,个数为1、2或3个”取代的c2-7炔基,更优选“卤素或c2-10烯基,个数为1个”取代的c2-5炔基,进一步优选
r3-3中,所述卤素优选f、cl、br或i,更优选cl。
r3-3中,所述c2-10烯基优选c2-6烯基,更优选c2-3烯基,进一步优选乙烯基。
r3-3中,所述c6-30芳基优选c6-14芳基,更优选c6-10芳基,进一步优选苯基。
r3-4中,所述c6-30芳基优选c6-14芳基,更优选c6-10芳基,进一步优选苯基。
r3-5a、r3-5b和r3-5c中,所述直链c1-10烷基独立地优选直链c1-6烷基,优选直链c1-3烷基,进一步优选甲基。
在某一技术方案中,r1和r2独立地优选c1-10烷基或c3-10环烷基,更优c1-10烷基。
在某一技术方案中,r1和r2独立优选甲基、乙基或环己基,更优选甲基或乙基。
在某一技术方案中,r1、r2及与它们相连的碳一起形成c3-10环烷基、c3-10杂环烷基或r2-2取代的c3-10杂环烷基,更优选r1、r2及与它们相连的碳一起形成c3-10环烷基,最优选r1、r2及与它们相连的碳一起形成c4-7环烷基。
在某一技术方案中,r1、r2及与它们相连的碳一起形成
在某一技术方案中,r3为c6-30芳基、r3-1取代的c6-30芳基、c3-30杂芳基、c2-10炔基、r3-3取代的c2-10炔基、
在某一技术方案中,r3为
在某一技术方案中,r1和r2独立地为c1-10烷基或c3-10环烷基;或者,r1、r2及与它们相连的碳一起形成c3-10环烷基、c3-10杂环烷基或r2-2取代的c3-10杂环烷基;
和,r3为c6-30芳基、r3-1取代的c6-30芳基、c3-30杂芳基、c2-10炔基、r3-3取代的c2-10炔基、
在某一技术方案中,r1和r2为c1-10烷基,或者r1、r2及与它们相连的碳一起形成c3-10环烷基;
和,r3为c6-30芳基、r3-1取代的c6-30芳基、c3-30杂芳基、c2-10炔基或r3-3取代的c2-10炔基。
在某一技术方案中,所述如式i所示的环丙烷类化合物为如下化合物:
本发明还提供了一种如上如式i所示的环丙烷类化合物的制备方法,其包括以下步骤:在保护气体的存在中,在碱性试剂、氮杂环卡宾配体与钯催化剂存在下,将化合物a与化合物b在有机溶剂中进行如下式反应,得到如式i所示的环丙烷类化合物,即可;
其中,m+为k+、na+或li+。
其中,所述保护气体可为本领域常规的保护气体,优选氖气、氩气、氪气、氙气和氡气中的一种或多种,更优选氮气和/或氩气。
其中,所述碱性试剂可为本领域常规碱性试剂,优选六甲基二硅基胺基锂、六甲基二硅基胺基钠、二异丙基氨基锂、碱金属醇盐和碱金属碳酸盐一种或多种,更优选六甲基二硅基胺基锂或/或碱金属醇盐。所述碱金属醇盐可为raona、rbok、rcoli中的一种或多种,其中,ra、rb和rc独立地为c1-4烷基;优选叔丁基。所述raona优选叔丁醇钠。所述rbok优选叔丁醇钾。所述rcoli优选叔丁醇锂。所述碱金属碳酸盐优选碳酸铯和/或碳酸钾。
其中,所述氮杂环卡宾配体可为本领域常规氮杂环卡宾配体,优选非手性氮杂环卡宾配体和/或手性氮杂环卡宾配体。所述非手性氮杂环卡宾配体可为
所述非手性氮杂环卡宾配体优选
其中,所述手性氮杂环卡宾配体可为
所述手性氮杂环卡宾配体优选
其中,所述钯催化剂可为金属钯和/或钯络合物,优选钯络合物。所述钯络合物可为氯化烯丙基钯(ii)二聚物、双二亚苄基丙酮钯、醋酸钯和氯化钯中的一种或多种,优选氯化烯丙基钯(ii)二聚物。
其中,所述有机溶剂可为本领域此类反应种常规有机溶剂,优选醚类溶剂、芳烃类溶剂和烷烃类溶剂中的一种或多种。所述的醚类溶剂可为四氢呋喃、乙二醇二甲醚、乙醚和二氧六环中的一种或多种;优选四氢呋喃。所述的芳烃类溶剂可为甲苯。所述的烷烃类溶剂可为正己烷和/或环己烷;优选正己烷。
其中,所述碱性试剂与所述化合物b的摩尔比值可为本领域此类反应中的常规比值,优选0.1~0.5,优选0.1~0.2,例如0.125。
其中,所述氮杂环卡宾配体与所述化合物b的摩尔比值可为0.01-0.10,优选0.02~0.08,例如0.05。
其中,所述钯催化剂与所述化合物b的摩尔比值可为0.005~0.1,优选0.01~0.04,例如0.025。
其中,所述化合物a与所述的化合物b的摩尔比值可为1~5;优选2~5。
其中,所述有机溶剂的用量可不做具体限定,只要能够溶解底物,不影响反应即可。所述有机溶剂的体积与所述的化合物b的摩尔的体积摩尔比,优选10~20ml/mmol,例如14ml/mmol。
其中,所述化合物a优选
其中,所述化合物a优选
其中,所述化合物b优选
其中,所述反应的温度可为本领域此类反应的常规温度。优选-30℃~50℃,更优选-30℃~40℃。
所述反应的进程可采用本领域中的常规监测方法(例如tlc、或lc-ms)进行监测,一般以所述化合物b不再反应或消失为反应终点。所述反应时间可为1~50h,优选5~48h,例如12h。
所述反应结束后,还可包括下述后处理步骤:淬灭、浓缩和柱层析。所述淬灭的方法可为本领域此类反应的常规的淬灭方法。优选通过加入淬灭剂的方式进行淬灭。所述淬灭剂可为本领域常规的淬灭剂。优选水。所述浓缩的条件和操作可为本领域常规的条件和操作,优选减压浓缩。所述柱层析的洗脱剂可为本领域常规的洗脱剂,优选石油醚和乙酸乙酯。
在某一优选技术方案中,当所述述氮杂环卡宾配体为非手性氮杂环卡宾配体为时,所述如式i所示的环丙烷类化合物的制备方法,得到产物i-a1和产物i-a2;其中,所述产物i-a1与所述产物i-a2的摩尔比值为1:1;
在某一优选技术方案中,当所述述氮杂环卡宾配体为手性氮杂环卡宾配体为时,所述如式i所示的环丙烷类化合物的制备方法,得到产物i-a1和产物i-a2;其中,所述产物i-a1与所述产物i-a2的摩尔比值大于1;
在某一优选技术方案中,所述如式i所示的环丙烷类化合物的制备方法,还可包括以下步骤:步骤一:将所述的碱性试剂、所述氮杂环卡宾配体、所述钯催化剂、所述化合物b以及所述有机溶剂进行混合得到混合溶液;步骤二:将所述化合物a在步骤一得到的混合溶液中进行反应,得到如式i所示的环丙烷类化合物,即可。
本发明中,如式i所示的环丙烷类化合物的制备方法,还包括以下步骤:在卤化银作用下,将化合物c和碱性试剂在有机溶剂中进行如下反应,得到所述化合物a,即可;
其中,r1、r2和m+定义均如前所述。
所述碱性试剂可为本领域该类反应的常规用碱性试剂,优选为碱金属盐。所述碱金属盐可为钠/液氨、氨基钠、二异丙基氨基锂、氢钠、三苯基甲基钠、叔丁醇钠、乙醇钠、叔丁醇钾或六甲基二硅基胺基锂中的一种或多种;更优选六甲基二硅基胺基锂。
所述卤化银可为溴化银、氯化银和碘化银中一种或多种,优选溴化银。
所述有机溶剂如上所述。
所述碱性试剂与所述化合物c的摩尔比值,可为1~5;优选2~4,例如2。
所述卤化银与所述化合物c的摩尔比值,可为0.1~0.5,优选0.125~0.25,例如0.125,又例如0.25。
所述如式i所示的环丙烷类化合物的制备方法中所述化合物a,可不经过后处理直接应用于所述的化合物i的制备。
本发明还提供了一种如式a所示化合物:
其中,r1、r2和m+定义均如前所述。
本发明还提供了一种所述如式i所示的环丙烷类化合物,在制备如式d所示的伯胺类化合物中的应用,
所述应用,优选包括所述如d所示的伯胺类化合物的制备方法,其包括以下步骤:在还原剂作用下,将化合物i在有机溶剂中进行如下式的还原反应,得到化合物d,即可,
所述的还原反应可为本领域此类反应的常规反应。本发明优选以下条件。
所述还原剂可为本领域此类反应常规还原剂。优选金属盐还原剂。所述金属还原剂可为lialh4、dibal-h或nabh4。优选lialh4。
所述有机溶剂可为本领域此类反应常规较溶剂。优选芳烃类溶剂、醚类溶剂和烷烃类溶剂中的一种或多种。所述的芳烃类溶剂优选为甲苯。所述的醚类溶剂优选四氢呋喃、乙二醇二甲醚、乙醚或二氧六环中的一种或多种;所述的烷烃类溶剂优选正己烷。
所述还原反应的反应温度可为-10~50℃,优选0~50℃。
所述还原剂与所述化合物i的摩尔比优选为1:1~1:2,例如1:1。
所述还原反应的反应的进程可以采用本领域的常规监测方法(如tlc、hplc或nmr)进行监测,一般以化合物i消失或不反应为反应终点。所述还原反应的时间可为1h~20h,优选12h。
将上述如式i所示的环丙烷类化合物用于制备上述如d所示的伯胺类化合物,其收率可达96%,纯度可达95%。
本发明还提供了一种所述如式i所示的环丙烷类化合物,在制备如式e所示的酮类化合物的应用,
其中,r4为c6-14芳基或c1-6烷基,x为卤素。
所述应用,优选包括酮类化合物e的制备方法,其包括以下步骤:在格氏试剂的作用下,将化合物i在有机溶剂中进行如下式的加成反应,得到化合物e,即可,
其中,r4为c6-14芳基或c1-6烷基,x为卤素。
所述加成反应可为本领域此类反应常规反应,优选以下条件:
所述有机溶剂可为本领域此类反应常规有机溶剂。优选卤代烷烃类溶剂醚类溶剂或芳烃类溶剂中的一种或多种。所述卤代烷烃类溶剂可为二氯甲烷和/或氯仿。所述醚类溶剂可为四氢呋喃、二氧六环、乙醚或乙二醇二甲醚中的一种或多种,优选乙醚。所述的芳烃类溶剂优选甲苯。
所述的格氏试剂为本领域此类反应的常规格式试剂。
所述格氏试剂与所述的化合物i摩尔的比值可为1~3,例如1.1。
所述加成反应的反应温度可为0~100℃,优选60~90℃,例如80℃。
所述加成反应的反应进程可以采用本领域中的常规监测方法(如tlc、hplc或nmr)进行监测,一般以化合物i消失时为反应终点。所述的反应的时间可为1h~20h,优选5h~15h,更优选12h。
将上述如式i所示的环丙烷类化合物用于制备上述如式e所示的酮类化合物,其收率可达75%,纯度可达95%。
本发明还提供了一种所述如式i所示的环丙烷类化合物,在制备如式f所示的环内酰胺类化合物的应用,
所述应用,优选还包括所述化合物f的制备方法,其包括以下步骤:在无机酸作用下,所述化合物i在溶剂中进行如下反应,得到化合物f,即可,
所述的无机酸为本领域中常规无机酸。本发明优选盐酸、硫酸和乙酸一种或多种。
所述反应的反应温度可为25~150℃,优选为60~150℃,例如110℃。
所述反应的反应进程可以采用本领域中的常规监测方法(如tlc、hplc或nmr)进行监测,一般以化合物ii消失时为反应终点。所述反应时的间可为1h~20h,优选5h~15h,例如12h。
将上述如式i所示的环丙烷类化合物用于制备上述如f所示的环内酰胺类化合物,其收率可达52%,纯度可达95%。
本发明中,当取代基的取代位置在“芳基与其它基团连接位点”的邻位和/或者对位时,“芳基与其它基团连接位点”中的芳基为苯基。
本发明,“杂环基”是指包含1~4个杂原子(如氮、氧和硫中的一种或多种)的4~12元单环,其中每个环可以含有一个或多个双键,但没有一个环具有完全共轭的π电子体系,例如
本发明中,“c1-10烷基”未作限定时,均包括直链和支链的c1-10烷基烷基。
本发明中,i-propanol为异丙醇。
本发明中,-oboc为
本发明中,室温为10~30℃。
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:本发明环丙烷类化合物的制备方法底物适用广,反应条件温和,后处理简单,环境友好,适合于工业化生产。采用本发明的制备方法能够简单、高效的制备得到多种类型的环丙烷类化合物。
附图说明
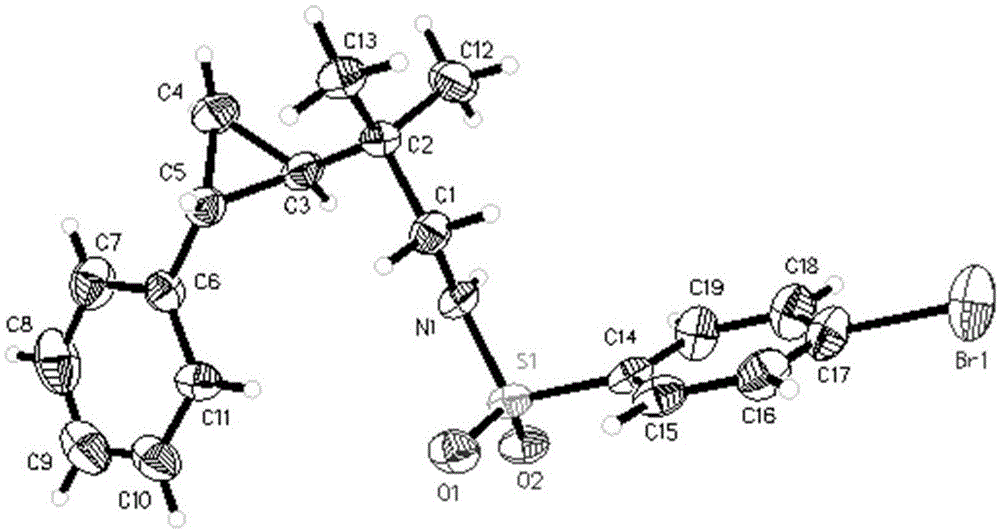
图1为实施例48中如式1所示的化合物的单晶的x-射线单晶衍射图。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
实施例1
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.05mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(其结构式是
1hnmr(400mhz,cdcl3):δ7.27-7.23(m,2h),7.17-7.14(m,1h),7.08-7.06(m,2h),2.12-2.03(m,3h),1.75-1.73(m,3h),1.67-1.57(m,2h),1.45-1.39(m,2h),1.24-1.17(m,2h),1.11-1.06(m,1h),1.01-0.95(m,1h);13cnmr(101mhz,cdcl3):δ141.8,128.4,126.1,125.9,121.5,41.8,36.0,35.8,30.2,25.3,23.1(2c),19.8,11.9;ir(neat):3063,3028,2932,2857,2233,2210,1605,1499,1450,752,697cm-1;ms(ei)m/z(rel):225(m+,12),180(5),117(100),104(7),91(11),73(12),53(1);hrms(ei):calcdforc16h19n:225.1517,found:225.1524。
实施例2
氩气条件下,将
1hnmr(400mhz,cdcl3):δ7.29-7.25(m,2h),7.20-7.16(m,1h),7.10-7.08(m,2h),2.21-2.16(m,2h),2.12-2.07(m,1h),1.90-1.79(m,6h),1.24-1.17(m,2h),1.07-1.02(m,1h);13cnmr(101mhz,cdcl3):δ141.6,128.4,126.0,125.9,123.4,45.2,38.1(2c),28.4,24.3(2c),20.8,12.8;ir(neat):3027,3003,2962,2874,2232,1605,1498,1453,1030,754,697cm-1;ms(ei)m/z(rel):211(m+,12),184(5),141(7),117(100),104(13),91(12),77(3),51(2);hrms(ei):calcdforc15h17n:211.1361,found:211.1365。
实施例3
氩气条件下,将
1hnmr(400mhz,cdcl3):δ7.29-7.25(m,2h),7.20-7.16(m,1h),7.10-7.08(m,2h),2.20-2.10(m,3h),1.76-1.49(m,10h),1.25-1.15(m,2h),1.05-1.00(m,1h);13cnmr(101mhz,cdcl3):δ141.8,128.4,126.0,125.9,122.3,44.8,38.8,38.6,31.2,27.9(2c),23.7,23.6,20.1,12.8;ir(neat):3063,3027,2927,2857,2231,1735,1604,1497,1460,1255,1155,1034,838,751,696cm-1;ms(ei)m/z(rel):239(m+,3),154(2),122(6),117(100),115(18),104(13),91(17),77(5),57(38),41(13);hrms(ei):calcdforc17h21n:239.1674,found:239.1686.
实施例4
氩气条件下,将
1hnmr(400mhz,cdcl3):δ7.28-7.24(m,2h),7.19-7.15(m,1h),7.08-7.06(m,2h),4.00-3.94(m,2h),3.70(dt,j=12.0,2.0hz,2h),2.16-2.11(m,1h),1.97-1.91(m,2h),1.82-1.74(m,2h),1.25-1.20(m,1h),1.17-1.12(m,1h),1.06-1.01(m,1h);13cnmr(101mhz,cdcl3):δ142.6,130.0,127.5,127.4,121.9,66.1,40.9,36.9,36.7,31.1,21.0,13.0;ir(neat):3063,2957,2925,2852,2233,1736,1604,1498,1465,1443,1243,1143,1103,1032,835,757,697cm-1;ms(ei)m/z(rel):227(m+,8),141(4),117(100),104(7),91(21),77(5),57(9),41(3);hrms(ei):calcdforc15h17no:227.1310,found:227.1307.
实施例5
氩气条件下,将
1hnmr(400mhz,cdcl3):δ7.29-7.25(m,2h),7.20-7.16(m,1h),7.08-7.06(m,2h),4.14-4.09(m,2h),3.04(br,2h),2.17-2.12(m,1h),2.03-1.98(m,2h),1.68-1.57(m,2h),1.46(s,9h),1.27-1.21(m,1h),1.14-1.09(m,1h),1.07-1.02(m,1h);13cnmr(101mhz,cdcl3):δ154.4,141.1,128.5,126.1(2c),120.2,80.1,40.7,34.8,29.3,28.4,19.8,11.8;ir(neat):3005,2975,2864,2234,1691,1605,1421,1278,1159,863,760,697cm-1;ms(ei)m/z(rel):326(m+,2),270(45),253(32),226(100),135(50),117(56),94(24),57(77),51(3);hrms(esi):calcdforc20h26n2nao2[m+na]+:349.1886,found:349.1887.
实施例6
氩气条件下,将
1hnmr(400mhz,cdcl3):δ7.30-7.26(m,2h),7.20-7.16(m,1h),7.11-7.09(m,2h),2.12-2.07(m,1h),1.48(s,3h),1.47(s,3h),1.21-1.11(m,2h),1.06-1.01(m,1h);13cnmr(101mhz,cdcl3):δ141.6,128.4,126.0(2c),122.9,34.9,30.8,26.7(2c),20.6,12.6;ir(neat):3029,2978,2935,2236,1605,1498,1466,753,697cm-1;ms(ei)m/z(rel):185(m+,10),143(13),117(100),104(8),91(13),77(6),65(3),51(3);hrms(ei):calcdforc13h15n:185.1204,found:185.1201.
实施例7
氩气条件下,将
1hnmr(400mhz,cdcl3):δ7.30-7.26(m,2h),7.20-7.16(m,1h),7.09-7.06(m,2h),2.08-2.04(m,1h),1.86-1.66(m,4h),1.22-1.17(m,1h),1.13(t,j=7.6hz,3h),1.09-1.04(m,4h),0.99-0.94(m,1h);13cnmr(101mhz,cdcl3):δ141.7,128.5,125.9,125.8,121.0,45.3,31.4,31.3,28.1,20.3,12.5,9.6,9.4;ir(neat):3065,3028,2970,2938,2881,2232,1739,1605,1497,1460,1383,1156,1113,1027,884,751,697cm-1;ms(ei)m/z(rel):213(m+,3),157(4),129(5),117(100),104(13),91(16),77(5),51(3));hrms(ei):calcdforc15h19n:213.1517,found:213.1521.
实施例8
氩气条件下,将
1hnmr(400mhz,cdcl3):(takenasamixtureofdiastereomers):δ7.30-7.25(m,2.45h),7.20-7.16(m,1.26h),7.10-7.05(m,2.44h),2.15-2.10(m,1h),2.03-2.00(m,0.24h),1.95-1.91(m,2.42h),1.86-1.76(m,2.42h),1.71-1.64(m,1.29h),1.53-1.47(m,1.33h),1.42(s,3h),1.30-1.13(m,8.65h),1.12-1.04(m,2.52h),1.01-0.97(m,1h);13cnmr(101mhz,cdcl3):(takenasamixtureofdiastereomers):δ141.9,141.5,128.4(2c),125.9(2c),125.8,121.6,121.5,46.6(2c),44.3,44.0,28.6,28.5(2c),28.4,28.3,27.9,26.3(3c),26.1,26.0,25.9,24.4,22.8(2c),22.1,19.6,14.5,11.8;ir(neat):3064,2927,2854,2232,1737,1604,1497,1450,1376,1277,1256,933,889,843,753,697cm-1;ms(ei)m/z(rel):253(m+,3),170(13),156(9),128(6),117(100),104(18),91(16),77(5),55(18),41(10);hrms(ei):calcdforc18h23n:253.1830,found:253.1826.
实施例9
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.05mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(6.08mg,0.008mmol),ipr*·hcl(18.0mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.04-7.00(m,2h),6.83-6.79(m,2h),3.78(s,3h),2.10-2.03(m,3h),1.77-1.74(m,3h),1.68-1.58(m,2h),1.45(m,2h),1.25-1.19(m,1h),1.17-1.12(m,1h),1.05-1.00(m,1h),0.95-0.90(m,1h);13cnmr(101mhz,cdcl3):δ157.9,133.8,127.3,121.6,113.8,55.3,41.7,36.0,35.8,29.7,25.3,23.1,23.0,19.1,11.4;ir(neat):3078,2923,2854,2231,1608,1514,1456,1444,1246,1175,1028,828,815,697cm-1;ms(ei)m/z(rel):255(m+,5),225(13),147(23),117(100),104(7),91(12),57(4);hrms(ei):calcdforc17h21no:255.1623,found:225.1621.
实施例10
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.05mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.24-7.21(m,2h),7.02-6.99(m,2h),2.10-2.03(m,3h),1.78-1.74(m,3h),1.68-1.61(m,2h),1.47-1.37(m,2h),1.25-1.19(m,2h),1.08-1.03(m,1h),0.99-0.95(m,1h);13cnmr(101mhz,cdcl3):δ140.3,131.5,128.5,127.4,121.3,41.7,36.0,35.7,30.4,25.2,23.1,23.0,19.3,11.9;ir(neat):3010,2923,2855,2235,1493,1450,1085,1011,891,811,646cm-1;ms(ei)m/z(rel):259(m+,12),151(100),147(13),115(24),91(3),57(4);hrms(ei):calcdforc16h18ncl:259.1128,found:259.1129.
实施例11
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.05mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.17-7.10(m,3h),6.95-6.91(m,1h),2.45(s,3h),2.17-2.07(m,3h),1.82-1.77(m,3h),1.72-1.60(m,2h),1.55-1.41(m,2h),1.30-1.15(m,3h),0.94-0.87(m,1h);13cnmr(101mhz,cdcl3):δ139.3,137.5,129.8,126.1,125.9,125.3,121.6,41.6,36.6,35.8,28.7,25.3,23.2,23.1,19.9,17.8,10.7;ir(neat):3067,2932,2857,2232,1739,1604,1494,1450,1265,1162,1113,891,757,732cm-1;ms(ei)m/z(rel):239(m+,7),131(100),115(13),105(6),91(14),77(5),55(2),41(3);hrms(ei):calcdforc17h21n:239.1674,found:239.1678.
实施例12
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.05mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.18-7.14(t,j=7.6hz,1h),7.00-6.98(d,j=7.6hz,1h),6.90-6.88(m,2h),2.32(s,3h),2.11-2.05(m,3h),1.79-1.74(m,3h),1.69-1.59(m,2h),1.50-1.39(m,2h),1.26-1.16(m,2h),1.12-1.07(m,1h),1.02-0.97(m,1h);13cnmr(101mhz,cdcl3):δ141.8,138.0,128.3,126.9,126.7,123.1,121.5,41.8,36.0,35.8,30.1,25.3,23.1(2c),21.4,19.8,11.9;ir(neat):3009,2931,2857,2233,1738,1607,1491,1449,1272,1038,904,780,698cm-1;ms(ei)m/z(rel):239(m+,7),131(100),115(11),105(6),91(12),77(4),41(3);hrms(ei):calcdforc17h21n:239.1674,found:239.1667.
实施例13
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.05mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.09-6.98(m,4h),2.31(s,3h),2.11-2.04(m,3h),1.77-1.75(m,3h),1.65-1.59(m,2h),1.47-1.38(m,2h),1.26-1.15(m,2h),1.09-1.04(m,1h),0.99-0.94(m,1h);13cnmr(101mhz,cdcl3):δ138.8,135.5,129.1,126.0,121.6,41.8,36.0,35.8,30.0,25.3,23.1(2c),21.0,19.5,11.7;ir(neat):3077,3003,2928,2854,2236,1740,1514,1450,1260,1090,942,806,712cm-1;ms(ei)m/z(rel):239(m+,7),131(100),115(11),105(6),91(12),77(4),41(4);hrms(ei):calcdforc17h21n:239.1674,found:239.1677.
实施例14
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.05mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.15-7.01(m,4h),2.87(hept,j=6.8hz,1h),2.11-2.05(m,3h),1.77-1.75(m,3h),1.68-1.60(m,2h),1.47-1.39(m,2h),1.24(d,j=6.8hz,6h),1.20-1.15(m,2h),1.11-1.07(m,1h),0.99-0.94(m,1h);13cnmr(101mhz,cdcl3):δ146.5,139.2,126.4,126.1,121.6,41.8,36.0,35.9,33.7,29.9,25.3,24.0,23.1(2c),19.5,11.8;ir(neat):3070,2934,2858,2229,1613,1516,1445,1106,1047,926,890,820cm-1;ms(ei)m/z(rel):267(m+,9),224(5),197(4),159(25),131(14),117(100),91(14),77(7),57(39),43(40);hrms(ei):calcdforc19h25n:267.1987,found:267.1989.
实施例15
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.05mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.81-7.75(m,3h),7.54(s,1h),7.48-7.40(m,2h),7.22(d,j=10.8hz,1h),2.32-2.27(m,1h),2.13(t,j=13.6hz,2h),1.79-1.76(m,3h),1.71-1.59(m,2h),1.51-1.44(m,2h),1.32-1.12(m,4h);13cnmr(101mhz,cdcl3):δ139.3,133.4,132.0,128.1,127.6,127.3,126.2,125.2,124.9,124.2,121.5,41.9,36.0,35.9,30.4,25.3,23.1,23.0,20.1,11.9;ir(neat):3073,2936,2854,2237,1759,1729,1507,1401,1260,1084,906,849,812,744cm-1;ms(ei)m/z(rel):275(m+,13),201(6),167(100),152(16),117(15),107(8),91(6),77(7),41(6);hrms(ei):calcdforc20h21n:275.1674,found:275.1673.
实施例16
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.05mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.23-7.22(m,1h),6.27-6.25(m,1h),5.98(d,j=3.2hz,1h),2.13-2.02(m,3h),1.78-1.74(m,3h),1.67-1.57(m,2h),1.49-1.38(m,2h),1.26-1.19(m,2h),1.17-1.11(m,1h),1.07-1.03(m,1h);13cnmr(101mhz,cdcl3):δ155.2,140.6,121.2,110.3,104.1,41.4,35.8,35.7,27.8,25.3,23.0,13.2,10.2;ir(neat):3468,3118,2933,2858,2234,1700,1601,1449,1400,1184,1148,1014,919,798,732,700cm-1;ms(ei)m/z(rel):215(m+,6),107(100),94(11),79(19),53(5),41(4);hrms(ei):calcdforc14h17no:215.1310,found:215.1315.
实施例17
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.10mmol),四甲基乙二胺(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ2.09(t,j=6.8hz,2h),2.04(d,j=13.2hz,1h),1.95(d,j=13.2hz,1h),1.75-1.72(m,3h),1.60-1.54(m,2h),1.48-1.31(m,7h),1.24-1.15(m,1h),1.09-1.05(m,1h),0.97-0.92(m,1h),0.89(t,j=6.8hz,3h),0.85-0.81(m,1h);13cnmr(101mhz,cdcl3):δ120.8,81.2,76.7,41.2,35.7,35.6,31.0,29.0,25.2,23.0,21.9,18.4,13.6,11.8,4.0;ir(neat):3008,2932,2859,2233,1737,1450,1253,1095,931,844,696cm-1;ms(ei)m/z(rel):229(m+,7),200(6),180(22),166(13),121(20),113(14),109(18),93(30),79(51),73(100),67(27),57(36),45(9);hrms(ei):calcdforc16h23n:229.1830,found:229.1838.
实施例18
氩气条件下,将
1hnmr(400mhz,cdcl3):δ2.10-2.06(m,4h),1.80-1.70(m,6h),1.45-1.29(m,5h),1.18-1.13(m,1h),0.94-0.82(m,5h);13cnmr(101mhz,cdcl3):δ122.8,80.9,77.0,44.6,38.1,37.9,31.0,27.2,24.3(2c),21.9,18.4,13.6,12.7,5.1;ir(neat):3009,2958,2932,2872,2233,1716,1620,1452,1364,1256,1043,958,909,750cm-1;ms(ei)m/z(rel):215(m+,16),186(12),172(15),121(23),108(26),93(74),79(100),67(28),55(24),51(10);hrms(ei):calcdforc15h21n:215.1674,found:215.1677.
实施例19
氩气条件下,将
1hnmr(400mhz,cdcl3):δ2.16-2.03(m,4h),1.78-1.65(m,8h),1.56-1.32(m,7h),1.17-1.12(m,1h),0.99-0.94(m,1h),0.90(t,j=7.2hz,3h),0.88-0.85(m,1h);13cnmr(101mhz,cdcl3):δ121.6,81.2,76.9,44.2,38.5(2c),31.0,30.0,27.8,23.6,23.5,21.9,18.4,13.6,12.6,5.0;ir(neat):3008,2928,2859,2232,1718,1460,1257,1075,1043,887,843,803,749cm-1;ms(ei)m/z(rel):243(m+,11),214(11),136(16),121(39),93(70),79(100),67(36),55(36);hrms(ei):calcdforc17h25n:243.1987,found:243.1993.
实施例20
氩气条件下,将
1hnmr(400mhz,cdcl3):δ3.96-3.93(m,2h),3.64(tt,j=12.0,2.4hz,2h),2.08(td,j=7.2,1.2hz,2h),1.93-1.89(m,1h),1.84-1.67(m,3h),1.44-1.29(m,5h),1.14-1.09(m,1h),0.99-0.94(m,1h),0.89-0.84(m,4h);13cnmr(101mhz,cdcl3):δ119.8,80.6,77.2,64.6(2c),39.1,35.3,35.2,30.9,28.5,21.9,18.4,13.6,11.6,4.0;ir(neat):3009,2956,2928,2855,2237,1739,1465,1389,1243,1192,1143,1104,943,845,750cm-1;ms(ei)m/z(rel):231(m+,18),202(7),174(19),160(18),146(23),134(24),119(26),108(23),93(53),79(100),67(33),55(35),51(12);hrms(ei):calcdforc15h21no:231.1623,found:231.1629.
实施例21
氩气条件下,将
1hnmr(400mhz,cdcl3):δ4.11(br,2h),2.99(br,2h),2.09(t,j=5.6hz,2h),1.99-1.86(m,2h),1.66-1.51(m,2h),1.45-1.34(m,14h),1.10-1.05(m,1h),1.00-0.95(m,1h),0.90-0.86(m,4h);13cnmr(101mhz,cdcl3):δ154.4,119.5,80.5,80.1,77.2,40.1,34.7,30.9,28.4,28.2,21.9,18.4,13.6,11.7,4.2;ir(neat):3007,2931,2864,2236,1694,1420,1366,1278,1248,1159,1108,1022,862,769cm-1;ms(ei)m/z(rel):330(m+,1),274(28),257(9),230(14),187(35),94(21),57(100),51(3);hrms(ei):calcdforc20h30n2o2:330.2307,found:330.2298.
实施例22
氩气条件下,将
1hnmr(400mhz,cdcl3):δ2.10(t,j=6.8hz,2h),1.44-1.33(m,11h),1.11-1.06(m,1h),0.94-0.83(m,5h);13cnmr(101mhz,cdcl3):δ122.3,80.9,77.0,34.4,31.0,29.7,26.5(2c),21.9,18.4,13.6,12.5,4.8;ir(neat):3084,2959,2933,2872,2237,1717,1620,1464,1368,1328,1254,1188,1101,1076,1044,920,885,803,751cm-1;ms(ei)m/z(rel):189(m+,17),174(30),151(16),121(26),105(20).91(57),79(100),67(29),55(30),51(12);hrms(ei):calcdforc13h19n:189.1517,found:189.1514.
实施例23
氩气条件下,将
1hnmr(400mhz,cdcl3):δ2.10-2.07(m,2h),1.83-1.60(m,4h),1.45-1.30(m,5h),1.10(t,j=7.2hz,3h),1.04(t,j=7.2hz,3h),0.94-0.82(m,6h);13cnmr(101mhz,cdcl3):δ120.3,81.0,76.9,44.6,31.2,31.1,31.0,26.5,21.9,18.4,13.6,11.9,9.4,9.2,4.7;ir(neat):3084,2965,2933,2866,2233,1718,1620,1461,1383,1258,1103,1078,1045,903,886,786cm-1;ms(ei)m/z(rel):217(m+,6),188(16),174(13),121(32),105(14),93(66),79(100),67(27),55(29),51(8);hrms(ei):calcdforc15h23n:217.1830,found:217.1826.
实施例24
氩气条件下,将
1hnmr(400mhz,cdcl3):(takenasamixtureofdiastereomers):δ2.11-1.68(m,10.16h),1.49-0.94(m,23.19h),0.91-0.87(m,4h),0.83-0.79(m,1.80h);13cnmr(101mhz,cdcl3):(takenasamixtureofdiastereomers):δ121.0,120.8,81.2,80.9,77.1,76.8,46.5,46.4,43.6,43.4,31.0(2c),28.5,28.4(2c),28.2,27.3,27.2,26.3(3c),26.0,22.9,22.4,21.9(2c),18.4,14.2,13.6,11.1,6.8,3.9;ir(neat):3084,2928,2856,2233,1451,1377,1255,1103,1044,928,891,839,798,750cm-1;ms(ei)m/z(rel):257(m+,11),242(7),228(22),214(24),200(9),174(21),160(15),150(27),132(72),121(47),107(24),93(90),79(100),67(35),55(75);hrms(ei):calcdforc17h28n:257.2143,found:257.2148.
实施例25
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.10mmol),四甲基乙二胺(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ2.10-2.06(m,3h),1.95(d,j=12.8hz,1h),1.74-1.72(m,3h),1.60-1.53(m,2h),1.47-1.37(m,5h),1.34-1.29(m,4h),1.24-1.18(m,1h),1.09-1.04(m,1h),0.97-0.80(m,5h);13cnmr(101mhz,cdcl3):δ120.8,81.2,76.8,41.2,35.7,35.6,31.0,29.0,28.6,25.2,23.0,22.2,18.7,14.0,11.8,4.1;ir(neat):3009,2931,2858,2233,1737,1451,1257,1093,1074,861,805,731cm-1;ms(ei)m/z(rel):243(m+,8),228(4),200(16),186(13),174(7),135(25),107(36),93(89),79(100),67(44),55(35);hrms(ei):calcdforc17h25n:243.1987,found:243.1991.
实施例26
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.10mmol),四甲基乙二胺(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ2.07-1.94(m,4h),1.75-1.72(m,4h),1.62-1.55(m,2h),1.49-1.31(m,3h),1.26-1.19(m,1h),1.10-1.06(m,1h),1.00-0.93(m,7h),0.87-0.82(m,1h);13cnmr(101mhz,cdcl3):δ120.9,82.1,75.6,41.2,35.7,35.6,29.1,28.2,27.9,25.2,23.0,21.9,11.8,4.1;ir(neat):3008,2933,2861,2233,1737,1450,1278,1254,1105,1073,960,886,861,844,809,751cm-1;ms(ei)m/z(rel):229(m+,18),214(15),186(15),160(11),121(100),109(22),93(69),79(53),73(30),67(19),57(39),53(11);hrms(ei):calcdforc16h23n:229.1830,found:229.1835.
实施例27
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.10mmol),四甲基乙二胺(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ2.50-2.43(m,1h),2.03(d,j=13.2hz,1h),1.94(d,j=13.2hz,1h),1.74-1.72(m,3h),1.63-1.52(m,2h),1.49-1.33(m,3h),1.23-1.14(m,1h),1.11-1.02(m,7h),0.97-0.92(m,1h),0.84-0.80(m,1h);13cnmr(101mhz,cdcl3):δ120.9,82.3,80.4,41.2,35.7,35.6,29.1,25.2,23.2,23.0,20.4,11.9,4.0;ir(neat):2934,2860,2237,1710,1450,1359,1260,1090,1069,1000,852,809cm-1;ms(ei)m/z(rel):215(m+,16),200(14),172(16),156(13),146(17),131(20),121(25),105(100),95(79),91(74),79(98),65(34),55(34);hrms(ei):calcdforc15h21n:215.1674,found:215.1666.
实施例28
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.10mmol),四甲基乙二胺(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ2.04(d,j=12.8hz,1h),1.94(d,j=12.8hz,1h),1.75-1.73(m,3h),1.63-1.51(m,2h),1.49-1.34(m,3h),1.25-1.17(m,1h),1.15(s,9h),1.08-1.03(m,1h),0.97-0.92(m,1h),0.83-0.78(m,1h);13cnmr(101mhz,cdcl3):δ120.9,85.1,79.6,41.2,35.7,35.6,31.2,29.1,27.2,25.2,23.0,12.0,4.0;ir(neat):2926,2857,2231,1739,1451,1363,1260,1088,1020,926,800,731,700cm-1;ms(ei)m/z(rel):229(m+,16),214(19),121(32),105(36),93(100),79(34),55(10);hrms(ei):calcdforc16h23n:229.1830,found:229.1828.
实施例29
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.10mmol),四甲基乙二胺(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ3.61(t,j=6.4hz,2h),2.30(td,j=6.8,1.6hz,2h),2.05-2.02(m,1h),1.99-1.86(m,3h),1.75-1.73(m,3h),1.66-1.53(m,2h),1.48-1.33(m,3h),1.27-1.15(m,1h),1.11-1.06(m,1h),0.99-0.94(m,1h),0.86-0.82(m,1h);13cnmr(101mhz,cdcl3):δ120.8,82.4,74.6,43.7,41.2,35.7,35.6,31.6,29.0,25.2,23.0,16.2,11.8,3.9;ir(neat):3007,2932,2858,2234,1736,1449,1288,1154,1011,884,860,724,652cm-1;ms(ei)m/z(rel):249(m+,8),214(11),141(100),122(22),105(39),91(29),77(40),65(15),57(11);hrms(ei):calcdforc15h20ncl:249.1284,found:249.1289.
实施例30
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.10mmol),四甲基乙二胺(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(3.8mg,0.005mmol),ipr*·hcl(18.0mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.28(t,j=7.6hz,2h),6.98-6.91(m,3h),4.61(s,2h),2.01(d,j=13.2hz,1h),1.93(d,j=13.2hz,1h),1.74-1.71(m,3h),1.61-1.55(m,1h),1.52-1.33(m,4h),1.23-1.13(m,2h),1.04-0.99(m,1h),0.94-0.90(m,1h);13cnmr(101mhz,cdcl3):δ157.7,129.4,121.3,120.6,114.8,89.1,71.3,56.4,41.2,35.7,35.6,29.2,25.2,22.9,12.0,3.9;ir(neat):3009,2926,2857,2239,1599,1496,1453,1377,1230,1016,991,885,820,748,688cm-1;ms(ei)m/z(rel):279(m+,11),264(12),236(12),224(11),186(32),171(100),158(31),144(49),131(38),117(39),105(30),94(64),77(68),65(64),51(25);hrms(ei):calcdforc19h21no:279.1623,found:279.1630.
实施例31
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.10mmol),四甲基乙二胺(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ5.85-5.80(m,1h),5.06-4.99(m,2h),2.31-2.19(m,4h),2.03(d,j=12.8hz,1h),1.95(d,j=12.8hz,1h),1.75-1.72(m,3h),1.63-1.53(m,2h),1.48-1.30(m,3h),1.24-1.18(m,1h),1.10-1.05(m,1h),0.98-0.93(m,1h),0.86-0.81(m,1h);13cnmr(101mhz,cdcl3):δ137.1,120.8,115.5,81.8,75.9,41.2,35.7,35.6,33.2,29.0,25.2,23.0,18.6,11.8,4.0;ir(neat):3079,3006,2932,2858,2233,1641,1449,1261,994,913,861,826,626cm-1;ms(ei)m/z(rel):227(m+,5),198(6),184(7),170(7),158(7),144(7),130(8),119(82),105(17),91(100),79(24),67(18),53(9);hrms(ei):calcdforc16h21n:227.1674,found:227.1675.
实施例32
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.10mmol),四甲基乙二胺(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(0.38mg,0.001mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.36-7.26(m,5h),2.11(d,j=13.2hz,1h),2.00(d,j=13.2hz,1h),1.81-1.75(m,3h),1.69-1.60(m,3h),1.54-1.39(m,2h),1.30-1.21(m,2h),1.16-1.10(m,1h),1.07-1.02(m,1h);13cnmr(101mhz,cdcl3):δ131.6,128.2,127.7,123.5,120.7,91.2,41.32,35.8,35.7,29.5,25.2,23.0,12.4,4.6;ir(neat):3014,2930,2856,2230,1598,1491,1448,1253,943,913,844,755,691cm-1;ms(ei)m/z(rel):249(m+,8),193(6),180(7),159(10),141(40),126(13),111(12),97(18),83(24),73(100),57(40),45(16);hrms(ei):calcdforc18h19n:249.1517,found:249.1511.
实施例33
氩气条件下,将环己基甲腈(0.4mmol),1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入1.2ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ2.04-1.91(m,2h),1.75-1.72(m,3h),1.64-1.54(m,2h),1.42-1.30(m,2h),1.28-1.14(m,1h),0.79-0.74(m,1h),0.67-0.62(m,1h),0.44-0.40(m,1h),-0.05(s,9h),-0.15--0.21(m,1h);13cnmr(101mhz,cdcl3):δ121.6,42.5,36.2,36.1,25.4,23.6,23.2,23.1,5.6,1.1,-2.6;ir(neat):3062,2935.2859,2235,1738,1451,1249,1080,1019,891,835,751.692cm-1;ms(ei)m/z(rel):221(m+,2),179(31),151(16),122(74),107(50),100(38),93(28),73(100),59(20),45(12);hrms(ei):calcdforc13h23nsi:221.1600,found:221.1602.
实施例34
氩气条件下,将
1hnmr(400mhz,cdcl3):δ2.13-1.99(m,2h),1.69-1.47(m,10h),0.79-0.70(m,2h),0.46-0.41(m,1h),-0.05(s,9h),-0.12--0.20(m,1h);13cnmr(101mhz,cdcl3):δ122.4,45.4,39.0,38.9,27.9,27.8,24.6,23.6,6.4,2.1,-2.5;ir(neat):3061,2930,2858,2231,1739,1459,1248,981,876,832,749,691,673cm-1;ms(ei)m/z(rel):235(m+,2),220(5),193(20),166(10),136(32),121(57),107(36),100(23),94(26),73(100),59(20),45(13);hrms(ei):calcdforc14h25nsi:235.1756,found:221.1748.
实施例35
氩气条件下,将
1hnmr(400mhz,cdcl3):δ1.81-1.59(m,4h),1.09-1.01(m,6h),0.75-0.71(m,1h),0.59-0.54(m,1h),0.46-0.42(m,1h),-0.05(s,9h),-0.19--0.25(m,1h);13cnmr(101mhz,cdcl3):δ121.2,45.8,31.3,30.9,20.9,9.4,9.1,6.4,1.1,-2.4;ir(neat):3063,2955,2884,2232,1741,1249,1094,1039,1012,901,879,834,749,692cm-1;ms(ei)m/z(rel):209(m+,1),180(25),110(52),100(18),95(24),81(43),73(100),59(16),45(10);hrms(ei):calcdforc12h23nsi:209.1600,found:209.1599.
实施例36
氩气条件下,将环己基甲腈(0.4mmol),溴化银(0.10mmol),1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入0.8ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),ipr*·hcl(9.5mg,0.01mmol)和四氢呋喃(1.0ml),0℃下加入25μl叔丁醇钾(1.0minthf),室温搅拌30min后,将两个反应管合并加入
1hnmr(400mhz,cdcl3):δ7.30-7.27(m,2h),7.02-6.95(m,3h),3.89-3.87(m,1h),2.16(d,j=12.4hz,1h),1.97(d,j=13.6hz,1h),1.76-1.74(m,3h),1.67-1.58(m,2h),1.52-1.35(m,2h),1.30-1.19(m,2h),1.09-1.04(m,1h),0.99-0.97(m,1h);13cnmr(101mhz,cdcl3):δ158.2,129.4,121.3(2c),115.0,53.2,39.9,35.9,35.4,26.6,25.1,23.0,22.8,10.6;ir(neat):3017,2941,2859,2227,1731,1599,1586,1483,1447,1243,1154,1092,1070,856,757,690cm-1;ms(ei)m/z(rel):241(m+,9),184(1),133(100),105(33),94(15),77(20),65(8),51(7);hrms(ei):calcdforc16h19no:241.1467,found:241.1477.
实施例37
氩气条件下,将环己基甲腈(1.0mmol),溴化锂(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入2.0ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),氮杂环卡宾配体
hplc(chiralpakad-h,hexane:i-propanol=98:2,1ml/min,214nm):tminor=5.52min,tmajor=6.62min。[α]d30=-105.7(1.0,chcl3).;1hnmr(400mhz,cdcl3):δ7.29-7.25(m,2h),7.20-7.16(m,1h),7.10-7.08(m,2h),2.21-2.16(m,2h),2.12-2.07(m,1h),1.90-1.79(m,6h),1.24-1.17(m,2h),1.07-1.02(m,1h);13cnmr(101mhz,cdcl3):δ141.6,128.4,126.0,125.9,123.4,45.2,38.1(2c),28.4,24.3(2c),20.8,12.8;ir(neat):3027,3003,2962,2874,2232,1605,1498,1453,1030,754,697cm-1;ms(ei)m/z(rel):211(m+,12),184(5),141(7),117(100),104(13),91(12),77(3),51(2);hrms(ei):calcdforc15h17n:211.1361,found:211.1365.
实施例38
氩气条件下,将环己基甲腈(1.0mmol),溴化锂(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入2.0ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),氮杂环卡宾配体
hplc(chiralpakad-h,hexane:i-propanol=98:2,1ml/min,214nm):tminor=5.52min,tmajor=6.62min。[α]d30=-105.7(1.0,chcl3).;1hnmr(400mhz,cdcl3):δ7.29-7.25(m,2h),7.20-7.16(m,1h),7.10-7.08(m,2h),2.21-2.16(m,2h),2.12-2.07(m,1h),1.90-1.79(m,6h),1.24-1.17(m,2h),1.07-1.02(m,1h);13cnmr(101mhz,cdcl3):δ141.6,128.4,126.0,125.9,123.4,45.2,38.1(2c),28.4,24.3(2c),20.8,12.8;ir(neat):3027,3003,2962,2874,2232,1605,1498,1453,1030,754,697cm-1;ms(ei)m/z(rel):211(m+,12),184(5),141(7),117(100),104(13),91(12),77(3),51(2);hrms(ei):calcdforc15h17n:211.1361,found:211.1365.
实施例39
氩气条件下,将环己基甲腈(1.0mmol),溴化锂(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入2.0ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),氮杂环卡宾配体
hplc(chiralpakad-h,hexane:i-propanol=98:2,1ml/min,214nm):tminor=5.52min,tmajor=6.62min。[α]d30=-105.7(1.0,chcl3).;1hnmr(400mhz,cdcl3):δ7.29-7.25(m,2h),7.20-7.16(m,1h),7.10-7.08(m,2h),2.21-2.16(m,2h),2.12-2.07(m,1h),1.90-1.79(m,6h),1.24-1.17(m,2h),1.07-1.02(m,1h);13cnmr(101mhz,cdcl3):δ141.6,128.4,126.0,125.9,123.4,45.2,38.1(2c),28.4,24.3(2c),20.8,12.8;ir(neat):3027,3003,2962,2874,2232,1605,1498,1453,1030,754,697cm-1;ms(ei)m/z(rel):211(m+,12),184(5),141(7),117(100),104(13),91(12),77(3),51(2);hrms(ei):calcdforc15h17n:211.1361,found:211.1365.
实施例40
氩气条件下,将环己基甲腈(1.0mmol),溴化锂(0.10mmol)和1.0ml四氢呋喃加入到10ml的反应管中,0℃下加入2.0ml六甲基二硅基胺基锂(1.0minthf),恢复室温搅拌30min,在另外一5ml的反应管中加入氯化烯丙基钯(ii)二聚物(1.9mg,0.005mmol),氮杂环卡宾配体
hplc(chiralpakad-h,hexane:i-propanol=98:2,1ml/min,214nm):tminor=5.52min,tmajor=6.62min。[α]d30=-105.7(1.0,chcl3).;1hnmr(400mhz,cdcl3):δ7.29-7.25(m,2h),7.20-7.16(m,1h),7.10-7.08(m,2h),2.21-2.16(m,2h),2.12-2.07(m,1h),1.90-1.79(m,6h),1.24-1.17(m,2h),1.07-1.02(m,1h);13cnmr(101mhz,cdcl3):δ141.6,128.4,126.0,125.9,123.4,45.2,38.1(2c),28.4,24.3(2c),20.8,12.8;ir(neat):3027,3003,2962,2874,2232,1605,1498,1453,1030,754,697cm-1;ms(ei)m/z(rel):211(m+,12),184(5),141(7),117(100),104(13),91(12),77(3),51(2);hrms(ei):calcdforc15h17n:211.1361,found:211.1365.
实施例41
氩气条件下,将
hplc(chiralpakad-h,hexane:i-propanol=98:2,1ml/min,214nm):tminor=5.78min,tmajor=6.40min.[α]d29=-90.8(1.0,chcl3);1hnmr(400mhz,cdcl3):δ7.29-7.25(m,2h),7.20-7.16(m,1h),7.10-7.08(m,2h),2.21-2.16(m,2h),2.12-2.07(m,1h),1.90-1.79(m,6h),1.24-1.17(m,2h),1.07-1.02(m,1h);13cnmr(101mhz,cdcl3):δ141.6,128.4,126.0,125.9,123.4,45.2,38.1(2c),28.4,24.3(2c),20.8,12.8;ir(neat):3027,3003,2962,2874,2232,1605,1498,1453,1030,754,697cm-1;ms(ei)m/z(rel):211(m+,12),184(5),141(7),117(100),104(13),91(12),77(3),51(2);hrms(ei):calcdforc15h17n:211.1361,found:211.1365.
实施例42
氩气条件下,将
hplc(chiralpakad-h,hexane:i-propanol=98:2,1ml/min,214nm):tminor=5.83min,tmajor=7.06min.[α]d30=-91.3(1.0,chcl3);1hnmr(400mhz,cdcl3):δ7.29-7.25(m,2h),7.20-7.16(m,1h),7.10-7.08(m,2h),2.20-2.10(m,3h),1.76-1.49(m,10h),1.25-1.15(m,2h),1.05-1.00(m,1h);13cnmr(101mhz,cdcl3):δ141.8,128.4,126.0,125.9,122.3,44.8,38.8,38.6,31.2,27.9(2c),23.7,23.6,20.1,12.8;ir(neat):3063,3027,2927,2857,2231,1735,1604,1497,1460,1255,1155,1034,838,751,696cm-1;ms(ei)m/z(rel):239(m+,3),154(2),122(6),117(100),115(18),104(13),91(17),77(5),57(38),41(13);hrms(ei):calcdforc17h21n:239.1674,found:239.1686.
实施例43
氩气条件下,将
hplc(chiralpakic,hexane:i-propanol=98:2,1ml/min,214nm):tmajor=14.76min,tminor=19.02min.[α]d30=-95.2(1.0,chcl3);1hnmr(400mhz,cdcl3):δ7.28-7.24(m,2h),7.19-7.15(m,1h),7.08-7.06(m,2h),4.00-3.94(m,2h),3.70(dt,j=12.0,2.0hz,2h),2.16-2.11(m,1h),1.97-1.91(m,2h),1.82-1.74(m,2h),1.25-1.20(m,1h),1.17-1.12(m,1h),1.06-1.01(m,1h);13cnmr(101mhz,cdcl3):δ142.6,130.0,127.5,127.4,121.9,66.1,40.9,36.9,36.7,31.1,21.0,13.0;ir(neat):3063,2957,2925,2852,2233,1736,1604,1498,1465,1443,1243,1143,1103,1032,835,757,697cm-1;ms(ei)m/z(rel):227(m+,8),141(4),117(100),104(7),91(21),77(5),57(9),41(3);hrms(ei):calcdforc15h17no:227.1310,found:227.1307.
实施例44
氩气条件下,将
hplc(chiralpakid,hexane:i-propanol=99:1,1ml/min,214nm):tminor=28.62min,tmajor=30.71min.[α]d30=-49.9(1.0,chcl3);1hnmr(400mhz,cdcl3):δ7.29-7.25(m,2h),7.20-7.16(m,1h),7.08-7.06(m,2h),4.14-4.09(m,2h),3.04(br,2h),2.17-2.12(m,1h),2.03-1.98(m,2h),1.68-1.57(m,2h),1.46(s,9h),1.27-1.21(m,1h),1.14-1.09(m,1h),1.07-1.02(m,1h);13cnmr(101mhz,cdcl3):δ154.4,141.1,128.5,126.1(2c),120.2,80.1,40.7,34.8,29.3,28.4,19.8,11.8;ir(neat):3005,2975,2864,2234,1691,1605,1421,1278,1159,863,760,697cm-1;ms(ei)m/z(rel):326(m+,2),270(45),253(32),226(100),135(50),117(56),94(24),57(77),51(3);hrms(esi):calcdforc20h26n2nao2[m+na]+:349.1886,found:349.1887.
实施例45
氩气条件下,将
hplc(chiralpakod-h,hexane:i-propanol=99:1,1ml/min,214nm):tmajor=7.11min,tminor=7.96min.[α]d31=-84.8(1.0,chcl3);1hnmr(400mhz,cdcl3):δ7.30-7.26(m,2h),7.20-7.16(m,1h),7.11-7.09(m,2h),2.12-2.07(m,1h),1.48(s,3h),1.47(s,3h),1.21-1.11(m,2h),1.06-1.01(m,1h);13cnmr(101mhz,cdcl3):δ141.6,128.4,126.0(2c),122.9,34.9,30.8,26.7(2c),20.6,12.6;ir(neat):3029,2978,2935,2236,1605,1498,1466,753,697cm-1;ms(ei)m/z(rel):185(m+,10),143(13),117(100),104(8),91(13),77(6),65(3),51(3);hrms(ei):calcdforc13h15n:185.1204,found:185.1201.
实施例46
氩气条件下,将
1hnmr(400mhz,cdcl3):δ7.81-7.75(m,3h),7.51(s,1h),7.48-7.40(m,2h),7.22(d,j=7.6hz,1h),2.28-2.24(m,1h),1.51(s3h),1.50(s,3h),1.30-1.21(m,2h),1.19-1.15(m,1h);13cnmr(101mhz,cdcl3):δ139.0,133.4,132.1,128.1,127.6,127.3,126.2,125.3,124.8,124.2,123.0,35.0,31.0,26.8,26.7,20.9,12.6;ir(neat):3058,2980,2922,2853,2235,2693,2630,1597,1505,1459,1367,1303,1251,1023,964,886,811,742,475cm-1;ms(ei)m/z(rel):235(m+,27),191(15),167(100),155(32),127(33),115(9),77(8),63(7),57(8),51(5);hrms(ei):calcdforc17h17n:235.1361,found:235.1364;hplc(chiralpakic,hexane:i-propanol=99.2:0.8,1ml/min,214nm):tmajor=12.57min,tminor=13.31min.[α]d29=-50.5(1.0,chcl3).
实施例47
氩气条件下,将
87:13er;1hnmr(400mhz,cdcl3):δ7.23(s,1h),6.27(s,1h),6.00(d,j=2.8hz,1h),2.10-2.05(m,1h),1.47(s,3h),1.45(s,3h),1.29-1.24(m,1h),1.13-1.05(m,2h);13cnmr(101mhz,cdcl3):δ154.9,140.7,122.6,110.3,104.2,34.6,28.5,26.6(2c),13.9,10.8;ir(neat):2979,2930,2872,2237,1599,1510,1460,1372,1246,1183,1148,1013,966,798,731,597cm-1;ms(ei)m/z(rel):175(m+,51),117(7),107(100),94(24),79(75),77(57),65(12),63(5),57(1);hrms(ei):calcdforc11h13n):175.0997,found:175.1003;hplc(chiralpakie,hexane:i-propanol=99:1,1ml/min,214nm):tminor=10.49min,tmajor=10.99min.[α]d29=-68.5(1.0,chcl3).
实施例48
如式1所示的化合物的制备
步骤一:氩气条件下,将实施例45中hplc保留时间为t=7.11min的产物(0.20mmol),1.0ml乙醚加入到10ml的反应管中,在0℃下加入lialh4(0.26mmol),恢复室温后,反应过夜。反应结束后,加入2.0ml饱和氯化铵水溶液淬灭,乙醚萃取(3×5ml),无水硫酸钠干燥,旋干溶剂得到产物,总收率96%。
步骤二:将步骤一得到的产物、1ml二氯甲烷和0.1ml三乙胺的混合溶液中,在0℃下加入对溴苯磺酰氯,恢复室温后,反应过夜。反应结束后,加入2.0ml水淬灭,乙醚萃取(3×5ml),无水硫酸钠干燥,旋干溶剂,得到产物即可。
如式1所示的化合物的单晶的制备
通过挥发法来培养单晶:取50mg步骤二得到的产物于10ml试管中,加入1ml二氯甲烷溶解后,再加入0.5ml正己烷。将试管置于装有15ml正己烷的锥形瓶中,将锥形瓶封口后放置在室温下结晶,即可。
检测方法x-射线单晶衍射
将上述化合物的单晶进行x-射线单晶衍射。经检测,其晶为三斜晶系,空间群属于p1,晶胞参数为
如式1所示的化合物的单晶参数
由所得x-射线单晶衍射的表征结果表明,可以确定如式1所示的化合物的构型为
应用实施例1
氩气条件下,将
1hnmr(400mhz,cdcl3):δ7.70-7.68(m,2h),7.45-7.41(m,1h),7.36-7.32(m,2h),7.27-7.23(m,2h),7.17-7.14(m,1h),7.06-7.04(m,2h),2.24-2.18(m,2h),2.07-2.02(m,1h),1.60-1.57(m,3h),1.38-1.32(m,3h),1.25-1.24(m,3h),1.18-1.13(m,1h),107-1.02(m,1h);13cnmr(101mhz,cdcl3):δ208.2,142.5,139.5,130.7,128.3,127.9,127.7,125.8,125.7,50.5,33.5,33.2,31.9,25.9,23.3(2c),20.8,13.1;ir(neat):3066,2927,2857,1667,1599,1496,1449,1324,1226,1159,1127,1068,984,931,781,749,693cm-1;ms(ei)m/z(rel):304(m+,10),243(5),200(34),131(14),117(100),105(82),91(73),77(43),67(11),55(16);hrms(ei):calcdforc12h24o2:304.1827,found:304.1833.
应用实施例2
氩气条件下,将
1hnmr(400mhz,cdcl3):δ7.27-7.23(m,2h),7.16-7.12(m,1h),7.08-7.07(m,2h),2.57(s,2h),1.81-1.76(m,1h),1.30(br,2h),0.98-0.88(m,2h),0.83-0.79(m,7h);13cnmr(101mhz,cdcl3):δ143.8,128.3,125.8,125.3,54.4,34.5,31.8,23.0,22.8,18.2,11.0;ir(neat):3064,3026,2954,1602,1496,1465,1363,1118,1070,1030,875,755,696cm-1;ms(ei)m/z(rel):189(m+,15),172(7),159(11),143(18),133(100),129(32),117(74),104(22),91(44),77(14),55(12);hrms(ei):calcdforc13h19n:189.1517,found:189.1521.
应用实施例3
氩气条件下,将
1hnmr(400mhz,cdcl3):δ7.38-7.29(m,5h),5.76(br,1h),4.13(d,j=9.2hz,1h),2.26-2.17(m,1h),1.92-1.85(m,1h),1.74-1.24(m,9h),0.97(d,j=7.2hz,3h);13cnmr(101mhz,cdcl3):δ182.1,141.0,128.7,128.0,126.4,62.1,52.1,45.3,33.4,28.0,25.8,21.9,21.6,11.2;ir(neat):3166,3065,3031,2922,2855,1675,1446,1339,1276,1233,1088,1063,841,802,697,664cm-1;ms(ei)m/z(rel):243(m+,38),228(17),202(10),188(100),175(22),160(13),117(11),106(25),91(15),81(15),77(11),67(9);hrms(ei):calcdforc16h21no:243.1623,found:243.1627.
- 还没有人留言评论。精彩留言会获得点赞!