一种牡丹的基因组原位杂交方法及其应用与流程
本发明涉及基因工程技术领域,具体涉及一种牡丹的基因组原位杂交方法及其应用。
背景技术:
牡丹属于芍药科芍药属牡丹组,为中国的传统名花,栽培应用的历史悠久,具有较高的观赏及应用价值。经过1600多年的人工选育,牡丹形成了众多的优良品种。其中亚组间远缘杂交在品种培育过程中发挥了极其重要的作用,目前,美国牡丹芍药协会已登录的牡丹亚组间杂交品种有426个。但对于牡丹亚组间远缘杂交成功的机理、远缘杂种的遗传组成等研究还十分缺乏。对牡丹亚组间远缘杂交后代染色体的研究,有利于揭示杂种后代的杂交机理,为牡丹的远缘杂交育种提供一定的指导。
染色体的识别是染色体研究的基础工作。染色体的识别是指通过一定的标记将不同的染色体区分开,包括染色体组、单个染色体以及染色体片段,这一直是细胞遗传学研究的重要内容(katoetal.,2005)。
压片法开启了染色体核型分析的开端且一直是核型分析的常用手段之一(belling,1921)。传统的核型分析以染色体的基础测量数据如相对长度、着丝点位置及臂比值等为染色体识别的依据,在最初的研究中扮演了重要的角色。关于芍药属牡丹组植物的核型分析,已有前人做过大量的工作,涉及牡丹的所有野生种及栽培牡丹的多个品种,为该组植物细胞学研究奠定了理论基础,对确定野生种分类地位、演化关系及遗传育种工作等具有重要的价值。(stebbins,1938;李懋学等,1982;王莲英等,1983;于兆英等,1987;张赞平等,1988;洪德元等,1988;龚洵等,1991)。传统的核型分析对于形态相近的染色体或区段变异的区分缺乏准确性,因此需要可以进一步显示染色体的内部结构的技术来进行染色体的准确识别。
染色体显带技术可通过一定技术显现染色体的纹路,进行染色体内部结构的识别,若染色体结构发生变异,带纹也可能发生变化,可用来区分各条染色体以及初步鉴定染色体的变异,是染色体识别从外部形态研究向内部结构研究的一个转折点(caspersonetal.,1968)。染色体显带技术包括c带、g带、银染法、n带、r带、t带等多种带型分析方法。另外,高分辨显带技术使染色体分带细、带纹可达800条甚至更多,染色体识别更为准确,在临床医学和植物染色体识别等方面皆有应用(yunis,1976)。染色体显带技术在牡丹中也有一定的应用,c带及银染带等的分析结果可作为鉴别种及品种的依据(张赞平等,1990;于玲等,1997;裴彦龙,1993)。
对于一些染色体较小,浓缩程度高且形态相近的物种,染色体经显带技术处理后不能产生相应的带纹或产生的带纹有限,因此仍难以准确识别所有的染色体。染色体原位杂交技术(insituhybridization)可通过探针与靶dna的结合产生的荧光信号位点进行染色体的准确识别。该方法使用标记的核酸序列作为探针,与染色体上的靶dna进行杂交,由于探针在不同染色体上组成、分布、位置和重复数的不同,可进行染色体的准确识别,应用较为广泛。
原位杂交技术分为荧光原位杂交(fluorescenceinsituhybridization,fish)和基因组原位杂交(genomeinsituhybridization,gish)。在植物fish实验中,应用最多的探针是克隆的rdna和其他主要的串联重复序列。根据杂交信号的有无、数量多少及位置的不同,很多植物的全部或部分染色体得以准确识别,由此建立了准确的核型。fish技术在芍药组芍药属植物中已有应用,根据其信号位点在染色体上的分布,可识别染色体结构变异(zhangetal.,1998;),进行rdna在染色体上的定位、rrna基因物理图谱构建研究(zhangetal.,1999),sat-染色体、间期核中rrna基因的杂交信号及核仁数目研究(uchinoetal.,2000),及种内不同居群间rrna位点定位等研究(luoetal.,2006),对芍药属植物的进化研究有较大的意义。fish技术的杂交信号为染色体上的位点,且需要进行探针的筛选与分离,在进行远缘杂交后代中不能便捷的区分来源于不同亲本基因组的染色体。以总基因组dna作为探针进行整条染色体的杂交,可识别植物杂种、异源多倍体和重组的育种品系中不同来源的染色体和染色体片段,这一技术即为基因组原位杂交技术(gish)。
gish技术采用来自一个物种的总基因组dna作为标记探针,用另一物种的总基因组dna以适当浓度进行封阻,在子代染色体上进行原位杂交,探针dna与子代染色体组中来源于该物种的染色体杂交呈现出杂交信号,从而将不同来源的染色体组进行区分。此技术简便易行,不用分离探针,只需提取植物的总基因组dna进行标记作为探针,可与整条染色体杂交,而且杂交位点可以在细胞分裂任何时期观察到,即可迅速准确地进行目标染色体(片段)及基因组的检测,广泛用于植物异源染色质的鉴定及物种起源演化研究中,在风信子、菊科、草莓、忍冬、百合等园艺植物中进行杂种后代染色体识别等均有所应用(abdel-twab&kondo,2004;barba-gonzalezetal.,2006;budylinetal.,2014;jangetal.,2015;miyashita&hoshino,2015;liuetal.,2016)。牡丹的基因组较大(13-16gb)且杂合性高,使得gish检测方法在牡丹中的应用受到限制,目前尚没有gish技术在牡丹中应用的报道。
技术实现要素:
为解决现有技术中的技术问题,本发明的目的在于提供一种牡丹的基因组原位杂交方法,用于准确鉴定牡丹种间杂交过程中的双亲染色体的遗传方式及其在后代染色体组中的组成。
本发明提供一种牡丹的基因组原位杂交方法,其采用三步法对包含探针dna和封阻dna的杂交混合液以及待检测染色体进行变性处理,将变性后的杂交混合液和染色体杂交;
所述三步法为分别将所述杂交混合液和所述待检测染色体进行变性处理后,再将变性后的杂交混合液和染色体混合,进行共变性处理。采用染色体及杂交混合液分别变性后再共变性的三步法变性过程,能够保证探针dna、封阻dna和染色体dna的双链充分打开,为杂交创造有利条件,大大提高了杂交的成功率和特异性。
其中,所述杂交混合液的变性为将杂交混合液于95~98℃变性10~15min;
所述待检测染色体的变性为将待检测染色体玻片于甲酰胺溶液中70~75℃水浴变性3~5min;
所述共变性为将经变性处理的杂交混合液与待检测染色体混合,于80~85℃变性10~15min。
封阻dna能够通过杂交封闭染色体中的非特异性杂交位点(同源序列),在牡丹的基因组原位杂交中,封阻dna相对于探针dna的在一定范围内的过量,有利于实现更优的封阻效果,保证杂交的特异性。
本发明中,所述杂交混合液中探针dna与封阻dna的质量比为1:10~1:50。
优选地,所述杂交混合液中探针dna与封阻dna的质量比为1:25~1:40。
进一步地,合适的探针dna及封阻dna的片段大小以及制备条件能够保证杂交的特异性和成功率。
本发明中,所述探针dna的片段大小为200~500bp;
所述探针dna的标记采用放射性或非放射性的标记;优选采用地高辛进行标记。
优选地,本发明所述探针dna的制备为将牡丹的总基因组dna与dig-nicktranslationmix混合,于15℃避光反应60~70min。
具体地,所述dig-nicktranslationmix的用量为4~6μl/μg总基因组dna。
本发明中,所述封阻dna的片段大小为200~500bp。
优选地,所述封阻dna的制备为将牡丹的总基因组dna于沸水浴中煮沸处理150~300min。
本发明提供的基因组原位杂交方法可以以牡丹亚组间远缘杂交后代的有丝分裂中期的染色体为待测靶标,以一个亲本物种的全基因组dna为探针dna,另一亲本物种的全基因组dna为封阻dna,进行基因组原位杂交。
优选地,本发明中,所述封阻dna来源于与待测牡丹杂交亲本同种的牡丹的基因组dna。
本发明所述的牡丹基因组原位杂交方法包括如下步骤:
(1)染色体玻片标本的制备和预处理:对待检测牡丹的组织进行预处理、固定和酶解后,采用去壁低渗火焰干燥法制备待测牡丹染色体的玻片,再对染色体玻片进行酶解预处理;
(2)探针标记及封阻dna制备:将牡丹的总基因组dna与dig-nicktranslationmix混合,于15℃避光反应60~70min,得到探针dna;
将牡丹的总基因组dna于沸水浴中煮沸处理150~300min,得到封阻dna;
(3)染色体和探针的变性:将步骤(1)制备的经预处理的染色体玻片于70%的甲酰胺中70~75℃变性3~5min,在预冷的乙醇中逐级脱水、干燥;
将包含探针dna和封阻dna的杂交混合液于95~98℃变性10~15min;
将经变性处理的杂交混合液加入至经变性处理的染色体玻片,于80~85℃变性10min;
(4)杂交
将步骤(3)得到的经变性处理的杂交混合液与待检测染色体的混合物于37℃杂交12-16h;
(5)洗脱与信号检测:步骤(4)得到的杂交产物经洗脱、封闭处理后,添加荧光标记的抗地高辛抗体处理,经洗涤后,添加抗荧光衰减剂,封片。
其中,上述步骤(5)中所述洗脱包括采用30%~50%的去离子甲酰胺溶液洗脱杂交产物的步骤。
其中,上述步骤(1)所述染色体玻片标本的制备和预处理,具体包括如下步骤:
①使用对二氯苯-α-溴奈混合液对待检测牡丹的组织进行预处理,4℃处理10~12h后,采用卡诺固定液固定;
②加入包含2%纤维素酶和0.5%果胶酶的混合酶液,37℃酶解处理70~90min后,采用去壁低渗火焰干燥法制片;
③加入rna酶,37℃处理1~2h;经洗涤后,加入胃蛋白酶,37℃处理30~40min。
上述步骤①中,经卡诺固定液固定的待检测牡丹组织可于70%酒精中-20℃长期保存。
上述步骤②具体为:加入包含2%纤维素酶和0.5%果胶酶的混合酶液,37℃酶解70~90min;蒸馏水洗去酶液,采用去壁低渗火焰干燥法制片,显微镜下挑选染色体分散良好的染色体玻片。
上述步骤③具体为:将步骤②挑选的染色体玻片于60℃烘干12h后,加入rna酶,37℃处理1~2h;经洗涤后,加入胃蛋白酶,37℃处理30~40min;经洗涤后,加入4%去离子甲酰胺,室温固定10min,防止染色体脱落。
进一步地,本发明提供所述的基因组原位杂交方法在牡丹的种质鉴定及牡丹杂交育种的遗传分析中的应用。
本发明的有益效果在于,
本发明通过对基因组原位杂交的条件参数进行全面的调整和优化,得到了高效的牡丹基因组原位杂交方法,利用本发明提供的方法进行牡丹基因组原位杂交,成功率显著提高,且杂交的特异性明显提高,杂交信号在染色体上具有更高的清晰度,能够准确区分来自于杂交双亲本的染色体,可以在实践中用于牡丹的种质鉴定及杂交育种的遗传分析。
附图说明
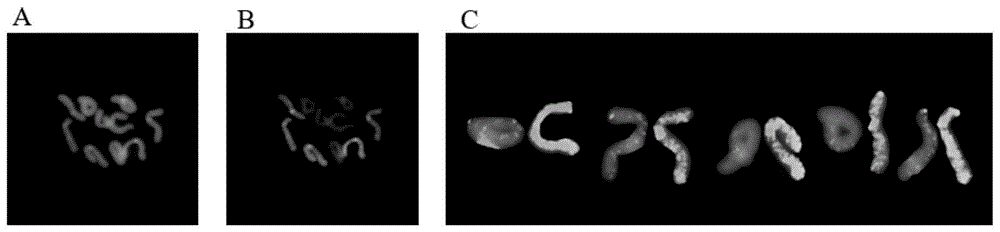
图1为本发明实施例2的牡丹基因组原位杂交结果图片,其中,a为染色体中期图;b为dig杂交信号效果图;c为染色体核型图。
图2为本发明实施例3的牡丹基因组原位杂交结果图片,其中,a为染色体中期图;b为dig杂交信号效果图;c为染色体核型图。
图3为本发明实施例4的牡丹基因组原位杂交结果图片,其中,a为染色体中期图;b为dig杂交信号效果图;c为染色体核型图。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中待测牡丹的材料来源于paeonia×lemoinei‘highnoon’的幼嫩子房,‘highnoon’为牡丹亚组间远缘杂交品种,是p.delavayi(黄花)与p.×suffruticosa的杂交后代(p.delavayi为肉质花盘亚组,p.×suffruticosa为革质花盘亚组。);母本dna材料来源于p.delavayi(黄花);父本dna材料来源于p.×suffruticosa的两个品种‘luoyanghong’及‘hoki’。
下述实施例中使用的各种试剂配方及制备方法如下:
(1)检测试剂的配制
anti-dig-rhodamine:将冻干粉200μg溶于1mlddh2o中,避免反复冻融,分装成10份,于4℃避光保存2个月,也可-20℃保存。
(2)封闭试剂的配制
称取bsa干粉5g,用100ml蒸馏水或4×ssc-tween20配制(效果更好)分装,-20℃保存。
(3)杂交液中的药品配制
50%ds(硫酸葡聚糖):称取0.5g干粉溶于1ml无菌ddh2o(65℃溶解)中,装成小管,-20℃保存。
10%sds(十二烷基磺酸钠):称取2gsds,溶解于18ml无菌ddh2o中,加热助溶,加浓hcl,调ph为7.2,加水定容至20ml分装。
(4)缓冲液配制
10×pbs:称取nacl80g、kcl2.0g、na2hpo414.4g、kh2po42.4g加蒸馏水溶解,调节ph7.5,定容至1000ml,高温灭菌。
20×ssc:称取柠檬酸三钠88.4g溶于蒸馏水中,用滤纸过滤后加入nacl175.4g,调节ph7.0,定容至1000ml,高温灭菌。
1×pbs:10×pbs与蒸馏水比例为1:9配制。
2×ssc:20×ssc与蒸馏水比例为1:9配制。
4×ssc:20×ssc与蒸馏水比例为1:4配制。
(5)预处理试剂
100mg/μlrnasea溶液:将10mg粉末溶于1mlddh2o中配成原液,使用时将原液于2×ssc按照1:99的配比进行稀释使用。
1%胃蛋白酶溶液:将10mg粉末将10mg粉末溶于1mlddh2o中配成原液,使用时将原液于2×ssc按照1:99的配比进行稀释使用。
对二氯苯-α溴奈混合液:称取对二氯苯结晶约20g于棕色试剂瓶中,加入45℃的蒸馏水500ml,振摇约3min,室温静置过夜后,加入2~3滴α溴奈并充分振摇,静置后即可使用,室温保存。
(6)4×ssc-tween20溶液的配制
每100ml4×ssc溶液中加0.2mltween20,其它需要加入tween20的溶液中tween20的比例同上。
(7)dig-nicktranslationmix(no.11745816910)的使用说明书
具体步骤:取1μg总基因组dna加双蒸水至16μl,加入4μldig-nicktranslationmix,混合后短暂离心,于15℃避光反应,反应过程中进行探针片段大小的检测。(将反应物放置于冰上,取3μl反应物加入loadingbuffer,95℃变性3min后,放置于冰上3min,1.5%的琼脂糖凝胶电泳,探针长度应在200~500bp之间,如若长度大于500bp,可将反应物于15℃重新温育后再次检测探针长度。)当探针长度达到要求后,每20μl体系加入1μl0.5medta(ph8.0)于65℃反应10min终止反应。
实施例1牡丹基因组原位杂交的条件筛选
为得到较好的杂交结果,本实施例分别对染色体玻片标本的制备、染色体玻片标本的预处理、dna提取、探针标记及封阻dna制备以及杂交后洗脱步骤的条件进行筛选和优化,确定上述步骤的最佳条件参数。
1、染色体玻片标本的制备
(1)使用对二氯苯-α-溴奈混合液对p.×lemoinei‘highnoon’的幼嫩子房进行预处理,4℃预处理0~24h,卡诺固定液中4℃固定24h,筛选适宜的预处理的时长。结果表明,预处理环节中,较适宜的时间为10-12h,低于10h,染色体收缩较长,高于12h染色体收缩较短,且容易对细胞产生毒害作用,不利于制片。
(2)对牡丹材料进行酶解制片,在步骤(1)得到的预处理材料中加入混合酶液(2%纤维素酶与0.5%果胶酶),于37℃、ph4.0-4.5的条件下、酶解50~100min,筛选适宜的酶解时间。结果表明,酶解步骤中,较适宜的酶解时间为70-90min,低于70min,解离不彻底,高于90min,组织过于松散,不利于酶液的洗脱,且容易丢失大量细胞。
(3)采用去壁低渗火焰干燥法制备待测牡丹染色体的玻片。
2、染色体玻片标本的预处理
对上述步骤1得到的充分干燥的染色体玻片进行rnase和胃蛋白酶的处理。滴加不含dnase的rnase(100mg/μl),37℃处理30min~120min,用2×ssc洗涤3次,每次5min;滴加1%胃蛋白酶,37℃处理10~40min,1×pbs洗涤2次,每次5min。转入4%多聚甲醛中固定10min。2×ssc洗涤3次,每次5min。结果表明,rnase处理1h、胃蛋白酶处理30min后染色体的背景较干净,低于此时长,存在细胞残留物影响后续实验,高于此时长,容易导致染色体从玻片上脱落。
3、dna提取、探针标记及封阻dna制备
dna提取:取paeonia×lemoinei‘highnoon’的亲本牡丹的叶片或芽,采用ctab法(艾德莱植物基因组快速提取试剂盒,dn14)提取总基因组dna,以母本p.delavayi的总基因组dna作为探针材料,父本p.×suffruticosa的总基因组dna作为封阻材料。
探针标记:使用dig-nicktranslationmix(roche,no.11745816910)标记p.delavayi的总基因组dna。于15℃避光反应30-120min,进行探针标记时间的筛选(筛选梯度为10min)。反应过程中进行探针片段大小的检测,控制探针长度在200~500bp之间。
结果表明,探针标记时间在60-70min时,探针长度在200~500bp之间;低于此时长,探针长度大于500bp,高于此时长,探针长度小于200bp,均不利于杂交。
封阻dna的制备:将p.×suffruticosa‘luoyanghong’及p.×suffruticosa‘hoki’的总基因组dna分别于沸水浴中煮沸处理30~300min,进行封阻dna制备时间的筛选,筛选梯度为30min,反应过程中进行探针片段大小的检测,控制封阻dna长度在200~500bp之间。
结果表明,封阻制备时间在150-300min时,封阻dna长度在200~500bp之间;低于150min,封阻dna的长度整体大于500bp,高于300min,封阻dna的长度整体小于200bp,均不利于杂交。
4、杂交后洗脱
杂交结束后取出玻片,用2×ssc漂去盖片,在20%~50%去离子甲酰胺溶液(0.1×ssc配制)中于42℃洗涤2次,每次5min;用0.1×ssc于42℃洗涤2次,每次5min;用2×ssc于42℃洗涤5min。4×ssc-tween20中,室温洗涤5min。筛选用于洗脱第一步的去离子甲酰胺溶液的浓度,结果表明,采用30%-50%去离子甲酰胺洗涤杂交后的玻片能够获得更好的洗脱效果,去离子甲酰胺的溶液浓度低于30%时,不易洗脱探针及封阻dna,高于50%时对已杂交的信号会产生影响。
实施例2
本实施例提供一种牡丹的基因组原位杂交方法,具体步骤如下:
(1)染色体玻片标本的制备:
使用对二氯苯-α-溴奈混合液对p.×lemoinei‘highnoon’的幼嫩子房进行预处理,以使材料的染色体缩短及积累更多的中期相细胞,4℃处理10h;
加入卡诺固定液(无水乙醇:冰醋酸=3:1),4℃固定24h,加入混合酶液(2%纤维素酶与0.5%果胶酶,ph4.0-4.5),37℃酶解70min;采用去壁低渗火焰干燥法制备待测牡丹染色体的玻片。
(2)染色体玻片标本的预处理
在步骤(1)得到的充分干燥的染色体玻片上滴加不含dnase的rnase(100mg/μl),37℃处理1h,用2×ssc洗涤3次,每次5min;滴加1%胃蛋白酶,37℃处理30min,1×pbs洗涤2次,每次5min。转入4%多聚甲醛中固定10min。2×ssc洗涤3次,每次5min。
(3)探针标记及封阻dna制备
ctab法提取paeonia×lemoinei‘highnoon’的亲本的总基因组dna。
使用dig-nicktranslationmix标记p.delavayi的总基因组dna,标记反应为15℃避光反应60min,探针长度在200~500bp之间。
将p.×suffruticosa‘luoyanghong’的总基因组dna分别于沸水浴中煮沸处理150min,封阻dna长度在200~500bp之间。
(4)染色体和探针的变性
将步骤2制备的经预处理的染色体玻片于70%去离子甲酰胺中75℃水浴变性3min,在-20℃预冷的70%、90%、100%乙醇中逐级脱水3min,空气干燥。
依次加入表1所示的试剂,配制杂交混合液,其中,封阻dna的用量为2μl,在涡流混合器上混匀,置于pcr仪上95℃变性10min。
将上述杂交混合液滴于经变性处理的染色体玻片上,加盖片,85℃变性10min。
表1杂交混合液成分及浓度
(5)杂交
将共变性后的杂交混合液与染色体玻片于37℃培养箱中黑暗条件下杂交12h。
(6)洗脱与信号检测
杂交结束后取出玻片,用2×ssc漂去盖片,在30%去离子甲酰胺溶液(0.1×ssc配制)中于42℃洗涤2次,每次5min。用0.1×ssc于42℃洗涤2次,每次5min。用2×ssc于42℃洗涤5min。4×ssc-tween20中,室温洗涤5min。
在载片上滴加40μl的5%bsa(4×ssc-tween20配制)封闭液,37℃处理30min,加入30μl的anti-dig-rhodamine抗体(2μg/ml溶于含5%bsa的pbs缓冲液),37℃避光温育1h。用1×pbs-tween20、1×pbs分别于37℃洗涤3次,每次5min。滴加含dapi的抗荧光衰减剂vectashield封片,避光后于olympusbx-51进行荧光显微镜观察(牡丹的染色体用dapi复染呈蓝色,杂交信号呈紫红色),采用cytovision软件进行拍照,photoshopcs6软件进行图像处理。采用本实施例的方法进行的基因组原位杂交的结果如图1所示。
实施例3
本实施例提供一种牡丹基因组的原位杂交方法,与实施例2的方法的区别仅在于步骤(3)使用的封阻dna的来源不同,步骤(3)具体如下:
(3)探针标记及封阻dna制备
ctab法提取paeonia×lemoinei‘highnoon’的亲本的总基因组dna。
使用dig-nicktranslationmix标记p.delavayi的总基因组dna,标记反应为15℃避光反应60min,探针长度在200~500bp之间。
将p.×suffruticosa‘hoki’的总基因组dna分别于沸水浴中煮沸处理150min,封阻dna长度在200~500bp之间。
采用本实施例所述的方法进行的待测牡丹基因组原位杂交的结果如图2所示。
实施例4
本实施例提供一种牡丹基因组的原位杂交方法,与实施例2的方法的区别仅在于步骤(4)不同,步骤(4)具体如下:
将步骤2制备的经预处理的染色体玻片于70%去离子甲酰胺中75℃水浴变性3min,在-20℃预冷的70%、90%、100%乙醇中逐级脱水3min,空气干燥。
依次加入表1所示的试剂,配制杂交混合液,其中,封阻dna的用量为3μl,在涡流混合器上混匀,置于pcr仪上98℃变性10min。
将上述杂交混合液滴于经变性处理的染色体玻片上,加盖片,85℃变性10min。
实施例4的基因组原位杂交结果如图3所示。
综合分析实施例2~4的杂交结果可知,采用待测牡丹的母本p.delavayi的基因组dna作为探针可将子代‘highnoon’的染色体分为两组。‘highnoon’为二倍体,染色体数目为10,两组染色体所占比例为1:1。图1、图2和图3中,紫红色的一组染色体来源于p.delavayi,蓝色的一组染色体为来源于p.×suffruticosa。
当探针与封阻的比例一致时,来源于待测牡丹的同一亲本种下的不同品种(‘luoyanghong’与‘hoki’)的封阻dna,均可达到较好的封阻效果,进而获得较好的杂交结果,能够区分两组染色体(图1与图2比较),增大了封阻材料的选择范围。
当封阻dna材料一致时,探针dna与封阻dna的比例对杂交结果具有较大的影响,其中封阻dna与探针dna的质量比为75:2时的杂交结果明显优于质量比为25:1时的杂交结果(图1与图3比较)。
对比例1
本对比例提供一种牡丹基因组的原位杂交方法,与实施例2的方法的区别仅在于步骤(4)不同,步骤(4)具体如下:
依次加入表1所示的试剂,配制杂交混合液,其中,封阻dna的用量为2μl,在涡流混合器上混匀,将上述杂交混合液滴于步骤(2)制备的预处理的染色体玻片上,加盖片,85℃变性10min。
杂交结果表明,由于染色体和探针变性不充分,探针与染色体不能充分结合,导致杂交效果不明显或不能杂交上。
对比例2
本对比例提供一种牡丹基因组的原位杂交方法,与实施例2的方法的区别仅在于步骤(4)不同,步骤(4)具体如下:
将步骤2制备的经预处理的染色体玻片于70%去离子甲酰胺中75℃水浴变性3min,在-20℃预冷的70%、90%、100%乙醇中逐级脱水3min,空气干燥。
依次加入表1所示的试剂,配制杂交混合液,其中,封阻dna的用量为2μl,在涡流混合器上混匀,置于pcr仪上95℃变性10min。
杂交结果表明,由于染色体和探针变性不充分,使得探针与染色体不能充分结合,导致杂交效果不明显或不能杂交上。
对比例3
本对比例提供一种牡丹基因组的原位杂交方法,与实施例2的方法的区别仅在于步骤(4)不同,步骤(4)具体如下:
将步骤2制备的经预处理的染色体玻片于70%去离子甲酰胺中80℃水浴变性1min,在-20℃预冷的70%、90%、100%乙醇中逐级脱水3min,空气干燥。
依次加入表1所示的试剂,配制杂交混合液,其中,封阻dna的用量为2μl,在涡流混合器上混匀,置于pcr仪上95℃变性15min。
将上述杂交混合液滴于经变性处理的染色体玻片上,加盖片,85℃变性10min。
杂交结果表明,由于染色体和探针变性不充分,使得探针与染色体不能充分结合,导致杂交效果不明显或不能杂交上。
综上所述,本发明提供的牡丹gish方法能够有效区分子代中不同来源的染色体,可用于开展牡丹杂交中杂交后代的真实性及染色体的组成研究。
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!