氘代丁苯那嗪的类似物、其制备方法及用途与流程
相关申请的交叉参考本申请案主张2017年3月15日申请的美国临时申请案第62/471,484号的权益,其全部内容以引用的方式并入本文中。
背景技术:
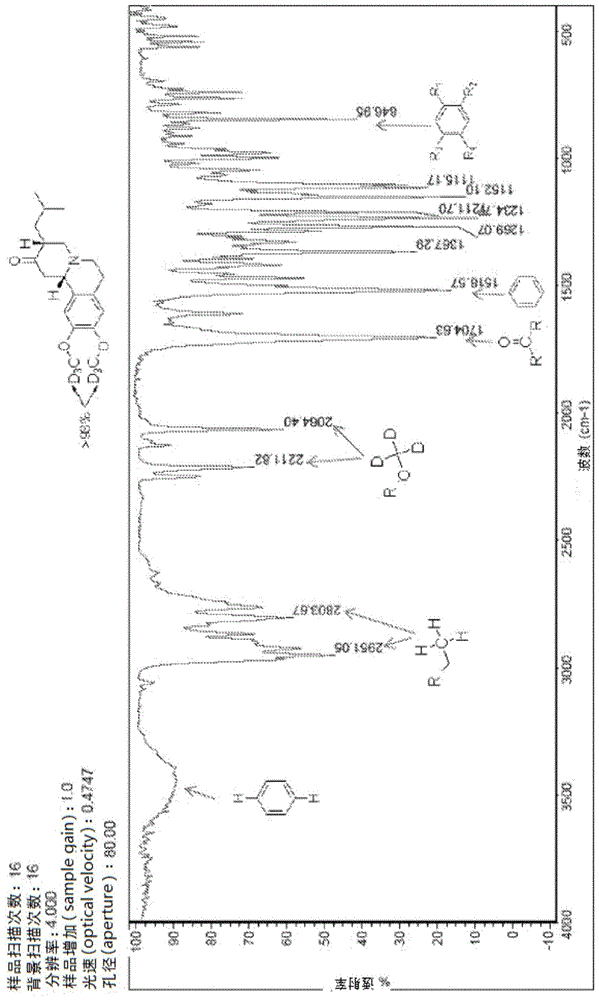
:丁苯那嗪(nitomantm、xenazinetm、ro1-9569)(1,3,4,6,7,11b-六氢-9,10-二甲氧基-3-(2-甲基丙基)-2h-苯并[a]喹啉)为囊状单胺转运体2(vmat2)抑制剂。丁苯那嗪通常经医生开药用于治疗亨廷顿氏病(huntington’sdisease)(savani等人,neurology2007,68(10),797;及kenney等人,expertreviewofneurotherapeutics2006,6(1),7-17)。丁苯那嗪d6-丁苯那嗪(d6-tetrabenazine)(usan及inn:氘代丁苯那嗪)是丁苯那嗪的氘化类似物,在美国系以商品名营销。当与非氘化药物比较时,其具有改善的药物动力学特性。参见例如us8,524,733。d6-丁苯那嗪(氘代丁苯那嗪)氘代丁苯那嗪的合成方法公开在美国公开申请案第2015/0152099号中。包含氘代丁苯那嗪的医药组合物公开在美国专利9,233,959中。美国公开申请案第2016/0287574号公开了用于治疗异常的非自主运动障碍的氘代丁苯那嗪。虽然氘代丁苯那嗪具有理想的及有益的效果,但仍存在对于治疗前述病症的优质组合物的持续需求。为确保药品如预期起作用,寻求销售批准的申请者需要概述药品中识别的杂质,如使用提出的商业制造工艺产生的杂质以及储存后产生的杂质。申请者必须确定药品在制造后及储存后的杂质识别的含量水平在生物学上是安全的。含有可接受的杂质描述说明的药品是有必要的。技术实现要素:本公开内容针对包含氘代丁苯那嗪原料药及医药学上可接受的载体的混杂物的医药组合物,其中氘代丁苯那嗪原料药包含:氘代丁苯那嗪;基于hplc方法的测定,相对于氘代丁苯那嗪的浓度的0.5面积%或更少的化合物1;及基于hplc方法的测定,相对于氘代丁苯那嗪的浓度的0.15面积%或更少的化合物2;且其中当在室温下储存一个月至二十四个月时,该医药组合物是稳定的。提供化合物1及化合物2的化学结构:本公开内容针对具有化合物1或化合物2的结构的分离的化合物、以及其盐及立体异构体。还描述包含化合物1及/或化合物2的组合物,以及使用该化合物作为参考标准的方法。本公开内容还针对用于测试包含氘代丁苯那嗪的组合物的样品是否含有非所要杂质的方法。还描述用于生产氘代丁苯那嗪药品的方法,以及分配包含氘代丁苯那嗪原料药的氘代丁苯那嗪药品的方法。描述用于验证用于分配的含有氘代丁苯那嗪及医药学上可接受的载体的医药产品的方法。还描述使用本文中所描述的化合物及组合物治疗罹患过动性运动障碍的个体的方法。附图简述图1:化合物1的ftir光谱。图2:化合物1的1hnmr。图3:化合物1的13cnmr。图4:化合物1的代表性层析图。图5:化合物2的ftir光谱。图6:化合物2的1hnmr。图7:化合物2的13cnmr。图8:化合物2的代表性层析图。发明详述在本公开内容中,除非上下文另外明确指示,否则单数形式“一(a/an)”及“该(the)”包括复数个引用,且特定数值的引用至少包括该特定值。因此,例如,“一种材料”的引用指的是本领域技术人员已知的此类材料及其等效物中的至少一者,以此类推。当通过使用描述词“约”来将值表达为近似值时,将理解,特定值形成另一实施例。一般而言,使用术语“约”指示可视试图由公开的主题获得的所要特性而变化的近似值,且基于其功能在它使用的特定情形中加以解释。在本公开内容的一些方面中,“约”是指为引述值的±10%的值的范围。举例来说,“约10”是指“9至11”以及“10”。本领域技术人员将能够按常规对此加以解释。在一些情况下,用于特定值的有效数字的数目可以是确定词“约”的程度的一个非限制性方法。在其他情况下,用于一系列数值的渐变可用于确定针对各值可供术语“约”使用的预期范围。在存在的情况下,所有范围均为包括性的且可组合。也即,对按范围陈述的值的引用包括该范围内的每一个值。应理解,当提供参数范围时,本发明还提供在该范围内的所有整数及其十分之一。举例来说,“20至40mg”包括20.0mg、20.1mg、20.2mg、20.3mg等直至40.0mg。当展示清单时,除非另外陈述,否则应理解,该清单中的各个别要素及该清单的每一个组合应解释为独立实施例。举例来说,表示为“a、b或c”的实施例的清单应解释为包括以下实施例:“a”、“b”、“c”、“a或b”、“a或c”、“b或c”或“a、b或c”。应了解,出于清楚目的而在独立实施例的情形中在本文中描述的本发明的某些特征也可以组合形式提供于单一实施例中。也即,除非明显地不兼容或已排除,否则认为各个别实施例可与任何其他实施例组合,且将此组合视为另一实施例。反之,出于简洁目的,在单一实施例的情况中描述的本发明的各种特征也可分别地或以任何子组合提供。应进一步注意,权利要求书可被起草以排除任何视情况选用的要素。因此,此陈述意欲充当前提基础以供使用与所主张要素的引述有关的此类排他性术语(如“仅仅(solely)”、“仅(only)”及其类似术语)或使用“负值”限制。最后,尽管实施例可描述为一系列步骤的一部分或更通用结构的一部分,但也可将各该步骤视为单独的实施例本身。本公开内容针对在室温下储存时处于稳定的氘代丁苯那嗪医药组合物。在一些方面中,当在室温下储存约一个月至约二十四个月时,医药组合物是稳定的。在一些方面中,当在室温下储存约一个月至约十八个月时,医药组合物是稳定的。在一些方面中,当在室温下储存约一个月至约十二个月时,医药组合物是稳定的。在一些方面中,当在室温下储存约一个月至约六个月时,医药组合物是稳定的。在一些方面中,当在室温下储存约一个月至约三个月时,医药组合物是稳定的。在一些方面中,当在室温下储存约一个月时,医药组合物是稳定的。举例来说,当在室温下储存约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或约24个月时,本公开内容的医药组合物是稳定的。本公开内容的医药组合物包含氘代丁苯那嗪原料药及医药学上可接受的载体的混杂物。根据本公开内容,氘代丁苯那嗪原料药包含氘代丁苯那嗪、化合物1及化合物2。在特别优选方面中,氘代丁苯那嗪原料药包含:氘代丁苯那嗪;基于hplc方法的测定,相对于氘代丁苯那嗪的浓度的0.5面积%或更少的化合物1;及基于hpld方法的测定,相对于氘代丁苯那嗪的浓度的0.15面积%或更少的化合物2。在优选方面中,基于hplc方法的测定,除氘代丁苯那嗪之外,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.5面积%或更少的化合物1。例示性hplc方法在本文中公开了。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.1面积%至约0.5面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.1面积%至约0.4面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.1面积%至约0.3面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.1面积%至约0.2面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.1面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.15面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.2面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.25面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.3面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.35面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.4面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.45面积%的化合物1。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.5面积%的化合物1。在优选方面中,基于hplc方法的测定,除氘代丁苯那嗪之外,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.15面积%或更少的化合物2。例示性hplc方法在本文中公开了。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.05面积%至约0.15面积%的化合物2。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.05面积%至约0.1面积%的化合物2。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.15面积%的化合物2。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.1面积%的化合物2。在一些方面中,基于hplc方法的测定,氘代丁苯那嗪原料药包含相对于氘代丁苯那嗪的浓度的约0.05面积%的化合物2。在一些方面中,基于hplc方法的测定,本发明的医药组合物包含相对于氘代丁苯那嗪的浓度的约3面积%或更少的化合物1。在其他方面中,基于hplc方法的测定,本发明的医药组合物包含相对于氘代丁苯那嗪的浓度的约0.4面积%或更少的化合物2。在又其他方面中,基于hplc方法的测定,本发明的医药组合物包含各自相对于氘代丁苯那嗪的浓度的约3面积%或更少的化合物1及约0.4面积%或更少的化合物2。在一些方面中,基于hplc方法的测定,本公开内容的医药组合物包含相对于氘代丁苯那嗪的浓度的约0.007面积%至3面积%的化合物1。在一些方面中,基于hplc方法的测定,本公开内容的医药组合物包含相对于氘代丁苯那嗪的浓度的0.01面积%至3面积%的化合物1。在一些方面中,基于hplc方法的测定,本公开内容的医药组合物包含相对于氘代丁苯那嗪的浓度的约0.1面积%至3面积%的化合物1。在一些方面中,基于hplc方法的测定,本公开内容的医药组合物包含相对于氘代丁苯那嗪的浓度的1面积%至3面积%的化合物1。举例来说,基于hplc方法的测定,本公开内容的医药组合物包含相对于氘代丁苯那嗪的浓度的0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9或3面积%的化合物1。在一些方面中,基于hplc方法的测定,本公开内容的医药组合物包含相对于氘代丁苯那嗪的浓度的约0.007面积%至0.4面积%的化合物2。在一些方面中,基于hplc方法的测定,本公开内容的医药组合物包含相对于氘代丁苯那嗪的浓度的约0.03面积%至0.4面积%的化合物2。在一些方面中,基于hplc方法的测定,本公开内容的医药组合物包含相对于氘代丁苯那嗪的浓度的约0.1面积%至0.4面积%的化合物2。举例来说,基于hplc方法的测定,本公开内容的医药组合物包含相对于氘代丁苯那嗪的浓度的0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.15、0.2、0.25、0.3、0.35或0.4面积%的化合物2。根据本公开内容,本公开内容的医药组合物包括具有不低于约50%的氘富集的氘代丁苯那嗪原料药。在本公开内容的一些方面中,本公开内容的医药组合物包括具有不低于约90%的氘富集的氘代丁苯那嗪原料药。在一些方面中,本公开内容的医药组合物包括具有不低于约95%的氘富集的氘代丁苯那嗪原料药。在一些方面中,本公开内容的医药组合物包括具有不低于约98%的氘富集的氘代丁苯那嗪原料药。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的氘代丁苯那嗪在甲氧基部分中的每一者处具有不低于约50%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的氘代丁苯那嗪在甲氧基部分中的每一者处具有不低于约90%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的氘代丁苯那嗪在甲氧基部分中的每一者处具有不低于约95%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的氘代丁苯那嗪在甲氧基部分中的每一者处具有不低于约98%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的化合物1在甲氧基部分中的每一者处具有不低于约50%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的化合物1在甲氧基部分中的每一者处具有不低于约90%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的化合物1在甲氧基部分中的每一者处具有不低于约95%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的化合物1在甲氧基部分中的每一者处具有不低于约98%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的化合物2在甲氧基部分中的每一者处具有不低于约50%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的化合物2在甲氧基部分中的每一者处具有不低于约90%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的化合物2在甲氧基部分中的每一者处具有不低于约95%的氘富集。在本公开内容的一些方面中,本公开内容的氘代丁苯那嗪原料药中的化合物2在甲氧基部分中的每一者处具有不低于约98%的氘富集。本公开内容还针对具有以下结构的分离的化合物:及以及其盐及立体异构体。在本发明的一实施例中,分离的化合物具有以下结构:在本发明的一实施例中,分离的化合物具有以下结构:本发明进一步提供分离的化合物1或2,其中表示为d的各位置具有不低于约10%的氘富集。优选地,不低于约50%。更优选地,不低于约90%。最优选地,不低于约98%。本发明还提供包含氘代丁苯那嗪及具有以下结构的至少一种化合物的组合物:其中组合物中化合物的重量相对于氘代丁苯那嗪的重量的比为99:1至1:99。在一实施例中,组合物中化合物的重量相对于氘代丁苯那嗪的重量的比为90:10至10:90或85:15至15:85。举例来说,在一些方面中,组合物中化合物的重量相对于氘代丁苯那嗪的重量的比为95:5、90:10、85:15、80:20、75:25、70:30、65:35、60:40、55:45、50:50、45:55、40:60、35:65、30:70、25:75、20:80、15:85、10:90或5:95。在其他方面中,组合物中化合物的重量相对于氘代丁苯那嗪的重量的比为5:95、10:90、15:85、20:80、25:75、30:70、35:65、40:60、45:55、50:50、55:45、60:40、65:35、70:30、75:25、88:20、85:15、90:10或95:5。本公开内容还提供包含具有以下结构的至少一种化合物的组合物:其中该组合物大体上不含氘代丁苯那嗪。如本文中所使用,“大体上不含氘代丁苯那嗪”是指具有小于1wt%的氘代丁苯那嗪,优选地小于0.1wt%的氘代丁苯那嗪。如本文中所使用,“不含氘代丁苯那嗪”是指如通过hplc方法所测定不具有氘代丁苯那嗪。化合物1为氘代丁苯那嗪的非对映异构体。其可作为制造工艺的副产物出现在原料药中。当储存原料药或药品(医药组合物)时,化合物1的量会随时间推移增加。根据本公开内容,为确保医药组合物(基于hplc方法的测定,该医药组合物不含有相对于氘代丁苯那嗪浓度的超过3面积%的化合物1)随时间推移的稳定性,已基于hplc方法的测定来测定用于制备医药组合物的氘代丁苯那嗪原料药应具有相对于氘代丁苯那嗪的浓度的0.5面积%或更少的化合物1。化合物2可由氧化/去氢化氘代丁苯那嗪形成。其可作为制造工艺的副产物出现在原料药中。当储存原料药(医药组合物)或药品时,化合物2的量会随时间推移增加。根据本公开内容,为确保医药组合物(基于hplc方法的测定,该医药组合物不含有相对于氘代丁苯那嗪的浓度的超过0.4面积%的化合物2)随时间推移的稳定性,已基于hplc方法的测定来测定用于制备医药组合物的氘代丁苯那嗪原料药应具有相对于氘代丁苯那嗪的浓度的0.15面积%或更少的化合物2。根据本公开内容,为确保医药组合物(基于hplc方法的测定,该医药组合物不含有各自相对于氘代丁苯那嗪的浓度的超过3面积%的化合物1及0.4面积%的化合物2)随时间推移的稳定性,已基于hplc方法的测定来测定用于制备医药组合物的氘代丁苯那嗪原料药应具有各自相对于氘代丁苯那嗪的浓度的0.5面积%或更少的化合物1及0.15面积%或更少的化合物2。本公开内容还提供包含一定量的氘代丁苯那嗪以及化合物1及化合物2中至少一者的医药组合物,其中a)基于hplc方法的测定,化合物1以相对于氘代丁苯那嗪浓度不超过10面积%的量存在于医药组合物中,或b)基于hplc方法的测定,化合物2以相对于氘代丁苯那嗪浓度不超过10面积%的量存在于医药组合物中。本公开内容还提供包含一定量的氘代丁苯那嗪以及化合物1及化合物2中至少一者的医药组合物,其中a)基于hplc方法的测定,化合物1以相对于氘代丁苯那嗪浓度不超过3面积%的量存在于医药组合物中,或b)基于hplc方法的测定,化合物2以相对于氘代丁苯那嗪浓度不超过0.4面积%的量存在于医药组合物中。在一个实施例中,化合物1及化合物2中至少一者存在于描述的医药组合物中。在一实施例中,医药组合物呈胶囊、片剂或液体悬浮液的形式。在另一实施例中,医药组合物呈口服单位剂型。在一实施例中,医药组合物包含5-30mg之间的氘代丁苯那嗪。在另一实施例中,医药组合物包含6-24mg之间的氘代丁苯那嗪。在另一实施例中,医药组合物包含约6mg氘代丁苯那嗪。在另一实施例中,医药组合物包含约9mg氘代丁苯那嗪。在另一实施例中,医药组合物包含约12mg氘代丁苯那嗪。在另一实施例中,医药组合物包含约15mg氘代丁苯那嗪。在另一实施例中,医药组合物包含约18mg氘代丁苯那嗪。在另一实施例中,医药组合物包含约21mg氘代丁苯那嗪。在另一实施例中,医药组合物包含约24mg氘代丁苯那嗪。在另一实施例中,医药组合物经制备以供每天投与一次。在另一实施例中,医药组合物经制备以供每天投与超过一次,例如,每天两次、每天三次、每天四次等。本公开内容还提供一种用于分离化合物1的方法,其包含从乙醇再结晶氘代丁苯那嗪及化合物1的混合物以产生化合物1。本公开内容还提供一种用于制备化合物2的方法,其包含氧化氘代丁苯那嗪以形成化合物2。本公开内容还提供一种用于测试包含氘代丁苯那嗪的组合物的样品是否含有非所要杂质(也即,非所要量的化合物1及/或化合物2)的方法,其包含测定样品是否含有具有以下结构的化合物的步骤:及/或本发明还提供一种用于产生氘代丁苯那嗪药品的方法,其包含获得氘代丁苯那嗪原料药且将氘代丁苯那嗪原料药与适合赋形剂混合以便产生氘代丁苯那嗪药品,其中氘代丁苯那嗪原料药包含:i)氘代丁苯那嗪原料药中一定量的化合物1,其基于hplc方法的测定,为相对于氘代丁苯那嗪的浓度的不超过0.5面积%的化合物1,或ii)氘代丁苯那嗪原料药中一定量的化合物2,其基于hplc方法的测定,为相对于氘代丁苯那嗪的浓度的不超过0.15面积%的化合物2。在一个实施例中,该方法进一步包含基于hplc方法的测定来测定氘代丁苯那嗪原料药中的化合物1及化合物2中的至少一者的量。本发明还提供一种生产用于商业销售及/或人类投与的氘代丁苯那嗪药品的方法,其包含获得一批次氘代丁苯那嗪药品,该氘代丁苯那嗪药品包含:i)该批次氘代丁苯那嗪药品中一定量的化合物1,其基于hplc方法的测定,为相对于氘代丁苯那嗪的浓度的不超过3面积%的化合物1,或ii)该批次氘代丁苯那嗪药品中一定量的化合物2,其基于hplc方法的测定,为相对于氘代丁苯那嗪的浓度的不超过0.4面积%的化合物2,及制备用于商业销售及/或人类投与的该批次氘代丁苯那嗪药品。在一个实施例中,该方法进一步包含测定氘代丁苯那嗪药品中化合物1及化合物2的至少一者的量。本发明还提供一种分配包含氘代丁苯那嗪原料药的氘代丁苯那嗪药品的方法,其包含:a)获得氘代丁苯那嗪药品,其中氘代丁苯那嗪原料药包含:i)氘代丁苯那嗪原料药中一定量的化合物1,其基于hplc方法的测定,为相对于氘代丁苯那嗪的浓度的不超过0.5面积%的化合物1,或ii)氘代丁苯那嗪原料药中一定量的化合物2,其基于hplc方法的测定,为相对于氘代丁苯那嗪的浓度的不超过0.15面积%的化合物2;及b)分配包含氘代丁苯那嗪原料药的氘代丁苯那嗪药品。本发明还提供一种分配氘代丁苯那嗪药品的方法,其包含a)获得氘代丁苯那嗪药品,该氘代丁苯那嗪药品包含:i)氘代丁苯那嗪药品中一定量的化合物1,其基于hplc方法的测定,为相对于氘代丁苯那嗪的浓度的不超过3面积%的化合物1,或ii)氘代丁苯那嗪药品中一定量的化合物2,其基于hplc方法的测定,为相对于氘代丁苯那嗪的浓度的不超过0.4面积%的化合物2;及b)分配氘代丁苯那嗪药品。本发明还提供一种杂质,其用作用以检测包含氘代丁苯那嗪的医药组合物中的杂质的痕量的参考标准,其中该杂质为化合物1或化合物2。本发明还提供一种测定包含氘代丁苯那嗪的组合物中杂质浓度的方法,该方法包含:a)由医药组合物制备样品溶液,b)制备包含乙腈的稀释剂溶液,c)制备包含氘代丁苯那嗪及稀释剂溶液的标准溶液,d)制备包含氘代丁苯那嗪及杂质的离析溶液,e)通过将770mg的乙酸铵溶解于1000ml水中来制备缓冲溶液,f)将稀释剂溶液、离析溶液、标准溶液及样品溶液注入于hplc中,g)使用190-400nm(优选220nm)的缓冲液及稀释剂下的紫外线吸收作为移动相进行hplc,其中梯度程序以80%缓冲液/20稀释剂开始且在20分钟内斜升至100%缓冲液,h)测定样品溶液的层析图中的杂质的保留时间(rt)及峰面积,及i)对样品溶液的层析图中的相应峰进行杂质定量,其中杂质为化合物1或化合物2。本发明还提供一种测定包含氘代丁苯那嗪及医药学上可接受的载体的医药组合物中杂质浓度的方法,该方法包含a)由医药组合物制备样品溶液,b)制备包含异丙醇及乙腈的稀释剂溶液,c)制备包含氘代丁苯那嗪及稀释剂溶液的标准溶液,d)制备包含氘代丁苯那嗪及杂质的离析溶液,e)通过将乙酸铵溶解于水中来制备缓冲溶液,f)将稀释剂溶液、离析溶液、标准溶液及样品溶液注入于hplc中,g)在190-400nm或220nm处使用紫外线吸收及作为移动相的缓冲溶液及乙腈的混合物进行hplc,h)测定样品溶液的层析图中的杂质的保留时间(rt)及峰面积,及i)对样品溶液的层析图中的相应峰进行杂质定量,其中杂质为化合物1或化合物2。本发明还提供一种治疗罹患过动性运动障碍的个体的方法,其包含向个体投与本发明的医药组合物。本发明还提供一种治疗罹患亨廷顿氏病的个体的方法,其包含向个体投与本发明的医药组合物。本发明还提供一种治疗罹患与亨廷顿氏病相关的舞蹈症的个体的方法,其包含向个体投与本发明的医药组合物。本发明还提供一种治疗罹患迟发性运动不能的个体的方法,其包含向个体投与本发明的医药组合物。本发明还提供一种治疗罹患与妥瑞症候群相关联的抽搐的个体的方法,其包含向个体投与本发明的医药组合物。本发明还提供一种用于验证用于分配的含有氘代丁苯那嗪及医药学上可接受的载体的批次医药产品的方法,其包含:a)基于hplc方法的测定,测定化合物1及化合物2中至少一者的量;及b)仅在以下情况下验证用于分配的该批次医药产品:i)基于hplc方法的测定,该批次医药产品经测定具有相对于氘代丁苯那嗪浓度不超过3面积%的化合物1,或ii)基于hplc方法的测定,该批次医药产品经测定具有相对于氘代丁苯那嗪浓度不超过0.4面积%的化合物2。本发明还提供一种用于制备包含氘代丁苯那嗪的经验证医药组合物的方法,其包含:a)获得一批次氘代丁苯那嗪原料药;b)基于hplc方法的测定,测定化合物1及化合物2中至少一者的量;及c)仅在以下情况下由该批次医药产品制备该医药组合物:i)基于hplc方法的测定,该批次医药产品经测定具有相对于氘代丁苯那嗪浓度不超过0.5%的化合物1,或ii)基于hplc方法的测定,该批次医药产品经测定具有相对于氘代丁苯那嗪浓度不超过0.15%的化合物2。本文中公开的各实施例预期适用于其他公开的实施例中的每一者。由此,本文中所描述的各种要素的所有组合均在本发明的范畴内。举例来说,封装及医药组合物实施例中所引述的要素可用于本文中所描述的方法及用途实施例中。术语如本文中所使用且除非另外说明,否则以下术语中的每一者应具有以下所陈述的定义。不对称中心存在于本文中公开的化合物中。视围绕手性碳原子的取代物的构型而定,这些中心由符号“r”或“s”表示。应理解,本发明涵盖所有立体化学异构体形式,包括非对映异构体、对映异构体及差向异构体形式以及d型异构体及l型异构体,及其混合物。化合物的个别立体异构体可由含有手性中心的可商购的起始材料合成地制备,或通过制备对映异构体产物的混合物,随后分离,诸如转化为非对映异构体的混合物,随后分离或再结晶,层析技术,在手性层析柱上直接分离对映异构体,或本领域中已知的任何其他适当的方法。特定立体化学的起始化合物为可商购的或可通过本领域中已知的技术制备及解决。另外,本文中公开的化合物可以几何异构体的形式存在。本发明包括所有顺式、反式、同侧、对侧、异侧(entgegen;e)及同侧(zusammen;z)异构体以及其适当的混合物。另外,化合物可以互变异构体的形式存在;所有互变异构体由本发明提供。另外,本文中公开的化合物可以非溶剂化形式以及具有诸如水、乙醇及类似物的医药学上可接受的溶剂的溶剂化形式存在。一般而言,溶剂化形式被视为等效于非溶剂化形式。术语“3s,11bs对映异构体”或术语“3r,11br对映异构体”是指具有下文所示结构式的氘代丁苯那嗪立体异构体中的任一者:(3s,11bs)-对映异构体(3r,11br)-对映异构体。在某些实施例中,化学结构可绘制为3s,11bs对映异构体或3r,11br对映异构体,但本说明书的文本可指示3s,11bs对映异构体、3r,11br对映异构体、其外消旋混合物(其可描述为(rr,ss)-d6-丁苯那嗪)或前述所有可以是意欲描述的。如本文中所使用,“原料药”是指药品中的活性成分或是指含有在配制成药品之前的活性成分的组合物,其在诊断、治愈、缓解、治疗或预防疾病时提供药理学活性或其他直接效果,或影响人类或动物的结构或任何功能。如本文中所使用,“药品”是指含有原料药以及至少一种医药学上可接受的载体的配制的或成品的剂型。如本文中所使用,“分离的”化合物为在肯定分离作用之后从粗反应混合物分离的化合物。分离作用涉及将化合物与粗反应混合物的其他已知组分分离,且允许保留一些杂质、未知副产物及粗反应混合物中残余量的其他已知组分。纯化为肯定分离作用的实例。如本文中所使用,关于氘代丁苯那嗪的术语“稳定”意谓氘代丁苯那嗪,其中当在特定温度下保持特定时间段时,特定杂质(例如,化合物1、化合物2或其组合)的量并不会增加至超过特定限制。更具体地说,术语“稳定”意谓氘代丁苯那嗪,其中当在室温下保持约1个月至约24个月时,如由hplc所测量,化合物1的量不会增加至超过氘代丁苯那嗪面积的总量的3%,或其中如由hplc所测量,化合物2的量不会增加至超过氘代丁苯那嗪面积的总量的0.4%。如本文中所使用,“室温”是指温度范围介于约20℃至约30℃。如本文中所使用,“稳定性测试”是指在特定时间间隔且在各种环境条件(例如,温度及湿度)下进行测试以得知药品是否在其指定存放期内分解且达到何种分解程度。测试的特定条件及时间为使得其促进药品在其存放期内预期所遇到的状况的条件及时间。举例来说,成品药物的稳定性测试的详细要求整理于21c.f.r§211.166中,其全部内容在此以引用的方式并入。如本文中所使用,“大约”在数值或范围的情形下意谓所述或所主张的数值或范围的±5%。如本文中所使用,如以毫克测量的化合物的“量”是指存在于制剂中化合物的毫克数,而不管制剂的形式。“为40mg的化合物的量”意谓制剂中化合物的量为40mg,而不管制剂的形式。因此,当呈载体的形式时,由于载体的存在,为提供剂量为40mg化合物所需要的载体的重量将大于40mg。如本文中所使用,“治疗(treating/treatment)”涵盖例如诱导抑制、消退或停滞疾病、病症或病状,或改善或缓解疾病、病症或病状的症状。如本文所使用,“改善”或“缓解”病症或病况应意谓减轻或减少该病症或病况的症状。如本文中所使用,“抑制”个体的疾病进展或疾病并发症意谓在个体中预防或减少疾病进展及/或疾病并发症。“向个体投与”意谓向个体给予、分配或施用药品、药物或治疗法以减轻、治愈或减少与病状(例如,病理性病状)相关联的症状。本发明的原料药(例如,氘代丁苯那嗪)可以与相对于预期的投与形式适当选择的适合医药稀释剂、增效剂、赋形剂或载体(在本文中被统称为医药学上可接受的载体)混合及与常规的医药上的实践一致的形式被投与。胶囊或片剂可含有合适的黏合剂、润滑剂、崩解剂、稀释剂、着色剂、引流剂及融化剂。用于本发明方法的化合物的剂量单位可包含单一化合物或其与额外治疗剂的混合物。如以毫克测量的氘代丁苯那嗪的“剂量”或“剂量单位”或“单位剂量”是指存在于制剂中氘代丁苯那嗪的毫克数,而不管制剂的形式。剂量单位可包含单一化合物或其化合物的混合物。剂量单位可制备为经口剂型,诸如片剂、胶囊、丸剂、粉剂、液体悬浮液及颗粒剂。举例来说,氘代丁苯那嗪的“剂量”或“剂量单位”可为6、9、12、15、18、21或24mg。如本文中所使用,“医药学上可接受的”组分为适合与人类及/或动物一起使用且无与合理的益处/风险比率相称的不当有害副作用(诸如毒性、刺激及过敏性反应)的组分。本发明还意欲包括在本文中公开的化合物上出现的原子的所有同位素,包括杂质。同位素包括原子数相同但质量数不同的那些原子。作为一般实例但非限制性地,氢的同位素包括氚及氘。碳的同位素包括c-12、c-13及c-14。如本文中所使用,用于筛检或测试样品中化合物的存在的分析方法的“检测极限”为临限值,在该临限值下不能通过所使用的分析方法检测到样品中的化合物。用于检测含有氘代丁苯那嗪的样品中杂质的给定hplc方法的检测极限可基于该方法及所检测的一种或多种杂质而变化。举例来说,用于检测化合物1的典型hplc方法的检测极限为0.01面积%,且用于检测化合物2的检测极限为0.03面积%。如本文中所使用,用于筛检或测试样品中化合物的存在的分析方法的“定量极限”为临限值,在该临限值下无法通过所使用的分析方法定量样品中的化合物。用于检测含有氘代丁苯那嗪的样品中杂质的给定hplc方法的定量极限可基于所检测的一种或多种杂质而变化。举例来说,用于定量化合物1的典型hplc方法的定量极限为0.007面积%,且用于化合物2的定量极限为0.007面积%。化合物的特征是指化合物展现,例如峰或保留时间的任何质量,如通过1h核磁光谱法、质谱法、红外线、紫外线或荧光分光光度法、气相层析、薄层层析、高效液相层析(hplc)、元素分析、埃姆斯测试(amestest)、溶解性、稳定性所测定,及可通过分析方法测定的任何其他质量。一旦已知化合物的特征,即可使用该信息来例如筛检或测试样品中化合物的存在。如本文中所使用,“nmt”意谓不超过。如本文中所使用,“lt”意谓小于。除非另外规定,否则杂质的量是通过反相hplc来测量的。如本文中所使用,术语“有效量”是指在按本发明的方式使用时足以产生所要治疗反应且无与合理的益处/风险比率相称的不当有害副作用(诸如毒性、刺激或过敏反应)的组分的数量,也即治疗有效量。特定有效量将随诸如以下因素而变化:待治疗的特定病症、患者的身体状况、待治疗的哺乳动物的类型、治疗的持续时间、并行疗法(若存在)的性质及所采用的特定配方及化合物或其衍生物的结构。如本文中所使用,“制备用于商业销售的药品”意谓进行制备以用于商业销售的活动。实例包括但不限于使药品着色、编码、压印、封装该药品。如本文中所使用,“氘富集”是指在分子的给定位置氘代替氢的并入百分比。举例来说,在给定位置的1%的氘富集意谓在给定样品中1%分子在特定位置含有氘。由于氘的自然存在的分布约0.0156%,因此使用非富集起始材料合成的化合物中的任何位置处的氘富集约0.0156%。氘富集可使用本领域技术人员所已知的常规分析方法(包括质谱法及核磁共振光谱法)来测定。如本文中所使用,“是氘”在用于描述分子中的给定位置时,或符号“d”在用于表示分子结构图式中的给定位置时,意谓特定位置富集有高于自然存在的氘分布的氘。在一个实施例中,氘富集在特定位置处不小于约1%,在另一实施例中不小于约5%,在另一实施例中不小于约10%,在另一实施例中不小于约20%,在另一实施例中不小于约50%,在另一实施例中不小于约70%,在另一实施例中不小于约80%,在另一实施例中不小于约90%或在另一实施例中不小于约98%的氘。医药组合物尽管根据本发明使用的化合物可以原始化合物的形式投与,但优选将活性成分(视情况呈生理学上可接受的盐的形式)与一或多种佐剂、赋形剂、载体、缓冲剂、稀释剂及/或其他惯用医药助剂一起引入医药组合物中。在一实施例中,本发明提供医药组合物,其包含活性化合物或其医药学上可接受的盐或衍生物以及一或多种医药学上可接受的载体,并且,可选择地,包含本领域中已知及使用的其他治疗性及/或预防性成分。载体必须在与配方中的其他成分兼容且对其接受者无害的意义上为“可接受”的。表1显示化合物1-2的结构。表1参考以下实验细节将更好地理解本发明,然而本领域技术人员将容易了解,详述的特定实验仅为说明本发明,其在其后的权利要求书中得到更充分描述。实验细节实例实例1制备化合物1通过用etoh(2×3v)再结晶来纯化从氘代丁苯那嗪的母液获得的粗物质(10g),以获得2.5g呈灰白色固体的化合物1。化合物1的nmr一致性分析化合物1:使用300mhznmr仪,使用化合物1于cdcl3(99.9%d原子)中的样品来测定表2中的以下数据。参见图2及图3。表2:1hnmr及13cnmra,c的分配位置1h化学位移(分裂模式,偶合常数)位置1h化学位移(分裂模式,偶合常数)12.61(m,1h),2.84(m,1h),116.61(s,1h)2n/a11b3.42(d,j=10.8hz,1h)32.53(m,1h)121.54(m,1h),1.80(m,1h)42.71(m,1h),2.98(m,1h)131.55(m,1h)5n/a140.92(m,6h)62.53(m,2h),3.02(m,2h)15n/a73.14(m,1h),2.65(m,1h)16n/a86.56(s,1h)17n/a9n/a18n/a10n/an/an/a位置13c化学位移(分裂模式,偶合常数)位置13c化学位移(分裂模式,偶合常数)145.22(s)11111.40(s)2212.42(s)11b62.01(s)349.06(s)1240.54(s)459.66(s)1325.74(s)5n/a1422.71(d)651.62(s)15128.67(s)729.19(s)16126.43(s)8107.64(s)17n/a9147.67(s)18n/a10147.43(s)n/an/aa分配是基于从hsqc(异核单量子相干波谱分析)及hmbc(异核多键相关性)实验提取的化学位移及1h-13c偶合。b参考nmr溶剂峰校准光谱。实例2制备化合物2向氘代丁苯那嗪(31.7g,10.0mmol)及四氯醌(26g,10.5mmol)中添加甲苯(300ml),且在回流下加热混合物2.5h。向深色溶液中添加甲苯(500ml),且用300ml的2nnaoh及h2o洗涤混合物。甲苯溶液经干燥(na2so4)、过滤且蒸发至干燥。残余物从乙酸乙酯中结晶以获得21g(66%)呈灰白色结晶固体的化合物2。化合物2的nmr一致性分析化合物2:使用300mhznmr仪使用化合物2于cdcl3(99.9%d原子)中的样品来测定表3中的以下数据。表3:1hnmr及13cnmra,b的分配a分配是基于信号的偶合模式、偶合常数及化学位移。b参考nmr溶剂峰校准光谱。参见图6及图7实例3-制备粗制氘代丁苯那嗪步骤1:碘化2-乙酰基-n,n,n,4-四甲基-1-戊烷铵:将3-[(二甲胺基)甲基]-5-甲基-己-2-酮(90g,0.526mol,1.00eq)中装入甲基第三丁基醚(1.35l,15.0vol)且在0-10℃下冷却。向反应混合物中缓慢添加碘代甲烷(171g,1.209mol,2.3eq)且在25-35℃下搅拌15小时。使该反应物升温至35-40℃维持2小时。在氮气下过滤经沈淀固体且用甲基第三丁基醚(900ml,10.0vol)洗涤。通过在乙酸乙酯(1.46l,10vol)中浆化来进一步纯化粗制产物且过滤,以获得呈白色固体的碘化2-乙酰基-n,n,n,4-四甲基-1-戊烷铵(146g)。步骤2:将含有d6-6,7-二甲氧基-3,4-二氢异喹啉(盐酸盐或游离碱,1.00eq)及溶剂的悬浮液装入碘化2-乙酰基-n,n,n,4-四甲基-1-戊烷铵。(若使用d6-6,7-二甲氧基-3,4-二氢异喹啉盐酸盐,则在室温下向反应混合物中添加碱。)在适当的温度下搅拌反应混合物,冷却,且添加水。过滤反应物质,且用水洗涤固体并干燥以获得产物。实例4-氘代丁苯那嗪原料药的样品中化合物1及2的量的分析。化合物1及2可用于测定含有氘代丁苯那嗪的组合物的纯度。参见图4及图8表4:装置仪器高压液相层析检测器pdaiuv检测器管柱x-bridge,c18,150×4.6mm,3.5μm或等效物波长220nm注入体积10.0μl管柱烘箱温度30℃流速1.0ml/min运行时间25min移动相a:10mm乙酸铵水溶液移动相b:乙腈稀释剂:乙腈表5:梯度程序:表6:用于测定相关物质的保留时间及相对保留时间:名称rt(min)rrt氘代丁苯那嗪13.161.00化合物114.251.08化合物29.940.76实例4:傅里叶变换红外光谱(ftir)分析化合物1及2的ftir光谱描绘于图1及图5中。实例4-氘代丁苯那嗪药品的长期稳定性表7:储存于室温下的7.5mg片剂表8:储存于室温下的15mg片剂实例5用化合物1进行90天的glp普通大鼠毒理学研究。在该研究中,氘代丁苯那嗪的未观测到的不良反应水平(noael)剂量为10毫克/公斤/天。那些剂量被显示在大鼠中提供0.346mg的化合物1/公斤/天,其接近0.056mg/kg的人类等效剂量。实例6用化合物1进行3天的glp小鼠微核子研究。该研究包括用化合物1对氘代丁苯那嗪进行glp细菌逆向突变分析。该研究还包括培养的人类周边血液淋巴球的活体外染色体畸变测试。在研究中,80毫克/公斤/天的氘代丁苯那嗪的最高量在雄性及雌性中均无遗传毒性。该剂量水平被预测向小鼠提供2.77mg化合物1/公斤/天,其接近0.23mg/kg的人类等效剂量。方面方面1.一种分离的化合物,其具有以下结构:或其盐或立体异构体。方面2.如方面1的分离的化合物,其具有以下结构:或其盐或立体异构体。方面3.如方面1的分离的化合物,其具有以下结构:或其盐或立体异构体。方面4.一种包含氘代丁苯那嗪及至少一种化合物的组合物,该化合物具有以下结构:其中组合物中化合物的重量相对于氘代丁苯那嗪的重量的比为99:1至1:99。方面5.一种组合物,其包含具有以下结构的化合物:其中该组合物大体上不含氘代丁苯那嗪。方面6.如方面4或5中任一者的组合物,其中化合物具有以下结构:方面7.如方面4或5中任一者的组合物,其中化合物具有以下结构:方面8.一种包含一定量的氘代丁苯那嗪及化合物1及化合物2中至少一者的医药组合物,其中a)基于hplc方法的测定,化合物1以相对于氘代丁苯那嗪浓度不超过10面积%的量存在于医药组合物中,或b)基于hplc方法的测定,化合物2以相对于氘代丁苯那嗪浓度不超过10面积%的量存在于医药组合物中。方面9.如方面8的医药组合物,其中a)基于hplc方法的测定,化合物1以相对于氘代丁苯那嗪浓度不超过3面积%的量存在于医药组合物中,或b)基于hplc方法的测定,化合物2以相对于氘代丁苯那嗪浓度不超过0.4面积%的量存在于医药组合物中。方面10.如方面9的医药组合物,其中a)基于hplc方法的测定,化合物1以相对于氘代丁苯那嗪浓度不超过0.15面积%的量存在于医药组合物中,或b)基于hplc方法的测定,化合物2以相对于氘代丁苯那嗪浓度不超过0.15面积%的量存在于医药组合物中。方面11.如方面9的医药组合物,其中a)基于hplc方法的测定,化合物1以相对于氘代丁苯那嗪浓度大于0.01面积%且不超过3面积%的量存在于医药组合物中,或b)基于hplc方法的测定,化合物2以相对于氘代丁苯那嗪浓度大于0.01面积%且不超过0.4面积%的量存在于医药组合物中。方面12.如方面9的医药组合物,其中a)基于hplc方法的测定,化合物1以相对于氘代丁苯那嗪浓度大于0.01面积%且不超过0.15面积%的量存在于医药组合物中,或b)基于hplc方法的测定,化合物2以相对于氘代丁苯那嗪浓度大于0.01面积%且不超过0.15面积%的量存在于医药组合物中。方面13.如方面11至12中的任一者的医药组合物,其中a)基于hplc方法的测定,化合物1以相对于氘代丁苯那嗪浓度小于0.04面积%的量存在于医药组合物中,或b)基于hplc方法的测定,化合物2以相对于氘代丁苯那嗪浓度小于0.04面积%的量存在于医药组合物中。方面14.如方面9的医药组合物,其中a)基于hplc方法的测定,化合物1以相对于氘代丁苯那嗪浓度小于0.01面积%的量存在于医药组合物中,或b)基于hplc方法的测定,化合物2以相对于氘代丁苯那嗪浓度小于0.01面积%的量存在于医药组合物中。方面15.如方面8至14中的任一者的医药组合物,其包含化合物1及化合物2。方面16.如方面8至14中的任一者的医药组合物,其包含化合物1。方面17.如方面8至14中的任一者的医药组合物,其包含化合物2。方面18.如方面8至17中的任一者的医药组合物,其包含氘代丁苯那嗪。方面19.如方面8至18中的任一者的医药组合物,其呈胶囊、片剂或液体悬浮液的形式。方面20.如方面19的医药组合物,其呈口服单位剂型。方面21.如方面20的医药组合物,其包含5-30mg之间的氘代丁苯那嗪。方面22.如方面21的医药组合物,其包含6-24mg之间的氘代丁苯那嗪。方面23.如方面22的医药组合物,其包含约6mg氘代丁苯那嗪。方面24.如方面22的医药组合物,其包含约9mg氘代丁苯那嗪。方面25.如方面22的医药组合物,其包含约12mg氘代丁苯那嗪。方面26.如方面22的医药组合物,其包含约15mg氘代丁苯那嗪。方面27.如方面22的医药组合物,其包含约18mg氘代丁苯那嗪。方面28.如方面22的医药组合物,其包含约21mg氘代丁苯那嗪。方面29.如方面22的医药组合物,其包含约24mg氘代丁苯那嗪。方面30.如方面22的医药组合物,其经制备以供每天投与一次。方面31.如方面22的医药组合物,其经制备以供每天投与超过一次。方面32.一种用于测试包含氘代丁苯那嗪的组合物的样品是否含有非所要杂质的方法,其包含基于hplc方法的测定来确定样品是否含有具有以下结构的至少一种化合物的步骤:方面33.一种用于生产氘代丁苯那嗪药品的方法,其包含获得氘代丁苯那嗪原料药,且将氘代丁苯那嗪原料药与适合赋形剂混合以便产生氘代丁苯那嗪药品,其中氘代丁苯那嗪原料药包含:i)氘代丁苯那嗪原料药中一定量的化合物1,其基于hplc方法的测定,为相对于氘代丁苯那嗪浓度不超过0.5面积%的化合物1,或ii)氘代丁苯那嗪原料药中一定量的化合物2,其基于hplc方法的测定,为相对于氘代丁苯那嗪浓度不超过0.15面积%的化合物2。方面34.如方面33的方法,其中该方法进一步包含测定氘代丁苯那嗪原料药中化合物1及化合物2中至少一者的量。方面35.一种生产用于商业销售的氘代丁苯那嗪药品的方法,其包含获得一批次氘代丁苯那嗪药品,该氘代丁苯那嗪药品包含:i)该批次氘代丁苯那嗪药品中一定量的化合物1,其基于hplc方法的测定,为相对于氘代丁苯那嗪浓度不超过3面积%的化合物1,或ii)该批次氘代丁苯那嗪药品中一定量的化合物2,其基于hplc方法的测定,为相对于氘代丁苯那嗪浓度不超过0.4面积%的化合物2,及制备用于商业销售的该批次氘代丁苯那嗪药品。方面36.如方面35的方法,其中该方法进一步包含测定该批次氘代丁苯那嗪药品中的化合物1及化合物2中至少一者的量。方面37.一种分配包含氘代丁苯那嗪原料药的氘代丁苯那嗪药品的方法,其包含:a)获得氘代丁苯那嗪药品,其中氘代丁苯那嗪原料药包含:i)氘代丁苯那嗪原料药中一定量的化合物1,其基于hplc方法的测定,为相对于氘代丁苯那嗪浓度不超过0.5面积%的化合物1,或ii)氘代丁苯那嗪原料药中一定量的化合物2,其基于hplc方法的测定,为相对于氘代丁苯那嗪浓度不超过0.15面积%的化合物2;及b)分配包含氘代丁苯那嗪原料药的氘代丁苯那嗪药品。方面38.一种分配氘代丁苯那嗪药品的方法,其包含a)获得氘代丁苯那嗪药品,该氘代丁苯那嗪药品包含:i)氘代丁苯那嗪药品中一定量的化合物1,其基于hplc方法的测定,为相对于氘代丁苯那嗪浓度不超过3面积%的化合物1,或ii)氘代丁苯那嗪药品中一定量的化合物2,其基于hplc方法的测定,为相对于氘代丁苯那嗪浓度不超过0.4面积%的化合物2;及b)分配氘代丁苯那嗪药品。方面39.一种杂质,其用作用以检测包含氘代丁苯那嗪的医药组合物中的杂质的痕量的参考标准,其中该杂质为方面40.一种治疗罹患过动性运动障碍的个体的方法,其包含向个体投与方面8至31中的任一者的医药组合物。方面41.如方面40的方法,其中过动性运动障碍为亨廷顿氏病。方面42.如方面40的方法,其中过动性运动障碍为与亨廷顿氏病相关的舞蹈症。方面43.如方面40的方法,其中过动性运动障碍为迟发性运动不能。方面44.如方面40的方法,其中过动性运动障碍为与妥瑞症候群相关联的抽搐。方面45.一种用于验证用于分配的含有氘代丁苯那嗪及医药学上可接受的载体的一批次医药产品的方法,其包含:a)测定该批次医药产品中化合物1及化合物2中的至少一者的量;及b)仅在以下情况下验证用于分配的该批次医药产品:i)该批次医药产品经测定具有相对于氘代丁苯那嗪浓度不超过3面积%的化合物1,或ii)该批次医药产品经测定具有相对于氘代丁苯那嗪浓度不超过0.4面积%的化合物2。方面46.一种用于制备包含氘代丁苯那嗪的经验证医药组合物的方法,其包含:a)获得一批次氘代丁苯那嗪原料药;b)测定该批次医药产品中化合物1及化合物2的至少一者的量;及c)仅在以下情况下由该批次医药产品制备该医药组合物:i)该批次医药产品经测定具有相对于氘代丁苯那嗪的浓度的不超过0.5%的化合物1,或ii)该批次医药产品经测定具有相对于氘代丁苯那嗪的浓度的不超过0.15%的化合物2。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1