用于治疗细菌感染的手段和方法与流程
发明领域
本发明涉及非天然存在的抗细菌肽。更特别地,所述肽可以用于治疗多重耐药细菌感染。此外,本发明提供了用于制备抗细菌肽的方法。
发明介绍
对多种药物具有耐药性的微生物引起了人们的极大关注,并且其后果对于特别容易受到细菌感染的儿童而言可能是最深远的影响。发展中国家最常见的儿童细菌性疾病-肺炎、其它呼吸道感染和痢疾-已不再可以通过许多较旧的抗生素治愈。其后果是灾难性的:例如,细菌性急性呼吸道感染每年导致超过300万儿童死亡。这些疾病的许多情况是由现在对普通抗生素具有抗性的菌株引起的。在较富裕的国家中,医院对耐甲氧西林的金黄色葡萄球菌(staphylococcusaureus)(mrsa)的爆发感到震惊。从1974年到2004年,在许多美国医院中,mrsa的患病率从葡萄球菌感染的大约2%上升到50%以上,导致数万人死亡。对抗生素的耐药性也对治愈患者的费用产生了惊人的影响。在许多贫困国家中,药品支出占整体卫生保健费用的很大一部分,占卫生总支出的20-60%。当一线药物失败时,二线替代药物几乎总是昂贵得多,并且需要更大的医疗监督。例如,治愈一名广泛耐药tb患者的费用与治愈200名易感tb患者的费用相同。除了已知的病原体之外,对许多药物具有内在抗性的机会性生物体的相对较新出现也使医学技术的发展变得复杂。随着更大量免疫功能低下的患者和更长的时间处于免疫功能低下的状态,几种生物体已成为“特殊”病原体-典型地仅攻击最脆弱的患者。在这些机会性病原体中有肠球菌、凝固酶阴性葡萄球菌、铜绿假单胞菌(pseudomonasaeruginosa)和鲍氏不动杆菌(acinetobacterbaumanii)。
在本发明中,我们公开了一种新的设计者的抗生素范例,其利用蛋白质聚集通过广泛的蛋白静止性崩溃杀死细菌。由于体内高度拥挤的胞内环境使非常靠近的许多种类的多肽需要进行容易出错的折叠反应才能获得其天然构象2,因此蛋白质稳态或蛋白稳态损失1对于任何活细胞都是一个持续的威胁。为了控制这种威胁,细胞进化出了由分子伴侣、蛋白酶和其它特殊分子组成的复杂网状结构3。尽管该机制的基本组成在所有生命王国中都是保守的,但与在真核细胞中观察到的更为复杂的版本相比4,细菌具有相对简单的蛋白稳态网状结构。尽管存在这些细胞应答机制,但人类蛋白质折叠病理学已经清楚表明,在持续暴露于聚集蛋白质的情况下,例如突变的结果是,蛋白稳态网状结构最终分解,最终导致细胞死亡5。另一方面,蛋白质聚集被证明是高度有序并且特定的过程:聚集在相似多肽之间比在无关多肽之间更有效6-8。在机械论水平上,蛋白聚集是由短聚集倾向序列片段(称为apr)介导的,该片段在一级多肽序列中平均大约每100个氨基酸发生一次。这些apr通常是(但并非总是)构成球形蛋白或蛋白-蛋白相互作用界面的疏水核心的序列区段。令人遗憾地,提供这些三级蛋白质相互作用模式的物理化学要求也有利于蛋白质聚集9。实际上,在(部分)未折叠的蛋白质中,在形成天然蛋白质最稳定的部分时,apr也可以与来自另一种蛋白质的相同apr进行自组装,以形成甚至更稳定的β结构聚集体10。因此,在蛋白质获得其天然构象之前,聚集的风险在翻译过程中最高11。总体而言,细菌蛋白质组比高级生物体显示出更高的内在聚集敏感性14。另外,细菌中的蛋白质转换需要更快以支持其高代谢和细胞分裂速率,这进一步增加了细菌中蛋白质聚集的可能性。越来越多地研究细菌蛋白稳态作为新抗生素的药物靶标15。例如,抗微生物肽(amp)oncocin通过结合到核糖体出口通道发挥其抗细菌活性16。有意义的是,肽的淀粉样蛋白形成倾向与其抗细菌活性之间存在明显的重叠17,18,并且我们预先观察到,源自革兰氏阳性表皮葡萄球菌(staphylococcusepidermidis)聚集蛋白质片段的肽可能对这些细菌有特异性毒性19。
蛋白质聚集是一种序列特异性过程,它使蛋白质可以模板化其自身的聚集,但不能模板化异源序列。我们以前利用此特征在westernblot8中进行特异性蛋白质检测,或使用靶蛋白质的短聚集倾向序列片段(apr)诱导特异性蛋白质敲除。使用融合到目标apr的转基因gfp载体,我们在拟南芥(arabidopsisthaliana)和玉米(zeamays)中产生了特异性功能丧失表型,分别导致植物大小增加和淀粉含量增加21。我们还发现有可能使用合成肽达到相同的效果,并且最近设计了一种名为vascin的肽,该肽被人细胞内化,并且通过聚集特异性诱导vegfr-2失活。此外,在同基因鼠模型中,vascin在体内具有抑制vegfr-2依赖性肿瘤生长的活性47。近来,我们还研究了具有革兰氏阳性葡萄球菌内源性apr的合成肽是否可以在体外诱导聚集相关的细菌死亡,并且发现了几种在体内对mrsa有活性的肽19。
发明概述
鉴于抗细菌药耐药性迅速增加的问题,尤其是在革兰氏阴性细菌中,我们在这里着手开发对抗肠出血性大肠杆菌(e.coli)菌株o157:h7的新抗微生物肽,该菌株产生高水平的毒素,导致感染时出血性腹泻和肾衰竭20。假设对具有多个靶标的药物更难产生耐药性,我们寻找可以引起多种细菌蛋白质错误折叠或聚集的肽。为此,我们筛选了125个在大肠杆菌蛋白质组中具有高度丰余性的聚集序列。以这种方式,一种含有该apr的肽可以潜在地影响许多含有高度相似的apr的蛋白质的折叠。使用这种策略,我们鉴定了几种在致病性大肠杆菌中有效诱导杀细菌蛋白质聚集和包涵体形成的肽。这些的一个代表-在本文中进一步命名为colpeptin1-对哺乳动物细胞几乎没有毒性或无毒性,并且还对许多其它细菌病原体具有活性(参见表2),并且在小鼠膀胱感染模型中对大肠杆菌具有体内有效作用。我们证明了非天然肽(例如colpeptin1)的内化,然后是通过主要的colpeptin1靶标促进的多种蛋白质的快速聚集级联,从而导致细菌蛋白稳态崩解。
附图
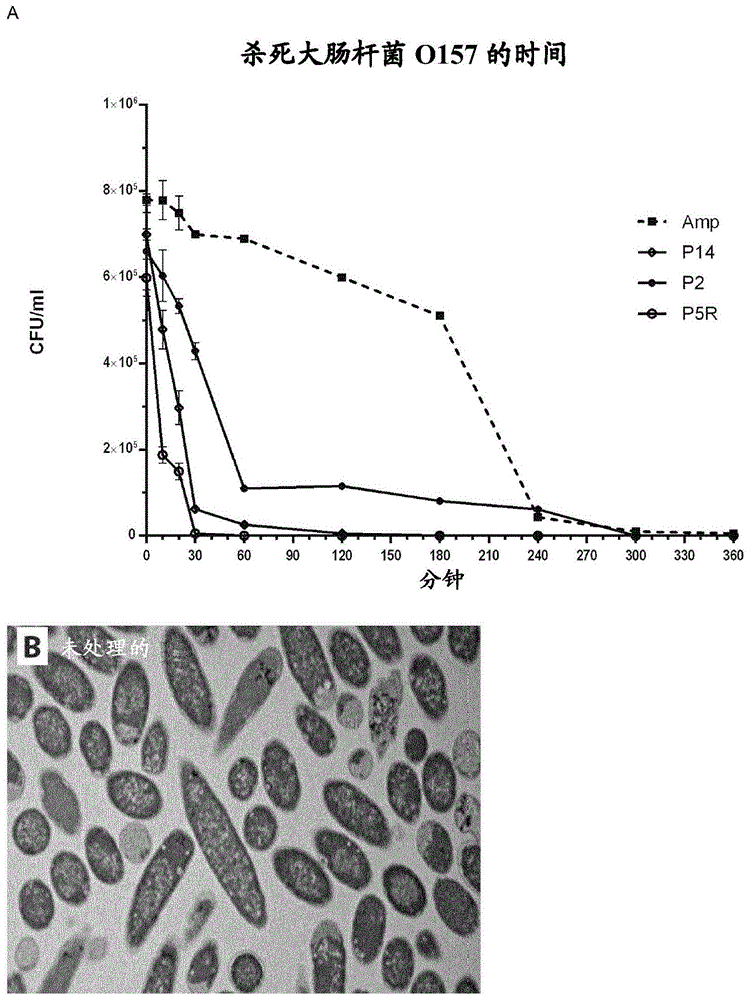
图1:抗细菌聚集肽的活性、细胞毒性和聚集。(a)在mic浓度(3次重复的平均值和s.d.)下处理的对抗大肠杆菌菌株o157的所选肽的时间-杀死曲线。(b、c、d)包埋入树脂中的大肠杆菌o157的横截面的透射电子显微胶片(tem)。b为模拟物处理的,c为p2处理的大肠杆菌o157(2小时)并且d为p105处理的大肠杆菌o157(2小时)。(e)通过监测在亚致死剂量的肽或氨苄西林(mic的50%)下维持36天的培养物的mic值来监测耐药性的自发建立。(f)所选肽对人红细胞的浓度依赖性溶血作用(3次重复的平均值和s.d.)。(g)通过celltiterblue测定法(3次重复的平均值和s.d.)和(h)通过ldh释放测定法(3次重复的平均值和s.d.)测定的colpeptin1对人hela细胞的细胞毒性。(i)在50mmmes缓冲液ph7中将单体稀释至最终肽浓度为100μm后两分钟,显示了colpeptin1单体(1)到九聚体(9)的esi-ims-msdriftscope图。esi–ims–msdriftscope图显示了ims迁移时间与质/荷(m/z)与强度(z,平方根标度)的关系。数据来自单个试验,该试验重复了3次。(j)使用线性聚合物作为颗粒模型,根据记录的新鲜溶解的colpeptin1的dls数据计算的颗粒尺寸分布的直方图。(k)250.000g超速离心2小时后的肽样品的溶解度(4次重复的平均值和s.d.)。(l)前一组获得的不溶级分的ftir光谱(4次重复的平均值和s.d.)。(m)添加到colpeptin1制备物中的淀粉样特异性染料pftaa的荧光强度,归一化为使用相同的单体单元浓度的alzheimerβ肽的淀粉样原纤维观察到的强度(3次重复的平均值和s.d.)。(n)colpeptin1的代表性透射电子显微镜检查图像(乙酸双氧铀负染色)。(o)在1mm六磷酸盐的存在下,通过pftaa荧光监测的colpeptin1的聚集动力学(4次重复的平均值和s.d.)。
图2:交叉接种和体内活性。(a)与大肠杆菌o157混合并且用fitc-标记的colpeptin1处理的hela细胞的荧光显微镜检查图像(绿色通道)。蓝色通道为dapi,红色为cellmask深红色质膜染料。(d)在人血清的存在下,colpeptin1对细菌生长的抑制作用(3次重复的平均值和s.d.)。(e)使用30mg/kgcolpeptin1处理18天的动物血清,对固定的colpeptin1进行elisa(在3只小鼠中重复3次)。(f-i)在(f)肾脏、(g)结肠、(h)膀胱和(i)输尿管中用colpeptin1(p2)和对照(氨苄西林、缓冲液和p2-pro,每组15只动物)处理后经尿道感染大肠杆菌o157的小鼠器官中的细菌载量。有关详细信息,参见材料和方法。
图3:摄取和包涵体形成。(a-e)对10.000个大肠杆菌o157细胞进行荧光激活细胞分选(facs)分析,如下测量fitc荧光(x-轴)和碘化丙啶荧光(y-轴):(a)未经处理和热灭活的细菌按1:1混合,(b)用fitc标记的colpeptin1处理15分钟的细菌。(c)处理1小时。(d)处理3小时。(e)处理6小时。(f)来自四个独立试验(例如a-e中所示)的fitc-阳性细胞的平均群大小,。(g)用fitc-colpeptin1处理15分钟和(h)1小时的大肠杆菌的荧光显微镜检查图像。(i)用colpeptin1和pftaa处理的大肠杆菌o157的荧光显微镜检查图像。(j)用缓冲液、非聚集p2-pro和colpeptin1(p2)处理的大肠杆菌o157中淀粉样蛋白特异性染料pftaa的荧光发射光谱(3次重复的平均值)。(k)colpeptin1对菌落形成的时间依赖性作用。(l)来自四个独立的facs试验(例如a-e中所示)的pi-阳性细胞的平均群大小。(m-o)大肠杆菌o157的扫描电子显微镜检查(sem)。(m)是模拟处理的细菌的图像,(n)是p105处理的图像和(o)是p14处理的大肠杆菌o157的图像。
图4:colpeptin1和p53cd包涵体的表征。(a)过表达p53cd的细菌和未转化对照的生长曲线。(3次重复的平均值和s.d.),(d)从用colpeptin1、p2pro或缓冲液处理的大肠杆菌o157中纯化的和用于比较的从正常的和瞬时过表达人p53蛋白核心结构域的大肠杆菌bl21中纯化的包涵体的sds-page的考马斯染色。(e)与d中相同的样品的蛋白质印迹分析。(f)稳定表达用colpeptin1处理的dnak(mcer)荧光融合体的大肠杆菌细胞的荧光图像。(h)使用对抗重组制备的hcab产生的抗体用colpeptin1处理的细菌的可溶和不可溶级分的蛋白质印迹。(j)预测与colpeptin1共聚集的蛋白质的计算翻译效率(根据tuller等人35)。
图5:经ip注射18天后,由colpeptin1处理的小鼠体重。
图6:连续18天用30mg/kgcolpeptin1处理的小鼠的组织切片的病理分析。
图7:单次注射colpeptin1(10mg/kg)后3小时,离体器官的荧光成像。
图8:向大肠杆菌bl2菌株、鲍氏不动杆菌、肺炎克雷伯菌(klebsiellapneumoniae)和铜绿假单胞菌施用一组28个肽,其序列如表4所示。描绘了mic值。
图9:上组列出了colpeptin1(图中的p2)对抗多种临床大肠杆菌分离物的活性(mic值)。临床分离物对抗12种不同抗生素的敏感性(s)或耐药性(r)或中等耐药性(i)描绘在组中(根据clsi针对特定抗生素的标准得出的数据)。mic值<32μg/ml被认为是有活性的。测试的最高浓度为32μg/ml的colpeptin1。下组列出了colpeptin1(图中的p2)对抗许多鲍氏不动杆菌临床分离物的活性(mic值)。临床分离物对抗12种不同抗生素的敏感性(s)或耐药性(r)或中等耐药性(i)描绘在组中(根据clsi针对特定抗生素的标准得出的数据)。mic值<32μg/ml被认为是有活性的。测试的最高浓度为32μg/ml的colpeptin1。提及p2突变体是指衍生自colpeptin1的变体无活性序列,如表1所述。
发明详述
将针对特定实施方案并且参考某些附图来描述本发明,但是本发明不限于此,而是仅由权利要求来限定。权利要求中的任何参考标记不应被解释为限制范围。当然,应当理解,根据本发明的任何特别实施方案,不一定可以实现所有方面或优点。因此,例如,本领域技术人员将认识到,本发明可以以实现或优化本文所教导的一个优点或一组优点的方式具体实施或进行,而不必实现本文所教导或建议的其它方面或优点。
当结合附图阅读下面的详细描述时,可以最好地理解本发明的组织和操作方法以及其特征和优点。参考下文描述的实施方案,本发明的各方面和优点将变得显而易见并得到阐明。在说明书的上下文中,所涉及的“一个实施方案”或“一种实施方案”是指结合该实施方案描述的特定特征、结构或特性包括在本发明的至少一个实施方案中。因此,在整个说明书中多处出现的短语“在一个实施方案中”或“在一种实施方案中”并不一定全都指同一实施方案,而是可以是同一个实施方案。类似地,应当理解,在本发明的示例性实施方案的描述中,有时将本发明的多种特征组合在单个实施方案、图或其描述中,以简化公开内容并且帮助理解多个创造性方面的一个或多个。然而,该公开的方法不应被解释为反映了这样一种意图,即所要求保护的发明需要比每个权利要求中明确叙述的特征更多的特征。相反,如所附权利要求所反映的,发明的方面在于少于单个前述公开的实施方案的所有特征。
提及单数名词时使用的不定冠词或定冠词,例如除非另外特别说明,否则“一个”或“该”包括该名词的复数形式。在本说明书和权利要求中使用术语“包含”时,其不排除其它要素或步骤。此外,说明书和权利要求中的术语第一,第二,第三等用于区分相似要素,而不必须用于描述顺序或时间顺序。应当理解,如此使用的术语在适当的情况下是可互换的,并且本文描述的本发明的实施方案能够以不同于本文描述或示例的其它顺序来操作。仅提供以下术语或定义以帮助理解本发明。除非本文特别定义,否则本文使用的所有术语具有与本发明领域的技术人员认为的相同的含义。从业人员特别涉及如下用于本领域定义和术语的文献:sambrook等人,molecularcloning:alaboratorymanual,第4版,coldspringharborpress,plainsview,newyork(2012);和ausubel等人currentprotocolsinmolecularbiology(增刊114),johnwiley&sons,newyork(2016)。本文提供的定义不应被视为具有小于本领域技术人员所理解的范围。
当涉及可测量值(例如量,时间范围等)时,本文所用的“约”意在包括距规定值±20%或±10%的变化,更优选±5%,甚至更优选±1%并且更优选±0.1%,因为这样的变化适合于进行所公开的方法。
术语“多肽”和“肽”在本文中进一步可互换使用,并且是指氨基酸残基的聚合物及其变体和合成类似物。因此,这些术语应用于氨基酸聚合物,其中一个或多个氨基酸残基为合成的非天然存在的氨基酸,例如相应天然存在的氨基酸的化学类似物,以及天然存在的氨基酸聚合物。该术语还包括多肽的翻译后修饰,例如糖基化、磷酸化、酰胺化、氧化和乙酰化。所谓“重组多肽”是指使用重组技术即通过表达重组或合成的多核苷酸制备的多肽。术语“表达”或“基因表达”是指一种或多种特定的基因或特定的基因构建体的转录。术语“表达”或“基因表达”特别指将一种或多种基因或基因构建体转录成结构rna(rrna、trna)或mrna,随后将其翻译或不将其翻译成蛋白质。该过程包括dna的转录和所得mrna产物的加工。本文所用的术语“重组宿主细胞”,“工程化的细胞”,“表达宿主细胞”,“表达宿主系统”,“表达系统”或简称为“宿主细胞”,意指其中已经导入了重组载体和/或嵌合基因构建体的细胞。应当理解,这些术语不仅旨在指特定的个体细胞,而且还指该细胞的子代。因为由于突变或环境影响,某些修饰可能在成功的后代中发生,所以这种子代实际上可能与亲代细胞不同,但仍包括在本文所用的术语“宿主细胞”的范围内。术语“调节”指特定水平或活性的增强(例如增加)或抑制(例如减少)。术语“增强”或“增加”是指特定参数增加至少约1.25-倍、1.5-倍、2-倍、3-倍、4-倍、5-倍、6-倍、8-倍、10-倍、12-倍乃至15-倍。
如本文所用,术语“抑制”或“减少”或其语法变化是指特定水平或活性降低或减少至少约15%、25%、35%、40%、50%、60%、75%、80%、90%、95%或以上。在特别的实施方案中,抑制或减少导致几乎没有或基本上没有可检测的活性(至多是微不足道的量,例如小于约10%乃至5%)。
关于本发明的非天然存在的肽或其变体和细菌分离物使用的术语“接触”或其语法变体是指使非天然存在的肽(或其变体)与细菌分离物足以彼此接近以发挥一者对另一者的生物学作用。在一些实施方案中,术语接触是指特异性非天然存在的肽与细菌分离物的结合。本文所用的“治疗有效”量是为个体提供一些改善或益处的量。换句话说,“治疗有效”量是将在个体的至少一种临床症状中提供一定程度的缓解、减轻或减少的量。本领域技术人员将理解,只要向个体提供了某些益处,治疗效果就不必是完全的或治愈的。所谓术语“治疗”表示个体的病症的严重程度减轻或至少部分改善或改变,以及至少一种临床症状实现缓解、减轻或减少。如本文所用,“功能性”肽是基本上保留通常与该肽相关的至少一种生物学活性(例如结合和抑制细菌的生长(或杀死细菌))的肽。在特别的实施方案中,“功能性”肽基本上保留了未修饰肽所具有的所有活性,所谓“基本上保留”生物学活性是指该肽保留了至少约20%、30%、40%、50%、60%、75%、85%、90%、95%、97%、98%、99%或以上的天然多肽的生物学活性(并且甚至可以具有比天然肽更高的活性水平)。生物学活性例如蛋白质结合和细菌抑制活性可以使用本文所述的测定法和本领域众所周知的其它测定法测定。
如本文所用,术语“保守氨基酸取代”是指通常在肽序列中正常存在的氨基酸被具有相似大小、电荷或极性的不同氨基酸取代。保守取代的实例包括用非极性(疏水)残基例如异亮氨酸、缬氨酸和亮氨酸取代另一个非极性残基。同样,保守取代的实例包括一个极性(亲水)残基取代另一个,例如精氨酸和赖氨酸之间、谷氨酰胺与天冬酰胺之间以及甘氨酸与丝氨酸之间。另外,保守取代的另外实例是用碱性残基例如赖氨酸、精氨酸或组氨酸取代另一个,或用一个酸性残基例如天冬氨酸或谷氨酸取代另一个酸性残基。非保守取代的实例包括非极性(疏水)氨基酸残基例如异亮氨酸、缬氨酸、亮氨酸、丙氨酸、蛋氨酸取代极性(亲水)残基例如半胱氨酸、谷氨酰胺、谷氨酸或赖氨酸和/或极性残基取代非极性残基。
本发明提供了新的设计者抗生素范例,该范例利用聚集来通过广泛的蛋白质稳态崩解来抑制病原细菌的生长(和/或杀死)。特别地,我们鉴定了许多非天然存在的肽,它们包含在大肠杆菌蛋白质组中丰余的短聚集-成核序列。对特别的代表性成员(在本文中进一步称为colpeptin1)的作用方式的分析揭示出,由于98%的细胞在15分钟内呈阳性,因此该肽被大肠杆菌快速有效地内化。colpeptin1摄取容易导致大的极性包涵体的形成和细菌细胞死亡,其中15分钟内细胞死亡约50%,1小时后超过80%。令人惊讶的是,由于ib的形成通常对细菌急性应激的快速致死和可逆响应,因此,本文观察到与快速和致死聚集相关的细菌细胞死亡。此外,与对照抗生素氨苄西林相反,在亚致死浓度(mic的50%)的活性肽上重复传代细菌36天期限不会导致耐药性的发生。此外,该肽在体内具有活性,实际上colpeptin1有效降低了小鼠膀胱感染模型中的细菌载量,而对其宿主没有不良影响。本发明提供了非天然存在的肽,例如colpeptin1及其变体和用于制备变体或类似肽的方法,其用于处理致病性细菌,例如用于对抗难以处理的病原细菌。实际上,我们的发明显示,有可能利用细菌蛋白质中易于聚集的肽片段的序列特异性同时击中几个蛋白质靶标,从而导致细菌细胞快速死亡。因此,该方法代表了开发新型抗生素的有意义的范例。
因此,本发明在第一方面提供了非天然存在的抗细菌肽,其被装配为诱导细菌的一种或多种主要靶蛋白的聚集,从而形成包含所述细菌中的所述一种或多种主要靶蛋白的包涵体,其中所述细菌的一种或多种主要靶蛋白包括3-苯丙酸-二氢二醇/肉桂酸-二氢二醇脱氢酶(hcab)蛋白。
在某些实施方案中,所述细菌的一种或多种主要靶蛋白还包括:
-伴侣蛋白skp(skp)、磷酸调节子传感蛋白(phor)、二肽和三肽通透酶a(dtpa)、可能的传感器样组氨酸激酶yedv(yedv)、未表征的na(+)/h(+)交换剂yjce(yjce)、渗透性传感蛋白envz(envz)、传感蛋白rstb(rstb)、传感蛋白zras(zras)、推定的未表征的蛋白ybfo(ybfo)、传感组氨酸激酶dcus(dcus)、信号转导组氨酸-蛋白激酶atos(atos)、甲酸脱氢酶亚单位4(hycd)、芳族氨基酸输出物yddg(yddg)、upf0226蛋白yfcj(yfcj)和内膜蛋白yfez(yfez);
-选自表8中列出的蛋白质的一种或多种蛋白质;和/或
-选自表9中列出的蛋白质的一种或多种蛋白质。
在某些实施方案中,该肽通过与所述一种或多种主要靶蛋白中的一个或多个聚集倾向的区域(apr)共聚集诱导所述细菌的所述一种或多种主要靶蛋白聚集。在某些实施方案中,所述一个或多个apr的氨基酸序列为glglalv(seqidno:128)或与glglalv(seqidno:128)相比展示出单一错配序列。
在某些实施方案中,该肽通过与选自如下的一个或多个apr共聚集诱导所述细菌的所述一种或多种主要靶蛋白聚集:glglalv(seqidno:128),glglala(seqidno:202),glglaiv(seqidno:203),glglamv(seqidno:204),glglslv(seqidno:205),glalalv(seqidno:206),glglavv(seqidno:207),glplalv(seqidno:208),gvglalv(seqidno:209),glglals(seqidno:210),glllalv(seqidno:211),glglalq(seqidno:212),giglalv(seqidno:213)。
在某些实施方案中,细菌为革兰氏阴性菌,优选埃希氏菌属(escherichia)或不动杆菌属(acinetobacter),更优选大肠杆菌(escherichiacoli)、抗辐射不动杆菌(acinetobacterradioresistens)或鲍氏不动杆菌。
在某些实施方案中,该肽表现出对抗所述细菌的最低抑制浓度(mic)小于32μg/ml,例如25μg/ml或以下,12μg/ml或以下或6μg/ml或以下。
在某些实施方案中,该肽包含序列x1-x2-x3-x4-x5-x6-x7,其被装配成与所述一个或多个apr共聚集,其中:
-x1为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x2为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x3为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x4为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x5为丙氨酸或丙氨酸的保守氨基酸取代或丙氨酸的非天然氨基酸变体或丙氨酸的d-氨基酸或丙氨酸的保守氨基酸取代的d-氨基酸或丙氨酸的非天然氨基酸变体的d-氨基酸,
-x6为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,并且
-x7为缬氨酸或缬氨酸的保守氨基酸取代或缬氨酸的非天然氨基酸变体或缬氨酸的d-氨基酸或缬氨酸的保守氨基酸取代的d-氨基酸或缬氨酸的非天然氨基酸变体的d-氨基酸。
在某些实施方案中,该肽包含一个或多个d-氨基酸和/或非天然氨基酸。
在某些实施方案中,该肽包含如下结构:(a2i-1-x1-x2-x3-x4-x5-x6-x7-a2i-zi)n,其中:
-n为1-4的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个连续看门物(gatekeeper),其中肽结构中的氨基-末端看门物任选被乙酰化,和/或其中肽序列中的羧基-末端看门物任选被酰胺化,
-x1为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x2为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x3为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x4为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x5为丙氨酸或丙氨酸的保守氨基酸取代或丙氨酸的非天然氨基酸变体或丙氨酸的d-氨基酸或丙氨酸的保守氨基酸取代的d-氨基酸或丙氨酸的非天然氨基酸变体的d-氨基酸,
-x6为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x7为缬氨酸或缬氨酸的保守氨基酸取代或缬氨酸的非天然氨基酸变体或缬氨酸的d-氨基酸或缬氨酸的保守氨基酸取代的d-氨基酸或缬氨酸的非天然氨基酸变体的d-氨基酸,
并且其中x1-x2-x3-x4-x5-x6-x7和x7-x6-x5-x4-x3-x2-x1在重复中可以互换使用,其中n为2-4,
并且zi各自为接头。
因此,作为相关的方面,还提供了包含如下结构的肽:(a2i-1-x1-x2-x3-x4-x5-x6-x7-a2i-zi)n,其中:
-n为1-4的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个连续看门物,其中肽结构中的氨基-末端看门物任选被乙酰化,和/或其中肽序列中的羧基-末端看门物任选被酰胺化,
-x1为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x2为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x3为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x4为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x5为丙氨酸或丙氨酸的保守氨基酸取代或丙氨酸的非天然氨基酸变体或丙氨酸的d-氨基酸或丙氨酸的保守氨基酸取代的d-氨基酸或丙氨酸的非天然氨基酸变体的d-氨基酸,
-x6为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x7为缬氨酸或缬氨酸的保守氨基酸取代或缬氨酸的非天然氨基酸变体或缬氨酸的d-氨基酸或缬氨酸的保守氨基酸取代的d-氨基酸或缬氨酸的非天然氨基酸变体的d-氨基酸,
并且其中x1-x2-x3-x4-x5-x6-x7和x7-x6-x5-x4-x3-x2-x1在重复中可以互换使用,其中n为2-4,
并且zi各自为接头。
在某些实施方案中,a2i-1和a2i各自独立地选自1-3个选自r、k、d、e、p的连续看门氨基酸和/或1-3个非天然看门氨基酸。
在某些实施方案中,zi各自独立地选自1-5个单元的段,其中单元为peg、氨基酸或非天然氨基酸。
在某些实施方案中,a2i-1、a2i、x1-x2-x3-x4-x5-x6-x7和/或zi的一个或多个氨基酸为d-氨基酸和/或非天然氨基酸。
还提供了从所述肽生成的肽模拟物。
在某些实施方案中,所述肽或肽模拟物还包含可检测标记。
在某些实施方案中,所述肽或肽模拟物还包含增加半衰期延长的分子。
在某些实施方案中,所述肽或肽模拟物还包含增加分子溶解度的部分。
在某些实施方案中,所述肽或肽模拟物展示出对抗多于一种细菌分类群的抗细菌作用,例如多于一种的细菌属、物种或菌株。
还独立地提供了:
-所述肽或肽模拟物,其用作药物;
-所述肽或肽模拟物,其用作抗细菌剂;和使用所述肽或肽模拟物治疗细菌感染的相应方法;
-所述肽或肽模拟物,其用作诊断剂;和使用所述肽或肽模拟物诊断的相应方法;或
-包含所述肽或肽模拟物和药学上可接受的载体的药物组合物。
本发明在第二个方面还提供了非天然存在的抗细菌肽,其被装配诱导细菌的一种或多种主要靶蛋白聚集,以便形成包含所述细菌中的所述一种或多种主要靶蛋白的包涵体,其中所述细菌的一种或多种主要靶蛋白包括选自表4中列出的蛋白质的蛋白质。
在某些实施方案中,所述肽通过与所述一种或多种主要靶蛋白中的一个或多个聚集蛋白片段(apr)共聚集诱导所述细菌的所述一种或多种主要靶蛋白聚集。
在某些实施方案中,所述一个或多个apr的氨基酸序列如表4中所列或与之相比展示出单一错配序列。
在某些实施方案中,细菌为革兰氏阴性菌,优选埃希氏菌属或不动杆菌属,更优选大肠杆菌、抗辐射不动杆菌或鲍氏不动杆菌。
在某些实施方案中,所述肽表现出对抗所述细菌的最低抑制浓度(mic)小于32μg/ml,例如25μg/ml或以下,12μg/ml或以下或6μg/ml或以下。
在某些实施方案中,所述肽包含如下结构:(a2i-1-apr-a2i-zi)n,其中:
-n为1-4的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个连续的看门物,其中肽结构中的氨基-末端看门物任选被乙酰化,和/或其中肽序列中的羧基-末端看门物任选被酰胺化,
-apr中包含的肽的名称描述在表5中(p3、p4、p5、p12、p14、p16、p18、p23、p26、p29、p33、p39、p40、p49、p50、p58、p72、p76、p79、p80、p87、p88、p89、p90、p91、p92、p93、p99、p101、p103、p105、p111、p112、p113、p114、p115、p116、p117、p118、p123、p124和p125),并且这些肽的相应氨基酸序列描述在表4中,其中apr包含天然氨基酸,或者apr包含存在于apr中的氨基酸的保守氨基酸取代,或者apr包含存在于apr中存在的肽序列中的氨基酸的非天然氨基酸类似物,或者apr包含存在于apr中的氨基酸的肽序列中的d-氨基酸取代,
并且其中apr中的氨基酸可以为同向或反向重复的,其中n为2-4,并且zi各自为接头。
因此,作为相关的方面,还提供了包含如下结构的肽:(a2i-1-apr-a2i-zi)n,其中:
-n为1-4的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个连续的看门物,其中肽结构中的氨基-末端看门物任选被乙酰化,和/或其中肽序列中的羧基-末端看门物任选被酰胺化,
-apr中包含的肽的名称描述在表5中(p3、p4、p5、p12、p14、p16、p18、p23、p26、p29、p33、p39、p40、p49、p50、p58、p72、p76、p79、p80、p87、p88、p89、p90、p91、p92、p93、p99、p101、p103、p105、p111、p112、p113、p114、p115、p116、p117、p118、p123、p124和p125),并且这些肽的相应氨基酸序列描述在表4中,其中apr包含天然氨基酸,或者apr包含存在于apr中的氨基酸的保守氨基酸取代,或者apr包含存在于apr中存在的肽序列中的氨基酸的非天然氨基酸类似物,或者apr包含存在于apr中的氨基酸的肽序列中的d-氨基酸取代,
并且其中apr中的氨基酸可以为同向或反向重复的,其中n为2-4,并且zi各自为接头。
在某些实施方案中,a2i-1和a2i各自独立地选自1-3个选自r、k、d、e、p的连续的看门氨基酸和/或1-3个非天然看门氨基酸。
在某些实施方案中,zi各自独立地选自1-5个单元的段,其中单元为peg、氨基酸或非天然氨基酸。
在某些实施方案中,a2i-1、a2i、apr和/或zi的一个或多个氨基酸为d-氨基酸和/或非天然氨基酸。
在某些实施方案中,所述肽还包含可检测标记。
在某些实施方案中,所述肽还包含增加半衰期延长的分子。
在某些实施方案中,所述肽还包含增加分子溶解度的部分。
还独立地提供了:
-所述肽,其用作药物;
-所述肽,其用作抗细菌剂;和使用所述肽治疗细菌感染的相应方法;
-所述肽,其用作诊断剂;和使用所述肽诊断的相应方法;或者
-包含所述肽和药学上可接受的载体的药物组合物。
在一个实施方案中,本发明还提供了包含如下结构的肽:(a2i-1-apr-a2i-zi)n,其中:
-n为1-4的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸和/或1-3个非天然看门氨基酸,其选自3-甲基脯氨酸、3,4-脱氢-脯氨酸、2-[(2s)-2-(肼羰基)吡咯烷-1-基]-2-氧代乙酸、β-高脯氨酸、α-甲基-脯氨酸、羟基脯氨酸、4-氧代-脯氨酸、β,β-二甲基-脯氨酸、5,5-二甲基-脯氨酸、4-环己基-脯氨酸、4-苯基-脯氨酸、3-苯基-脯氨酸、4-氨基脯氨酸、4-巯基脯氨酸、2-氨基-己二酸(高谷氨酸)、2-氨基-庚二酸(2-氨基庚二酸)、2-氨基-辛二酸(氨基辛二酸)、2-氨基-4-羧基-戊二酸(4-羧基谷氨酸)、乙二醛-氢化咪唑酮、甲基乙二醛-氢化咪唑酮、n-α-甲基-精氨酸、ω-甲基-精氨酸、正精氨酸、高精氨酸、n,n’-二乙基-高精氨酸、β-高精氨酸、2-氨基-3-脲基-丙酸、2-氨基-6-(1-羧基乙基氨基)己酸、2-氨基-6-羧基甲基氨基)己酸、2-氨基-6-(2-(呋喃-2-基)-2-氧代乙基氨基)己酸、2-氨基-6-(甲酰基-5-羟基甲基-吡咯-1-基)-己酸、c-α-甲基-赖氨酸、β,β-二甲基-赖氨酸、n-ε-甲酰基-赖氨酸、n-ε-甲基-赖氨酸、n-ε-异丙基-赖氨酸、n-ε-二甲基-赖氨酸、n-ε-三甲基铵-赖氨酸、n-ε-烟酰基-赖氨酸、{[5-氨基-1-(肼羰基)戊基]氨基甲酰基}甲酸、n-α-甲基-赖氨酸、高赖氨酸、β-高赖氨酸、2-氨基-6-重氮基-5-氧代己酸、正缬氨酸、α-甲基-正缬氨酸、羟基正缬氨酸、鸟氨酸、n-δ-甲基-鸟氨酸、n-δ-n-δ-二甲基-鸟氨酸、n-δ-异丙基-鸟氨酸、c-α-甲基-鸟氨酸、β,β-二甲基-鸟氨酸、刀豆氨酸、n-δ-甲基-n-δ-丁基-鸟氨酸、n-δ-甲基-n-δ-苯基-鸟氨酸、δ-(2-甲基吡咯烷)-鸟氨酸、δ-哌啶基-鸟氨酸、γ-氨基-δ-哌啶基-戊酸和δ-氮杂环庚烷基-鸟氨酸,并且其中肽结构中的氨基-末端看门氨基酸或氨基-末端非天然看门氨基酸任选被乙酰化,和/或其中肽序列中的羧基-末端看门氨基酸或羧基-末端非天然看门氨基酸任选被酰胺化;
-apr中包含的肽的名称描述在表5中(p2、p3、p4、p5、p12、p14、p16、p18、p23、p26、p29、p33、p39、p40、p49、p50、p58、p72、p76、p79、p80、p87、p88、p89、p90、p91、p92、p93、p99、p101、p103、p105、p111、p112、p113、p114、p115、p116、p117、p118、p123、p124和p125),并且这些肽的相应氨基酸序列描述在表4中,其中apr包含天然氨基酸,或者apr包含存在于apr中的氨基酸的保守氨基酸取代,或者apr包含存在于apr中存在的肽序列中的氨基酸的非天然氨基酸类似物,或者apr包含存在于apr中的氨基酸的肽序列中的d-氨基酸取代,
并且其中apr中的氨基酸可以为同向或反向重复的,其中n为2-4;
并且zi各自为接头,并且其中zi各自独立地选自1-5个单元的段,其中单元为peg、氨基酸或非天然氨基酸。
在另一个实施方案中,本发明提供了描述在表5中的序列(p2、p3、p4、p5、p12、p14、p16、p18、p23、p26、p29、p33、p39、p40、p49、p50、p58、p72、p76、p79、p80、p87、p88、p89、p90、p91、p92、p93、p99、p101、p103、p105、p111、p112、p113、p114、p115、p116、p117、p118、p123、p124和p125),并且这些肽的相应氨基酸序列描述在表4中。
在另一个实施方中,本发明提供了包含如下结构的肽:(a2i-1-x1-x2-x3-x4-x5-x6-x7-a2i-zi)n,其中:
-n为1-4的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸和/或1-3个非天然看门氨基酸,其选自3-甲基脯氨酸、3,4-脱氢-脯氨酸、2-[(2s)-2-(肼羰基)吡咯烷-1-基]-2-氧代乙酸、β-高脯氨酸、α-甲基-脯氨酸、羟基脯氨酸、4-氧代-脯氨酸、β,β-二甲基-脯氨酸、5,5-二甲基-脯氨酸、4-环己基-脯氨酸、4-苯基-脯氨酸、3-苯基-脯氨酸、4-氨基脯氨酸、4-巯基脯氨酸、2-氨基-己二酸(高谷氨酸)、2-氨基-庚二酸(2-氨基庚二酸)、2-氨基-辛二酸(氨基辛二酸)、2-氨基-4-羧基-戊二酸(4-羧基谷氨酸)、乙二醛-氢化咪唑酮、甲基乙二醛-氢化咪唑酮、n-α-甲基-精氨酸、ω-甲基-精氨酸、正精氨酸、高精氨酸、n,n’-二乙基-高精氨酸、β-高精氨酸、2-氨基-3-脲基-丙酸、2-氨基-6-(1-羧基乙基氨基)己酸、2-氨基-6-羧基甲基氨基)己酸、2-氨基-6-(2-(呋喃-2-基)-2-氧代乙基氨基)己酸、2-氨基-6-(甲酰基-5-羟基甲基-吡咯-1-基)-己酸、c-α-甲基-赖氨酸、β,β-二甲基-赖氨酸、n-ε-甲酰基-赖氨酸、n-ε-甲基-赖氨酸、n-ε-异丙基-赖氨酸、n-ε-二甲基-赖氨酸、n-ε-三甲基铵-赖氨酸、n-ε-烟酰基-赖氨酸、{[5-氨基-1-(肼羰基)戊基]氨基甲酰基}甲酸、n-α-甲基-赖氨酸、高赖氨酸、β-高赖氨酸、2-氨基-6-重氮基-5-氧代己酸、正缬氨酸、α-甲基-正缬氨酸、羟基正缬氨酸、鸟氨酸、n-δ-甲基-鸟氨酸、n-δ-n-δ-二甲基-鸟氨酸、n-δ-异丙基-鸟氨酸、c-α-甲基-鸟氨酸、β,β-二甲基-鸟氨酸、刀豆氨酸、n-δ-甲基-n-δ-丁基-鸟氨酸、n-δ-甲基-n-δ-苯基-鸟氨酸、δ-(2-甲基吡咯烷)-鸟氨酸、δ-哌啶基-鸟氨酸、γ-氨基-δ-哌啶基-戊酸和δ-氮杂环庚烷基-鸟氨酸,并且其中肽结构中的氨基-末端看门氨基酸或氨基-末端非天然看门氨基酸任选被乙酰化和/或其中肽序列中的羧基-末端看门氨基酸或羧基-末端非天然看门氨基酸任选被酰胺化,
-x1为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x2为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x3为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x4为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x5为丙氨酸或丙氨酸的保守氨基酸取代或丙氨酸的非天然氨基酸变体或丙氨酸的d-氨基酸或丙氨酸的保守氨基酸取代的d-氨基酸或丙氨酸的非天然氨基酸变体的d-氨基酸,
-x6为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x7为缬氨酸或缬氨酸的保守氨基酸取代或缬氨酸的非天然氨基酸变体或缬氨酸的d-氨基酸或缬氨酸的保守氨基酸取代的d-氨基酸或缬氨酸的非天然氨基酸变体的d-氨基酸,
并且其中x1-x2-x3-x4-x5-x6-x7和x7-x6-x5-x4-x3-x2-x1在重复中可以互换使用,其中n为2-4,
并且zi各自为接头,并且其中zi各自独立地选自1-5个单元的段,其中单元为peg、氨基酸或非天然氨基酸。
尽管优选不使用长的柔性接头,但是本发明的肽中接头部分zi的性质对本发明而言不是至关重要的。根据特别的实施方案,zi各自独立地选自0至20个相同或不同的单元的段,其中单元为氨基酸、单糖、核苷酸或单体。不相同的单元可以是相同性质的不相同的单元(例如不同的氨基酸或某些共聚物)。它们也可以是性质不同的不同单元,例如具有氨基酸和核苷酸单元的接头,或包含两个或更多个不同单体种类的杂聚物(共聚物)。根据特别的实施方案,除zn以外的至少一个并且特别是每个zi的长度为至少1个单元。根据其它特别的实施方案,zn为0个单元。根据特别的实施方案,除zn以外的所有zi接头是相同的。根据另外的实施方案,所有zi部分是相同的。
根据特别的实施方案,zi的至少一个并且特别是全部具有相同性质的0至10个单元,特别是相同性质的0至5个单元。根据特别的实施方案,至少一个zi部分,并且特别是除zn的所有zi部分为肽或多肽接头。此类接头的特别设想的序列包括但不限于ppp、pp或gs。接头也可以具有化学性质。特别设想的化学接头包括peg和ttds(aka4,7,10-三氧杂十三烷-13-琥珀酸(succinamicacid))。
典型地,不使用长接头。然而,根据其中促进聚集的部分相当于多于一种蛋白质的聚集诱导区域的特定实施方案,设想可以使用长接头。实际上,为了确保分子可以(例如同时)与多于一种蛋白质发生相互作用,增加不同的靶向聚集促进部分之间的距离可能是有益的,使得由于位阻而不能阻止相互作用。在这些情况下,zi接头可以是0-100个相同或不同单元的段,其中单元为氨基酸、单糖、核苷酸或单体;或0-90、0-80、0-70、0-60、0-50、0-40、0-30或0-20个相同或不同单元的段。特别地,zi接头的最小长度为至少1个单元、至少2个单元、至少3个单元、至少4个单元或至少5个单元。
在另一个实施方案中,本发明提供了包含如下结构的肽:(a2i-1-x1-x2-x3-x4-x5-x6-x7-a2i-zi)n,其中:
-n为1-4的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸和/或其中氨基-末端看门氨基酸任选被乙酰化和/或其中肽序列中的羧基-末端看门氨基酸任选被酰胺化,
-x1为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x2为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x3为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x4为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x5为丙氨酸或丙氨酸的保守氨基酸取代或丙氨酸的非天然氨基酸变体或丙氨酸的d-氨基酸或丙氨酸的保守氨基酸取代的d-氨基酸或丙氨酸的非天然氨基酸变体的d-氨基酸,
-x6为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x7为缬氨酸或缬氨酸的保守氨基酸取代或缬氨酸的非天然氨基酸变体或缬氨酸的d-氨基酸或缬氨酸的保守氨基酸取代的d-氨基酸或缬氨酸的非天然氨基酸变体的d-氨基酸,
并且其中x1-x2-x3-x4-x5-x6-x7和x7-x6-x5-x4-x3-x2-x1在重复中可以互换使用,其中n为2-4,
并且zi各自为接头,并且其中zi各自独立地选自1-5个单元的段,其中单元为peg、氨基酸或非天然氨基酸。
在另一个实施方案中,本发明提供了包含如下结构的肽:(a2i-1-x1-x2-x3-x4-x5-x6-x7-a2i-zi)n,其中:
-n为1-3的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸,并且其中氨基-末端看门氨基酸任选被乙酰化和/或其中肽序列中的羧基-末端看门氨基酸任选被酰胺化,
-x1为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x2为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x3为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x4为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x5为丙氨酸或丙氨酸的保守氨基酸取代或丙氨酸的非天然氨基酸变体或丙氨酸的d-氨基酸或丙氨酸的保守氨基酸取代的d-氨基酸或丙氨酸的非天然氨基酸变体的d-氨基酸,
-x6为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x7为缬氨酸或缬氨酸的保守氨基酸取代或缬氨酸的非天然氨基酸变体或缬氨酸的d-氨基酸或缬氨酸的保守氨基酸取代的d-氨基酸或缬氨酸的非天然氨基酸变体的d-氨基酸,
并且其中x1-x2-x3-x4-x5-x6-x7和x7-x6-x5-x4-x3-x2-x1在重复中可以互换使用,其中n为2-4,
并且zi各自为接头,并且其中zi各自独立地选自1-5个单元的段,其中单元为peg、氨基酸或非天然氨基酸。
在另一个实施方案中,本发明提供了包含如下结构的肽:a2i-1-x1-x2-x3-x4-x5-x6-x7-a2i-zi,其中:
-a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸,并且其中氨基-末端看门氨基酸任选被乙酰化和/或其中肽序列中的羧基-末端看门氨基酸任选被酰胺化,
-x1为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x2为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x3为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x4为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x5为丙氨酸或丙氨酸的保守氨基酸取代或丙氨酸的非天然氨基酸变体或丙氨酸的d-氨基酸或丙氨酸的保守氨基酸取代的d-氨基酸或丙氨酸的非天然氨基酸变体的d-氨基酸,
-x6为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x7为缬氨酸或缬氨酸的保守氨基酸取代或缬氨酸的非天然氨基酸变体或缬氨酸的d-氨基酸或缬氨酸的保守氨基酸取代的d-氨基酸或缬氨酸的非天然氨基酸变体的d-氨基酸,
并且zi各自为接头,并且其中zi各自独立地选自1-5个单元的段,其中单元为peg、氨基酸或非天然氨基酸。
在另一个实施方案中,本发明提供了包含如下结构的肽:(a2i-1-x1-x2-x3-x4-x5-x6-x7-a2i-zi)n,其中:
-n为1-2的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸,并且其中氨基-末端看门氨基酸任选被乙酰化和/或其中肽序列中的羧基-末端看门氨基酸任选被酰胺化,
-x1为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x2为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x3为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x4为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x5为丙氨酸或丙氨酸的保守氨基酸取代或丙氨酸的非天然氨基酸变体或丙氨酸的d-氨基酸或丙氨酸的保守氨基酸取代的d-氨基酸或丙氨酸的非天然氨基酸变体的d-氨基酸,
-x6为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x7为缬氨酸或缬氨酸的保守氨基酸取代或缬氨酸的非天然氨基酸变体或缬氨酸的d-氨基酸或缬氨酸的保守氨基酸取代的d-氨基酸或缬氨酸的非天然氨基酸变体的d-氨基酸,
并且其中x1-x2-x3-x4-x5-x6-x7和x7-x6-x5-x4-x3-x2-x1在重复中可以互换使用,其中n为2,
并且zi各自为接头,并且其中zi各自独立地选自1-5个单元的段,其中单元为peg、氨基酸或非天然氨基酸。
在另一个实施方案中,本发明提供了colpeptin1(p2),其序列在seqidno:1中描述。
seqidno:1:氨基-rglglalvrrprglglalvrr-羧基
在另一个实施方案中,x1和x3选自甘氨酸或甘氨酸的非天然变体,其选自n-α-甲基-甘氨酸(肌氨酸)、环丙基甘氨酸和环戊基甘氨酸,x2、x4和x6选自亮氨酸或缬氨酸或亮氨酸的非天然变体,其选自2-氨基-3,3-二甲基-丁酸(t-亮氨酸)、α-甲基亮氨酸、羟基亮氨酸、2,3-脱氢-亮氨酸、n-α-甲基-亮氨酸、2-氨基-5-甲基-己酸(高亮氨酸)、3-氨基-5-甲基己酸(β-高亮氨酸)、2-氨基-4,4-二甲基-戊酸(4-甲基-亮氨酸、新戊基甘氨酸)、4,5-脱氢-正亮氨酸(烯丙基甘氨酸)、l-正亮氨酸、n-α-甲基-正亮氨酸和6-羟基-正亮氨酸,x5选自丙氨酸或丙氨酸的非天然变体,其选自2-氨基-异丁酸(2-甲基丙氨酸)、2-氨基-2-甲基丁酸(异缬氨酸)、n-α-甲基-丙氨酸、2-氨基-2-甲基戊-4-烯酸(α-烯丙基丙氨酸)、β-高丙氨酸、2-茚满基-甘氨酸、二-正丙基-甘氨酸、二-正丁基-甘氨酸、二乙基-甘氨酸、(1-萘基)丙氨酸、(2-萘基)丙氨酸、环己基甘氨酸、金刚烷基-甘氨酸、β-高烯丙基甘氨酸,并且x7选自缬氨酸或亮氨酸或亮氨酸的天然变体,其选自c-α-甲基-缬氨酸(2,3-二甲基丁酸)、2,3-脱氢-缬氨酸、3,4-脱氢-缬氨酸、3-甲基-l-异缬氨酸(甲基缬氨酸)、2-氨基-3-羟基-3-甲基丁酸(羟基缬氨酸)、β-高缬氨酸和n-α-甲基-缬氨酸。
术语“本发明的肽”在本文中便利地用于包括体现本文所公开的本发明的原理的任何肽和肽变体,例如但不限于基于coleptin1的肽及其变体。
特别地,可以通过本发明的肽的结构中、例如在seqidno:1的结构中用丙氨酸类似物替代至少一个丙氨酸用于开发本发明的肽的变体、例如seqidno:1的变体的丙氨酸类似物在表i中描述:
表i:丙氨酸类似物
特别地,可以通过肽的结构中、例如在seqidno:1的结构中用精氨酸类似物替代至少一个精氨酸用于开发本发明的肽的变体、例如seqidno:1的变体的精氨酸类似物在表ii中描述:
表ii:精氨酸类似物
特别地,可以通过肽的结构中、例如在seqidno:1的结构中用甘氨酸类似物替代至少一个甘氨酸用于开发本发明的肽的变体、例如seqidno:1的变体的甘氨酸类似物在表iii中描述:
表iii:甘氨酸类似物
在某些实施方案中,特别地,可以通过替代肽的结构中、例如在seqidno:1的结构中的至少一个甘氨酸用于开发本发明的肽的变体、例如seqidno:1的变体的甘氨酸类似物可以包括β-丙氨酸或表iii中所述的类似物,且可以优选β-丙氨酸。
特别地,可以通过肽的结构中、例如在seqidno:1的结构中用亮氨酸类似物替代至少一个亮氨酸用于开发本发明的肽的变体、例如seqidno:1的变体的亮氨酸类似物在表iv中描述:
表iv:亮氨酸类似物
在某些实施方案中,特别地,可以通过肽的结构中、例如在seqidno:1的结构中用亮氨酸类似物替代至少一个亮氨酸用于开发本发明的肽的变体、例如seqidno:1的变体的亮氨酸类似物在以下描述:
在某些实施方案中,特别地,可以通过肽的结构中、例如在seqidno:1的结构中用亮氨酸类似物替代至少一个亮氨酸用于开发本发明的肽的变体、例如seqidno:1的变体的亮氨酸类似物可以为正缬氨酸或α-甲基-正缬氨酸。
特别地,可以通过肽的结构中、例如在seqidno:1的结构中用缬氨酸类似物替代至少一个缬氨酸用于开发本发明的肽的变体、例如seqidno:1的变体的缬氨酸类似物在表v中描述:
表v:缬氨酸类似物
特别地,可以通过用赖氨酸类似物(k)替代看门残基赖氨酸(k)用于开发本发明的肽的赖氨酸类似物在表vi中描述:
表vi:赖氨酸类似物
在某些实施方案中,特别地,可以通过用赖氨酸类似物(k)替代看门残基赖氨酸(k)用于开发本发明的肽的赖氨酸类似物可以为n-ε-甲酰基-赖氨酸、n-ε-甲基-赖氨酸、n-ε-异丙基-赖氨酸、n-ε-二甲基-赖氨酸、n-ε-三甲基铵-赖氨酸、n-ε-烟酰基-赖氨酸、{[5-氨基-1-(肼羰基)戊基]氨基甲酰基}甲酸、n-α-甲基-赖氨酸、高赖氨酸、β-高赖氨酸、2-氨基-6-重氮基-5-氧代己酸、羟基正缬氨酸、鸟氨酸、n-δ-甲基-鸟氨酸、n-δ-n-δ-二甲基-鸟氨酸、n-δ-异丙基-鸟氨酸、c-α-甲基-鸟氨酸、β,β-二甲基-鸟氨酸、刀豆氨酸、n-δ-甲基-n-δ-丁基-鸟氨酸、n-δ-甲基-n-δ-苯基-鸟氨酸、δ-(2-甲基吡咯烷)-鸟氨酸、δ-哌啶基-鸟氨酸、γ-氨基-δ-哌啶基-戊酸或δ-氮杂环庚烷基-鸟氨酸。
特别地,可以通过用人工脯氨酸(p)替代权利要求1中所述的看门物中的脯氨酸用于开发本发明的肽的变体、例如seqidno:1的变体的脯氨酸类似物如表vii所示:
表vii:脯氨酸类似物
在另一个实施方案中,本发明的肽的接头zi由脯氨酸、4-羟基脯氨酸、(2r,5s)-5-苯基-吡咯烷-2-羧酸、3,4-脱氢-l-脯氨酸、β-(2-苯并噻唑基)-丙氨酸、3-(2-呋喃基)-丙氨酸或β-(2-噻吩基)-丙氨酸组成。
在另一个实施方案中,本发明提供了环肽,其通过形成氨基-末端与羧基-末端非天然看门残基(a2i-1和a2i)之间的环结构制备。
在另一个实施方案中,本发明的肽还包含可检测标记。
本发明还包括同位素标记的肽,其与本文所定义的相同,但是实际上一个或多个原子被原子量或质量数与自然界通常发现的原子量或质量数不同的原子所替代。可掺入本发明的肽的同位素的实例包括氢、碳、氮、氧、磷、硫、氟和氯的同位素,例如分别为2h、3h、13c、11c、14c、15n、18o、17o、31p、32p、35s、18f和36ci。本发明的肽和所述肽的药学上可接受的盐或包含前述同位素和/或其它原子的其它同位素的肽和所述肽的药学上可接受的盐在本发明的范围内。本发明的某些同位素标记的肽,例如掺入有放射性同位素例如3h和14c的那些肽,可用于药物和/或底物组织分布测定。由于其易于制备和可检测性,氚代即3h和碳-14即14c的同位素是特别优选的。此外,用较重的同位素(例如氘)取代(即2h)可能会因更高的代谢稳定性(例如增加的体内半衰期或降低的剂量要求)而提供某些治疗优势并且由此在某些情况下是优选的,本发明式i的同位素标记的肽通常可以通过进行以下实施例中公开的方法,用容易获得的同位素标记的试剂取代非同位素标记的试剂来制备。
在另一个实施方案中,本发明的肽还包含增加半衰期延长的分子。
在另一个实施方案中,本发明的肽还包含增加所述肽溶解度的部分。
根据其它特别的实施方案,所述分子可以与其它部分融合,例如延长其体内半衰期。除了增加稳定性之外,这类部分还可以增加与它们所融合的分子的溶解度。尽管看门物(编号为x的部分)的存在原则上足以防止分子过早聚集并且将其保持在溶液中,但进一步添加增加溶解度(即防止聚集)的部分可以使分子更容易处理和特别改善稳定性和贮存期限。这类部分的众所周知的实例为peg(聚乙二醇)。特别设想了该部分,因为它既可以用作接头,也可以用作增溶部分。其它实例包括肽和蛋白质或蛋白质结构域,乃至完整蛋白质(例如gfp)。在这方面,应当注意,像peg一样,一个部分可以具有不同的功能或作用。例如,flag标签(序列dykddddk)为可以用作标记的肽部分,但由于其电荷密度,它也将增强溶解性。聚乙二醇化已经经常被证明可以提高生物药物的溶解度(例如veronese和mero,biodrugs.2008;22(5):315-29)。在本领域中已经广泛地描述了将肽、多肽、蛋白质或蛋白质结构域标签添加至目标分子。实例包括但不限于衍生自突触核蛋白的肽(例如,park等人,proteineng.des.sel.2004;17:251-260)、set(溶解度增强标签,zhang等人,proteinexprpurif2004;36:207-216)、硫氧还蛋白(trx)、谷胱甘肽-s-转移酶(gst)、麦芽糖结合蛋白(mbp)、n-利用物质(nusa)、小的泛素样修饰剂(sumo)、泛素(ub)、二硫键c(dsbc)、十七千道尔顿蛋白(skp)、噬菌体t7蛋白激酶片段(t7pk)、蛋白gb1结构域、蛋白aiggzz重复结构域和细菌免疫球蛋白结合结构域(hutt等人,jbiolchem.;287(7):4462-9,2012)。标签的性质将取决于应用,如技术人员可以确定的。例如,对于本文所述分子的转基因表达,可以设想将分子融合至更大的结构域,以防止通过细胞机制过早降解。其它应用可以设想与较小的增溶标签(例如少于30个氨基酸,或少于20个氨基酸,或乃至少于10个氨基酸)融合,以便不过度改变分子的性质。
除了延长半衰期外,分子还可以融合到改变其它或另外的药代动力学和药效学性质的部分上。例如,已知与白蛋白(例如人血清白蛋白)、白蛋白结合结构域或合成白蛋白结合肽融合可改善不同治疗蛋白的药代动力学和药效学(langenheim和chen,endocrinol.;203(3):375-87,2009)。通常使用的另一个部分为抗体的片段可结晶区域(fc)。这些部分的性质对于本发明并非至关重要,并且可以由本领域技术人员根据应用的不同来确定。
在另一个实施方案中,本发明的肽还包含在所述肽的氨基-末端和/或羧基-末端上的至少一个d-丙氨酸。
在另一个实施方案中,本发明提供了本发明的肽,其用作药物。
在另一个实施方案中,本发明提供了本发明的肽,其用作抗细菌剂。
在另一个实施方案中,本发明提供了本发明的肽,其用于处理革兰氏阳性细菌。
在另一个实施方案中,本发明提供了本发明的肽,其用于处理革兰氏阴性细菌。
在另一个实施方案中,本发明提供了本发明的肽,其用于处理耐药细菌菌株。
在另一个实施方案中,本发明提供了本发明的肽,其用于处理多重耐药细菌菌株。
在另一个实施方案中,本发明提供了本发明的肽,其用于处理多重耐药细菌菌株,所述菌株选自耐碳青霉烯肠杆菌科(enterobacteriaceae),耐药淋病奈瑟球菌(neisseriagonorrhoeae),多重耐药不动杆菌属(acetinobacter),耐药弯曲杆菌属(campylobacter),产广谱β-内酰胺酶的肠杆菌科,多重耐药铜绿假单胞菌,耐药非伤寒沙门菌属(salmonella),耐药伤寒沙门菌(salmonellatyphi)和耐药志贺菌属(shigella)。
在另一个实施方案中,本发明提供了本发明的肽用作诊断剂的用途。
在另一个实施方案中,本发明提供了包含本发明的肽和药学上可接受的载体的药物组合物。
在另一个实施方案中,本发明提供了制备抗细菌肽的方法,该方法包括下列步骤:
i)以计算机模拟(insilico)方式生成一组聚集倾向的区域(apr),其具有5-14个氨基酸例如5-12个氨基酸或6-14个氨基酸例如6-12个氨基酸长度,该apr在细菌蛋白质组中鉴定,
ii)合成包含基于如下结构的apr的众多20-200个不同的肽:(a2i-1-apr-a2i-zi)n,其中n为1-4的整数,并且i在每次重复时从1增加至n,并且a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸,
iii)测试所述肽的抗细菌作用并且制备抗细菌肽。
鉴定蛋白质中的此类序列、特别是鉴定蛋白质组中存在的蛋白质中的apr序列的一种特别便利的方式是通过使用β-聚集预测算法。这样的算法典型地可以考虑生物物理参数。tango和zyggregator是这种算法的常见实例,但是在本领域中已经描述了众多这样的实例,包括但不限于如下文献中所述的那些:bryan等人,ploscomputbiol.5(3):e1000333,2009;caflish,curropinchembiol.10(5):437-44,2006;conchillo-sole等人,bmcbioinformatics8:65,2007;galzitskaya等人,ploscomputbiol.29;2(12):e177,2006;goldschmidt等人,pnas107(8):3487-92,2010;maurer-stroh等人,natmethods7(3):237-42,2010;rojasquijano等人,biochemistry45(14):4638-52,2006;saiki等人,biochembiophysrescommun343(4):1262-71,2006;sanchezdegroot等人,bmcstructbiol5:18,2005;tartaglia等人,proteinsci.14(10):2723-34,2005;tartaglia等人,jmolbiol.380(2):425-36,2008;thompson等人,pnas103(11):4074-8,2006;trovato等人,proteinengdessel.20(10):521-3,2007;yoon和welsh,proteinsci.13(8):2149-60,2004;zibaee等人,proteinsci.16(5):906-18,2007。注意,其中许多牵涉淀粉样蛋白聚集序列,而不仅与无定形β-聚集有关。两种形式的聚集的序列间隔都可以重叠(rousseau等人,currentopinioninstructuralbiology16:118-126,2006),并且设想了两种形式的聚集,只要反应的动力学和条件有利于所关注的蛋白质聚集即可。
在一些实施方案中,本发明的肽可以在氨基-末端和/或羧基-末端包含一个或多个另外的残基。在一些实施方案中,一个或多个另外的残基是d-丙氨酸。例如,肽可以在氨基-末端和/或羧基-末端包含一个或两个d-丙氨酸。
同样,本领域技术人员将理解,本发明还涵盖包含特化非天然存在的肽的融合多肽。作为替代选择,融合蛋白可以包含报道分子。在其它实施方案中,融合蛋白可以包含提供与该肽的活性相同或不同的功能或活性例如靶向、结合或酶活性或功能的多肽。同样,应当理解,本文具体公开的肽典型地将耐受氨基酸序列中的取代并且基本保留生物学活性。为了鉴定除本文具体公开的肽以外的本发明的肽,氨基酸取代可以基于本领域已知的任何特征,包括氨基酸侧链取代基的相对相似性或差异性,例如它们的疏水性、亲水性、电荷、大小等。
如本领域中已知的,许多不同的程序可以用于鉴定多肽是否与已知序列具有序列同一性或相似性。序列同一性或相似性可以使用本领域已知的标准技术来确定,包括但不限于smith&waterman,adv.appl.math.2:482(1981)的局部序列同一性算法;needleman&wunsch,j.mol.biol.48:443(1970)的序列同一性调整算法;pearson&lipman,proc.natl.acad.sci.usa85:2444(1988)的相似性方法研究;这些算法的计算机实施方式(wisconsingeneticssoftwarepackage中的gap、bestfit、fasta和tfasta,geneticscomputergroup,575sciencedrive,madison,wis.);devereux等人,nucl.acidres.12:387(1984)描述的最佳拟合序列程序,优选使用默认设置;或通过检查。一个有用的算法示例为pileup。pileup使用渐进的成对比对,从一组相关序列中创建多个序列比对。它还可以绘制显示用于创建比对的成簇相关性路线的树。pileup使用feng&doolittle,j.mol.evol.35:351(1987)的渐进比对方法的简化形式;该方法类似于higgins&sharp,cabios5:151(1989)中描述的方法。有用的算法的另一个实例为blast算法,其描述在altschul等人,j.mol.biol.215:403(1990)和karlin等人,proc.natl.acad.sci.usa90:5873(1993)中。特别有用的blast程序为wu-blast-2程序,其得自altschul等人,meth.enzymol.,266:460(1996);blast.wustl/edu/blast/readme.html.wu-blast-2使用几个检索参数,优选将其设定至默认值。这些参数是动态值,并且由程序本身根据要检索感兴趣序列的特定序列的组成和特定数据库的组成来建立;但是,可以调整这些值以提高灵敏度。如altschul等人在nucleicacidsres.25:3389(1997)中报道的,另外有用的算法为空位的blast。由匹配的相同残基的数目除以比对区域中“较长”序列的残基总数确定氨基酸序列同一性百分比。“较长”序列是在比对区域中具有最实际残基的序列(由wu-blast-2导入以最大化比对得分的空位被忽略)。比对可以包括在要比对的序列中导入空位。另外,对于含有比本文具体公开的肽更多或更少的氨基酸的序列,应当理解,在一个实施方案中,将基于相对于氨基酸总数的相同氨基酸的数目来确定序列同一性的百分比。因此,在一个实施方案中,例如,将使用较短序列中的氨基酸数目来确定比本文具体公开的序列短的序列的序列同一性。在百分比同一性计算中,相对权重未分配给序列变异的多种表现形式,例如插入、缺失、取代等。
在一个特别的实施方案中,可以通过在氨基-末端和/或羧基-末端添加封闭剂来修饰本发明的肽用于在体内使用,以促进相关多肽在体内的存活。这在肽末端在细胞摄取前倾向于被蛋白酶降解的情况下可能有用。这样的封闭剂可以包括但不限于可以与所施用的肽的氨基末端和/或羧基末端残基连接的其它相关或无关的肽序列。这可以在肽的合成过程中以化学方式进行,也可以通过任何适合的方法通过重组dna技术进行。例如,可以将一个或多个非天然存在的氨基酸,例如d-丙氨酸添加至末端。或者,可以将封闭剂例如焦谷氨酸或本领域已知的其它分子连接至氨基末端和/或羧基末端残基,或可以将氨基末端的氨基或羧基末端的羧基替换为不同的部分。另外,肽末端可以被修饰,例如通过n-末端的乙酰化和/或c-末端的酰胺化来进行。同样,在施用前,可以将肽与药学上可接受的“载体”蛋白共价或非共价偶联。
本发明肽的施用-包含本发明肽的药物组合物
在一个实施方案中,将本发明的肽直接施用于个体。通常,将本发明的化合物悬浮在药学上可接受的载体(例如生理盐水)中,并且通过口服或通过静脉内输注施用,或通过皮下、肌内、鞘内、腹膜内、直肠内、阴道内、鼻内、胃内、气管内或肺内施用。在另一个实施方案中,气管内或肺内递送可以使用标准喷雾器、喷射喷雾器、金属丝网喷雾器、干粉吸入器或计量吸入器来完成。可以将它们直接递送到细菌感染的部位,例如肺、肾、膀胱或肠。所需剂量取决于施用途径的选择;制剂的性质;患者的疾病的性质;个体的体型、体重、表面积、年龄和性别;正在施用的其它药物;以及主治医师的判断。适合的剂量范围为0.01-100mg/kg。考虑到可能的肽和变体的多样性以及多种施用途径的不同效率,所需剂量的广泛变化是可以预期的。例如,预计口服施用比通过静脉内注射施用需要更高的剂量。可以使用本领域众所周知的用于优化的标准试验途径来调节这些剂量水平的变化。施用可以是单次或多次(例如2-倍,3-倍,4-倍,6-倍,8-倍,10-倍;20-倍,50-倍,100-倍,150-倍或更多-倍)。
在某些实施方案中,本发明的肽包含至少一个修饰的末端,例如以保护肽免于降解。在一些实施方案中,n-末端被乙酰化和/或c-末端被酰胺化。在某些实施方案中,本发明的肽包含至少一个非天然氨基酸(例如1、2、3或更多个)或至少一个末端修饰(例如1或2个)。在一些实施方案中,该肽包含至少一个非天然氨基酸和至少一个末端修饰。
本发明的肽可以任选与其它治疗剂联合递送。可以与本发明的肽同时递送另外的治疗剂。如本文所用,词语“同时”是指在时间上足够接近以产生组合效果(即,可以同时地同时发生,或者可以是在分别发生之前或之后的短时间内发生的两个或更多个事件)。在本发明的一个实施方案中,将非天然存在的肽与调节细菌生长的抗生素同时递送给患者,其中非天然存在的肽和抗生素活性剂的组合活性比单独的对细菌具有更好的活性。
本发明的另一方面涉及药盒,其包含来自本发明的肽并且可用于实施本发明的方法。该药盒可以进一步包含用于实施所述方法的其它试剂(例如缓冲液、容器、其它治疗剂)以及说明书。作为另一个方面,本发明提供了达到上述任何治疗效果(例如细菌杀灭)的药物制剂及其施用方法。药物制剂可以在药学上可接受的载体中包含以上讨论的任何试剂,例如非天然存在的肽或其变体。所谓“药学上可接受的”是指不是生物学上或其它不希望的物质,即,可以将该物质施用于个体而不会引起任何不期望的生物学作用,例如毒性。本发明的制剂可任选包含医学活性剂、药物活性剂、载体、佐剂、分散剂、稀释剂等。可以根据已知技术配制本发明的肽以在药物载体中施用。参见例如remington,thescienceandpracticeofpharmacy(2014年版)。在制备根据本发明的药物制剂中,所述肽(包括其生理学上可接受的盐)通常特别与可接受的载体混合。该载体可以为固体或液体或它们两者,并且优选与肽一起配制为单位剂量制剂,例如片剂,其可以包含0.01或0.5%-95%或99%重量的肽。可将一种或多种肽掺入本发明的制剂中,其可以通过任何众所周知的药学技术来制备。本发明的另一方面是体内治疗个体的方法,其包括向个体施用包含在药学上可接受的载体中的本发明的肽的药物组合物,其中将所述药物组合物以治疗有效量施用。将本发明的肽施用于需要的人或动物可以通过本领域已知的用于施用化合物的任何方式进行。本发明的制剂包括适合于口服、直肠、局部、口含(例如舌下)、阴道、非肠道(例如皮下,肌内包括骨骼肌、心肌、膈肌和平滑肌,皮内,静脉内,腹膜内)、局部(即皮肤和粘膜表面,包括气道表面)、鼻内、经皮、关节内、鞘内和吸入施用,通过门静脉内递送向肝脏施用以及直接器官注射(例如,注入肝,注入大脑以递送至中枢神经系统,注入胰,或注入肿瘤或肿瘤周围的组织)。在任何给定情况下,最适合的途径取决于所治疗病症的性质和严重程度以及所用特定肽的性质。
对于注射,载体通常为液体,例如无菌无热原水、无菌生理盐水、高张生理盐水、无热原磷酸盐缓冲盐水溶液。对于其它施用方法,载体可以是固体或液体。
对于口服施用,该肽可以以固体剂型例如胶囊剂、片剂和散剂或以液体剂型例如酏剂、糖浆剂和混悬剂施用。可以将肽与非活性成分和粉状载体例如葡萄糖、乳糖、蔗糖、甘露糖醇、淀粉、纤维素或纤维素衍生物、硬脂酸镁、硬脂酸、糖精钠、滑石粉、碳酸镁等一起包封在明胶胶囊中。可以添加以提供期望的颜色、味道、稳定性、缓冲能力、分散性或其它已知的期望特征的其它非活性成分的实例是红色氧化铁、硅胶、月桂基硫酸钠、二氧化钛、可食用白色墨水等。类似的稀释剂可用于制备压制片剂。片剂和胶囊剂均可制成缓释产品,以便在数小时的期限内提供连续释放的药物。压制片剂可以为包糖衣的或薄膜包衣的以便掩蔽任何令人不愉快的味道并且防止片剂受到大气影响;或者为肠溶包衣的以便选择在胃肠道中崩解。用于口服施用的液体剂型可以包含着色剂和矫味剂以便增加患者的可接受性。适合于口含(舌下)施用的制剂包括:锭剂,其包含在矫味基质中的化合物,所述矫味基质通常为蔗糖和阿拉伯胶或黄蓍胶;和软锭剂,其包含在惰性基质中的化合物,所述惰性基质例如为明胶和甘油或蔗糖和阿拉伯胶。适合于非肠道施用的本发明的制剂包含所述肽的无菌水和非水注射溶液,该制剂优选与预期接受者的血液等渗。这些制剂可以包含抗氧化剂、缓冲剂、抑菌剂和使得该制剂与预期接受者的血液等渗的溶质。水和非水无菌混悬剂可以包括助悬剂和增稠剂。可以将制剂提供在单位/剂量或多剂量容器中,例如,密封安瓿和小瓶,并且可以储存在冷冻干燥(冻干)条件下,在使用前仅需要即刻添加无菌液体载体,例如盐水或注射用水。
可以由上述类型的无菌粉末、颗粒和片剂制备临时注射溶液和混悬液。例如,在本发明的一个方面,提供了包含本发明的肽的可注射、稳定、无菌组合物,其为在密封容器中的单位剂型形式。提供了冻干物形式的肽或盐,其能够用适合的药学上可接受的载体重构而形成适合于将其注入个体的液体组合物。单位剂型通常包含约1mg-约10克的肽或盐。当肽或盐基本上不溶于水时,足量的为药学上可接受的乳化剂可以以足量用于乳化在水性载体中的肽或盐。一种这样的有用的乳化剂为磷脂酰胆碱。适合于直肠施用的制剂优选作为单位剂型的栓剂存在。可以通过将所述肽与一种或多种常用固体载体例如可可脂混合,然后使产生的混合物成形来制备它们。适合于局部应用于皮肤的制剂优选采用软膏剂、乳膏剂、洗剂、糊剂、凝胶剂、喷雾剂、气雾剂或油的形式。可以使用的载体包括凡士林油、羊毛脂、聚乙二醇、醇类、透皮增强剂及其两种或多种的组合。适合于透皮施用的制剂可以作为适合于保持紧密接触接受者表皮延长的时间期限的不连续的贴剂存在。还可以通过离子透入法递送适合于透皮施用的制剂(参见,例如,tyle,pharm.res.3:318(1986),并且其通常采用任选缓冲的肽水溶液的形式。适合的制剂包含柠檬酸盐或bis/tris缓冲液(ph6)或乙醇/水,并且包含0.1-0.2m的化合物。或者,可以将所述肽配置成用于鼻施用,否则通过任何适合的方式将其施用于个体的肺,例如,通过包含所述肽的可吸收颗粒的气雾剂混悬液施用,由所述个体吸入。可吸入颗粒可以为液体或固体。术语“气雾剂”包含任何产生气体的悬浮的相,其能够被吸入细支气管或鼻道。特别地,气雾剂包括液滴的产生气体的混悬液,正如可以在计量吸入器或喷雾器中产生的,或在雾化器中产生的。气雾剂还包含悬浮于空气或其它载气中的干粉组合物,其可以通过从例如吸入器装置中吸入来递送。包含所述肽的液体颗粒的气雾剂可以通过任何适合的方式制备,例如使用本领域技术人员已知的压力驱动的气雾剂喷雾器或超声波雾化器。同样,可以使用任何固体颗粒药物的气雾剂发生器,通过制药领域公知的技术制备包含所述肽的固体颗粒的气雾剂。或者,可以以非全身方式局部施用所述肽,例如,以储库或缓释制剂形式。
此外,本发明提供了本文公开的肽及其盐的脂质体制剂。形成脂质体混悬液的技术是本领域众所周知的。当肽或其盐为水溶性盐时,使用常规脂质体技术,可以将其掺入脂囊泡中。在这种情况下,由于肽或盐的水溶性,肽或盐将基本上被夹带在脂质体的亲水中心或芯内。所使用的脂质层可以具有任何常规组成,并且可以包含胆固醇或可以不含胆固醇。当目的肽或盐不溶于水时,再次采用常规脂质体形成技术,该盐可以基本上夹带在形成脂质体结构的疏水性脂质双层中。在任一种情况下,所产生的脂质体都可以通过使用标准的超声处理和匀化技术来减小尺寸。可以冻干包含本文公开的肽或其盐的脂质体制剂以产生冻干物,该冻干物可以用药学上可接受的载体例如水重构以再生脂质体混悬液。在水不溶性肽的情况下,可以制备包含水不溶性肽的药物组合物,例如在水性基质乳液中。在这种情况下,组合物将包含足量的药学上可接受的乳化剂以乳化所需量的肽。特别有用的乳化剂包括磷脂酰胆碱和卵磷脂。在特别的实施方案中,以如上定义的术语治疗有效量向个体施用该肽。药学活性肽的剂量可以通过本领域已知的方法来确定,参见,例如,remington’spharmaceuticalsciences。任何特定肽的治疗有效剂量随肽与肽的不同和患者与患者的不同而有所不同,并且将取决于患者的状况和递送途径。一般而言,约0.1-约50mg/kg的剂量具有治疗功效,所有重量均基于肽的重量计算,包括使用盐的情况。较高水平的毒性问题可以将静脉内剂量限制在较低水平,例如最高约10mg/kg,所有重量均基于肽的重量来计算,包括使用盐的情况。可以将约10mg/kg-约50mg/kg的剂量用于口服施用。通常,肌内注射可采用约0.5mg/kg-5mg/kg的剂量。用于静脉内或口服施用的肽的特别剂量分别为约1μmol/kg-50μmol/kg,并且更特别地为约22μmol/kg-33μmol/kg。在本发明的特别实施方案中,可以历经多种时间间隔(例如每小时、每天、每周、每月等)内采用多于一次施用(例如两次、三次、四次或更多次施用)以达到治疗效果。本发明可用于兽医和医学应用。适合的个体包括禽类和哺乳动物,其中哺乳动物是优选的。本文所用的术语“禽类”包括但不限于鸡、鸭、鹅、鹌鹑、火鸡和雉鸡。如本文所用,术语“哺乳动物”包括但不限于人、牛、绵羊、山羊、马、猫、犬、兔等。人个体包括新生儿、婴儿、少年和成人。
肽的合成
在特别的实施方案中,可以根据本领域已知的几种肽合成方法来制备本发明的肽。肽合成方法可以是例如固相合成过程和液相合成过程中的任何一种。即,目标肽可以通过根据期望的序列重复缩合能够构成化合物(i)的部分肽或氨基酸与其余部分(可以由两个或更多个氨基酸构成)来制备。当具有期望序列的产物具有保护基时,可以通过消除保护基来制备目标肽。已知的缩合方法和保护基的消除方法的实例包括以下(1)-(5)中所述的方法。(1)m.bodanszky和m.a.ondetti:peptidesynthesis,intersciencepublishers,newyork(1966),(2)schroeder和luebke:thepeptide,academicpress,newyork(1965),(3)nobuoizumiya等人:peptidegosei-no-kisotojikken(basicsandexperimentsofpeptidesynthesis),maruzenco.出版(1975),(4)haruakiyajima和shunpeisakakibara:seikagakujikkenkoza(biochemicalex-periment)1,tanpakushitsunokagaku(chemistryofproteins)iv,205(1977)和(5)haruakiyajima编辑:zokuiyakuhinnokaihatsu(asequeltodevelopmentofpharmaceuticals),第14卷,peptidesynthesis,hirokawashoten出版。反应后,可以使用常规纯化方法,例如溶剂萃取、蒸馏、柱色谱、液相色谱、重结晶等及其组合,纯化和分离所述肽。当通过上述方法获得的肽为游离形式时,可以通过已知方法将其转化为适合的盐;相反,当以盐的形式获得该肽时,可以通过已知方法将盐转化为游离形式或其它盐。起始化合物也可以是盐。此类盐的实例包括那些作为在下文中提及的肽的盐示例的盐。为了缩合保护的氨基酸或肽,可以使用可用于肽合成的多种活化试剂,特别优选三磷
精氨酸的胍基的保护基的实例包括tos、z、4-甲氧基-2,3,6-三甲基苯磺酰基(mtr)、对甲氧基苯磺酰基(mbs)、2,2,5,7,8-五甲基色满-6-磺酰基(pmc)、均三甲苯-2-磺酰基(mts)、2,2,4,6,7-五甲基二氢苯并呋喃-5-磺酰基(pbf)、boc、z、no2等。赖氨酸侧链氨基的保护基的实例包括z、cl-z、三氟乙酰基、boc、fmoc、trt、mtr、4,4-二甲基-2,6-二氧代亚环己基(dde)等。色氨酸的吲哚基的保护基的实例包括甲酰基(for)、z、boc、mts、mtr等。天冬酰胺和谷氨酰胺的保护基的实例包括trt、呫吨基(xan)、4,4’-二甲氧基二苯甲基(mbh)、2,4,6-三甲氧基苄基(tmob)等。起始材料中活化羧基的实例包括相应的酸酐、叠氮化物、活性酯[与醇的酯(例如五氯苯酚、2,4,5-三氯苯酚、2,4-二硝基苯酚、氰基甲基醇、对硝基苯酚、honb,n-羟基琥珀酰亚胺、1-羟基苯并三唑(hobt)、1-羟基-7-氮杂苯并三唑(hoat))]等。起始材料中的活化氨基的实例包括相应的亚磷酰胺。除去(消除)保护基的方法的实例包括在催化剂例如pd-黑或pd-碳的存在下在氢气流中的催化还原;使用无水氟化氢、甲磺酸、三氟甲磺酸、三氟乙酸盐、三甲基甲硅烷基溴化物(tmsbr)、三甲基甲硅烷基三氟甲磺酸盐、四氟硼酸、三(三氟)硼酸、三溴化硼或其混合物溶液的酸处理;使用二异丙基乙胺、三乙胺、哌啶、哌嗪等的碱处理;和用液态氨中的钠还原等。上述酸处理的消除反应通常在-20℃至40℃的温度进行;酸处理通过加入阳离子清除剂例如茴香醚、苯酚、硫代茴香醚、间甲酚和对甲酚;二甲硫、1,4-丁二硫醇、1,2-乙二硫醇等而有效地进行。另外,通过硫代苯酚处理除去用作组氨酸的咪唑的保护基的2,4-二硝基苯基;通过在1,2-乙二硫醇、1,4-丁二硫醇等存在下用酸处理脱保护,以及通过用稀氢氧化钠、稀氨水等碱处理除去用作色氨酸的吲哚的保护基的甲酰基。
另外,本发明的肽可以是溶剂化物(例如水合物)或非溶剂化物(例如非水合物)。可以用同位素(例如3h、14c、35s、125i)标记肽。此外,所述肽可以是氘转化形式,其中1h被转化为2h(d)。被同位素标记或取代的肽可以用作例如示踪剂(pet示踪剂),该示踪剂用于正电子发射断层摄影(pet),并且可用于医学诊断等领域中。
对于本文提及的肽,根据常规的肽标记原则,左端为n-末端(氨基末端),而右端为c-末端(羧基末端)。肽的c-末端可以是酰胺(-conh2)、羧基(-cooh)、羧酸酯(-coo-)、烷基酰胺(-conhr)和酯(-coor)。特别优选酰胺(-conh2)。化合物可以是盐形式。这样的盐的实例包括金属盐、铵盐、与有机碱的盐、与无机酸的盐、与有机酸的盐、与碱性或酸性氨基酸的盐等。
在某些实施方案中,肽也可以是前药形式。前药是指在生物体内的生理条件下由于酶、胃酸等的反应而被转化为本发明的功能性肽的化合物,即根据酶的氧化、还原、水解等被转化为本发明的肽的化合物;由于胃酸通过水解等转化为本发明的肽的化合物等。本发明的肽的前药的实例包括化合物,其中所述肽的氨基被酰化、烷基化或磷酸化的化合物(例如,其中所述肽的氨基为二十烷酰基化、丙氨酰化、戊基氨基羰基化、(5-甲基-2-氧代-1,3-间二氧杂环戊烯-4-基)甲氧基羰基、四氢呋喃基化、吡咯烷基甲基化、新戊酰基氧基甲基化或叔丁基化等的化合物);其中肽的羟基被酰化、烷基化、磷酸化或硼酸化的化合物(例如,其中肽的羟基被乙酰化、棕榈酰化、丙酰化、新戊酰化、琥珀酰化、富马酰化、丙氨酰化或二甲基氨基甲基羰基化的化合物);其中肽的羧基被酯化或酰胺化的化合物(例如,肽的羧基被c1-6烷基酯化、苯基酯化、羧基甲基酯化、二甲基氨基甲基酯化、新戊酰基氧基甲基酯化、乙氧基羰基氧基乙基酯化、邻苯二甲酰基酯化、(5-甲基-2-氧代-1,3-间二氧杂环戊烯-4-基)甲基酯化、环己基氧基羰基乙基酯化或甲基酰胺化的化合物)等。其中,优选使用其中化合物(i)的羧基被c1-6烷基例如甲基、乙基、叔丁基等酯化的化合物。这些化合物可以通过本身已知的方法由肽制备。本发明的肽的前药也可以是在生理条件下转化为本发明的肽的前药,例如在iyakuhinnokaihatsu(developmentofpharmaceuticals),第7卷,designofmolecules,p.163-198,hirokawashoten出版(1990)中所述的那些。在本说明书中,前药可以形成盐。此类盐的实例包括作为本发明的肽的盐示例的那些盐。本发明的肽可以形成晶体。具有单晶形式或多种晶形式的混合物的晶体也包括在本发明的肽中。可以通过根据本身已知的结晶方法使本发明的肽结晶来制备晶体。另外,本发明的肽可以是药学上可接受的共晶体或共晶体盐。在本文中,共晶体或共晶体盐是指由两种或更多种在室温下为固体的特定物质组成的晶体物质,它们各自具有不同的物理特性(例如结构、熔点、熔化热、吸湿性、溶解性、稳定性等)。共晶体或共晶体盐可以通过本身已知的共结晶制备。本发明的肽的晶体在物理化学性质(例如,熔点、溶解性、稳定性)和生物学性质(例如,药代动力学(吸收、分布、代谢、排泄),功效表达)方面是优越的,因此非常适合用作药物。
在另外的方面和实施方案中,本发明还提供了如下(1)-(14)任一项和全部中举出的主题:
(1)包含如下结构的肽:(a2i-1-x1-x2-x3-x4-x5-x6-x7-a2i-zi)n,其中:
-n为1-4的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸和/或1-3个非天然看门氨基酸,其选自3-甲基脯氨酸、3,4-脱氢-脯氨酸、2-[(2s)-2-(肼羰基)吡咯烷-1-基]-2-氧代乙酸、β-高脯氨酸、α-甲基-脯氨酸、羟基脯氨酸、4-氧代-脯氨酸、β,β-二甲基-脯氨酸、5,5-二甲基-脯氨酸、4-环己基-脯氨酸、4-苯基-脯氨酸、3-苯基-脯氨酸、4-氨基脯氨酸、4-巯基脯氨酸、2-氨基-己二酸(高谷氨酸)、2-氨基-庚二酸(2-氨基庚二酸)、2-氨基-辛二酸(氨基辛二酸)、2-氨基-4-羧基-戊二酸(4-羧基谷氨酸)、乙二醛-氢化咪唑酮、甲基乙二醛-氢化咪唑酮、n-α-甲基-精氨酸、ω-甲基-精氨酸、正精氨酸、高精氨酸、n,n’-二乙基-高精氨酸、β-高精氨酸、2-氨基-3-脲基-丙酸、2-氨基-6-(1-羧基乙基氨基)己酸、2-氨基-6-羧基甲基氨基)己酸、2-氨基-6-(2-(呋喃-2-基)-2-氧代乙基氨基)己酸、2-氨基-6-(甲酰基-5-羟基甲基-吡咯-1-基)-己酸。c-α-甲基-赖氨酸、β,β-二甲基-赖氨酸、n-ε-甲酰基-赖氨酸、n-ε-甲基-赖氨酸、n-ε-异丙基-赖氨酸、n-ε-二甲基-赖氨酸、n-ε-三甲基铵-赖氨酸、n-ε-烟酰基-赖氨酸、{[5-氨基-1-(肼羰基)戊基]氨基甲酰基}甲酸、n-α-甲基-赖氨酸、高赖氨酸、β-高赖氨酸、2-氨基-6-重氮基-5-氧代己酸、正缬氨酸、α-甲基-正缬氨酸、羟基正缬氨酸、鸟氨酸、n-δ-甲基-鸟氨酸、n-δ-n-δ-二甲基-鸟氨酸、n-δ-异丙基-鸟氨酸、c-α-甲基-鸟氨酸、β,β-二甲基-鸟氨酸、刀豆氨酸、n-δ-甲基-n-δ-丁基-鸟氨酸、n-δ-甲基-n-δ-苯基-鸟氨酸、δ-(2-甲基吡咯烷)-鸟氨酸、δ-哌啶基-鸟氨酸、γ-氨基-δ-哌啶基-戊酸和δ-氮杂环庚烷基-鸟氨酸,并且其中肽结构中的氨基-末端看门氨基酸或氨基-末端非天然看门氨基酸任选被乙酰化和/或其中肽序列中的羧基-末端看门氨基酸或羧基-末端非天然看门氨基酸任选被酰胺化,
-x1为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x2为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x3为甘氨酸或甘氨酸的保守氨基酸取代或甘氨酸的非天然氨基酸变体或甘氨酸的保守氨基酸取代的d-氨基酸或甘氨酸的非天然氨基酸变体的d-氨基酸,
-x4为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x5为丙氨酸或丙氨酸的保守氨基酸取代或丙氨酸的非天然氨基酸变体或丙氨酸的d-氨基酸或丙氨酸的保守氨基酸取代的d-氨基酸或丙氨酸的非天然氨基酸变体的d-氨基酸,
-x6为亮氨酸或亮氨酸的保守氨基酸取代或亮氨酸的非天然氨基酸变体或亮氨酸的d-氨基酸或亮氨酸的保守氨基酸取代的d-氨基酸或亮氨酸的非天然氨基酸变体的d-氨基酸,
-x7为缬氨酸或缬氨酸的保守氨基酸取代或缬氨酸的非天然氨基酸变体或缬氨酸的d-氨基酸或缬氨酸的保守氨基酸取代的d-氨基酸或缬氨酸的非天然氨基酸变体的d-氨基酸,
并且其中x1-x2-x3-x4-x5-x6-x7和x7-x6-x5-x4-x3-x2-x1在重复中可以互换使用,其中n为2-4,
并且zi各自为接头,并且其中zi各自独立地选自1-5个单元的段,其中单元为peg、氨基酸或非天然氨基酸。
(2)根据(1)的肽,其中:
-x1和x3选自甘氨酸、n-α-甲基-甘氨酸(肌氨酸)、环丙基甘氨酸和环戊基甘氨酸
-x2、x4和x6选自亮氨酸、缬氨酸、2-氨基-3,3-二甲基-丁酸(t-亮氨酸)、α-甲基亮氨酸、羟基亮氨酸、2,3-脱氢-亮氨酸、n-α-甲基-亮氨酸、2-氨基-5-甲基-己酸(高亮氨酸)、3-氨基-5-甲基己酸(β-高亮氨酸)、2-氨基-4,4-二甲基-戊酸(4-甲基-亮氨酸、新戊基甘氨酸)、4,5-脱氢-正亮氨酸(烯丙基甘氨酸)、l-正亮氨酸、n-α-甲基-正亮氨酸和6-羟基-正亮氨酸
-x5选自丙氨酸、2-氨基-异丁酸(2-甲基丙氨酸)、2-氨基-2-甲基丁酸(异缬氨酸)、n-α-甲基-丙氨酸、2-氨基-2-甲基戊-4-烯酸(α-烯丙基丙氨酸)、β-高丙氨酸、2-茚满基-甘氨酸、二-正丙基-甘氨酸、二-正丁基-甘氨酸、二乙基-甘氨酸、(1-萘基)丙氨酸、(2-萘基)丙氨酸、环己基甘氨酸、金刚烷基-甘氨酸、β-高烯丙基甘氨酸
-x7选自缬氨酸、亮氨酸、c-α-甲基-缬氨酸(2,3-二甲基丁酸)、2,3-脱氢-缬氨酸、3,4-脱氢-缬氨酸、3-甲基-l-异缬氨酸(甲基缬氨酸)、2-氨基-3-羟基-3-甲基丁酸(羟基缬氨酸)、β-高缬氨酸和n-α-甲基-缬氨酸。
(3)根据(1)或(2)的肽,其中zi由脯氨酸、4-羟基脯氨酸、(2r,5s)-5-苯基(penyl)-吡咯烷-2-羧酸、3,4-脱氢-l-脯氨酸、β-(2-苯并噻唑基)-丙氨酸、3-(2-呋喃基)-丙氨酸或β-(2-噻吩基)-丙氨酸组成。
(4)根据(1)-(3)任一项的环肽,其中氨基末端和羧基末端看门氨基酸a2i-1和a2i形成环结构。
(5)由根据(1)、(2)、(3)或(4)的肽生成的肽模拟物。
(6)(1)-(5)任一项的肽或肽模拟物,其还包含可检测标记。
(7)(1)-(5)任一项的肽或肽模拟物,其还包含增加半衰期延长的分子。
(8)(1)-(5)任一项的肽或肽模拟物,其还包含增加分子溶解度的部分。
(9)(1)-(5)任一项的肽或肽模拟物,其还包含在氨基-末端和/或羧基-末端上的至少一个d-丙氨酸。
(10)(1)-(9)任一项的分子,其用作药物。
(11)(1)-(9)任一项的分子,其用作抗细菌剂。
(12)(1)-(9)任一项的分子,其用作诊断剂。
(13)药物组合物,其包含(1)-(9)的任一项和药学上可接受的载体。
(14)在另一个实施方案中,本发明提供了用于制备抗细菌肽的方法,该方法包括下列步骤:
(i)以计算机模拟方式生成聚集倾向区域(apr),其具有6-12个氨基酸长度,该apr在细菌蛋白质组中鉴定,
(ii)合成包含基于如下结构的apr的众多20-200个不同的肽:(a2i-1-apr-a2i-zi)n,其中n为1-4的整数,并且i在每次重复时从1增加至n,并且a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸,
(iii)测试所述肽的抗细菌作用并且制备抗细菌肽。
在另外的方面和实施方案中,本发明还提供了如下(1*)-(12*)中任一项和全部中举出的主题:
(1*)包含如下结构的肽:(a2i-1-apr-a2i-zi)n,其中:
-n为1-4的整数,并且i在每次重复时从1增加至n;
-a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸或1-3个非天然看门氨基酸,其选自3-甲基脯氨酸、3,4-脱氢-脯氨酸、2-[(2s)-2-(肼羰基)吡咯烷-1-基]-2-氧代乙酸、β-高脯氨酸、α-甲基-脯氨酸、羟基脯氨酸、4-氧代-脯氨酸、β,β-二甲基-脯氨酸、5,5-二甲基-脯氨酸、4-环己基-脯氨酸、4-苯基-脯氨酸、3-苯基-脯氨酸、4-氨基脯氨酸、4-巯基脯氨酸、2-氨基-己二酸(高谷氨酸)、2-氨基-庚二酸(2-氨基庚二酸)、2-氨基-辛二酸(氨基辛二酸)、2-氨基-4-羧基-戊二酸(4-羧基谷氨酸)、乙二醛-氢化咪唑酮、甲基乙二醛-氢化咪唑酮、n-α-甲基-精氨酸、ω-甲基-精氨酸、正精氨酸、高精氨酸、n,n’-二乙基-高精氨酸、β-高精氨酸、2-氨基-3-脲基-丙酸、2-氨基-6-(1-羧基乙基氨基)己酸、2-氨基-6-羧基甲基氨基)己酸、2-氨基-6-(2-(呋喃-2-基)-2-氧代乙基氨基)己酸、2-氨基-6-(甲酰基-5-羟基甲基-吡咯-1-基)-己酸。c-α-甲基-赖氨酸、β,β-二甲基-赖氨酸、n-ε-甲酰基-赖氨酸、n-ε-甲基-赖氨酸、n-ε-异丙基-赖氨酸、n-ε-二甲基-赖氨酸、n-ε-三甲基铵-赖氨酸、n-ε-烟酰基-赖氨酸、{[5-氨基-1-(肼羰基)戊基]氨基甲酰基}甲酸、n-α-甲基-赖氨酸、高赖氨酸、β-高赖氨酸、2-氨基-6-重氮基-5-氧代己酸、正缬氨酸、α-甲基-正缬氨酸、羟基正缬氨酸、鸟氨酸、n-δ-甲基-鸟氨酸、n-δ-n-δ-二甲基-鸟氨酸、n-δ-异丙基-鸟氨酸、c-α-甲基-鸟氨酸、β,β-二甲基-鸟氨酸、刀豆氨酸、n-δ-甲基-n-δ-丁基-鸟氨酸、n-δ-甲基-n-δ-苯基-鸟氨酸、δ-(2-甲基吡咯烷)-鸟氨酸、δ-哌啶基-鸟氨酸、γ-氨基-δ-哌啶基-戊酸和δ-氮杂环庚烷基-鸟氨酸,并且其中肽结构中的氨基-末端看门氨基酸或氨基-末端非天然看门氨基酸任选被乙酰化和/或其中肽序列中的羧基-末端看门氨基酸或羧基-末端非天然看门氨基酸任选被酰胺化,
-apr中包含的肽的名称描述在表5中(p3、p4、p5、p12、p14、p16、p18、p23、p26、p29、p33、p39、p40、p49、p50、p58、p72、p76、p79、p80、p87、p88、p89、p90、p91、p92、p93、p99、p101、p103、p105、p111、p112、p113、p114、p115、p116、p117、p118、p123、p124和p125),并且这些肽的相应的氨基酸序列描述在表4中,其中apr包含天然氨基酸或apr包含存在于apr中的氨基酸的保守氨基酸取代或apr包含存在于apr中存在的肽序列中的氨基酸的非天然氨基酸类似物或apr包含apr中存在的氨基酸的肽序列中的d-氨基酸取代,
并且其中apr中的氨基酸可以为同向或反向重复,其中n为2-4,
并且zi各自为接头,并且其中zi各自独立地选自1-5个单元的段,其中单元为peg、氨基酸或非天然氨基酸。
(2*)根据(1*)的肽,其中zi由脯氨酸、4-羟基脯氨酸、(2r,5s)-5-苯基-吡咯烷-2-羧酸、3,4-脱氢-l-脯氨酸、β-(2-苯并噻唑基)-丙氨酸、3-(2-呋喃基)-丙氨酸或β-(2-噻吩基)-丙氨酸组成。
(3*)根据(1*)-(2*)任一项的环肽,其中氨基末端和羧基末端看门氨基酸a2i-1和a2i形成环结构。
(4*)根据(1*)-(3*)任一项的肽,其还包含可检测标记。
(5*)根据(1*)-(4*)任一项的肽,其还包含增加半衰期延长的分子。
(6*)根据(1*)-(3*)任一项的肽,其还包含增加分子的溶解度的部分。
(7*)根据(1*)-(3*)任一项的肽,其还包含在氨基-末端和/或羧基-末端上的至少一个d-丙氨酸。
(8*)根据(1*)-(7*)任一项的分子,其用作药物。
(9*)根据(1*)-(7*)任一项的分子,其用作抗细菌剂。
(10*)根据(1*)-(7*)任一项的分子,其用作诊断剂。
(11*)药物组合物,其包含(1*)-(7*)的任一项和药学上可接受的载体。
(12*)用于制备抗细菌肽的方法,该方法包括下列步骤:
(i)以计算机模拟方式生成聚集倾向区域(apr),其具有6-10个氨基酸长度,该apr在细菌蛋白质组中鉴定,
(ii)合成包含基于如下结构的apr的众多20-200个不同肽:(a2i-1-apr-a2i-zi)n,其中n为1-4的整数,并且i在每次重复时从1增加至n,并且a2i-1和a2i各自独立地选自1-3个选自r、k、d、e和p的连续的看门氨基酸,
(iii)测试所述肽的抗细菌作用并且制备抗细菌肽。
应当理解,尽管本文已经针对根据本发明的工程肽和方法讨论了特别的实施方案,特别的装配以及材料和/或分子,但是可以在不脱离本发明范围和精神的情况下在形式和细节上进行多种改变或修饰。提供以下实施例以更好地示例特别的实施方案,并且不应将它们视为限制本申请。本申请仅由权利要求限定。
实施例
1.大肠杆菌特异性聚集肽的设计和筛选
在本发明中,我们使用统计热力学算法tango来鉴定大肠杆菌菌株o157:h7的蛋白质组中聚集倾向区域(apr)。这产生了3535个长度为至少6个氨基酸的序列,并且tango得分为至少20%。为了产生有效的聚集接种物,我们采用了先前设计的串联重复设计19,21,其中apr重复一次并且被接头分开。考虑到固相肽合成在收率和纯度方面的长度限制,我们集中于1542个apr,其长度为7个氨基酸。为了最大程度地发挥这些肽在大肠杆菌中诱导聚集的潜能,我们根据apr在整个大肠杆菌蛋白质组中的出现频率对它们进行了排序,允许单个氨基酸错配并且从该列表(表4)中选择了前75个最频繁出现的序列。在设计模式中,并且为了增加这些聚集肽的胶体稳定性,apr的侧翼是聚集看门物,这是一类先前已证明会降低聚集动力学的残基22-24。由于已显示带正电荷的残基有助于细菌摄取25,我们选择精氨酸以获得以下肽配置:r-apr-rr。为了产生串联,我们使用单个脯氨酸残基作为看门物侧翼apr之间的接头。除了以这种方式生成的75个肽外,我们还通过将第一个apr重复中的一个残基随机突变为精氨酸,添加了列表中前25个肽的各自的2个变体,以进一步调节肽的聚集倾向性(表4)。使用固相合成法以200nmole的规模生成所有肽,并且将其溶于dmso中,达到理论原料浓度为2mm(假设合成效率为100%)。以相当于1、6、12和25μg/ml浓度的肽稀释液测量肽对大肠杆菌o157:h7生长的活性。尽管没有一种肽能够在最高稀释度下抑制细菌生长,但是其中有43种肽对25μg/ml的大肠杆菌o157具有活性,其中11种在12μg/ml下具有活性,并且6种具有表观最低抑制浓度(mic)值为6μg/ml(表5)。我们使用经过训练以识别已知amps26的camp软件预测算法来分析我们的序列,并且发现预测90%为抗细菌的,与我们是否发现它们是否具有活性无关(65%无活性)。具有测量活性的matthews相关系数(mcc)在12μg/ml时为0.1,并且在25μg/ml时为0.24。这表明通过机器学习算法捕获的已知amp的关键特性(例如疏水性和电荷)不足以预测聚集肽的抗细菌活性,并且我们的肽通过当前预测算法中未包含的机制起作用。
2.大肠杆菌衍生的聚集肽的活性和选择性
我们从筛选中选择、重新合成并且hplc纯化了几种肽,即p2(rglglalvrrprglglalvrr,seqidno:1)、p5(rallttllrrprallttllrr,seqidno:3),p14(rgllallarrprgllallarr,seqidno:6)以及p105(rallrtllrrprallttllrr,seqidno:5),并且将hplc级纯化肽的最低抑制浓度(mic)和最低杀细菌浓度(mbc)值确定为6-12μg/ml(参见表1)。分析肽对抗大肠杆菌o157:h7的杀细菌活性比例(在mic浓度下)表明,该肽在30分钟至2小时内发挥了充分的杀细菌作用(图1a)。肽处理的细菌的横截面透射电子显微镜检查揭示出大包涵体的广泛存在,这是大肠杆菌中蛋白质聚集的标志,这启示该肽通过干扰细菌的蛋白稳态而起作用(图1b、c、d)。这些包涵体(也称为大极性聚集体)大多位于细菌细胞的两极,如由于类核阻塞而对这些结构所预期的27。有意义的是,当细菌以亚致死浓度(mic的50%)的活性肽反复传代36天期限时,没有观察到耐药性发生,而对照抗生素氨苄西林就发生了这种情况(图1e)。作为这些肽的特异性的第一个指标,我们评估了它们对人红细胞的溶血活性(图1f),这揭示了p2肽(rglglalvrrprglglalvrr,seqidno:1)对大肠杆菌菌株o157:h7具有有利的(特别是最特异性的)毒性特性。对hela细胞通过celltiterblue(图1g)和ldh释放(图1h)分析进一步证实了这一点。通过确定细菌生长被抑制50%时的浓度(ic50=1.5μg/ml)评估p2对大肠杆菌o157:h7的特异性并且与该肽诱导人红细胞50%裂解时的浓度(lc50=1100μg/ml)进行比较,得到治疗比率为730。基于此观察结果,选择p2进行进一步表征,因此将其称为colpeptin1。作为对照,我们生成了colpeptin1突变体,其中我们在apr的不同位置导入脯氨酸取代(表1),这保留了疏水性但破坏了β-折叠的倾向性,因此降低了肽的聚集倾向。由于保留了突变肽的疏水性和电荷,camp预测软件再次将这些对照归类为抗细菌剂。但是,当我们用对照肽处理细菌时,我们获得mic值超过200μg/ml,这表明β结构的形成是我们的肽的抗细菌活性的关键,并且证实其它amp的作用方式不是预测我们序列观察到的抗细菌活性。在下一步中,我们评估了colpeptin1对抗多种细菌菌株的活性,并且将其与细菌菌株中存在的hcab蛋白的序列保守性相关联。数据如表2所示。
3.colpeptin1形成成熟为无定形聚集物的可溶性寡聚化β-结构化的聚集物
通过与离子流动度光谱测定法联用的电喷雾电离-质谱法(esi-ims-ms)28对colpeptin1的分析揭示出,将colpeptin1溶于100mm乙酸铵缓冲液后,该肽不仅即刻是单体的,而且容易形成二聚体至最高可达9-聚体的可溶性寡聚体和可能更高等级(图1i)。与此相一致,溶解时通过动态光散射(dls)观察到的主要种类具有约1-2nm的表观流体力学半径,其在数小时内迅速生长成大颗粒(图1j)。colpeptin1溶液的组成会随着时间的推移而向着更大的种类发展,在质谱仪中,这伴随着更小的种类的消耗(更大的种类超出了仪器的检测范围)。使用超速离心法对肽随时间变化的溶解度进行的研究也显示出聚集现象,溶解后通过超速离心30分钟,溶液中残留的肽小于60%(图1k)。将以此方式收集的不溶级分重新悬浮(以原始体积的10%的比例),并且使用傅立叶变换红外光谱(ftir)分析二级结构含量,其显示1622和1641附近的主要峰,与β-结构形成一致(图1l)。成熟的聚集体仅对淀粉样蛋白特异性染料五聚体甲酰基噻吩乙酸(p-ftaa)29-31呈轻度阳性(图1m)。通过透射电子显微镜检查,成熟的聚集体主要形成淀粉样蛋白样的聚集体,有时会组装成有序的原纤维(图1n)。综上所述,这些特征与形成缓慢转变成不溶性纤维状聚集体的β-结构化的可溶性寡聚体的colpeptin1一致。在将colpeptin1暴露于多磷酸盐,即大肠杆菌中预先显示有利于淀粉样蛋白形成的天然丰富形式的磷酸盐时32,该肽显示出典型的淀粉样蛋白聚集动力学,如使用pftaa荧光测得的(图1o)。对colpeptin1的脯氨酸取代和无活性对照(称为p-colpeptin1)的分析表明,在相同条件下溶解时,p-colpeptin1几乎完全可溶并且不采用β-结构化的构象,不过,沉降分析仍揭示出在较长的时间量程时聚集(图1k&l)。
4.colpeptin1在膀胱感染模型中展示出对抗大肠杆菌的体内活性
为了测试colpeptin1的体内潜能,我们用colpeptin1处理了哺乳动物(hela)细胞和大肠杆菌o157:h7的共培养物,并且观察到colpeptin1在细菌中的优先积累,但在哺乳动物细胞中却没有(图2a)。最终,我们发现在25%或50%的人血清中温育2小时的colpeptin1仍能够以25μg/ml和50μg/ml抑制细菌生长(图2d)。鉴于这些积极的结果,我们然后通过进行剂量递增试验确定了瑞士小鼠对该肽的耐受性。我们观察到腹膜内施用至多30mg/kg的colpeptin1不会在整个浓度范围内对动物的基本生理和行为参数产生急性不良影响。观察到的参数包括体重、食物和水的消耗、笼舍活动和运动。随后,我们以最大耐受剂量每天注射6只小鼠的组达18天,无明显不良反应。允许小鼠恢复三天,此时处死它们,并且进行主要器官的检查,揭示出没有主要的形态学毒性迹象(表6、7和图5、6)。此外,对这些动物的血清进行的elisa分析未揭示出对colpeptin1肽的特异性抗体反应(图2e)。注射(ip或泌尿道)单剂量10mg/kgfitc标记的colpeptin1后,在健康动物中进行的有限生物分布研究揭示出,注射后至少3小时荧光物质分布清晰,并且24小时后肽完全清除(图7)。基于这些观察结果,我们在小鼠膀胱感染模型中测试了colpeptin1的抗细菌功效。在该模型中,通过尿道将50μl108cfu/ml大肠杆菌o157:h7悬浮液接种物递送至健康的瑞士小鼠的膀胱中。感染后1小时,我们通过尿道(n=15)或腹膜内(n=15)施用单次注射的10mg/kg的colpeptin1。处理后24小时,处死动物并且通过将浸渍的组织铺板确定肾、结肠、膀胱和输尿管中的细菌滴度(图2f-1)。这些试验揭示出,经腹膜内和尿道递送后,经colpeptin1处理的动物的不同器官中的细菌滴度均显著降低了超过2-log倍(与缓冲液对照相比p-val<10-4,并且与非聚集性p-colpeptin1对照相比p-val<10-4,使用tukey事后检验的方差分析)。该效果与口服给药的用作对照的氨苄西林(20mg/kg)相差无几,这表明colpeptin1对抗大肠杆菌的抗细菌活性在体内得以维持。
5.colpeptin1摄取导致ib形成和生长抑制
为了研究其作用模式,我们用异硫氰酸荧光素(fitc)衍生的colpeptin1,并且确定该缀合物保留了其抗细菌活性(mic=3μg/ml,对抗大肠杆菌o157:h7),并且通过流式细胞术定量了colpeptin1的摄取。对大肠杆菌o157:h7摄取colpeptin1的分析表明,在15分钟后,fitc(图3b&f)阳性的细胞为97.7±2.9%(n=4)(图3b&f),在1小时及以后增加到接近100%(图3c-f)。平行地,在mic浓度下处理的大肠杆菌o157:h7的荧光显微镜检查证实fitc-colpeptin1的细胞膜上没有富集,但从15分钟起在胞内极性包涵体(ib)中显示出清晰的荧光积累(图3g),其在以后的时间点仍然存在(图3h)。此外,可以用p-ftaa对colpeptin1诱导的ib进行染色,p-ftaa是一种特异性结合淀粉样蛋白聚集体以及与疾病相关的蛋白包涵体的染料31,这证实了这些包涵体富含有序的β-折叠的聚集蛋白结构(图3i&j)。这表明colpeptin1的摄取和ib的形成紧密相继发生。colpeptin1处理后(图3k)通过cfu测定测得的细菌细胞死亡动力学也与肽内化密切相关,并且与15分钟处理后ib的出现相符(15分钟后为50%)。另一方面,如膜渗透引起的碘化丙锭(pi)摄取监测的细菌细胞死亡增加得更为缓慢(15分钟后为2.1±1.3%,3小时后为85±13.2%,图3a-e和3l),这表明,在较短的处理时间时,与ib形成同时建立了显著的生长抑制,但在可以观察到膜渗透之前。与此相符的是,使用扫描电子显微镜检查(sem,图3m、n、o)对在4xmic下处理2小时的细菌和未经处理的对照进行了形态学分析,结果表明,colpeptin1处理的细菌出现皱缩,但没有明显的细胞渗漏。这些数据共同启示一系列事件,其中colpeptin1内化与含colpeptin1的ib形成和细菌生长抑制同时发生。
6.colpeptin1诱导致死性细菌性蛋白稳态崩解
细菌ib形成是与细胞应激相关的常见事件,包括暴露于热和重组蛋白(过)表达。然而,该过程通常是短暂的和可逆的,并且不一定导致细菌细胞死亡。实际上,细菌中重组蛋白的产生在很大程度上取决于细菌应对ib的能力。作为实例,我们测量了过表达人类p53蛋白(p53cd)高度聚集倾向的核心结构域对大肠杆菌bl21细胞生长(图4a)的影响,该细胞通常用于重组蛋白制备。尽管p53cd的表达导致指数生长期的延迟,这与过表达引起的细胞应激是一致的,但对菌落形成没有影响,表明这种应激不是致死的。为了了解为何colpeptin1诱导ib形成具有不可逆毒性,我们比较了从用colpeptin1以mic浓度处理1小时的大肠杆菌o157:h7细胞纯化的ib与从过表达p53cd的大肠杆菌菌株bl21过夜纯化的ib的组成。通过tem对所得样品进行的检查证实了这些ib的成功纯化(图4c)。随后通过考马斯染色的sds-page(图4d)分析ib的组成。考马斯染色的整体模式揭示出,大量类似细菌蛋白被俘获在colpeptin1处理的大肠杆菌o157:h7和p53过表达的大肠杆菌bl21的ib中,但未在未处理的细菌中被捕获,这启示与ib形成相关的共同分子机制。在ib捕获的蛋白中,可以检测到许多已知在包涵体中出现的分子伴侣蛋白,包括细菌hsp70同源物dnak、hsp60伴侣蛋白groel、核糖体相关伴侣蛋白触发因子(tf)和细菌hsp40dnaj(图4e)。荧光可追踪的dnak-mcerulean3融合蛋白(后者部分包含蓝色荧光蛋白)在暴露于colpeptin1的大肠杆菌k12mg1655细胞中的极性定位证实了dnak与ib的关联(图4f)。我们的数据显示colpeptin1和p53cdib共有许多蛋白,包括许多伴侣蛋白和核糖体蛋白,它们是ib的常见组成成分。其次,除了这个共同的核心,我们还发现colpeptin1ib比p53cdib包含更多的其它蛋白质。这表明,与p53cd过表达的作用相比,colpeptin1处理的毒性影响相当于更广泛的蛋白质组学影响。该观察结果符合我们最初的设计假设,该假设旨在通过多种蛋白的聚集诱导蛋白稳态崩解。
7.colpeptin1诱导直接序列靶标的共翻译聚集
按照我们的设计,coepteptin1apr在大肠杆菌蛋白质组中高度丰富,并且还可以在其它18种具有单一错配的大肠杆菌蛋白(表8)和158种具有双错配的蛋白中发现。对于colpeptin1,其直接apr匹配是来自hcab的g17lglalv24序列。hcab(3-苯丙酸-二氢二醇/肉桂酸-二氢二醇脱氢酶)为芳香族化合物代谢中的一种非必需酶,其丰度非常低(根据paxdb33,为0.015ppm)。taguchi及其同事先前使用无细胞翻译系统确定了包括hcab在内的整个大肠杆菌蛋白质组的溶解度,其显示hcab是高度聚集倾向的蛋白质,其高度依赖groel/es进行折叠34。在下一步中,我们将hcab克隆到诱导型载体中以进行重组表达,并且从过表达hcab的大肠杆菌bl21:de3细胞的裂解物中色谱纯化蛋白质。使用这种材料,我们在小鼠中进行了免疫接种方案(参见材料和方法),在蛋白质印迹中产生对抗hcab的抗血清,揭示出正确分子量的条带以及2个脱靶条带(图4h)。使用这种抗血清,我们比较了colpeptin1处理(在mic浓度下1h)对内源表达hcab的大肠杆菌o157:h7的可溶和不可溶级分和过表达hcab的大肠杆菌bl21细胞中存在的hcab的影响(图4h),从而证实hcab在colpeptin1处理的细胞的包涵体级分中蓄积。这证实了在用colpeptin1处理后hcab确实会聚集。当基于tuller方法35(使用单个密码子的典型解码次数)计算这些基因的翻译效率时,我们发现colpeptin1靶蛋白的翻译效率明显高于(斯氏t检验,p<0.001,图4j)对于未检测的推定靶标,这启示高翻译率可能有利于colpeptin1诱导的聚集。为了验证这一推定,我们在大环内酯类抗生素红霉素存在下测量了colpeptin1的mbc值,大环内酯类抗生素红霉素是一种通过阻断核糖体中多肽出口通道起作用的抑菌药物。令人惊讶的是,我们观察到在用100μg/ml红霉素预处理2小时以阻断在暴露于colpeptin1期间的翻译后,细菌(大肠杆菌o157)对colpeptin1显著脱敏(mbc>100μg/ml),这强烈支持了蛋白聚集的共-翻译诱导作为作用模式。
colpeptin1apr在鲍氏不动杆菌蛋白质组中是高度丰富的,并且还可以在具有单一错配的18种其它鲍氏不动杆菌蛋白和具有双错配的268种蛋白中发现(表9),这支持了观察到的colpeptin1对抗大肠杆菌和鲍氏不动杆菌两者的杀细菌活性(图9)。
8.colpeptin1诱导导致蛋白稳态崩解的多靶标聚集级联
然后,问题仍然是colpeptin1及其检测到的靶标的聚集与在colpeptin1ib中发现的其它蛋白的聚集有何关系。第一种可能在于colpeptin1诱导的蛋白稳态崩解是由于细菌伴侣蛋白的饱和所致。为了测试这种可能,我们确定了在大肠杆菌k-12bw25113菌株(keio集合37)中对主要细菌伴侣蛋白和蛋白酶colpeptin1活性的影响,并且发现从大肠杆菌的主要蛋白稳态成分的单个敲除物中,只有dnak对colpeptin1的活性有轻微的影响(表3)。此外,使用侧翼带正电荷的菌株特异性apr的串联重复预先设计的在表皮葡萄球菌19中诱导致死性聚集的肽,即使这些肽已被内化,它们对抗革兰氏阴性大肠杆菌也没有活性,反之亦然。这些数据共同启示,用聚集肽来饱和伴侣蛋白和蛋白稳态系统并不是colpeptin1的主要作用机理。或者,并且与我们的推定一致,apr丰度通过蛋白聚集的序列特异性级联驱动蛋白稳态崩解。我们的理由在于主要的colpeptin1靶标在其序列中具有其它apr,并且这些形成也存在于这些ib中的colpeptin1诱导的共聚集蛋白,这些蛋白本身可以通过由主要colpeptin1靶标中的次级apr确定的聚集级联反应进一步连接。进一步,仍然可以通过第三层以类似的方式连接更多数量的蛋白,最后使细胞中的几乎没有蛋白质保持未连接状态。
相比之下,根据tango(iltiitl,seqidno:223)38,p53cd具有一种优势apr,其在大肠杆菌o157:h7的蛋白质组中没有确切匹配,但它具有3种具有一个突变的apr的蛋白和50种具有2个突变掉的apr的蛋白。这些蛋白无一在ib中可检测到(数据未显示),表明p53cd聚集是序列空间中更为孤立的事件。另一方面,在p53cd的ib中检测到的蛋白主要由伴侣蛋白客体组成39-46,这证实p53cd聚集构成了蛋白稳态应激,但与colpeptin1相反,它不会引起蛋白稳态崩解并且不会对细菌细胞致死。
9.28种不同肽对抗一组细菌的mic值的测定
在本试验中,将一组28种肽(其氨基酸序列示于表4)施用于大肠杆菌bl2菌株、鲍氏不动杆菌、肺炎克雷伯菌和铜绿假单胞菌。确定了mic值,并且描述在图8中。
10.colpeptin1具有种类反应性中的宽范围并且不受病原抗性特性影响
在本试验中,我们评估了colpeptin1对抗许多大肠杆菌临床分离株和许多鲍氏不动杆菌临床分离株(包括2种参比菌株)的效力。图9(上图)列出了colpeptin1(在图8中表示为p2)相对于许多大肠杆菌临床分离株的mic值。图9(下图)列出了colpeptin1的mic值(在图9中以p2表示),图中描述了临床分离株对抗12种不同抗生素的敏感性(s)或耐药性(r)或中等耐药性(i)(数据根据特定抗生素的clsi标准确定)。我们的数据表明colpeptin1具有广泛的物种内活性,并且对于大肠杆菌和鲍氏不动杆菌,mic值均不受抗生素病原抗性特性的影响。
材料和方法
1.生物信息学分析
从uniprot(nucleicacidres.(2008)36,d190-5)获得了多种细菌菌株的蛋白质序列,并且使用cd-hit算法(ful.等人(2012)bioinformatics28,3150)去除了丰余。我们在本手稿中将tango算法用于所有apr鉴定。我们对每个残基的tango得分使用了5的临界值,因为这在预测与试验之间给出了mathews相关系数为0.92(fernandez-escamillaam等人(2004)nat.biotechnol.22,1302)。tango的设置为温度=298k,ph=7.5,离子强度=0.10m。
2.肽合成
在筛选阶段期间,使用标准固相肽合成(jpt,berlin,germany)合成肽。使用intavismultipeprsi合成机器人在内部以更高规模在室内重新合成肽命中样本,并且在prominencehplc(shimadzu,japan)上使用zorbaxsb-c3半制备柱(agilent,usa)进行hplc纯化至95%。将肽冻干并且在使用前储存在-20℃。
3.细菌菌株和生长条件
在37℃,在luria-bertani(lb)肉汤(difco)中培养革兰氏阴性细菌菌株,并且在丰富培养基脑心浸液(bhi)肉汤(difco,sparks,md)中培养革兰氏阳性细菌菌株。无论何时需要,在培养基或平板上均向生长培养基中补充适当的抗生素。大肠杆菌dh5α用于克隆和质粒扩增。为了选择抗生素抗性菌落,使携带质粒的大肠杆菌在补充了25μg/ml氨苄西林或100μg/ml红霉素(sigma)的lb培养基中生长。在血琼脂平板上进行细菌cfu计数(bdbiosciences)。使用maldi-tof和
4.mic测定
根据eucast指南,通过微量肉汤稀释法确定活性肽的mic,该测定在96-孔聚苯乙烯平底微量滴定板(bdbiosciences)中进行。简言之,将单个菌落接种到5mllb培养基中,并且在37℃的摇动温育箱中生长至末端指数生长期。随后将培养物在新鲜lb培养基中稀释至od600为0.002(1x108cfu/ml)。将100μl从100μg/ml到1μg/ml范围的不同浓度多肽lb培养基系列稀释到无菌96-孔板(每个板中至少3孔)中。此后,将100μl稀释的细菌吸移到含有不同浓度肽的96-孔板中。在每个板中,将生长细菌与最大浓度的载体和培养基分别视为阳性和阴性对照。之后,将96-孔板在37℃下静置培养过夜,以使细菌生长。使用perkinelmer分光光度计(1420multilabelcountervictor3),在od590nm处摇晃1秒的多功能uv/vis读板器测量生长细菌的吸光度。
5.抗体和抗生素产品代码
抗-clpb(aviva,目录#arp53790_p050),抗-dnak(aviva,目录#oaed00201),抗-触发因子(clontech,目录#m201),抗-groel(abcam,目录#ab82592),抗-dnaj(enzolifesciences,目录#adi-spa-410-d)。氨苄西林钠,cas编号69-52-3,duchefabiochemie,目录#a0104。红霉素,cas编号114-07-8,sigmaaldrich,cas编号114-07-8,目录#e5389。
6.生物物理学表征
使用配备有830nm激光源的dynaprodls读板仪(wyatt,santabarbara,ca,usa),在室温下进行动态光散射(dls)测量。将样品(100μlpbs缓冲液,2mm肽)放入平底96-孔微孔澄清板(greiner,frickenhausen,germany)中。记录90°角的散射光强度的自相关校正10秒,并且在40次记录中取平均值,以获得单个数据点。使用wyattdynamics软件通过假设球形颗粒形状来计算流体力学半径。使用配备bio-atrii附件的brukertensor27红外分光光度计进行衰减全反射傅立叶变换红外光谱(atrftir)。通过累积120个数据采集,以4cm-1的光谱分辨率记录了900-3500cm-1范围内的光谱。用干燥空气连续吹扫分光光度计。对光谱进行校正以消除大气干扰,减去基线,并且在酰胺ii区域(1500-1600cm-1)中重新定标。对于透射电子显微镜检查(tem),将来自肽制备物的等分试样吸附到碳涂覆的formvar400-目铜网格(agarscientific)上1分钟。印迹网格,洗涤并且用1%(wt.vol-1)乙酸双氧铀染色。用jeoljem-1400显微镜(jeoltokyo,japan)在80kv下研究样品。
7.时间杀死动力学测定
进行了肽的时间-杀死动力学研究,以评估在足够的暴露时间点细菌的杀死率。这项研究根据标准指南进行,以便使用时间-杀死动力学方法评估抗微生物活性。活性剂浓度的选择由mic终点指导。
简言之,将20μl的大肠杆菌o157:h7冷冻培养物接种到5mllb中,并且在37℃的摇动温育箱中生长至末端指数生长期。随后将培养物在新鲜lb培养基(1ml)中稀释至od600=0.002(1x108cfu/ml)。为了评估聚集物随时间的作用,细菌在不同时间段(5分钟,10分钟,30分钟,1小时,直至6小时)以mic值经受不同肽的浓度。在规定的接触时间后,将50μl的各个培养物系列稀释并且铺在血琼脂平板上。将板在37℃下温育过夜而不摇动。阳性和阴性对照分别用最大使用的缓冲液和lb培养基处理细菌。将存活生物体的数量计为cfu/ml。
8.多级抗性发生研究
通过历经30天半mic值的活性肽存在下重复传代培养,评估靶菌株对活性化合物产生抗性的能力。简言之,将大肠杆菌o157培养物在luriabroth(lb)培养基中生长;然后将细菌的光密度调整为od600为0.002(相当于1x108cfu/ml)。然后,将细菌用半-mic浓度的p2肽处理,24小时温育期后,根据eucast指南通过微稀释法测试mic,然后在半-mic值的相应聚集物存在下对细菌进行重新培养。氨苄西林在本试验中用作阳性对照。
9.扫描电子显微镜检查
为了进行扫描电子显微镜检查(sem),将处于末端指数生长期的大肠杆菌o157细菌稀释至108cfu/ml的密度,并且用超-mic浓度的肽进行处理。2小时处理后,将细菌用2%戊二醛固定1小时。1%的四氧化锇(oso4)用作后固定在0.1m的甲胂酸钠缓冲液中1小时。将样品在室温用甲胂酸盐缓冲液(0.1m甲胂酸钠)洗涤3次,每次10分钟。样品用分级乙醇系列(50%、70%、96%、100%乙醇)脱水。脱水步骤后,将样品用六甲基二硅氮烷(hmds)干燥1小时,并且将其固定在样品桩上,并且用金进行溅射涂覆。使用加速电压为30kv的sem-feg显微镜(jeoljsm6700f)。
10.横截面透射电子显微镜检查
将处于末端指数生长期的大肠杆菌洗涤两次,并且用生理水稀释,然后在37℃用4xmic值的特异性聚集肽(colpeptin1或p2pro2)或缓冲液处理2小时(对照组)。2小时后,将细菌以6000rpm离心4分钟,并且将沉淀用在0.1mph=7.2-7.4的甲胂酸钠缓冲液[+2.5mmcacl2+1mmmgcl2]中的2.5%戊二醛固定1小时。然后,将沉淀用甲胂酸盐缓冲液洗涤,重悬于在甲胂酸盐缓冲液(40℃)中的1.5%低熔点琼脂糖(sigmaa4018)中,并且以6000rpm离心4分钟。将离心管在冰上放置15分钟,此后将含有沉淀的尖端切掉,并且用一滴甲胂酸盐缓冲液除去沉淀。将沉淀切成1mm3的立方体(4℃),用在蒸馏水中的1%四氧化锇(oso4)固定2小时,并且用蒸馏水洗涤两次。此时,将样品以梯度乙醇系列(30、50、70、90、100%)分别在4℃的每个步骤脱水5分钟,同时缓慢旋转(乙醇100%,重复3次)。最终,将细胞在4℃用环氧丙烷处理两次,每次15分钟,用1:1的环氧树脂和环氧丙烷混合物浸润(60’@4℃,缓慢旋转),然后保持在2:1的环氧树脂和环氧丙烷的混合物中在无盖的通风橱中过夜。第二天早上,将样品置于100%新鲜环氧树脂中,晚上将其包埋在beem胶囊中,并且在60℃的烘箱中聚合2天。用leicaultracutuct超薄切片机切割超薄切片,并且在80kv下操作并且配备olympusquemesa11mpxl相机的jeoljem1400透射电子显微镜中观察。
11.体外溶血活性测试
通过针对人红细胞的溶血作用测定肽的溶血活性。获得合并的新鲜血液,并且通过3000rpm离心5分钟(用edtak抗凝)收集红细胞(cristina等人,2015)。用pbs洗涤沉淀3次,并且在pbs中稀释至8%的浓度。在96孔板(bdbiosciences)中,将100μl的8%红血细胞溶液与100μl在pbs缓冲液中的肽系列稀释液混合。将反应混合物在37℃温育1小时。此时,将板以3000rpm离心10分钟,并且将100μl上清液转移至灭菌的96-孔板(平底)中。血红蛋白的释放通过测量在405nm处的上清液吸光度来确定。将溶血活性确定为引起溶血的最小肽浓度(最低溶血浓度,mhc)。1%triton和max使用浓度的载体中的红细胞分别用作100%和0%溶血的对照。
12.体外哺乳动物细胞毒性
使用ldh释放(roche,mannheim,germany)和celltiterblue(promega)方法测量哺乳动物的细胞毒性。简言之,将hela细胞(从bartdestrooper实验室获得,经测试不含支原体)以在dulbecco的改良eagle培养基中3×105个细胞/ml的浓度接种在96-孔圆底板中,并且用不同浓度的肽处理。将用1%tritontmx-100和载体处理的细胞分别视为阳性和阴性对照。将微量滴定板在37℃、5%co2和90%湿度下温育4小时。将微量滴定板以1350rpm下离心10分钟。将100μl上清液转移至澄清的96-孔平底微量滴定板中。为了确定上清液中的ldh活性,将100μl反应混合物(催化剂和染料溶液)加入每个孔中,并且在黑暗中于室温温育30分钟,并且通过添加100ul终止溶液终止ldh反应。在490nm处测量样品的吸光度。使用以下公式计算细胞存活率:(试验值-阴性对照值)/(阳性对照值-阴性对照值)*100。吸光度与活细胞数量成正比,并且相当于细胞的代谢活性。
13.大肠杆菌atcc25922菌株中hcab基因的克隆和表达
大肠杆菌o157hcab的编码区使用包含另外的用于克隆目的的sali和smai限制位点的hcab特异性引物(atgtcgacatgagcgatctgcataacga(seqidno:224)、atgtcgacatggagcgatttatcgaagaaggc(seqidno:225)、atcccgggttaaagatccaacccagccg(seqidno:226))扩增。设计了该基因的两个截短形式,一个具有目标基因部分apr,另一个则没有目标区域。将细菌大肠杆菌o157菌株即临床分离株的基因组dna(gdna)用作模板。将扩增子连接到sali/smai-消化的pcn68大肠杆菌-葡萄球菌属穿梭载体中,产生不同的截短形式的pcn-hcab。在该质粒中,pblaz为启动子。氨苄西林(25μg/ml)或红霉素(100μg/ml)用作选择标志物。克隆的正确性首先通过限制性内切酶消化,pcr和插入物的核苷酸序列分析和随后测序来确认。
14.大环内酯和肽相互作用
为了评估在红霉素存在下的肽作用,将大肠杆菌o157在5mllb(luria-bertani)中生长。然后将指数期培养物稀释至108个细胞/ml。用红霉素以100ug/ml的浓度处理细菌3小时,以在37℃停止生长,不摇动。将不同浓度的肽(100ug/ml-0.75ug/ml)或缓冲液铺在96-孔板上,其中至少3次重复孔(50ul)。将50ul红霉素处理的细菌加入各孔中,并且将96孔板在37℃温育2小时。2小时后,将细菌系列稀释并且在血琼脂平板上培养。将板在37℃温育过夜。通过cfu计数定量活细胞的数量。
细菌和哺乳动物细胞与fitc标记肽偶联的共培养物的荧光显微镜检查
为了成像目的,将人hela细胞在带有玻璃底部的小细胞视野细胞培养皿(greinerbio-one/gmbh/35mmref:627860)上生长,以形成汇合的单层。此时,用200μl带有fitc肽(3xmic)的大肠杆菌o157菌株过夜培养物感染细胞24小时。将细胞用cellmask深红色质膜染料和1μlnucblue试剂(invitrogen)染色30分钟,然后除去培养基,并且向平板中加入2ml4%的低聚甲醛进行固定。将板在rt温育6小时。在成像之前,将共培养的细胞用1ml盐水洗涤3次。
15.用发光结合的寡聚体(lco)的染色
将200μl末端指数培养的大肠杆菌o157用pbs洗涤3次,将细菌数调整为108个细胞,然后用肽(以mic)或pro2肽作为对照处理细菌2小时。2小时后,将细胞与1μllco染料p-ftaa一起温育1小时30分钟。在480-600nm处测量吸收和发射光谱。
16.使用标记的肽和碘化丙啶(pi)的细菌流式细胞术分析
使用碘化丙啶(pi)和fitc肽的双重染色技术,在二维分析中评估了杀死率和肽摄取。简言之,将末端指数生长期的大肠杆菌o157细胞(108cfu/ml)用pbs洗涤,并且用mic值的肽(colpeptin11或pro2/fitc标记的)处理不同时间期限。再次用pbs缓冲液洗涤处理的细菌3次。将1ulpi(invitrogen)加入细菌中,并且温育5分钟后,将混合物等分(500μl)入fac管中。为了使肽的活性与细胞死亡建立相关性,使用galliostm流式细胞仪在两个通道中测量了荧光强度,pi:激发536nm,发射617nm,fitc:激发490nm,发射525nm。
17.包涵体纯化
将20ml过夜细菌培养物以6000rpm离心30分钟,并且用生理水洗涤。将细菌以mic的肽处理半数杀死时间,然后将细菌沉淀用10ml缓冲液a(50mmhepesph7.5,300mmnacl,5mmm-巯基乙醇,1.0mmedta)洗涤并且在4℃以6krpm离心30分钟。弃去上清液,并且将20ml缓冲液b(缓冲液a加1μg/ml亮抑蛋白酶肽,0.1mg/mlaebsf)加入细菌沉淀中。为了破坏细胞,使用压力设置为20000-25000psi的glencrestoncell匀化器,此外,将悬浮液在冰上超声处理(bransondigital超声仪50/60hz),交替2分钟(15次脉冲,50%功率,在冰上停顿30秒,直到完成2分钟的总超声处理时间为止)。将裂解的细胞在4℃以10krpm离心30分钟。然后将沉淀的级分重悬于10ml缓冲液d(缓冲液a加:0.8%v/vtritonx-100,1%脱氧胆酸钠)中,并且对悬浮液进行超声处理,以确保沉淀完全溶解。将该步骤重复3次。在4℃以10.000rpm离心30分钟。最终为了使ib增溶,将沉淀物悬浮于每克沉淀级分1ml的缓冲液f(50mmhepesph7.5,8.0m脲)中。
18.血清存在下的肽活性和稳定性
简言之,为了获得人血清,将新鲜血液在rt(室温)放置20分钟以使其凝结。然后将试管以3000pm离心10分钟,并且分离血清。将血清稀释到rpmi培养基(50%)中,并且将不同浓度的5μg/ml、25μg/ml和50μg/ml的肽加入每个孔中。2小时温育后,用pbs将末端指数大肠杆菌o157培养物洗涤3次(8000rpm,10分钟)。然后在有或没有血清的rpmi培养基中将细菌数调整为9×108个细胞。2小时温育后,将细菌系列稀释并且在血琼脂平板上培养。然后将板在37℃温育过夜。将活细菌的数量量化为cfu/ml(菌落形成单位)的数量。
19.hcab纯化和抗体产生
使用具有用于克隆目的额外的ndei和bamhi限制位点(加下划线和粗体)的hcab-特异性引物(
大肠杆菌菌株o157的基因组dna(gdna)用作模板。将扩增子连接到ndei/bamhi-消化的pet11c质粒中,作为在大肠杆菌中蛋白表达的系统的组分,从而产生pet-his-hcab。在该质粒中,t7rna聚合酶(高活性组成型启动子)是启动子。氨苄西林用作选择标志物。所有重组质粒均在大肠杆菌bl21中复制以具有bl21pet-his-hcab。克隆的正确性通过限制性酶消化和插入物的核苷酸序列分析得到证实。
如先前所述纯化蛋白质(luminy和cedex2011)。简言之,将大肠杆菌bl21pet-his-hcab在含有100μg/ml氨苄西林和1mm异丙基-β-d-硫代吡喃半乳糖苷(iptg)的1lluria-bertani(lb)肉汤中于37℃生长,振摇过夜。此后,通过离心(4,000rpm,10分钟,4℃),收集细胞标签将其重新悬浮于25ml裂解缓冲液(pbsph7.5,1mmb-巯基乙醇加1片蛋白酶抑制剂mini,edta-freelyse)中,纯化通过french法压制并且在添加dnasei和完整蛋白的条件下在4℃搅拌裂解的细菌。为了消除聚集,我们将蛋白保留在冰上,然后过滤。hcab蛋白纯化通过aktafplc系统进行,该系统为全自动液相色谱系统,其中hcab蛋白使用hipreptmhp5ml柱进行纯化。在实际的纯化操作之前,将akta进行剥离、装料和做空白。纯化通过aktaxpress中的程序进行。从不同试管中收集纯化的蛋白标签合并级分,标签保持在4℃。通过在sds凝胶上运行检查纯化的蛋白。将三只瑞士小鼠在10天内进行了两次腹膜内免疫接种。施用hcab蛋白(50ug/小鼠)和完全弗氏佐剂(cfa;sigma)(1:1)的混合物第一次注射。在第10天,通过elisa滴定抗体后进行加强注射(蛋白和不完全弗氏佐剂(ifa;sigma))。然后根据制造商的说明,通过吸附至蛋白g柱(gehealthcare)从血清中纯化总免疫球蛋白gs(igg)。
20.试验动物
5至8周(20和23g)的雌性瑞士小鼠用于本试验。经过3天试验笼的适应期后,其中具有正常的12小时光照-黑暗期限和20℃的环境温度,将动物用于试验。
21.体内毒性试验
测定中所用的方法已获得当地动物伦理委员会(localanimalethicalcommittee)批准,并且符合国际动物福利标准(ethicalcommitteeofkuleuven的批准书p067/2015)。通过逐步进行的试验达到了30mg/kg的安全剂量,并且腹膜内施用未见急性不良反应。
简言之,将5-6周龄的瑞士雌性动物分为3组(每组6只动物),每天一次通过ip注射施用30mg/kgcolpeptin1(a组)或载体(生理水ph7.5)(b组),持续18天。在处理期间,不断监测和记录临床、生理和行为参数,包括体重、食物和水的消耗、身体状况评分,饲养笼活动和运动。
最后一次施用后三天,将动物麻醉,并且使用标准的后眼眶穿刺法从每只动物采血。接下来,处死小鼠并且进行使用肉眼检查和器官重量的完全尸检。采样器官(心、肝、脾、肾、骨髓、脑、肺)并且将其浸没固定在4%低聚甲醛中。常规处理脱水后福尔马林固定的组织,并且将其包埋在石蜡块中以进行组织病理学检查。然后将从这些块中取出的5μm厚切片(thermoscientificmicromhm355s切片机)用苏木精和曙红(leicast5010autostainerxl)染色,并且在leicadm2500光学显微镜下由广泛认证的兽医病理学家进行评估。使用自动高分辨率流式细胞仪abbottcell-dyn3700进行血液学检查。
22.尿道感染模型
如前所述,将8周龄的瑞士雌性小鼠用于尿道感染模型4。简言之,通过腹膜内施用10%的戊巴比妥将小鼠麻醉,然后用手指轻轻按摩小鼠的膀胱并且向下推以排出残留的尿液。此后,将麻醉的小鼠在膀胱中通过无菌导管在5秒内缓慢地经尿道接种50μl细菌混悬液(1x108cfu/ml),以避免通过手术显微镜引起膀胱输尿管反流。我们估计样本大小如下:允许i型错误率为0.05,ii型错误为0.2,并且估算1logcfu时cfu测定的最大标准偏差,我们计算出样本大小为15可使我们可靠地检测处理与未处理之间的效应大小差异为1logcfu。1小时后,将小鼠随机分组并且分为5组(15只小鼠/组),a组和b组经腹膜内或经尿道分别接受10mg/kgcolpeptin。c组经尿道接受p2pro2肽(脯氨酸取代物)。d组接受口服氨苄西林作为阳性对照,并且d组接受载体(生理水)。接种后立即取下导管。感染后24小时,处死小鼠,并且用pbs洗涤肾、膀胱、输尿管、结肠,并且匀化。系列稀释匀化的组织,并且在血琼脂平板上培养。将板在37℃保持过夜。通过cfu值测量细菌的比率。致盲:通过l.k.进行动物样品制备和处理,并且l.k.也进行了cfu测定,但是在处理与读出之间,动物被p.c.随机改组,并且直到所有结果都输入后,才显示分组的关键。
23.大肠杆菌mg1655dnak-mcer3的构建
为了构建大肠杆菌mg1655dnak-mcer3,首先通过使用ecori和bamhi限制位点将mcer3扩增子(使用引物5’-agaattcggcagcggcagcggcagcgtgagcaagggcgagga-3’(fw)(seqidno:229)和5’-aggatccttacttgtacagctcgtcca-3’(rev)(seqidno:230)生成)整合入pgbkdparspmt15构建质粒pgbkd-mcer3。除添加不同限制位点至扩增子末端外,这些引物对还添加了柔性接头(编码gsgsgs6),从而有利于用这些序列构建的荧光融合蛋白折叠。随后使用引物对
5’-agatgacgatgttgtcgacgctgaatttgaagaagtcaaagacaaaaaaggcagcggcagcggca-3’(fw)(seqidno:231)
和
5’-aggaaattccccttcgcccgtgtcagtataattacccgtttatagggcgagtgtaggctggagctgcttc-3’(rev)(seqidno:232)由质粒pgbkd-mcer3对mcer3-frt-cat-frt弹夹进行pcr扩增。
随后将扩增子插入mg1655,生成c-末端dnak-mcer3融合体。随后通过用质粒pcp207短暂装配该菌株翻转cat弹夹,产生期望的mg1655dnak-mcer3菌株。
24.从sds凝胶的蛋白质纯化用于ms分析
将纯化的包涵体上至sds凝胶(4-15%
25.统计
除非另有说明,否则使用prism进行统计计算。
对于感染模型(图2f-i)的anova分析,使用bartlett检验测试了各组具有相似标准偏差的假设,除了输尿管数据,我们将其忽略,标准偏差之间没有显著性差异,因为这是由于未处理组的标准偏差降低所致。
表1-通过hplc-级纯化的选择的肽对大肠杆菌o157的mic和mbc值
表2-colpeptin1对抗多种细菌菌株的活性特性和hcab蛋白和靶标apr的序列保守
表3:colpeptin1对伴侣分子缺失菌株的最低抑制浓度
表4-肽设计和筛选
1大肠杆菌o157:h7蛋白质组中的匹配序列的数量,允许1次突变。
2使用camp软件8的抗细菌活性预测
表5-25ug/ml下活性肽对抗大肠杆菌o157
表6-18天连续注射后用30mg/kgcolpeptin1处理的小鼠的器官重量
表7-18天连续注射后用colpeptin1处理的小鼠的血液学值(平均值+sd)
wbc,白血细胞或白细胞计数。neu,嗜中性粒细胞绝对计数%n-嗜中性粒细胞百分比。lym,淋巴细胞绝对计数%l-淋巴细胞百分比。mono,单核细胞绝对计数%m-单核细胞百分比。eos,嗜酸性粒细胞绝对计数%e-嗜酸性粒细胞百分比。baso,嗜碱性粒细胞绝对计数%b-嗜碱性粒细胞百分比。rbc,红血细胞或红细胞计数。hgb,血红蛋白浓度。hct,血细胞比容。mcv,平均血细胞体积。mch,红细胞平均血红蛋白含量。mchc,红细胞平均血红蛋白浓度。plt,血小板或血小板计数。mpv,血小板平均体积。pdw,血小板分布宽度。pct,血小板压积。
表8-来自大肠杆菌蛋白质组的与colpeptin1的apr具有相似(相同或1个错配(85.71%同一性))序列片段的蛋白质
参考文献
1balch,w.e.,morimoto,r.i.,dillin,a.&kelly,j.w.adaptingproteostasisfordiseaseintervention.science319,916-919,doi:319/5865/916[pii]10.1126/science.1141448(2008).
2ellis,r.j.macromolecularcrowding:obviousbutunderappreciated.trendsbiochemsci26,597-604.(2001).
3young,j.c.,agashe,v.r.,siegers,k.&hartl,f.u.pathwaysofchaperone-mediatedproteinfoldinginthecytosol.natrevmolcellbiol5,781-791,doi:10.1038/nrm1492(2004).
4mogk,a.,huber,d.&bukau,b.integratingproteinhomeostasisstrategiesinprokaryotes.coldspringharborperspectivesinbiology3,doi:10.1101/cshperspect.a004366(2011).
5dobson,c.m.proteinfoldingandmisfolding.nature426,884-890(2003).
6krebs,m.r.,morozova-roche,l.a.,daniel,k.,robinson,c.v.&dobson,c.m.observationofsequencespecificityintheseedingofproteinamyloidfibrils.proteinsci13,1933-1938,doi:10.1110/ps.0470700413/7/1933[pii](2004).
7o′nuallain,b.,williams,a.d.,westermark,p.&wetzel,r.seedingspecificityinamyloidgrowthinducedbyheterologousfibrils.jbiolchem279,17490-17499(2004).
8ganesan,a.etal.selectivityofaggregation-determininginteractions.jmolbiol427,236-247,doi:10.1016/j.jmb.2014.09.027(2015).
9debaets,g.,schymkowitz,j.&rousseau,f.predictingaggregation-pronesequencesinproteins.essaysbiochem56,41-52,doi:10.1042/bse0560041(2014).
10ganesan,a.etal.structuralhotspotsforthesolubilityofglobularproteins.naturecommunications7,10816,doi:10.1038/ncomms10816(2016).
11willmund,f.etal.thecotranslationalfunctionofribosome-associatedhsp70ineukaryoticproteinhomeostasis.cell152,196-209,doi:10.1016/j.cell.2012.12.001(2013).
12linding,r.,schymkowitz,j.,rousseau,f.,diella,f.&serrano,l.acomparativestudyoftherelationshipbetweenproteinstructureandbeta-aggregationinglobularandintrinsicallydisorderedproteins.jmolbiol342,345-353,doi:10.1016/j.jmb.2004.06.088(2004).
13tompa,p.intrinsicallyunstructuredproteins.trendsbiochemsci27,527-533(2002).
14rousseau,f.,serrano,l.&schymkowitz,j.w.howevolutionarypressureagainstproteinaggregationshapedchaperonespecificity.jmolbiol355,1037-1047,doi:10.1016/j.jmb.2005.11.035(2006).
15bednarska,n.g.,schymkowitz,j.,rousseau,f.&vaneldere,j.proteinaggregationinbacteria:thethinboundarybetweenfunctionalityandtoxicity.microbioi-sgm159,1795-1806,doi:10.1099/mic.0.069575-0(2013).
16seefeldt,a.c.etal.theproline-richantimicrobialpeptideonc112inhibitstranslationbyblockinganddestabilizingtheinitiationcomplex.natstructmolbiol22,470-475,doi:10.1038/nsmb.3034(2015).
17last,n.b.,schlamadinger,d.e.&miranker,a.d.acommonlandscapeformembrane-activepeptides.proteinsci22,870-882,doi:10.1002/pro.2274(2013).
18last,n.b.&miranker,a.d.commonmechanismunitesmembraneporationbyamyloidandantimicrobialpeptides.procnatlacadsciusa110,6382-6387,doi:10.1073/pnas.1219059110(2013).
19bednarska,n.g.etal.proteinaggregationasanantibioticdesignstrategy.molmicrobiol,doi:10.1111/mmi.13269(2015).
20hayashi,t.etal.completegenomesequenceofenterohemorrhagicescherichiacolio157:h7andgenomiccomparisonwithalaboratorystraink-12.dnares8,11-22(2001).
21betti,c.etal.sequence-specificproteinaggregationgeneratesdefinedproteinknockdownsinplants.plantphysiology171,773-787,doi:10.1104/pp.16.00335(2016).
22debaets,g.,vandurme,j.,rousseau,f.&schymkowitz,j.agenome-widesequence-structureanalysissuggestsaggregationgatekeepersconstituteanevolutionaryconstrainedfunctionalclass.jmolbiol426,2405-2412,doi:10.1016/j.jmb.2014.04.007(2014).
23beerten,j.etal.aggregationgatekeepersmodulateproteinhomeostasisofaggregatingsequencesandaffectbacterialfitness.proteinengdessel25,357-366,doi:10.1093/protein/gzs031(2012).
24rousseau,f.,serrano,l.&schymkowitz,j.w.h.howevolutionarypressureagainstproteinaggregationshapedchaperonespecificity.journalofmolecularbiology355,1037-1047,doi:10.1016/j.jmb.2005.11.035(2006).
25hancock,r.e.&chapple,d.s.peptideantibiotics.antimicrobialagentsandchemotherapy43,1317-1323(1999).
26waghu,f.h.etal.camp:collectionofsequencesandstructuresofantimicrobialpeptides.nucleicacidsres42,d1154-1158,doi:10.1093/nar/gkt1157(2014).
27rokney,a.etal.e.colitransportsaggregatedproteinstothepolesbyaspecificandenergy-dependentprocess.jmolbiol392,589-601,doi:10.1016/j.jmb.2009.07.009(2009).
28young,l.m.etal.screeningandclassifyingsmall-moleculeinhibitorsofamyloidformationusingionmobilityspectrometry-massspectrometry.natchem7,73-81,doi:10.1038/nchem.2129(2015).
29klingstedt,t.etal.synthesisofalibraryofoligothiophenesandtheirutilizationasfluorescentligandsforspectralassignmentofproteinaggregates.organic&biomolecularchemistry9,8356-8370,doi:10.1039/c1ob05637a(2011).
30hammarstrom,p.etal.afluorescentpentamericthiophenederivativedetectsinvitro-formedprefibrillarproteinaggregates.biochemistry49,6838-6845,doi:10.1021/bi100922r(2010).
31aslund,a.etal.novelpentamericthiophenederivativesforinvitroandinvivoopticalimagingofaplethoraofproteinaggregatesincerebralamyloidoses.acschemicalbiology4,673-684,doi:10.1021/cb900112v(2009).
32cremers,c.m.etal.polyphosphate:aconservedmodifierofamyloidogenicprocesses.molcell63,768-780,doi:10.1016/j.molcel.2016.07.016(2016).
33wang,m.etal.paxdb,adatabaseofproteinabundanceaveragesacrossallthreedomainsoflife.molcellproteomics11,492-500,doi:10.1074/mcp.o111.014704(2012).
34niwa,t.etal.bimodalproteinsolubilitydistributionrevealedbyanaggregationanalysisoftheentireensembleofescherichiacoliproteins.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica106,4201-4206,doi:10.1073/pnas.0811922106(2009).
35dana,a.&tuller,t.meanofthetypicaldecodingrates:anewtranslationefficiencyindexbasedontheanalysisofribosomeprofilingdata.g3(bethesda)5,73-80,doi:10.1534/g3.114.015099(2014).
36huangda,w.,sherman,b.t.&lempicki,r.a.systematicandintegrativeanalysisoflargegenelistsusingdavidbioinformaticsresources.natprotoc4,44-57,doi:10.1038/nprot.2008.211(2009).
37baba,t.etal.constructionofescherichiacolik-12in-frame,single-geneknockoutmutants:thekeiocollection.molsystbiol2,20060008,doi:10.1038/msb4100050(2006).
38xu,j.etal.gainoffunctionofmutantp53bycoaggregationwithmultipletumorsuppressors.natchembiol7,285-295,doi:10.1038/nchembio.546(2011).
39calloni,g.etal.dnakfunctionsasacentralhubinthee.colichaperonenetwork.cellreports1,251-264,doi:10.1016/j.celrep.2011.12.007(2012).
40chapman,e.etal.globalaggregationofnewlytranslatedproteinsinanescherichiacolistraindeficientofthechaperoningroel.procnatlacadsciusa103,15800-15805,doi:10.1073/pnas.0607534103(2006).
41fujiwara,k.,ishihama,y.,nakahigashi,k.,soga,t.&taguchi,h.asystematicsurveyofinvivoobligatechaperonin-dependentsubstrates.emboj29,1552-1564,doi:10.1038/emboj.2010.52(2010).
42houry,w.a.,frishman,d.,eckerskorn,c.,lottspeich,f.&hartl,f.u.identificationofinvivosubstratesofthechaperoningroel.nature402,147-154(1999).
43kerner,m.j.etal.proteome-wideanalysisofchaperonin-dependentproteinfoldinginescherichiacoli.cell122,209-220,doi:10.1016/j.cell.2005.05.028(2005).
44niwa,t.,kanamori,t.,ueda,t.&taguchi,h.globalanalysisofchaperoneeffectsusingareconstitutedcell-freetranslationsystem.procnatlacadsciusa109,8937-8942,doi:10.1073/pnas.1201380109(2012).
45mogk,a.etal.identificationofthermolabileescherichiacoliproteins:preventionandreversionofaggregationbydnakandclpb.emboj18,6934-6949(1999).
46deuerling,e.etal.triggerfactoranddnakpossessoverlappingsubstratepoolsandbindingspecificities.molmicrobiol47,1317-1328(2003).
47gallardo,r.etal.denovodesignofabiologicallyactiveamyloid.science354,doi:10.1126/science.aah4949(2016).
- 还没有人留言评论。精彩留言会获得点赞!