新型γδT细胞受体和其配体的制作方法
本公开涉及一种新的t细胞受体(tcr),特别是其至少一个互补决定区(cdr);表达所述tcr的t细胞;表达所述tcr的克隆;编码所述tcr的载体;所述tcr的可溶性形式;包含所述tcr、所述细胞、所述克隆或所述载体的药物组合物或免疫原性剂或双特异性或疫苗;所述tcr或所述细胞或所述克隆或所述载体或所述药物组合物或免疫原性剂或双特异性或疫苗用于治疗癌症的用途;一种使用所述tcr、所述细胞、所述克隆、所述载体、包含所述tcr的所述药物组合物、免疫原性剂、双特异性或疫苗治疗癌症的方法;以及所述tcr与之结合的配体。
背景
我们发现了一种有效治疗癌症的新类型的γδt细胞,它要求靶细胞表达完整的scnn1a基因以进行识别。该t细胞不遵循需要特定人类白细胞抗原(hla)以识别靶标的惯例,因此被称为“非常规”。hla基因座高度可变,目前已描述了17,000多个不同的等位基因。因此,任何经由hla起作用的治疗方法都仅对少数患者有效。相比之下,全部人类群体都表达scnn1a,经由我们的γδtcr和其相应的下文中称为sw.3g1的新t细胞克隆识别癌细胞所需的基因。该克隆是在筛选可识别用epstein-barr病毒(ebv)(也称为人疱疹病毒4(hhv-4))感染健康的b细胞而创建的类淋巴母细胞系(lcl)的γδt细胞的过程中发现的。有利地,sw.3g1γδt细胞克隆对健康的b细胞或其他健康的细胞系无反应。
进一步的研究表明,sw.3g1γδt细胞克隆可以识别大多数,即便不是全部,癌细胞。这种识别需要scnn1a基因,并且scnn1a基因因此是sw.3g1tcr的结合配体。
正如人们所知,并如图2所示,tcr是二硫键连接的膜锚定的异二聚体蛋白,通常由高度可变的γ链和δ链组成,这些γ和δ链与不变的cd3链分子结合形成完整的功能性tcr。表达此受体的t细胞称为γ:δ(或γδ)t细胞。
γ链和δ链由包含恒定(c)区和可变(v)区的胞外结构域组成。恒定区接近细胞膜,其后是跨膜区和短的细胞质尾部,而可变区与配体结合。大多数γδt细胞的配体仍然未知。
tcr的γ-链和δ-链的可变域各自具有三个称为互补决定区(cdr)的可变区域。通常,抗原结合位点是由tcr的γ-链和δ-链的cdr环形成的。cdr1γ和cdr2γ由独立vγ基因编码,而cdr1δ和cdr2δ由独立vδ基因编码。tcrγ链的cdr3是高变的,这是由于在v区和连接区的连接部分周围可能添加和移除核苷酸。tcrδ链cdr3具有更大的变异能力,因为在vdj重组发生后,它还可以包含多样性(d)基因。
2015年,约有9050万人患有癌症。每年大约发生1,410万新病例(不包括黑色素瘤以外的皮肤癌)。它导致约880万人死亡(15.7%)。男性中最常见的癌症类型是肺癌,前列腺癌,结直肠癌和胃癌。女性中,最常见的癌症类型是乳腺癌,结直肠癌,肺癌和宫颈癌。如果将黑色素瘤以外的皮肤癌包括在每年总新发癌症中,则其约占病例数的40%。在儿童中,急性淋巴母细胞性白血病和脑肿瘤是最常见的,除了在非洲,那里更常出现非霍奇金淋巴瘤。2012年,约有165,000名15岁以下的儿童被诊断出患有癌症。癌症的风险随着年龄的增长而显著增加,并且许多癌症在发达国家更常见。随着越来越多的人活到老年,以及随着发展中国家生活方式的改变,比率正在增加。截至2010年,癌症的财务成本估计为每年1.16万亿美元。因此存在提供更好和更安全的方式以治疗或根除该疾病的需要。使用身体天然防御系统杀死异常组织的免疫疗法被公认为比化学干预更为安全,但要有效,免疫疗法必须是癌症特异性的。而且,发现一种对任何类型的癌症都有效的免疫疗法将是极其有益的,因为它不仅可以施用于患有多种不同类型癌症的个体(即可以在广泛人群应用),而且还可以施用于患有多于一种类型的癌症的单个患者。另外,鉴定非mhc限制的免疫疗法也将是非常有利的,因为这意味着可以将其施用于任何个体,无需顾及mhc组织类型。
我们在本文中鉴定出的t细胞具有前述有利特性,因为它们对任何类型的癌症均有效,并且不受mhc限制,并且由于识别所需的scnn1a基因产物是普遍表达的而具有广泛人群的应用。
发明描述
根据本发明的第一方面,提供了一种肿瘤特异性t细胞受体(tcr)或其片段,其特征在于至少一个互补决定区(cdr)包含catwdrrdykklf(seqidno:1)和/或calgvlptvtggglif(seqidno:2)或由其组成。
在本发明的一个优选实施方案中,所述cdr包含(cdr)catwdrrdykklf(seqidno:1)和/或calgvlptvtggglif(seqidno:2),或与之具有至少88%、例如89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的cdr、或由其组成。
本文所描述的cdr代表所述tcr的cdr3,因此是负责识别加工的抗原或配体的主要cdr。其他cdr(cdr1γ,cdr2γ,cdr1δ和cdr2δ)由种系编码。因此,本发明还涉及一种tcr,其还包括与所述一个或多个cdr3序列组合的这些其他cdr即cdr1γ、cdr2γ、cdr1δ和/或cdr2δ中的一个或多个。
因此,在一个优选的实施方案中,所述tcr包含以下互补决定区的一个或多个(包括任何组合),或由其组成:
vtntfy(cdr1γ)seqidno:3
ydvstard(cdr2γ)seqidno:4
tswwsyy(cdr1δ)seqidno:5
qgs(cdr2δ)seqidno:6。
在本文中所提及的肿瘤特异性tcr是在scnn1a基因表达的背景下特异性识别肿瘤细胞或肿瘤细胞配体的tcr,并且由其激活,但是不被非肿瘤细胞或非肿瘤细胞配体激活。
在本发明的一个优选的实施方案中,所述tcr是具有一条γ链和一条δ链的γδtcr,并且所述γ链的所述cdr包含以下cdr或由其组成:catwdrrdykklf(seqidno:1)或与之具有至少88%,例如89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的cdr;所述δ链的所述cdr包含以下cdr或由其组成:calgvlptvtggglif(seqidno:2)或与之具有至少88%,例如89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的cdr。因此,所述tcr可包含前述cdr中的一个或两个,并且在优选的实施方案中,包含两个所述cdr。
在本发明的另一个优选实施方案中,所述tcr的所述cdr另外或可选地包含为calwevdykklf(seqidno:9)的γ链序列和/或为calgepvlfavrglif(seqidno:10)和/或cacdllgdrytdklif(seqidno:11)的δ链序列,或与之具有至少88%,例如89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的cdr,或由其组成。
在仍然另一个优选的实施方案中,所述tcr是非常规的,因为它不是mhc限制的,而是在scnn1a基因表达的背景下结合肿瘤特异性配体。这些t细胞及它们的tcr是非mhc限制的事实意味着它们具有广泛群体治疗的潜力,并因此代表了极其重要的新癌症疗法。
在本发明的另一个优选实施方案中,所述tcrγ链包含:
或与之具有至少88%,例如89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列,或由其组成。
在本发明的另一个优选实施方案中,所述tcrδ链包含
或与之具有至少88%,例如89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列,或由其组成。
(在以上各段中,粗体和带下划线的文本表示cdr,即1、2和3的顺序)。
在本发明的仍然又一个优选实施方案中,所述tcr包含之前所述tcrγ链和之前所述tcrδ链。
在仍然又一个优选的实施方案中,所述tcr是可溶性tcr或stcr,并因此缺少跨膜结构域,以及理想地还缺乏细胞内结构域。
在本发明的仍然另一个优选实施方案中,所述tcr是具有本文所描述功能的嵌合受体的一部分。理想地,所述tcr融合至αβ至αβ恒定结构域。
在替代方案中,提供了所述tcr的片段,例如其单体部分,理想地为tcr的单链形式。
根据本发明的另一方面提供了一种t细胞,其表达本发明的所述的tcr,理想地以可溶的或膜相容的形式(即具有跨膜区和细胞内区)。
根据本发明的仍然另一方面提供了t细胞克隆,其表达本发明的所述的tcr,理想地以可溶性或膜相容形式(即具有跨膜区和细胞内区)。优选地,所述克隆是本文所描述的sw.3g1克隆。
根据本发明的仍然另一方面,提供了编码本发明所述的tcr的载体。
根据本发明的仍然另一方面,提供了包含本发明所述tcr或细胞或克隆或载体的药物组合物或免疫原性剂或双特异性或疫苗。
在一个优选的实施方案中,所述药物组合物或免疫原性剂或双特异性或疫苗用于治疗任意癌症,理想地是结直肠癌、肺、肾、前列腺、膀胱、宫颈、黑色素瘤(皮肤)、骨、乳腺、血液癌症、脑、胰腺、睾丸、卵巢、头/颈、肝、膀胱、甲状腺和子宫。
根据本发明的仍然另一方面,提供了本文所描述的tcr或细胞或克隆或载体,用于癌症治疗。
根据本发明的仍然另一方面,提供了一种治疗癌症的方法,包括向待治疗的个体施用所述tcr或细胞或克隆或载体。
理想地,所述癌症是任何类型,但特别是结直肠癌、肺、肾、前列腺、膀胱、宫颈、黑色素瘤(皮肤)、骨、乳腺、血液癌、脑、胰腺、睾丸、卵巢、头/颈、肝、膀胱、甲状腺和子宫。
在本发明的优选方法中,所述tcr、细胞、克隆或载体与抗肿瘤剂,例如但不限于双特异性,组合施用。
本文中提及的双特异性是指双特异性单克隆抗体(bsmab、bsab),其是可以同时结合两种不同类型抗原的人工蛋白质。
仍然可选地,所述tcr可以形成双特异性的一部分,其中所述双特异性包括所述tcr,用以结合其在癌细胞上的配体,并包括免疫细胞活化组分或配体,其结合并因而活化免疫细胞,例如杀伤t细胞。
根据本发明的仍然另一方面,提供了所述tcr或细胞或克隆或载体在制备用于治疗癌症的药物中的用途。
根据本发明的仍然另一方面,提供了一种用于治疗癌症的组合治疗剂,其包含:
a)所述tcr或细胞或克隆或载体或免疫原性剂或双特异性或疫苗,联合
b)其他癌症治疗剂。
根据本发明的仍然另一方面,提供了一种tcr或多肽或双特异性或抗体,或所述抗体的片段,其与图9所示的scnna1基因产物同种型中的至少一种结合,且特别是其胞外结构域。
在本发明的优选实施方案中,所述多肽,抗体或片段抑制所述scnna1基因产物的活性,并且是在所述抗体最理想地是单克隆抗体的情况下。
在以下权利要求中和以上本发明的描述中,除非由于表述或必要含义而另外说明,词语“包含(comprise)上或变化形式例如“comprises”或“comprising”用于表示包括性意义,即表明存在所述特征,但是不排除存在或增加本发明的各种实施方案中的其它特征。
将本说明书中引述的所有的参考文献包括任何专利或专利申请引入本文作为参考。不认可任何参考文献构成现有技术。此外,不认可任何现有技术构成了本领域常用的一般知识的一部分。
本发明每个方面的优选特征可以如所描述的与任何其他方面结合。
本发明的其他特征将从以下实施例变得显而易见。一般而言,本发明扩展到本说明书(包括所附权利要求和附图)中公开的任何新颖的特征或任何新颖的特征组合。因此,除非互不相容,在本发明的特定方面、实施方案或实施例中联合描述的特征、整体、特性、化合物或化学部分应理解为适用于本文所述的任何其他方面、实施方案或实施例。
此外,除非另有说明,否则本文公开的任何特征可以由具有相同或相似目的的替代特征所取代。
在整个本说明书的描述和权利要求中,除非上下文另有要求,单数形式包括复数。特别的是,除非上下文另有要求,在使用不定冠词的情况中,则应理解为考虑复数以及单数两种形式。
现在将仅以举例的方式参考下文来描述本发明的实施方案,其中:
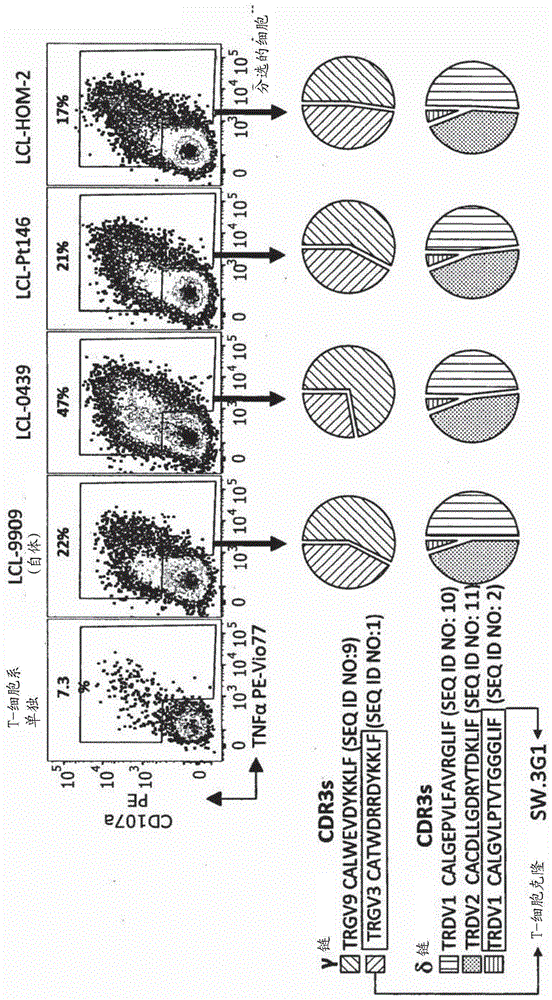
图1显示了如何对与自体和非自体淋巴母细胞样细胞(lcl)反应的γδt细胞系进行克隆分型并发现其表达由分别具有cdr3scatwdrrdykklf(seqidno:1)和calgvlptvtggglif(seqidno:2)的trgv3和trdv1基因组成的tcr。通过有限稀释培养出表达该tcr的克隆,并命名为sw.3g1。(a)用来自三位供体(0439,pt146和hom-2)的lcl集合对来自健康供体9909的纯化γδt细胞进行引发(prime)(第0天)并再次刺激(第14天)。在第28天,将t细胞系与用于引发的lcl以及自体lcl-9909一起孵育4小时,并通过加入tapi-0、抗cd107a和抗tnf0抗体评估活化。通过流式细胞仪对活化的细胞进行分选,并通过下一代测序分析t细胞受体(tcr)。饼状图描述了存在于分选的细胞中被展示的tcr链和cdr3(互补决定区)的比例。流式细胞仪图的活化细胞百分比标示于每个门上方。从表达被突出强调的tcr链的细胞系中获得的t细胞克隆sw.3g1,其完整的tcr序列如图2所示。(b)用抗体对克隆sw.3g1进行表型鉴定,并证实其表达tcrδ1链。sw.3g1不表达与识别常规肽-hla抗原相关的αβ相关的或cd8或cd4糖蛋白。
图2显示了克隆sw.3g1的γ和δtcr链的t细胞受体序列。mrna结构(顶部)表明,对于每条链,cdr1和cdr2均在种系中编码。cdr3是t细胞受体(tcr)-γ链的v–j连接处和tcr-δ链的v–d–j连接处连接区多样性的产物。因此,cdr3是高变的。cdr环采用的颜色代码在全图中都保持。灰色区域代表tcr的恒定和可变结构域(不包括高变cdr环)。右侧的板块显示了预期的蛋白折叠。tcr采用相似的三级结构,将互补决定区(cdr)环定位在分子的膜远端。六个cdr环一起形成抗原结合位点。
图3显示sw.3g1可以识别并杀伤自体和非自体lcl,而非各种组织来源的健康细胞。(a)sw.3g1与lcl共同孵育4小时,并通过引入tapi-0,抗cd107a和抗tnf0抗体评估其活化。(b)使用与(a)中相同的lcl进行6.5h铬释放细胞毒测定。(c)从供体9909直接离体磁性纯化的自体健康b细胞用于如同a的活化测定中,用lcl-9909作为活化的阳性对照。(d)使用lcl-9909和健康细胞系cil-1(无色素的睫状上皮)和hep2(肝细胞)进行如同a的活化测定。显示了门内细胞的百分比。
图4显示了来自多个没有共同hla的供体的lcl和来自不同组织的一批癌细胞系的由sw.3g1介导的裂解。sw.3g1用于6.5h铬释放细胞毒测定。(a)来自24个供体(名称在x轴上)的一组淋巴母细胞系(lcl)。lcl中的红色条形用于从供体9909产生t细胞系,从后者中克隆了sw.3g1。t细胞与lcl的比例为1:1。(b)sw.3g1介导杀伤一组不同组织起源(图例)的癌细胞系(名称在x轴上),t细胞与癌细胞的比例在10:1。
图5显示sw.3g1不通过已知机制识别靶细胞。(a)将γδsw.3g1克隆与hmb-pp,淋巴母细胞系(lcl)-9909和植物血凝素(pha)共孵育4小时。t细胞还单独孵育。通过引入tapi-0、抗cd107a和抗tnf0抗体来评估t细胞活化,活化细胞的百分比标示在门内细胞上方。(b)使用与(a)中相同的活化测定法,将sw.3g1与已经用抗体(ab)预先标记的lcl孵育,抗体结合的蛋白质名称在x轴上。sw.3g1也与无ab的lcl孵育(无抗体对照)。反应性百分比以图形方式显示(y轴)。mica/b(主要组织相容性复合物(mhc)i类相关链a/b)和epcr(内皮蛋白c受体)。抗mhci类和ii类抗体也包括在内。
图6显示了用于鉴定参与sw.3g1识别靶细胞的候选基因/蛋白质的全基因组crispr/cas9方法。
图7显示了全基因组crispr/cas9方法的结果,该方法鉴定了用于sw.3g1识别靶细胞多个候选基因。(a)用全基因组crispr/cas9文库转导自体lcl-9909和癌细胞系kbm7。使用sw.3g1t细胞克隆对文库进行数次选择,以产生抵抗裂解的靶细胞系。在sw.3g1活化测定中,一起测试了存活的靶细胞(选择后)和选择前的细胞系。通过加入tapi-0、抗cd107a和抗tnf0抗体进行活化评估。(b)选择后文库的测序揭示出了对应于(c)中所示基因的丰富的指导rna。(c)在lcl-9909和kbm7文库中均可见,或仅在lcl-9909或kbm7中可见的候选基因。给出了基因和(蛋白质)名称和网站链接以获取更多信息。
图8显示了关于通过全基因组crispr/cas9文库方法鉴定得到的候选基因/蛋白质scnn1a的信息。
图9显示了scnn1a的标准蛋白质序列,与5个表达的剪接变体比对。同种型1是标准序列(isoform1uniprotp37088-1)。黑色突出显示的氨基酸:用于生成本研究中使用的多克隆抗体的区域。红色:由于与所示氨基酸残基不同而导致蛋白质变体的位点。蛋白质变体的氨基酸残基在此处未显示,但可以在http://www.uniprot.org/uniprot/p37088上找到。蓝色:剪接同种型之间的氨基酸差异。
图10显示了验证scnn1a在sw.3g1对靶细胞的识别中的作用的实验结果。(a)scnn1a基因和蛋白质的示意图,以及来自全基因组gecko文库的指导rna(grna)位点(编号1)和我们设计的不同验证性grnascnn1a序列(编号2)。该图改编自chen2014。(b)使用sw.3g1与野生型lcl.174,geckogrna-1和grna-2敲除的lcl.174细胞的长期杀伤试验。(c)已经接受了scnn1a的grna-2的乳腺癌细胞系mda-mb-231的蛋白质印迹分析。野生型细胞用于对比,红色箭头指示76kdascnn1a蛋白。(d)来自(c)的mda-mb-231细胞和和黑色素瘤mm909.24,野生型和scnn1a敲除(ko)细胞系,与sw.3g1用在长期杀伤试验中。将癌细胞用作细胞系并通过嘌呤霉素处理选择表达grna的细胞,无需随后的细胞克隆。
图11显示来自sw.3g1的tcr的转移赋予针对来自三个健康供体的αβt细胞的靶细胞的反应性。(a)用sw.3g1t细胞受体链(经由大鼠(r)cd2的标志物并纯化)和grna共转导到来自三个供体的纯化cd8+t细胞,使得受体t细胞tcr使链阴性(通过嘌呤霉素处理进行选择)(legut等人2017)。用rcd2抗体(ab)和抗γδtcr抗体检查细胞的纯度。(b)来自一位供体的细胞在长期杀伤试验中进行了测试(下方图)。使用lcl.174细胞系:野生型,scnn1a敲除(使用grna-1和-2)和scnn1a敲入(已接受密码子优化的scnn1a转基因的ko细胞)细胞。
发明详述
材料与方法
t细胞系的产生和克隆分型
通过标准密度梯度分离从健康供体(代码9909)的血液中纯化外周血单核细胞(pbmc)。外周血中γδt细胞的主要种群表达vγ9vδ2tcr,通常对源自细菌的抗原产生反应。为了富集γδtcr+/vδ2-t细胞,从而增加发现具有癌症反应性t细胞的可能性,我们修改了基于磁性的纯化方案。第一种改进方法是用pe缀合的抗vδ2抗体(ab)(克隆b6,biolegend,sandiego,ca)对pbmc进行染色。接下来,根据制造商的说明(miltheyibiotec,bergishgladbach,germany),通过积极去除γδtcr-细胞来被动地富集γδtcr+t细胞。第二种改进方法涉及将抗pe微珠(miltneyibiotec)添加到γδtcr纯化试剂盒的珠子中,从而同时去除δ2+细胞和γδtcr-细胞。将纯化的细胞与来自三个供体的经辐射(3000-3100rad)的lcl共同孵育,这些lcl从pbmc中,通过用epstein-barr病毒(ebv)将b细胞永生化而产生。所有lcl作为悬浮细胞在r10培养基(rpmi-1640、10%热灭活的胎牛血清,2mml-谷氨酰胺,100u/ml青霉素和100μg/ml链霉素,均为lifetechnologies,carlsbad,ca)中生长。14天后,用来自相同供体的经辐射的lcl再次刺激t细胞。在第28天,收获t细胞并用于活化测定中以评估对lcl的反应性。将t细胞(30,000)在带有等量lcl的96u孔板中孵育4小时。将30mm的tnfα加工抑制剂-0(来自sigmaaldrich的tapi-0)(haney等人,2011),抗cd107aab(h4a2,bectondickinson(bd),franklinlakes,nj)和抗tnfαab(ca2,miltenyibiotec)在测定开始时被添加到测定培养基中,随后将细胞用细胞活力染料vivid(lifetechnologies,在pbs中以1:40稀释,然后在每次50μl的染色中2μl)和抗cd3抗体(ab)染色(bw264/56,miltenyibiotec)。活化的细胞在bdfacsaria上分选到rltplus缓冲液(补充有40mmdtt)(qiagen)中,准备进行tcr链测序。使用rneasymicro试剂盒(qiagen,hilden,germany)提取rna。根据制造商的说明,使用5'/3'smarter试剂盒(clontech,paris,france)合成cdna。smarter方法使用莫洛尼氏鼠白血病病毒(murinemoloneyleukaemiavirus,mmlv)逆转录酶,3'oligo-dt引物和5'寡核苷酸来生成cdna模板,其侧翼为已知的通用锚定序列。使用锚特异性正向引物和γ或δtcr链恒定区的反向引物进行pcr。最终的pcr产物经过凝胶纯化,并准备用于下一代测序(donia等,2017)。
克隆sw.3g1的获得和表型分型
通过限制稀释直接从t细胞系克隆t细胞(theaker等,2016)。培养4周后,将每个克隆按培养体积的50%收获,并如同上述,用于lcl的活化测定。在进行活化测定之前,洗涤t细胞克隆并在低血清培养基中孵育24小时。展现出对lcl的反应性的克隆生长到足以进行tcr测序(下文)的数量。克隆sw.3g1用抗体染色用于cd3(miltenyibiotec)、cd8(bw135/80,miltenyibiotec)、cd4(m-t466,miltenyibiotec)、αβtcr(bw242/412,miltenyibiotec)和tcrvδ1链(rea173,miltenyibiotec)的表面表达。
sw.3g1tcr的测序
如上所述,为对t细胞系进行测序,应用纯化的最终pcr后的pcr产物,其被克隆到zero-blunttopo中并转化到oneshotchemicallycompetent大肠杆菌(e.coli)细胞中,用于标准测序(均来自lifetechnologies)
sw.3g1识别lcl,而非健康细胞
为了确认sw.3g1对lcl的反应性,进行了上述活化测定和铬释放细胞毒测定。使用pe缀合的抗cd19抗体(hib19,miltenyibiotec)从供体9909中纯化健康b细胞,并用抗pe微珠(miltenyibiotec)进行阳性捕获,并立即用于测定中。其他健康细胞系及其专有培养基获取自sciencell(carlsbad,ca):cil-1(人非色素性睫状上皮细胞)和hep2(人肝细胞)用于如上所述的活化。
sw.3g1杀伤所有测试的永生的和癌细胞系
lcl和肿瘤细胞用铬51标记以进行细胞毒测定(ekeruche-makinde等,2012),其t细胞与靶细胞的比例为1:1(lcl)或10:1(癌细胞)。lcl的维持如上文所述。癌细胞系(
sw.3g1不通过已知机制识别靶细胞
将vγ9vδ2t细胞活化剂(e)-4-羟基-3-甲基-丁-2-烯基焦磷酸盐(hmb-pp)(sigmaaldrich)在dmso中重构并直接添加至测定孔中。以下单克隆抗体用于阻断测定:抗-hla、-b、-c(克隆w6/32,biolegend),抗-hla-dr、-dp、-dq(克隆tu39,bioloegend),抗-epcr(多克隆,r&dsystems),抗-mica/micb(克隆6d4,biolegend)和抗-cd1d(克隆51.1,miltenyibiotech)在10μg/ml的最终浓度下使用。
通过全基因组crispr基因捕获
使用了完整的基因组crispr/cas9文库方法(概述见图5)。使用geckov2子文库a和b(adgene质粒,#1000000048,由fengzhang博士友情提供(patel等人,2017))进行全基因组靶向的lcl-9909和kbm7s用于sw.3g1的选择。简而言之,将成功转导并经嘌呤霉素选择的靶细胞与sw.3g1以预定比例在96u孔板中共同孵育2-3周。用选择前和选择后的靶细胞进行活化测定(如上所述)以确认sw.3g1对所选择的细胞失去活性。用sw.3g1的两轮选择存活的靶细胞的基因组dna进行下一代测序,以揭示插入的指导rna和候选基因。
确认scnn1a在靶细胞识别中的作用
用氯化钙转染hek293t细胞产生慢病毒颗粒,并通过超速离心进行浓缩,然后再利用8μg/ml聚凝胺和离心转染转导靶细胞。将grna克隆到plenticrisprv2质粒(fengzhang博士友情提供,addgene质粒52961)中,其编码spcas9蛋白和嘌呤霉素抗性标记基因(pac,嘌呤霉素n-乙酰转移酶),并与包装和包膜质粒pmd2.g和pspax2(均来自addgene)共转染。将全长密码子优化的scnn1a转基因(同种型1,uniprotp37088-1)克隆到第三代慢病毒转移载体pelns中(jamesriley博士友情提供,universityofpennsylvania,pa)。pelns载体包含大鼠cd2(rcd2)基因,用于使用抗rcd2pe抗体(ox-34,biolegend)选择细胞。根据制造商的说明书,使用兔抗scnn1a多克隆抗体(pa1-902a,thermofisherscientific)用于流式细胞术(数据未出示)和western印迹分析,评估靶细胞中scnn1a的表达。
用sw.3g1tcr转导多克隆t细胞赋予靶细胞的识别
将由自切割的2a序列分隔的、密码子优化的、全长tcr链合成(genewiz)并克隆到第3代慢病毒转移载体pelns中(jamesriley博士友情提供,universityofpennsylvania,pa)。pelns载体包含大鼠cd2(rcd2)标记基因,其通过另一条自切割的2a序列与tcr分隔。另外,还用grna共转导了细胞,以通过靶向两个tcrβ恒定结构域消除在受体细胞中tcrβ链的表达(目前将要在blood出版的手稿)。慢病毒颗粒是用氯化钙转染hek293t细胞产生的。将tcr转移载体与包装和包膜质粒pmd2.g,prsv-rev和pmdlg/prre共转染。慢病毒颗粒通过超速离心进行浓缩,然后利用5μg/ml的聚凝胺转导cd8+t细胞,其中cd8+t-细胞是提前24小时从三个健康供体中通过磁力分离法(miltenyibiotec)纯化,并用cd3/cd28珠子(dynabeads,lifetechnologies)以珠子:t细胞比例为3:1活化过夜。通过与2μg/ml嘌呤霉素孵育选择摄取了病毒的t细胞(tcrβ链敲除),所述细胞用抗rcd2pe抗体(ox-34,biolegend)和随后的抗pe磁珠(miltenyibiotec)富集。转导后14天,用同种异体饲养细胞和pha扩增t细胞。tcr转导的细胞用于长期杀伤测定,其中将lcl.174靶以50,000细胞/孔的密度一式两份铺在96u孔板中。将sw.3g1添加至靶细胞中并孵育7天。靶细胞还在无t细胞情况下铺板作为100%存活对照。收获细胞,用pbs洗涤,并用vivid和抗cd3抗体染色(以排除t细胞)。作为内部对照,在收获/洗涤之前将countbrighttmabsolutecountingbeads(lifetechnologies)添加到每个孔中(约10,000个珠子/孔)。样品在facscantoii上获得,每个样品至少采集了1,000个珠子事件。根据以下公式计算靶细胞的存活率:
-----------------------------
结果
克隆特征化
1.用三种非自体淋巴母细胞样细胞系(-0439,-pt146和-hom-2)的集合对从健康的供体(9909)中纯化的γδ纯细胞进行引发和再次刺激。在第28天测试了对每种细胞系的反应性(图1)。t细胞系还识别自体lcl-9909(图1)。
2.基于对每种lcl的反应性,对来自上述系的t细胞进行流式细胞术分选,并通过下一代测序分析其tcr(图1)。对于γ链测序,存在两种独特的cdr3,具有可变链trgv9和trgv3。对于δ链,存在三种cdr3,具有可变链trdv1和trdv2。
3.从供体9909t细胞系产生的t细胞系表达γ3δ1tcr以及每条链的cdr3为catwdrrdykkl和calgvlptvtggglif(图1和图2)。所有生长的克隆都表达相同的tcr。此克隆被命名为sw.3g1。
sw.3g1的抗体染色证实了vδ1链的表达,并且是αβtcr-/cd8low/cd4-(图1b)。
4.使用tnfr和cd107a作为读数的活化测定证实了sw.3g1对自体lcl-9909和非自体lcl-0439的反应性(图3a)。对于i类mhc和ii类mhc等位基因,供体9909和0439为hla完全不匹配,因此sw.3g1以不依赖hla的方式识别靶细胞。sw.3g1也能够裂解lcl-9909和-0439,因此具有细胞毒性(图3b)。当ebv感染b细胞时,对lcl的识别取决于永生化过程,因为直接从9909离体纯化的自体健康b细胞不能作用为sw.3g1的靶标(图3c)。类似地,健康细胞cil-1(上皮细胞)和hep2(肝细胞)也未引起sw.3g1活化(图3d)。
5.sw.3g1能够裂解来自测试的所有24个供体的lcl(图3b为自体lcl,且图4a为23个非自体lcl),进一步证实sw.3g1以hla非依赖方式起作用。此外,lcl.174(图4a,左侧第4条)仅表达染色体6(即携带mhc基因座的人类染色体)的一个拷贝。细胞lcl.174中的染色体6含有大缺失并且不携带mhcii类基因和涉及mhci类抗原加工中的许多成分。
6.sw.3g1杀伤来自8种不同的组织的23种癌细胞系:皮肤/黑色素瘤、肾脏、结肠、乳腺、血液/白血病、肺、宫颈和骨骼。(图4b)。
7.sw.3g1对已知的γδt细胞抗原hmb-pp无反应(图5a),所述抗原导致vγ9vδ2tcrt细胞亚群识别被病原体感染的细胞,其方式类似于识别焦磷酸盐自身。该途径需要靶细胞表达嗜乳脂蛋白(butyrophillin)3a1。sw.3g1对lcl-9909(自体)、-0439和–pt146的反应性不受包含结合下列已知γδt细胞配体的阻断抗体的阻碍:主要组织相容性复合体(mhc)i类相关链a和b(mica/micb),epcr内皮蛋白c受体(epcr)和cd1d(图5b)。mhci类和ii类也未能阻断sw.3g1活化。尽管不是一个广泛的排除过程,但这些数据表明sw.3g1可能识别癌细胞表面未知的γδtcr配体。因此,采用了全基因组crispr/cas9文库方法来发现与sw.3g1识别靶细胞有关的候选基因/蛋白质(图6)。
8.使用全基因组crispr/cas9文库在自体lcl-9909和单倍体髓性白血病细胞系kbm7中创建基因敲除。两个文库都与sw.3g1共同孵育以进行连续多轮选择,以富集含有允许从sw.3g1介导的裂解逃避的grna的靶细胞(图7a)。sw.3g1反应性从选择前的lcl-9909的59%降至选择后的12%。对于kmb7,反应性从12%降至4.2%。选择后的lcl-9909和kbm7用于下一代测序,以鉴定被富集的grna。在lcl-9909和kbm7文库之间共有的总共7个基因中有4个被鉴定为关键基因(图7b和7c)。在两个文库中存在高度富集了特异性针对编码蛋白质钠离子通道上皮细胞1α亚基的基因scnn1a(在此处用于描述编码的蛋白质)的指导(图7b&c)。scnn1a基因和蛋白质别名显示在图8中。该蛋白质在细胞表面表达,因此是进一步探究的良好候选。scnn1a具有6个剪接变体同种型和各种自然发生的突变(图8和9)。
9.用来自全基因组文库的scnn1agrna(gecko,grna-1)或自行设计的其他指导(grna-2)(图10a)转导的lcl.174不再是sw.3g1的靶标,从而证实了scnn1a在靶细胞识别中的作用(图10b),敲除细胞系的裂解降至低于5%,相比之下野生型细胞100%杀伤。在两种癌细胞中创建了scnn1a基因敲除品系,它们部分或全部逃脱了sw.3g1的裂解(图10c)。值得注意的是,在整个研究中创建的scnn1a敲除细胞作为品系使用,并且在进行测定前未进行克隆化。这可能是某些“敲除”细胞系残留反应性的原因,因为由于从嘌呤霉素选择中逃脱和/或scnn1a基因的切除不成功,敲除系中一小部分细胞仍可能表达scnn1a。用于sw.3g1活化测定的scnn1a敲除mda-mb-231细胞的western印迹分析显示,与野生型细胞相比,敲除细胞系中scnn1a蛋白显著减少(图10c),从而证实了基因敲除。使用的抗体可以识别所有scnn1a同种型(图9)。我们还注意到,scnn1a敲除细胞在扩展培养(3周以上)时变得不那么活跃,并且在某些情况下,细胞分裂完全停止。该观察结果是scnn1agrna所独有的,因为转导了许多其他基因的grna的相同细胞系在细胞生长和活力方面没有表现出相同的变化。该结果表明scnn1a基因对于培养中的细胞的长期生长是必要的。
10.将sw.3g1tcr转入来自三个健康供体的多克隆cd8+t细胞中,赋予了对靶细胞lcl-pt146的反应性(图11a)。针对scnn1a敲除细胞,tcr转导的细胞显示出与针对sw.3g1克隆的如上文所描述的相同的功能模式(图11b)。为了支持scnn1a基因敲除数据,并进一步确认scnn1a在靶细胞识别中的作用,我们用scnn1a基因转导基因敲除细胞。在表达scnn1agrna的敲除细胞中引入天然scnn1a基因,会导致转基因的切除。因此,引入了密码子优化的基因,不同于天然基因的dna序列(同种型1uniprotp37088-1,图9),但表达相同的蛋白质。对grna-1或grna-2转导细胞的杀伤被消除,但可以通过在敲除细胞中表达scnn1a基因来恢复(图11b)。
结论
sw.3g1tcr使t细胞能够识别多种肿瘤。识别经由scnn1a基因产物发生。sw.3g1t细胞克隆识别癌细胞特异性scnn1a配体,无mhc限制性。
本发明聚焦于在t细胞克隆sw.3g1中鉴定的tcr。该tcr通过scnn1a的表达识别多种癌细胞。该tcr不识别非肿瘤细胞。从肿瘤系中crispr/cas9敲除scnn1a或抗体阻断,证实tcr需要scnn1a基因产物来识别肿瘤细胞。sw.3g1tcr可以用于多种不同的癌症免疫治疗策略。广泛的肿瘤识别和识别的人白细胞抗原(hla)非依赖性为使用该tcr针对广泛癌症,广泛群体免疫疗法开辟了令人兴奋的可能性。
参考文献
chen,j.,trkleyman和s.sheng.2014deletionofα-subunitexon11oftheepithelialna+channelrevealsaregulatorymodule.amjphysiol.renalphysiol306,f561-7.
donia,m.,kjeldsen,j.w.,andersen,r.,westergaard,m.c.w.,bianchi,v.,legut,m.,attaf,m.,szomolay,b.,ott,s.,dolton,g.,lyngaa,r.,hadrup,s.r.,sewell,a.k.,svane,i.m.,2017.pd-1+polyfunctionaltcellsdominatetheperipheryaftertumor-infiltratinglymphocytetherapyforcancer.clin.cancerres.clincanres.1692.2016.
ekeruche-makinde,j.,clement,m.,cole,d.k.,edwards,e.s.j.,ladell,k.,miles,j.j.,matthews,k.k.,fuller,a.,lloyd,k.a.,madura,f.,dolton,g.m.,pentier,j.,lissina,a.,gostick,e.,baxter,t.k.,baker,b.m.,rizkallah,p.j.,price,d.a.,wooldridge,l.,sewell,a.k.,2012.t-cellreceptor-optimizedpeptideskewingofthet-cellrepertoirecanenhanceantigentargeting.j.biol.chem.287,37269–81.
haney,d.,quigley,m.f.,asher,t.e.,ambrozak,d.r.,gostick,e.,price,d.a.,douek,d.c.,betts,m.r.,2011.isolationofviableantigen-specificcd8+tcellsbasedonmembrane-boundtumornecrosisfactor(tnf)-alphaexpression.j.immunol.methods369,33–41.
legut,m.,gdolton,a.a.mian,o.ottmannanda.k.sewell.2017crispr-mediatedtcrreplacementgeneratessuperioranticancertransgenict-cells.blood[epubaheadofprint]doi:https://doi.org/10.1182/blood-2017-05-787598
patel,s.j.,sanjana,n.e.,kishton,r.j.,eidizadeh,a.,vodnala,s.k.,cam,m.,gartner,j.j.,jia,l.,steinberg,s.m.,yamamoto,t.n.,merchant,a.s.,mehta,g.u.,chichura,a.,shalem,o.,tran,e.,eil,r.,sukumar,m.,guijarro,e.p.,day,c.-p.,robbins,p.,feldman,s.,merlino,g.,zhang,f.,restifo,n.p.,2017.identificationofessentialgenesforcancerimmunotherapy.nature548,537–542.
theaker,s.m.,rius,c.,greenshields-watson,a.,lloyd,a.,trimby,a.,fuller,a.,miles,j.j.,cole,d.k.,peakman,m.,sewell,a.k.,dolton,g.,2016.t-celllibrariesallowsimpleparallelgenerationofmultiplepeptide-specifichumant-cellclones.j.immunol.methods430,43–50.
- 还没有人留言评论。精彩留言会获得点赞!