用于治疗疾病的新化合物及其药物组合物的制作方法
本发明涉及化合物、制备本发明的化合物的方法、包含本发明的化合物的药物组合物、通过施用本发明的化合物预防和/或治疗以下疾病的用途和方法:炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病。特别地,本发明的化合物可抑制盐诱导型激酶(“sik”激酶)。
发明背景
蛋白激酶属于负责控制宽范围的细胞信号转导过程的结构相关酶的大家族。特别地,已经证明它们是细胞功能中的关键调节因子,所述功能包括例如增殖、代谢和细胞凋亡。因此,蛋白质磷酸化的缺陷控制(其导致信号传导失控)牵涉在多种疾病中,包括例如炎症、变态反应、癌症、自身免疫性疾病、cns病症、血管生成。
在健康个体中,炎症是自限性的,它的消退是通过称为“抑制性”或“调控性”的细胞所产生的抗炎性介质和细胞因子如白介素-10(il-10)(其作为负反馈环的一部分产生)的释放进行控制的,
的确,在身体的正常炎症过程中,初始促炎反应之后是促消退反应,所述促消退反应在发作已经消退后使炎症消失,导致促炎细胞因子如tnfα和il-12的减少以及抗炎细胞因子如il-10和tgf-β的水平增加,导致产生所谓的致耐受性环境。
单磷酸腺苷活化蛋白激酶(ampk)属于蛋白激酶家族,该家族包括盐诱导型激酶(sik),其为在体内广泛表达的丝氨酸/苏氨酸激酶家族,特别地牵涉在细胞能量内稳态中。已经识别了三种sik同工型,命名为sik1(亦称作snfi样激酶(snf1lk)或心肌snf1样激酶(msk))、sik2(snf1lk2或kiaa0781)和sik3(kiaa0999)(katoh等人,2004)。
sik在不同细胞类型中发挥多种作用,已经发现使多种底物磷酸化,所述底物包括creb-反应性转录共激活因子(crtc)蛋白质和还有组蛋白脱乙酰酶(hdac)蛋白质,从而调节多种不同基因的转录。crtc信号传导的作用之一涉及控制巨噬细胞的表现型,特别是巨噬细胞通过crtc3磷酸化发生的极化,如通过减少的促炎细胞因子il-12分泌和伴随增加的促消退细胞因子il-10分泌所测得(clark等人,2012;ozanne等人,2015)。
最近已经证明sik1牵涉在小鼠的肥胖个体的骨骼肌敏感性中,并且可以是预防ii型糖尿病(nixon等人,2016)和糖尿病性肾病(yu等人,2013)的受关注靶标。
最近已经识别到sik2和sik3通过分泌高水平的抗炎细胞因子、特别是白介素-10(il-10)和极低水平的促炎细胞因子如tnf-α在炎症中起作用(darling等人,2017)。
最近已经描述了sik2通过调控ifnγ和il-12信号传导在t辅助(th)1细胞分化中的作用,这表明sik2可以是炎性疾病的受关注靶标(yao等人,2013)。
最近,还已经证明:与pth类似,小分子sik抑制剂引起hdac4/5和crtc2的磷酸化减少和核易位增加。用小分子sik抑制剂ykl-05-099进行的治疗增加了小鼠的骨形成和骨量(wein等人,2016),这证实了sik抑制在治疗骨转换疾病中的相关性。
此外,还证明了在氧糖剥夺后sik2的抑制增强神经元存活(sasaki等人,2011)或促进黑素瘤细胞中的黑色素生成(kumagai等人,2011)。在此文中,因为需要治疗策略以调节应激细胞反应(例如在局部缺血期间和组织再输注之后,在心脏重塑的慢性期中,在糖尿病和神经变性病症中),所以在多种应激后sik蛋白质的快速激活或降解使其成为炎性、心脏或代谢疾病以及神经变性疾病中的受关注靶标。sik抑制还可能应用于美容学或色素沉着相关疾病以诱导黑色素生成。
通过sik1发生的alk5调节(yu等人,2013)和将sik2基因识别为原发性硬化性胆管炎的风险基因座(liu等人,2013)提示了sik蛋白质在纤维化疾病中的作用。
除了在细胞能量内稳态中的重要功能外,sik蛋白质还牵涉在细胞周期的调控中。较高的sik2表达与高级别浆液性卵巢癌患者的存活差显著相关(ashourahmed等人,2010),而且sik3的表达在卵巢癌中、特别是在浆液性亚型中和在晚期升高(charoenfuprasert等人,2011)。因此,sik抑制可用于治疗癌症。
尽管在过去二十年基于靶向于促炎细胞因子的抗体如抗tnfα在治疗自身免疫性疾病患者中有极大进展,但是显著比例的患者对这些疗法不响应或经历严重不良事件如机会性感染。因此,对于治疗这些疾病仍然存在未满足的大的医疗需求,并且需要用于预防和/或治疗上述疾病的新药物。
附图说明
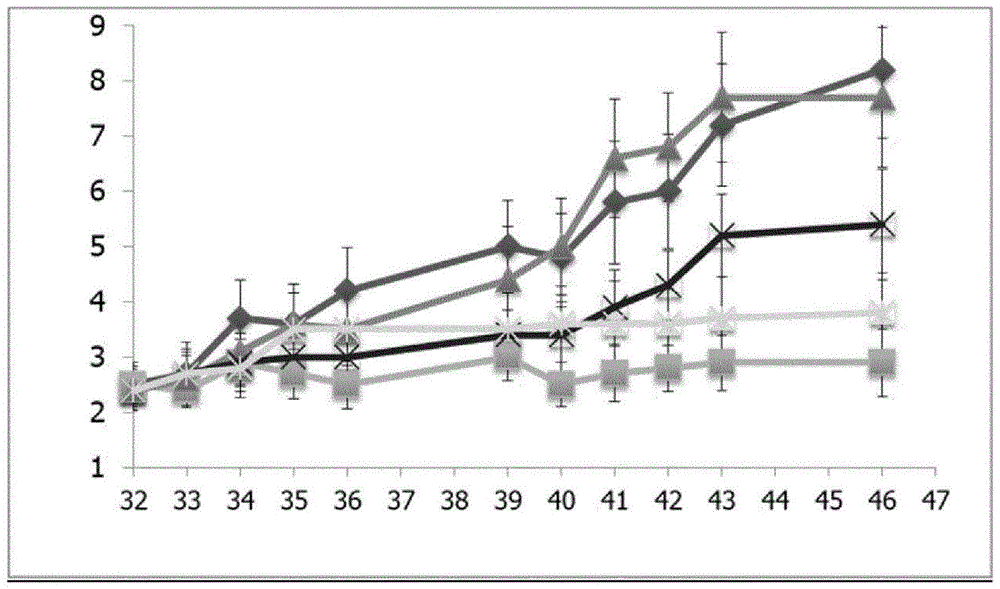
图1涉及实施例4.2,显示了cia小鼠模型中对溶媒(实心菱形)、enbrel(实心正方形)、以2mg/kgbid给予的cpd53(实心三角形)、以5mg/kgbid给予的cpd53(×)和以30mg/kgbid给予的cpd53(星号)而言的临床评分的发展[x-轴:方案天数,y-轴:临床评分]。
发明简述
本发明基于识别了新的化合物以及它们在预防和/或治疗下列疾病中的用途:炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病。特别地,本发明的化合物可以是sik抑制剂,更特别是sik1、sik2和/或sik3抑制剂。本发明还提供了制备这些化合物的方法、包含这些化合物的药物组合物和通过施用本发明的化合物来预防和/或治疗炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病的方法。
因此,在本发明的第一方面,提供了本发明的化合物,其具有式(i):
其中,
x为n或cr4;
y1、y2和y3中一者为n且另两者为c;
z为
--nr5ar5b,
--nr5c-,其中n原子和r3b与它们所连接的原子一起形成稠合5至6元杂环烯基,该杂环烯基包含一条双键且另外包含0、1或2个独立地选自n、o和s的额外杂原子,或
-n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,任选被1、2或3个独立选择的r6基团取代;
r1为h、卤素、c1-4烷基、或任选被c1-4烷氧基、苯基、-cn、-c(=o)oh或-c(=o)-c1-4烷氧基取代的c1-4烷氧基;
r2为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的r7基团取代;
r3a和r3b独立地选自
-卤素,
-c1-4烷基,
-任选被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基,
--nr8ar8b,和
--oh;
r4为h或c1-4烷基;
r5a为h或c1-4烷基;
r5b选自
-任选被一或多个独立选择的r9取代的c1-6烷基,
-任选被一或多个独立选择的r10取代的c3-7环烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,该杂环烷基任选被一或多个氧代基取代,和
-包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的c1-4烷基取代;
r5c选自c3-7环烷基、和任选被一或多个独立选择的卤素取代的c1-6烷基;
r6各自独立地选自
-氧代基,
-卤素,
--cn,
--oh,
--nr11ar11b,
-苯基,
-c3-7环烷基,
-c2-4炔基,
--c(=o)-c1-4烷氧基,
-任选被一或多个卤素或苯基取代的c1-4烷氧基,
-任选被一或多个卤素、-oh或c1-4烷氧基取代的c1-4烷基,和
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基;
r7各自选自
-卤素,
--cn,
-任选被一或多个独立选择的以下基团取代的c1-6烷基:
o卤素,
o-cn,
o-oh,
o任选被一或多个独立选择的卤素取代的c1-4烷氧基,
o-nr11cr11d,
o-c(=o)r12,或
o包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基;
-c1-4烷氧基,
-c3-7环烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基,该杂环烷基任选被-c(=o)c1-4烷氧基或c1-4烷基取代,该c1-4烷基任选被-cn取代,
--nr13ar13b,和
--c(=o)nr13cr13d;
r8a和r8b各自独立地选自h和任选被一个-oh或c1-4烷氧基取代的c1-4烷基;
r9各自独立地选自
-卤素,
--cn,
--nr11er11f,
--oh,
-c1-4烷氧基,
--s(=o)2-c1-4烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,和
-包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的c1-4烷基取代;
r10各自独立地选自
-卤素,
-任选被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷基,
--oh,
-c1-4烷氧基,和
--nr11gr11h;
r11a、r11b、r11c、r11d、r11e、r11f、r11g和r11h各自独立地选自h和c1-4烷基;
r12各自为
--nr14ar14b,其中r14a和r14b各自独立地选自h和c1-4烷基,
--oh,
-任选被一或多个独立选择的以下基团取代的c1-4烷氧基:c3-7环烷基、卤素、-nr15ar15b或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基,
--o-(包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基),或
--o-(c3-7单环环烷基);
r13a、r13b、r13c和r13d各自独立地选自h和c1-4烷基;
r15a和r15b各自独立地选自h和c1-4烷基。
在一个特定方面,提供了本发明的化合物,其用于预防和/或治疗炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病。
而且,还已经出人意料地证明:本发明的化合物显示出对抗sik激酶家族的效能,其可产生致耐受性疗法(tolerogenictherapy)(即,减少促炎细胞因子如tnfα和il-12以及增加抗炎细胞因子如il-10和tgf-β的水平)。
在另一方面,本发明提供了药物组合物,其包含本发明的化合物和药用载体、赋形剂或稀释剂。在一个特定方面,药物组合物可另外包含适用于与本发明的化合物组合的其它治疗活性成分。在一个更特定的方面,所述其它治疗活性成分是用于治疗以下疾病的活性剂:炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病。
而且,可用于本文公开的药物组合物和治疗方法中的本发明的化合物在制备和使用时是药学上可接受的。
在本发明的另一方面,本发明提供了治疗患有选自本文列出那些的病症、特别是炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病的哺乳动物、特别是人的方法,该方法包括施用有效量的如本文所述的本发明的药物组合物或化合物。
本发明还提供了药物组合物,其包含本发明的化合物和适用于药剂的药用载体、赋形剂或稀释剂。在一个特定方面,药物组合物用于预防和/或治疗炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病。
在另外方面,本发明提供了合成本发明的化合物的方法,本文稍后公开了代表性的合成方案和途径。
考虑到随后的详述,其它目标和优点对于本领域技术人员而言将是显而易见的。
可以了解,本发明的化合物可以代谢产生生物活性代谢物。
发明详述
定义
以下术语意欲具有下文提供的含义,可用于理解本发明的描述和预期范围。
当描述本发明(其可包括化合物、含有这类化合物的药物组合物和使用这类化合物和组合物的方法)时,以下术语(若存在)具有以下含义,另有指示除外。还应理解,当在本文中描述时,下文定义的任意部分可以被多个取代基取代,并且各定义在其范围内意欲包括这类被取代的部分,如下文所给出。除非另有指出,否则术语“被取代”如下文所述那样进行定义。还应理解,术语“基团”和“基”在本文中使用时可被视为可互换。
名词对象在本文中可用于指一种/个或多于一种/个(即至少一种/个)所述名词对象。作为举例,“类似物”指一种类似物或多于一种类似物。
“烷基”指具有指定数目的碳原子的直链或支链脂族烃。特定的烷基基团具有1至6个碳原子或1至4个碳原子。支链指一或多个烷基基团(例如甲基、乙基或丙基)连接至直链烷基链。特定的烷基基团有甲基(-ch3)、乙基(-ch2-ch3)、正丙基(-ch2-ch2-ch3)、异丙基(-ch(ch3)2)、正丁基(-ch2-ch2-ch2-ch3)、叔丁基(-ch2-c(ch3)3)、仲丁基(-ch2-ch(ch3)2)、正戊基(-ch2-ch2-ch2-ch2-ch3)、正己基(-ch2-ch2-ch2-ch2-ch2-ch3)和1,2-二甲基丁基(-chch3)-c(ch3)h2-ch2-ch3)。特定的烷基基团具有1至4个碳原子。
“烯基”指具有指定碳原子数的单价烯属(不饱和)烃基。特定的烯基具有2至8个碳原子,更特别具有2至6个碳原子,其可以是直链或支链的,并且具有至少1个和特别是1至2个烯烃不饱和位点。特定的烯基基团包括乙烯基(-ch=ch2)、正丙烯基(-ch2ch=ch2)、异丙烯基(-c(ch3)=ch2)等。
“亚烷基”指具有指定碳原子数、特别是具有1至6个碳原子和更特别是1至4个碳原子的二价烃基,其可以是直链或支链。此术语的示例有诸如亚甲基(-ch2-)、亚乙基(-ch2-ch2-)或-ch(ch3)-等的基团。
“亚炔基”指具有指定的碳原子数和叁键数目、特别是2至6个碳原子和更特别是2至4个碳原子的二价炔基,其可以是直链或支链。此术语的示例有诸如-c≡c-、-ch2-c≡c-和-c(ch3)h-c≡ch-的基团。
“烷氧基”指基团o-烷基,其中烷基具有指定碳原子数。特别地,该术语指基团-o-c1-6烷基。特定的烷氧基有甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、叔丁氧基、仲丁氧基、正戊氧基、正己氧基和1,2-二甲基丁氧基。特定的烷氧基基团为低级烷氧基,即,具有1至6个碳原子。其它特定的烷氧基基团具有1至4个碳原子。
“氨基”指基团-nh2。
“芳基”指通过从母体芳族环系的单个碳原子移除一个氢原子衍生的单价芳族烃基。特别地,芳基指具有指定环原子数的芳族环结构(单环或稠合多环)。具体而言,该术语包括包含6至10个环成元的基团。特定的芳基包括苯基和萘基。
“环烷基”指具有指定环原子数的非芳族烃基环结构(单环、稠合多环、桥连多环或螺环)。环烷基可具有3至12个碳原子,特别是3至10个、更特别是3至7个碳原子。这类环烷基包括例如单环结构,例如环丙基、环丁基、环戊基、环己基和环庚基。
“氰基”指基团-cn。
“卤素”或“卤代”指氟(f)、氯(cl)、溴(br)和碘(i)。特定的卤素基团为氟或氯。
当用于描述化合物或化合物上存在的基团时,“杂”指化合物或基团中的一或多个碳原子已经被氮、氧或硫杂原子替换。杂可应用于上述烃基中的任一者,例如烷基(例如杂烷基)、环烷基(例如杂环烷基)、芳基(例如杂芳基)等,具有1至4个、特别是1至3个杂原子,更典型地是1或2个杂原子,例如单杂原子。
“杂芳基”指包含一或多个独立地选自o、n和s的杂原子和指定环原子数的芳族环结构(单环或稠合多环)。特别地,芳族环结构可具有5至9个环成员。杂芳基基团可以例如是五元或六元单环或由稠合的五元环和六元环或两个稠合的六元环或作为进一步的举例两个稠合的五元环形成的稠合双环结构。各环可含有至多四个通常选自氮、硫和氧的杂原子。通常,杂芳基环将含有至多4个杂原子,更通常至多3个杂原子,更经常是至多2个、例如单个杂原子。在一个实施方案中,杂芳基环含有至少一个环氮原子。杂芳基环中的氮原子可以是碱性的(如在咪唑或吡啶的情况下)或基本上是非碱性的(如在吲哚或吡咯氮的情况下)。通常,杂芳基基团(包括环的任何氨基取代基)中存在的碱性氮原子的数目将少于五。
五元单环杂芳基基团的实例包括但不限于吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、噁三唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基和四唑基基团。
六元单环杂芳基基团的实例包括但不限于吡啶基、吡嗪基、哒嗪基、嘧啶基和三嗪基。
含有与另一个五元环稠合的五元环的双环杂芳基基团的特定实例包括但不限于咪唑并噻唑基和咪唑并咪唑基。
含有与五元环稠合的六元环的双环杂芳基的特定实例包括但不限于苯并呋喃基、苯并噻吩基、苯并咪唑基、苯并噁唑基、异苯并噁唑基、苯并异噁唑基、苯并噻唑基、苯并异噻唑基、异苯并呋喃基、吲哚基、异吲哚基、吲嗪基、嘌呤基(例如腺嘌呤、鸟嘌呤)、吲唑基、吡唑并嘧啶基、三唑并嘧啶基和吡唑并吡啶基基团。
含有两个稠合的六元环的双环杂芳基基团的特定实例包括但不限于喹啉基、异喹啉基、吡啶并吡啶基、喹喔啉基、喹唑啉基、噌啉基、酞嗪基、萘啶基和喋啶基基团。特定的杂芳基基团是衍生自噻吩基、吡咯基、苯并噻吩基、苯并呋喃基、吲哚基、吡啶基、喹啉基、咪唑基、噁唑基和吡嗪基的那些。
代表性的杂芳基的实例包括下列:
其中y各自选自>c=o、nh、o和s。
“杂环烷基”指包含一或多个独立地选自o、n和s的杂原子和指定环原子数的非芳族完全饱和环结构(单环、稠合多环、螺环或桥连多环)。杂环烷基环结构可具有4至12个环成员,特别是4至10个环成员,更特别是4至7个环成员。各环可含有至多四个通常选自氮、硫和氧的杂原子。通常,杂环烷基环将含有至多4个杂原子,更通常至多3个杂原子,更通常至多2个、例如单个杂原子。杂环的实例包括但不限于氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基(例如1-吡咯烷基、2-吡咯烷基和3-吡咯烷基)、四氢呋喃基(例如1-四氢呋喃基、2-四氢呋喃基和3-四氢呋喃基)、四氢噻吩基(例如1-四氢噻吩基、2-四氢噻吩基和3-四氢噻吩基)、哌啶基(例如1-哌啶基、2-哌啶基、3-哌啶基和4-哌啶基)、四氢吡喃基(例如4-四氢吡喃基)、四氢噻喃基(例如4-四氢噻喃基)、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。
如本文所用的术语“杂环烯基”指包含至少一条双键的“杂环烷基”。在下列说明性实例中显示了杂环烯基的特定实例:
其中w各自选自ch2、nh、o和s;y各自选自nh、o、c(=o)、so2和s;且z各自选自n或ch。
在下列说明性实例中显示了单环的特定实例:
其中w和y各自独立地选自-ch2-、-nh-、-o-和-s-。
下列说明性实例中显示了稠合双环的特定实例:
其中w和y各自独立地选自-ch2-、-nh-、-o-和-s-。
下列说明性实例中显示了桥连双环的特定实例:
其中w和y各自独立地选自-ch2-、-nh-、-o-和-s-。
下列说明性实例中显示了螺环的特定实例:
其中y各自选自-ch2-、-nh-、-o-和-s-。
“羟基”指基团-oh。
“氧代基”指基团=o。
“取代”指其中一或多个氢原子各自独立地被相同或不同取代基替换的基团。
“磺基”或”磺酸”指例如-so3h的基团。
“硫醇”指基团-sh。
如本文所用的术语“被一或多个……取代”指一至四个取代基。在一个实施方案中,其指一至三个取代基。在其它实施方案中,其指一或两个取代基。在另一实施方案中,其指一个取代基。
“硫代烷氧基”指基团-s-烷基,其中烷基具有指定碳原子数。特别地,该术语指基团-s-c1-6烷基。特定的硫代烷氧基有硫代甲氧基、硫代乙氧基、硫代正丙氧基、硫代异丙氧基、硫代正丁氧基、硫代叔丁氧基、硫代仲丁氧基、硫代正戊氧基、硫代正己氧基和1,2-二甲基硫代丁氧基。特定的硫代烷氧基为低级硫代烷氧基,即包含1至6个碳原子。其它特定的烷氧基具有1至4个碳原子。
有机合成领域的普通技术人员将知晓,稳定的、化学上可行的杂环(无论是芳族或非芳族)中的杂原子的最大数目由环大小、不饱和度和杂原子价态所确定。通常,杂环可包含一至四个杂原子,只要该杂芳族环是化学上可行的和稳定的。
“可药用”指联邦政府或州政府的监管机构或除美国之外的国家的相应机构批准或可批准的,或者在美国药典或其它通常认可的药典中被列出用于动物和更特别是人。
“可药用盐”指在药学上可接受的并且具有母体化合物的预期药理学活性的本发明的化合物的盐。特别地,这类盐是无毒的,可以是无机酸加成盐或有机酸加成盐和碱加成盐。特别地,这类盐包括:(1)用无机酸形成的酸加成盐,所述无机酸例如有盐酸、氢溴酸、硫酸、硝酸、磷酸等;或用有机酸形成的酸加成盐,所述有机酸例如有乙酸、丙酸、己酸、环戊烷丙酸、乙醇酸、丙酮酸、乳酸、丙二酸、琥珀酸、苹果酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、3-(4-羟基苯甲酰基)苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、1,2-乙烷-二磺酸、2-羟基乙磺酸、苯磺酸、4-氯苯磺酸、2-萘磺酸、4-甲苯磺酸、樟脑磺酸、4-甲基双环[2.2.2]-辛-2-烯-1-甲酸、葡糖庚酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、月桂基硫酸、葡糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸、粘康酸等;或(2)当母体化合物中存在的酸性质子被金属离子(例如碱金属离子、碱土金属离子或铝离子)替换或与有机碱(例如乙醇胺、二乙醇胺、三乙醇胺、n-甲基葡糖胺等)配位时形成的盐。盐还包括(仅作为举例)钠盐、钾盐、钙盐、镁盐、铵盐、四烷基铵盐等;当化合物含有碱性官能团时,还包括无毒有机酸或无机酸的盐,例如盐酸盐、氢溴酸盐、酒石酸盐、甲磺酸盐、乙酸盐、马来酸盐、草酸盐等。术语“可药用阳离子”指酸性官能团的可接受的带正电荷的抗衡离子。这类阳离子的实例有钠、钾、钙、镁、铵、四烷基铵阳离子等。
“可药用辅料”指与本发明的化合物一起施用的稀释剂、佐剂、赋形剂或载体。
“前药”指如下的化合物、包括本发明的化合物的衍生物:具有可裂解的基团并且通过溶剂解或在生理条件下变成在体内具有药物活性的本发明的化合物。这类实例包括但不限于胆碱酯衍生物等、n-烷基吗啉酯等。
“溶剂合物”指与溶剂缔合的、通常通过溶剂解反应与溶剂缔合的化合物的形式。该物理缔合包括氢键合。常规溶剂包括水、etoh、乙酸等。本发明的化合物可以例如制备成结晶形式,并且可以被溶剂化或水合。适宜的溶剂合物包括可药用的溶剂合物、例如水合物,并且还包括化学计量溶剂合物和非化学计量溶剂合物两者。在某些情况下,溶剂合物将能够分离,例如当在结晶固体的晶格中并入了一个或多个溶剂分子时。“溶剂合物”涵盖溶液相和可分离的溶剂合物两者。代表性的溶剂合物包括水合物、乙醇化物和甲醇化物。
“个体”包括人。术语“人”、“患者”和“个体”在本文中可互换使用。
“有效量”指当施用于个体治疗疾病时足以实现对疾病的这类治疗的本发明的化合物的量。“有效量”可视化合物、疾病及其严重度和待治疗个体的年龄、体重等而变化。
“阻止”指减小获得或罹患疾病或病症的风险(即,在可暴露于引起疾病的因素或在疾病发作前易患该疾病的个体中使疾病的至少一种临床症状不出现)。
术语“预防”与“阻止”相关,指其目的是阻止、而非治疗或治愈疾病的措施或操作。预防性措施的非限制性实例可包括施用疫苗;给处于归因于例如固定的血栓形成的风险中的住院患者施用低分子量肝素;和在访问疟疾是地方性疾病或感染疟疾的风险较高的地理区域之前施用抗疟疾剂,例如氯奎。
在一个实施方案中,“治疗”任意疾病或病症指改善疾病或病症(即,遏制疾病或降低其至少一种临床症状的表现、程度或严重度)。在另一实施方案中,“治疗”指改善至少一个不能由个体辨别的身体参数。在另一实施方案中,“治疗”指在身体上(例如稳定可辨别的症状)、生理上(例如稳定身体参数)或这两者上调节疾病或病症。在另一实施方案中,“治疗”涉及减缓疾病进程。
如本文所用的术语“炎性病症”指包括以下的病症组:类风湿性关节炎、骨关节炎、幼年特发性关节炎、银屑病、银屑病性关节炎、强直性脊柱炎、过敏性气道疾病(例如哮喘、鼻炎)、慢性阻塞性肺病(copd)、炎性肠病(例如克罗恩病、溃疡性结肠炎)、内毒素驱动疾病状态(例如旁路手术后并发症或促成例如慢性心力衰竭的慢性内毒素病状)和涉及软骨如关节软骨的相关疾病。特别地,该术语指类风湿性关节炎、骨关节炎、过敏性气道疾病(例如哮喘)、慢性阻塞性肺病(copd)和炎性肠病。更特别地,该术语指类风湿性关节炎、慢性阻塞性肺病(copd)和炎性肠病。
如本文所用的术语“自身炎症性疾病”指包括以下的病症组:隐热蛋白(cryopyrin)相关周期综合征(caps)、家族性地中海热(fmf)和肿瘤坏死因子受体相关周期综合征(traps)、白塞病
如本文所用的术语“自身免疫性疾病”指包括以下的病症组:阻塞性气道疾病,包括病症诸如copd、哮喘(例如内源性哮喘、外源性哮喘、粉尘性哮喘、婴幼儿哮喘)、特别是慢性或顽固性哮喘(inveterateasthma)(例如晚期哮喘和气道高反应性),支气管炎(包括支气管哮喘)、全身性红斑狼疮(sle)、皮肤性红斑狼疮、狼疮性肾炎、皮肌炎、自身免疫性肝疾病(例如自身免疫性肝炎、原发性硬化性胆管炎和原发性胆汁性肝硬化)、舍格伦
如本文所用的术语“增殖性疾病”指诸如以下的病症:癌症(例如子宫平滑肌肉瘤或前列腺癌)、骨髓增殖性疾病(例如真性红细胞增多症、原发性血小板增多症和骨髓纤维化)、白血病(例如急性髓性白血病、急性和慢性淋巴母细胞性白血病)、多发性骨髓瘤、银屑病、再狭窄、硬皮病或纤维化。特别地,该术语指癌症、白血病、多发性骨髓瘤和银屑病。
如本文所用的术语“癌症”指皮肤或身体器官(例如但不限于乳房、前列腺、肺、肾、胰、胃或肠)中的细胞的恶心或良性生长。癌症倾向于浸润入邻近组织并扩展(转移)至远处器官如骨、肝脏、肺或脑。如本文所用的术语癌症包括转移性肿瘤细胞类型(例如但不限于黑素瘤、淋巴瘤、白血病、纤维肉瘤、横纹肌肉瘤和肥大细胞瘤)和组织癌类型(例如但不限于结肠直肠癌、前列腺癌、小细胞肺癌和非小细胞肺癌、乳癌、胰癌、膀胱癌、肾癌、胃癌、胶质母细胞瘤、原发性肝癌、卵巢癌、前列腺癌和子宫平滑肌肉瘤)。特别地,术语“癌症”指急性淋巴母细胞性白血病、急性髓性白血病、肾上腺皮质癌、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎样/横纹肌样肿瘤、基底细胞癌、胆管癌、膀胱癌、骨癌(骨肉瘤和恶性纤维组织细胞瘤)、脑干神经胶质瘤、脑瘤、脑和脊髓瘤、乳癌、支气管肿瘤、伯基特(burkitt)淋巴瘤、子宫颈癌、慢性淋巴细胞性白血病、慢性骨髓性白血病、结肠癌、结肠直肠癌、颅咽管瘤、皮肤t-细胞淋巴瘤、胚胎瘤、子宫内膜癌、室管膜母细胞瘤、室管膜瘤、食道癌、肿瘤的尤因肉瘤家族、眼癌、视网膜母细胞瘤、胆囊癌、胃癌、胃肠类癌瘤、胃肠间质瘤(gist)、胃肠基质细胞瘤、生殖细胞肿瘤、神经胶质瘤、多毛细胞白血病、头颈癌、肝细胞(肝)癌、霍奇金淋巴瘤、下咽癌、眼内黑素瘤、胰岛细胞肿瘤(内分泌胰)、卡波西肉瘤、肾癌、朗格汉斯细胞组织细胞增多症、喉癌、白血病、急性淋巴母细胞白血病、急性髓性白血病、慢性淋巴细胞性白血病、慢性骨髓性白血病、多毛细胞白血病、肝癌、非小细胞肺癌、小细胞肺癌、伯基特淋巴瘤、皮肤t-细胞淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、淋巴瘤、瓦尔登斯特伦巨球蛋白血症、成神经管细胞瘤、髓上皮瘤、黑素瘤、间皮瘤、口癌、慢性骨髓性白血病、髓性白血病、多发性骨髓瘤、鼻咽癌、成神经细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口腔癌、口咽癌、骨肉瘤、骨恶性纤维组织细胞瘤、卵巢癌、卵巢上皮癌、卵巢生殖细胞肿瘤、卵巢低恶性潜能肿瘤、胰癌、乳头状瘤病、甲状旁腺癌、阴茎癌、咽癌、中度分化的松果体实质肿瘤、松果体母细胞瘤和幕上原始神经外胚层肿瘤、垂体瘤、浆细胞瘤/多发性骨髓瘤、胸膜肺母细胞瘤、原发性中枢神经系统淋巴瘤、前列腺癌、直肠癌、肾细胞(肾)癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤、肿瘤的尤因肉瘤家族、卡波西肉瘤、赛泽里综合征、皮肤癌、小细胞肺癌、小肠癌、软组织肉瘤、鳞状细胞癌、胃癌、幕上原始神经外胚层肿瘤、t-细胞淋巴瘤、睾丸癌、喉癌、胸腺瘤和胸腺癌、甲状腺癌、尿道癌、子宫癌、子宫肉瘤、阴道癌、外阴癌、瓦尔登斯特伦巨球蛋白血症和维尔姆斯肿瘤。
如本文所用的术语“白血病”指血液和造血器官的赘生性疾病。这类疾病可造成骨髓和免疫系统功能障碍,致使宿主对感染和出血高度易感。特别地,术语白血病指急性髓性白血病(aml)和急性淋巴母细胞白血病(all)和慢性淋巴母细胞白血病(cll)。
如本文所用的术语“纤维化疾病”指如下的疾病:以归因于胞外基质的过量产生、沉积和收缩所致的过度结疤为特征的疾病,和伴有细胞和/或纤连蛋白和/或胶原的异常积聚和/或纤维母细胞募集增加的那些,包括但不限于个体器官或组织的纤维化,所述器官或组织例如有心脏、肾脏、肝脏、关节、肺、胸膜组织、腹膜组织、皮肤、角膜、视网膜、肌肉骨胳和消化道。特别地,术语纤维化疾病指特发性肺纤维化(ipf);囊性纤维化,不同病因学的其它弥漫性实质性肺疾病、包括医源性药物诱导的纤维化、职业和/或环境诱导的纤维化、肉芽肿病(结节病、过敏性肺炎)、胶原血管病、肺泡蛋白沉着症、朗格汉斯细胞肉芽肿病、淋巴管肌瘤病、遗传疾病(赫-普综合征、结节性脑硬化、神经纤维瘤病、代谢储积病症、家族性间质性肺病);放射诱导的纤维化;慢性阻塞性肺病(copd);硬皮病;博来霉素诱导的肺纤维化;慢性哮喘;硅肺病;石棉诱导的肺纤维化;急性呼吸窘迫综合征(ards);肾纤维化;小管间质性纤维化;肾小球肾炎;糖尿病性肾病,局灶节段性肾小球硬化症;iga肾病;高血压;奥尔波特综合征;肠纤维化;肝纤维化;肝硬化;酒精诱导的肝纤维化;毒素/药物诱导的肝纤维化;血色素沉着病;非酒精性脂肪性肝炎(nash);胆管道损伤;原发性胆汁性肝硬化;感染诱导的肝纤维化;病毒诱导的肝纤维化;和自身免疫性肝炎;角膜瘢痕;肥厚性瘢痕;迪皮特朗病(dupuytren'sdisease)、瘢痕瘤、皮肤纤维化;皮肤硬皮病;全身性硬化症、脊髓损伤/纤维化;骨髓纤维化;迪谢内肌营养不良(dmd)相关性肌骨骼纤维化、血管再狭窄;动脉粥样硬化;动脉硬化;韦格纳肉芽肿病;佩罗尼病或慢性淋巴细胞病。更特别地,术语“纤维化疾病”指特发性肺纤维化(ipf)、迪皮特朗病、非酒精性脂肪性肝炎(nash)、全身性硬化症、肾纤维化和皮肤纤维化。
如本文所用的术语“移植排斥”指(例如胰岛、干细胞、骨髓、皮肤、肌肉、角膜组织、神经元组织、心、肺、合并心-肺、肾、肝、肠、胰、气管或食管的)细胞、组织或实体器官同种异体或异种移植的急性或慢性排斥或者移植物抗宿主疾病。
如本文所用的术语“涉及软骨转换损伤的疾病”包括例如以下的病症:骨关节炎、银屑病性关节炎、幼年类风湿性关节炎、痛风性关节炎、脓毒性或感染性关节炎、反应性关节炎、反射交感性营养不良、痛性营养不良、tietze综合征或肋软骨炎、纤维肌痛、骨软骨炎、神经源性或神经性关节炎、关节病、地方性关节炎如地方性变形性骨关节炎、姆塞莱尼(mseleni)病和handigodu病);由纤维肌痛造成的退化、全身性红斑狼疮、硬皮病和强直性脊柱炎。
如本文所用的术语“先天性软骨畸形”包括诸如遗传性软骨溶解、软骨发育不良和假性软骨发育不良的病症,特别是但不限于小耳畸形、无耳畸形、干骺端软骨发育不良和相关病症。
如本文所用的术语“涉及骨转换损伤的疾病”包括诸如以下的病症:骨质疏松症(包括绝经后骨质疏松症、男性骨质疏松症、糖皮质激素诱导的骨质疏松症和幼年型骨质疏松症)、通过赘生性骨髓病症造成的骨质疏松症、骨质减少、激素缺乏症(维生素d缺乏症、男性和女性性腺功能减退)、激素过量(高泌乳素血症、过量糖皮质激素、甲状腺机能亢进、甲状旁腺功能亢进)、佩吉特病、骨关节炎、肾性骨病、成骨不全、低磷酸酯酶症。
如本文所用的术语“与il-6过度分泌相关的疾病”包括诸如卡斯尔曼(castleman’s)病、多发性骨髓瘤、银屑病、卡波西肉瘤和/或系膜增殖性肾小球肾炎的病症。
如本文所用的术语“与tnfα、干扰素、il-12和/或il-23过度分泌相关的疾病”包括诸如以下的病症:全身性和皮肤性红斑狼疮、狼疮性肾炎、皮肌炎、舍格伦综合征、银屑病、类风湿性关节炎、银屑病性关节炎、多发性硬化症、21-三体综合征、溃疡性结肠炎和/或克罗恩病。
如本文所用的术语“呼吸系统疾病”指影响涉及呼吸的器官如鼻、咽、喉、咽鼓管、气管、支气管、肺、相关肌肉(例如隔膜和肋间)和神经的疾病。特别地,呼吸系统疾病的实例包括哮喘、成人呼吸窘迫综合征和过敏性(外源性)哮喘、非过敏性(内源性)哮喘、急性严重哮喘、慢性哮喘、临床哮喘、夜间哮喘、过敏原诱导的哮喘、阿司匹林敏感性哮喘、运动诱导的哮喘、等二氧化碳过度换气(isocapnichyperventilation)、儿童发作哮喘、成人发作哮喘、咳嗽变异型哮喘、职业性哮喘、类固醇抵抗性哮喘、季节性哮喘、季节性过敏性鼻炎、常年性过敏性鼻炎、慢性阻塞性肺病(包括慢性支气管炎或肺气肿)、肺高压、间质性肺纤维化和/或气道炎症、囊性纤维化和低氧。
如本文所用的术语“内分泌和/或代谢疾病”指涉及身体的某种或某些激素的产生过多或过少的病症组,而代谢病症影响身体处理某些营养素和维生素的能力。内分泌病症尤其包括甲状腺功能减退症、先天性肾上腺增生、甲状旁腺疾病、糖尿病、肾上腺疾病(包括库欣(cushing’s)综合征和艾迪生病(addison’sdisease))和卵巢功能障碍(包括多囊卵巢综合征)。代谢病症的一些实例包括囊性纤维化、苯丙酮酸尿(pku)、糖尿病、高脂血症、痛风和佝偻病。代谢病症的特定实例为肥胖和/或ii型糖尿病。
如本文所用的术语“心血管疾病”指影响心脏或血管或二者的疾病。特别地,心血管疾病包括心律失常(心房或心室或二者);动脉粥样硬化及其后遗症;心绞痛;心律紊乱;心肌缺血;心肌梗塞;心脏或血管动脉瘤;血管炎;中风;肢体、器官或组织的外周阻塞性动脉病;脑、心脏、肾脏或其它器官或组织缺血后再灌注损伤;内毒素性、外科或创伤性休克;高血压、瓣膜性心脏病、心力衰竭、异常血压;休克;血管收缩(包括与偏头痛相关的血管收缩);限于单个器官或组织的血管异常、炎症、功能不全。更特别地,心血管疾病指动脉粥样硬化。
如本文所用的术语“皮肤病学疾病”指皮肤病症。特别地,皮肤病学病症包括皮肤的增殖性或炎性病症,例如特应性皮炎、大疱性疾病、胶原性疾病、银屑病、银屑病性病变、皮炎、接触性皮炎、湿疹、白斑、瘙痒症、荨麻疹、酒渣鼻、硬皮病、伤口愈合、瘢痕形成、肥厚瘢痕形成、瘢痕瘤、川崎病(kawasakidisease)、酒渣鼻、舍格伦-拉森(
如本文所用的术语“异常血管生成相关疾病”指由调节血管生成的过程失调造成的疾病。特别地,异常血管生成相关疾病指动脉粥样硬化、高血压、肿瘤生长、炎症、类风湿性关节炎、湿性黄斑变性、脉络膜新生血管形成、视网膜新生血管形成和糖尿病性视网膜病变。
“本发明的化合物”和等同表达意欲涵盖如本文所述的通式化合物,该表述当上下文允许时包括可药用盐和溶剂合物(例如水合物)和可药用盐的溶剂合物。类似地,无论是否要求其自身,对中间体的称谓当上下文允许时意欲涵盖它们的盐和溶剂合物。
当本文提及范围、例如但不限于c1-8烷基时,对范围的引用应当被视为给出了该范围的每个成员。
本发明的化合物的其它衍生物在其酸和酸衍生物形式下均具有活性,但是酸敏感形式通常在哺乳动物生物体中提供了溶解性、组织相容性或延缓释放的优点(bundgaard1985)。前药包括本领域技术人员熟知的酸衍生物,例如通过母体酸与适宜醇反应制备的酯,或通过母体酸化合物与取代或未取代的胺反应制备的酰胺,或酸酐或混合酸酐。衍生自本发明的化合物上悬挂的酸基团的简单脂族或芳族酯、酰胺和酸酐是特别有用的前药。在一些情况下,期望制备双酯型前药,例如(酰氧基)烷基酯或((烷氧羰基)氧基)烷基酯。特定的这类前药有本发明的化合物的c1-8烷基、c2-8烯基、c6-10任选被取代的芳基和(c6-10芳基)-(c1-4烷基)酯。
本公开内容包括本文提供的本发明的化合物的所有同位素形式,无论是(i)其中给定原子数的所有原子具有在自然界中占优势的质量数(或质量数的混合物)(本文称为“自然同位素形式”)或(ii)其中一或多个原子被具有相同原子数、但是质量数与自然界中占优势的原子的质量数不同的原子所替换(本文称为“非自然变体同位素形式”)的形式。可以理解,原子可自然地作为质量数的混合物存在。术语“非自然变体同位素形式”还包括这样的实施方案:其中具有自然界较少见的质量数的给定原子数的原子(本文中称为“不常见同位素”)的比例相对于天然存在者增加,例如以该原子数的原子的数目计增加至>20%、>50%、>75%、>90%、>95%或>99%的水平(后一实施方案称为“同位素富集变体形式”)。术语“非自然变体同位素形式”还包括其中不常见同位素的比例相对于天然存在者降低的实施方案。同位素形式可包括放射性形式(即,它们并入了放射性同位素)和非放射性形式。放射性形式将通常是同位素富集的变体形式。
因此,化合物的非自然变体同位素形式可以在一或多个原子中含有一或多个人工或不常见同位素,例如氘(2h或d)、碳-11(11c)、碳-13(13c)、碳-14(14c)、氮-13(13n)、氮-15(15n)、氧-15(15o)、氧-17(17o)、氧-18(18o)、磷-32(32p)、硫-35(35s)、氯-36(36cl)、氯-37(37cl)、氟-18(18f)、碘-123(123i)、碘-125(125i),或者可以在一或多个原子中含有与自然界中占优势的比率相比增加比例的所述同位素。
包含放射性同位素的非自然变体同位素形式可以例如用于药物和/或底物组织分布研究。放射性同位素氚(即3h)和碳-14(即14c)由于它们容易并入和现成的检测手段而尤其适用于此目的。并入了氘(即2h或d)的非自然变体同位素形式可提供由更高的代谢稳定性产生的某些治疗优点(例如增加的体内半衰期或降低的剂量需求),因此在一些情况下是优选的。此外,可以制备并入了正电子发射同位素如11c、18f、15o和13n的非自然变体同位素形式,它们可用于正电子发射断层摄影术(pet)研究来检查底物受体占有率。
还应理解,具有相同分子式、但是性质或它们的原子键合顺序或它们的原子空间排列不同的化合物称为“异构体”。它们的原子空间排列不同的异构体称为“立体异构体”。
彼此不为镜像的立体异构体称为“非对映异构体”,彼此为不可重叠的镜像的那些称为“对映异构体”。当化合物具有不对称中心时,例如,其键合至四个不同基团,则一对对映异构体是可能的。对映异构体可通过其不对称中心的绝对构型来表征,由cahn和prelog的r-和s-定序规则或以其中分子旋转偏振光平面和指定为右旋或左旋(即分别为(+)或(-)异构体)的方式来描述。手性化合物可作为单独对映异构体或作为其混合物存在。含有相等比率的对映异构体的混合物称为“外消旋混合物”。
“互变异构体”指特定化合物结构的可互换形式且氢原子和电子位移变化的化合物。因此,两种结构可以通过π电子和原子(通常h)的运动处于平衡中。例如,烯醇与酮为互变异构体,因为它们通过用酸或碱处理快速互相转变。互变现象的另一实例是苯基硝基甲烷的酸形式和硝基形式,其同样通过用酸或碱处理形成。
互变异构形式可以与所关注化合物的最佳化学反应性和生物活性的达成有关。
本发明的化合物可具有一或多个不对称中心;因此,这类化合物可作为单独(r)-或(s)-立体异构体或作为其混合物产生。
除非另外指明,否则本说明书和权利要求书中的特定化合物的描述或命名意欲包括单独对映异构体及其混合物(外消旋或其它)两者。用于确定立体化学和分离立体异构体的方法是本领域熟知的。
应当理解,本发明的化合物可以代谢产生生物活性代谢物。
本发明
本发明基于识别了新的化合物以及它们在预防和/或治疗下列疾病中的用途:炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病。特别地,本发明的化合物可以是sik抑制剂,更特别是sik1、sik2和/或sik3抑制剂。
本发明还提供了制备这些化合物的方法、包含这些化合物的药物组合物和通过施用本发明的化合物来预防和/或治疗炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病的方法。
因此,在本发明的第一方面,提供了本发明的化合物,其具有式i:
其中,
x为n或cr4;
y1、y2和y3中一者为n且另两者为c;
z为
--nr5ar5b,
--nr5c-,其中n原子和r3b与它们所连接的原子一起形成稠合5至6元杂环烯基,该杂环烯基包含一条双键且另外包含0、1或2个独立地选自n、o和s的额外杂原子,或
-n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,任选被1、2或3个独立选择的r6基团取代;
r1为h、卤素、c1-4烷基、或任选被c1-4烷氧基、苯基、-cn、-c(=o)oh或-c(=o)-c1-4烷氧基取代的c1-4烷氧基;
r2为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的r7基团取代;
r3a和r3b独立地选自
-卤素,
-c1-4烷基,
-任选被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基,
--nr8ar8b,和
--oh;
r4为h或c1-4烷基;
r5a为h或c1-4烷基;
r5b选自
-任选被一或多个独立选择的r9取代的c1-6烷基,
-任选被一或多个独立选择的r10取代的c3-7环烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,该杂环烷基任选被一或多个氧代基取代,和
-包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的c1-4烷基取代;
r5c选自c3-7环烷基、和任选被一或多个独立选择的卤素取代的c1-6烷基;
r6各自独立地选自
-氧代基,
-卤素,
--cn,
--oh,
--nr11ar11b,
-苯基,
-c3-7环烷基,
-c2-4炔基,
--c(=o)-c1-4烷氧基,
-任选被一或多个卤素或苯基取代的c1-4烷氧基,
-任选被一或多个卤素、-oh或c1-4烷氧基取代的c1-4烷基,和
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基;
r7各自选自
-卤素,
--cn,
-任选被一或多个独立选择的以下基团取代的c1-6烷基:
o卤素,
o-cn,
o-oh,
o任选被一或多个独立选择的卤素取代的c1-4烷氧基,
o-nr11cr11d,
o-c(=o)r12,或
o包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基;
-c1-4烷氧基,
-c3-7环烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基,该杂环烷基任选被-c(=o)c1-4烷氧基或c1-4烷基取代,该c1-4烷基任选被-cn取代,
--nr13ar13b,和
--c(=o)nr13cr13d;
r8a和r8b各自独立地选自h和任选被一个-oh或c1-4烷氧基取代的c1-4烷基;
r9各自独立地选自
-卤素,
--cn,
--nr11er11f,
--oh,
-c1-4烷氧基,
--s(=o)2-c1-4烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,和
-包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的c1-4烷基取代;
r10各自独立地选自
-卤素,
-任选被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷基,
--oh,
-c1-4烷氧基,和
--nr11gr11h;
r11a、r11b、r11c、r11d、r11e、r11f、r11g和r11h各自独立地选自h和c1-4烷基;
r12各自为
--nr14ar14b,其中r14a和r14b各自独立地选自h和c1-4烷基,
--oh,
-任选被一或多个独立选择的以下基团取代的c1-4烷氧基:c3-7环烷基、卤素、-nr15ar15b或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基,
--o-(包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基),或
--o-(c3-7单环环烷基);
r13a、r13b、r13c和r13d各自独立地选自h和c1-4烷基;
r15a和r15b各自独立地选自h和c1-4烷基。
在一个实施方案中,本发明的化合物是式i,其中x为cr4且r4为h。
在一个实施方案中,本发明的化合物是式i,其中x为cr4且r4为c1-4烷基。在一个特定实施方案中,r4为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r4为-ch3。
在一个实施方案中,本发明的化合物是式iia、iib、iic、iid、iie或iif:
其中r1、r2、r3a、r3b和z如上所述。
在一个实施方案中,本发明的化合物是式i至iif中任一者,其中r1为h。
在一个实施方案中,本发明的化合物是式i至iif中任一者,其中r1为卤素。在一个特定实施方案中,r1为f、cl或br。
在一个实施方案中,本发明的化合物是式i至iif中任一者,其中r1为c1-4烷基。在一个特定实施方案中,r1为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r1为-ch3。
在一个实施方案中,本发明的化合物是式i至iif中任一者,其中r1为c1-4烷氧基。在一个特定实施方案中,r1为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。在一个更特定的实施方案中,r1为-o-ch3。
在一个实施方案中,本发明的化合物是式i至iif中任一者,其中r1为被c1-4烷氧基、苯基、-cn、-c(=o)oh或-c(=o)-c1-4烷氧基取代的c1-4烷氧基。在一个特定实施方案中,r1为-o-ch2ch3或-o-ch(ch3)2,被c1-4烷氧基、苯基、-cn、-c(=o)oh或-c(=o)-c1-4烷氧基取代。在另一个特定实施方案中,r1为被-o-ch3或-o-ch2ch3、苯基、-cn、-c(=o)oh或-c(=o)-o-ch2ch3取代的c1-4烷氧基。在一个更特定的实施方案中,r1为-o-ch2ch2-o-ch3、苄氧基、-o-ch(cn)ch3、-o-ch2-c(=o)oh、-o-ch(ch3)-c(=o)oh、-o-ch2-c(=o)-o-ch2ch3或-o-ch(ch3)-c(=o)-o-ch2ch3。
在一个实施方案中,本发明的化合物是式i至iif中任一者,其中r1为被c1-4烷氧基取代的c1-4烷氧基。在一个特定实施方案中,r1为被c1-4烷氧基取代的-o-ch2ch3或-o-ch(ch3)2。在另一个特定实施方案中,r1为被-o-ch3或-o-ch2ch3取代的c1-4烷氧基。在一个更特定的实施方案中,r1为-o-ch2ch2-o-ch3。
在一个实施方案中,本发明的化合物是式iiia、iiib、iiic、iiid、iiie或iiif:
其中r2、r3a、r3b和z如上所述。
在一个实施方案中,本发明的化合物是式i至iiif中任一者,其中z为-nr5c-,其中n原子和r3b与它们所连接的原子一起形成稠合5至6元杂环烯基,该杂环烯基包含一条双键且另外包含0、1或2个独立地选自n、o和s的额外杂原子,且r5c如前所述。在一个特定实施方案中,z为-nr5c-,其中n原子和r3b与它们所连接的原子一起形成稠合3,4-二氢-2h-1,3-噁嗪、1,2,3,4-四氢嘧啶、3-吡咯啉、1,2,3,6-四氢吡啶或3,4-二氢-2h-1,3-噻嗪。在一个更特定的实施方案中,z为-nr5c-,其中n原子和r3b与它们所连接的原子一起形成稠合3,4-二氢-2h-1,3-噁嗪、3-吡咯啉或1,2,3,6-四氢吡啶。
在一个实施方案中,本发明的化合物是式iva、ivb、ivc或ivd:
其中r2、r3a和r5c如上所述。
在一个实施方案中,本发明的化合物是式i至ivd中任一者,其中r5c为c3-7环烷基。在一个特定实施方案中,r5c为环丙基、环丁基或环戊基。在一个更特定的实施方案中,r5c为环丙基。
在一个实施方案中,本发明的化合物是式i至ivd中任一者,其中r5c为c1-6烷基。在一个特定实施方案中,r5c为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或-c(ch3)3。在一个更特定的实施方案中,r5c为-ch2ch3。
在一个实施方案中,本发明的化合物是式i至ivd中任一者,其中r5c为被一或多个独立选择的卤素取代的c1-6烷基。在一个特定实施方案中,r5c为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或-c(ch3)3,其各自被一或多个独立选择的卤素取代。在另一个特定实施方案中,r5c为被1、2或3个独立选择的卤素取代的c1-6烷基。在又一个特定实施方案中,r5c为被一或多个独立选择的f或cl取代的c1-6烷基。在一个更特定的实施方案中,r5c为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或-c(ch3)3,其各自被1、2或3个独立选择的卤素取代。在另一个更特定的实施方案中,r5c为被1、2或3个独立选择的f或cl取代的c1-6烷基。在又一个更特定的实施方案中,r5c为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或-c(ch3)3,其各自被一或多个独立选择的f或cl取代。在另一个更特定的实施方案中,r5c为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或-c(ch3)3,其各自被1、2或3个独立选择的f或cl取代。在另一个更特定的实施方案中,r5c为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或-c(ch3)3,其各自被一或多个f取代。在又一个更特定的实施方案中,r5c为被1、2或3个独立选择的f取代的c1-6烷基。在一个最特定的实施方案中,r5c为被1、2或3个f取代的-ch2ch3。
在一个实施方案中,本发明的化合物是式i至ivd中任一者,其中r2为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基。在一个特定实施方案中,r2为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基。在一个更特定的实施方案中,r2为吡唑基。
在一个实施方案中,本发明的化合物是式i至ivd中任一者,其中r2为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的r7基团取代。在一个特定实施方案中,r2为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被1、2或3个独立选择的r7基团取代。在另一个特定实施方案中,r2为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一或多个独立选择的r7基团取代。在一个更特定的实施方案中,r2为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一个r7基团取代。在一个最特定的实施方案中,r2为被一个r7基团取代的吡唑基。
在一个实施方案中,本发明的化合物是式i至ivd中任一者,其中r2为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的r7基团取代且r7为卤素或-cn。在一个特定实施方案中,r7为f、cl、br或-cn。在一个更特定的实施方案中,r7为f或-cn。
在一个实施方案中,本发明的化合物是式i至ivd中任一者,其中r2为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的r7基团取代且r7为c1-4烷氧基。在一个特定实施方案中,r7为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。在一个更特定的实施方案中,r7为-o-ch3或-o-ch2ch3。
在一个实施方案中,本发明的化合物是式i至ivd中任一者,其中r2为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的r7基团取代,r7为-nr13ar13b且r13a和r13b各自如前所述。在一个特定实施方案中,r13a和r13b均为h。在另一个特定实施方案中,r13a和r13b中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r13a和r13b均为c1-4烷基。在另外更特定的实施方案中,r13a和r13b各自独立地选自h、-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r13a和r13b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在一个最特定的实施方案中,r7为nh2或-n(ch3)2。
在一个实施方案中,本发明的化合物是式i至ivd中任一者,其中r2为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的r7基团取代,r7为-c(=o)nr13cr13d且r13c和r13d各自如前所述。在一个特定实施方案中,r13c和r13d均为h。在另一个特定实施方案中,r13c和r13d中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r13c和r13d均为c1-4烷基。在一个更特定的实施方案中,r13c和r13d中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r13c和r13d各自独立地选自h、-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r13c和r13d为-ch3、-ch2ch3或-ch(ch3)2。
在一个实施方案中,本发明的化合物是式va、vb、vc、vd、ve或vf:
其中r3a、r3b、r7和z如上所述。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为c1-6烷基。在一个特定实施方案中,r7为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3、-ch(ch3)ch(ch3)2、-ch2ch(ch3)ch2ch3或-ch2ch2ch(ch3)2。在一个更特定的实施方案中,r7为-ch3或-ch2ch3。在一个最特定的实施方案中,r7为-ch3。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为c1-4烷基。在一个特定实施方案中,r7为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r7为-ch3或-ch2ch3。在一个最特定的实施方案中,r7为-ch3。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的以下基团取代的c1-6烷基:卤素、-cn、-oh、任选被一或多个独立选择的卤素取代的c1-4烷氧基、-nr11cr11d、-c(=o)r12或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在一个特定实施方案中,r7为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3、-ch(ch3)ch(ch3)2、-ch2ch(ch3)ch2ch3或-ch2ch2ch(ch3)2,其各自被一或多个独立选择的以下基团取代:卤素、-cn、-oh、任选被一或多个独立选择的卤素取代的c1-4烷氧基、-nr11cr11d、-c(=o)r12或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在另一个特定实施方案中,r7为被1、2或3个独立选择的以下基团取代的c1-6烷基:卤素、-cn、-oh、任选被一或多个独立选择的卤素取代的c1-4烷氧基、-nr11cr11d、-c(=o)r12或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在又一个特定实施方案中,r7为被一或多个独立选择的以下基团取代的c1-6烷基:f、cl、-cn、-oh、-o-ch3、-o-ch2ch3、-o-ch(ch3)2、-o-chf2、-o-cf3、-o-ch2chf2、-nr11cr11d、-c(=o)r12、氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。在一个更特定的实施方案中,r7为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch(ch3)ch2ch3、-ch(ch3)ch(ch3)2、-ch2ch(ch3)ch2ch3或-ch2ch2ch(ch3)2,其各自被1、2或3个独立选择的以下基团取代:卤素、-cn、-oh、任选被一或多个独立选择的卤素取代的c1-4烷氧基、-nr11cr11d、-c(=o)r12或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在另一个更特定的实施方案中,r7为被1、2或3个独立选择的以下基团取代的c1-6烷基:f、cl、-cn、-oh、-o-ch3、-o-ch2ch3、-o-ch(ch3)2、-o-chf2、-o-cf3、-o-ch2chf2、-nr11cr11d或-c(=o)r12。在又一个更特定的实施方案中,r7为被一个氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基取代的c1-6烷基。在另外更特定的实施方案中,r7为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2或-ch2ch2ch(ch3)2,其各自被1、2或3个独立选择的f、cl、-cn、-oh、-o-ch3、-o-ch2ch3、-o-ch(ch3)2、-o-chf2、-o-cf3、-o-ch2chf2、-nr11cr11d或-c(=o)r12取代。在另一个更特定的实施方案中,r7为-ch3或-ch2ch3,其各自被一个氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基取代。在一个最特定的实施方案中,r7为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2或-ch2ch2ch(ch3)2,其各自被1、2或3个独立选择的f、-cn、-oh、-o-ch3或-c(=o)r12取代。在另一个最特定的实施方案中,r7为-ch3或-ch2ch3,其各自被一个四氢呋喃基或吗啉基取代。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的以下基团取代的c1-4烷基:卤素、-cn、-oh、任选被一或多个独立选择的卤素取代的c1-4烷氧基、-nr11cr11d、-c(=o)r12或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在一个特定实施方案中,r7为-ch3、-ch2ch3、-ch2ch2ch3或-ch(ch3)2,其各自被一或多个独立选择的以下基团取代:卤素、-cn、-oh、任选被一或多个独立选择的卤素取代的c1-4烷氧基、-nr11cr11d、-c(=o)r12或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在另一个特定实施方案中,r7为被1、2或3个独立选择的以下基团取代的c1-4烷基:卤素、-cn、-oh、任选被一或多个独立选择的卤素取代的c1-4烷氧基、-nr11cr11d、-c(=o)r12或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在又一个特定实施方案中,r7为被一或多个独立选择的以下基团取代的c1-4烷基:f、cl、-cn、-oh、-o-ch3、-o-ch2ch3、-o-ch(ch3)2、-o-chf2、-o-cf3、-o-ch2chf2、-nr11cr11d、-c(=o)r12、氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。在一个更特定的实施方案中,r7为-ch3、-ch2ch3或-ch2ch2ch3,其各自被1、2或3个独立选择的以下基团取代:卤素、-cn、-oh、任选被一或多个独立选择的卤素取代的c1-4烷氧基、-nr11cr11d、-c(=o)r12或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在另一个更特定的实施方案中,r7为被1、2或3个独立选择的以下基团取代的c1-4烷基:f、cl、-cn、-oh、-o-ch3、-o-ch2ch3、-o-ch(ch3)2、-o-chf2、-o-cf3、-o-ch2chf2、-nr11cr11d或-c(=o)r12。在又一个更特定的实施方案中,r7为被一个氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基取代的c1-4烷基。在另外更特定的实施方案中,r7为-ch3、-ch2ch3或-ch2ch2ch3,其各自被1、2或3个独立选择的以下基团取代:f、cl、-cn、-oh、-o-ch3、-o-ch2ch3、-o-ch(ch3)2、-o-chf2、-o-cf3、-o-ch2chf2、-nr11cr11d或-c(=o)r12。在另一个更特定的实施方案中,r7为-ch3或-ch2ch3,其各自被一个氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基取代。在一个最特定的实施方案中,r7为-ch3、-ch2ch3或-ch2ch2ch3,其各自被1、2或3个独立选择的f、-cn、-oh、-o-ch3或-c(=o)r12取代。在另一个最特定的实施方案中,r7为-ch3或-ch2ch3,其各自被一个四氢呋喃基或吗啉基取代。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-nr11cr11d取代的c1-6烷基,且r11c和r11d均为h。在另一实施方案中,r11c和r11d中一者为h且另一者为c1-4烷基。在又一实施方案中,r11c和r11d均为c1-4烷基。在一个特定实施方案中,r11c和r11d中一者为h且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r11c和r11d为-ch3、-ch2ch3或-ch(ch3)2。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-nr11cr11d取代的c1-4烷基,且r11c和r11d均为h。在另一实施方案中,r11c和r11d中一者为h且另一者为c1-4烷基。在又一实施方案中,r11c和r11d均为c1-4烷基。在一个特定实施方案中,r11c和r11d中一者为h且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r11c和r11d为-ch3、-ch2ch3或-ch(ch3)2。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-6烷基,r12为-nr14ar14b且各r14a和r14b如前所述。在一个特定实施方案中,r14a和r14b均为h。在另一个特定实施方案中,r14a和r14b中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r14a和r14b均为c1-4烷基。在一个更特定的实施方案中,r14a和r14b中一者为h且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r14a和r14b为-ch3、-ch2ch3或-ch(ch3)2。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-4烷基,r12为-nr14ar14b且各r14a和r14b如前所述。在一个特定实施方案中,r14a和r14b均为h。在另一个特定实施方案中,r14a和r14b中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r14a和r14b均为c1-4烷基。在一个更特定的实施方案中,r14a和r14b中一者为h且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r14a和r14b为-ch3、-ch2ch3或-ch(ch3)2。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-6烷基,且r12为-oh。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-4烷基,且r12为-oh。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-6烷基,且r12为c1-4烷氧基。在一个特定实施方案中,r12为-o-ch3、-o-ch2ch3、-o-ch(ch3)2或-o-c(ch3)3。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-4烷基,且r12为c1-4烷氧基。在一个特定实施方案中,r12为-o-ch3、-o-ch2ch3、-o-ch(ch3)2或-o-c(ch3)3。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-6烷基,且r12为被一或多个独立选择的以下基团取代的c1-4烷氧基:c3-7环烷基、卤素、-nr15ar15b或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在一个特定实施方案中,r12为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个独立选择的以下基团取代:c3-7环烷基、卤素、-nr15ar15b或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在另一个特定实施方案中,r12为被1、2或3个独立选择的以下基团取代的c1-4烷氧基:c3-7环烷基、卤素、-nr15ar15b或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在又一个特定实施方案中,r12为被一或多个独立选择的以下基团取代的c1-4烷氧基:环丙基、环丁基、环戊基、f、cl、-nr15ar15b、氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。在一个更特定的实施方案中,r12为-o-ch3或-o-ch2ch3,其各自被1、2或3个以下基团取代:c3-7环烷基、卤素、-nr15ar15b或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在另一个更特定的实施方案中,r12为被1、2或3个以下基团取代的c1-4烷氧基:环丙基、环丁基或环戊基、f、-nr15ar15b或四氢呋喃基。在一个最特定的实施方案中,r12为-o-ch3或-o-ch2ch3,其各自被1、2或3个f取代。在另一个最特定的实施方案中,r12为-o-ch3或-o-ch2ch3,其各自被一个环丙基、环丁基、环戊基、-nr15ar15b或四氢呋喃基取代。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-6烷基,r12为被一或多个独立选择的-nr15ar15b取代的c1-4烷氧基,且r15a和r15b各自如前所述。在一个特定实施方案中,r15a和r15b均为h。在另一个特定实施方案中,r15a和r15b中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r15a和r15b均为c1-4烷基。在一个更特定的实施方案中,r15a和r15b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r15a和r15b均为-ch3、-ch2ch3或-ch(ch3)2。在一个最特定的实施方案中,r15a和r15b均为-ch2ch3。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-4烷基,且r12为被一或多个独立选择的c3-7环烷基或卤素取代的c1-4烷氧基。在一个特定实施方案中,r12为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个独立选择的c3-7环烷基或卤素取代。在另一个特定实施方案中,r12为被1、2或3个独立选择的c3-7环烷基或卤素取代的c1-4烷氧基。在又一个特定实施方案中,r12为被一或多个独立选择的环丙基、环丁基、环戊基、f或cl取代的c1-4烷氧基。在一个更特定的实施方案中,r12为-o-ch3或-o-ch2ch3,其各自被1、2或3个c3-7环烷基或卤素取代。在另一个更特定的实施方案中,r12为被1、2或3个环丙基、环丁基或环戊基或f取代的c1-4烷氧基。在一个最特定的实施方案中,r12为-o-ch3或-o-ch2ch3,其各自被1、2或3个f取代。在另一个最特定的实施方案中,r12为-o-ch3或-o-ch2ch3,其各自被一个环丙基、环丁基或环戊基取代。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-6烷基,且r12为-o-(包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基)。在一个特定实施方案中,r12为-o-氮杂环丁烷基、-o-氧杂环丁烷基、-o-吡咯烷基、-o-四氢呋喃基、-o-哌啶基、-o-四氢吡喃基、-o-四氢噻喃基、-o-吗啉基、-o-硫代吗啉基、-o-二噁烷基或-o-哌嗪基。在一个更特定的实施方案中,r12为-o-四氢呋喃基。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为被一或多个独立选择的-c(=o)r12取代的c1-6烷基,且r12为-o-(c3-7单环环烷基)。在一个特定实施方案中,r12为-o-环丙基、-o-环丁基或-o-环戊基。在一个更特定的实施方案中,r12为-o-环丙基。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为c3-7环烷基。在一个特定实施方案中,r7为环丙基、环丁基、环戊基或环己基。在一个更特定的实施方案中,r7为环丙基。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。在一个特定实施方案中,r7为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。在一个更特定的实施方案中,r7为氮杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、吗啉基或哌嗪基。
在一个实施方案中,本发明的化合物是式i至vf中任一者,其中r7为包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基,其被-c(=o)c1-4烷氧基或任选被-cn取代的c1-4烷基取代。在一个特定实施方案中,r7为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基,其各自被-c(=o)c1-4烷氧基或任选被-cn取代的c1-4烷基取代。在另一个特定实施方案中,r7为包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基,其被以下基团取代:-c(=o)-o-ch3、-c(=o)-o-ch2ch3、-c(=o)-o-ch(ch3)2、-c(=o)-o-c(ch3)3、-ch3、-ch2ch3、-ch(ch3)2、-ch2-cn、-ch2ch2-cn、-ch2ch(ch3)-cn或-ch(ch3)ch2-cn。在一个更特定的实施方案中,r7为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基,其各自被以下基团取代:-c(=o)-o-ch3、-c(=o)-o-ch2ch3、-c(=o)-o-ch(ch3)2、-c(=o)-o-c(ch3)3、-ch3、-ch2ch3、-ch(ch3)2、-ch2-cn、-ch2ch2-cn、-ch2ch(ch3)-cn或-ch(ch3)ch2-cn。在另外更特定的实施方案中,r7为氮杂环丁烷基、吡咯烷基、哌啶基或哌嗪基,其各自被以下基团取代:-c(=o)-o-ch3、-c(=o)-o-ch2ch3、-c(=o)-o-ch(ch3)2、-c(=o)-o-c(ch3)3、-ch3、-ch2ch3、-ch(ch3)2、-ch2-cn、-ch2ch2-cn、-ch2ch(ch3)-cn或-ch(ch3)ch2-cn。在另一个更特定的实施方案中,r7为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基,其各自被-c(=o)-o-c(ch3)3、-ch3、-ch2-cn或-ch2ch2-cn取代。在一个最特定的实施方案中,r7为氮杂环丁烷基、吡咯烷基、哌啶基或哌嗪基,其各自被-c(=o)-o-c(ch3)3、-ch3、-ch2-cn或-ch2ch2-cn取代。
在一个实施方案中,本发明的化合物是式i至iiif和va至vf中任一者,其中r3b为卤素或-oh。在一个特定实施方案中,r3b为f、cl或-oh。
在一个实施方案中,本发明的化合物是式i至iiif和va-f中任一者,其中r3b为c1-4烷基。在一个特定实施方案中,r3b为ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r3b为-ch3或-ch2ch3。在一个最特定的实施方案中,r3b为-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va-f中任一者,其中r3b为c1-4烷氧基。在一个特定实施方案中,r3b为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。在一个更特定的实施方案中,r3b为-o-ch3或-o-ch(ch3)2。在一个最特定的实施方案中,r3b为-o-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va-f中任一者,其中r3b为被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基。在一个特定实施方案中,r3b为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。在另一个特定实施方案中,r3b为被1、2或3个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基。在又一个特定实施方案中,r3b为被一或多个独立选择的f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷氧基。在一个更特定的实施方案中,r3b为-o-ch3或-o-ch2ch3,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。在另一个更特定的实施方案中,r3b为被1、2或3个f或cl取代的c1-4烷氧基。在又一个更特定的实施方案中,r3b为被一个-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷氧基。在另外更特定的实施方案中,r3b为被一或多个独立选择的f、-oh或-o-ch3取代的c1-4烷氧基。在甚至更特定的实施方案中,r3b为-o-ch3或-o-ch2ch3,其各自被1、2或3个f取代。在另一个甚至更特定的实施方案中,r3b为-o-ch3或-o-ch2ch3,其各自被一个-oh或-o-ch3取代。在一个最特定的实施方案中,r3b为-o-chf2。
在一个实施方案中,本发明的化合物是式i至iiif和va-f中任一者,其中r3b为-nr8ar8b,且r8a和r8b各自如前所述。在一个特定实施方案中,r8a和r8b均为h。在另一个特定实施方案中,r8a和r8b中一者为h,且另一者为任选被一个-oh或c1-4烷氧基取代的c1-4烷基。在又一个特定实施方案中,r8a和r8b均为任选被一个-oh或c1-4烷氧基取代的c1-4烷基。在一个更特定的实施方案中,r8a和r8b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r8a和r8b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2,其各自被一个-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代。在一个最特定的实施方案中,r3b为-nh-ch3、-nh-ch(ch3)2或-nh-ch2ch2-oh。
在一个实施方案中,本发明的化合物是式via、vib、vic、vid、vie或vif:
其中r3a、r7和z如上所述。
在一个实施方案中,本发明的化合物是式via至f中任一者,其中r7为c1-4烷基。在一个特定实施方案中,r7为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r7为-ch3或-ch2ch3。在一个最特定的实施方案中,r7为-ch3。
在一个实施方案中,本发明的化合物是式viia、viib、viic、viid、viie或viif:
其中r3a和z如上所述。
在一个实施方案中,本发明的化合物是式i至viif中任一者,其中r3a为卤素或-oh。在一个特定实施方案中,r3a为f、cl或-oh。
在一个实施方案中,本发明的化合物是式i至viif中任一者,其中r3a为c1-4烷基。在一个特定实施方案中,r3a为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r3a为-ch3或-ch2ch3。在一个最特定的实施方案中,r3a为-ch3。
在一个实施方案中,本发明的化合物是式i至viif中任一者,其中r3a为c1-4烷氧基。在一个特定实施方案中,r3a为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。在一个更特定的实施方案中,r3a为-o-ch3或-o-ch(ch3)2。在一个最特定的实施方案中,r3a为-o-ch3。
在一个实施方案中,本发明的化合物是式i至viif中任一者,其中r3a为被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基。在一个特定实施方案中,r3a为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。在另一个特定实施方案中,r3a为被1、2或3个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基。在又一个特定实施方案中,r3a为被一或多个独立选择的f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷氧基。在一个更特定的实施方案中,r3a为-o-ch3或-o-ch2ch3,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。在另一个更特定的实施方案中,r3a为被1、2或3个f或cl取代的c1-4烷氧基。在又一个更特定的实施方案中,r3a为被一个-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷氧基。在另外更特定的实施方案中,r3a为被一或多个独立选择的f、-oh或-o-ch3取代的c1-4烷氧基。在甚至更特定的实施方案中,r3a为-o-ch3或-o-ch2ch3,其各自被1、2或3个f取代。在另一个甚至更特定的实施方案中,r3a为-o-ch3或-o-ch2ch3,其各自被一个-oh或-o-ch3取代。在一个最特定的实施方案中,r3a为-o-chf2。
在一个实施方案中,本发明的化合物是式i至viif中任一者,其中r3a为-nr8ar8b,且r8a和r8b各自如前所述。在一个特定实施方案中,r8a和r8b均为h。在另一个特定实施方案中,r8a和r8b中一者为h,且另一者为任选被一个-oh或c1-4烷氧基取代的c1-4烷基。在又一个特定实施方案中,r8a和r8b均为任选被一个-oh或c1-4烷氧基取代的c1-4烷基。在一个更特定的实施方案中,r8a和r8b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r8a和r8b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2,其各自被一个-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代。在一个最特定的实施方案中,r3a为-nh-ch3、-nh-ch(ch3)2或-nh-ch2ch2-oh。
在一个实施方案中,本发明的化合物是式viiia、viiib、viiic或viiid:
其中z如上所述。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,且r5a和r5b如前所述。在一个特定实施方案中,r5a为h。在另一个特定实施方案中,r5a为c1-4烷基。在一个更特定的实施方案中,r5a为-ch3、-ch2ch3或-ch(ch3)2。在一个最特定的实施方案中,r5a为-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,且r5b为c1-6烷基。在一个特定实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2。在一个更特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或ch2ch(ch3)2。在一个最特定的实施方案中,r5b为-ch2ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,且r5b为被一或多个独立选择的r9取代的c1-6烷基。在一个特定实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2,其各自被一或多个独立选择的r9取代。在另一个特定实施方案中,r5b为被1、2或3个独立选择的r9取代的c1-6烷基。在一个更特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-c(ch3)3或-ch(ch3)ch(ch3)2,其各自被一或多个独立选择的r9取代。在另一个更特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2,其各自被1、2或3个独立选择的r9取代。在又一个更特定的实施方案中,r5b为被一个r9取代的c1-6烷基。在甚至更特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-c(ch3)3或-ch(ch3)ch(ch3)2,其各自被1、2或3个独立选择的r9取代。在另一个甚至更特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2,其各自被一个r9取代。在一个最特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-c(ch3)3或-ch(ch3)ch(ch3)2,其各自被一个r9取代。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r9取代的c1-6烷基,且r9为卤素、cn、-oh、c1-4烷氧基或-s(=o)2-c1-4烷基。在一个特定实施方案中,r9各自独立地为f、cl、-cn、-oh、-o-ch3、-o-ch2ch3、-o-ch(ch3)2、-s(=o)2-ch3、-s(=o)2-ch2ch3或-s(=o)2-ch(ch3)2。在一个更特定的实施方案中,r9各自独立地为f、-cn、-oh、-o-ch3或-s(=o)2-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r9取代的c1-6烷基,且r9为-nr11er11f,且r11e和r11f各自如前所述。在一个特定实施方案中,r11e和r11f均为h。在另一个特定实施方案中,r11e和r11f中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r11e和r11f均为c1-4烷基。在一个更特定的实施方案中,r11e和r11f中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r11e和r11f为-ch3、-ch2ch3或-ch(ch3)2。在一个最特定的实施方案中,r11e和r11f为-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r9取代的c1-6烷基,且r9为包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基。在一个特定实施方案中,r9为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。在一个更特定的实施方案中,r9为二噁烷基。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r9取代的c1-6烷基,且r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基。在一个特定实施方案中,r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、噁三唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基。在一个更特定的实施方案中,r9为咪唑基、吡唑基或吡啶基。在一个最特定的实施方案中,r9为吡啶基。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r9取代的c1-6烷基,且r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的c1-4烷基取代。在一个特定实施方案中,r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基,其各自被一或多个独立选择的c1-4烷基取代。在另一个特定实施方案中,r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个c1-4烷基取代。在又一个特定实施方案中,r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的-ch3、-ch2ch3或-ch(ch3)2取代。在一个更特定的实施方案中,r9为咪唑基或吡唑基,其各自被一或多个独立选择的c1-4烷基取代。在另一个更特定的实施方案中,r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基,其各自被一个c1-4烷基取代。在又一个更特定的实施方案中,r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基,其各自被一或多个独立选择的-ch3、-ch2ch3或-ch(ch3)2取代。在另外更特定的实施方案中,r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个-ch3、-ch2ch3或-ch(ch3)2取代。在另外更特定的实施方案中,r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个-ch3取代。在甚至更特定的实施方案中,r9为咪唑基或吡唑基,其各自被一个c1-4烷基取代。在另一个甚至更特定的实施方案中,r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基,其各自被一个-ch3、-ch2ch3或-ch(ch3)2取代。在又一个甚至更特定的实施方案中,r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个-ch3取代。在一个最特定的实施方案中,r9为咪唑基或吡唑基,其各自被一个-ch3取代。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,且r5b为c3-7环烷基。在一个特定实施方案中,r5b为环丙基、环丁基、环戊基或环己基。在一个更特定的实施方案中,r5b为环丙基、环丁基、环戊基。在一个最特定的实施方案中,r5b为环丙基。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,且r5b为被一或多个独立选择的r10取代的c3-7环烷基。在一个特定实施方案中,r5b为环丙基、环丁基、环戊基或环己基,其各自被一或多个独立选择的r10取代。在另一个特定实施方案中,r5b为被1、2或3个独立选择的r10取代的c3-7环烷基。在一个更特定的实施方案中,r5b为环丙基、环丁基、环戊基或环己基,其各自被1、2或3个独立选择的r10取代。在另一个更特定的实施方案中,r5b为被一个r10取代的c3-7环烷基。在一个最特定的实施方案中,r5b为环丙基、环丁基、环戊基或环己基,其各自被一个r10取代。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r10取代的c3-7环烷基,且r10为卤素、-oh或c1-4烷氧基。在一个特定实施方案中,r10为f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2。在一个更特定的实施方案中,r10为f、-oh或-o-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r10取代的c3-7环烷基,且r10为c1-4烷基。在一个特定实施方案中,r10为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r10为-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r10取代的c3-7环烷基,且r10为被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷基。在一个特定实施方案中,r10为-ch3、-ch2ch3或-ch(ch3)2,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。在另一个特定实施方案中,r10为被1、2或3个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷基。在又一个特定实施方案中,r10为被一或多个f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷基。在一个更特定的实施方案中,r10为被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的-ch3。在另一个更特定的实施方案中,r10为被一个卤素、-oh或c1-4烷氧基取代的c1-4烷基。在又一个更特定的实施方案中,r10为被一或多个独立选择的f或-oh取代的c1-4烷基。在另外更特定的实施方案中,r10为-ch3、-ch2ch3或-ch(ch3)2,其各自被1、2或3个独立选择的卤素、-oh或c1-4烷氧基取代。在另外更特定的实施方案中,r10为被1、2或3个独立选择的f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷基。在一个最特定的实施方案中,r10为-ch2f、-chf2、-cf3或-ch2-oh。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r10取代的c3-7环烷基,且r10为-nr11gr11h,且各r11g和r11h如前所述。在一个特定实施方案中,r11g和r11h均为h。在另一个特定实施方案中,r11g和r11h中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r11g和r11h均为c1-4烷基。在一个更特定的实施方案中,r11g和r11h中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r11g和r11h为-ch3、-ch2ch3或-ch(ch3)2。在一个最特定的实施方案中,r11g和r11h为-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,且r5b为包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基。在一个特定实施方案中,r5b为氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基或四氢噻喃基。在一个更特定的实施方案中,r5b为氧杂环丁烷基、硫杂环丁烷基或四氢噻喃基。在一个最特定的实施方案中,r5b为氧杂环丁烷基。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,且r5b为包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,该杂环烷基被一或多个氧代基取代。在一个特定实施方案中,r5b为氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基或四氢噻喃基,其各自被一或多个氧代基取代。在另一个特定实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,该杂环烷基被一个氧代基取代。在一个更特定的实施方案中,r5b为硫杂环丁烷基或四氢噻吩基,其各自被一或多个氧代基取代。在另一个更特定的实施方案中,r5b为氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基或四氢噻喃基,其各自被一个氧代基取代。在一个最特定的实施方案中,r5b为硫杂环丁烷基或四氢噻吩基,其各自被两个氧代基取代。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,且r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基。在一个特定实施方案中,r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基。在一个更特定的实施方案中,r5b为咪唑基、吡唑基、异噁唑基或嘧啶基。在一个最特定的实施方案中,r5b为异噁唑基。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a如前所述,且r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的c1-4烷基取代。在一个特定实施方案中,r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一或多个独立选择的c1-4烷基取代。在另一个特定实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个c1-4烷基取代。在又一个特定实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的-ch3、-ch2ch3或-ch(ch3)2取代。在一个更特定的实施方案中,r5b为咪唑基、吡唑基或嘧啶基,其各自被一或多个独立选择的c1-4烷基取代。在另一个更特定的实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个-ch3取代。在又一个更特定的实施方案中,r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一个c1-4烷基取代。在另外更特定的实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个-ch3、-ch2ch3或-ch(ch3)2取代。在甚至更特定的实施方案中,r5b为咪唑基、吡唑基或嘧啶基,其各自被一个c1-4烷基取代。在另一个甚至更特定的实施方案中,r5b为咪唑基、吡唑基或嘧啶基,其各自被一或多个-ch3、-ch2ch3或-ch(ch3)2取代。在又一个甚至更特定的实施方案中,r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一或多个-ch3取代。在另外甚至更特定的实施方案中,r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一个-ch3、-ch2ch3或-ch(ch3)2取代。在另外甚至更特定的实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个-ch3取代。在一个最特定的实施方案中,r5b为咪唑基、吡唑基或嘧啶基,其各自被一个-ch3取代。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为-nr5ar5b,r5a为h,且r5b为-ch2ch3、-ch2cf3、-ch(ch3)cf3或环丙基。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子。在一个特定实施方案中,z为氮杂环丁烷基、吡咯烷基、哌啶基、吗啉基、硫代吗啉基、哌嗪基、2-氮杂螺[3.3]庚基、1,6-二氮杂螺[3.3]庚基、2,6-二氮杂螺[3.3]庚基、1-氧杂-6-氮杂螺[3.3]庚基、2-氧杂-6-氮杂螺[3.3]庚基、1-硫杂-6-氮杂螺[3.3]庚基或2-硫杂-6-氮杂螺[3.3]庚基。在一个更特定的实施方案中,z为氮杂环丁烷基、吡咯烷基、哌啶基、2-氧杂-6-氮杂螺[3.3]庚基或2-硫杂-6-氮杂螺[3.3]庚基。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代。在一个特定实施方案中,z为氮杂环丁烷基、吡咯烷基、哌啶基、吗啉基、硫代吗啉基、哌嗪基、2-氮杂螺[3.3]庚基、1,6-二氮杂螺[3.3]庚基、2,6-二氮杂螺[3.3]庚基、1-氧杂-6-氮杂螺[3.3]庚基、2-氧杂-6-氮杂螺[3.3]庚基、1-硫杂-6-氮杂螺[3.3]庚基或2-硫杂-6-氮杂螺[3.3]庚基,其各自被1、2或3个独立选择的r6基团取代。在一个更特定的实施方案中,z为氮杂环丁烷基、吡咯烷基、哌啶基或2-硫杂-6-氮杂螺[3.3]庚基,其各自被1、2或3个独立选择的r6基团取代。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为氧代基、卤素、-cn、-oh、苯基、c3-7环烷基、c2-4炔基或-c(=o)-c1-4烷氧基。在一个特定实施方案中,r6为氧代基、f、cl、-cn、-oh、苯基、环丙基、环丁基、环戊基、-c≡ch、-c(=o)-o-ch3、-c(=o)-o-ch2ch3或-c(=o)-o-ch(ch3)2。在一个更特定的实施方案中,r6为氧代基、f、-cn、-oh、苯基、环丙基、-c≡ch或-c(=o)-o-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为-nr11ar11b,且r11a和r11b各自如前所述。在一个特定实施方案中,r11a和r11b均为h。在另一个特定实施方案中,r11a和r11b中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r11a和r11b均为c1-4烷基。在一个更特定的实施方案中,r11a和r11b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r11a和r11b为-ch3、-ch2ch3或-ch(ch3)2。在一个最特定的实施方案中,r11a和r11b为-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为c1-4烷氧基。在一个特定实施方案中,r6为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。在一个更特定的实施方案中,r6为-o-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为被一或多个卤素或苯基取代的c1-4烷氧基。在一个特定实施方案中,r6为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个卤素或苯基取代。在另一个特定实施方案中,r6为被1、2或3个卤素或苯基取代的c1-4烷氧基。在又一个特定实施方案中,r6为被一或多个f、cl或苯基取代的c1-4烷氧基。在一个更特定的实施方案中,r6为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个f、cl或苯基取代。在另一个更特定的实施方案中,r6为被1、2或3个f、cl或苯基取代的c1-4烷氧基。在又一个更特定的实施方案中,r6为被1、2或3个卤素或苯基取代的-o-ch3。在一个最特定的实施方案中,r6为被1、2或3个f取代的-o-ch3。在另一个最特定的实施方案中,r6为被一个苯基取代的-o-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为c1-4烷基。在一个特定实施方案中,r6为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r6为-ch3或-ch2ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为被一或多个卤素、-oh或c1-4烷氧基取代的c1-4烷基。在一个特定实施方案中,r6为被一或多个卤素、-oh或c1-4烷氧基取代的-ch3、-ch2ch3或-ch(ch3)2。在另一个特定实施方案中,r6为被1、2或3个卤素、-oh或c1-4烷氧基取代的c1-4烷基。在又一个特定实施方案中,r6为被一或多个f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷基。在一个更特定的实施方案中,r6为被1、2或3个卤素、-oh或c1-4烷氧基取代的-ch3。在另一个更特定的实施方案中,r6为被1、2或3个f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷基。在另外更特定的实施方案中,r6为-ch3、-ch2ch3或-ch(ch3)2,其各自被1、2或3个f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代。在一个最特定的实施方案中,r6为被1、2或3个f或-oh取代的-ch3。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基。在一个特定实施方案中,r6为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。在一个更特定的实施方案中,r6为四氢吡喃基或吗啉基。
在一个实施方案中,本发明的化合物是式i至iiif和va至viiid中任一者,其中z为
在一个实施方案中,本发明的化合物是式i,其中该化合物选自:
n-乙基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-(3-吡啶基)苯并咪唑-1-基]苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-(6-吗啉基代-3-吡啶基)苯并咪唑-1-基]苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-[1-(2-吗啉代基乙基)吡唑-4-基]苯并咪唑-1-基]苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-n-(2-羟基乙基)-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-甲基-苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
4-[5-(1,3-二甲基吡唑-4-基)苯并咪唑-1-基]-n-乙基-2,6-二甲氧基-苯甲酰胺,
n-乙基-4-[6-(1-乙基吡唑-4-基)吡唑并[1,5-a]嘧啶-3-基]-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-n-(2-氟乙基)-2,6-二甲氧基-苯甲酰胺,
n-(2,2-二氟乙基)-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-[1-(2-甲氧基乙基)吡唑-4-基]苯并咪唑-1-基]苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-(1-四氢吡喃-4-基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
4-[5-[1-(氰基甲基)吡唑-4-基]苯并咪唑-1-基]-n-乙基-2,6-二甲氧基-苯甲酰胺,
n-乙基-4-[5-[1-(2-羟基乙基)吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
2-(二氟甲氧基)-n-乙基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-6-甲氧基-苯甲酰胺,
4-[5-[1-(2-氨基-2-氧代-乙基)吡唑-4-基]苯并咪唑-1-基]-n-乙基-2,6-二甲氧基-苯甲酰胺,
n-环丙基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
4-[6-(1-乙基吡唑-4-基)吡唑并[1,5-a]嘧啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
n-(2,2-二氟乙基)-4-[6-(1-乙基吡唑-4-基)吡唑并[1,5-a]嘧啶-3-基]-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-丙基-苯甲酰胺,
n-乙基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2-羟基-6-甲氧基-苯甲酰胺,
n-(2,2-二氟乙基)-2,6-二甲氧基-4-[6-(1-甲基吡唑-4-基)吡唑并[1,5-a]嘧啶-3-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丁基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2-甲氧基乙基)-n-甲基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-n-异丁基-2,6-二甲氧基-n-甲基-苯甲酰胺,
4-[6-(1-乙基吡唑-4-基)咪唑并[4,5-b]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-甲基-苯甲酰胺,
n-(氰基甲基)-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-甲基-苯甲酰胺,
2,6-二甲氧基-4-[5-(6-吗啉代-3-吡啶基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[1-(2-羟基乙基)吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(6-吡咯烷-1-基-3-吡啶基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(5-甲氧基-3-吡啶基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(6-氰基-3-吡啶基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[6-(二甲氨基)-3-吡啶基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(6-氨基-3-吡啶基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-吡啶基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[1-(氰基甲基)吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(2-吗啉代乙基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(4-哌啶基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-叔丁基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(3,3,3-三氟丙基)苯甲酰胺,
n-环戊基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(1-甲基-4-哌啶基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(1h-吡唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-[(2r)-2-甲基环丙基]苯甲酰胺,
n-(氰基甲基)-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
4-(5-异噁唑-4-基苯并咪唑-1-基)-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[6-(1-甲基吡唑-4-基)吡唑并[1,5-a]嘧啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-6-甲氧基-苯甲酰胺,
4-[5-[1-(氰基甲基)吡唑-4-基]苯并咪唑-1-基]-n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[5-[1-(2-吗啉代乙基)吡唑-4-基]苯并咪唑-1-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[5-[1-(2-吗啉代乙基)吡唑-4-基]苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-[(1r)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
n-(2-氰基乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-(3-甲氧基丙基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-[(1-甲基吡唑-3-基)甲基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-(2-吡啶基甲基)苯甲酰胺,
n-(3-羟基丙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(1,1-二氧代硫杂环丁烷-3-基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-(2-甲基磺酰基乙基)苯甲酰胺,
n-(1,1-二氧代硫杂环戊烷-3-基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[[(2r)-1,4-二噁烷-2-基]甲基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟-1,1-二甲基-乙基)苯甲酰胺,
n-[[(2s)-1,4-二噁烷-2-基]甲基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-(5-甲基吡嗪-2-基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-[(1-甲基咪唑-2-基)甲基]-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-异噁唑-3-基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-(2-甲基吡唑-3-基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(氰基甲基)-2,6-二甲氧基-n-甲基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(氰基甲基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-叔丁基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-环丁基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(2,2-二氟乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(2-氟乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-[(1s)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
2,6-二甲氧基-n-(1-甲基吡唑-3-基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-(1-甲基咪唑-4-基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-(1-甲基吡唑-4-基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(2-甲氧基乙基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(氧杂环丁烷-3-基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(1-氰基乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-3-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-(2,2-二氟环戊基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(2,2-二氟-1-甲基-乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-(氧杂环丁烷-3-基)苯甲酰胺,
2,6-二甲氧基-4-(5-哒嗪-4-基苯并咪唑-1-基)-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[1-(氮杂环丁烷-3-基)吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(1-异丙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(1-环丙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[1-(二氟甲基)吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(1-甲基氮杂环丁烷-3-基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[6-(1-甲基吡唑-4-基)吡唑并[1,5-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[1-[1-(氰基甲基)氮杂环丁烷-3-基]吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基-1h-吡唑-5-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-丙基吡唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-(5-嘧啶-5-基苯并咪唑-1-基)-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(2-甲氧基嘧啶-5-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(2-甲氧基-4-吡啶基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-b]哒嗪-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基异噁唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基异噁唑-5-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(1-异丁基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(四氢呋喃-2-基甲基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-b]哒嗪-3-基]苯甲酰胺,
n-异丁基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-仲丁基-苯甲酰胺,
n-异丙基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[6-(1-甲基吡唑-4-基)吡唑并[1,5-a]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-b]哒嗪-3-基]苯甲酰胺,
n-环丙基-2-异丙氧基-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-[2-(4-甲基哌嗪-1-基)-4-吡啶基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(6-甲基哒嗪-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-(氰基甲基)-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-(3-甲基异噁唑-5-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-(3,3-二氟环丁基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(5-甲基-1,2,4-噁二唑-3-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(5-甲基-4h-1,2,4-三唑-3-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-(5-吡嗪-2-基苯并咪唑-1-基)-n-(2,2,2-三氟乙基)苯甲酰胺,
n-异丁基-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-(1,1-二氧代硫杂环丁烷-3-基)-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2,6-二甲氧基-n-(2-甲氧基乙基)-n-甲基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1s)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
n-(2,2-二氟乙基)-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基咪唑-2-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基咪唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[5-(5-甲基-1,2,4-噁二唑-3-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基咪唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(2,3-二甲基咪唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
n-[(1r,2r)-2-氨基环己基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2r)-2-羟基环戊基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2s)-2-羟基环戊基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
(3,3-二氟氮杂环丁烷-1-基)-[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]甲酮,
n-[(1r,2r)-2-羟基环戊基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2s)-2-氟环丙基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-(7-哒嗪-4-基咪唑并[1,2-a]吡啶-3-基)苯甲酰胺,
4-[7-(6-氰基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-2-(二氟甲氧基)-n-乙基-6-甲氧基-苯甲酰胺,
4-[4-[3-[3-(二氟甲氧基)-4-(乙基氨甲酰基)-5-甲氧基-苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]哌啶-1-甲酸叔丁酯,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-[1-(1-甲基-4-哌啶基)吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-[1-(4-哌啶基)吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[5-(5-甲基-4h-1,2,4-三唑-3-基)苯并咪唑-1-基]苯甲酰胺,
2-(二氟甲氧基)-4-[7-[1-(二氟甲基)吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]-n-乙基-6-甲氧基-苯甲酰胺,
2,6-二甲氧基-4-[5-(2-甲基-1h-咪唑-5-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(1h-咪唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基吡唑-1-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(4-甲基咪唑-1-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-[(1r,2r)-2-(羟基甲基)环丙基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2r)-2-(二氟甲基)环丙基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2s)-2-(二氟甲基)环丙基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2r)-2-羟基环丁基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基三唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-n-(2-甲氧基环己基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
氮杂环丁烷-1-基-[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]甲酮,
n-(2-氨基乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1s,2s)-2-羟基环己基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
4-[5-(3,5-二甲基吡唑-1-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基-1,2,4-三唑-1-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(5-甲基-1,3,4-噁二唑-2-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(4,5-二甲基-1,2,4-三唑-3-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基-1,2,4-噁二唑-5-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-[(1s,2s)-2-羟基环丁基]-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-异丙基-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-[(1s,2s)-2-(二氟甲基)环丙基]-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
(3,3-二氟氮杂环丁烷-1-基)-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯基]甲酮,
2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1r)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
2-乙基-7-氟-5-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]异吲哚啉-1-酮,
2-乙基-7-甲氧基-5-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]异吲哚啉-1-酮,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[6-(1-甲基吡唑-4-基)咪唑并[4,5-b]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-(1-甲基咪唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3,3-二甲基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-苯基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2,4-二甲基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2-甲基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-[3-(羟基甲基)氮杂环丁烷-1-基]甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-羟基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-[3-(二甲氨基)氮杂环丁烷-1-基]甲酮,
(3-苄氧基氮杂环丁烷-1-基)-[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2-苯基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-吗啉代氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2,2,4-三甲基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-甲氧基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-四氢吡喃-4-基氮杂环丁烷-1-基)甲酮,
1-[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰基]氮杂环丁烷-3-甲腈,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-[2-(羟基甲基)氮杂环丁烷-1-基]甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2,2-二氧代-2λ6-硫杂-6-氮杂螺[3.3]庚烷-6-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-苯基吡咯烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(4-氟-1-哌啶基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-[4-(三氟甲氧基)-1-哌啶基]甲酮,
n-叔丁基-2-(二氟甲氧基)-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[2-甲基-1-(三氟甲基)丙基]苯甲酰胺,
2-乙基-7-(2-羟基乙基氨基)-5-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]异吲哚啉-1-酮,
2-乙基-7-(2-羟基乙基氨基)-5-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]异吲哚啉-1-酮,
2-氟-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-甲氧基-6-(甲氨基)-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-(2-羟基乙基氨基)-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-甲氧基-6-甲基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-氯-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯基]-(3,3-二甲基氮杂环丁烷-1-基)甲酮,
1-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰基]氮杂环丁烷-3-甲腈,
1-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰基]吡咯烷-3-甲腈,
(3,3-二氟吡咯烷-1-基)-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯基]甲酮,
(4,4-二氟-1-哌啶基)-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯基]甲酮,
[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯基]-[3-(三氟甲基)氮杂环丁烷-1-基]甲酮,
8-甲氧基-6-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-3,4-二氢-2h-异喹啉-1-酮,
2,6-二甲氧基-4-[7-(1-甲基咪唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1r)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
2,6-二甲氧基-4-[7-(1-甲基咪唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1s)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-羟基-3-甲基-氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-乙基-3-羟基-氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-[3-羟基-3-(三氟甲基)氮杂环丁烷-1-基]甲酮,
(3-环丙基-3-羟基-氮杂环丁烷-1-基)-[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-乙炔基-3-羟基-氮杂环丁烷-1-基)甲酮,
2,6-二甲氧基-4-[7-(1h-吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1r)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
2,6-二甲氧基-4-[7-(3-甲基异噁唑-5-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1r)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
2,6-二甲氧基-4-[7-(3-甲基异噁唑-5-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1s)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
8-甲氧基-6-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-2-(2,2,2-三氟乙基)-3,4-二氢异喹啉-1-酮,
1-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰基]氮杂环丁烷-3-甲酸甲酯,
2,6-二甲氧基-4-[7-(1h-吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸叔丁酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸乙酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸异丙酯,
2,6-二甲氧基-4-[7-(3-甲基异噁唑-5-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-羟基-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸环丙酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸2-氟乙酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸甲酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸四氢呋喃-3-基酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸环丁基甲酯,
2,6-二甲氧基-4-[7-(6-甲氧基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-(6-氰基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(2-甲氧基嘧啶-5-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-(7-嘧啶-5-基咪唑并[1,2-a]吡啶-3-基)-n-(2,2,2-三氟乙基)苯甲酰胺,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丙酸叔丁酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丙酸甲酯,
2,6-二甲氧基-4-[7-(5-甲氧基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-(2-氨基嘧啶-5-基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-(7-哒嗪-4-基咪唑并[1,2-a]吡啶-3-基)-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-(5-乙氧基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-[1-甲基-3-(三氟甲基)吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(2-甲氧基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(6-吗啉代-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(6-甲基哒嗪-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-(4-异丙基嘧啶-5-基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丙酸,
4-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丁酸,
4-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丁酸甲酯,
4-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丁酸乙酯,
4-[7-(4-氰基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
3-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡啶-4-甲酰胺,
3-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]氮杂环丁烷-1-甲酸叔丁酯,
7-甲氧基-5-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-2-(2,2,2-三氟乙基)异吲哚啉-1-酮,
2-环丙基-8-甲氧基-6-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-3,4-二氢异喹啉-1-酮,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丙酸乙酯,
4-[7-[1-[1-(2-氰基乙基)氮杂环丁烷-3-基]吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-[1-[1-(氰基甲基)氮杂环丁烷-3-基]吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-2,6-双(三氘代甲氧基)-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(6-甲氧基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
4-[7-(2-氰基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(6-甲基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(3-甲基异噁唑-5-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2,6-二氟-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(6-甲基哒嗪-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(6-甲基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(3-甲基咪唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
8-甲氧基-6-[7-(6-甲基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]-2-(2,2,2-三氟乙基)-3,4-二氢异喹啉-1-酮,
n-环丙基-2-氟-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(异丙基氨基)-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-甲氧基-6-(2-甲氧基乙氧基)-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(2-羟基乙氧基)-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(6-甲氧基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-[6-(三氟甲基)哒嗪-3-基]咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
4-[7-(6-氰基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]-n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-4-[7-[6-(二甲氨基)哒嗪-3-基]咪唑并[1,2-a]吡啶-3-基]-6-甲氧基-苯甲酰胺,
2-[4-[3-[4-(环丙基氨甲酰基)-3-(二氟甲氧基)-5-甲氧基-苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸乙酯,
n-环丙基-4-[7-(6-环丙基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(6-吗啉代哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
7-[5-(5-氟-3-吡啶基)苯并咪唑-1-基]-5-甲氧基-2,3-二氢-1,3-苯并噁嗪-4-酮,
5-甲氧基-7-[5-(5-甲氧基-3-吡啶基)苯并咪唑-1-基]-2,3-二氢-1,3-苯并噁嗪-4-酮,
7-[5-(3-氟-2-吡啶基)苯并咪唑-1-基]-5-甲氧基-2,3-二氢-1,3-苯并噁嗪-4-酮,
7-[5-(2-异丙基噻唑-4-基)苯并咪唑-1-基]-5-甲氧基-2,3-二氢-1,3-苯并噁嗪-4-酮,
3-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]-2-甲基-丙酸乙酯,
2-[[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]甲基]-3-甲基-丁酸乙酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]-2-甲基-丙酸乙酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]-3-甲基-丁酸乙酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸四氢呋喃-2-基甲酯,
2-[3-[4-(环丙基氨甲酰基)-3-(二氟甲氧基)-5-甲氧基-苯基]-7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-6-基]氧基乙酸乙酯,
2-[3-[4-(环丙基氨甲酰基)-3-(二氟甲氧基)-5-甲氧基-苯基]-7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-6-基]氧基乙酸,
4-[6-苄氧基-7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺,
4-[6-(1-氰基乙氧基)-7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺,
2-[3-[4-(环丙基氨甲酰基)-3-(二氟甲氧基)-5-甲氧基-苯基]-7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-6-基]氧基丙酸乙酯,
2-[3-[4-(环丙基氨甲酰基)-3-(二氟甲氧基)-5-甲氧基-苯基]-7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-6-基]氧基丙酸,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]-2-甲基-丙酸,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]-2-甲基-丙酸2-(二乙基氨基)乙酯,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[5-(1h-吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,和
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(1h-吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺。
在一个实施方案中,本发明的化合物是式i,其中该化合物选自:
n-乙基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-(3-吡啶基)苯并咪唑-1-基]苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-(6-吗啉代-3-吡啶基)苯并咪唑-1-基]苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-[1-(2-吗啉代乙基)吡唑-4-基]苯并咪唑-1-基]苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-n-(2-羟基乙基)-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-甲基-苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
4-[5-(1,3-二甲基吡唑-4-基)苯并咪唑-1-基]-n-乙基-2,6-二甲氧基-苯甲酰胺,
n-乙基-4-[6-(1-乙基吡唑-4-基)吡唑并[1,5-a]嘧啶-3-基]-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-n-(2-氟乙基)-2,6-二甲氧基-苯甲酰胺,
n-(2,2-二氟乙基)-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-[1-(2-甲氧基乙基)吡唑-4-基]苯并咪唑-1-基]苯甲酰胺,
n-乙基-2,6-二甲氧基-4-[5-(1-四氢吡喃-4-基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
4-[5-[1-(氰基甲基)吡唑-4-基]苯并咪唑-1-基]-n-乙基-2,6-二甲氧基-苯甲酰胺,
n-乙基-4-[5-[1-(2-羟基乙基)吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
2-(二氟甲氧基)-n-乙基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-6-甲氧基-苯甲酰胺,
4-[5-[1-(2-氨基-2-氧代-乙基)吡唑-4-基]苯并咪唑-1-基]-n-乙基-2,6-二甲氧基-苯甲酰胺,
n-环丙基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
4-[6-(1-乙基吡唑-4-基)吡唑并[1,5-a]嘧啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
n-(2,2-二氟乙基)-4-[6-(1-乙基吡唑-4-基)吡唑并[1,5-a]嘧啶-3-基]-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-丙基-苯甲酰胺,
n-乙基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2-羟基-6-甲氧基-苯甲酰胺,
n-(2,2-二氟乙基)-2,6-二甲氧基-4-[6-(1-甲基吡唑-4-基)吡唑并[1,5-a]嘧啶-3-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丁基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2-甲氧基乙基)-n-甲基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-n-异丁基-2,6-二甲氧基-n-甲基-苯甲酰胺,
4-[6-(1-乙基吡唑-4-基)咪唑并[4,5-b]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-甲基-苯甲酰胺,
n-(氰基甲基)-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-甲基-苯甲酰胺,
2,6-二甲氧基-4-[5-(6-吗啉代-3-吡啶基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[1-(2-羟基乙基)吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(6-吡咯烷-1-基-3-吡啶基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(5-甲氧基-3-吡啶基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(6-氰基-3-吡啶基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[6-(二甲氨基)-3-吡啶基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(6-氨基-3-吡啶基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-吡啶基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[1-(氰基甲基)吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(2-吗啉代乙基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(4-哌啶基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-叔丁基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(3,3,3-三氟丙基)苯甲酰胺,
n-环戊基-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(1-甲基-4-哌啶基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(1h-吡唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-[(2r)-2-甲基环丙基]苯甲酰胺,
n-(氰基甲基)-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-苯甲酰胺,
4-(5-异噁唑-4-基苯并咪唑-1-基)-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[6-(1-甲基吡唑-4-基)吡唑并[1,5-a]嘧啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-4-[5-(1-乙基吡唑-4-基)苯并咪唑-1-基]-6-甲氧基-苯甲酰胺,
4-[5-[1-(氰基甲基)吡唑-4-基]苯并咪唑-1-基]-n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[5-[1-(2-吗啉代乙基)吡唑-4-基]苯并咪唑-1-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[5-[1-(2-吗啉代乙基)吡唑-4-基]苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-[(1r)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
n-(2-氰基乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-(3-甲氧基丙基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-[(1-甲基吡唑-3-基)甲基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-(2-吡啶基甲基)苯甲酰胺,
n-(3-羟基丙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(1,1-二氧代硫杂环丁烷-3-基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-(2-甲基磺酰基乙基)苯甲酰胺,
n-(1,1-二氧代硫杂环戊烷-3-基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[[(2r)-1,4-二噁烷-2-基]甲基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟-1,1-二甲基-乙基)苯甲酰胺,
n-[[(2s)-1,4-二噁烷-2-基]甲基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-(5-甲基吡嗪-2-基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-[(1-甲基咪唑-2-基)甲基]-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-异噁唑-3-基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-(2-甲基吡唑-3-基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(氰基甲基)-2,6-二甲氧基-n-甲基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(氰基甲基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-叔丁基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-环丁基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(2,2-二氟乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(2-氟乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-[(1s)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
2,6-二甲氧基-n-(1-甲基吡唑-3-基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-(1-甲基咪唑-4-基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-n-(1-甲基吡唑-4-基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(2-甲氧基乙基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(氧杂环丁烷-3-基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(1-氰基乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-3-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-(2,2-二氟环戊基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-(2,2-二氟-1-甲基-乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-(氧杂环丁烷-3-基)苯甲酰胺,
2,6-二甲氧基-4-(5-哒嗪-4-基苯并咪唑-1-基)-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[1-(氮杂环丁烷-3-基)吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(1-异丙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(1-环丙基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[1-(二氟甲基)吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(1-甲基氮杂环丁烷-3-基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[6-(1-甲基吡唑-4-基)吡唑并[1,5-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-[1-[1-(氰基甲基)氮杂环丁烷-3-基]吡唑-4-基]苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基-1h-吡唑-5-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-丙基吡唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-(5-嘧啶-5-基苯并咪唑-1-基)-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(2-甲氧基嘧啶-5-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(2-甲氧基-4-吡啶基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-b]哒嗪-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基异噁唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基异噁唑-5-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(1-异丁基吡唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-[1-(四氢呋喃-2-基甲基)吡唑-4-基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-b]哒嗪-3-基]苯甲酰胺,
n-异丁基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]-n-仲丁基-苯甲酰胺,
n-异丙基-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[6-(1-甲基吡唑-4-基)吡唑并[1,5-a]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-b]哒嗪-3-基]苯甲酰胺,
n-环丙基-2-异丙氧基-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-[2-(4-甲基哌嗪-1-基)-4-吡啶基]苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(6-甲基哒嗪-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-(氰基甲基)-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-(3-甲基异噁唑-5-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-(3,3-二氟环丁基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(5-甲基-1,2,4-噁二唑-3-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(5-甲基-4h-1,2,4-三唑-3-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-(5-吡嗪-2-基苯并咪唑-1-基)-n-(2,2,2-三氟乙基)苯甲酰胺,
n-异丁基-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-(1,1-二氧代硫杂环丁烷-3-基)-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2,6-二甲氧基-n-(2-甲氧基乙基)-n-甲基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1s)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
n-(2,2-二氟乙基)-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基咪唑-2-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基咪唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[5-(5-甲基-1,2,4-噁二唑-3-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基咪唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(2,3-二甲基咪唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
n-[(1r,2r)-2-氨基环己基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2r)-2-羟基环戊基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2s)-2-羟基环戊基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
(3,3-二氟氮杂环丁烷-1-基)-[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]甲酮,
n-[(1r,2r)-2-羟基环戊基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2s)-2-氟环丙基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-(7-哒嗪-4-基咪唑并[1,2-a]吡啶-3-基)苯甲酰胺,
4-[7-(6-氰基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-2-(二氟甲氧基)-n-乙基-6-甲氧基-苯甲酰胺,
4-[4-[3-[3-(二氟甲氧基)-4-(乙基氨甲酰基)-5-甲氧基-苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]哌啶-1-甲酸叔丁酯,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-[1-(1-甲基-4-哌啶基)吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-[1-(4-哌啶基)吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[5-(5-甲基-4h-1,2,4-三唑-3-基)苯并咪唑-1-基]苯甲酰胺,
2-(二氟甲氧基)-4-[7-[1-(二氟甲基)吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]-n-乙基-6-甲氧基-苯甲酰胺,
2,6-二甲氧基-4-[5-(2-甲基-1h-咪唑-5-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(1h-咪唑-4-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基吡唑-1-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(4-甲基咪唑-1-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-[(1r,2r)-2-(羟基甲基)环丙基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2r)-2-(二氟甲基)环丙基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2s)-2-(二氟甲基)环丙基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1r,2r)-2-羟基环丁基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[5-(1-甲基三唑-4-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-n-(2-甲氧基环己基)-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
氮杂环丁烷-1-基-[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]甲酮,
n-(2-氨基乙基)-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
n-[(1s,2s)-2-羟基环己基]-2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
4-[5-(3,5-二甲基吡唑-1-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基-1,2,4-三唑-1-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(5-甲基-1,3,4-噁二唑-2-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[5-(4,5-二甲基-1,2,4-三唑-3-基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[5-(3-甲基-1,2,4-噁二唑-5-基)苯并咪唑-1-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-[(1s,2s)-2-羟基环丁基]-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-异丙基-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-[(1s,2s)-2-(二氟甲基)环丙基]-2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
(3,3-二氟氮杂环丁烷-1-基)-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯基]甲酮,
2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1r)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
2-乙基-7-氟-5-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]异吲哚啉-1-酮,
2-乙基-7-甲氧基-5-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]异吲哚啉-1-酮,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[6-(1-甲基吡唑-4-基)咪唑并[4,5-b]吡啶-3-基]苯甲酰胺,
2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[7-(1-甲基咪唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3,3-二甲基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-苯基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2,4-二甲基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2-甲基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-[3-(羟基甲基)氮杂环丁烷-1-基]甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-羟基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-[3-(二甲氨基)氮杂环丁烷-1-基]甲酮,
(3-苄氧基氮杂环丁烷-1-基)-[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2-苯基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-吗啉代氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2,2,4-三甲基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-甲氧基氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-四氢吡喃-4-基氮杂环丁烷-1-基)甲酮,
1-[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰基]氮杂环丁烷-3-甲腈,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-[2-(羟基甲基)氮杂环丁烷-1-基]甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(2,2-二氧代-2λ6-硫杂-6-氮杂螺[3.3]庚烷-6-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-苯基吡咯烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(4-氟-1-哌啶基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-[4-(三氟甲氧基)-1-哌啶基]甲酮,
n-叔丁基-2-(二氟甲氧基)-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺,
2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[2-甲基-1-(三氟甲基)丙基]苯甲酰胺,
2-乙基-7-(2-羟基乙基氨基)-5-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]异吲哚啉-1-酮,
2-乙基-7-(2-羟基乙基氨基)-5-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]异吲哚啉-1-酮,
2-氟-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-甲氧基-6-(甲氨基)-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-(2-羟基乙基氨基)-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-甲氧基-6-甲基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-氯-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯基]-(3,3-二甲基氮杂环丁烷-1-基)甲酮,
1-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰基]氮杂环丁烷-3-甲腈,
1-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰基]吡咯烷-3-甲腈,
(3,3-二氟吡咯烷-1-基)-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯基]甲酮,
(4,4-二氟-1-哌啶基)-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯基]甲酮,
[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯基]-[3-(三氟甲基)氮杂环丁烷-1-基]甲酮,
8-甲氧基-6-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-3,4-二氢-2h-异喹啉-1-酮,
2,6-二甲氧基-4-[7-(1-甲基咪唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1r)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
2,6-二甲氧基-4-[7-(1-甲基咪唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1s)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-羟基-3-甲基-氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-乙基-3-羟基-氮杂环丁烷-1-基)甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-[3-羟基-3-(三氟甲基)氮杂环丁烷-1-基]甲酮,
(3-环丙基-3-羟基-氮杂环丁烷-1-基)-[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]甲酮,
[2,6-二甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯基]-(3-乙炔基-3-羟基-氮杂环丁烷-1-基)甲酮,
2,6-二甲氧基-4-[7-(1h-吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1r)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
2,6-二甲氧基-4-[7-(3-甲基异噁唑-5-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1r)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
2,6-二甲氧基-4-[7-(3-甲基异噁唑-5-基)咪唑并[1,2-a]吡啶-3-基]-n-[(1s)-2,2,2-三氟-1-甲基-乙基]苯甲酰胺,
8-甲氧基-6-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-2-(2,2,2-三氟乙基)-3,4-二氢异喹啉-1-酮,
1-[2,6-二甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰基]氮杂环丁烷-3-甲酸甲酯,
2,6-二甲氧基-4-[7-(1h-吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸叔丁酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸乙酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸异丙酯,
2,6-二甲氧基-4-[7-(3-甲基异噁唑-5-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-羟基-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸环丙酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸2-氟乙酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸甲酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸四氢呋喃-3-基酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸环丁基甲酯,
2,6-二甲氧基-4-[7-(6-甲氧基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-(6-氰基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(2-甲氧基嘧啶-5-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-(7-嘧啶-5-基咪唑并[1,2-a]吡啶-3-基)-n-(2,2,2-三氟乙基)苯甲酰胺,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丙酸叔丁酯,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丙酸甲酯,
2,6-二甲氧基-4-[7-(5-甲氧基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-(2-氨基嘧啶-5-基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-(7-哒嗪-4-基咪唑并[1,2-a]吡啶-3-基)-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-(5-乙氧基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-[1-甲基-3-(三氟甲基)吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(2-甲氧基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(6-吗啉代-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(6-甲基哒嗪-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-(4-异丙基嘧啶-5-基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丙酸,
4-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丁酸,
4-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丁酸甲酯,
4-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丁酸乙酯,
4-[7-(4-氰基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
3-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡啶-4-甲酰胺,
3-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]氮杂环丁烷-1-甲酸叔丁酯,
7-甲氧基-5-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-2-(2,2,2-三氟乙基)异吲哚啉-1-酮,
2-环丙基-8-甲氧基-6-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-3,4-二氢异喹啉-1-酮,
2-[4-[3-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]丙酸乙酯,
4-[7-[1-[1-(2-氰基乙基)氮杂环丁烷-3-基]吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-[1-[1-(氰基甲基)氮杂环丁烷-3-基]吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-2,6-双(三氘代甲氧基)-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(6-甲氧基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
4-[7-(2-氰基-3-吡啶基)咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺,
2,6-二甲氧基-4-[7-(6-甲基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(3-甲基异噁唑-5-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
2,6-二氟-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]-n-(2,2,2-三氟乙基)苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(6-甲基哒嗪-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(6-甲基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(3-甲基咪唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
8-甲氧基-6-[7-(6-甲基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]-2-(2,2,2-三氟乙基)-3,4-二氢异喹啉-1-酮,
n-环丙基-2-氟-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(异丙基氨基)-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-甲氧基-6-(2-甲氧基乙氧基)-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(2-羟基乙氧基)-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(6-甲氧基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-[6-(三氟甲基)哒嗪-3-基]咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
4-[7-(6-氰基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]-n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-4-[7-[6-(二甲氨基)哒嗪-3-基]咪唑并[1,2-a]吡啶-3-基]-6-甲氧基-苯甲酰胺,
2-[4-[3-[4-(环丙基氨甲酰基)-3-(二氟甲氧基)-5-甲氧基-苯基]咪唑并[1,2-a]吡啶-7-基]吡唑-1-基]乙酸乙酯,
n-环丙基-4-[7-(6-环丙基哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺,
n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[7-(6-吗啉代哒嗪-3-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺,
7-[5-(5-氟-3-吡啶基)苯并咪唑-1-基]-5-甲氧基-2,3-二氢-1,3-苯并噁嗪-4-酮,
5-甲氧基-7-[5-(5-甲氧基-3-吡啶基)苯并咪唑-1-基]-2,3-二氢-1,3-苯并噁嗪-4-酮,
7-[5-(3-氟-2-吡啶基)苯并咪唑-1-基]-5-甲氧基-2,3-二氢-1,3-苯并噁嗪-4-酮和
7-[5-(2-异丙基噻唑-4-基)苯并咪唑-1-基]-5-甲氧基-2,3-二氢-1,3-苯并噁嗪-4-酮。
在一个实施方案中,本发明的化合物是式i,其中该化合物为n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺。
在一个实施方案中,本发明的化合物是式i,其中该化合物不是n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺。
在一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物:
其中,
w为cl、br、i、-nh2、-b(oh)2或4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基;
z为
--nr5ar5b,或
-n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,任选被1、2或3个独立选择的r6基团取代;
r3a和r3b独立地选自任选被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基;
r5a为h或c1-4烷基;
r5b选自
-任选被一或多个独立选择的r9取代的c1-6烷基,
-任选被一或多个独立选择的r10取代的c3-7环烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,该杂环烷基任选被一或多个氧代基取代,和
-包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的c1-4烷基取代;
r6各自独立地选自
-氧代基,
-卤素,
--cn,
--oh,
--nr11ar11b,
-苯基,
-c3-7环烷基,
-c2-4炔基,
--c(=o)-c1-4烷氧基,
-任选被一或多个卤素或苯基取代的c1-4烷氧基,
-任选被一或多个卤素、-oh或c1-4烷氧基取代的c1-4烷基,和
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基;
r9各自独立地选自
-卤素,
--cn,
--nr11er11f,
--oh,
-c1-4烷氧基,
--s(=o)2-c1-4烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,和
-包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的c1-4烷基取代;
r10各自独立地选自
-卤素,
-任选被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷基,
--oh,
-c1-4烷氧基,和
--nr11gr11h;
r11a、r11b、r11e、r11f、r11g和r11h各自独立地选自h和c1-4烷基。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3a为卤素或-oh。在一个特定实施方案中,r3a为f、cl或-oh。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3a为c1-4烷基。在一个特定实施方案中,r3a为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r3a为-ch3或-ch2ch3。在一个最特定的实施方案中,r3a为-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3a为c1-4烷氧基。在一个特定实施方案中,r3a为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。在一个更特定的实施方案中,r3a为-o-ch3或-o-ch(ch3)2。在一个最特定的实施方案中,r3a为-o-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3a为被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基。在一个特定实施方案中,r3a为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。在另一个特定实施方案中,r3a为被1、2或3个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基。在又一个特定实施方案中,r3a为被一或多个独立选择的f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷氧基。在一个更特定的实施方案中,r3a为-o-ch3或-o-ch2ch3,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。在另一个更特定的实施方案中,r3a为被1、2或3个f或cl取代的c1-4烷氧基。在又一个更特定的实施方案中,r3a为被一个-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷氧基。在另外更特定的实施方案中,r3a为被一或多个独立选择的f、-oh或-o-ch3取代的c1-4烷氧基。在甚至更特定的实施方案中,r3a为-o-ch3或-o-ch2ch3,其各自被1、2或3个f取代。在另一个甚至更特定的实施方案中,r3a为-o-ch3或-o-ch2ch3,其各自被一个-oh或-o-ch3取代。在一个最特定的实施方案中,r3a为-o-chf2。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3a为-nr8ar8b,且r8a和r8b各自如前所述。在一个特定实施方案中,r8a和r8b均为h。在另一个特定实施方案中,r8a和r8b中一者为h,且另一者为任选被一个-oh或c1-4烷氧基取代的c1-4烷基。在又一个特定实施方案中,r8a和r8b均为任选被一个-oh或c1-4烷氧基取代的c1-4烷基。在一个更特定的实施方案中,r8a和r8b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r8a和r8b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2,其各自被一个-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代。在一个最特定的实施方案中,r3a为-nh-ch3、-nh-ch(ch3)2或-nh-ch2ch2-oh。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3b为卤素或-oh。在一个特定实施方案中,r3b为f、cl或-oh。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3b为c1-4烷基。在一个特定实施方案中,r3b为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r3b为-ch3或-ch2ch3。在一个最特定的实施方案中,r3b为-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3b为c1-4烷氧基。在一个特定实施方案中,r3b为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。在一个更特定的实施方案中,r3b为-o-ch3或-o-ch(ch3)2。在一个最特定的实施方案中,r3b为-o-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3b为被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基。在一个特定实施方案中,r3b为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。在另一个特定实施方案中,r3b为被1、2或3个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基。在又一个特定实施方案中,r3b为被一或多个独立选择的f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷氧基。在一个更特定的实施方案中,r3b为-o-ch3或-o-ch2ch3,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。在另一个更特定的实施方案中,r3b为被1、2或3个f或cl取代的c1-4烷氧基。在又一个更特定的实施方案中,r3a为被一个-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷氧基。在另外更特定的实施方案中,r3b为被一或多个独立选择的f、-oh或-o-ch3取代的c1-4烷氧基。在甚至更特定的实施方案中,r3b为-o-ch3或-o-ch2ch3,其各自被1、2或3个f取代。在另一个甚至更特定的实施方案中,r3b为-o-ch3或-o-ch2ch3,其各自被一个-oh或-o-ch3取代。在一个最特定的实施方案中,r3b为-o-chf2。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3b为-nr8ar8b,且r8a和r8b各自如前所述。在一个特定实施方案中,r8a和r8b均为h。在另一个特定实施方案中,r8a和r8b中一者为h,且另一者为任选被一个-oh或c1-4烷氧基取代的c1-4烷基。在又一个特定实施方案中,r8a和r8b均为任选被一个-oh或c1-4烷氧基取代的c1-4烷基。在一个更特定的实施方案中,r8a和r8b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r8a和r8b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2,其各自被一个-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代。在一个最特定的实施方案中,r3a为-nh-ch3、-nh-ch(ch3)2或-nh-ch2ch2-oh。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,且r5a和r5b如前所述。在一个特定实施方案中,r5a为h。在另一个特定实施方案中,r5a为c1-4烷基。在一个更特定的实施方案中,r5a为-ch3、-ch2ch3或-ch(ch3)2。在一个最特定的实施方案中,r5a为-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,且r5b为c1-6烷基。在一个特定实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2。在一个更特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或-ch2ch(ch3)2。在一个最特定的实施方案中,r5b为-ch2ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,且r5b为被一或多个独立选择的r9取代的c1-6烷基。在一个特定实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2,其各自被一或多个独立选择的r9取代。在另一个特定实施方案中,r5b为被1、2或3个独立选择的r9取代的c1-6烷基。在一个更特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-c(ch3)3或-ch(ch3)ch(ch3)2,其各自被一或多个独立选择的r9取代。在另一个更特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2,其各自被1、2或3个独立选择的r9取代。在又一个更特定的实施方案中,r5b为被一个r9取代的c1-6烷基。在甚至更特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-c(ch3)3或-ch(ch3)ch(ch3)2,其各自被1、2或3个独立选择的r9取代。在另一个甚至更特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2,其各自被一个r9取代。在一个最特定的实施方案中,r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-c(ch3)3或-ch(ch3)ch(ch3)2,其各自被一个r9取代。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r9取代的c1-6烷基,且r9为卤素、-cn、-oh、c1-4烷氧基或-s(=o)2-c1-4烷基。在一个特定实施方案中,r9各自独立地为f、cl、-cn、-oh、-o-ch3、-o-ch2ch3、-o-ch(ch3)2、-s(=o)2-ch3、-s(=o)2-ch2ch3、-s(=o)2-ch(ch3)2。在一个更特定的实施方案中,r9各自独立地为f、-cn、-oh、-o-ch3或-s(=o)2-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r9取代的c1-6烷基,且r9为-nr11er11f,且r11e和r11f各自如前所述。在一个特定实施方案中,r11e和r11f均为h。在另一个特定实施方案中,r11e和r11f中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r11e和r11f均为c1-4烷基。在一个更特定的实施方案中,r11e和r11f中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r11e和r11f为-ch3、-ch2ch3或-ch(ch3)2。在一个最特定的实施方案中,r11e和r11f为-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r9取代的c1-6烷基,且r9为包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基。在一个特定实施方案中,r9为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。在一个更特定的实施方案中,r9为二噁烷基。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r9取代的c1-6烷基,且r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基。在一个特定实施方案中,r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、噁三唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基。在一个更特定的实施方案中,r9为咪唑基、吡唑基或吡啶基。在一个最特定的实施方案中,r9为吡啶基。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r9取代的c1-6烷基,且r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的c1-4烷基取代。在一个特定实施方案中,r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基,其各自被一或多个独立选择的c1-4烷基取代。在另一个特定实施方案中,r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个c1-4烷基取代。在又一个特定实施方案中,r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的-ch3、-ch2ch3或-ch(ch3)2取代。在一个更特定的实施方案中,r9为咪唑基或吡唑基,其各自被一或多个独立选择的c1-4烷基取代。在另一个更特定的实施方案中,r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基,其各自被一个c1-4烷基取代。在又一个更特定的实施方案中,r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基,其各自被一或多个独立选择的-ch3、-ch2ch3或-ch(ch3)2取代。在另外更特定的实施方案中,r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个-ch3、-ch2ch3或-ch(ch3)2取代。在又另外更特定的实施方案中,r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个-ch3取代。在甚至更特定的实施方案中,r9为咪唑基或吡唑基,其各自被一个c1-4烷基取代。在另一个甚至更特定的实施方案中,r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基,其各自被一个-ch3、-ch2ch3或-ch(ch3)2取代。在又一甚至更特定的实施方案中,r9为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个-ch3取代。在一个最特定的实施方案中,r9为咪唑基或吡唑基,其各自被一个-ch3取代。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,且r5b为c3-7环烷基。在一个特定实施方案中,r5b为环丙基、环丁基、环戊基或环己基。在一个更特定的实施方案中,r5b为环丙基、环丁基、环戊基。在一个最特定的实施方案中,r5b为环丙基。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,且r5b为被一或多个独立选择的r10取代的c3-7环烷基。在一个特定实施方案中,r5b为环丙基、环丁基、环戊基或环己基,其各自被一或多个独立选择的r10取代。在另一个特定实施方案中,r5b为被1、2或3个独立选择的r10取代的c3-7环烷基。在一个更特定的实施方案中,r5b为环丙基、环丁基、环戊基或环己基,其各自被1、2或3个独立选择的r10取代。在另一个更特定的实施方案中,r5b为被一个r10取代的c3-7环烷基。在一个最特定的实施方案中,r5b为环丙基、环丁基、环戊基或环己基,其各自被一个r10取代。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r10取代的c3-7环烷基,且r10为卤素、-oh或c1-4烷氧基。在一个特定实施方案中,r10为f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2。在一个更特定的实施方案中,r10为f、-oh或-o-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r10取代的c3-7环烷基,且r10为c1-4烷基。在一个特定实施方案中,r10为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r10为-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r10取代的c3-7环烷基,且r10为被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷基。在一个特定实施方案中,r10为-ch3、-ch2ch3或-ch(ch3)2,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。在另一个特定实施方案中,r10为被1、2或3个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷基。在又一个特定实施方案中,r10为被一或多个f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷基。在一个更特定的实施方案中,r10为被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的-ch3。在另一个更特定的实施方案中,r10为被一个卤素、-oh或c1-4烷氧基取代的c1-4烷基。在又一个更特定的实施方案中,r10为被一或多个独立选择的f或-oh取代的c1-4烷基。在另外更特定的实施方案中,r10为-ch3、-ch2ch3或-ch(ch3)2,其各自被1、2或3个独立选择的卤素、-oh或c1-4烷氧基取代。在另外更特定的实施方案中,r10为被1、2或3个独立选择的f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷基。在一个最特定的实施方案中,r10为-ch2f、-chf2、-cf3或-ch2-oh。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,r5b为被一或多个独立选择的r10取代的c3-7环烷基,且r10为-nr11gr11h,且r11g和r11h各自如前所述。在一个特定实施方案中,r11g和r11h均为h。在另一个特定实施方案中,r11g和r11h中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r11g和r11h均为c1-4烷基。在一个更特定的实施方案中,r11g和r11h中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r11g和r11h为-ch3、-ch2ch3或-ch(ch3)2。在一个最特定的实施方案中,r11g和r11h为-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,且r5b为包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基。在一个特定实施方案中,r5b为氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基或四氢噻喃基。在一个更特定的实施方案中,r5b为氧杂环丁烷基、硫杂环丁烷基或四氢噻喃基。在一个最特定的实施方案中,r5b为氧杂环丁烷基。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,且r5b为包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,该杂环烷基被一或多个氧代基取代。在一个特定实施方案中,r5b为氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基或四氢噻喃基,其各自被一或多个氧代基取代。在另一个特定实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,该杂环烷基被一个氧代基取代。在一个更特定的实施方案中,r5b为硫杂环丁烷基或四氢噻吩基,其各自被一或多个氧代基取代。在另一个更特定的实施方案中,r5b为氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基或四氢噻喃基,其各自被一个氧代基取代。在一个最特定的实施方案中,r5b为硫杂环丁烷基或四氢噻吩基,其各自被两个氧代基取代。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,且r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基。在一个特定实施方案中,r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基。在一个更特定的实施方案中,r5b为咪唑基、吡唑基、异噁唑基或嘧啶基。在一个最特定的实施方案中,r5b为异噁唑基。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a如前所述,且r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的c1-4烷基取代。在一个特定实施方案中,r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一或多个独立选择的c1-4烷基取代。在另一个特定实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个c1-4烷基取代。在又一个特定实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一或多个独立选择的-ch3、-ch2ch3或-ch(ch3)2取代。在一个更特定的实施方案中,r5b为咪唑基、吡唑基或嘧啶基,其各自被一或多个独立选择的c1-4烷基取代。在另一个更特定的实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个-ch3取代。在又一个更特定的实施方案中,r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一个c1-4烷基取代。在另外更特定的实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个-ch3、-ch2ch3或-ch(ch3)2取代。在甚至更特定的实施方案中,r5b为咪唑基、吡唑基或嘧啶基,其各自被一个c1-4烷基取代。在另一个甚至更特定的实施方案中,r5b为咪唑基、吡唑基或嘧啶基,其各自被一或多个-ch3、-ch2ch3或-ch(ch3)2取代。在又一甚至更特定的实施方案中,r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一或多个-ch3取代。在另外甚至更特定的实施方案中,r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一个-ch3、-ch2ch3或-ch(ch3)2取代。在另外甚至更特定的实施方案中,r5b为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基被一个-ch3取代。在一个最特定的实施方案中,r5b为咪唑基、吡唑基或嘧啶基,其各自被一个-ch3取代。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为-nr5ar5b,r5a为h,且r5b为-ch2ch3、-ch2cf3、-ch(ch3)cf3或环丙基。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子。在一个特定实施方案中,z为氮杂环丁烷基、吡咯烷基、哌啶基、吗啉基、硫代吗啉基、哌嗪基、2-氮杂螺[3.3]庚基、1,6-二氮杂螺[3.3]庚基、2,6-二氮杂螺[3.3]庚基、1-氧杂-6-氮杂螺[3.3]庚基、2-氧杂-6-氮杂螺[3.3]庚基、1-硫杂-6-氮杂螺[3.3]庚基或2-硫杂-6-氮杂螺[3.3]庚基。在一个更特定的实施方案中,z为氮杂环丁烷基、吡咯烷基、哌啶基、2-氧杂-6-氮杂螺[3.3]庚基或2-硫杂-6-氮杂螺[3.3]庚基。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代。在一个特定实施方案中,z为氮杂环丁烷基、吡咯烷基、哌啶基、吗啉基、硫代吗啉基、哌嗪基、2-氮杂螺[3.3]庚基、1,6-二氮杂螺[3.3]庚基、2,6-二氮杂螺[3.3]庚基、1-氧杂-6-氮杂螺[3.3]庚基、2-氧杂-6-氮杂螺[3.3]庚基、1-硫杂-6-氮杂螺[3.3]庚基或2-硫杂-6-氮杂螺[3.3]庚基,其各自被1、2或3个独立选择的r6基团取代。在一个更特定的实施方案中,z为氮杂环丁烷基、吡咯烷基、哌啶基或2-硫杂-6-氮杂螺[3.3]庚基,其各自被1、2或3个独立选择的r6基团取代。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为氧代基、卤素、-cn、-oh、苯基、c3-7环烷基、c2-4炔基或-c(=o)-c1-4烷氧基。在一个特定实施方案中,r6为氧代基、f、cl、-cn、-oh、苯基、环丙基、环丁基、环戊基、-c≡ch、-c(=o)-o-ch3、-c(=o)-o-ch2ch3或-c(=o)-o-ch(ch3)2。在一个更特定的实施方案中,r6为氧代基、f、-cn、-oh、苯基、环丙基、-c≡ch或-c(=o)-o-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为-nr11ar11b,且r11a和r11b各自如前所述。在一个特定实施方案中,r11a和r11b均为h。在另一个特定实施方案中,r11a和r11b中一者为h,且另一者为c1-4烷基。在又一个特定实施方案中,r11a和r11b均为c1-4烷基。在一个更特定的实施方案中,r11a和r11b中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。在另一个更特定的实施方案中,r11a和r11b为-ch3、-ch2ch3或-ch(ch3)2。在一个最特定的实施方案中,r11a和r11b为-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为c1-4烷氧基。在一个特定实施方案中,r6为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。在一个更特定的实施方案中,r6为-o-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为被一或多个卤素或苯基取代的c1-4烷氧基。在一个特定实施方案中,r6为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个卤素或苯基取代。在另一个特定实施方案中,r6为被1、2或3个卤素或苯基取代的c1-4烷氧基。在又一个特定实施方案中,r6为被一或多个f、cl或苯基取代的c1-4烷氧基。在一个更特定的实施方案中,r6为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个f、cl或苯基取代。在另一个更特定的实施方案中,r6为被1、2或3个f、cl或苯基取代的c1-4烷氧基。在又一个更特定的实施方案中,r6为被1、2或3个卤素或苯基取代的-o-ch3。在一个最特定的实施方案中,r6为被1、2或3个f取代的-o-ch3。在另一个最特定的实施方案中,r6为被一个苯基取代的-o-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为c1-4烷基。在一个特定实施方案中,r6为-ch3、-ch2ch3或-ch(ch3)2。在一个更特定的实施方案中,r6为-ch3或-ch2ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为被一或多个卤素、-oh或c1-4烷氧基取代的c1-4烷基。在一个特定实施方案中,r6为被一或多个卤素、-oh或c1-4烷氧基取代的-ch3、-ch2ch3或-ch(ch3)2。在另一个特定实施方案中,r6为被1、2或3个卤素、-oh或c1-4烷氧基取代的c1-4烷基。在又一个特定实施方案中,r6为被一或多个f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷基。在一个更特定的实施方案中,r6为被1、2或3个卤素、-oh或c1-4烷氧基取代的-ch3。在另一个更特定的实施方案中,r6为被1、2或3个f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷基。在另外更特定的实施方案中,r6为-ch3、-ch2ch3或-ch(ch3)2,其各自被1、2或3个f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代。在一个最特定的实施方案中,r6为被1、2或3个f或-oh取代的-ch3。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,被1、2或3个独立选择的r6基团取代,且r6为包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基。在一个特定实施方案中,r6为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。在一个更特定的实施方案中,r6为四氢吡喃基或吗啉基。
在另一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中z为
在一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3a为-o-ch3,r3b为-o-chf2,w为br,z为-nr5ar5b,r5a为h,且r5b为环丙基。
在一个实施方案中,本发明提供了用于制备本发明的化合物的式a化合物,其中r3a和r3b为-o-ch3,w为br,z为-nr5ar5b,r5a为h,且r5b为-ch2cf3。
在一个实施方案中,本发明的化合物不是同位素变体。
在一方面,如本文所述的实施方案中任一者的本发明的化合物作为游离碱存在。
在一方面,如本文所述的实施方案中任一者的本发明的化合物为可药用盐。
在一方面,如本文所述的实施方案中任一者的本发明的化合物为化合物的溶剂合物。
在一方面,如本文所述的实施方案中任一者的本发明的化合物为化合物的可药用盐的溶剂合物。
虽然上文已经分别地概括列出了各实施方案的具体群组,但是本发明的化合物包括其中上述化学式以及本文给出的其它化学式中的若干实施方案或各实施方案选自针对各变量分别指明的一个或多个特定成员或群组的化合物。因此,本发明的范围意欲包括这些实施方案的所有组合。
虽然上文已经分别地概括列出了各实施方案的具体群组,但是本发明的化合物可以是其中一个或多个变量(例如r基团)选自上文列出的化学式中任一者的一个或多个实施方案的化合物。因此,本发明的范围意欲包括来自所公开实施方案任一者的变量的所有组合。
或者,本发明还涵盖从群组或实施方案或其组合中排除一个或多个指定变量。
在一些方面,本发明提供了根据上述化学式的化合物的前药和衍生物。前药是本发明的化合物的衍生物,其具有可代谢裂解的基团,通过溶剂解或在生理条件下变成在体内具有药物活性的本发明的化合物。这类实例包括但不限于胆碱酯衍生物和类似物、n-烷基吗啉酯和类似物。
本发明的化合物的其它衍生物在其酸和酸衍生物形式下均具有活性,但是酸敏感形式通常在哺乳动物生物体中提供了溶解性、组织相容性或延缓释放的优点(bundgaard,1985)。前药包括本领域技术人员熟知的酸衍生物,例如通过母体酸与适宜醇反应制备的酯,或通过母体酸化合物与取代或未取代的胺反应制备的酰胺,或酸酐或混合酸酐。衍生自本发明的化合物上悬挂的酸基团的简单脂族或芳族酯、酰胺和酸酐是优选的前药。在一些情况下,期望制备双酯型前药,例如(酰氧基)烷基酯或((烷氧羰基)氧基)烷基酯。本发明的化合物的c1-c8烷基、c2-c8烯基、芳基、c7-c12被取代芳基和c7-c12芳基烷基酯是特别有用的。
条款
1.式i化合物:
其中,
x为n或cr4;
y1、y2和y3中一者为n且另两者为c;
z为
--nr5ar5b,
--nr5c-,其中该n原子和r3b与它们所连接的原子一起形成稠合5至6元杂环烯基,该杂环烯基包含一条双键且另外包含0、1或2个独立地选自n、o和s的额外杂原子,或
-n-连接的4至7元杂环烷基,其另外包含0、1或2个独立地选自n、o和s的额外杂原子,任选被1、2或3个独立选择的r6基团取代;
r1为h、卤素、c1-4烷基、或任选被c1-4烷氧基、苯基、-cn、-c(=o)oh或-c(=o)-c1-4烷氧基取代的c1-4烷氧基;
r2为包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的r7基团取代;
r3a和r3b独立地选自
-卤素,
-c1-4烷基,
-任选被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷氧基,
--nr8ar8b,和
--oh;
r4为h或c1-4烷基;
r5a为h或c1-4烷基;
r5b选自
-任选被一或多个独立选择的r9取代的c1-6烷基,
-任选被一或多个独立选择的r10取代的c3-7环烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,该杂环烷基任选被一或多个氧代基取代,和
-包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的c1-4烷基取代;
r5c选自c3-7环烷基,和任选被一或多个独立选择的卤素取代的c1-6烷基;
r6各自独立地选自
-氧代基,
-卤素,
--cn,
--oh,
--nr11ar11b,
-苯基,
-c3-7环烷基,
-c2-4炔基,
--c(=o)-c1-4烷氧基,
-任选被一或多个卤素或苯基取代的c1-4烷氧基,
-任选被一或多个卤素、-oh或c1-4烷氧基取代的c1-4烷基,和
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基;
r7各自选自
-卤素,
--cn,
-任选被一或多个独立选择的以下基团取代的c1-6烷基:
o卤素,
o-cn,
o-oh,
o任选被一或多个独立选择的卤素取代的c1-4烷氧基,
o-nr11cr11d,
o-c(=o)r12,或
o包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基;
-c1-4烷氧基,
-c3-7环烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基,该杂环烷基任选被-c(=o)c1-4烷氧基或c1-4烷基取代,该c1-4烷基任选被-cn取代,
--nr13ar13b,和
--c(=o)nr13cr13d;
r8a和r8b各自独立地选自h和任选被一个-oh或c1-4烷氧基取代的c1-4烷基;
r9各自独立地选自
-卤素,
--cn,
--nr11er11f,
--oh,
-c1-4烷氧基,
--s(=o)2-c1-4烷基,
-包含1、2或3个独立地选自n、o和s的杂原子的4至7元单环杂环烷基,和
-包含1、2或3个独立地选自n、o和s的杂原子的5至6元单环杂芳基,该杂芳基任选被一或多个独立选择的c1-4烷基取代;
r10各自独立地选自
-卤素,
-任选被一或多个独立选择的卤素、-oh或c1-4烷氧基取代的c1-4烷基,
--oh,
-c1-4烷氧基,和
--nr11gr11h;
r11a、r11b、r11c、r11d、r11e、r11f、r11g和r11h各自独立地选自h和c1-4烷基;
r12各自为
--nr14ar14b,其中r14a和r14b各自独立地选自h和c1-4烷基,
--oh,
-任选被一或多个独立选择的以下基团取代的c1-4烷氧基:c3-7环烷基、卤素、-nr15ar15b或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基,
--o-(包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基),或
--o-(c3-7单环环烷基);
r13a、r13b、r13c和r13d各自独立地选自h和c1-4烷基;
r15a和r15b各自独立地选自h和c1-4烷基;
或其可药用盐、溶剂合物或溶剂合物的盐。
2.如条款1的化合物或其可药用盐,其中x为cr4且r4为h。
3.如条款1的化合物或其可药用盐,其中x为cr4且r4为-ch3、-ch2ch3或-ch(ch3)2。
4.如条款1的化合物或其可药用盐,其中该化合物是式iia至iif中任一者:
5.如条款1至4任一项的化合物或其可药用盐,其中r1为h。
6.如条款1至4任一项的化合物或其可药用盐,其中r1为f、cl或br。
7.如条款1至4任一项的化合物或其可药用盐,其中r1为-ch3、-ch2ch3或-ch(ch3)2。
8.如条款1至4任一项的化合物或其可药用盐,其中r1为-ch3。
9.如条款1至4任一项的化合物或其可药用盐,其中r1为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。
10.如条款1至4任一项的化合物或其可药用盐,其中r1为-o-ch3。
11.如条款1至4任一项的化合物或其可药用盐,其中r1为被c1-4烷氧基取代的-o-ch2ch3或-o-ch(ch3)2。
12.如条款1至4任一项的化合物或其可药用盐,其中r1为-o-ch2ch2-o-ch3。
13.如条款1的化合物或其可药用盐,其中该化合物是式iiia至iiif中任一者:
14.如条款1至13任一项的化合物或其可药用盐,其中z为-nr5c-,其中n原子和r3b与它们所连接的原子一起形成稠合3,4-二氢-2h-1,3-噁嗪、1,2,3,4-四氢嘧啶、3-吡咯啉、1,2,3,6-四氢吡啶或3,4-二氢-2h-1,3-噻嗪。
15.如条款1至13任一项的化合物或其可药用盐,其中z为-nr5c-,其中n原子和r3b与它们所连接的原子一起形成稠合3,4-二氢-2h-1,3-噁嗪、3-吡咯啉或1,2,3,6-四氢吡啶。
16.如条款1的化合物或其可药用盐,其中该化合物是式iva-f中任一者:
17.如条款1或16的化合物或其可药用盐,其中r5c为c3-7环烷基。
18.如条款1或16的化合物或其可药用盐,其中r5c为环丙基、环丁基或环戊基。
19.如条款1或16的化合物或其可药用盐,其中r5c为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或-c(ch3)3。
20.如条款1或16的化合物或其可药用盐,其中r5c为-ch2ch3。
21.如条款1或16的化合物或其可药用盐,其中r5c为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或-c(ch3)3,其各自被1、2或3个独立选择的卤素取代。
22.如条款1或16的化合物或其可药用盐,其中r5c为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2或-c(ch3)3,其各自被1、2或3个独立选择的f或cl取代。
23.如条款1或16的化合物或其可药用盐,其中r5c为被1、2或3个f取代的-ch2ch3。
24.如条款1至23任一项的化合物或其可药用盐,其中r2为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基。
25.如条款1至23任一项的化合物或其可药用盐,其中r2为吡唑基。
26.如条款1至23任一项的化合物或其可药用盐,其中r2为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一或多个独立选择的r7基团取代。
27.如条款1至23任一项的化合物或其可药用盐,其中r2为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一个r7基团取代。
28.如条款1至23任一项的化合物或其可药用盐,其中r2为被一个r7基团取代的吡唑基。
29.如条款1、26至28任一项的化合物或其可药用盐,其中r7为f、cl、br或-cn。
30.如条款1、26至28任一项的化合物或其可药用盐,其中r7为f或-cn。
31.如条款1、26至28任一项的化合物或其可药用盐,其中r7为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。
32.如条款1、26至28任一项的化合物或其可药用盐,其中r7为-o-ch3或-o-ch2ch3。
33.如条款1、26至28任一项的化合物或其可药用盐,其中r7为-o-ch3。
34.如条款1、26至28任一项的化合物或其可药用盐,其中r7为-nr13ar13b且r13a和r13b各自为独立选择的h、-ch3、-ch2ch3或-ch(ch3)2。
35.如条款1、26至28任一项的化合物或其可药用盐,其中r7为-nh2或-n(ch3)2。
36.如条款1、26至28任一项的化合物或其可药用盐,其中r7为-c(=o)nr13cr13d,且r13c和r13d各自为独立选择的h、-ch3、-ch2ch3或-ch(ch3)2。
37.如条款1、26至28任一项的化合物或其可药用盐,其中r7为-c(=o)nr13cr13d,且r13c和r13d中一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。
38.如条款1的化合物或其可药用盐,其中该化合物是式va至vf中任一者:
39.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为-ch3、-ch2ch3或-ch(ch3)2。
40.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为-ch2ch3。
41.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为-ch3。
42.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为-ch3、-ch2ch3、-ch2ch2ch3或-ch(ch3)2,其各自被一或多个独立选择的卤素、-cn、-oh、任选被一或多个独立选择的卤素取代的c1-4烷氧基、-nr11cr11d、-c(=o)r12或包含1、2或3个独立地选自n、o和s的杂原子的4至6元单环杂环烷基。
43.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为被一或多个独立选择的以下基团取代的c1-4烷基:f、cl、-cn、-oh、-o-ch3、-o-ch2ch3、-o-ch(ch3)2、-o-chf2、-o-cf3、-o-ch2chf2、-nr11cr11d、-c(=o)r12、氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。
44.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为-ch3或-ch2ch3,其各自被一个四氢呋喃基或吗啉基取代。
45.如条款42和43的化合物或其可药用盐,其中r11c和r11d中一者为h,且另一者为c1-4烷基。
46.如条款42和43的化合物或其可药用盐,其中r11c和r11d为-ch3、-ch2ch3或-ch(ch3)2。
47.如条款42和43的化合物或其可药用盐,其中r12为-nr14ar14b,且r14a和r14b中一者为h,且另一者为c1-4烷基。
48.如条款42和43的化合物或其可药用盐,其中r12为-nr14ar14b,且r14a和r14b为-ch3、-ch2ch3或-ch(ch3)2。
49.如条款42和43的化合物或其可药用盐,其中r12为-oh。
50.如条款42和43的化合物或其可药用盐,其中r12为-o-ch3、-o-ch2ch3、-o-ch(ch3)2或-o-c(ch3)3。
51.如条款42和43的化合物或其可药用盐,其中r12为-o-ch3或-o-ch2ch3,其各自被1、2或3个c3-7环烷基或卤素取代。
52.如条款42和43的化合物或其可药用盐,其中r12为-o-ch3或-o-ch2ch3,其各自被1、2或3个f取代。
53.如条款42和43的化合物或其可药用盐,其中r12为-o-ch3或-o-ch2ch3,其各自被一个环丙基、环丁基或环戊基取代。
54.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为环丙基、环丁基、环戊基或环己基。
55.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。
56.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基,其各自被-c(=o)c1-4烷氧基或任选被-cn取代的c1-4烷基取代。
57.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基,其各自被-c(=o)-o-c(ch3)3、-ch3、-ch2-cn或-ch2ch2-cn取代。
58.如条款1至13、24至28和38任一项的化合物或其可药用盐,其中r7为氮杂环丁烷基、吡咯烷基、哌啶基或哌嗪基,其各自被-c(=o)-o-c(ch3)3、-ch3、-ch2-cn或-ch2ch2-cn取代。
59.如条款1至13和24至59任一项的化合物或其可药用盐,其中r3b为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。
60.如条款1至13和24至59任一项的化合物或其可药用盐,其中r3b为-o-ch3。
61.如条款1至13和24至59任一项的化合物或其可药用盐,其中r3b为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。
62.如条款1至13和24至59任一项的化合物或其可药用盐,其中r3b为被一或多个独立选择的f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代的c1-4烷氧基。
63.如条款1至13和24至59任一项的化合物或其可药用盐,其中r3b为-o-chf2。
64.如条款1至13和24至59任一项的化合物或其可药用盐,其中r3b为-nr8ar8b,且r8a和r8b均为h。
65.如条款1至13和24至59任一项的化合物或其可药用盐,其中r3b为-nr8ar8b,且r8a和r8b中一者为h,且另一者为任选被一个-oh或c1-4烷氧基取代的c1-4烷基。
66.如条款1至13和24至59任一项的化合物或其可药用盐,其中r3b为-nh-ch3、-nh-ch(ch3)2或-nh-ch2ch2-oh。
67.如条款1的化合物或其可药用盐,其中该化合物是式via至vif中任一者:
68.如条款1至13和24至67任一项的化合物或其可药用盐,其中r7为-ch3、-ch2ch3或-ch(ch3)2。
69.如条款1的化合物或其可药用盐,其中该化合物是式viia-f中任一者:
70.如条款1至69任一项的化合物或其可药用盐,其中r3a为f、cl或-oh。
71.如条款1至69任一项的化合物或其可药用盐,其中r3a为-ch3、-ch2ch3或-ch(ch3)2。
72.如条款1至69任一项的化合物或其可药用盐,其中r3a为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。
73.如条款1至69任一项的化合物或其可药用盐,其中r3a为-o-ch3。
74.如条款1至69任一项的化合物或其可药用盐,其中r3a为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个独立选择的卤素、-oh或c1-4烷氧基取代。
75.如条款1至69任一项的化合物或其可药用盐,其中r3a为被1、2或3个f或cl取代的c1-4烷氧基。
76.如条款1至69任一项的化合物或其可药用盐,其中r3a为-o-ch3或-o-ch2ch3,其各自被一个-oh或-o-ch3取代。
77.如条款1至69任一项的化合物或其可药用盐,其中r3a为-o-chf2。
78.如条款1至69任一项的化合物或其可药用盐,其中r3a为-nr8ar8b,且r8a和r8b均为h。
79.如条款1至69任一项的化合物或其可药用盐,其中r3a为-nr8ar8b,且r8a和r8b中一者为h,且另一者为任选被一个-oh或c1-4烷氧基取代的c1-4烷基。
80.如条款1至69任一项的化合物或其可药用盐,其中r3a为-nh-ch3、-nh-ch(ch3)2或-nh-ch2ch2-oh。
81.如条款1的化合物或其可药用盐,其中该化合物是式viiia至viiid中任一者:
82.如条款1至13和24至81任一项的化合物或其可药用盐,其中z为-nr5ar5b。
83.如条款82的化合物或其可药用盐,其中r5a为h。
84.如条款82的化合物或其可药用盐,其中r5a为-ch3、-ch2ch3或-ch(ch3)2。
85.如条款82的化合物或其可药用盐,其中r5a为-ch3。
86.如条款82的化合物或其可药用盐,其中r5a为-ch2ch3。
87.如条款82至86任一项的化合物或其可药用盐,其中r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2。
88.如条款82至86任一项的化合物或其可药用盐,其中r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2,其各自被一或多个独立选择的r9取代。
89.如条款82至86任一项的化合物或其可药用盐,其中r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2,其各自被1、2或3个独立选择的r9取代。
90.如条款82至86任一项的化合物或其可药用盐,其中r5b为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-c(ch3)3、-ch(ch3)ch2ch3或-ch(ch3)ch(ch3)2,其各自被一个r9取代。
91.如条款88至90任一项的化合物或其可药用盐,其中r9各自独立地为f、cl、-cn、-oh、-o-ch3、-o-ch2ch3、-o-ch(ch3)2、-s(=o)2-ch3、-s(=o)2-ch2ch3或-s(=o)2-ch(ch3)2。
92.如条款88至90任一项的化合物或其可药用盐,其中r9为f、-cn、-oh、-o-ch3或-s(=o)2-ch3。
93.如条款88至90任一项的化合物或其可药用盐,其中r9为-nr11er11f,且r11e和r11f均为h。
94.如条款88至90任一项的化合物或其可药用盐,其中r9为-nr11er11f,且r11e和r11f的一者为h,且另一者为-ch3、-ch2ch3或-ch(ch3)2。
95.如条款88至90任一项的化合物或其可药用盐,其中r9为-n(ch3)2。
96.如条款88至90任一项的化合物或其可药用盐,其中r9为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。
97.如条款88至90任一项的化合物或其可药用盐,其中r9为二噁烷基。
98.如条款88至90任一项的化合物或其可药用盐,其中r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、噁三唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基。
99.如条款88至90任一项的化合物或其可药用盐,其中r9为咪唑基、吡唑基或吡啶基。
100.如条款88至90任一项的化合物或其可药用盐,其中r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基,其各自被一或多个独立选择的c1-4烷基取代。
101.如条款88至90任一项的化合物或其可药用盐,其中r9为吡咯基、呋喃基、噻吩基、咪唑基、呋咱基、噁唑基、噁二唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、三唑基、四唑基、吡啶基、吡嗪基、哒嗪基或嘧啶基,其各自被一或多个独立选择的-ch3、-ch2ch3或-ch(ch3)2取代。
102.如条款82至86任一项的化合物或其可药用盐,其中r5b为环丙基、环丁基、环戊基或环己基。
103.如条款82至86任一项的化合物或其可药用盐,其中r5b为环丙基。
104.如条款82至86任一项的化合物或其可药用盐,其中r5b为环丙基、环丁基、环戊基或环己基,其各自被1、2或3个独立选择的r10取代。
105.如条款82至86任一项的化合物或其可药用盐,其中r5b为环丙基、环丁基、环戊基或环己基,其各自被一个r10取代。
106.如条款104或105的化合物或其可药用盐,其中r10为卤素、-oh或c1-4烷氧基。
107.如条款104或105的化合物或其可药用盐,其中r10为f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2。
108.如条款104或105的化合物或其可药用盐,其中r10为-ch3、-ch2ch3或-ch(ch3)2。
109.如条款104或105的化合物或其可药用盐,其中r10为-ch3、-ch2ch3或-ch(ch3)2,其各自被1、2或3个独立选择的卤素、-oh或c1-4烷氧基取代。
110.如条款104或105的化合物或其可药用盐,其中r10为-ch2f、-chf2、-cf3或-ch2-oh。
111.如条款104或105的化合物或其可药用盐,其中r10为-nr11gr11h。
112.如条款111的化合物或其可药用盐,其中r11g和r11h独立地为h、-ch3、-ch2ch3或-ch(ch3)2。
113.如条款104或105的化合物或其可药用盐,其中r10为-n(ch3)2。
114.如条款82至86任一项的化合物或其可药用盐,其中r5b为氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基或四氢噻喃基。在一个更特定的实施方案中,r5b为氧杂环丁烷基、硫杂环丁烷基或四氢噻喃基。
115.如条款82至86任一项的化合物或其可药用盐,其中r5b为氧杂环丁烷基。
116.如条款82至86任一项的化合物或其可药用盐,其中r5b为氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、四氢吡喃基或四氢噻喃基,其各自被一或多个氧代基取代。
117.如条款82至86任一项的化合物或其可药用盐,其中r5b为硫杂环丁烷基或四氢噻吩基,其各自被两个氧代基取代。
118.如条款82至86任一项的化合物或其可药用盐,其中r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基。
119.如条款82至86任一项的化合物或其可药用盐,其中r5b为咪唑基、吡唑基、异噁唑基或嘧啶基。
120.如条款82至86任一项的化合物或其可药用盐,其中r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一或多个独立选择的c1-4烷基取代。
121.如条款82至86任一项的化合物或其可药用盐,其中r5b为咪唑基、吡唑基、三唑基、噻唑基、噁唑基、异噁唑基、噁二唑基、吡啶基、哒嗪基、嘧啶基或吡嗪基,其各自被一个-ch3、-ch2ch3或-ch(ch3)2取代。
122.如条款82至86任一项的化合物或其可药用盐,其中r5b为咪唑基、吡唑基或嘧啶基,其各自被一个-ch3取代。
123.如条款82的化合物或其可药用盐,其中r5a为h,且r5b为-ch2ch3、-ch2cf3、-ch(ch3)cf3或环丙基。
124.如条款1至13和24至81任一项的化合物或其可药用盐,其中z为氮杂环丁烷基、吡咯烷基、哌啶基、吗啉基、硫代吗啉基、哌嗪基、2-氮杂螺[3.3]庚基、1,6-二氮杂螺[3.3]庚基、2,6-二氮杂螺[3.3]庚基、1-氧杂-6-氮杂螺[3.3]庚基、2-氧杂-6-氮杂螺[3.3]庚基、1-硫杂-6-氮杂螺[3.3]庚基或2-硫杂-6-氮杂螺[3.3]庚基。在一个更特定的实施方案中,z为氮杂环丁烷基、吡咯烷基、哌啶基、2-氧杂-6-氮杂螺[3.3]庚基或2-硫杂-6-氮杂螺[3.3]庚基。
125.如条款1至13和24至81任一项的化合物或其可药用盐,其中z为氮杂环丁烷基、吡咯烷基、哌啶基、吗啉基、硫代吗啉基、哌嗪基、2-氮杂螺[3.3]庚基、1,6-二氮杂螺[3.3]庚基、2,6-二氮杂螺[3.3]庚基、1-氧杂-6-氮杂螺[3.3]庚基、2-氧杂-6-氮杂螺[3.3]庚基、1-硫杂-6-氮杂螺[3.3]庚基或2-硫杂-6-氮杂螺[3.3]庚基,其各自被1、2或3个独立选择的r6基团取代。
126.如条款1至13和24至81任一项的化合物或其可药用盐,其中z为氮杂环丁烷基、吡咯烷基、哌啶基或2-硫杂-6-氮杂螺[3.3]庚基,其各自被1、2或3个独立选择的r6基团取代。
127.如条款125或126的化合物或其可药用盐,其中r6为氧代基、f、cl、-cn、-oh、苯基、环丙基、环丁基、环戊基、-c≡ch、-c(=o)-o-ch3、-c(=o)-o-ch2ch3或-c(=o)-o-ch(ch3)2。
128.如条款125或126的化合物或其可药用盐,其中r6为-nr11ar11b且r11a和r11b各自独立地选自h、-ch3、-ch2ch3和-ch(ch3)2。
129.如条款125或126的化合物或其可药用盐,其中r6为-n(ch3)2。
130.如条款125或126的化合物或其可药用盐,其中r6为-o-ch3、-o-ch2ch3或-o-ch(ch3)2。
131.如条款125或126的化合物或其可药用盐,其中r6为-o-ch3、-o-ch2ch3或-o-ch(ch3)2,其各自被一或多个f、cl或苯基取代。
132.如条款125或126的化合物或其可药用盐,其中r6为-ch3、-ch2ch3或-ch(ch3)2。
133.如条款125或126的化合物或其可药用盐,其中r6为-ch3、-ch2ch3或-ch(ch3)2,其各自被1、2或3个f、cl、-oh、-o-ch3、-o-ch2ch3或-o-ch(ch3)2取代。
134.如条款125或126的化合物或其可药用盐,其中r6为被1、2或3个f或-oh取代的-ch3。
135.如条款125或126的化合物或其可药用盐,其中r6为氮杂环丁烷基、氧杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、二噁烷基或哌嗪基。
136.如条款125或126的化合物或其可药用盐,其中r6为四氢吡喃基或吗啉基。
137.如条款1至13和24至81任一项的化合物或其可药用盐,其中z为
138.如条款1的化合物或其可药用盐,其中该化合物选自表iii。
139.药物组合物,其包含可药用载体和药学有效量的如条款1至138任一项的化合物。
140.如条款138的药物组合物,其包含另外的治疗剂。
141.如条款1至138任一项的化合物或其可药用盐或如条款139或140的药物组合物,其用于药剂中。
142.如条款1至138任一项的化合物或其可药用盐或如条款139或140的药物组合物,其用于预防和/或治疗炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病。
143.如条款1至138任一项的化合物或其可药用盐或如条款139或140的药物组合物,其中所述化合物或药物组合物与另外的治疗剂组合施用。
144.如条款140的药物组合物或如条款143的用途,其中所述另外的治疗剂是用于预防和/或治疗以下疾病的治疗剂:炎性疾病、自身炎症性疾病、自身免疫性疾病、增殖性疾病、纤维化疾病、移植排斥、涉及软骨转换损伤的疾病、先天性软骨畸形、涉及骨转换损伤的疾病、与tnfα、干扰素、il-6、il-12和/或il-23过度分泌相关的疾病、呼吸系统疾病、内分泌和/或代谢疾病、心血管疾病、皮肤病学疾病和/或异常血管生成相关疾病。
药物组合物
当用作药物时,本发明的化合物通常以药物组合物的形式施用。这类组合物可以以药物领域熟知的方式制备,包含至少一种式i的本发明的活性化合物。通常,本发明的化合物以药物有效的量施用。实际施用的本发明的化合物的量通常将由医师根据相关情况来判定,所述情况包括待治疗的病症、所选施用途径、所施用的实际的本发明的化合物、个体患者的年龄、体重和响应以及患者症状的严重度等。
本发明的药物组合物可以通过多种途径施用,包括口服、经直肠、经皮、皮下、关节内、静脉内、肌内和鼻内。根据预期的递送途径,本发明的化合物优选被配制成可注射或口服组合物或者均用于经皮施用的药膏、乳液或贴剂。
用于口服施用的组合物可采取散装液体溶液或混悬液或散装粉末的形式。然而,组合物更通常以单位剂型呈现以便于精确给药。术语“单位剂型”指适宜作为用于人个体和其它哺乳动物的单位剂量的物理离散单元,各单元含有与适宜药物赋形剂、辅料或载体联合的经计算产生预期治疗作用的预定量的活性材料。典型的单位剂型包括液体组合物的预装、预测量安瓿或注射器或者就固体组合物而言丸剂、片剂、胶囊等。在这类组合物中,式i的本发明的化合物通常为小量组分(约0.1至约50%重量或优选约1至约40%重量),其余为有助于形成预期剂型的各种辅料或载体以及加工助剂。
适于口服施用的液体形式可包括含有缓冲剂、混悬和分散剂、着色剂、矫味剂等的适宜的水性或非水性辅料。固体形式可包括例如以下成分或具有类似性质的本发明的化合物中的任一者:粘合剂,例如微晶纤维素、西黄蓍胶或明胶;赋形剂,例如淀粉或乳糖;崩解剂,例如海藻酸、primogel或玉米淀粉;润滑剂,例如硬脂酸镁;助流剂,例如胶态二氧化硅;甜味剂,例如蔗糖或糖精;或矫味剂,例如欧薄荷或橙矫味剂。
可注射组合物通常基于可注射无菌盐水或磷酸盐缓冲盐水或本领域已知的其它可注射载体。如前所述,该组合物中的式i的本发明的活性化合物通常是小量组分,经常为约0.05至10%重量,其余为可注射载体等。
经皮组合物通常配制成含有活性成分的局部用软膏或乳膏剂,所述活性成分的量通常为约0.01至约20%重量、优选约0.1至约20%重量、优选约0.1至约10wt%、更优选约0.5至约15%%重量。当配制成软膏时,活性成分通常与石蜡或水混溶性软膏基质组合。或者,活性成分可使用例如水包油型乳膏基质配制成乳膏剂。这类经皮制剂是本领域熟知的,通常包括另外的成分以提高活性成分或制剂的皮肤渗透或稳定性。所有这类已知的经皮制剂和成分均包括在本发明的范围内。
本发明的化合物还可以通过经皮装置施用。因此,经皮施用可以采用储库或多孔膜型的贴剂或固体基质类型的贴剂来实现。
上述用于可口服施用、可注射或可局部施用的组合物的组分仅仅是代表性的。其它材料以及加工技术等在remington'spharmaceuticalsciences,第17版,1985,mack出版公司,伊斯顿,宾夕法尼亚的第8部分中给出,该文献通过援引并入本文。
本发明的化合物还可以以持续释放形式施用或从持续释放药物递送系统施用。代表性的持续释放材料的描述可见于remington'spharmaceuticalsciences。
以下制剂实施例解释说明了可按照本发明制备的代表性药物组合物。然而,本发明不限于以下药物组合物。
制剂1-片剂
可以将式i的本发明的化合物与干燥明胶粘合剂以约1:2重量比混合成干燥粉末。可添加少量硬脂酸镁作为润滑剂。可以将混合物在压片机中形成240-270mg片剂(每片片剂80-90mg式i的本发明的活性化合物)。
制剂2-胶囊
可以将式i的本发明的化合物与淀粉稀释剂以约1:1重量比混合成干燥粉末。可以将混合物填充至250mg胶囊(每粒胶囊125mg式i的本发明的活性化合物)。
制剂3-液体
可以将式i的本发明的化合物(125mg)与蔗糖(1.75g)和黄原胶(4mg)混合,将所得混合物掺和,穿过10号筛孔美制筛网,然后与先前制备的微晶纤维素和羧甲基纤维素钠(11:89,50mg)在水中的溶液混合。可以将苯甲酸钠(10mg)、矫味剂和着色剂用水稀释,在搅拌下添加。然后可以在搅拌下添加足够的水。然后可以进一步添加足够的水以产生5ml的总体积。
制剂4-片剂
可以将式i的本发明的化合物与干燥明胶粘合剂以约1:2重量比混合成干燥粉末。可以添加少量硬脂酸镁作为润滑剂。可以将混合物在压片机中形成450-900mgmg片剂(每片片剂150-300mg式i的本发明的活性化合物)。
制剂5-注射剂
可以将式i的本发明的化合物溶于或混悬于缓冲无菌盐水可注射水性介质中,达到约5mg/ml的浓度。
制剂6-局部
可以使硬脂醇(250g)和白凡士林(250g)于约75℃熔融,然后可以添加式i的本发明的化合物(50g)、尼泊金甲酯(0.25g)、尼泊金丙酯(0.15g)、月桂硫酸钠(10g)和丙二醇(120g)溶于水(约370g)中的混合物,可以将所得混合物搅拌直至凝固。
治疗方法
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于药剂。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗炎性疾病。特别地,术语炎性疾病指类风湿性关节炎、骨关节炎、过敏性气道疾病(例如哮喘)、慢性阻塞性肺病(copd)和炎性肠病(例如克罗恩病、溃疡性结肠炎)。更特别地,该术语指类风湿性关节炎、慢性阻塞性肺病(copd)和炎性肠病(例如克罗恩病、溃疡性结肠炎)。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗炎性疾病的药剂中的用途。特别地,术语炎性疾病指类风湿性关节炎、骨关节炎、过敏性气道疾病(例如哮喘)、慢性阻塞性肺病(copd)和炎性肠病(例如克罗恩病、溃疡性结肠炎)。更特别地,该术语指类风湿性关节炎、慢性阻塞性肺病(copd)和炎性肠病(例如克罗恩病、溃疡性结肠炎)。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有炎性疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语炎性疾病指类风湿性关节炎、骨关节炎、过敏性气道疾病(例如哮喘)、慢性阻塞性肺病(copd)和炎性肠病(例如克罗恩病、溃疡性结肠炎)。更特别地,该术语指类风湿性关节炎、慢性阻塞性肺病(copd)和炎性肠病(例如克罗恩病、溃疡性结肠炎)。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为炎性疾病治疗剂。特别地,术语炎性疾病指类风湿性关节炎、骨关节炎、过敏性气道疾病(例如哮喘)、慢性阻塞性肺病(copd)和炎性肠病(例如克罗恩病、溃疡性结肠炎)。更特别地,该术语指类风湿性关节炎、慢性阻塞性肺病(copd)和炎性肠病(例如克罗恩病、溃疡性结肠炎)。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗自身炎症性疾病。特别地,术语自身炎症性疾病指隐热蛋白相关周期综合征(caps)、家族性地中海热(fmf)和肿瘤坏死因子受体相关周期综合征(traps)、白塞病、全身发作型幼年特发性关节炎(sjia)或斯蒂尔病。更特别地,该术语指caps、fmf、traps和斯蒂尔病。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗自身炎症性疾病的药剂中的用途。特别地,术语自身炎症性疾病指隐热蛋白相关周期综合征(caps)、家族性地中海热(fmf)和肿瘤坏死因子受体相关周期综合征(traps)、白塞病、全身发作型幼年特发性关节炎(sjia)或斯蒂尔病。更特别地,该术语指caps、fmf、traps和斯蒂尔病。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有自身炎症性疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语自身炎症性疾病指隐热蛋白相关周期综合征(caps)、家族性地中海热(fmf)和肿瘤坏死因子受体相关周期综合征(traps)、白塞病、全身发作型幼年特发性关节炎(sjia)或斯蒂尔病。更特别地,该术语指caps、fmf、traps和斯蒂尔病。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为自身炎症性疾病治疗剂。特别地,术语自身炎症性疾病指隐热蛋白相关周期综合征(caps)、家族性地中海热(fmf)和肿瘤坏死因子受体相关周期综合征(traps)、白塞病、全身发作型幼年特发性关节炎(sjia)或斯蒂尔病。更特别地,该术语指caps、fmf、traps和斯蒂尔病。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗自身免疫性疾病。特别地,术语自身免疫性疾病指copd、哮喘、支气管炎、全身性红斑狼疮(sle)、皮肤性红斑狼疮(cle)、狼疮性肾炎、皮肌炎、自身免疫性肝炎、原发性硬化性胆管炎、原发性胆汁性肝硬化、舍格伦综合征、多发性硬化症、银屑病、干眼病、i型糖尿病、特应性皮炎、甲状腺炎、接触性皮炎、湿疹性皮炎、炎性肠病(例如克罗恩病和溃疡性结肠炎)、动脉粥样硬化和肌萎缩性侧索硬化。更特别地,该术语指copd、哮喘、全身性红斑狼疮、i型糖尿病和炎性肠病。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗自身免疫性疾病的药剂中的用途。特别地,术语自身免疫性疾病指copd、哮喘、支气管炎、全身性红斑狼疮(sle)、皮肤性红斑狼疮(cle)、狼疮性肾炎、皮肌炎、自身免疫性肝炎、原发性硬化性胆管炎、原发性胆汁性肝硬化、舍格伦综合征、多发性硬化症、银屑病、干眼病、i型糖尿病、特应性皮炎、甲状腺炎、接触性皮炎、湿疹性皮炎、炎性肠病(例如克罗恩病和溃疡性结肠炎)、动脉粥样硬化和肌萎缩性侧索硬化。更特别地,该术语指copd、哮喘、全身性红斑狼疮、i型糖尿病和炎性肠病。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有自身免疫性疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语自身免疫性疾病指copd、哮喘、支气管炎、全身性红斑狼疮(sle)、皮肤性红斑狼疮(cle)、狼疮性肾炎、皮肌炎、自身免疫性肝炎、原发性硬化性胆管炎、原发性胆汁性肝硬化、舍格伦综合征、多发性硬化症、银屑病、干眼病、i型糖尿病、特应性皮炎、甲状腺炎、接触性皮炎、湿疹性皮炎、炎性肠病(例如克罗恩病和溃疡性结肠炎)、动脉粥样硬化和肌萎缩性侧索硬化。更特别地,该术语指copd、哮喘、全身性红斑狼疮、i型糖尿病和炎性肠病。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为自身免疫性疾病治疗剂。特别地,术语自身免疫性疾病指copd、哮喘、支气管炎、全身性红斑狼疮(sle)、皮肤性红斑狼疮(cle)、狼疮性肾炎、皮肌炎、自身免疫性肝炎、原发性硬化性胆管炎、原发性胆汁性肝硬化、舍格伦综合征、多发性硬化症、银屑病、干眼病、i型糖尿病、特应性皮炎、甲状腺炎、接触性皮炎、湿疹性皮炎、炎性肠病(例如克罗恩病和溃疡性结肠炎)、动脉粥样硬化和肌萎缩性侧索硬化。更特别地,该术语指copd、哮喘、全身性红斑狼疮、i型糖尿病和炎性肠病。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗增殖性疾病。特别地,术语增殖性疾病指癌症、骨髓增殖性疾病、白血病、多发性骨髓瘤、银屑病、再狭窄、硬皮病或纤维化。更特别地,该术语指癌症、白血病、多发性骨髓瘤和银屑病。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗增殖性疾病的药剂中的用途。特别地,术语增殖性疾病指癌症、骨髓增殖性疾病、白血病、多发性骨髓瘤、银屑病、再狭窄、硬皮病或纤维化。更特别地,该术语指癌症、白血病、多发性骨髓瘤和银屑病。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有增殖性疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语增殖性疾病指癌症、骨髓增殖性疾病、白血病、多发性骨髓瘤、银屑病、再狭窄、硬皮病或纤维化。更特别地,该术语指癌症、白血病、多发性骨髓瘤和银屑病。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为增殖性疾病治疗剂。特别地,术语增殖性疾病指癌症、骨髓增殖性疾病、白血病、多发性骨髓瘤、银屑病、再狭窄、硬皮病或纤维化。更特别地,该术语指癌症、白血病、多发性骨髓瘤和银屑病。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗纤维化疾病。特别地,术语纤维化疾病指特发性肺纤维化(ipf)、迪皮特朗病、非酒精性脂肪性肝炎(nash)、全身硬化症、肾纤维化和皮肤纤维化。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗纤维化疾病的药剂中的用途。特别地,术语纤维化疾病指特发性肺纤维化(ipf)、迪皮特朗病、非酒精性脂肪性肝炎(nash)、全身硬化症、肾纤维化和皮肤纤维化。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有纤维化疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语纤维化疾病指特发性肺纤维化(ipf)、迪皮特朗病、非酒精性脂肪性肝炎(nash)、全身硬化症、肾纤维化和皮肤纤维化。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为纤维化疾病治疗剂。特别地,术语纤维化疾病指特发性肺纤维化(ipf)、迪皮特朗病、非酒精性脂肪性肝炎(nash)、全身硬化症、肾纤维化和皮肤纤维化。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗移植排斥。特别地,术语移植排斥指例如胰岛、干细胞、骨髓、皮肤、肌肉、角膜组织、神经元组织、心、肺、合并心-肺、肾、肝、肠、胰、气管或食管的细胞、组织或实体器官同种异体或异种移植的急性或慢性排斥或者移植物抗宿主疾病。更特别地,该术语指移植物抗宿主疾病。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗移植排斥的药剂中的用途。特别地,术语移植排斥指例如胰岛、干细胞、骨髓、皮肤、肌肉、角膜组织、神经元组织、心、肺、合并心-肺、肾、肝、肠、胰、气管或食管的细胞、组织或实体器官同种异体或异种移植的急性或慢性排斥或者移植物抗宿主疾病。更特别地,该术语指移植物抗宿主疾病。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有移植排斥的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语移植排斥指例如胰岛、干细胞、骨髓、皮肤、肌肉、角膜组织、神经元组织、心、肺、合并心-肺、肾、肝、肠、胰、气管或食管的细胞、组织或实体器官同种异体或异种移植的急性或慢性排斥或者移植物抗宿主疾病。更特别地,该术语指移植物抗宿主疾病。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为移植排斥治疗剂。特别地,术语移植排斥指例如胰岛、干细胞、骨髓、皮肤、肌肉、角膜组织、神经元组织、心、肺、合并心-肺、肾、肝、肠、胰、气管或食管的细胞、组织或实体器官同种异体或异种移植的急性或慢性排斥或者移植物抗宿主疾病。更特别地,该术语指移植物抗宿主疾病。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗涉及软骨转换损伤的疾病。特别地,术语涉及软骨转换损伤的疾病指骨关节炎、银屑病性关节炎、幼年类风湿性关节炎、痛风性关节炎、脓毒性或感染性关节炎、反应性关节炎、反射交感性营养不良、痛性营养不良、tietze综合征或肋软骨炎、纤维肌痛、骨软骨炎、神经源性或神经性关节炎、关节病、地方性关节炎如地方性变形性骨关节炎、姆塞莱尼病和handigodu病;由纤维肌痛造成的退化、全身性红斑狼疮、硬皮病和强直性脊柱炎。更特别地,该术语指骨关节炎、银屑病性关节炎、幼年类风湿性关节炎、全身性红斑狼疮、硬皮病和强直性脊柱炎。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗涉及软骨转换损伤的疾病的药剂中的用途。特别地,术语涉及软骨转换损伤的疾病指骨关节炎、银屑病性关节炎、幼年类风湿性关节炎、痛风性关节炎、脓毒性或感染性关节炎、反应性关节炎、反射交感性营养不良、痛性营养不良、tietze综合征或肋软骨炎、纤维肌痛、骨软骨炎、神经源性或神经性关节炎、关节病、地方性关节炎如地方性变形性骨关节炎、姆塞莱尼病和handigodu病;由纤维肌痛造成的退化、全身性红斑狼疮、硬皮病和强直性脊柱炎。更特别地,该术语指骨关节炎、银屑病性关节炎、幼年类风湿性关节炎、全身性红斑狼疮、硬皮病和强直性脊柱炎。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有涉及软骨转换损伤的疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语涉及软骨转换损伤的疾病指骨关节炎、银屑病性关节炎、幼年类风湿性关节炎、痛风性关节炎、脓毒性或感染性关节炎、反应性关节炎、反射交感性营养不良、痛性营养不良、tietze综合征或肋软骨炎、纤维肌痛、骨软骨炎、神经源性或神经性关节炎、关节病、地方性关节炎如地方性变形性骨关节炎、姆塞莱尼病和handigodu病;由纤维肌痛造成的退化、全身性红斑狼疮、硬皮病和强直性脊柱炎。更特别地,该术语指骨关节炎、银屑病性关节炎、幼年类风湿性关节炎、全身性红斑狼疮、硬皮病和强直性脊柱炎。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为涉及软骨转换损伤的疾病的治疗剂。特别地,术语涉及软骨转换损伤的疾病指骨关节炎、银屑病性关节炎、幼年类风湿性关节炎、痛风性关节炎、脓毒性或感染性关节炎、反应性关节炎、反射交感性营养不良、痛性营养不良、tietze综合征或肋软骨炎、纤维肌痛、骨软骨炎、神经源性或神经性关节炎、关节病、地方性关节炎如地方性变形性骨关节炎、姆塞莱尼病和handigodu病;由纤维肌痛造成的退化、全身性红斑狼疮、硬皮病和强直性脊柱炎。更特别地,该术语指骨关节炎、银屑病性关节炎、幼年类风湿性关节炎、全身性红斑狼疮、硬皮病和强直性脊柱炎。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗先天性软骨畸形。特别地,术语先天性软骨畸形指遗传性软骨溶解、软骨发育不良和假性软骨发育不良、小耳畸形、无耳畸形、干骺端软骨发育不良。更特别地,该术语指小耳畸形、无耳畸形、干骺端软骨发育不良。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗先天性软骨畸形的药剂中的用途。特别地,术语先天性软骨畸形指遗传性软骨溶解、软骨发育不良和假性软骨发育不良、小耳畸形、无耳畸形、干骺端软骨发育不良。更特别地,该术语指小耳畸形、无耳畸形、干骺端软骨发育不良。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有先天性软骨畸形的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语先天性软骨畸形指遗传性软骨溶解、软骨发育不良和假性软骨发育不良、小耳畸形、无耳畸形、干骺端软骨发育不良。更特别地,该术语指小耳畸形、无耳畸形、干骺端软骨发育不良。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为先天性软骨畸形治疗剂。特别地,术语先天性软骨畸形指遗传性软骨溶解、软骨发育不良和假性软骨发育不良、小耳畸形、无耳畸形、干骺端软骨发育不良。更特别地,该术语指小耳畸形、无耳畸形、干骺端软骨发育不良。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗涉及骨转换损伤的疾病。特别地,术语涉及骨转换损伤的疾病指骨质疏松症、骨质减少、激素缺乏症、激素过量、佩吉特病、骨关节炎、肾性骨病、成骨不全和低磷酸酯酶症。更特别地,该术语指骨质疏松症。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗涉及骨转换损伤的疾病的药剂中的用途。特别地,术语涉及骨转换损伤的疾病指骨质疏松症、骨质减少、激素缺乏症、激素过量、佩吉特病、骨关节炎、肾性骨病、成骨不全和低磷酸酯酶症。更特别地,该术语指骨质疏松症。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有涉及骨转换损伤的疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语涉及骨转换损伤的疾病指骨质疏松症、骨质减少、激素缺乏症、激素过量、佩吉特病、骨关节炎、肾性骨病、成骨不全和低磷酸酯酶症。更特别地,该术语指骨质疏松症。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为涉及骨转换损伤的疾病的治疗剂。特别地,术语涉及骨转换损伤的疾病指骨质疏松症、骨质减少、激素缺乏症、激素过量、佩吉特病、骨关节炎、肾性骨病、成骨不全和低磷酸酯酶症。更特别地,该术语指骨质疏松症。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗与il-6过度分泌相关的疾病。特别地,术语与il-6过度分泌相关的疾病指卡斯尔曼病、多发性骨髓瘤、银屑病、卡波西肉瘤和/或系膜增殖性肾小球肾炎。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗与il-6过度分泌相关的疾病的药剂中的用途。特别地,术语与il-6过度分泌相关的疾病指卡斯尔曼病、多发性骨髓瘤、银屑病、卡波西肉瘤和/或系膜增殖性肾小球肾炎。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有与il-6过度分泌相关的疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语与il-6过度分泌相关的疾病指卡斯尔曼病、多发性骨髓瘤、银屑病、卡波西肉瘤和/或系膜增殖性肾小球肾炎。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为与il-6过度分泌相关的疾病的治疗剂。特别地,术语与il-6过度分泌相关的疾病指卡斯尔曼病、多发性骨髓瘤、银屑病、卡波西肉瘤和/或系膜增殖性肾小球肾炎。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗与tnfα、干扰素、il-12和/或il-23过度分泌相关的疾病。特别地,术语与tnfα、干扰素、il-12和/或il-23过度分泌相关的疾病指全身性和皮肤性红斑狼疮、狼疮性肾炎、皮肌炎、舍格伦综合征、银屑病、类风湿性关节炎、银屑病性关节炎、多发性硬化症、21-三体综合征、溃疡性结肠炎和/或克罗恩病。更特别地,该术语指舍格伦综合征、银屑病、类风湿性关节炎、银屑病性关节炎、多发性硬化症、21-三体综合征、溃疡性结肠炎和/或克罗恩病。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗与tnfα、干扰素、il-12和/或il-23过度分泌相关的疾病的药剂中的用途。特别地,术语与tnfα、干扰素、il-12和/或il-23过度分泌相关的疾病指全身性和皮肤性红斑狼疮、狼疮性肾炎、皮肌炎、舍格伦综合征、银屑病、类风湿性关节炎、银屑病性关节炎、多发性硬化症、21-三体综合征、溃疡性结肠炎和/或克罗恩病。更特别地,该术语指舍格伦综合征、银屑病、类风湿性关节炎、银屑病性关节炎、多发性硬化症、21-三体综合征、溃疡性结肠炎和/或克罗恩病。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有与tnfα、干扰素、il-12和/或il-23过度分泌相关的疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语与tnfα、干扰素、il-12和/或il-23过度分泌相关的疾病指全身性和皮肤性红斑狼疮、狼疮性肾炎、皮肌炎、舍格伦综合征、银屑病、类风湿性关节炎、银屑病性关节炎、多发性硬化症、21-三体综合征、溃疡性结肠炎和/或克罗恩病。更特别地,该术语指舍格伦综合征、银屑病、类风湿性关节炎、银屑病性关节炎、多发性硬化症、21-三体综合征、溃疡性结肠炎和/或克罗恩病。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为与tnfα、干扰素、il-12和/或il-23过度分泌相关的疾病的治疗剂。特别地,术语与tnfα、干扰素、il-12和/或il-23过度分泌相关的疾病指全身性和皮肤性红斑狼疮、狼疮性肾炎、皮肌炎、舍格伦综合征、银屑病、类风湿性关节炎、银屑病性关节炎、多发性硬化症、21-三体综合征、溃疡性结肠炎和/或克罗恩病。更特别地,该术语指舍格伦综合征、银屑病、类风湿性关节炎、银屑病性关节炎、多发性硬化症、21-三体综合征、溃疡性结肠炎和/或克罗恩病。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗呼吸系统疾病。特别地,术语呼吸系统疾病指哮喘、成人呼吸窘迫综合征、等二氧化碳过度换气、季节性哮喘、季节性过敏性鼻炎、常年性过敏性鼻炎、慢性阻塞性肺病、肺气肿、肺高压、间质性肺纤维化、囊性纤维化或低氧。更特别地,该术语指肺高压或间质性肺纤维化。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗呼吸系统疾病的药剂中的用途。特别地,术语呼吸系统疾病指哮喘、成人呼吸窘迫综合征、等二氧化碳过度换气、季节性哮喘、季节性过敏性鼻炎、常年性过敏性鼻炎、慢性阻塞性肺病、肺气肿、肺高压、间质性肺纤维化、囊性纤维化或低氧。更特别地,该术语指肺高压或间质性肺纤维化。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有呼吸系统疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语呼吸系统疾病指哮喘、成人呼吸窘迫综合征、等二氧化碳过度换气、季节性哮喘、季节性过敏性鼻炎、常年性过敏性鼻炎、慢性阻塞性肺病、肺气肿、肺高压、间质性肺纤维化、囊性纤维化或低氧。更特别地,该术语指肺高压或间质性肺纤维化。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为呼吸系统疾病治疗剂。特别地,术语呼吸系统疾病指哮喘、成人呼吸窘迫综合征、等二氧化碳过度换气、季节性哮喘、季节性过敏性鼻炎、常年性过敏性鼻炎、慢性阻塞性肺病、肺气肿、肺高压、间质性肺纤维化、囊性纤维化或低氧。更特别地,该术语指肺高压或间质性肺纤维化。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗内分泌和/或代谢疾病。特别地,术语内分泌和/或代谢疾病指甲状腺功能减退症、先天性肾上腺增生、甲状旁腺疾病、糖尿病、肾上腺疾病、库欣综合征和艾迪生病、和卵巢功能障碍、多囊卵巢综合征、囊性纤维化、苯丙酮酸尿(pku)、糖尿病、高脂血症、痛风和佝偻病。更特别地,该术语指肥胖和/或ii型糖尿病。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗内分泌和/或代谢疾病的药剂中的用途。特别地,术语内分泌和/或代谢疾病指甲状腺功能减退症、先天性肾上腺增生、甲状旁腺疾病、糖尿病、肾上腺疾病、库欣综合征和艾迪生病和卵巢功能障碍、多囊卵巢综合征、囊性纤维化、苯丙酮酸尿(pku)、糖尿病、高脂血症、痛风和佝偻病。更特别地,该术语指肥胖和/或ii型糖尿病。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有内分泌和/或代谢疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语内分泌和/或代谢疾病指甲状腺功能减退症、先天性肾上腺增生、甲状旁腺疾病、糖尿病、肾上腺疾病、库欣综合征和艾迪生病和卵巢功能障碍、多囊卵巢综合征、囊性纤维化、苯丙酮酸尿(pku)、糖尿病、高脂血症、痛风和佝偻病。更特别地,该术语指肥胖和/或ii型糖尿病。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为内分泌和/或代谢疾病治疗剂。特别地,术语内分泌和/或代谢疾病指甲状腺功能减退症、先天性肾上腺增生、甲状旁腺疾病、糖尿病、肾上腺疾病、库欣综合征和艾迪生病和卵巢功能障碍、多囊卵巢综合征、囊性纤维化、苯丙酮酸尿(pku)、糖尿病、高脂血症、痛风和佝偻病。更特别地,该术语指肥胖和/或ii型糖尿病。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗心血管疾病。特别地,术语心血管疾病指心律失常(心房或心室或二者);动脉粥样硬化及其后遗症;心绞痛;心律紊乱;心肌缺血;心肌梗塞;心脏或血管动脉瘤;血管炎;中风;肢体、器官或组织的外周阻塞性动脉病;脑、心脏、肾脏或其它器官或组织缺血后再灌注损伤;内毒素性、外科或创伤性休克;高血压、瓣膜性心脏病、心力衰竭、异常血压;休克;血管收缩(包括与偏头痛相关的血管收缩);限于单个器官或组织的血管异常、炎症、功能不全。更特别地,该术语指动脉粥样硬化。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗心血管疾病的药剂中的用途。特别地,术语心血管疾病指心律失常(心房或心室或二者);动脉粥样硬化及其后遗症;心绞痛;心律紊乱;心肌缺血;心肌梗塞;心脏或血管动脉瘤;血管炎;中风;肢体、器官或组织的外周阻塞性动脉病;脑、心脏、肾脏或其它器官或组织缺血后再灌注损伤;内毒素性、外科或创伤性休克;高血压、瓣膜性心脏病、心力衰竭、异常血压;休克;血管收缩(包括与偏头痛相关的血管收缩);限于单个器官或组织的血管异常、炎症、功能不全。更特别地,该术语指动脉粥样硬化。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有心血管疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语心血管疾病指心律失常(心房或心室或二者);动脉粥样硬化及其后遗症;心绞痛;心律紊乱;心肌缺血;心肌梗塞;心脏或血管动脉瘤;血管炎;中风;肢体、器官或组织的外周阻塞性动脉病;脑、心脏、肾脏或其它器官或组织缺血后再灌注损伤;内毒素性、外科或创伤性休克;高血压、瓣膜性心脏病、心力衰竭、异常血压;休克;血管收缩(包括与偏头痛相关的血管收缩);限于单个器官或组织的血管异常、炎症、功能不全。更特别地,该术语指动脉粥样硬化。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为心血管疾病治疗剂。特别地,术语心血管疾病指心律失常(心房或心室或二者);动脉粥样硬化及其后遗症;心绞痛;心律紊乱;心肌缺血;心肌梗塞;心脏或血管动脉瘤;血管炎;中风;肢体、器官或组织的外周阻塞性动脉病;脑、心脏、肾脏或其它器官或组织缺血后再灌注损伤;内毒素性、外科或创伤性休克;高血压、瓣膜性心脏病、心力衰竭、异常血压;休克;血管收缩(包括与偏头痛相关的血管收缩);限于单个器官或组织的血管异常、炎症、功能不全。更特别地,该术语指动脉粥样硬化。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗皮肤病学疾病。特别地,术语皮肤病学疾病指特应性皮炎、大疱性疾病、胶原性疾病、银屑病、银屑病性病变、皮炎、接触性皮炎、湿疹、白斑、瘙痒症、荨麻疹、酒渣鼻、硬皮病、伤口愈合、瘢痕形成、肥厚瘢痕形成、瘢痕瘤、川崎病、酒渣鼻、舍格伦-拉森综合征或荨麻疹。更特别地,该术语指特应性皮炎、硬皮病、舍格伦-拉森综合征或荨麻疹。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗皮肤病学疾病的药剂中的用途。特别地,术语皮肤病学疾病指特应性皮炎、大疱性疾病、胶原性疾病、银屑病、银屑病性病变、皮炎、接触性皮炎、湿疹、白斑、瘙痒症、荨麻疹、酒渣鼻、硬皮病、伤口愈合、瘢痕形成、肥厚瘢痕形成、瘢痕瘤、川崎病、酒渣鼻、舍格伦-拉森综合征或荨麻疹。更特别地,该术语指特应性皮炎、硬皮病、舍格伦-拉森综合征或荨麻疹。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有皮肤病学疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语皮肤病学疾病指特应性皮炎、大疱性疾病、胶原性疾病、银屑病、银屑病性病变、皮炎、接触性皮炎、湿疹、白斑、瘙痒症、荨麻疹、酒渣鼻、硬皮病、伤口愈合、瘢痕形成、肥厚瘢痕形成、瘢痕瘤、川崎病、酒渣鼻、舍格伦-拉森综合征或荨麻疹。更特别地,该术语指特应性皮炎、硬皮病、舍格伦-拉森综合征或荨麻疹。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为皮肤病学疾病治疗剂。特别地,术语皮肤病学疾病指特应性皮炎、大疱性疾病、胶原性疾病、银屑病、银屑病性病变、皮炎、接触性皮炎、湿疹、白斑、瘙痒症、荨麻疹、酒渣鼻、硬皮病、伤口愈合、瘢痕形成、肥厚瘢痕形成、瘢痕瘤、川崎病、酒渣鼻、舍格伦-拉森综合征或荨麻疹。更特别地,该术语指特应性皮炎、硬皮病、舍格伦-拉森综合征或荨麻疹。
在一个实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物,其用于预防和/或治疗异常血管生成相关疾病。特别地,术语异常血管生成相关疾病指动脉粥样硬化、高血压、肿瘤生长、炎症、类风湿性关节炎、湿性黄斑变性、脉络膜新生血管形成、视网膜新生血管形成和糖尿病性视网膜病变。更特别地,该术语指动脉粥样硬化、高血压或糖尿病性视网膜病变。
在另一实施方案中,本发明提供了本发明的化合物或包含本发明的化合物的药物组合物在制造用于预防和/或治疗异常血管生成相关疾病的药剂中的用途。特别地,术语异常血管生成相关疾病指动脉粥样硬化、高血压、肿瘤生长、炎症、类风湿性关节炎、湿性黄斑变性、脉络膜新生血管形成、视网膜新生血管形成和糖尿病性视网膜病变。更特别地,该术语指动脉粥样硬化、高血压或糖尿病性视网膜病变。
在额外的治疗方法方面,本发明提供了预防和/或治疗患有异常血管生成相关疾病的哺乳动物的方法,所述方法包括施用有效量的本发明的化合物或本文所述药物组合物中的一或多者以治疗或预防所述病症。特别地,术语异常血管生成相关疾病指动脉粥样硬化、高血压、肿瘤生长、炎症、类风湿性关节炎、湿性黄斑变性、脉络膜新生血管形成、视网膜新生血管形成和糖尿病性视网膜病变。更特别地,该术语指动脉粥样硬化、高血压或糖尿病性视网膜病变。
在一个实施方案中,本发明提供了药物组合物,其包含本发明的化合物和另外的治疗剂。在一个特定实施方案中,另外的治疗剂为异常血管生成相关疾病治疗剂。特别地,术语异常血管生成相关疾病指动脉粥样硬化、高血压、肿瘤生长、炎症、类风湿性关节炎、湿性黄斑变性、脉络膜新生血管形成、视网膜新生血管形成和糖尿病性视网膜病变。更特别地,该术语指动脉粥样硬化、高血压或糖尿病性视网膜病变。
注射剂量水平的范围为约0.1mg/kg/h至至少10mg/kg/h,均为约1至约120小时和尤其是24至96小时。还可以施用约0.1mg/kg至约10mg/kg或更多的预载推注以达成足够的稳态水平。对于40至80kg人类患者而言,最大总剂量预期不超过约1克/天。
对于长期病症如退化性病症的预防和/或治疗,治疗方案通常延续数月或数年,因此口服给药对于患者便利性和耐受性而言是优选的。就口服给药而言,每天一至四(1至4)次规律给药、尤其是每天一至三(1至3)次规律给药、通常每天一至两(1至2)次规律给药和最通常每天一(1)次规律给药是代表性方案。或者,对于长持续起效的药物,就口服给药而言,每隔一周一次、每周一次和每天一次是代表性方案。特别地,给药方案可以是每个1至14天,更特别是1至10天,甚至更特别是1至7天,最特别是1至3天。
采用这些给药模式,各剂量提供了约1至约1000mg本发明的化合物,其中特定剂量各自提供了约10至约500mg、尤其是约30至约250mg。
通常选择经皮给药以提供与使用注射给药所达成的血液水平相似或更低的血液水平。
当用于阻止病症发作时,将本发明的化合物以上文所述的剂量水平施用于处于发生所述病症的风险中的患者,通常在医师的建议和监督下。处于发生特定病症的风险中的患者通常包括具有该病症的家族史的那些患者,或者已通过遗传测试或筛选鉴别为尤其易于发生该病症的那些患者。
本发明的化合物可以作为单独活性剂施用,或者可以与其它治疗剂组合施用,所述其它治疗剂包括呈现相同或相似治疗活性并且对于这类组合施用而言被确定为安全有效的其它的本发明的化合物。在一个特定实施方案中,两种(或更多种)活性剂的共同施用允许显著降低所使用的活性剂的剂量,由此减轻所见到的副作用。
在一个实施方案中,本发明的化合物或包含本发明的化合物的药物组合物作为药剂施用。在一个特定实施方案中,所述药物组合物另外包含其它活性成分。
在一个实施方案中,本发明的化合物与其它治疗剂共同施用以用于治疗和/或预防涉及炎症的疾病,特定治疗剂包括但不限于免疫调节剂如硫唑嘌呤、皮质类固醇(例如泼尼松龙或地塞米松)、环磷酰胺、环孢素a、他克莫司、麦考酚酸吗乙酯、莫非替克(mofetil)、莫罗单抗-cd3(okt3,例如
在一个实施方案中,本发明的化合物与其它治疗剂共同施用以用于治疗和/或预防关节炎(例如类风湿性关节炎),特定治疗剂包括但不限于镇痛剂、非类固醇抗炎药(nsaids)、类固醇、合成dmards(例如但不限于甲氨蝶呤、来氟米特、柳氮磺吡啶、金诺芬、金硫丁二钠、青霉胺、氯奎、羟氯喹、硫唑嘌呤、托法替尼(tofacitinib)、巴瑞替尼(baricitinib)、福他替尼(fostamatinib)和环孢素)和生物dmards(例如但不限于英夫利昔单抗、依那西普、阿达木单抗、利妥昔单抗和阿巴西普)。
在一个实施方案中,本发明的化合物与另外的治疗剂共同施用以治疗和/或预防增殖性疾病,特定治疗剂包括但不限于:甲氨蝶呤、亚叶酸、亚德利亚霉素(adriamycin)、泼尼松、博来霉素、环磷酰胺、5-氟尿嘧啶、紫杉醇(paclitaxel)、多西他赛、长春花新碱、长春花碱、长春瑞滨、多柔比星、他莫昔芬、托瑞米芬、醋酸甲地孕酮、阿那曲唑、戈舍瑞林、抗her2单克隆抗体(例如
在一个实施方案中,本发明的化合物与另外的治疗剂共同施用以治疗和/或预防自身免疫性疾病,特定治疗剂包括但不限于:糖皮质激素、细胞生长抑制剂(例如嘌呤类似物)、烷化剂(例如氮芥(环磷酰胺)、亚硝基脲、本发明的铂化合物及其它)、抗代谢物(例如甲氨蝶呤、硫唑嘌呤和巯嘌呤)、细胞毒性抗生素(例如更生霉素、蒽环类药物、丝裂霉素c、博来霉素和光神霉素)、抗体(例如抗cd20、抗cd25或抗cd3(otk3)单克隆抗体、
在一个实施方案中,本发明的化合物与另外的治疗剂共同施用以治疗和/或预防移植排斥,特定治疗剂包括但不限于:钙调磷酸酶抑制剂(例如环孢素或他克莫司(fk506))、mtor抑制剂(例如西罗莫司、依维莫司)、抗增殖物(例如硫唑嘌呤、麦考酚酸)、皮质类固醇(例如泼尼松龙、氢化可的松)、抗体(例如单克隆抗il-2rα受体抗体、巴利昔单抗、达珠单抗)、多克隆抗t-细胞抗体(例如抗胸腺细胞球蛋白(atg)、抗淋巴细胞球蛋白(alg))。
在一个实施方案中,本发明的化合物与另外的治疗剂共同施用以治疗和/或预防哮喘和/或鼻炎和/或copd,特定治疗剂包括但不限于:β2-肾上腺素受体激动剂(例如沙丁胺醇、左沙丁胺醇、特布他林和比托特罗(bitolterol))、肾上腺素(吸入或片剂)、抗胆碱能药(例如异丙托溴铵)、糖皮质激素(口服或吸入)、长效β2-激动剂(例如沙美特罗、福莫特罗、班布特罗和缓释口服沙丁胺醇)、吸入类固醇与长效支气管扩张药的组合(例如氟替卡松/沙美特罗、布地奈德/福莫特罗)、白细胞三烯拮抗剂和合成抑制剂(例如孟鲁司特、扎鲁司特和齐留通)、介体释放抑制剂(例如色甘酸酯和酮替芬)、ige响应生物调节剂(例如奥马珠单抗)、抗组胺药(例如西替利嗪、桂利嗪、非索非那定)和血管收缩剂(例如羟甲唑啉(oxymethazoline)、赛洛唑啉(xylomethazoline)、萘甲唑啉(nafazoline)和曲马唑啉)。
此外,本发明的化合物可以与用于哮喘和/或copd的紧急疗法组合施用,这类疗法包括氧或氦氧施用、雾化沙丁胺醇或特布他林(任选与以下组合:抗胆碱能药(例如异丙阿托品)、全身性类固醇(口服或静脉内,例如泼尼松、泼尼松龙、甲泼尼龙、地塞米松或氢化可的松)、静脉内沙丁胺醇、经注射或吸入的非特异性β激动剂(例如肾上腺素、异他林(isoetharine)、异丙肾上腺素、奥西那林)、抗胆碱能药(iv或雾化的(例如)格隆铵、阿托品、异丙阿托品)、甲基黄嘌呤(茶碱、氨茶碱、苄胺茶碱(bamiphylline))、具有支气管扩张效应的吸入麻醉剂(例如异氟烷、氟烷、恩氟烷)、氯胺酮和静脉内硫酸镁。
在一个实施方案中,本发明的化合物与另外的治疗剂共同施用以治疗和/或预防炎性肠病(ibd),特定治疗剂包括但不限于:糖皮质激素(例如泼尼松、布地奈德)、合成性改变病情免疫调节剂(例如甲氨蝶呤、来氟米特、柳氮磺吡啶、美沙拉嗪、硫唑嘌呤、6-巯基嘌呤和环孢素)和生物改变病情免疫调节剂(英夫利昔单抗、阿达木单抗、利妥昔单抗和阿巴西普)。
在一个实施方案中,本发明的化合物与另外的治疗剂共同施用以治疗和/或预防sle,特定治疗剂包括但不限于:人单克隆抗体(贝利单抗(belimumab)(benlysta))、改变病情抗风湿药物(dmards)如抗疟药(例如硫酸羟氯喹(plaquenil)、羟氯喹)、免疫抑制剂(例如甲氨喋呤和硫唑嘌呤)、环磷酰胺和麦考酚酸、免疫抑制药物和镇痛药,例如非甾体抗炎药、鸦片剂(例如右丙氧芬和可可达莫(co-codamol))、阿片样物质(例如氢可酮、羟考酮、mscontin或美沙酮)和芬太尼duragesic透皮贴剂。
在一个实施方案中,本发明的化合物与另外的治疗剂共同施用以治疗和/或预防银屑病,特定治疗药剂包括但不限于:局部治疗,例如含有煤焦油、二羟基蒽酚(地蒽酚)、皮质类固醇如去羟米松(topicorttm)、醋酸氟轻松、维生素d3类似物(例如卡泊三醇)、阿甘油(arganoil)和类视色素(依曲替酯、阿维a、他佐罗汀)的浴液、保湿霜、加药乳霜和软膏,全身性治疗如甲氨蝶呤、环孢素、类视色素、硫鸟嘌呤、羟基脲、柳氮磺吡啶、麦考酚酸吗乙酯、硫唑嘌呤、他克莫司、富马酸酯或生物剂如amevivetm、enbreltm、humiratm、remicadetm、raptivatm和尤特克单抗(ustekinumab)(为il-12和il-23阻断剂)。此外,本发明的化合物可以与其它疗法组合施用,所述疗法包括但不限于光疗法或光化学疗法(例如补骨脂素(psoralen)和紫外线a光疗法(puva))。
在一个实施方案中,本发明的化合物与另外的治疗剂共同施用以治疗和/或预防过敏反应,特定治疗剂包括但不限于:抗组胺药(例如西替利嗪、苯海拉明、非索非那定、左西替利嗪)、糖皮质激素(例如泼尼松、倍他米松、倍氯米松、地塞米松)、肾上腺素、茶碱或抗白细胞三烯(例如孟鲁司特或扎鲁司特)、抗胆碱能药和减充血药。
如本领域技术人员清楚的是,共同施用包括将两种或更多种治疗剂作为同一治疗方案的部分递送给患者的任意手段。尽管两种或更多种治疗剂可以在单一制剂中同时施用(即作为单一药物组合物),但是这不是必须的。治疗剂可以在不同制剂中和在不同时间施用。
化学合成操作
通用
本发明的化合物可使用以下的通用方法和操作、由容易获得的起始材料制备。可以理解,在给出典型或优选方法条件(即反应温度、时间、反应物的摩尔比、溶剂、压力等)的情况下,还可以使用其它方法条件,另有指示除外。最佳反应条件可以根据所用的具体反应物或溶剂而变化,但是这类条件可以由本领域技术人员通过常规优化操作来确定。
此外,如本领域技术人员清楚的是,可能需要常规保护基来阻止某些官能团经历不希望的反应。特定官能团的适宜保护基以及保护和脱保护的适宜条件的选择是本领域熟知的(wuts和greene2006)。
详细给出了有关制备上文所定义的本发明的化合物和比较实施例的以下方法。本发明的化合物可以由有机合成领域的技术人员用已知的或市售的起始材料和试剂来制备。
除非另有指出,否则所有试剂均为商品级,未经进一步纯化原样使用。市售无水溶剂用于在惰性氛围下进行的反应。除非另外规定,否则在所有其它情况中均使用试剂级溶剂。柱色谱法在硅胶60(35-70μm)、正相
表i.在实验部分中使用的缩略语清单
本发明的化合物的合成制备
实施例1.通用合成方法
1.1.合成方法概观
通用方法b:卤代硝基苯基或吡啶衍生物上的三取代苯胺的snar
方法b1:卤代硝基苯基衍生物上的二取代氨基苯甲酸酯的snar
方法b2:卤代硝基苯基衍生物上的二取代氨基苯甲酰胺的snar
方法b3:卤代硝基吡啶衍生物上的二取代氨基苯甲酰胺或苯甲酸酯的snar
通用方法c:还原和环化过程
方法c1:sncl2,2h2o/sncl2/原甲酸三甲酯
方法c2:zn/acoh/hc(och3)3
通用方法e:芳基偶联与肽偶联
方法e1:铃木(suzuki)反应过程(具有可交换顺序的3个步骤)
方法e2:布赫瓦尔德(buchwald)反应过程(3个步骤)
方法e3:铜胺化过程(3个步骤)
方法e4:硼化,然后铃木反应(3个步骤)
方法e5:氰化,然后成环过程(4个步骤)
通用方法f:杂芳基化合物的碘化
通用方法h:c-h活化
通用方法i:苯酚脱保护(去甲基化)
通用方法j:苯酚烷基化
方法j1:k2co3/烷基碘
方法j2:koh/(溴二氟甲基)膦酸二乙酯
通用方法k:胺脱保护
通用方法l:胺官能化
方法l1:还原胺化
方法l2:胺的n-烷基化
通用方法m:snar
方法m1:利用胺的snar
方法m2:利用醇的snar
通用方法n:吡唑烷基化
方法n1:利用烷基卤的烷基化
方法n2:利用卤代乙酸酯的烷基化
通用方法o:酰胺烷基化
通用方法p:叔丁酯的裂解
通用方法q:羧酸的酯化
方法q1:hatu
方法q2:socl2
方法q3:烷基溴/cs2co3
通用方法r:叔丁酯的酯交换
1.2.通用方法
1.2.1.方法b:卤代硝基苯基或吡啶衍生物上的三取代苯胺的snar
1.2.1.1.方法b1:卤代硝基苯基衍生物上的二取代氨基苯甲酸酯的snar
将4-氨基-2,6-二甲氧基-苯甲酸甲酯(1eq.)和4-溴-1-氟-2-硝基苯(1eq.)在thf中的溶液于0℃在n2下冷却。然后历时2小时滴加lihmds(在thf中的1m溶液,2.3eq.)。将反应用水淬灭。将thf蒸发,将剩余反应混合物于3℃搅拌过夜。向反应混合物中缓慢添加2mhcl并同时快速搅拌,将混合物于3℃搅拌1小时。过滤出沉淀,然后在真空烘箱中在45℃和20mbar下干燥5小时,得到预期中间体。
int59的说明性合成
将4-氨基-2,6-二甲氧基-苯甲酸甲酯(40g,189.4mmol,1eq.)和4-溴-1-氟-2-硝基苯(23.3ml,189.4mmol,1eq.)在thf(1000ml)中的溶液于0℃在n2下冷却。然后历时2小时滴加lihmds(在thf中的1m溶液,435.6ml,435.6mmol,2.3eq.)。将反应用水(800ml)淬灭。将thf蒸发,将剩余反应混合物于3℃搅拌过夜。向反应混合物中缓慢添加2mhcl(600ml)并同时快速搅拌,将混合物于3℃搅拌1小时。过滤出沉淀,然后在真空烘箱中在45℃和20mbar下干燥5小时,得到预期化合物。
1.2.1.2.方法b2:卤代硝基苯基衍生物上的二取代氨基苯甲酰胺的snar
向放置在氩气氛围下的二取代氨基苯甲酰胺(1至1.1eq.)在无水thf或dmf(在cn取代基的情况下使用dmf)中的溶液中添加氟代硝基衍生物(1至1.7eq.)。于0℃将混合物冷却,分批添加nah(3eq.)。将混合物于0℃搅拌10分钟,然后于室温搅拌过夜或加热至100℃达3小时(当w=-cn时)。将混合物冷却至0℃,用水或饱和nh4cl溶液淬灭,用etoac或dcm和水、饱和nh4cl溶液或盐水稀释,用etoac或dcm萃取。将合并的有机层干燥或用盐水洗涤,然后干燥(na2so4或mgso4),过滤,在真空中浓缩。通过硅胶快速色谱法纯化,得到所需化合物。
int61的说明性合成
向用n2脱气、然后放置在氩气氛围下的int12(3.90g,14.98mmol,1eq.)在无水thf(30ml)中的溶液中添加4-溴-1-氟-2-硝基苯(3.95g,17.97mmol,1.2eq.)。将混合物于0℃冷却,分批添加nah(1.79g,44.94mmol,3eq.)。将混合物升温至室温,于室温搅拌过夜。将混合物冷却至0℃,用冷水淬灭,用etoac、水和饱和nh4cl溶液稀释,用etoac萃取。将合并的有机层干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh95/5洗脱)纯化,得到预期产物。
4-(4-氰基-2-硝基-苯胺基)-2-(二氟甲氧基)-n-乙基-6-甲氧基-苯甲酰胺的说明性合成
向冷却至0℃的int12(1.00g,3.84mmol,1eq.)和氟-硝基衍生物(0.79g,4.77mmol,1.1eq.)在无水dmf(15ml)中的搅拌溶液中添加nah(0.46g,11.52mmol,3eq.)。将混合物于0℃搅拌1小时,然后于室温搅拌1小时,然后于100℃搅拌3小时。将混合物小心添加至冰/水混合物中。添加盐水,用etoac萃取水层。将合并的有机层经mgso4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至98/2洗脱)纯化,得到预期产物。
lcms:mw(计算值):406.3;m/zmw(实测值):407.3(m+h)。
1.2.1.3.方法b3:卤代硝基吡啶衍生物上的二取代氨基苯甲酰胺或苯甲酸酯的snar
向苯胺(1至1.2eq.)和氯代或氟代-硝基吡啶衍生物(1至1.2eq.)在无水dmso或dmf中的室温或加热至80℃的溶液中添加et3n(5eq.)。将混合物于80℃搅拌过夜。冷却至室温后,将混合物在真空中浓缩(仅与作为溶剂的dmf反应),用etoac或dcm、水或nacl溶液稀释,用etoac或dcm萃取。将合并的有机层干燥,过滤或通过在疏水柱上过滤干燥,在真空中浓缩。将残余物通过硅胶快速色谱法纯化,得到预期产物。
int73的说明性合成
向4-氨基-2,6-二甲氧基-苯甲酸甲酯(232mg,1.1mmol,1.2eq.)和5-溴-2-氯-3-硝基-吡啶(250mg,0.914mmol,1eq.)在无水dmso(0.5ml)中的于80℃搅拌5分钟的溶液中添加et3n(0.64ml,4.57mmol,5eq.)。将混合物于80℃搅拌,然后添加无水dmso(1ml),将混合物于80℃搅拌过夜。冷却至室温后,将混合物用etoac、水和盐水稀释。用etoac萃取水层。将合并的有机层干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用庚烷/etoac80/20洗脱)纯化,得到预期产物。
1.2.2.方法c:还原和环化过程
1.2.2.1.方法c1:sncl2,2h2o/sncl2/原甲酸三甲酯
将在etoh中的硝基苯胺衍生物(1eq.)、氯化锡(ii)二水合物(2.3eq.)和氯化锡(ii)(1.7eq.)的混合物于回流搅拌2小时。在通过uplc监测显示完全还原成胺后,缓慢添加原甲酸三甲酯(4eq.)至混合物中,于回流继续搅拌2小时。将混合物冷却至室温,浓缩至干。将残余物溶于etoac中,用2mnaoh洗涤。将形成的混悬液(软膏状锡)过滤。分离层。向有机层中添加饱和nahco3水溶液。再次形成混悬液。向混悬液中添加20%naoh(放热)。各层静置分离过夜。将有机层经k2co3干燥,过滤。将所有过滤残余物用etoac洗涤,与水层合并,分离各层。合并有机层,在减压下浓缩至干。将残余物混悬于et2o中,搅拌30分钟,过滤。滤饼在漏斗上抽吸20分钟,得到预期产物。
int45的说明性合成
将在etoh(1800ml)中的int59(148.2g,360.4mmol,1eq.)、氯化锡(ii)二水合物(188g,833.1mmol,2.3eq.)和氯化锡(ii)(116.2g,612.8mmol,1.7eq.)的混合物于回流搅拌2小时。在通过uplc监测显示完全还原成胺后,缓慢添加原甲酸三甲酯(157.7ml,1441.5mmol,4eq.)至混合物中,于回流继续搅拌2小时。将混合物冷却至室温,浓缩至干。将残余物溶于etoac(1400ml)中,用2mnaoh(600ml)洗涤。将形成的混悬液(软膏状锡)过滤(静置过滤过夜)。分离层。向有机层中添加饱和nahco3水溶液(1000ml)。再次形成混悬液。向混悬液中添加20%naoh(2000ml)(放热)。使层静置分离过夜。将有机层经k2co3干燥和过滤。将所有过滤残余物用etoac洗涤,与水层合并,分离各层。合并有机层,在减压下浓缩至干。将残余物混悬于et2o(500ml)中,搅拌30分钟,过滤。滤饼在漏斗上抽吸20分钟,得到预期产物int45(82.1g)。
1.2.2.2.方法c2:zn/acoh/hc(och3)3
向于室温或回流搅拌的在冰乙酸中的硝基氨基衍生物(1eq.)的溶液中分批引入锌粉(5至11.1eq.)。将所得混合物搅拌(75℃或回流)10分钟至1小时。(通过tlc和/或uplc-ms监测反应完全)。将反应混合物冷却至室温,在etoac或甲苯中稀释或未经稀释后经clarcel过滤,用etoac或甲苯或acoh或etoac和甲苯冲洗。将滤液蒸发至干,将二氨基衍生物原样用于下一步骤或将残余物通过快速色谱法在
向在meoh中的二氨基衍生物(1eq.)的溶液中引入对甲苯磺酸或对甲苯磺酸单水合物(0.2至0.6eq.)或acoh(0.2eq.)和原甲酸三甲酯(3至5eq.)。将所得混合物搅拌至75℃至回流(30分钟至过夜),冷却至室温。将反应混合物在真空中浓缩,通过硅胶快速色谱法纯化或利用水/etoac萃取和通过硅胶快速色谱法纯化,得到预期产物。
int42的说明性合成
向经回流搅拌的在冰乙酸中的int60(313mg,0.663mmol,1eq.)的溶液中分批引入锌粉(330mg,5.047mmol,7.6eq.)。将所得混合物搅拌至回流,然后再次添加锌粉(150mg,2.294mmol,3.5eq.),将混合物搅拌至回流(通过tlc监测完成)。将反应混合物冷却至室温,经clarcel过滤,用etoac和甲苯冲洗。将滤液在真空中浓缩,将4-(2-氨基-4-溴-苯胺基)-n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺(邻亚苯基二胺衍生物)原样用于下一步骤。
向在meoh(7ml)中的邻亚苯基二胺衍生物(0.663mmol,1eq.)的溶液中引入对甲苯磺酸单水合物(25mg,0.133mmol,0.2eq.)和原甲酸三甲酯(218μl,1.988mmol,3eq.)。将所得混合物于90℃搅拌30分钟,于室温搅拌过夜。将反应混合物在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh100/0至90/10洗脱)纯化,得到预期产物。
1.2.3.方法e
1.2.3.1.方法e1:铃木反应过程(具有可交换顺序的3个步骤)
方法e1:顺序e1.1+e1.2+e1.3
1.2.3.1.1e1.1:酯皂化
将甲酯衍生物(1eq.)、meoh/thf混合物或meoh和2mnaoh(2至20eq)的混合物或甲酯衍生物(1eq.)、meoh和naoh片(过量)的混合物在65至90℃下搅拌5小时至过夜。冷却至环境温度后,在减压下移除有机溶剂。将残余物用水稀释,用hcl(2n或6n)调整ph直至酸性ph。将所得混悬液过滤,用戊烷和et2o或水冲洗,在真空烘箱中干燥或将混悬液用chcl3/n-buoh混合物(9/1)萃取,将合并的有机层干燥,过滤,在真空中浓缩,得到预期产物。
int44的说明性合成
将4-(5-溴苯并咪唑-1-基)-2,6-二甲氧基-苯甲酸甲酯(int45)(82.1g,209.8mmol,1eq.)、meoh(450ml)、thf(550ml)和2mnaoh(550ml,1100mmol,5.2eq.)的混合物在75℃下搅拌过夜。冷却至环境温度后,在减压下移除有机溶剂。将残余物用水(800ml)稀释。利用6mhcl水溶液将ph自12.4调整至1.6。将所得混悬液在2℃下搅拌30分钟,然后过滤。将滤饼用水(800ml)洗涤,在漏斗上抽吸20分钟,得到暗红色固体。将该固体在真空烘箱中在45℃下干燥2小时,得到呈紫色粉末形式的4-(5-溴苯并咪唑-1-基)-2,6-二甲氧基-苯甲酸。
1.2.3.1.2e1.2:肽偶联
向烧瓶中放入羧酸衍生物(1eq.)、无水dmf、hatu(1.0至2eq.)、dipea(2至10eq.)。将混合物于室温搅拌5至20分钟,然后添加胺或盐酸胺(1.2至4.8eq.)。将混合物于室温搅拌1小时至96小时。向混合物中添加水后将沉淀过滤,得到预期酰胺衍生物,或者任选将混合物在真空中浓缩,添加水或饱和nahco3溶液,接着用etoac、etoac/meoh、etoac/i-proh或dcm萃取。然后将合并的有机层经疏水柱干燥或用hcl0.1n、然后用盐水洗涤或仅用盐水洗涤,经无水na2so4(或mgso4)干燥,过滤,在真空中浓缩。将残余物通过快速色谱法在硅胶或
int39的说明性合成
向烧瓶中放入int44(0.3g,0.795mmol,1eq.)、hatu(332mg,0.874mmol,1.1eq.)、无水dmf(9ml)和dipea(0.4ml,2.39mmol,3eq.)。将混合物于室温搅拌10分钟,然后添加2,2,2-三氟乙胺盐酸盐(216mg,1.6mmol,2eq.)。将混合物于室温搅拌过夜。在蒸发dmf后,将残余物在etoac与水之间分配。用etoac萃取水层。将合并的有机层经无水na2so4干燥,过滤,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到int39。
1.2.3.1.3e1.3:铃木反应
将配备有冷凝器的压力反应器或开口圆底烧瓶中放入杂芳基溴化物衍生物(1eq.)、硼酸或硼酸频哪醇酯(1.1至1.5eq.)、碱(cs2co3、na2co3或kf,2至3eq.)和二噁烷/水溶剂混合物(4/1或3/1)或dmf/水溶剂混合物(4/1)或thf/水混合物(9/1)或dme/水(10/1)。将混合物加热至50℃或回流,用n2脱气,然后添加pd催化剂(pd(ph3)4或pd(dppf)cl2·dcm加合物)(0.07至0.2eq.),或者于室温用n2或ar脱气,然后添加催化剂,或者将溶剂脱气,然后添加在混合物中,最后添加催化剂。将混合物于50℃至110℃搅拌15分钟至20小时。将反应混合物在真空中浓缩,将残余物溶于etoac或dcm和水中,或者将反应混合物用水或饱和nahco3溶液淬灭。然后将反应混合物用etoac或dcm萃取。任选将合并的有机层用盐水洗涤,经无水na2so4或mgso4干燥,过滤,在真空中浓缩,通过快速色谱法在硅胶或/和
cpd25的说明性合成
向烧瓶中放入4-(5-溴苯并咪唑-1-基)-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺(int39)(450mg,0.982mmol,1eq.)、cs2co3(961mg,2.95mmol,3eq.)、1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;306mg,1.47mmol,1.5eq.)和二噁烷/水溶剂混合物:4/1(20ml)。将混合物加热至100℃,用n2脱气5分钟,然后添加pd(pph3)4(173mg,0.15mmol,0.15eq.)。将混合物于100℃搅拌2小时。将反应混合物在真空中浓缩。将残余物溶于etoac和水中,用etoac萃取水层。将合并的有机层经无水na2so4干燥,过滤,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh95/5洗脱)纯化,得到预期化合物。
cpd51的说明性合成
向烧瓶中放入4-(5-溴苯并咪唑-1-基)-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺(int39)(40mg,0.09mmol,1eq.)、kf(16mg,0.27mmol,3eq.)、4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)异噁唑(cas号928664-98-6;26mg,0.135mmol,1.5eq.)和dmf/水溶剂混合物:4/1(2ml)。将混合物加热至50℃,用n2脱气3分钟,然后添加pd(dppf)cl2·dcm(8mg,0.009mmol,0.1eq.)。将混合物于50℃搅拌2小时。将混合物在etoac与水之间分配,用etoac萃取水层。将合并的有机层经无水na2so4干燥,过滤,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh95/5洗脱)纯化,然后通过制备型hplc纯化,得到预期化合物。
cpd55的说明性合成
向烧瓶中放入int42(50mg,0.11mmol,1eq.)、cs2co3(107mg,0.33mmol,3eq.)、2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1h-吡唑-1-基)乙腈(cas号1093307-35-7;33mg,0.14mmol,1.3eq.)和thf/水溶剂混合物:9/1(3ml)。将混合物加热至回流,用n2脱气5分钟,然后添加pd(dppf)cl2·dcm(9mg,0.01mmol,0.1eq.)。将混合物于回流搅拌1小时。将混合物在dcm与水之间分配,用dcm萃取水层。将合并的有机层通过疏水柱过滤干燥,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh95/5洗脱)纯化。在异丙醚和数滴acn中研磨,然后过滤,得到预期化合物。
cpd124的说明性合成
向先前脱气的int37(90mg,0.19mmol,1eq.)、1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(47mg,0.23mmol,1.2eq.)的溶液中添加cs2co3(124mg,0.38mmol,2eq.)和pd(dppf)cl2·dcm络合物(15.5mg,0.019mmol,0.1eq.)。将溶液于105至110℃搅拌2小时。将反应混合物在dcm中稀释,用水和盐水洗涤。将有机层分离,经mgso4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,然后在et2o中研磨,在真空中浓缩,得到预期化合物。
1.2.3.1.4e1.3a:无水的铃木反应
cpd284的说明性合成
向烧瓶中放入int37(50mg,0.110mmol,1eq.)、1-(乙氧羰基甲基)-1h-吡唑-4-硼酸频哪醇酯(cas号864754-16-5;34mg,0.12mmol,1.1eq.)、cs2co3(72mg,0.22mmol,2eq.)、经n2脱气的二噁烷(1ml)和pd(dppf)cl2·dcm加合物(6.3mg,0.008mmol,0.07eq.)。将烧瓶密封,将混合物加热至90℃持续6.5小时。添加1-(乙氧羰基甲基)-1h-吡唑-4-硼酸频哪醇酯(cas号864754-16-5;10mg,0.04mmol,0.3eq.)和pd(dppf)cl2·dcm加合物(6.3mg,0.008mmol,0.07eq.),将混合物于90℃搅拌2小时。将溶剂蒸发,将残余物溶于etoac和水中,用etoac萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩,通过硅胶快速色谱法(用庚烷/etoac100/0至0/100、然后etoac/meoh100/0至90/10洗脱)纯化。在蒸发后,添加acn至残余物中,将获得的所得固体过滤,得到预期化合物。
int3的说明性合成
向烧瓶中放入7-溴咪唑并[1,2-a]吡啶(476mg,2.42mmol,1eq.)、经n2脱气的二噁烷(15ml)、1-(乙氧羰基甲基)-1h-吡唑-4-硼酸频哪醇酯(cas号864754-16-5;745mg,2.66mmol,1.1eq.)、cs2co3(1.58g,4.84mmol,2eq.)和pd(dppf)cl2·dcm加合物(138mg,0.17mmol,0.07eq.)。将烧瓶密封,用n2净化,将混合物加热至90℃持续3小时。将etoac、水和盐水添加至混合物中,接着用etoac、然后dcm萃取。通过过滤移除不可溶物质,将有机层通过经疏水柱过滤单独地干燥,然后合并,在真空中浓缩,通过硅胶快速色谱法(用庚烷/etoac100/0至0/100、然后dcm/meoh100/0至90/10洗脱)纯化,得到预期产物。
1.2.3.1.5e1.3b:具有腈水解的铃木反应
通用方法:向烧瓶中放入适当的中间体(1eq.)和二噁烷/水溶剂混合物4/1。将混合物用n2脱气,然后添加硼酸酯(1.2至1.5eq.)、cs2co3(2eq.)和pd催化剂(pd(dppf)cl2·dcm0.1eq.或pd(pph3)40.15eq.)。将烧瓶密封,将混合物加热至90℃至100℃持续1小时至1.5小时。将反应混合物用水或饱和nahco3溶液淬灭,用etoac或dcm萃取。将合并的有机层经无水na2so4干燥,过滤,或用盐水洗涤和通过疏水柱过滤进行干燥,然后在真空中浓缩,通过硅胶快速色谱法纯化,任选溶于dcm中,进行spm323-巯基丙基乙基硫醚二氧化硅处理,得到预期化合物。
cpd259和cpd258的说明性合成
向烧瓶中放入int46(50mg,0.110mmol,1eq.)、经n2脱气的二噁烷/水溶剂混合物:4/1(1ml)、3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡啶-4-甲腈(cas号878194-91-3;38mg,0.164mmol,1.5eq.)、cs2co3(83mg,0.218mmol,2eq.)和pd(dppf)cl2·dcm(9mg,0.011mmol,0.1eq.)。将烧瓶密封,将混合物加热至90℃持续1小时。将反应混合物用水淬灭,用etoac萃取。将合并的有机层经无水na2so4干燥,过滤,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh99/1至97/3洗脱)纯化,得到预期腈化合物(cpd258)。lcms:mw(计算值):481.4;m/zmw(实测值):482.0(m+h)。自97/3至90/10继续洗脱,得到预期甲酰胺化合物(cpd259)。
lcms:mw(计算值):499.4;m/zmw(实测值):500.2(m+h)
1.2.3.1.6e1.3c:具有酯裂解的铃木反应
cpd255的说明性合成
向烧瓶中放入int46(100mg,0.218mmol,1eq.)、cs2co3(142mg,0.44mmol,2eq.)、4-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑-1-基]丁酸甲酯(int72)(71mg,0.24mmol,1.1eq.)和经n2脱气的二噁烷/水溶剂混合物:4/1(4ml)。添加pd(dppf)cl2·dcm(12mg,0.015mmol,0.07eq.),然后将烧瓶密封,将混合物加热至90℃持续2小时,然后至50℃过夜。添加1ml水,将混合物于90℃搅拌4小时。将混合物在真空中浓缩,将残余物在et2o与水之间分配。将有机层用水萃取。将合并的水层用hcl2n酸化至ph5至6,用etoac萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh100/0至90/10洗脱)纯化。将在蒸发级分期间形成的沉淀过滤,用et2o冲洗,得到预期化合物。
1.2.3.2.方法e1:顺序e1.1+e1.3+e1.2
1.2.3.2.1e1.1:酯皂化
参见顺序e1.1+e1.2+e1.3的e1.1
1.2.3.2.2e1.3:铃木偶联
向烧瓶中放入适当的中间体(1eq.)、硼酸酯(1.3eq.)、cs2co3(3eq.)和二噁烷/水溶剂混合物:4/1。将混合物用n2脱气,然后添加pd(pph3)4(0.15eq.)。将混合物回流搅拌2小时,然后在真空中浓缩,用etoac和水稀释,用naoh(2n)碱化至ph9至10。分离水相,用hcl(1n)酸化至ph2至3,然后添加氯仿/n-buoh混合物:4/1。将形成的固体过滤,溶于dcm/meoh混合物:50/50中。将溶液干燥,过滤,在真空中浓缩。在异丙醚和acn中研磨,然后在真空中浓缩,得到预期化合物。
int50的说明性合成
向烧瓶中放入int44(2.5g,6.62mmol,1eq.)、1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;1.79g,8.61mmol,1.3eq.)、cs2co3(6.5g,19.9mmol,3eq.)和二噁烷/水溶剂混合物:4/1(100ml)。将混合物用n2脱气,然后添加pd(pph3)4(1.14g,0.99mmol,0.15eq.)。将混合物回流搅拌2小时,然后在真空中浓缩,用etoac和水稀释,用naoh(2n)碱化至ph9至10。分离水相,用hcl(1n)酸化至ph2至3,然后添加chcl3/n-buoh4/1混合物。将形成的固体过滤,溶于dcm/meoh混合物:50/50中。将溶液干燥,过滤,在真空中浓缩。在异丙醚和acn中研磨,然后在真空中浓缩,得到预期化合物。
1.2.3.2.3e1.2:肽偶联
向烧瓶中放入羧酸衍生物(1eq.)、hatu(1.1至1.2eq.)、无水dmf或dmso和dipea(3eq.)。将混合物于室温搅拌5分钟,然后添加胺(3eq.)。将混合物于室温搅拌1小时至过夜。将混合物通过制备型lcms纯化(在作为溶剂的dmso和dmf中反应)以得到所需酰胺,或在真空中浓缩,溶于etoac和水中,用etoac萃取(在dmf中反应),或在dcm或etoac中稀释,用水和/或盐水洗涤(在dmf中反应)。然后将合并的有机层干燥和过滤,或通过在疏水柱上过滤进行干燥,在真空中浓缩,通过硅胶快速色谱法纯化,得到所需酰胺。
cpd86的说明性合成
向烧瓶中放入int50(1.4g,3.69mmol,1eq.)、hatu(1.54g,4.06mmol,1.1eq.)、无水dmf(4ml)和dipea(1.92ml,11.07mmol,3eq.)。将混合物于室温搅拌5分钟,然后添加环丙胺(游离碱)(632mg,11.07mmol,3eq.)。将混合物于室温搅拌2小时。将混合物在真空中浓缩,将残余物溶于etoac中,用水、然后用盐水洗涤。用etoac萃取水层。将合并的有机层干燥,过滤,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到预期酰胺衍生物。
1.2.3.2.4利用聚合物负载的向山(mukaiyama)试剂的e1.2
向烧瓶中放入羧酸衍生物(1eq.)、聚合物负载的向山试剂(2eq.)、胺(0.9eq.)、无水dcm和et3n(3eq.)。将混合物于室温搅拌40至48小时。将反应混合物在dcm中稀释,过滤,在真空中浓缩,通过制备型lcms纯化,得到预期酰胺化合物。
cpd70的说明性合成
向烧瓶中放入int50(50mg,0.131mmol,1eq.)、ps-向山试剂(aldrich,目录号657182;223mg,1.7至2.5eq.)、5-甲基吡嗪-2-胺(cas号5521-58-4;13mg,0.118mmol,0.9eq.)、et3n(55μl,0.393mmol,3eq.)和无水dcm(3ml)。将混合物于室温搅拌40小时。将反应混合物在dcm中稀释,过滤,在真空中浓缩,通过制备型lcms纯化,得到预期酰胺化合物。
1.2.3.3.方法e1:顺序e1.3+e1.1+e1.2
1.2.3.3.1e1.3:铃木偶联
参见顺序e1.1+e1.2+e1.3的e1.3
int51的说明性合成
向烧瓶中放入int35(2.26g,0.006mol.,1eq.)、二噁烷/水溶剂混合物:4/1(25ml)、1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;1.44g,0.007mol.,1.2eq.)、cs2co3(3.76g,0.012mol.,2eq.)和pd(dppf)cl2·dcm(0.47g,0.001mol.,0.1eq.)。将混合物于80℃搅拌3小时,然后用水淬灭。添加dcm和饱和nahco3溶液,用dcm萃取水层。将合并的有机层用饱和nahco3溶液、然后用盐水洗涤,经无水na2so4干燥,过滤,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh100/0至91/9洗脱)纯化。
int27的说明性合成
向烧瓶中放入int26(99mg,0.285mmol,1eq.)、二噁烷/水溶剂混合物:4/1(25ml),充入n2,然后添加1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;71mg,0.342mmol,1.2eq.)、cs2co3(186mg,0.570mol.,2eq.)和pd(pph3)4(49mg,0.043mmol,0.15eq.)。将混合物于100℃搅拌3小时,然后于室温搅拌过夜,用饱和nahco3溶液淬灭,用dcm萃取。将合并的有机层用盐水洗涤,经疏水柱干燥,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh100/0至96/4洗脱)纯化,得到所需中间体。
1.2.3.3.2用于引入三取代苯甲酸酯或苯甲酰胺的方法e1.3
int37的说明性合成
向烧瓶中放入7-溴-3-碘-咪唑并[1,2-a]吡啶(2g,6.19mmol,1eq.)、n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯甲酰胺(2.37g,6.19mmol,1eq.)(int17)、cs2co3(4.04g,12.39mmol,2eq.)和经n2脱气的二噁烷/水溶剂混合物:4/1(70ml)。添加pd(pph3)4(537mg,0.46mmol,0.075eq.),将系统用n2净化,然后将混合物于90℃搅拌20小时。将二噁烷蒸发,添加水,将混合物用etoac或dcm萃取。将合并的有机层用水和盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩直至当固体沉淀时留下约100mletoac。将固体过滤,用etoac、然后用et2o冲洗,得到预期溴代衍生物。
1.2.3.3.3用于引入杂芳基的方法e1.3
int1的说明性合成
将7-溴咪唑并[1,2-a]吡啶(100g,507.54mmol,1eq.)、1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;116.18g,558.29mmol,1.1eq.)、na2co3(161.37g,1522.61mmol,3eq.)添加至二噁烷/水溶剂混合物:3/1(1l)中。将混合物用n2脱气,然后添加pd(dppf)cl2·dcm加合物(2.07g,2.54mmol,0.005eq.),将混合物于100℃搅拌6小时。将混合物冷却至室温,在
int2的说明性合成
在密封管中放入7-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)咪唑并[1,2-a]吡啶(cas号908268-52-0;0.5g,2.05mmol,1eq.)、3-氯-6-甲基哒嗪(cas号1121-79-5;316mg,2.46mmol,1.2eq.)、cs2co3(1.34g,4.10mmol,2eq.)、pd(dppf)cl2·dcm(167mg,0.20mmol,0.1eq.)和经n2脱气的二噁烷/水溶剂混合物:4/1(10ml)。将系统用n2净化,然后将混合物于90℃搅拌1小时。将反应混合物冷却至室温,在etoac中稀释,经
1.2.3.3.4e1.1:酯的皂化
参见顺序e1.1+e1.2+e1.3的e1.1
int52的说明性合成
将int51(1.92g,0.005mol.,1eq.)、meoh(10ml)、thf(10ml)和2mnaoh(15ml,0.029mol,6eq.)的混合物于70℃搅拌18小时。冷却至环境温度后,在减压下移除有机溶剂。将hcl2n添加至残余物中,接着添加水和acn,将混悬液研磨,过滤,用水、然后can、然后acn/dcm混合物冲洗,得到int52。
2,6-二甲氧基-4-[7-(1-甲基咪唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酸的说明性合成
将2,6-二甲氧基-4-[7-(1-甲基咪唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酸甲酯(116mg,0.296mmol,1eq.)、meoh(5ml)、thf(5ml)和2mnaoh(0.89ml,1.774mmol,6eq.)的混合物于70℃搅拌16小时。然后添加2mnaoh(45μl,0.090mmol,0.3eq.),将混合物于90℃搅拌4小时,然后于室温搅拌48小时。冷却至环境温度后,在减压下移除有机溶剂,将hcl2n添加至残余物中,接着添加水。将混合物在真空中浓缩,溶于dcm和少量meoh中,过滤。将滤液在真空中浓缩,得到羧酸化合物。
lcms:mw(计算值):378.4;m/zmw(实测值):379.3(m+h)。
int28的说明性合成
将int27(43mg,0.109mmol,1eq.)、meoh(4ml)、thf(2ml)和2mnaoh(2ml,1.088mmol,10eq.)的混合物于70℃搅拌3.5小时,然后于90℃搅拌3小时,然后于室温搅拌过夜。将混合物溶于dcm和水中。将水层用dcm洗涤,然后用hcl2n酸化,用dcm萃取。将合并的有机层经疏水柱干燥和浓缩,得到羧酸化合物。
2-氯-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酸的说明性合成
将2-氯-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酸甲酯(80mg,0.20mmol,1eq.)、meoh(2ml)和2nnaoh(200μl,0.40mmol,2eq.)的混合物于回流搅拌48小时。冷却至室温后,在减压下移除有机溶剂。将残余物用水稀释。利用2nhcl水溶液将ph调整至6。将所得混悬液过滤,在真空中干燥,得到羧酸衍生物。
lcms:mw(计算值):382.8;m/zmw(实测值):383.3-385.2(m+h)。
4-[6-(1-乙基吡唑-4-基)咪唑并[4,5-b]吡啶-3-基]-2,6-二甲氧基苯甲酸的说明性合成
将4-[6-(1-乙基吡唑-4-基)咪唑并[4,5-b]吡啶-3-基]-2,6-二甲氧基苯甲酸甲酯(150mg,0.368mmol,1eq.)、meoh(5ml)和naoh(5片,过量)的混合物于65℃搅拌过夜。在减压下移除有机溶剂。将残余物用水稀释。利用2nhcl水溶液将ph调整至1至2。将所得混合物用n-buoh/meoh混合物(9/1)萃取,干燥,过滤,在真空中浓缩,得到羧酸衍生物。
lcms:mw(计算值):393.4;m/zmw(实测值):394.4(m+h)。
1.2.3.3.5方法e1.1(吡唑乙酸酯皂化)
cpd228的说明性合成
将cpd230(80mg,0.151mmol,1eq.)、etoh(2.4ml)和2nnaoh(90.3μl,0.18mmol,1.2eq.)的混合物于60℃搅拌20分钟。在真空下移除有机溶剂。将残余物用水和et2o稀释。分离水层,用2nhcl水溶液酸化至ph5。将形成的混悬液搅拌,过滤,将获得的固体通过制备型hplc纯化,得到预期化合物。
1.2.3.3.6e1.2:肽偶联
参见方法e1:顺序e1.1+e1.2+e1.3的e1.2。
cpd88的说明性合成
将int52(4.66g,0.012mol.,1eq.)混悬于无水dmf(45ml)中,然后添加hatu(5.62g,0.015mol.,1.2eq.)和dipea(6.44ml,0.037mol.,3eq.)。将混合物于室温搅拌5分钟,然后将2,2,2-三氟乙胺(cas号753-90-2;1.93ml,0.025mol.,2eq.)添加至溶液中。将反应混合物于室温搅拌16小时,用水淬灭。添加etoac和饱和nahco3溶液,用etoac萃取水层。将盐水添加至合并的有机层中,将形成的固体过滤,用etoac和二氯甲烷冲洗。
分离水层,再次用etoac萃取。将合并的有机层和之前的有机层经无水na2so4干燥,过滤,浓缩。将残余物溶于acn中,研磨,超声处理,过滤。将两次获得的固体合并,通过硅胶快速色谱法(用dcm/meoh100/0至96/4洗脱)纯化,得到预期酰胺衍生物。
lcms:mw(计算值):459.4;m/zmw(实测值):460.4(m+h)。
cpd52的说明性合成
向小瓶中放入int28(18.5mg,0.049mmol,1eq.)、无水dmf(1.5ml),然后放入dipea(26μl,0.146mmol,3eq.)和hatu(20mg,0.054mmol,1.1eq.)。将混合物于室温搅拌20分钟,然后添加2,2,2-三氟乙胺盐酸盐(13mg,0.098mol.,2eq.)。将反应混合物于室温搅拌16小时,用饱和nahco3溶液淬灭,用etoac萃取。将合并的有机层经疏水柱干燥,在真空中浓缩。将残余物溶于dcm中,超声处理,过滤,用et2o冲洗,得到所需化合物。
cpd29的说明性合成
向小瓶中放入4-[6-(1-乙基吡唑-4-基)咪唑并[4,5-b]吡啶-3-基]-2,6-二甲氧基-苯甲酸(58mg,0.147mmol,1eq.)、hatu(61mg,0.161mmol,1.1eq.)、无水dmf(3ml)和dipea(77μl,0.441mmol,3eq.)。将混合物于室温搅拌10分钟,然后添加2,2,2-三氟乙胺盐酸盐(60mg,0.441mmol,3eq.)。将反应混合物于室温搅拌16小时。添加etoac和盐水,用etoac萃取水层。将合并的有机层干燥,过滤,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)、然后通过制备型lcms纯化,得到预期酰胺衍生物。
cpd206的说明性合成
向小瓶中放入2-甲氧基-6-甲基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酸(60mg,0.16mmol,1eq.)、hatu(69mg,0.18mmol,1.1eq.)、无水dmf(1ml)和dipea(56μl,0.32mmol,2eq.)。将混合物于室温搅拌10分钟,然后添加2,2,2-三氟乙胺(15μl,0.19mmol,1.2eq.)。将反应混合物于室温搅拌96小时。将混合物在真空中浓缩,通过快速色谱法在
1.2.3.4.方法e2:布赫瓦尔德反应过程(3个步骤)
1.2.3.4.1e2.1:酯的皂化
参见方法e1部分e1.1+e1.2+e1.3的e1.1。
1.2.3.4.2e2.2:肽偶联
参见方法e1部分e1.1+e1.2+e1.3的e1.2。
1.2.3.4.3e2.3:布赫瓦尔德反应
向卤代芳基衍生物(1eq.)和胺衍生物(1.5eq.)在之前经n2脱气的二噁烷中的搅拌溶液中添加t-buok(3eq.)、t-buxphos(0.2eq.)和pd2(dba)3(0.1eq.)。将混合物加热至110℃过夜,然后加热至120℃持续96小时,然后通过制备型lcms纯化,得到预期化合物。
cpd154的说明性合成
向int39(46mg,0.10mmol,1eq.)和3-甲基吡唑(cas号1453-58-3;12μl,0.15mmol,1.5eq.)在之前经n2脱气的二噁烷(2ml)中的搅拌溶液中添加t-buok(34mg,0.30mmol,3eq.)、t-buxphos(9mg,0.02mmol,0.2eq.)和pd2(dba)3(9mg,0.01mmol,0.1eq.)。将混合物加热至110℃过夜,然后加热至120℃持续96小时,然后通过制备型lcms纯化,得到预期化合物。
1.2.3.5.方法e3:铜胺化过程(3个步骤)
1.2.3.5.1e3.1:酯皂化
参见方法e1部分e1.1+e1.2+e1.3的e1.1。
1.2.3.5.2e3.2:肽偶联
参见方法e1部分e1.1+e1.2+e1.3的e1.2。
1.2.3.5.3e3.3:铜胺化
向卤代芳基衍生物(1eq.)和胺衍生物(1eq.)在之前经n2脱气的dmf中的搅拌溶液中添加cs2co3(2.5eq.)、cui(0.4eq.)和n,n’-二甲基乙二胺(cas号110-70-3;0.2eq.)。将混合物加热至140℃持续20小时,然后通过制备型lcms纯化,得到预期化合物。
cpd155的说明性合成
向int39(92mg,0.20mmol,1eq.)和4(5)-甲基咪唑(cas号822-36-6;17mg,0.20mmol,1eq.)在之前经n2脱气的dmf(1ml)中的搅拌溶液中添加cs2co3(163mg,0.50mmol,2.5eq.)、cui(15mg,0.08mmol,0.4eq.)和n,n’-二甲基乙二胺(cas号110-70-3;5μl,0.04mmol,0.2eq.)。将混合物加热至140℃持续20小时,然后通过制备型lcms纯化,得到作为85/15区域异构体混合物的预期化合物。
1.2.3.6.方法e4:硼化、然后铃木反应(3个步骤)
1.2.3.6.1e4.1:酯皂化
参见方法e1部分e1.1+e1.2+e1.3的e1.1。
1.2.3.6.2e4.2:肽偶联
参见方法e1部分e1.1+e1.2+e1.3的e1.2。
1.2.3.6.3e4.3:硼化、然后铃木反应
1.2.3.6.3.1.e4.3i:1中的2个步骤(单罐法):
向烧瓶中放入卤代芳基衍生物(1eq.)、之前经n2脱气的二噁烷、b2pin2(1.1至1.5eq.)、乙酸钾(3至4eq.)和pd(dppf)cl2·dcm(0.1至0.12eq.)。将混合物于90℃至110℃搅拌1.5至20小时,冷却至室温或50℃,原样用于铃木偶联中(参见e1.3,使用0.9至1.4eq.的芳基溴或芳基氯)。
cpd273的说明性合成
向烧瓶中放入int37(100mg,0.22mmol,1eq.)、之前经n2脱气的二噁烷(4ml)、b2pin2(67mg,0.26mmol,1.2eq.)、乙酸钾(65mg,0.66mmol,3eq.)和pd(dppf)cl2·dcm(11mg,0.013mmol,0.06eq.)。将混合物于90℃搅拌20小时。添加pd(dppf)cl2·dcm(11mg,0.013mmol,0.06eq.)、b2pin2(17mg,0.065mmol,0.3eq.)、乙酸钾(22mg,0.22mmol,1eq.),将混合物于90℃搅拌3小时,冷却至室温,原样用于下一步骤。
铃木偶联(等同于e1.3步骤):取适量的之前的硼酸酯/硼酸混合物的溶液(2.1ml,0.11mmol,1eq.)放入烧瓶中,添加二噁烷和水(c=0.037m,二噁烷/水混合物:4/1),接着添加6-甲基氯哒嗪(13mg,0.099mmol,0.9eq.)、cs2co3(72mg,0.22mmol,2eq.)和pd(dppf)cl2·dcm(4.5mg,0.006mmol,0.05eq.)。将混合物于90℃搅拌3小时。将二噁烷蒸发,通过spe分离器用dcm萃取剩余水层。将合并的有机层在真空中浓缩,通过制备型lcms纯化,得到预期化合物。
1.2.3.6.3.2.e4.3ii:2个步骤
向烧瓶中放入卤代芳基衍生物(1eq.)、之前经n2脱气的二噁烷、b2pin2(1.5至2eq.)、乙酸钾(3eq.)和pd(dppf)cl2·dcm(0.1至0.2eq.)。若之前未经脱气,则将混合物用n2脱气。将混合物于100至110℃搅拌过夜,冷却至室温,直接在真空中浓缩,或经
cpd137的说明性合成
硼化:向烧瓶中放入int39(458mg,1mmol,1eq.)、b2pin2(381mg,1.5mmol,1.5eq.)、之前经n2脱气的二噁烷(5ml)、乙酸钾(295mg,3mmol,3eq.)和pd(dppf)cl2·dcm(82mg,0.10mmol,0.1eq.)。将混合物于100℃搅拌过夜,在真空中浓缩。将残余物在dcm和水中稀释。分离有机层,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到预期的硼酸酯和硼酸混合物。
lcms:mw(计算值):505.3;m/zmw(实测值):506.3(m+h)。
lcms:mw(计算值):423.1;m/zmw(实测值):424.1(m+h)。
铃木偶联:向硼酸酯和硼酸混合物(51mg,0.10mmol,1eq.)和4-溴-1-甲基-咪唑(cas号25676-75-9;10μl,0.10mmol,1eq.)在二噁烷(2ml)中的搅拌溶液中添加在水(0.5ml)中的cs2co3(65mg,0.20mmol,2eq.)、pd(pph3)4(12mg,0.01mmol,0.1eq.)。将混合物于90℃加热1小时,然后在真空中浓缩。将残余物在dcm和水中稀释。分离有机层,在真空中浓缩,通过快速色谱法在
1.2.3.7.方法e5:氰化,然后成环过程
1.2.3.7.1e5.1:酯的皂化
参见方法e1部分e1.1+e1.2+e1.3的e1.1。
1.2.3.7.2e5.2:肽偶联
参见方法e1部分e1.1+e1.2+e1.3的e1.2。
1.2.3.7.3e5.3:氰化
向芳基溴衍生物(1eq.)在经脱气的n,n-二甲基乙酰胺中的搅拌溶液中添加zncn2(2eq.)、pd2(dba)3(0.03eq.)、dppf(0.07eq.)和zn粉(0.04eq.)。将混合物用氩气脱气5分钟,于125℃搅拌3小时。将反应混合物过滤。添加dcm和水。分离有机层,在真空中浓缩。将残余物通过硅胶快速色谱法纯化,得到预期的腈中间体。
4-(5-氰基苯并咪唑-1-基)-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺的说明性合成
向int39(458mg,1.00mmol,1eq.)在经脱气的n,n-二甲基乙酰胺(5ml)中的搅拌液中添加zncn2(235mg,2.00mmol,2eq.)、pd2(dba)3(27mg,0.03mmol,0.03eq.)、dppf(39mg,0.07mmol,0.07eq.)和zn粉(3mg,0.04mmol,0.04eq.)。将混合物用氩气脱气5分钟,于125℃搅拌3小时。将反应混合物过滤。添加dcm和水。分离有机层,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至96/4洗脱)纯化,得到预期的腈中间体。
lcms:mw(计算值):404.3;m/zmw(实测值):405.3(m+h)。
1.2.3.7.4e5.4:成环
1.2.3.7.4.1.e5.4i:1,2,4-噁二唑成环
向腈衍生物(1.0eq.)在etoh中的搅拌溶液中添加et3n(3.0eq.)和羟胺盐酸盐(1.1eq.)。将反应混合物于80℃搅拌(4至5小时),在真空中浓缩。将残余物未经进一步纯化用于下一步骤或在
将乙酸酐添加至n-羟基甲脒中间体(1eq.),将所得混合物于100℃搅拌1小时至2小时,然后在真空中浓缩。将残余物通过硅胶快速色谱法、然后通过制备型lcms纯化或在
cpd126的说明性合成
向4-(5-氰基苯并咪唑-1-基)-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺(37mg,0.09mmol,1eq.)在etoh(2ml)中的搅拌溶液中添加et3n(37μl,0.27mmol,3.0eq.)和羟胺盐酸盐(7mg,0.10mmol,1.1eq.)。将反应混合物于80℃搅拌5小时,在真空中浓缩。将n-羟基甲脒中间体未经进一步纯化用于下一步骤。
将乙酸酐(1ml)添加至n-羟基甲脒中间体(39mg,0.09mmol,1.0eq.),将所得混合物于100℃搅拌1小时,然后在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至97/3洗脱)纯化,得到预期化合物。
1.2.3.7.4.2.e5.4ii:1,2,4-三唑成环
向腈衍生物(1.0eq.)在dmso中的搅拌溶液中添加溴化亚铜(i)(0.05eq.)、cs2co3(3.0eq.)和乙脒盐酸盐(cas号124-42-5;1.5eq.)。将反应混合物在125℃下搅拌过夜,然后通过制备型lcms纯化,得到预期化合物。
cpd127的说明性合成
向4-(5-氰基苯并咪唑-1-基)-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺(41mg,0.10mmol,1.0eq.)在dmso(0.5ml)中的搅拌溶液中添加溴化亚铜(i)(1mg,0.005mmol,0.05eq.)、cs2co3(98mg,0.30mmol,3.0eq.)和乙脒盐酸盐(cas号124-42-5;14mg,0.15mmol,1.5eq.)。将反应混合物在125℃下搅拌过夜,然后通过制备型lcms纯化,得到预期化合物。
1.2.4.方法f:溴代杂芳基化合物的碘化
在n2氛围下,向6-溴吡唑并[1,5-a]吡啶(cas号1264193-11-4;1eq.)在acn中的溶液中引入n-碘代琥珀酰亚胺(1.05eq.)。将所得溶液于室温搅拌过夜。将反应混合物过滤,将固体用数毫升acn洗涤,得到预期的溴代碘代杂芳基化合物。
int15的说明性合成
在n2氛围下,向6-溴吡唑并[1,5-a]吡啶(cas号1264193-11-4;650mg,3.3mmol,1eq.)在acn中的溶液中引入n-碘代琥珀酰亚胺(780mg,3.46mmol,1.05eq.)。将所得溶液于室温搅拌过夜。
将反应混合物过滤,将固体用数毫升acn洗涤,得到6-溴-3-碘-吡唑并[1,5-a]吡啶,将其原样用于下一步骤。
1.2.5.方法h:c-h活化
将含氮杂环(1eq.)溶于之前经n2脱气的dmac中。添加芳基溴(1.0至1.6eq.)和乙酸钾(2至3eq.)。将混合物用n2脱气,然后添加pd(dppf)cl2·dcm(0.005至0.05eq.)。将混合物加热至105至130℃持续2.5小时至过夜。
后处理:将混合物冷却至室温,然后在dcm/meoh混合物中稀释、经
供选后处理1:将混合物冷却至室温,然后经
供选后处理2:将混合物冷却至室温,然后过滤。将水添加至滤液中,将混悬液过滤。将固体用水洗涤,过滤,然后用mtbe研磨。将固体溶于水和dcm中,将混合物用dcm萃取。将合并的有机层用水洗涤,通过硅胶快速色谱法纯化,得到预期化合物。
cpd275的说明性合成
将int2(47mg,0.22mmol,1eq.)溶于dmac(2ml)中,添加int7(113mg,0.34mmol,1.5eq.)、乙酸钾(66mg,0.67mmol,3eq.)、pd(dppf)cl2·dcm(9mg,0.01mmol,0.05eq.),将混合物于110℃搅拌过夜。然后将混合物冷却至室温,用饱和nahco3溶液淬灭,用etoac萃取。将合并的有机层经无水na2so4干燥,过滤,在真空中浓缩。将残余物通过快速色谱法经
1.2.6.方法i:苯酚脱保护(去甲基化)
向甲氧基衍生物(1eq.)在冷却至0℃至-15℃的dcm中的搅拌混合物中滴加bcl3在dcm中的1m溶液(2.2eq.)。将混合物于0℃搅拌2小时或于0℃搅拌45分钟和于室温搅拌3小时。将反应混合物倒入冰/水混合物中,用hcl(2n)酸化,或倒入hcl(0.1n)/冰混合物中,接着用dcm和数滴meoh或用dcm、然后etoac、然后chcl3/n-buoh(90/10或80/20混合物)萃取。将合并的有机层干燥(经疏水柱过滤或na2so4),在真空中浓缩。将残余物原样用于下一步骤或通过硅胶快速色谱法纯化,得到所需苯酚化合物。
cpd233的说明性合成
向cpd88(100mg,0.218mmol,1eq.)在冷却至0℃的dcm(3ml)中的搅拌混合物中滴加bcl3在dcm中的1m溶液(479μl,0.479mmol,2.2eq.)。将混合物于0℃搅拌2小时。将反应混合物倒入hcl0.1n和冰混合物中,用dcm和数滴meoh萃取,然后将合并的有机层经疏水柱干燥,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至90/10洗脱)纯化,得到预期化合物。
1.2.7.方法j:苯酚烷基化
1.2.7.1.方法j1:k2co3/烷基碘
向苯酚衍生物(1eq.)在acn/thf1/1混合物中的搅拌混合物中滴加烷基卤化物(1.3eq.)。将混合物在80℃下搅拌50小时。将混合物溶于dcm中,将有机层用水洗涤,经疏水柱干燥,在真空中浓缩。将残余物通过制备型hplc纯化,得到预期化合物。
cpd119的说明性合成
向n-环丙基-2-羟基-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺(30mg,0.074mmol,1eq.)在acn/thf1/1混合物(4ml)中的搅拌混合物中滴加2-碘丙烷(16.3mg,0.096mmol,1.3eq.)。将混合物在80℃下搅拌50小时。将混合物溶于dcm中,将有机层用水洗涤,经疏水柱干燥,在真空中浓缩。将残余物通过制备型hplc纯化,得到预期化合物。
1.2.7.2.方法j2:koh/(溴二氟甲基)膦酸二乙酯
向苯酚衍生物(1eq.)在acn/水1/1混合物(2ml)中的搅拌混合物中添加koh片(10eq.)。将混合物于-40℃搅拌15分钟,然后添加(溴二氟甲基)膦酸二乙酯(cas号65094-22-6;3eq.)。将反应混合物于-40℃搅拌1小时,然后升温至室温,于室温搅拌过夜。添加另外的koh(过量)和(溴二氟甲基)膦酸二乙酯(3eq.),将混合物于室温搅拌4小时,然后于90℃搅拌2小时,然后于室温搅拌48小时。将混合物用饱和nahco3溶液淬灭,用dcm萃取。将合并的有机层用盐水洗涤,通过疏水柱过滤进行干燥,在真空中浓缩。将残余物通过硅胶快速色谱法纯化,得到预期化合物。
cpd17的说明性合成
向cpd23(36mg,0.089mmol,1eq.)在acn/水1/1混合物(2ml)中的搅拌混合物中添加koh片(50mg,0.888mmol,10eq.)。将混合物于-40℃搅拌15分钟,然后添加(溴二氟甲基)膦酸二乙酯(47μl,0.266mmol,3eq.)。将反应混合物于-40℃搅拌1小时,然后升温至室温,于室温搅拌过夜。添加另外的koh(过量)和(溴二氟甲基)膦酸二乙酯(47μl,0.266mmol,3eq.),将混合物于室温搅拌4小时,然后于90℃搅拌2小时,然后于室温搅拌48小时。将混合物用饱和nahco3溶液淬灭,用dcm萃取。将合并的有机层用盐水洗涤,通过疏水柱过滤进行干燥,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至96/4洗脱)纯化,得到预期化合物。
1.2.8.方法k:胺脱保护
向n-boc保护的胺衍生物(1eq.)在dcm中的搅拌溶液中添加tfa(dcm/tfa混合物:90/10至50/50)。将反应混合物于室温搅拌18至72小时。将反应混合物用dcm稀释,冷却至0℃,用水稀释,用naoh(2n)碱化(ph10至11),萃取,将合并的有机层干燥,过滤,在真空中浓缩,得到预期化合物,或者将反应混合物在甲苯中稀释,在真空中浓缩,用dcm、数滴meoh和饱和na2co3溶液稀释和分离有机层,用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩,通过快速色谱法在
cpd94的说明性合成
向3-[4-[1-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]苯并咪唑-5-基]吡唑-1-基]氮杂环丁烷-1-甲酸叔丁酯(235mg,0.39mmol,1eq.)在dcm(4ml)中的搅拌溶液中添加tfa(0.4ml)。将反应混合物于室温搅拌72小时。将反应混合物蒸发至干,然后用dcm和饱和na2co3溶液稀释。分离有机层,在真空中浓缩。将残余物通过快速色谱法在
1.2.9.方法l:胺官能化
1.2.9.1.方法l1:还原胺化
1.2.9.1.1方法l1i:采用甲醛/nabh(oac)3/acoh进行的还原胺化
向搅拌的在acn或dcm中的胺或胺tfa盐衍生物(1eq.)的溶液中添加甲醛(37%在水中)(3eq.)和acoh(0.1至1eq.)。将反应混合物于室温搅拌,添加nabh(oac)3(3eq.)。将反应混合物于室温搅拌过夜。将其在真空中浓缩,用dcm和饱和nahco3溶液稀释,然后分离有机层,在真空中浓缩,将残余物通过快速色谱法在
cpd98的说明性合成
向搅拌的在acn(2ml)中的cpd94(50mg,0.10mmol,1eq.)的溶液中添加甲醛(37%在水中)(24μl,0.30mmol,3eq.)和acoh(12μl,0.01mmol,0.1eq.)。将反应混合物于室温搅拌5分钟,添加nabh(oac)3(64mg,0.30mmol,3eq.)。将反应混合物于室温搅拌过夜,在真空中浓缩,用dcm和饱和nahco3溶液稀释。分离有机层,在真空中浓缩。将残余物通过快速色谱法在
1.2.9.1.2方法l1ii:采用甲醛/nabh4进行的还原胺化
于0℃和在n2气氛下,向搅拌的在meoh中的胺衍生物(1eq.)的溶液中添加甲醛(37%在水中)(11eq.),然后添加nabh4(20eq.)。将反应混合物升温至室温,搅拌1小时。添加naoh溶液(2n),将形成的固体过滤,然后通过硅胶快速色谱法纯化,得到预期化合物。
cpd46的说明性合成
于0℃和在n2氛围下,向搅拌的在meoh(3ml)中的cpd42(60mg,0.11mmol,1eq.)的溶液中添加甲醛(37%在水中)(47μl,1.24mmol,11eq.),然后添加nabh4(85mg,2.26mmol,20eq.)。将反应混合物升温至室温,搅拌1小时。添加naoh溶液(2n),将形成的固体过滤,通过硅胶快速色谱法(用dcm/meoh90/10洗脱)纯化,得到预期化合物。
1.2.9.2.方法l2:胺的n-烷基化
1.2.9.2.1方法l2i:采用2-溴乙腈进行的烷基化
向搅拌的在acn中的胺衍生物(1eq.)的溶液中添加k2co3(2eq.)和2-溴乙腈(1.1eq.)。将反应混合物于室温搅拌过夜至72小时。将反应混合物在真空中浓缩,用dcm和水稀释,分离有机层,在真空中浓缩,或者添加饱和nahco3溶液,将混合物用etoac萃取,将合并的有机层经无水na2so4干燥,过滤,在真空中浓缩。将由一种或其它方式获得的残余物通过硅胶快速色谱法纯化,得到预期化合物。
cpd100的说明性合成
向搅拌的在acn(2ml)中的cpd94(41mg,0.08mmol,1eq.)的溶液中添加k2co3(22mg,0.16mmol,2eq.)和2-溴乙腈(6μl,0.09mmol,1.1eq.)。将反应混合物于室温搅拌72小时。将反应混合物在真空中浓缩,用dcm和水稀释。分离有机层,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到预期化合物。
1.2.9.2.2方法l2ii:采用丙-2-烯腈进行的烷基化
向胺衍生物(1eq.)在meoh中的搅拌混合物中添加dipea(5eq.)和丙-2-烯腈(1.1eq.)。将反应混合物于室温搅拌1小时,然后添加acn,将混合物于室温搅拌过夜。添加饱和nahco3溶液,将混合物用etoac萃取。将合并的有机层经na2so4干燥,过滤,在真空中浓缩,通过硅胶快速色谱法纯化,得到预期化合物。
cpd264的说明性合成
向搅拌的在meoh(0.5ml)中的4-[7-[1-(氮杂环丁烷-3-基)吡唑-4-基]咪唑并[1,2-a]吡啶-3-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺(50mg,0.10mmol,1eq.)的混合物中添加dipea(83μl,0.50mmol,5eq.)和丙-2-烯腈(7μl,0.11mmol,1.1eq.)。将反应混合物于室温搅拌1小时,然后添加acn(0.2ml),将混合物于室温搅拌过夜。添加饱和nahco3溶液,将混合物用etoac萃取。将合并的有机层经na2so4干燥,过滤,在真空中浓缩,通过硅胶快速色谱法(用dcm/meoh99/1至95/5洗脱)纯化,得到预期化合物。
1.2.10.方法m:snar
1.2.10.1.方法m1:用胺进行的snar
在密封小瓶中,向搅拌的在thf中的芳基氟衍生物(1eq.)的溶液中添加碳酸钾(3eq.)和胺衍生物(20至50eq.)。将混合物于90℃搅拌48小时。若此时未达成完全反应,则添加碳酸钾(3eq.)和胺衍生物(50eq.)并将混合物于90℃搅拌,然后将混合物在真空中浓缩,添加胺衍生物(过量)并将混合物于90℃搅拌18小时,分3次再次添加胺衍生物(过量)并将混合物于65℃搅拌32小时和于75℃搅拌3天。将混合物在真空中浓缩。通过硅胶快速色谱法或通过制备型lcms纯化,得到所需化合物。
cpd204的说明性合成
在密封小瓶中,向cpd203(55mg,0.12mmol,1eq.)在thf(3ml)中的搅拌溶液中添加碳酸钾(50mg,0.36mmol,3eq.)和2m甲胺的thf溶液(1.2ml,2.40mmol,20eq.)。将混合物于90℃搅拌48小时。将混合物在真空中浓缩。通过硅胶快速色谱法(用meoh在dcm中的0至3%溶液洗脱)纯化,得到所需化合物。
1.2.10.2.方法m2:采用醇进行的snar
向于室温搅拌5分钟的t-buok(3eq.)和醇(过量)的混合物中添加芳基氟衍生物(1eq.)。将反应混合物于80℃搅拌(2小时至26小时)和于室温搅拌48小时。若此时未达成完全反应,则添加t-buok(3eq.)和醇(过量),将混合物于80℃搅拌18小时,然后于110℃搅拌3小时。将混合物用dcm萃取,通过制备型lcms纯化,得到预期化合物。
cpd278的说明性合成
向于室温搅拌5分钟的t-buok(33mg,0.30mmol,3eq.)和2-甲氧基乙醇(0.5ml,过量)的混合物中添加n-环丙基-2-氟-6-甲氧基-4-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-3-基]苯甲酰胺(cpd276)(40mg,0.10mmol,1eq.)。将反应混合物于80℃搅拌2小时和于室温搅拌48小时,用dcm萃取,通过制备型lcms纯化,得到预期化合物。
1.2.11.方法n:吡唑烷基化
1.2.11.1.方法n1:采用烷基卤进行的烷基化
在密封小瓶中,向搅拌的在acn(2ml)中的吡唑衍生物(1eq.)的溶液中添加k2co3(2eq.)和烷基卤(1.3eq.)。将反应混合物于60℃搅拌2小时和于90℃搅拌过夜或于90℃搅拌过夜。添加另外的烷基卤(3.0eq.),将反应混合物于100℃搅拌(3小时至过夜)。将反应混合物在真空中浓缩,用dcm和水稀释。分离有机层,在真空中浓缩。将残余物通过硅胶快速色谱法纯化,得到预期化合物。
cpd110的说明性合成
在密封小瓶中,向搅拌的在acn(2ml)中的cpd47(36mg,0.08mmol,1eq.)的溶液中添加k2co3(22mg,0.16mmol,2eq.)和1-溴-2-甲基-丙烷(12μl,0.10mmol,1.3eq.)。将反应混合物于60℃搅拌2小时和于90℃搅拌过夜。添加另外的1-溴-2-甲基-丙烷(3.0eq.),将反应混合物于100℃搅拌过夜。将反应混合物在真空中浓缩,用dcm和水稀释。分离有机层,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到预期化合物。
1.2.11.2.方法n2:采用卤代乙酸酯进行的烷基化
向吡唑衍生物(1eq.)在dmf中的搅拌溶液中添加k2co3(1.5eq.)和卤代乙酸酯衍生物(1.05eq.)。将反应混合物于50℃搅拌3小时和于60℃搅拌2小时。将反应物冷却至室温,添加水。用etoac萃取水层,将合并的有机层用盐水洗涤,经mgso4干燥,过滤,在真空中浓缩。将残余物在二氧化硅饼上过滤进行纯化,然后通过制备型lcms纯化,然后通过硅胶快速色谱法纯化,得到预期化合物。
cpd229的说明性合成
向搅拌的在dmf(10ml)中的cpd227(262mg,0.588mmol,1eq.)的溶液中添加k2co3(122mg,0.882mmol,1.5eq.)和2-氯乙酸叔丁酯(88μl,0.618mmol,1.05eq.)。将反应混合物于50℃搅拌3小时和于60℃搅拌2小时。将反应物冷却至室温,添加水。用etoac萃取水层,将合并的有机层用盐水洗涤,经mgso4干燥,过滤,在真空中浓缩。将残余物在二氧化硅饼上过滤进行纯化(用dcm/meoh100/0至90/10洗脱),然后通过制备型lcms纯化,然后通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到预期化合物。
1.2.12.方法o:酰胺烷基化
于0℃向酰胺衍生物(1eq.)在nmp/thf混合物(1/1)或dmac中的搅拌混合物中滴加lihmds在thf中的1n溶液(1.4至1.7eq.)。搅拌15分钟后,于0℃添加三氟甲磺酸酯衍生物(1.4至1.7eq.),使反应混合物升温至室温,然后于室温搅拌过夜,将反应混合物通过添加饱和nahco3溶液淬灭,或者于100℃搅拌1小时,然后于120℃搅拌30分钟。在此最后一种情况下,添加额外的lihmds在thf中的1n溶液(1.7eq.),将反应混合物搅拌15分钟,添加三氟甲磺酸2,2,2-三氟乙酯(3.4eq.),将反应混合物于120℃搅拌30分钟,将反应混合物通过添加饱和nahco3溶液淬灭。将混合物用etoac萃取,将合并的有机层用盐水洗涤,经na2so4或mgso4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法纯化,在热acn中结晶或在et2o中沉淀,得到预期化合物。
cpd225的说明性合成
于0℃向int76(20mg,0.054mmol,1eq.)在nmp(2ml)和thf(1.9ml)中的搅拌混合物中滴加lihmds在thf中的1n溶液(92μl,0.093mmol,1.7eq.)。搅拌15分钟后,于0℃添加三氟甲磺酸2,2,2-三氟乙酯(13.5μl,0.093mmol,1.7eq.),使反应混合物升温至室温,然后至100℃搅拌1小时,然后至120℃搅拌30分钟。添加额外的lihmds在thf中的1n溶液(92μl,0.093mmol,1.7eq.),将反应混合物搅拌15分钟,添加三氟甲磺酸2,2,2-三氟乙酯(27μl,0.19mmol,3.4eq.)。将反应混合物于120℃搅拌30分钟。将反应混合物通过添加饱和nahco3溶液淬灭,将混合物用etoac萃取,将合并的有机层用盐水洗涤,经na2so4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法纯化两次(用dcm/meoh100/0至95/5洗脱),然后在热acn中结晶,得到预期化合物。
1.2.13.方法p:叔丁酯的裂解
向搅拌的在dcm中的叔丁酯衍生物(1eq.)的溶液中添加hcl在二噁烷中的4n溶液(20eq.)。将反应混合物于室温搅拌48小时,在真空中浓缩。将固体溶于et2o中,过滤,用et2o冲洗,得到预期化合物。
cpd254的说明性合成
向搅拌的在dcm(4ml)中的cpd243(29mg,0.050mmol,1eq.)的溶液中添加hcl在二噁烷中的4n溶液(0.25ml,0.996mmol,20eq.)。将反应混合物于室温搅拌48小时,在真空中浓缩。将固体溶于et2o中,过滤,用et2o冲洗,得到预期化合物。
1.2.14.方法q:羧酸的酯化
1.2.14.1.方法q1:hatu
向搅拌的在dmf中的羧酸或羧酸钠衍生物(1eq.)的溶液中添加hatu(1.1eq.)和醇衍生物(2.4eq.)。将反应混合物于室温搅拌过夜,然后于50℃搅拌1.5小时。添加hatu(1.1eq.)和dipea(2eq.),将反应混合物于50℃搅拌4小时。将反应混合物通过制备型lcms纯化,得到预期化合物。
cpd235的说明性合成
向搅拌的在dmf(1ml)中的cpd228(0.054mmol,1eq.)的溶液中添加hatu(23mg,0.06mmol,1.1eq.)和2-氟乙醇(8μl,0.13mmol,2.4eq.)。将反应混合物于室温搅拌过夜,然后于50℃搅拌1.5小时。添加hatu(23mg,0.06mmol,1.1eq.)、dipea(19μl,0.11mmol,2eq.),将反应混合物于50℃搅拌4小时。将反应混合物通过制备型lcms纯化,得到预期化合物。
1.2.14.2.方法q2:socl2
1.2.14.2.1方法q2i:socl2/rt
向搅拌的在醇衍生物(1ml)中的羧酸衍生物(1eq.)的溶液中添加socl2(1.5至6eq.,分一次或两次,历时18小时),将反应混合物于室温搅拌(18小时至70小时)。将混合物在真空中浓缩,溶于dcm/meoh混合物中,用nahco3中和,通过硅胶快速色谱法纯化,得到预期化合物,或者添加水和nahco3,将挥发物在真空中浓缩,将混合物通过经疏水柱过滤用dcm萃取,在真空中浓缩。将残余物通过硅胶快速色谱法纯化,得到预期化合物,或者添加acn,然后完全蒸发,保持继续蒸发直至留下少量溶剂,将固体过滤,得到预期化合物。
cpd236的说明性合成
向搅拌的在meoh(1ml)中的cpd228(23mg,0.046mmol,1eq.)的溶液中添加socl2(5μl,0.068mmol,1.5eq.),将反应混合物于室温搅拌过夜。添加socl2(5μl,0.068mmol,1.5eq.),将反应混合物于室温搅拌48小时,在真空中浓缩,溶于dcm/meoh混合物中,用nahco3中和,通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到预期化合物。
1.2.14.2.2方法q2ii:socl2/60℃
在螺帽小瓶中,向搅拌的在dcm中的羧酸衍生物(1eq.)的混合物中添加socl2(3eq.)和醇衍生物(2eq.),将反应混合物于室温搅拌过夜。添加另外的醇衍生物(过量),将反应混合物于40℃搅拌1小时。将dcm蒸发,历时5.5天分4次添加socl2(6eq.),同时于60℃搅拌。将反应混合物在真空中浓缩,用nahco3中和,通过硅胶快速色谱法纯化,任选在dcm/et2o混合物中结晶,得到预期化合物。
cpd237的说明性合成
在螺帽小瓶中,向搅拌的在dcm(1ml)中的cpd228(20mg,0.040mmol,1eq.)的混合物中添加socl2(8.6μl,0.12mmol,3eq.)和四氢呋喃-3-醇(6.4μl,0.08mmol,2eq.),将反应混合物于室温搅拌过夜。添加另外的四氢呋喃-3-醇(0.2ml,过量),将反应混合物于40℃搅拌1小时。将dcm蒸发,添加socl2(4.3μl,0.06mmol,1.5eq.),将混合物于60℃搅拌24小时。添加socl2(4.3μl,0.06mmol,1.5eq.),将混合物于60℃搅拌24小时和于室温搅拌3天。添加socl2(4.3μl,0.06mmol,1.5eq.),将混合物于50℃搅拌4小时。添加socl2(4.3μl,0.06mmol,1.5eq.),将混合物于60℃搅拌3小时。将反应混合物在真空中浓缩,用nahco3中和,通过硅胶快速色谱法(用dcm/meoh100/0至90/10洗脱)纯化,在dcm/et2o混合物中结晶,得到预期化合物。
1.2.14.3.方法q3:烷基溴/cs2co3
向搅拌的在dmf中的羧酸衍生物(1eq.)的混合物中添加cs2co3(2eq.)和烷基溴衍生物(1.2eq.)。将反应混合物于60℃搅拌2小时。添加烷基溴衍生物(1.8eq.)和cs2co3(1eq.),将反应混合物于60℃搅拌20小时。将反应混合物通过制备型lcms和通过硅胶快速色谱法纯化,得到预期化合物。
cpd238的说明性合成
向搅拌的在dmf(1ml)中的cpd228(24mg,0.048mmol,1eq.)的混合物中添加cs2co3(31mg,0.095mmol,2eq.)和溴甲基环丁烷(6.4μl,0.057mmol,1.2eq.)。将反应混合物于60℃搅拌2小时。添加溴甲基环丁烷(9.6μl,0.087mmol,1.8eq.)和cs2co3(15mg,0.047mmol,1eq.),将反应混合物于60℃搅拌20小时。将反应混合物通过制备型lcms、然后通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到预期化合物。
1.2.15.方法r:叔丁酯的酯交换
向搅拌的在醇衍生物中的叔丁酯衍生物(1eq.)的溶液中添加在二噁烷中的hcl4n(100eq.),将反应混合物于室温搅拌24小时或于60℃搅拌(0.5至1.5小时)。将反应混合物在真空中浓缩,溶于dmso中、通过nahco3中和和通过制备型lcms纯化以得到预期化合物,或者溶于nahco3水溶液和dcm中、将混合物用dcm萃取、通过疏水柱过滤进行干燥、在真空中浓缩、通过硅胶快速色谱法纯化以得到预期化合物,或者溶于dcm和nahco3水溶液中、将混合物用dcm萃取、通过疏水柱过滤进行干燥、在添加et2o后在真空中浓缩、将所得固体溶于et2o中和过滤以得到预期化合物。
cpd231的说明性合成
向搅拌的在丙-2-醇(1ml)中的cpd229(20mg,0.036mmol,1eq.)的溶液中添加在二噁烷中的hcl4n(0.89ml,3.6mmol,100eq.),将反应混合物于60℃搅拌1.5小时。将反应混合物在真空中浓缩,溶于dmso中,通过nahco3中和,通过制备型lcms纯化,得到预期化合物。
实施例2.制备本发明的化合物。
2.1.int1
将7-溴咪唑并[1,2-a]吡啶(cas号808744-34-5;100g,507.54mmol,1eq.)、1-甲基吡唑-4-硼酸频哪醇酯(cas号761446-44-0;116.18g,558.29mmol,1.1eq.)、na2co3(161.37g,1522.61mmol,3eq.)添加至二噁烷/水溶剂混合物:3/1(1l)中。将混合物用n2脱气,然后添加pd(dppf)cl2·dcm加合物(2.07g,2.54mmol,0.005eq.),将混合物于100℃搅拌6小时。将混合物冷却至室温,经
2.2.int2
在密封管中放入7-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)咪唑并[1,2-a]吡啶(cas号908268-52-0;0.5g,2.05mmol,1eq.)、3-氯-6-甲基哒嗪(cas号1121-79-5;316mg,2.46mmol,1.2eq.)、cs2co3(1.34g,4.10mmol,2eq.)、pd(dppf)cl2·dcm(167mg,0.20mmol,0.1eq.)和经n2脱气的二噁烷/水4/1溶剂混合物(10ml)。将系统用n2净化,然后将混合物于90℃搅拌1小时。将反应混合物冷却至室温,在etoac中稀释,经
2.3.int4
将4-溴-2,6-二氟苯甲酸(90.5g,381.86mmol,1.0eq.)添加至socl2(181ml,2份体积,6.5eq.)中。将反应混合物于回流搅拌。回流6小时后,停止加热,将反应混合物冷却至室温,然后在真空中浓缩。将残余物用甲苯(181ml,2份体积)稀释和浓缩以消除残余的亚硫酰氯。
将液体残余物用dcm(453ml,5份体积)稀释。在n2氛围下,将三氟乙胺盐酸盐(54.34g,400.95mmol,1.05eq.)添加至反应混合物中,将后者冷却至5℃。然后滴加et3n(117.09ml,840.08mmol,2.2eq.),保持反应混合物的温度在27℃以下。然后将反应混合物于室温在n2下搅拌14小时。将混悬液用dcm(1000ml,10份体积)稀释。将有机相用水(500ml,5份体积)和饱和nahco3(500ml,5份体积)洗涤。将有机相经na2so4(100g)干燥,过滤,浓缩,用庚烷(500ml,6份体积)研磨。将混悬液过滤,用庚烷(500ml,6份体积)洗涤,将固体在减压下干燥,得到int4。
2.4.int5
在n2下,向在nmp(551ml,5份体积)中的int4,4-溴-2,6-二氟-n-(2,2,2-三氟乙基)苯甲酰胺(110.20g,346.50mmol,1.0eq.)的溶液中添加甲醇钠(56.15g,1.04mol.,3eq.)。将反应混合物加热至90℃。于90℃搅拌1.5小时后,将反应混合物冷却至室温,添加水(1100ml,10份体积),产生沉淀。将混悬液过滤,将滤饼用水(3*1100ml)洗涤。将固体在55℃下在真空下干燥(3天),得到int5。
2.5.int6
将在dmso(5ml)中的int62(1g,3.62mmol,1eq.)和甲醇钠(0.23g,4.35mmol,1.2eq.)的混合物于60℃加热24小时。将反应混合物冷却至室温,倒入水(50ml)中。将形成的固体过滤,用水洗涤,干燥,得到预期化合物int6。
2.6.int7
2.6.1.步骤i:6-溴-8-甲氧基-3,4-二氢-2h-异喹啉-1-酮
向搅拌的在thf(30ml)中的6-溴-8-氟-3,4-二氢-2h-异喹啉-1-酮(cas号1242157-15-8;3g,12.29mmol,1eq.)的溶液中滴加含meona25重量%的meoh溶液(3.35ml,14.75mmol,1.2eq.)。在添加甲醇钠溶液的过程中,添加另外的thf(10ml)。将反应混合物于室温搅拌2小时,用饱和nh4cl水溶液淬灭,将thf蒸发。将在剩余水中获得的固体过滤,得到所需化合物。
lcms:mw(计算值):256.1;m/zmw(实测值):256.1-258.1。
2.6.2.步骤ii:6-溴-8-甲氧基-2-(2,2,2-三氟乙基)-3,4-二氢异喹啉-1-酮
于0℃向搅拌的在thf(45ml)中的6-溴-8-甲氧基-3,4-二氢-2h-异喹啉-1-酮(1.95g,7.61mmol,1eq.)的溶液中滴加在thf中的lihmds1n溶液(11.4ml,11.4mmol,1.5eq.)。将所得混合物于0℃搅拌15分钟,于0℃添加三氟甲磺酸2,2,2-三氟乙酯(1.64ml,11.4mmol,1.5eq.)。将反应混合物缓慢升温至室温,于室温搅拌过夜,然后于65℃搅拌2.5小时,然后于80℃搅拌2小时。将反应混合物用水淬灭。将thf蒸发,用etoac萃取水层。将合并的有机层用盐水洗涤,经无水na2so4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到int7。
2.7.int8
在n2下,将在nmp(26.35ml,5份体积)中的cd3od(2.36ml,58.00mmol,3.0eq.)的溶液用冰浴冷却至0℃,分批添加nah(1.99g,60%在油中,3eq.)。将反应混合物于室温搅拌30分钟,然后将int4(5.27g,16.57mmol,1.0eq.)添加至混合物中。将反应混合物加热至90℃持续1.5小时。将反应混合物冷却至室温,添加水(60ml,10份体积)。将混悬液过滤,将滤饼用水(3*60ml)和庚烷(3*60ml,因为来自nah的油)洗涤。将固体于40℃在真空下干燥,得到int8。
2.8.int9
在15l单夹套处理反应器中,将氢氧化钾(10eq.,243g)添加至在acn/水(acn/h2o1/1,10v,1240ml)中的int64(1eq.,124g)的溶液中。将反应混合物冷却至5℃(夹套温度在40分钟内自20℃至0℃)。在5℃(夹套温度设定于0℃)下,历时1小时将(溴二氟甲基)膦酸二乙酯(2eq.,154ml)净添加至溶液中,同时保持反应温度在18℃以下。在添加结束时,将反应混合物升温至20℃,于20℃搅拌30分钟。
将水相用etoac(3*650ml,3*5v)萃取三次。合并有机相,用nacl20%(5v,650ml)洗涤一次,浓缩。
将粗制物于20℃在mtbe(3v/理论质量,400ml)中再浆化30分钟。将混悬液过滤,将固体用mtbe(140ml)洗涤。将固体干燥,得到int9。
int91hnmr(400mhz,dmso-d6)δppm8.31(1h,宽s),7.34-6.98(3h,m),3.84(3h,s),2.74(1h,m),0.66(2h,m),0.43(2h,m)。
2.9.int10
2.9.1.步骤i:4-氨基-2-羟基-6-甲氧基-苯甲酸甲酯
在n2氛围下,向在无水dcm(230ml)中的4-氨基-2,6-二甲氧基-苯甲酸甲酯(cas号3956-34-1;8.75g,41mmol,1eq.)的溶液中滴加在dcm中的bcl31m(91ml,91mmol,2.2eq.),于0℃搅拌45分钟,于室温搅拌过夜。添加hcl2n和冰-水,将混合物用dcm萃取两次。将合并的有机层用水、盐水洗涤,经无水na2so4干燥,在真空中浓缩,得到所需产物。
lcms:mw(计算值):197.1;m/zmw(实测值):198.2(m+h)。
2.9.2.步骤ii:4-(2,5-二甲基吡咯-1-基)-2-羟基-6-甲氧基-苯甲酸甲酯
向在acoh(100ml)中的4-氨基-2-羟基-6-甲氧基-苯甲酸甲酯(4.72g,24mmol,1eq.)的溶液中添加2,5-己二酮(5.62ml,48mmol,2eq.),于110℃搅拌15分钟,然后于室温搅拌1.5小时。将混合物在真空中蒸发,通过硅胶柱色谱法(庚烷/etoac,50/50v/v)纯化,得到所需产物。
lcms:mw(计算值):275.3;m/zmw(实测值):276.3(m+h)。
2.9.3.步骤iii:4-(2,5-二甲基吡咯-1-基)-2-羟基-6-甲氧基-苯甲酸
向在meoh(100ml)中的4-(2,5-二甲基吡咯-1-基)-2-羟基-6-甲氧基-苯甲酸甲酯(6.10g,22mmol)的溶液中添加naoh2n溶液(133ml,266mmol,12eq.)。然后,将反应混合物于100℃搅拌18小时。将meoh在真空中浓缩,然后将水层用hcl2n(140ml)酸化,用dcm萃取三次。将合并的有机层经na2so4干燥,过滤出,在真空中浓缩,得到预期产物。
lcms:mw(计算值):261.2;m/zmw(实测值):262.2(m+h)。
2.9.4.步骤iv:n-环丙基-4-(2,5-二甲基吡咯-1-基)-2-羟基-6-甲氧基-苯甲酰胺
向搅拌的在无水dmf(200ml)中的4-(2,5-二甲基吡咯-1-基)-2-羟基-6-甲氧基-苯甲酸(10g,38.27mmol,1eq.)和hatu(16.01g,42.10mmol,1.1eq.)的溶液中添加dipea(13.34ml,76.54mmol,2eq.)。将混合物于室温搅拌10分钟,添加环丙胺(3.18ml,45.92mmol,1.2eq.)。将所得混合物于室温搅拌2小时。将反应混合物蒸发至干,然后用etoac和水稀释。分离有机层,经na2so4干燥,过滤,在减压下浓缩。将残余物通过硅胶色谱法(用0至30%etoac的己烷溶液洗脱)纯化。合并产物级分和蒸发至干,得到标题化合物。
lcms:mw(计算值):300.3;m/zmw(实测值):301.3(m+h)。
2.9.5.步骤v:n-环丙基-2-(二氟甲氧基)-4-(2,5-二甲基吡咯-1-基)-6-甲氧基-苯甲酰胺
于-10℃,向搅拌的在acn(100ml)中的n-环丙基-4-(2,5-二甲基吡咯-1-基)-2-羟基-6-甲氧基-苯甲酰胺(6.33g,21.07mmol,1eq.)的溶液中滴加在h2o(100ml)中的koh(23.65g,421.40mmol,20eq.)。将所得混合物于-10℃搅拌25分钟,滴加在acn(15ml)中的(溴二氟甲基)膦酸二乙酯(7.49ml,44.14mmol,2eq.)。将混合物用冰/h2o淬灭,用dcm萃取两次。将有机层经na2so4干燥,过滤,在减压下浓缩。将残余物在2x100ghp柱(biotage)上(用0至2%meoh的dcm溶液洗脱)纯化。合并产物级分和蒸发至干,得到标题化合物。
lcms:mw(计算值):350.3;m/zmw(实测值):351.5(m+h)。
2.9.6.步骤vi:int10
于室温向搅拌的在etoh(100ml)中的n-环丙基-2-(二氟甲氧基)-4-(2,5-二甲基吡咯-1-基)-6-甲氧基-苯甲酰胺(6.78g,19.35mmol,1eq.)的溶液中添加在h2o(50ml)中的羟胺盐酸盐(13.45g,193.51mmol,10eq.)。将所得混合物于110℃搅拌过夜。添加羟胺盐酸盐(5eq.)和et3n(2eq.)。将所得混合物于110℃搅拌3小时30分钟。将etoh在真空中浓缩。将水相用naoh2n调节至ph9,用etoac萃取两次。将有机层经na2so4干燥,过滤,在减压下浓缩。将残余物通过硅胶色谱法(用0至5%meoh的dcm溶液洗脱)纯化。合并产物级分,在真空中浓缩。将固体用et2o研磨和过滤,得到标题化合物。
lcms:mw(计算值):272.2;m/zmw(实测值):273.2(m+h)。
2.10.int11
2.10.1.步骤i:n-叔丁基-4-(2,5-二甲基吡咯-1-基)-2-羟基-6-甲氧基-苯甲酰胺
向搅拌的在无水dmf(25ml)中的4-(2,5-二甲基吡咯-1-基)-2-羟基-6-甲氧基-苯甲酸(参见int10合成,实施例2.9.3)(5.6g,21.4mmol,1.0eq.)和hatu(10.6g,27.8mmol,1.3eq.)的溶液中添加dipea(7.3ml,42.8mmol,2.0eq.)。将混合物于室温搅拌10分钟,添加叔丁胺(4.5ml,42.8mmol,2.0eq.)。将反应混合物蒸发至干,然后用etoac和水稀释。分离有机层,经na2so4干燥,过滤,在减压下浓缩。通过硅胶快速色谱法(用dcm/庚烷2/1;4/1;9/1洗脱)纯化得到所需化合物。
lcms:mw(计算值):316.4;m/zmw(实测值):317.7(m+h)。
2.10.2.步骤ii:n-叔丁基-2-(二氟甲氧基)-4-(2,5-二甲基吡咯-1-基)-6-甲氧基-苯甲酰胺
于-10℃,向搅拌的在acn(20ml)中的n-叔丁基-4-(2,5-二甲基吡咯-1-基)-2-羟基-6-甲氧基-苯甲酰胺的溶液中滴加在h2o(20ml)中的koh(5.3g,94.8mmol,20eq.)。将所得混合物于-10℃搅拌10分钟,滴加(溴二氟甲基)膦酸二乙酯(1.5ml,9.5mmol,2.0eq.)。将混合物于0℃搅拌30分钟。将混合物用冰/h2o淬灭,用dcm萃取两次。将acn在减压下浓缩。将预期产物过滤,用水洗涤。
lcms:mw(计算值):366.4;m/zmw(实测值):367.8(m+h)。
2.10.3.步骤iii:int11
于室温向搅拌的在etoh(50ml)和h2o(25ml)中的n-叔丁基-2-(二氟甲氧基)-4-(2,5-二甲基吡咯-1-基)-6-甲氧基-苯甲酰胺(1.5g,4.1mmol,1eq.)的溶液中添加et3n(1.2ml,8.2mmol,2.0eq.)和羟胺盐酸盐(2.9g,41mmol,10eq.)。将所得混合物于100℃搅拌过夜。将etoh蒸发。将水相用naoh2n调节至ph9,用dcm萃取两次。将有机层经na2so4干燥,过滤,在减压下浓缩。通过硅胶快速色谱法(用dcm、然后用dcm/meoh95/5洗脱)纯化,得到所需化合物。
2.11.int12
2.11.1.步骤i:4-(2,5-二甲基吡咯-1-基)-n-乙基-2-羟基-6-甲氧基-苯甲酰胺
向在无水dmf(50ml)中的4-(2,5-二甲基吡咯-1-基)-2-羟基-6-甲氧基-苯甲酸(参见int10合成,实施例2.9.3)(5.57g,21mmol,1eq.)的溶液中添加hatu(8.92g,23mmol,1.1eq.)和dipea(29.71ml,171mmol,8eq.)。将混合物于室温搅拌30分钟,然后添加乙基氯化铵(10.43g,128mmol,6eq.),于室温搅拌过夜。将反应混合物用饱和nahco3溶液淬灭,用etoac萃取两次。将合并的有机层用饱和nahco3、盐水洗涤,经na2so4干燥,在减压下蒸发。将粗制物通过硅胶柱色谱法(庚烷/etoac80/20)纯化,得到预期产物。
lcms:mw(计算值):288.3;m/zmw(实测值):289.4(m+h)。
2.11.2.步骤ii:2-(二氟甲氧基)-4-(2,5-二氟吡咯-1-基)-n-乙基-6-甲氧基-苯甲酰胺
向于-15℃冷却的在acn(100ml)中的4-(2,5-二甲基吡咯-1-基)-n-乙基-2-羟基-6-甲氧基-苯甲酰胺(4.78g,17mmol,1eq.)的溶液中添加在水(100ml)中的koh(18.60g,332mmol,20eq.)。然后将溶于acn中的(溴二氟甲基)膦酸二乙酯(5.89ml,33mmol,2eq.)缓慢添加至混合物中,于-10℃搅拌45分钟。将反应混合物用饱和nahco3和冰-水淬灭,用dcm萃取两次。将合并的有机层经na2so4干燥,在减压下蒸发,得到预期产物。
lcms:mw(计算值):338.3;m/zmw(实测值):339.4(m+h)。
2.11.3.步骤iii:int12
于室温向搅拌的在etoh(200ml)中的2-(二氟甲氧基)-4-(2,5-二甲基吡咯-1-基)-n-乙基-6-甲氧基-苯甲酰胺(17g,50.2mmol,1eq.)的溶液中添加在h2o(100ml)中的羟胺盐酸盐(34.9g,502.4mmol,10eq.)和et3n(13.9ml,100.5mmol,2eq.)。将所得混合物于110℃搅拌过夜。将etoh蒸发。将水相用naoh2n调节至ph9,用dcm萃取两次。将水相用饱和na2co3水溶液调节至ph10,用dcm萃取。合并有机层,经na2so4干燥,过滤,在真空中浓缩。将固体用dcm和et2o研磨和过滤。通过快速色谱法纯化(用0至5%meoh的dcm溶液),得到预期产物。
2.12.int13
向在甲苯(5ml,2份体积)中的4-溴-2,6-二氟苯甲酸(2g,8.44mmol,1.0eq.)的混悬液中添加socl2(3.08ml,42.19mmol,5eq.)。将反应混合物于回流搅拌。回流4小时后,反应显示完全转化。停止加热,将反应混合物冷却至室温,然后在真空中浓缩。将残余物用甲苯(20ml,10份体积)浓缩以消除残余亚硫酰氯。
在n2氛围下,将黄色残余液体用dcm(5ml,5份体积)稀释。将反应混合物用冰浴冷却。缓慢添加et3n,接着添加环丙胺-d5。然后在n2下,于室温将反应混合物搅拌过夜。然后将反应混合物用dcm稀释,添加水。将有机相用nahco3水溶液和20%nacl溶液依次洗涤。将有机相经mgso4干燥,过滤和浓缩。将残余物用庚烷(500ml,6份体积)研磨。将混悬液过滤,于室温用庚烷(20ml,10份体积)洗涤30分钟。将混悬液过滤,将滤饼用最少的庚烷洗涤,以获得int13。
2.13.int14:2,6-二甲氧基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯甲酸甲酯/(3,5-二甲氧基-4-甲氧羰基-苯基)硼酸的混合物
将2,6-二甲氧基苯甲酸甲酯(cas号2065-27-2;96.6g,492mmol,1eq.)、b2pin2(312.6g,1.23mol,2.5eq.)、[ir(ome)(cod)]2(6.5g,9.8mmol,0.02eq.)和3,4,7,8-四甲基-1,10-菲咯啉(activatescientific,目录号as21433;4.7g,20mmol,0.04eq.)溶于thf(1l)中。将混合物用氮气脱气,然后加热至回流。使反应混合物在65℃下搅拌过夜。将溶剂在真空中浓缩,将残余物在二异丙醚(400ml)中研磨。将获得的固体在真空烘箱中于40℃干燥过夜,得到所需化合物。
2.14.int16
2.14.1.步骤i:n-乙基-2,6-二甲氧基-苯甲酰胺
在惰性氛围下,将2,6-二甲氧基苯甲酸(2g,11mmol,1eq.)溶于dmf(200ml)中,然后添加et3n(31ml,220mmol,20eq.)和hatu(6.3g,16.47mmol,1.5eq.),于室温搅拌30分钟,然后添加乙基氯化铵(9g,111mmol,10eq.)。反应时间:18小时,于室温。将混合物在真空中浓缩。添加水和etoac。将混合物用etoac萃取三次,然后合并有机相,经na2so4干燥,过滤,在真空中浓缩。通过硅胶快速色谱法(用dcm/meoh99/1至97/3洗脱)纯化,得到所需化合物。
lcms:mw(计算值):209.2;m/zmw(实测值):210.4(m+h)。
2.14.2.步骤ii:n-乙基-2-羟基-6-甲氧基-苯甲酰胺
向于0℃在dcm(40ml)中的n-乙基-2,6-二甲氧基-苯甲酰胺(2.3g,11mmol,1eq.)的溶液中滴加三氯化硼(1m在dcm中,25ml,24.15mmol,2.2eq.)。将混合物于0℃搅拌30分钟。将粗制混合物倒入冰-水和浓氢氧化铵中。将产物用dcm萃取3次。将有机层经na2so4干燥,过滤,在真空中浓缩。将获得的粗制物在hcl2n水溶液中回流1小时。将化合物用etoac萃取3次。将有机相经na2so4干燥,过滤,在真空中浓缩。通过硅胶快速色谱法(用庚烷/etoac90/10至85/15洗脱)纯化,得到所需化合物。
lcms:mw(计算值):195.2;m/zmw(实测值):196.4(m+h)。
2.14.3.步骤iii:2-(二氟甲氧基)-n-乙基-6-甲氧基-苯甲酰胺
向在acn(1.5ml)中的n-乙基-2-羟基-6-甲氧基-苯甲酰胺(300mg,1.53mmol,1eq.)的溶液中添加水(1.5ml)和koh(861mg,15.3mmol,10eq.)。在-40℃下,滴加(溴二氟甲基)膦酸二乙酯(cas号65094-22-6;0.546ml,3.06mmol,2eq.)。将混合物在-40℃下搅拌10分钟,然后于室温搅拌30分钟。将混合物冷却至-40℃,滴加(溴二氟甲基)膦酸二乙酯(0.546ml,3.06mmol,2eq.)。将混合物在-40℃下搅拌10分钟,然后于室温搅拌过夜。添加水,将化合物用etoac萃取3次。将合并的有机层经na2so4干燥,过滤,在真空中浓缩。通过硅胶快速色谱法(用庚烷/etoac90/10至60/40洗脱)纯化,得到所需化合物。
lcms:mw(计算值):245.2;m/zmw(实测值):246.3(m+h)。
2.14.4.步骤iv:int16
在惰性氛围下,将2-(二氟甲氧基)-n-乙基-6-甲氧基-苯甲酰胺(690mg,2.8mmol,1eq.)、b2pin2(2.15g,8.4mmol,3eq.)、[ir(ome)(cod)]2(93mg,0.1mmol,0.05eq.)和bbbpy(30mg;0.11mmol,0.04eq.)溶于thf(12ml)中。将混合物于70℃搅拌过夜。将混合物在真空中浓缩。通过硅胶快速色谱法(用庚烷/etoac90/10至30/70洗脱)纯化,得到所需化合物。
2.15.int17
2.15.1.步骤i:n-环丙基-2-羟基-6-甲氧基-苯甲酰胺
将6-甲氧基水杨酸(cas号3147-64-6;10g,0.06mmol,1eq.)溶于dmf(50ml)中,添加hatu(33.93g,0.09mmol,1.5eq.),15分钟后接着添加环丙胺(cas号765-30-0;10.18g,0.18mmol,3eq.)和dipea(34.55g,0.26mmol,4.5eq.)。使反应混合物于室温搅拌18小时;然后添加1eq.的hatu、2eq.的环丙胺和2eq.的dipea。将反应混合物于室温搅拌68小时。将反应混合物在真空中浓缩。通过硅胶快速色谱法进行纯化(用庚烷/etoac100/0至50/50洗脱)。将收集的级分在真空中浓缩,用meoh/et2o研磨两次。将滤液在真空中浓缩,得到所需产物。
lcms:mw(计算值):207.2;m/zmw(实测值):208.4(m+h)。
2.15.2.步骤ii:n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺
在惰性氛围下,将n-环丙基-2-羟基-6-甲氧基-苯甲酰胺(2.80g,0.013mmol,1eq.)溶于acn(20ml)中,冷却至-20℃。添加在水(20ml)中的koh(7.57g,0.13mmol,10eq.)的溶液,将混合物搅拌10分钟,然后缓慢添加(溴二氟甲基)膦酸二乙酯(cas号65094-22-6;10.9g,0.04mmol,3.1eq.)。将反应混合物在-20℃下搅拌30分钟,然后于室温再搅拌30分钟。添加水,用etoac萃取三次。将有机层经na2so4干燥,过滤,在真空中浓缩。通过硅胶快速色谱法(用梯度庚烷/etoac100/0至0/100洗脱)纯化,得到预期产物。
lcms:mw(计算值):257.2;m/zmw(实测值):258.4(m+h)。
2.15.3.步骤iii:int17:n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯甲酰胺和4-(环丙基氨甲酰基)-3-(二氟甲氧基)-5-甲氧基苯基硼酸的混合物
在惰性氛围下,将n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺(2.80g,10.89mmol,1eq.)、b2pin2(8.30g,32.68mmol,3eq.)、[ir(och3)(cod)](360mg,0.54mmol,0.05eq.)和bbbpy(120mg,0.45mmol,0.04eq.)溶于经脱气的thf(70ml)中。将反应混合物于70℃在n2下搅拌3小时,然后于室温搅拌过夜。通过硅胶快速色谱法(用梯度庚烷/etoac100/0至30/70洗脱)纯化,得到预期产物,为与相应硼酸的混合物。
2.16.int18
2.16.1.步骤i:5-溴-2-乙基-7-氟-异吲哚啉-1-酮:
向搅拌的在thf(2ml)和dmf(25ml)中的5-溴-7-氟-异吲哚啉-1-酮(cas号957346-37-1;0.8g,3.48mmol,1eq.)的混合物中添加在油中的nah60%(153mg,3.83mmol,1.1eq.)。将反应混合物于室温搅拌45分钟,添加碘乙烷(308μl,3.83mmol,1.1eq.),将反应混合物于室温搅拌1小时。然后将其用nahco3水溶液淬灭,将dmf和thf浓缩,再次添加水,将混合物用etoac萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用庚烷/etoac100/0至50/50洗脱)纯化,得到5-溴-2-乙基-7-氟-异吲哚啉-1-酮。
lcms:mw(计算值):258.1;m/zmw(实测值):258.1-260.1。
2.16.2.步骤ii:5-溴-2-乙基-7-甲氧基-异吲哚啉-1-酮
向搅拌的在thf(1ml)中的5-溴-2-乙基-7-氟-异吲哚啉-1-酮(100mg,0.387mmol,1eq.)的溶液中添加在meoh中的meona25重量%(106μl,0.465mmol,1.2eq.)溶液。将反应混合物于室温搅拌5分钟,用饱和nh4cl水溶液淬灭。将混合物用etoac萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩,得到5-溴-2-乙基-7-甲氧基-异吲哚啉-1-酮。
lcms:mw(计算值):270.1;m/zmw(实测值):270.1-272.1。
2.16.3.步骤iii:int18:2-乙基-7-甲氧基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)异吲哚啉-1-酮/(2-乙基-7-甲氧基-1-氧代-异吲哚啉-5-基)硼酸的混合物
向小瓶中放入5-溴-2-乙基-7-甲氧基-异吲哚啉-1-酮(0.387mmol,1eq.)、b2pin2(118mg,0.46mmol,1.2eq.)、acok(114mg,1.16mmol,3eq.)、经脱气的二噁烷(2ml)和pd(dppf)cl2·dcm络合物(19mg,0.02mmol,0.06eq.)。将小瓶密封,将反应混合物于90℃搅拌1小时。添加水和nahco3,将混合物用etoac萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至90/10洗脱)纯化,得到2-乙基-7-甲氧基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)异吲哚啉-1-酮/(2-乙基-7-甲氧基-1-氧代-异吲哚啉-5-基)硼酸混合物。
2.17.int19
2.17.1.步骤i:5-溴-2-乙基-7-氟-异吲哚啉-1-酮
参见int18,步骤i。
2.17.2.步骤ii:5-溴-2-乙基-7-(2-羟基乙基氨基)异吲哚啉-1-酮
向搅拌的在dmac(2ml)中的5-溴-2-乙基-7-氟-异吲哚啉-1-酮(100mg,0.387mmol,1eq.)的溶液中添加2-氨基乙醇(70μl,1.16mmol,3eq.)和dipea(202μl,1.16mmol,3eq.)。将混合物于室温搅拌1小时,然后于100℃搅拌40小时。将反应混合物冷却,添加水,将混合物用etoac萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩,得到5-溴-2-乙基-7-(2-羟基乙基氨基)异吲哚啉-1-酮。
lcms:mw(计算值):299.2;m/zmw(实测值):299.3-301.2。
2.17.3.步骤iii:int19
向小瓶中放入5-溴-2-乙基-7-(2-羟基乙基氨基)异吲哚啉-1-酮(120mg,0.387mmol,1eq.)、b2pin2(118mg,0.46mmol,1.2eq.)、acok(114mg,1.16mmol,3eq.)、经脱气的二噁烷(2ml)和pd(dppf)cl2·dcm络合物(19mg,0.023mmol,0.06eq.)。将小瓶密封,将反应混合物于90℃搅拌1小时。添加水和nahco3,将混合物用etoac萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到2-乙基-7-(2-羟基乙基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)异吲哚啉-1-酮。
2.18.int20
2.18.1.步骤i.4-溴-2-氟-6-甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺
向搅拌的在无水dmf(5ml)中的4-溴-2-氟-6-甲氧基-苯甲酸(500mg,2mmol,1eq.)和hatu(841mg,2.2mmol,1.1eq.)的溶液中添加dipea(701μl,4mmol,2eq.)。将混合物于室温搅拌10分钟,添加三氟乙胺(189μl,2.4mmol,1.2eq.)。将所得混合物于室温搅拌过夜。将反应混合物在真空中浓缩,用dcm和水稀释。将产物用dcm萃取,将有机层经na2so4干燥,过滤,在真空中浓缩。通过硅胶快速色谱法(用dcm洗脱)纯化,得到所需化合物。
lcms:mw(计算值):330.1;m/zmw(实测值):330.1-332.1(m+h)。
2.18.2.步骤ii:int20:2-氟-6-甲氧基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-n-(2,2,2-三氟乙基)苯甲酰胺和3-氟-5-甲氧基-4-[(2,2,2-三氟乙基)氨甲酰基]苯基硼酸的混合物
向搅拌的在经脱气的二噁烷(2.5ml)中的4-溴-2-氟-6-甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺(165mg,0.5mmol,1eq.)和b2pin2(190mg,0.75mmol,1.5eq.)的溶液中添加koac(147mg,1.5mmol,3eq.)和pd(dppf)cl2·dcm(41mg,0.05mmol,0.1eq.)。将反应混合物于90℃搅拌2小时。将反应混合物在真空中浓缩,然后用dcm和水稀释。分离有机层,在减压下浓缩。通过硅胶快速色谱法(用0至2%meoh/dcm洗脱)纯化,得到所需化合物,为与相应硼酸的混合物。
2.19.int21
向搅拌的在经脱气的thf(3ml)中的2-甲氧基-6-甲基-苯甲酸甲酯(180mg,1mmol,1eq.)的溶液中添加[ir(ome)(cod)]2(33mg,0.05mmol,0.05eq.)、bbbpy(13mg,0.05mmol,0.05eq.)和b2pin2(330mg,1.3mmol,1.3eq.)。将反应混合物于70℃搅拌2小时。添加更多[ir(ome)(cod)]2(33mg,0.05mmol,0.05eq.)、bbbpy(13mg,0.05mmol,0.05eq.),将反应混合物于70℃搅拌4小时。将反应混合物于70℃搅拌过夜。添加更多[ir(ome)(cod)]2(33mg,0.05mmol,0.05eq.)、bbbpy(13mg,0.05mmol,0.05eq.)和b2pin2(120mg,0.47mmol,0.5eq.),将反应混合物于70℃搅拌4小时。将反应混合物在真空中浓缩。通过硅胶快速色谱法(用0至1%meoh的dcm溶液洗脱)纯化,得到所需化合物。
2.20.int22
向搅拌的在经脱气的thf(3ml)中的2-氯-6-甲氧基-苯甲酸甲酯(201mg,1mmol,1eq.)的溶液中添加b2pin2(330mg,1.3mmol,1.3eq.)、bbbpy(13mg,0.05mmol,0.05eq.)和[ir(ome)(cod)]2(33mg,0.05mmol,0.05eq.)。将反应混合物于70℃搅拌1小时。将反应混合物在真空中浓缩。通过硅胶快速色谱法(用dcm洗脱)纯化,得到所需化合物。
2.21.int23:8-甲氧基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-3,4-二氢-2h-异喹啉-1-酮和(8-甲氧基-1-氧代-3,4-二氢-2h-异喹啉-6-基)硼酸的混合物
向烧瓶中放入6-溴-8-甲氧基-3,4-二氢-2h-异喹啉-1-酮(100mg,0.39mmol,1eq.)、b2pin2(119mg,0.47mmol,1.2eq.)、acok(115mg,1.17mmol,3eq.)、经脱气的二噁烷(2ml)、pd(dppf)cl2·dcm络合物(19mg,0.023mmol,0.06eq.)。将烧瓶密封,将反应混合物于90℃搅拌1小时,于室温搅拌过夜,再于90℃搅拌1小时。然后将其通过硅胶快速色谱法(用dcm/meoh+1%acoh100/0/1%至80/20/1%洗脱)纯化,得到8-甲氧基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-3,4-二氢-2h-异喹啉-1-酮/(8-甲氧基-1-氧代-3,4-二氢-2h-异喹啉-6-基)硼酸混合物。
2.22.int24
2.22.1.步骤i:6-溴-2-环丙基-8-甲氧基-3,4-二氢异喹啉-1-酮
于0℃向搅拌的在thf(5ml)中的6-溴-8-甲氧基-3,4-二氢-2h-异喹啉-1-酮(223mg,0.87mmol,1eq.)的溶液中滴加lihmds在thf中的1n溶液(1.25ml,1.25mmol,1.4eq.)。搅拌15分钟后,于0℃添加三氟甲磺酸环丙酯(0.15ml,1.25mmol,1.4eq.),将反应混合物于室温搅拌过夜,然后于100℃搅拌8小时。将反应混合物用饱和nahco3溶液淬灭,用etoac萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用庚烷/etoac100/0至0/100洗脱)纯化,得到6-溴-2-环丙基-8-甲氧基-3,4-二氢异喹啉-1-酮。
lcms:mw(计算值):296.2;m/zmw(实测值):296.1-298.1。
2.22.2.步骤ii:2-环丙基-8-甲氧基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-3,4-二氢异喹啉-1-酮和(2-环丙基-8-甲氧基-1-氧代-3,4-二氢异喹啉-6-基)硼酸的混合物
向烧瓶中放入6-溴-2-环丙基-8-甲氧基-3,4-二氢异喹啉-1-酮(106mg,0.358mmol,1eq.)、b2pin2(109mg,0.429mmol,1.2eq.)、acok(105mg,1.074mmol,3eq.)、经脱气的二噁烷(2ml)、pd(dppf)cl2·dcm络合物(17mg,0.021mmol,0.06eq.)。将烧瓶密封,将反应混合物于90℃搅拌2小时。然后将其通过硅胶快速色谱法(用dcm/meoh100/0至90/10洗脱)纯化,得到2-环丙基-8-甲氧基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-3,4-二氢异喹啉-1-酮/(2-环丙基-8-甲氧基-1-氧代-3,4-二氢异喹啉-6-基)硼酸混合物。
2.23.int25
2.23.1.步骤i:5-溴-7-甲氧基-异吲哚啉-1-酮
向搅拌的在thf(5ml)中的5-溴-7-氟-异吲哚啉-1-酮(cas号957346-37-1;0.5g,2.17mmol,1eq.)的混合物中滴加在meoh中的meona25重量%溶液(0.6ml,2.61mmol,1.2eq.)。添加另外的thf(5ml)。将反应混合物于室温搅拌24小时,然后于60℃搅拌30分钟,用饱和nh4cl水溶液淬灭,用etoac萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用庚烷/etoac100/0至0/100、然后etoac/[dcm/meoh(90/10)]100/0至0/100洗脱)纯化,得到5-溴-7-甲氧基-异吲哚啉-1-酮。
lcms:mw(计算值):242.1;m/zmw(实测值):242.1-244.1。
2.23.2.步骤ii:int25:7-甲氧基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)异吲哚啉-1-酮和(7-甲氧基-1-氧代-异吲哚啉-5-基)硼酸的混合物
向小瓶中放入5-溴-7-甲氧基-异吲哚啉-1-酮(90mg,0.37mmol,1eq.)、b2pin2(113mg,0.45mmol,1.2eq.)、acok(109mg,1.12mmol,3eq.)、经脱气的二噁烷(2ml)和pd(dppf)cl2·dcm络合物(18mg,0.022mmol,0.06eq.)。将小瓶密封,将反应混合物于90℃搅拌1小时,于室温搅拌过夜。然后将其通过硅胶快速色谱法(用dcm/meoh100/0至80/20、然后dcm/meoh/acoh80/20/2%洗脱)纯化,得到7-甲氧基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)异吲哚啉-1-酮/(7-甲氧基-1-氧代-异吲哚啉-5-基)硼酸混合物。
2.24.int62
在15l夹套反应器中,在n2流下,在20℃(夹套温度)下,将4-溴-2,6-二氟苯甲酸(900g,3.80mol,1eq.)添加至在甲苯(2v,1800ml)中的socl2(5eq.,1385ml,19.07mol,5eq.)。然后将混悬液加热至80℃持续17小时(夹套温度设定在80℃)。
将反应混合物冷却至40℃,浓缩(使用200ml甲苯洗涤反应器)。将甲苯(1v,900ml)添加至残余物中,将溶液浓缩。
在n2下,将液体残余物(940g)溶于dcm(5v,4.5l)中,放入15l反应器中。将反应混合物冷却至13℃(夹套温度:5℃),历时1.3小时添加et3n(582.22ml,4.18mol,1.1eq.)和环丙胺(276.21ml,3.99mol,1.1eq.)的混合物,同时保持温度在25℃以下(在添加期间,夹套温度设定在5℃)。在n2下,在20℃下,将反应混合物搅拌14小时。
将水(2.2v,2l)添加至混悬液中。将两相溶液搅拌(200rpm)15分钟。然后将有机相用nahco35%(1.1v,1l)和20%nacl溶液(1.1v,1l)依次洗涤。收集dcm层,放入15l反应器中。
在15l反应器中进行溶剂交换:向dcm层中添加1l庚烷。将混合物逐步加热(其中夹套温度设定在65℃),在43℃与50℃之间移除dcm。移除2ldcm后,添加1l庚烷。在移除总共4l溶剂后,添加1l庚烷,将混合物在20分钟内冷却至20℃。最后添加1l庚烷(添加总共4l庚烷),将混合物在20℃下搅拌45分钟。
将混悬液过滤,将滤饼用1.5l庚烷洗涤。
将固体于50℃在真空下干燥过夜,得到int62。
2.25.int63
在15l夹套反应器中,将naoh4n(2155ml,8.62mol,2.5eq.)一次性添加至int62(952g,3.45mol,1eq.)在dmso(2v,1.9l)中的溶液中。将混悬液加热至90℃(夹套温度自50℃至90℃历时20分钟,然后于90℃保持2小时)。
然后将反应混合物冷却至25℃(夹套温度自90℃至5℃历时45分钟),添加hcl2n(2.7l,5.4摩尔,0.63eq./naoh)直至达到ph3。在添加hcl期间,温度保持在30℃以下(添加历时20分钟,夹套温度设定在5℃)。将混悬液在200rpm下搅拌2小时,同时温度降低至20℃(夹套温度设定在5℃)。然后将混悬液过滤。将湿滤饼用水(2l,2*2v两次)洗涤,将固体在烧结漏斗上干燥过夜。
将固体在真空烘箱中于50℃干燥3天,得到int63。
2.26.int64
在n2氛围下,在15l单夹套处理反应器中,历时20分钟将naome(717g,13.27mol,3.5eq.)添加至int63(1040g,3.79mol,1eq.)在dmso(5v,5200ml)中的溶液中。将反应混合物加热至100℃(夹套温度自20℃至100℃历时30分钟),在250rpm下搅拌过夜。
将反应混合物冷却至20℃(夹套温度;在45分钟内自100℃斜降至10℃),在2小时内添加hcl2n(5.3l,10.6mol,0.8eq./naome),同时维持内温在30℃以下。将混悬液冷却至20℃,搅拌15分钟,过滤。将滤饼用水(2*2l,2*2v)洗涤。将固体在真空烘箱中于50℃干燥。
在15l反应器中,将粗制固体(1040g)溶于丙酮(3l,3v)中。将溶液在15℃下冷却(在20分钟内夹套温度自20℃至10℃),历时30分钟逐步添加水(3l,3v)。在添加800ml水后,结晶开始。在添加结束时,将混悬液冷却至15℃,搅拌15分钟。将混悬液过滤,将滤饼用水(2*3l,2*3v)洗涤。将固体在真空烘箱中于50℃干燥,得到int64。
int641hnmr(400mhz,dmso-d6)δppm13.14(1h,宽s),8.38(1h,宽s),6.72(2h,m),3.86(3h,s),2.81(1h,m),0.70(2h,m),0.59(2h,m)。
2.27.int65
向在dmso(4ml,2份体积)中的int13(2g,7mmol,1.0eq.)的溶液中一次性添加naoh4m水溶液(4.4ml)。将反应混合物于90℃搅拌。于90℃搅拌4小时后,将反应混合物冷却至25℃,添加hcl2m水溶液(5.7ml,11.34mmol,0.63eq./naoh)直至ph约3,同时保持温度在30℃以下(在1分钟内添加)。将混悬液搅拌30分钟,同时温度降低至20℃。然后将混悬液过滤。将湿滤饼用水(2*4ml,2*2份体积)洗涤,将固体在烧结漏斗上干燥过夜,以获得int65。
2.28.int66
在n2下,将在dmso(2ml,2.5份体积)中的cd3od(0.52ml,13.00mmol,4.5eq.)的溶液用冰浴冷却至0℃,逐步添加nah(0.310g,60%在油中,4.5eq.)。将反应混合物于室温搅拌30分钟。然后将在dmso(2ml,2.5份体积)中的int65(0.8g,2.9mmol,1.0eq.)的溶液缓慢添加至混合物中。将反应混合物加热至100℃持续2.5小时。将反应混合物冷却至20℃,添加hcl2m水溶液(5.2ml,10.4mmol,0.8eq./naome)。将混悬液在20℃下搅拌15分钟,然后过滤。将滤饼用水(2*2ml,2*2份体积)洗涤,得到粗制物,将粗制物溶于丙酮中。将反应混合物在10℃下冷却(冰浴),添加水。将混悬液冷却至10℃,在此温度下搅拌15分钟。将混悬液过滤,用水洗涤,得到int66。
2.29.int67
在5℃下,将int66(1.59g,5.40mmol,1.0eq.)混悬于acn(8ml,5份体积)中。在2分钟内添加koh(3.03g,54.05mmol,10.0eq.)在冷水(8ml,5份体积)中的溶液。通过控制温度在20℃以下,在1.5小时内将(溴二氟甲基)膦酸二乙酯(cas号65094-22-6;1.34ml,7.57mmol,1.4eq.)添加至5℃溶液中。添加结束时(2.2小时),在10分钟内将反应混合物的温度升至20℃。将etoac(8ml,5份体积)添加至反应混合物中,然后萃取水相。用etoac(2ml,2份体积)进行另一次萃取。合并有机相,用20%nacl(6ml,5份体积)溶液洗涤一次,浓缩。于室温将此粗制混合物在mtbe(6ml,3份体积)中浆化30分钟。将混悬液过滤,将固体用mtbe(2ml,1份体积)洗涤。将固体于40℃在真空烘箱中干燥,得到int67。
2.30.int68
在n2下,向在二噁烷(9ml,6份体积)中的int67(1.45g,4.21mmol,1.0eq.)和int56(1.01g,4.63mmol,1.1eq.)的溶液中添加k3po4(1.79g,8.43mmol,2.0eq.)、pd(oac)2(9.5mg,0.04mmol,0.010eq.)和xantphos(48.8mg,0.08mmol,0.020eq.)。将反应混合物于100℃加热1小时。然后将反应混合物冷却至室温。添加水(6ml,4份体积)以淬灭反应,然后缓慢添加另外的水(12ml,总共18ml,12份体积),同时反应温度降低。将混悬液搅拌1小时。将混悬液过滤,将滤饼用水(9ml,6份体积)洗涤。将滤饼在sio2柱(25g
2.31.int69
在20℃下,向在thf/meoh(4/4ml,6份体积)中的int68(1.2g,2.49mmol,1.0eq.)和nh4cl(0.8g,14.95mmol,6.0eq.)的溶液中分批添加zn(0.65g,9.97mmol,4.0eq.)。将反应混合物加热至60℃持续1小时,然后添加nh4cl(70mg,1.31mmol.,0.5eq)。将反应混合物冷却至25℃,在dicalite4158re(carloerbareagents,目录号p8880017)上过滤。将滤饼用thf(10ml)洗涤。将滤液浓缩。于室温将粗制物在etoac(6ml)中研磨10分钟,过滤。将滤饼用etoac(3ml)洗涤。将固体在45℃下在真空下干燥过夜,得到int69。
2.32.int70
2.32.1.步骤i:4-溴-n-环丙基-2-羟基-6-(三氘代甲氧基)苯甲酰胺
在n2氛围下,向经烘箱干燥的烧瓶(25ml)中放入meoh-d4(10g,12.63ml)。在庚烷中称取钠(1.452g,63.15mmol),切成6个近似相等部分。将meoh-d4在冰浴上冷却,历时40分钟时间逐份添加钠。使混合物历时数小时达到室温,随后搅拌过夜。将溶液未经进一步分析原样进行使用。
将int63(1.55g,1eq.)溶于dmso(8ml)中。将naome-d3(3.96ml,5m,3.5eq.)经由注射器添加至混合物中,将混合物加热至100℃持续3小时。将混合物冷却至室温,历时10分钟时间添加2mhcl(7.92ml,2.8eq.)。将混合物搅拌1小时,过滤。将滤饼用水(2*6ml)洗涤和在真空中于40℃干燥过夜,得到4-溴-n-环丙基-2-(二氟甲氧基)-6-(三氘代甲氧基)苯甲酰胺。
2.32.2.步骤ii:int70
将4-溴-n-环丙基-2-羟基-6-(三氘代甲氧基)苯甲酰胺(1.386g,1eq.)溶于acn(7ml)中,冷却至0至5℃。制备koh(3.13ml,10eq.)在水(7ml)中的溶液,冷却,添加至混合物中,产生双相混合物。在搅拌下添加(溴二氟甲基)膦酸二乙酯(cas号65094-22-6;1.192ml,1.4eq.),保持温度在10℃以下持续15分钟。将混合物再搅拌15分钟,然后使之达到室温。添加etoac(14ml),分离各相,用etoac(5ml)萃取水相。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,在真空中浓缩。将固体用mtbe(4ml)研磨1小时,过滤,将滤饼用mtbe(1.4ml)洗涤,在真空中干燥,得到int70。
2.33.int72
向搅拌的在dmf(6ml)中的4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1h-吡唑(cas号269410-08-4;200mg,1.03mmol,1eq.)的溶液中添加2-溴丙酸叔丁酯(180μl,1.08mmol,1.05eq.)、k2co3(150mg,1.08mmol,1.05eq.),将反应混合物于室温搅拌4小时。添加2-溴丙酸叔丁酯(17μl,0.1mmol,0.1eq.)、k2co3(14mg,0.1mmol,0.1eq.),将反应混合物于室温搅拌4天。将混合物在真空中浓缩,添加水和dcm。将混合物用dcm萃取,通过疏水柱过滤进行干燥,在真空中浓缩,得到预期产物。
2.34.int73
向搅拌的在acn(5ml)中的4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1h-吡唑(200mg,1.03mmol,1eq.)的溶液中添加4-溴丁酸甲酯(143μl,1.13mmol,1.1eq.)、cs2co3(440mg,1.33mmol,1.3eq.),将反应混合物在120℃下搅拌20分钟(微波加热),然后在130℃下搅拌10分钟。添加4-溴丁酸甲酯(26μl,0.21mmol,0.2eq.),将反应混合物在120℃下搅拌1小时,然后于室温搅拌过夜。将混合物在真空中浓缩,添加水和dcm。将混合物用dcm萃取,通过疏水柱过滤进行干燥,在真空中浓缩,得到预期产物。
2.35.int76
2.35.1.步骤i:4-咪唑并[1,2-a]吡啶-7-基吡唑-1-甲酸叔丁酯
在氩气氛围下,放入经脱气的在无水thf(18ml)中的4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑-1-甲酸叔丁酯(cas号552846-17-0;1.50g,4.99mmol,1.10eq,)、磷酸钾k3po4(2.91g,3.0eq.)、7-溴咪唑并[1,2-a]吡啶(cas号808744-34-5;920mg,1.0eq.)和pd(dppf)cl2·dcm络合物(190mg,0.23mmol,0.05eq.)的溶液,于70℃搅拌3小时。将混合物冷却至室温,用100mletoac稀释。然后将有机层用200ml水、接着100ml盐水洗涤。在经na2so4干燥和过滤后,将溶剂蒸发。将残余物通过硅胶快速色谱法(用(meoh在etoac中的10%溶液)在etoac中的0至50%溶液洗脱)纯化,得到4-咪唑并[1,2-a]吡啶-7-基吡唑-1-甲酸叔丁酯。
lcms:mw(计算值):284.3;m/zmw(实测值):285.6
2.35.2.步骤ii:int76
向在40ml无水dcm中的4-咪唑并[1,2-a]吡啶-7-基吡唑-1-甲酸叔丁酯(0.88g,2.94mmol,1.0eq)的溶液中添加tfa(4.55ml,20.0eq)。将所得混合物于室温搅拌16小时。将挥发物蒸发,在经20gmeoh调节的
2.36.int77
2.36.1.步骤i:7-氯-6-甲氧基-咪唑并[1,2-a]吡啶
将在etoh(8ml)中的4-氯-5-甲氧基-吡啶-2-胺(cas号867131-26-8;1.0g,6.1mmol,1eq.)和nahco3(1.04g,12.2mmol,2eq.)的加热至60℃,滴加氯乙醛(50重量%水溶液,1.17ml,9.2mmol,1.5eq.)。然后将反应混合物加热至80℃持续1小时。将反应介质冷却至室温,浓缩至干。经残余物倒入水中,用etoac萃取。将合并的有机层经mgso4干燥,过滤,蒸发至干。将残余物溶于20ml水/hcl(3n)水溶液的混合物中。将水层用et2o洗涤,然后用k2co3碱化,用etoac萃取。将etoac层经mgso4干燥,过滤,蒸发至干,得到预期产物。
lcms:mw(计算值):182.6;m/zmw(实测值):183.0(m+h)。
2.36.2.步骤ii:int77
向在-15℃下在chcl3(15ml)中的7-氯-6-甲氧基-咪唑并[1,2-a]吡啶(445mg,2.3mmol,1eq.)的溶液中滴加bbr3(1ndcm溶液,11.55ml,11.5mmol,5eq.)。使混合物升温至室温,搅拌6小时。然后将反应介质冷却至0℃,添加meoh(10ml),将混合物于室温搅拌2小时。将挥发物浓缩,将残余物溶于etoh(10ml)中。将溶剂蒸发至干,得到预期产物。
2.37.cpd48
2.37.1.步骤i:方法e1.3,int58
在圆底烧瓶中引入1-溴-4-氟-3-硝基苯(cas号364-73-8;10g,45.45mmol,1eq.)、1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;11.34g,54.54mmol,1.2eq.)、pd(pph3)4(5.3g,4.54mmol,0.1eq.)、cs2co3(44.5g,136.4mmol,3eq.)和经脱气的二噁烷(100ml)和水(25ml)的溶液。将混合物于100℃搅拌2小时。使混合物冷却至室温,将溶剂在真空中蒸发。添加水(200ml)和盐水(50ml)。将混合物用dcm(200ml,100ml,100ml)萃取三次。将有机相经na2so4干燥,过滤,在真空中浓缩。通过硅胶快速色谱法(用dcm、然后dcm/acoet4/1洗脱)纯化,得到预期产物。
2.37.2.步骤ii:方法b2,int57
于0℃向搅拌的在无水dmf(75ml)中的int12(7.66g,29.4mmol,1eq.)和int58(7.15g,32.37mmol,1.1eq.)的溶液中添加氢化钠(60%在矿物油中的分散液;3.53g,88.29mmol,3eq.)。将反应混合物于0℃搅拌1小时和于室温搅拌1.5小时。将反应混合物小心添加在混合物冰/h2o上,将所得固体过滤以移除剩余int12和dmf。将残余物用etoac稀释,用h2o和盐水依次洗涤。将有机层经na2so4干燥,过滤,在真空中浓缩。通过硅胶快速色谱法(用在dcm中的0至2%meoh洗脱)纯化得到所需化合物,将其用丙酮/et2o研磨和过滤,得到标题int57。
2.37.3.步骤iii:方法c2,cpd48
于室温向搅拌的在acoh(40ml)中的int57(4g,8.66mmol,1eq.)的溶液中添加锌粉(2.83g,43.3mmol,5eq.)。将所得混合物在75℃下搅拌1小时。将反应混合物用etoac稀释,经dicalite4158re垫(carloerbareagents,目录号p8880017)用etoac过滤。将滤液在真空中浓缩。通过硅胶快速色谱法(用在dcm中的0至2%meoh洗脱)纯化,得到所需化合物。
lcms:mw(计算值):431.4;m/zmw(实测值):432.3(m+h)。
将获得的化合物(2.91g,6.74mmol,1eq.)溶于meoh(30ml)中。然后添加乙酸(50μl)和原甲酸三甲酯(3.68ml,33.70mmol,5eq.)。将所得混合物在75℃下搅拌1小时。将反应物在真空中浓缩。通过快速色谱法在
2.38.cpd53
2.38.1.步骤i:方法e1.3:4-(4-氟-3-硝基-苯基)-1-甲基-吡唑,int56
在15l单夹套处理反应器中,将na2co3(488g,2.0eq.)添加至经脱气的二噁烷/水4:1(4l,8v)中。将1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;550g,1.15eq.)和4-溴-2-硝基-苯胺(cas号875-51-4;500g,1.0eq.)依次添加至反应混合物中。一次性添加pd(pph3)4(26.6g,1.0mol%),将反应混合物历时40分钟自20℃加热至95℃,然后回流3小时。将反应混合物浓缩以移除二噁烷,将粗制残余物倒入水/冰(4l,8v)中。将混悬液于室温搅拌18小时,然后过滤。将滤饼用水(2*2l,2*4v)洗涤。将粗制残余物在i-proh(1.5l,3v)中研磨。将混悬液过滤,将固体用i-proh(500ml,1v)洗涤。将固体在真空烘箱中于50℃干燥,得到int56。
int561hnmr(400mhz,dmso-d6)δppm8.08(2h,m),7.80(1h,s),7.64(1h,dd),7.41(2h,宽s),7.04(1h,d),3.84(3h,s)。
2.38.2.步骤ii:方法e2.3:2-(二氟甲氧基)-n-乙基-6-甲氧基-4-[4-(1-甲基吡唑-4-基)-2-硝基-苯胺基]苯甲酰胺,int55
在n2氛围下,在15l单夹套处理反应器中,将pd(oac)2(3.6g,1.0mol%)和xantphos(18.6g,2.0mol%)添加至在二噁烷(2.7l,5v)中的int9(540g,1.0eq.)、int56(385g,1.1eq.)和k3po4(682g,2.0eq.)的溶液中。将反应混合物于回流加热(在1小时内夹套温度自20℃至100℃,然后保持)。
在98至101℃下1小时20分钟后,历时1小时将夹套温度自100℃冷却至15℃。在冷却开始时,添加水(2l,3.7v)以淬灭反应。
然后历时2小时缓慢添加剩余水(3.4l,总共5.4l,10v),同时反应温度自60℃下降至20℃。在已添加3.5l水后,沉淀开始。当温度下降至25℃以下时,大块沉淀产生。在添加结束时,将混悬液老化30分钟。将混悬液过滤,将固体用水(2l,4v)洗涤。将固体在真空烘箱中于60℃干燥2天。
将粗制固体(740g)在etoac/mtbe(1500/1500ml,2v/2v)中研磨1小时。将混悬液过滤,将固体用700mlmtbe(1v)洗涤。将固体在真空下于50℃干燥4天,得到int55。
int551hnmr(400mhz,dmso-d6)δppm9.20(1h,宽s),8.24(3h,宽s),7.93(1h,s),7.82(1h,dd),7.44(1h,d),7.24(0.4h,s),7.06(0.6h,s),6.87(1h,s),6.70(1h,s),3.87(3h,s),3.76(3h,s),2.77(1h,m),0.67(2h,m),0.46(2h,m)。
2.38.3.步骤iii:方法c3:n-环丙基-2-(二氟甲氧基)-6-甲氧基-4-[5-(1-甲基吡唑-4-基)苯并咪唑-1-基]苯甲酰胺(cpd53)
在配备有隔板的5l单夹套处理反应器中,在n2氛围下将int55(525g,1.0eq.)和氯化铵(326g,5.5eq.)添加至四氢呋喃/meoh1:1(2.5l,5v)的溶液中。搅拌设定为300rpm,分批(15至40g)添加锌粉(<10μm,290g,4.0eq.),同时保持反应温度低于50℃(在添加期间,夹套温度设定为20℃)。历时1小时的时间进行添加。
将反应混合物于60℃(夹套温度)加热15分钟。将反应混合物冷却至室温,在dicalite4158re(carloerbareagents,目录号p8880017)上过滤。将滤饼用thf(1500ml,3v)洗涤,将滤液浓缩。当已移除2l时,添加etoac(2l,4v)以共蒸发meoh。在蒸发结束时,添加1letoac。
将混悬液于室温研磨30分钟,过滤。将滤饼用etoac(200ml)洗涤。将固体于45℃在真空下干燥过夜,得到4-[2-氨基-4-(1-甲基吡唑-4-基)苯胺基]-n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺。
lcms:mw(计算值):443.4;m/zmw(实测值):444.6(m+h)。
1hnmr(400mhz,dmso-d6)δppm8.04(1h,d),7.96(1h,s),7.70(1h,s),7.57(1h,s),7.06-6.69(3h,m),6.78(1h,dd),6.23(1h,s),6.06(1h,s),4.79(2h,宽s),3.86(3h,s),3.66(3h,s),2.72(1h,m),0.63(2h,m),0.44(2h,m)。
在5l单夹套处理反应器中,将4-[2-氨基-4-(1-甲基吡唑-4-基)苯胺基]-n-环丙基-2-(二氟甲氧基)-6-甲氧基-苯甲酰胺(660g,1.0eq.)混悬于原甲酸三甲酯(2640ml,4v)中。然后将反应混合物回流(夹套温度设定在110℃)1.5小时。将反应器配备有溶剂回流头,移除反应混合物的一半溶剂(在2.5小时内移除1350ml溶剂)。将反应温度自87℃升高至100℃,当移除meoh时沉淀发生。将夹套温度程序设置为在1小时内自110℃下降至20℃。当反应温度达到60℃时,缓慢添加mtbe(1.35l,2v,1eq./原甲酸三甲酯)。将混悬液于室温搅拌过夜。
将混悬液过滤。将滤饼用mtbe(1l)洗涤。将固体在45℃下在真空下干燥,得到cpd53。
2.39.cpd165
2.39.1.步骤i:n-氨基-n-[1-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]苯并咪唑-5-基]氨甲酸叔丁酯和n-[[1-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]苯并咪唑-5-基]氨基]氨甲酸叔丁酯的混合物
向搅拌的在经脱气的二噁烷(2ml)中的int39(92mg,0.2mmol,1eq.)和氨甲酸叔丁酯(cas号870-46-2;40mg,0.3mmol,1.5eq.)的溶液中添加cs2co3(196mg,0.6mmol,3eq.)、brettphos(11mg,0.02mmol,0.1eq.)和pd2(dba)3(19mg,0.02mmol,0.1eq.)。将反应混合物于110℃搅拌3小时。将反应混合物在真空中浓缩,然后用etoac和水稀释。将有机相分离,经mgso4干燥,过滤,在真空中浓缩。通过硅胶快速色谱法(用在dcm中的0至5%meoh洗脱)纯化,得到预期产物(两种区域异构体的混合物)。通过硅胶快速色谱法(用在dcm中的0至3%meoh洗脱)纯化,得到预期区域异构体。
lcms:rt=0.64min,mw(计算值):509.5;m/zmw(实测值):510.3(m+h)。
lcms:rt=0.58min,mw(计算值):509.5;m/zmw(实测值):510.3(m+h)。
2.39.2.步骤ii:4-(5-肼基苯并咪唑-1-基)-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺
向搅拌的在二噁烷(2ml)中的n-boc保护的芳基肼的一种区域异构体(rt=0.64min,步骤i)(40mg,0.078mmol,1eq.)的溶液中添加hcl12n(65μl,0.78mmol,10eq.)。将反应混合物于室温搅拌过夜。将残余物在真空中浓缩,得到作为盐酸盐的预期产物。
lcms:mw(计算值):409.4;m/zmw(实测值):410.3(m+h)。
2.39.3.步骤iii:cpd165
于室温将在etoh(1ml)中的4-(5-肼基苯并咪唑-1-基)-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺(32mg,0.078mmol,1eq.)的溶液用乙酰丙酮(cas号123-54-2;8μl,0.078mmol,1eq.)处理,于回流搅拌1小时。将反应混合物在真空中浓缩。通过硅胶快速色谱法(用在dcm中的0至1%meoh洗脱)纯化,得到预期产物。
2.40.cpd166
2.40.1.制备乙亚胺硫代酸甲酯:
于0℃将碘甲烷(249μl,4mmol,2eq.)滴加至在丙酮(3ml)中的硫代乙酰胺(150mg,2mmol,1eq.)的溶液中。将反应混合物于室温搅拌3小时。将反应混合物在真空中浓缩,将残余物过滤,用et2o洗涤,得到标题化合物。
2.40.2.cpd166
向搅拌的在meoh(1ml)中的4-(5-肼基苯并咪唑-1-基)-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺(参见cpd165实施例2.39的合成,步骤ii)(30mg,0.074mmol,1eq.)的溶液中添加新制备的乙亚胺硫代酸甲酯。将反应混合物于室温搅拌30分钟,在减压下移除溶剂。添加甲苯(1ml)、原甲酸三甲酯(41μl,0.370mmol,5eq.)和吡啶(1ml),将反应混合物于110℃搅拌过夜。将反应混合物在真空中浓缩。将残余物用饱和nahco3水溶液稀释,在
2.41.cpd167
2.41.1.步骤i:1-[3,5二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]苯并咪唑-5-甲酸甲酯
向搅拌的在经脱气的二噁烷/meoh1/1(2ml)中的int39(92mg,0.2mmol,1eq.)的溶液中添加mo(co)6,[(t-bu)3ph]bf4(12mg,0.04mmol,0.2eq.)、赫尔曼氏(herrmann’s)催化剂(cas号172418-32-5;19mg,0.02mmol,0.1eq.)和dbu(45μl,0.3mmol,0.1eq.)。将反应混合物在微波照射下于150℃搅拌1小时。将反应混合物在真空中浓缩。通过硅胶快速色谱法(用在dcm中的0至4%meoh洗脱)纯化,得到预期产物。
lcms:mw(计算值):437.4;m/zmw(实测值):438.5(m+h)。
2.41.2.步骤ii:4-[5-(肼羰基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺
于室温将在etoh(2ml)中的1-[3,5二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]苯并咪唑-5-甲酸甲酯(100mg,0.23mmol,1eq.)的溶液用肼水合物(112μl,2.3mmol,10eq.)处理,于120℃搅拌4小时。将反应混合物在微波照射下于150℃搅拌2小时两次。将反应混合物在真空中浓缩。将残余物dcm洗涤,然后用meoh稀释。将混合物过滤,将滤液在真空中浓缩,得到预期产物。
lcms:mw(计算值):437.4;m/zmw(实测值):438.2(m+h)。
2.41.3.步骤iii:cpd167
将acoh(1滴)添加到在原乙酸三甲酯(1ml)中的4-[5-(肼羰基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺(50mg,0.11mmol,1eq.)的溶液中。将反应混合物于110℃在密封小瓶中搅拌过夜。将反应混合物在真空中浓缩。通过硅胶快速色谱法(用在dcm中的0至5%meoh洗脱)纯化,得到预期产物。
2.42.cpd168
将acoh添加至4-[5-(肼羰基)苯并咪唑-1-基]-2,6-二甲氧基-n-(2,2,2-三氟乙基)苯甲酰胺(参考实施例2.41,cpd167,步骤ii;50mg,0.11mmol,1eq.)、原乙酸三甲酯(44μl,0.35mmol,1.5eq.)和在thf中的甲胺2m(345μl,0.69mmol,3eq.)在二噁烷(1ml)中的溶液中。将反应混合物于120℃在密封小瓶中搅拌过夜。将反应混合物在真空中浓缩。通过快速色谱法在
2.43.cpd169
于室温向在氩气下搅拌的n-羟基乙酰胺(cas号22059-229;6mg,0.082mmol,1.2eq.)在无水thf(1ml)中的溶液中添加氢化钠(60%在矿物油中的分散液)(3mg,0.082mmol,1eq.)。将反应混合物于60℃搅拌1小时,然后冷却至0℃,然后添加在无水thf(1ml)中的1-[3,5-二甲氧基-4-(2,2,2-三氟乙基氨甲酰基)苯基]苯并咪唑-5-甲酸甲酯(参考实施例2.41,cpd167,步骤i;30mg,0.068mmol,1eq.)的溶液。将反应混合物于60℃搅拌1小时。添加饱和nh4cl水溶液,将水层在
2.44.cpd173
向在dmf(1.5ml)中的int52(160mg,0.42mmol,1eq.)的混悬液中添加hatu(239mg,0.63mmol,1.5eq.),然后添加dipea(220μl,1.26mmol,3eq.)和3,3-二氟氮杂环丁烷盐酸盐(cas号288315-03-7;66mg,0.51mmol,1.2eq.)。将溶液于室温搅拌过夜。将混合物用dcm稀释,用水和盐水洗涤。将有机相分离,经mgso4干燥,过滤,在真空中浓缩。通过硅胶快速色谱法(用在dcm中的0至5%meoh洗脱)纯化。通过快速色谱法在
2.45.cpd174(方法e1.2)
向在dmf(5ml)中的int52(650mg,1.72mmol,1eq.)的混悬液中添加dipea(955μl,6.87mmol,4eq.)、(2r)-1,1,1-三氟丙烷-2-胺(cas号779303-24-1;514mg,3.44mmol,2eq.)和hatu(718mg,1.89mmol,1.1eq.)。将混合物于室温搅拌过夜。添加hatu(460mg,0.6eq.)和(2r)-1,1,1-三氟丙烷-2-胺(0.7eq.),将混合物于室温搅拌3小时。添加饱和nahco3溶液和水,将混合物用etoac萃取。将合并的有机层用盐水洗涤,经na2so4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法纯化两次(用dcm/meoh100/0至95/5洗脱),得到预期化合物。
2.46.cpd175
2.46.1.步骤i:方法e1.3:5-(1-甲基-1h-吡唑-4-基)-1h-苯并咪唑
向配备有空气冷凝器的烧瓶中放入5-溴-1h-苯并咪唑(cas号4887-88-1;1.052g,5.34mmol,0.95eq.)、1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;1.17g,5.62mmol,1eq.)、cs2co3(3.67g,11.26mmol,2eq.)和经n2脱气的二噁烷/水溶剂混合物4/1(50ml)。添加pd(dppf)cl2·dcm(344mg,0.42mmol,0.075eq.),将系统放置在n2氛围下。将反应混合物于115℃搅拌2小时,然后于室温搅拌过夜。将反应混合物用n2脱气,然后添加经脱气的二噁烷/水溶剂混合物4/1(10ml)、1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;117mg,0.562mmol,0.1eq.)和pd(dppf)cl2·dcm(162mg,0.198mmol,0.035eq.),将混合物于115℃搅拌3.5小时。最后使用相同方案,添加1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;117mg,0.562mmol,0.1eq.)和pd(dppf)cl2·dcm(162mg,0.198mmol,0.035eq.),将混合物于115℃搅拌3小时。将混合物经
lcms:mw(计算值):198.2;m/zmw(实测值):199.2(m+h)。
2.46.2.步骤ii:方法e2.3:cpd175
向微波小瓶中放入5-(1-甲基-1h-吡唑-4-基)-1h-苯并咪唑(80mg,0.40mmol,1eq.)和k3po4(171mg,0.81mmol,2eq.)。将小瓶密封,然后排空和填充氩气(重复此过程3次)。经由注射器添加经脱气的无水甲苯和无水二噁烷的溶液(5/1,0.4ml)。
向第二个小瓶中放入pd2dba3(22mg,0.024mmol,6%mol.)和me4t-buxphos(cas号857356-94-6;23mg,0.048mmol,12%mol.)。将小瓶密封,然后排空和填充氩气(重复此过程3次)。经由注射器添加经脱气的无水甲苯和无水二噁烷的溶液(5/1,0.4ml)。将所得混合物于120℃搅拌5分钟。然后将5-溴-2-乙基-7-氟-异吲哚啉-1-酮(参见int19合成,实施例2.17,步骤i;104mg,0.40mmol,1eq.)和预混合的催化剂溶液添加至第一个小瓶中。将反应混合物于120℃加热18小时。
添加水,将混合物用dcm萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/etoac/etoh60/35/5、然后60/30/10洗脱)和制备型tlc(用dcm/etoac/etoh60/30/10洗脱)纯化,得到cpd175。
2.47.cpd202
向微波小瓶中放入cpd175(39mg,0.104mmol,1eq.)、dmac(0.9ml)、乙醇胺(19μl,0.311mmol,3eq.)和dipea(54μl,0.311mmol,3eq.)。将反应混合物于100℃搅拌30小时。将混合物在真空中浓缩,添加水和nahco3,将混合物用dcm萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,过滤,在真空中浓缩。将残余物通过硅胶快速色谱法(用dcm/meoh100/0至95/5洗脱)纯化,得到cpd202。
2.48.cpd266(方法h)
装载int1(2.5g,12.61mmol,1.0eq.)、int8(4.32g,12.61mmol,1.0eq.)、koac(2.5g,25.22mmol,2.0eq.)和dmac(25ml,10份体积)。在搅拌下,将反应混合物用n2脱气。添加pd(dppf)cl2·dcm(0.051g,0.063mmol,0.005eq.)。将混合物加热至130℃持续21小时。将混合物冷却至室温,然后过滤。将水(60ml,24份体积)添加至滤液中,将形成的混悬液过滤。将固体用水(60ml,24份体积)洗涤,过滤,用mtbe(60ml,24份体积)研磨。将固体溶于水和dcm中,将混合物用dcm萃取。将合并的有机层用水洗涤,通过硅胶快速色谱法、用dcm/meoh(100/0至95/05)洗脱纯化,得到cpd266。
2.49.cpd291
将int69(0.787g,1.74mmol,1.0eq.)混悬于原甲酸三甲酯(3ml,4份体积)中。将反应混合物回流(110℃)50分钟。将反应混合物冷却至25℃,然后添加mtbe(3ml)。将反应混合物于室温搅拌1小时。将混悬液过滤。将滤饼用mtbe(5ml)洗涤。将固体在硅胶柱上用dcm/can直至100%acn洗脱纯化,得到cpd291。
2.50.cpd292
2.50.1.步骤i:步骤e2.3:n-环丙基-2-(二氟甲氧基)-4-[4-(1-甲基吡唑-4-基)-2-硝基-苯胺基]-6-(三氘代甲氧基)苯甲酰胺
在无氧气和水氛围(手套箱)下进行实验。将int70(1.4g,4.13mmol,1eq.)、int56(0.99g,4.54mmol,1.1eq.)、k3po4(1.75g,8.26mmol,2eq.)、xantphos(48mg,0.083mmol,0.02eq.)和pd(oac)2(9mg,0.041mmol,0.01eq.)混悬于二噁烷(5v)中。将混合物加热至100℃持续90分钟。将混合物冷却至室温。在冷却期间,将水添加至混合物中。将混合物搅拌1小时。将混合物过滤,将滤饼用水、然后用mtbe洗涤。将所得滤饼在真空中干燥,然后混悬于mtbe(10ml)中,研磨过夜。将混合物过滤,将滤饼用mtbe(2*5ml)洗涤。将所得固体在真空中于50℃干燥3小时,得到所需的硝基苯胺基化合物。
lcms:mw(计算值):476.5;m/zmw(实测值):477.2。
2.50.2.步骤ii:方法c3:cpd292
将n-环丙基-2-(二氟甲氧基)-4-[4-(1-甲基吡唑-4-基)-2-硝基-苯胺基]-6-(三氘代甲氧基)苯甲酰胺(1.68g,1eq.)溶于thf(9ml)和meoh(9ml)中。添加nh4cl(2.075g,11eq.),接着添加锌(2.075g,9eq.)。将混合物加热至30℃,历时15分钟以约0.1g部分添加锌,同时保持温度在30与40℃之间。添加额外的zn(0.231g,1eq.)和nh4cl(0.207g,1.1eq.)。将混合物于50℃搅拌,直至其由橙色混悬液转变成淡棕色混悬液。将混合物经
2.51.cpd293
2.51.1.步骤i:3-(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)-2-甲基-丙酸乙酯
向在3ml无水acn中的int76(100mg,0.52mmol,1.0eq.)的混悬液中添加甲基丙烯酸乙酯(327μl,5.0eq.),接着添加dbu(40μl,0.5eq)。将所得混合物在密封小瓶中于80℃搅拌16小时。将反应混合物冷却至室温,用20mletoac稀释。将有机层用2×30ml饱和nahco3水溶液、接着用30ml盐水洗涤。经na2so4干燥后,蒸发溶剂。将残余物通过硅胶快速色谱法(用(在etoac中的10%meoh)在etoac中的5至100%溶液洗脱)纯化,得到3-(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)-2-甲基-丙酸乙酯。
lcms:mw(计算值):298.3;m/zmw(实测值):299.6(m+h)。
2.51.2.步骤ii:cpd293
将经脱气的在无水dmac(2.0ml)中的int5(262mg,1.6eq.)、koac(138mg,3.0eq.)、3-(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)-2-甲基-丙酸乙酯(140mg,0.464mmol,1.0eq.)和pd(dppf)cl2·dcm(19mg,0.05eq)的溶液放在氩气氛围下,于115℃搅拌8小时。将反应混合物于室温冷却,倒入30ml水中。添加5ml饱和na2co3水溶液。接着用3×15mletoac萃取。将合并的有机层用20ml盐水洗涤,经na2so4干燥。过滤后,蒸发溶剂。将残余物通过硅胶快速色谱法(用0至80%(10%meoh/dcm)/dcm、然后100%(10%meoh/dcm)洗脱)纯化。从所收集的级分蒸发溶剂后,将残余物溶于10mldcm中。蒸发,得到预期产物。
2.52.cpd294
2.52.1.步骤i:2-[(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)甲基]-3-甲基-丁酸乙酯
向在3ml无水acn中的int76(100mg,0.52mmol,1.0eq.)的混悬液中添加3-甲基-2-亚甲基-丁酸乙酯(327μl,5.0eq.),接着添加dbu(40μl,0.5eq.)。将所得混合物在密封小瓶中在80℃下搅拌16小时。将反应混合物冷却至室温,用30mletoac稀释。将有机层用2×30ml饱和nahco3水溶液、接着用30ml盐水洗涤。在经na2so4干燥后,蒸发溶剂。将残余物通过硅胶快速色谱法(用5至100%(10%meoh/etoac)/etoac洗脱)纯化,得到2-[(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)甲基]-3-甲基-丁酸乙酯。
lcms:mw(计算值):326.4;m/zmw(实测值):327.2(m+h)。
2.52.2.步骤ii:cpd294
将经脱气的在无水dmac(2.0ml)中的int5(238mg,1.6eq.)、koac(138mg,3.0eq.)、2-[(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)甲基]-3-甲基-丁酸乙酯(145mg,0.464mmol,1.0eq.)和pd(dppf)cl2·dcm(18mg,0.05eq)的溶液放在氩气氛围下,于115℃搅拌8小时。将反应混合物于室温冷却,倒入30ml饱和nahco3水溶液中。接着用3×15mletoac萃取。将合并的有机层用2×20ml饱和nahco3水溶液、20ml盐水洗涤和经na2so4干燥。过滤后,蒸发溶剂。将残余物通过硅胶快速色谱法(用0至45%的(10%meoh/dcm)/dcm洗脱)纯化。将所收集级分的溶剂蒸发后,将残余物溶于10mldcm中。蒸发,得到预期产物。
2.53.cpd295
2.53.1.步骤i:2-(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)-2-甲基-丙酸乙酯
向在2ml无水acn中的int76(120mg,0.585mmol,1.0eq.)和2-溴-2-甲基-丙酸乙酯(114μl,1.3eq.)的混悬液中添加k2co3(139mg,1.7eq.)。将所得混合物在密封小瓶中于90℃搅拌16小时。将反应混合物冷却至室温,倒入30ml饱和nahco3水溶液中。接着用2×20mletoac萃取。将合并的有机层用盐水洗涤,蒸发溶剂。将残余物通过硅胶快速色谱法(用etoac/10%meoh(dcm),5至100%的10%meoh(dcm)洗脱)纯化,得到2-(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)-2-甲基-丙酸乙酯。
lcms:mw(计算值):298.3;m/zmw(实测值):299.1(m+h)。
2.53.2.步骤ii:cpd295
将经脱气的在无水dmac(2.0ml)中的int5(187mg,0.55mmol,1.6eq.)、koac(98mg,3.0eq.)、2-(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)-2-甲基-丙酸乙酯(101mg,0.331mmol,1.0eq.)和pd(dppf)cl2·dcm(15mg,0.05eq)的溶液放在氩气氛围下,于115℃搅拌4小时。将反应混合物于室温冷却,倒入30ml饱和nahco3水溶液中。接着用3×15mletoac萃取。将合并的有机层用2×20ml饱和nahco3水溶液、20ml盐水洗涤和经na2so4干燥。过滤后,蒸发溶剂。将残余物通过硅胶快速色谱法(用0至45%的(10%meoh/dcm)/dcm洗脱)纯化。从所收集的级分蒸发溶剂后,将残余物溶于10mldcm中。蒸发,得到预期产物。
2.54.cpd296
2.54.1.步骤i:2-(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)-3-甲基-丁酸乙酯
向在2ml无水dmf中的int76(120mg,0.585mmol,1.0eq.)和2-溴-3-甲基-丁酸乙酯(127μl,1.3eq.)的混悬液中添加k2co3(139mg,1.7eq.)。将所得混合物于70℃搅拌8小时。将反应混合物冷却至室温,倒入30ml饱和nahco3水溶液中。接着用2×20mletoac萃取。将合并的有机层用盐水洗涤和蒸发溶剂。将残余物通过硅胶快速色谱法(用0至85%的(10%meoh/dcm)/dcm洗脱)纯化,得到2-(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)-3-甲基-丁酸乙酯。
lcms:mw(计算值):312.4;m/zmw(实测值):313.2(m+h)。
2.54.2.步骤ii:cpd296
将经脱气的在无水dmac(2.0ml)中的int5(187mg,0.55mmol,1.6eq.)、koac(98mg,3.0eq.)、2-(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)-3-甲基-丁酸乙酯(105mg,0.331mmol,1.0eq.)和pd(dppf)cl2·dcm(15mg,0.05eq)的溶液放在氩气氛围下,于115℃搅拌4小时。将反应混合物于室温冷却,倒入30ml饱和nahco3水溶液中。接着用3×15mletoac萃取。将合并的有机层用2×20ml饱和nahco3水溶液、20ml盐水洗涤和经na2so4干燥。过滤后,蒸发溶剂。将残余物通过硅胶快速色谱法(用0至45%的(10%meoh/dcm)/dcm洗脱)纯化。从所收集的级分蒸发溶剂后,将残余物溶于10mldcm中。蒸发,得到预期产物。
2.55.cpd297
向在1.2ml无水dmf中的cpd228(100mg,0.196mmol,1.0eq.)的溶液中添加1,1'-羰二咪唑(49mg,1.5eq.),将混合物于50℃搅拌1小时。接着滴加在400μl无水dmf中的四氢呋喃-2-基甲醇(39μl,2.0eq.)和dbu(45μl,1.5eq.)的混合物。将混合物于50℃搅拌2小时,冷却至室温。将混合物倒入25ml5%nahco3水溶液中。接着用3×15mldcm(10%异丙醇)萃取。将合并的有机层经na2so4干燥,过滤后蒸发溶剂。将残余物通过快速色谱法(用0至55%的(10%meoh/dcm)/dcm洗脱)纯化,得到预期产物。
2.56.cpd298
2.56.1.步骤i:2-(4-咪唑并[1,2-a]吡啶-7-基吡唑-1-基)-3-甲基-丁酸乙酯
将int77(575mg,2.3mmol,1eq.)和k2co3(370mg,2.8mmol,1.15eq.)混悬于dmf(9ml)中,将混合物加热至60℃。在此温度下,滴加在dmf(1ml)中的溴乙酸乙酯(272μl,2.43mmol,1.05eq.)的溶液。添加结束时,将混悬液于60℃加热90分钟,然后将反应介质冷却至室温,倒入120ml5%nahco3水溶液中。将混合物用etoac萃取(3次),将合并的有机层经na2so4干燥,过滤和浓缩。将残余物通过硅胶快速色谱法(用0至50%(10%meoh/etoac)/meoh洗脱)纯化,得到预期化合物。
lcms:mw(计算值):254.7;m/zmw(实测值):255.3(m+h)。
2.56.2.步骤ii:2-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-6-基]氧基乙酸乙酯
在80℃下,在氩气下,将经脱气的在无水1,4-二噁烷和etoh的混合物(2ml/2ml)中的1-甲基吡唑-4-硼酸频哪醇酯(cas号761446-44-0;105mg,0.49mmol,1.25eq.)、k3po4(250mg,1.2mmol,3eq.)、2-(7-氯咪唑并[1,2-a]吡啶-6-基)氧基乙酸乙酯(100mg,0.39mmol,1eq.)和pd(dppf)cl2·dcm(33mg,0.04mmol,0.1eq.)的溶液在密封烧瓶中搅拌4小时。将反应混合物冷却至室温,用50mldcm稀释。将获得的混悬液经硅藻土过滤,将滤液浓缩。将残余物通过硅胶快速色谱法(用0至80%(10%meoh/dcm)/dcm洗脱)纯化,得到预期产物。
lcms:mw(计算值):300.3;m/zmw(实测值):301.1(m+h)。
2.56.3.步骤iii:cpd298
于115℃,在氩气下,将在无水dmac(1.5ml)中的int9(128mg,0.37mmol,1.6eq.)、koac(69mg,0.69mmol,3eq.)、2-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-6-基]氧基乙酸乙酯(73mg,0.23mmol,1eq.)和pd(dppf)cl2·dcm(13mg,0.02mmol,0.07eq.)的混合物搅拌4小时。然后将反应介质冷却至室温,倒入20ml5%nahco3水溶液中。将混合物用etaoc萃取(3次),将合并的有机层用5%nahco3水溶液洗涤(2次),用盐水洗涤。将有机层经na2so4干燥,过滤和浓缩。将粗制混合物通过硅胶快速色谱法(用0至80%(10%meoh/dcm)/dcm洗脱)纯化,得到残余物,将该残余物溶于10mldcm中。浓缩至干,得到预期化合物。
2.57.cpd299
向在thf/h2o(2ml/0.5ml)溶剂混合物中的cpd298(30mg,0.054mmol,1eq.)的溶液中添加氢氧化锂(6.5mg,0.27mmol,5eq.),将反应混合物于室温搅拌1小时。将挥发物蒸发,将残余物溶于10ml水和1.5ml1nnaoh水溶液中。将获得的混悬液搅拌15分钟,用4nhcl水溶液将ph调整至约3。沉淀发生,将固体通过过滤收集,用3mlph=3的hcl溶液洗涤。将固体在真空烘箱中于40℃干燥3小时,得到预期产物。
2.58.cpd300
2.58.1.步骤i:6-苄氧基-7-氯-咪唑并[1,2-a]吡啶
搅拌5分钟后,向在dmf(3ml)中的int77(250mg,1mmol,1eq.)和cs2co3(653mg,2mmol,2eq.)的混悬液中添加苄基氯(117μl,1mmol,1eq.),将混合物于室温搅拌3小时。将反应介质倒入120ml5%nahco3水溶液中,将混合物用etoac萃取。将合并的有机层经na2so4干燥,过滤和蒸发。将粗制混合物通过硅胶快速色谱法(用0至50%(10%meoh/etoac)/etoac洗脱)纯化,得到预期产物。
lcms:mw(计算值):258.7;m/zmw(实测值):259.1(m+h)。
2.58.2.步骤ii:6-苄氧基-7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶
在80℃下,在氩气下,将经脱气的在无水1,4-二噁烷和etoh(2ml/2ml)的混合物中的1-甲基吡唑-4-硼酸频哪醇酯(cas号761446-44-0;96mg,0.45mmol,1.25eq.)、k3po4(231mg,1.1mmol,3eq.)、6-苄氧基-7-氯-咪唑并[1,2-a]吡啶(105mg,0.36mmol,1eq.)和pd(dppf)cl2·dcm(30mg,0.04mmol,0.1eq.)的溶液在密封烧瓶中搅拌4小时。将反应混合物冷却至室温,用50mldcm稀释。将获得的混悬液经硅藻土过滤,将滤液浓缩。将残余物通过硅胶快速色谱法(用0至80%(10%meoh/dcm)/dcm洗脱)纯化,得到预期产物。
lcms:mw(计算值):304.4;m/zmw(实测值):305.2(m+h)。
2.58.3.步骤iii:cpd300
于115℃,在氩气下,将经脱气的在无水dmac(1ml)中的int9(81mg,0.24mmol,1.6eq.)、koac(44mg,0.44mmol,3eq.)、6-苄氧基-7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶(47mg,0.15mmol,1eq.)和pd(dppf)cl2·dcm(8mg,0.01mmol,0.07eq.)的混合物搅拌4小时。然后将反应介质冷却至室温,倒入20ml5%nahco3水溶液中。将混合物用etaoc萃取(3次),将合并的有机层用5%nahco3水溶液洗涤(2次),用盐水洗涤。将有机层经na2so4干燥,过滤和浓缩。将粗制混合物通过硅胶快速色谱法(用0至80%(10%meoh/dcm)/dcm洗脱)纯化,得到残余物,将该残余物溶于10mldcm中。浓缩至干,得到预期化合物。
2.59.cpd301
2.59.1.步骤i:5-溴-4-氯-n,n-双[(4-甲氧基苯基)甲基]吡啶-2-胺
于0℃向在无水dmf(30ml)中的5-溴-4-氯-吡啶-2-胺(cas号942947-94-6;3.0g,14mmol,1eq.)的溶液中添加氢化钠(60%在矿物油中的分散液,1.46g,36.5mmol,2.6eq.),将所得混合物于0℃搅拌15分钟。然后添加1-(氯甲基)-4-甲氧基-苯(4.08ml,29.5mmol,2.2eq.),将混合物于0℃搅拌90分钟。将反应介质倒入et2o(300ml)/水(400ml)混合物中,分离层。用et2o萃取水相(两次),将合并的有机层用水和盐水洗涤,然后经na2so4干燥。过滤后,将溶剂浓缩。将残余物通过硅胶快速色谱法(用0至15%etoac/环己烷洗脱)纯化,得到预期产物。
lcms:mw(计算值):447.8;m/zmw(实测值):447.1/449.1(m+h)。
2.59.2.步骤ii:6-[双[(4-甲氧基苯基)甲基]氨基]-4-氯-吡啶-3-醇
于-78℃,向在无水thf(80ml)中的5-溴-4-氯-n,n-双[(4-甲氧基苯基)甲基]吡啶-2-胺(3.2g,7.07mmol,1eq.)的溶液中滴加叔丁基锂(2.5m在己烷中,3.54ml,8.84mmol,1.25eq.)。将混合物于-78℃搅拌90分钟,然后添加2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(cas号61676-62-8,2.94ml,14.14mmol,2.0eq.),将反应物于-78℃搅拌45分钟。将混合物在30分钟内升温至-10℃,添加过氧化氢(30%水溶液,2.89ml,28.28mmol,4.0eq.)。然后将反应物于室温搅拌30分钟,然后用250mletoac稀释,倒入250ml水/盐水混合物中。分离层,用etoac萃取水相。将合并的有机层经na2so4干燥,过滤和浓缩。将残余物混悬于400ml1nnaoh水溶液中,将水相用et2o洗涤。使用浓hcl将水层ph调整至约6,接着用etoac萃取(3次)。将合并的有机层经na2so4干燥,过滤和浓缩,得到预期产物。
lcms:mw(计算值):384.9;m/zmw(实测值):385.2(m+h)。
2.59.3.步骤iii:2-[[6-[双[(4-甲氧基苯基)甲基]氨基]-4-氯-3-吡啶基]氧基]丙腈
向在无水dmf(7ml)中的6-[双[(4-甲氧基苯基)甲基]氨基]-4-氯-吡啶-3-醇(500mg,1.24mmol,1.0eq.)和cs2co3(612mg,1.86mmol,1.5eq.)的混悬液中添加2-溴丙腈(133μl,1.5mmol,1.2eq.)。将所得混合物于75℃搅拌45分钟,冷却至室温后倒入etoac(70ml)/水(45ml)/盐水(45ml)混合物中。分离层,用etoac萃取水相。将合并的有机层用50ml盐水洗涤,经na2so4干燥,过滤和浓缩。将残余物通过硅胶快速色谱法(用0至25%etoac/环己烷洗脱)纯化,得到预期产物。
lcms:mw(计算值):437.9;m/zmw(实测值):438.2(m+h)。
2.59.4.步骤iv:2-[[6-[双[(4-甲氧基苯基)甲基]氨基]-4-(1-甲基吡唑-4-基)-3-吡啶基]氧]丙腈
于115℃,在氩气下,将在无水1,4-二噁烷(6ml)中的1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡唑(cas号761446-44-0;271mg,1.26mmol,1.5eq.)、k3po4(541mg,2.52mmol,3eq.)、2-[[6-[双[(4-甲氧基苯基)甲基]氨基]-4-氯-3-吡啶基]氧基]丙腈(372mg,0.84mmol,1eq.)和pd(dppf)cl2·dcm(70.8mg,0.084mmol,0.1eq.)在密封烧瓶中搅拌16小时。将反应混合物冷却至室温,用50mletoac、70ml水和50ml盐水稀释。分离层,用etoac(2×30ml)萃取水相。将合并的有机层用盐水洗涤,经硅藻土过滤,将滤液浓缩。将残余物通过硅胶快速色谱法(用0至35%etoac/dcm洗脱)纯化,得到预期产物。
lcms:mw(计算值):483.6;m/zmw(实测值):484.3(m+h)。
2.59.5.步骤v:2-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-6-基]氧基丙腈
向搅拌的在无水dcm(7ml)中的2-[[6-[双[(4-甲氧基苯基)甲基]氨基]-4-(1-甲基吡唑-4-基)-3-吡啶基]氧基]丙腈(270mg,0.54mmol,1eq.)的溶液中添加tfa(1.25ml,16.1mmol,30eq.),将混合物于室温搅拌16小时。然后蒸发溶剂,将残余物溶于dcm(30ml)中,添加饱和nahco3水溶液(30ml)。将所得混合物剧烈搅拌5分钟,分离层。用dcm萃取水相,将合并的有机层经na2so4干燥,过滤和蒸发。将残余物混悬于etoh(6ml)中,将混合物加热至60℃,滴加2-氯乙醛(50%水溶液,0.12ml,0.97mmol,1.8eq.)。将反应介质于回流搅拌3.5小时,然后将挥发物蒸发,将残余物溶于dcm(40ml)和饱和na2co3水溶液(30ml)中。分离层,用dcm萃取水相(两次)。将合并的有机层经na2so4干燥,过滤和浓缩。将残余物通过硅胶快速色谱法(用0至35%(10%meoh/dcm)/dcm洗脱)纯化,得到预期产物。
lcms:mw(计算值):267.3;m/zmw(实测值):268.1(m+h)。
2.59.6.步骤vi:cpd301
在119℃下,在氩气下,将经脱气的在无水dmac(1.2ml)中的int9(99mg,0.29mmol,1.6eq.)、koac(53mg,0.54mmol,3eq.)、2-[7-(1-甲基吡唑-4-基)咪唑并[1,2-a]吡啶-6-基]氧基丙腈(50mg,0.18mmol,1eq.)和pd(dppf)cl2·dcm(11mg,0.01mmol,0.07eq.)的混合物搅拌2小时。然后将反应混合物冷却至室温,倒入20ml5%nahco3水溶液中。将混合物用etoac萃取(3次),将合并的有机层用5%nahco3水溶液洗涤(2次),用盐水洗涤。将有机层经na2so4干燥,过滤和浓缩。将粗制混合物通过硅胶快速色谱法(用0至80%(10%meoh/dcm)/dcm洗脱)纯化,得到残余物,将该残余物溶于2mldcm中。浓缩至干,得到预期化合物。
2.60.cpd302
向在-5℃下在无水1,4-二噁烷(2ml)中的cpd301(122mg,0.22mmol,1eq.)的溶液中滴加hcl(1.25m在etoh中,1.08ml,1.34mmol,6eq.)。将所得混合物在密封小瓶中于90℃搅拌60小时,然后倒在100ml冰上。将混合物搅拌15分钟,用50ml饱和nahco3水溶液稀释,用2×40mletoac萃取。将合并的有机层经na2so4干燥,过滤和浓缩。经粗制混合物通过硅胶快速色谱法(用0至100%(10%meoh/etoac)/etoac洗脱)纯化,得到残余物,将该残余物溶于dcm/et2o混合物中。将溶剂浓缩,得到预期化合物。
2.61.cpd303
向在thf/h2o(2ml/0.7ml)溶剂混合物中的cpd302(30mg,0.05mmol,1eq.)的溶液中添加氢氧化锂(6.1mg,0.25mmol,5eq.),将反应混合物于室温搅拌1小时。将挥发物蒸发,将残余物溶于20ml水和1ml1nnaoh水溶液中。将溶液用et2o洗涤。然后在搅拌下用4nhcl水溶液将水相的ph调整至约3。将获得的溶液用20%异丙醇/dcm(3×15ml)萃取。将合并的有机层经na2so4干燥,通过相分离器短柱,浓缩,得到预期化合物。
2.62.cpd304
向搅拌的在1,4-二噁烷(2.0ml)中的cpd295(22.0mg,0.0381mmol)的混悬液中缓慢添加naoh1n水溶液(3.00ml,3.00mmol),将混合物于室温搅拌2小时。将混合物转移至烧瓶,将1,4-二噁烷蒸发。将残余物用3ml水稀释。使用4nhcl水溶液将溶液的ph调整至约4。沉淀形成,将其通过过滤收集,用2×3mlhcl水溶液(ph≈4)洗涤。在真空烘箱中于40℃干燥3小时,得到预期化合物。
2.63.cpd305
在密封小瓶中,将cpd304(40.0mg,0.0730mmol)、koac(50.4mg,0.365mmol)和2-氯乙基(二乙基)氯化铵(62.8mg,0.365mmol)的反应混合物于室温剧烈搅拌16小时。将反应混合物用5mletoac、接着用5ml水稀释,在剧烈振荡后分成两层。将有机层经na2so4干燥。过滤后,蒸发溶剂,得到粗物质,将该粗物质通过硅胶快速色谱法(用10%异丙醇/dcm、然后用10%异丙醇/1,4-二噁烷洗脱)纯化。将所收集级分的溶剂蒸发,得到残余物,将该残余物溶于dcm/et2o混合物中。将溶剂浓缩,得到预期化合物。
表ii.本发明的化合物所用的中间体
sm=起始物质,mtd=方法,msmes’d=测得质量
表iii.说明性的本发明的化合物
sm=起始物质,mtd=方法,msmes’d=测量的质量
表iv.说明性的本发明的化合物的nmr数据
生物学实施例
实施例3.体外分析
3.1.生物化学分析
3.1.1.33p放射活性激酶分析
3.1.1.1.概述
33p放射活性激酶分析的原则在于采用[33p]-g-atp测定当通过sik1、sik2或sik3磷酸化时进入底物amara肽的33p,其与激酶活性相关。
3.1.1.2.方案
将测试化合物制备成10点剂量响应的系列稀释,以1/5稀释步骤在100%dmso中自2mm最高浓度开始,在水中1/20稀释,取5μl转移至分析板(greiner,目录号651201)。
使用1%dmso和10μm星孢素终浓度作为阴性和阳性对照。
在分析板上添加11μl酶-底物混合物。通过在分析板上添加9μl由未标记的和经33p标记的atp组成的atp混合物开始反应。将板于30℃培育表v中所指示的时间期。
表v.用于人sik激酶33p放射活性分析的条件
通过向反应物中添加25μl磷酸(150mm)来终止反应。
使用采集器将完全终止的激酶反应物转移到预湿unifilter-96板(unifilter-96gf/b,perkinelmerinc.,cat#6005177)上。
在采集激酶反应物后,将滤板用磷酸(75mm)洗涤6次。将unifilter-96板的背面密封,向各孔添加40μlmicroscint-20(perkinelmerinc.,cat#6013621)。将板的顶部用topseal-a密封。用topcount仪器(perkinelmerinc.)进行读数。
3.1.1.3.数据分析和结果
在topcount上读数后生成原始数据,绘图产生剂量响应曲线以计算对每种sik同源物而言的抑制百分数(pin)和平均ic50,报道于下表中。
表vi.说明性的本发明的化合物的33p放射活性sik激酶分析ic50
*>500nm
**>100-500nm
***>10-100nm
****0.01-10nm
na未测量
3.1.2.adp-glotm激酶分析
3.1.2.1.概述
adp-glotm激酶分析为测定由激酶反应形成的adp的发光技术分析。在此特定研究中,激酶反应由amara肽底物(signalchem,目录号a11-58)经sik1(carnabiosciences,目录号02-131)、sik2(thermofisherscientific,目录号pv4792)或sik3(signalchem,目录号s12-11g-100)的磷酸化组成。在第二个步骤中,激酶反应终止并耗尽所有剩余atp。在最后步骤中,adp转化成atp并通过使用荧光素酶/荧光素反应测量这种新合成的atp。使用envision读板器测量产生的光,其中获得的发光信号与激酶活性正相关。
3.1.2.2.方案
将测试化合物制备成10点剂量响应的系列稀释,以1/5稀释步骤在100%dmso中自2mm最高浓度开始,在水中1/20稀释,取1μl转移至分析板(perkinelmerinc.,目录号6007290)。
使用1%dmso和10μm星孢素终浓度作为阴性和阳性对照。
将2μl酶-底物混合物添加至分析板中。
通过在分析板上添加2μl稀释atp开始反应。将板在1000rpm下离心数秒,轻轻振荡2分钟,接着于室温培育120分钟。
通过向反应物中添加5μladp-glo试剂(promega,目录号v912b)停止反应并耗尽未经消耗的atp。将板在1000rpm下离心数秒,于室温培育40分钟(atp耗尽)。
adp转化成atp,通过向反应物中添加10μl激酶检测试剂(promega,目录号v913b+v914b)引入荧光素酶和荧光素以检测atp。将板在1000rpm下离心数秒,于室温培育30分钟(adp检测)。
在envision读板器(perkinelmerinc.)上测量发光。
表vii.用于人sik激酶adp-glotm分析的条件
3.1.2.3.数据分析和结果
在topcount上读数后生成原始数据,绘图产生剂量响应曲线以计算对每种sik同源物而言的抑制百分数(pin)和平均ic50,报道于下表中。
表viii.说明性的本发明的化合物的adp-glotmsik激酶分析ic50
*>500nm
**>100-500nm
***>10-100nm
****0.01-10nm
na未测量
3.2.细胞分析
3.2.1.pbmc分析:lps触发的tnfα(elisa)
3.2.1.1.概述
sik抑制在lps触发的单核细胞衍生的巨噬细胞(mdm)和树突细胞(mddc)中抑制tnfα和增加il-10释放(clark等人,2012;sundberg等人,2014;ozanne等人,2015)。
此分析在外周血单核细胞(pbmc)中测定了测试化合物对lps驱动的tnfα分泌的抑制,其继而与sik抑制相关。
3.2.1.2.方案
从人血液样品分离pbmc(血沉棕黄层)。将血沉棕黄层无菌转移至50mlfalcontm管中,在磷酸盐缓冲盐水(pbs)中1/2稀释。将falcon管装入20mllymphoprep(axis-shield,目录号1001967)和25ml血沉棕黄层。将所述管在不带刹车的控温离心机中于25℃以400×g离心35分钟。从样品与lymphoprep之间的白色连接层吸出pbmc。将pbmc在pbs中洗涤五次。将细胞再混悬于补充有10%fbs、1%p/s的rpmi1640完全培养基中,用血液分析仪(sysmexxs-500i)测定细胞密度。最后将pbmc以400,000个pbmc/160μl/96孔接种。
在100%dmso中通过10mm测试化合物的储备溶液的3倍稀释制备化合物稀释板。通过在rpmi培养基中将化合物稀释板稀释50倍制备中间稀释板(10x终浓度)。
将20μl10x终浓度化合物添加至细胞中,于37℃培育1小时,然后添加触发剂。无触发剂条件/触发剂条件掺有相等最终dmso浓度的0.2%dmso。将20μl10xlps(终浓度1ng/ml)溶液添加至所有孔,除了“无触发剂孔”中添加20μl培养基。18至20小时后,收集上清液用于使用elisa进行il-10和tnfα测定。
通过填充multidrop和在吸收性纸上轻拍进行tnfα(100μl;384-孔板)和il-10elisa(200μl/孔;96-孔板)二者的所有洗涤步骤;利用多通道进行抗体/样品的添加。
3.2.1.2.1tnfαelisa
将lumitrac600greiner384-孔板涂覆40μl捕获抗体(bdpharmingen,目录号551220),达到在1xpbs中1μg/ml的终浓度,于4℃储存过夜。
然后将板用pbst(pbs+0.05%tween20)洗涤一次,用pbs洗涤一次,接着添加100μl阻断缓冲液(1%牛血清白蛋白(bsa)-5%蔗糖),将板密封,于室温培育至少4小时。将板用pbst洗涤一次、用pbs洗涤一次后,添加40μl标准品或样品(使用1/2系列稀释自16000pg/ml开始制备tnfα标准曲线;在稀释缓冲液(pbs+1%bsa)中进行稀释)。将板用pbst洗涤两次,用pbs洗涤一次,之后添加35μl检测抗体(在稀释缓冲液中稀释,终浓度为0.25μg/ml),将板于室温培育至少2小时。将板用pbst洗涤两次,用pbs洗涤一次,之后添加35μlstrep-hrp偶联物(在稀释缓冲液中稀释,终浓度为0.5μg/ml)。将板在黑暗中于室温培育至少45分钟,但是不长于1小时。将板用pbst洗涤两次,用pbs洗涤一次。之后,向各孔中添加50μl鲁米诺(luminol)底物(根据制造商的说明制备),于室温避光培育5分钟。在envision2104上测量化学发光。
3.2.1.3.数据分析和结果
3.2.1.3.1tnfα抑制计算
为了测量lps诱导的tnfα的抑制,与对照相比计算了所有测试浓度的抑制百分数(pin)值。使用未经刺激的样品(无触发剂/溶媒(0.2%dmso))作为阴性对照(100%抑制)。作为阳性对照(0%抑制),使用经刺激的样品(触发剂/溶媒)。
其中rlu=相对化学发光光单位(减去背景),下标p和n分别指阳性对照和阴性对照的平均值。
将pin值以浓度-响应绘图,用graphpadprism软件、应用4-参数非线性回归(s形)曲线拟合推导出ec50值。因为未获得清晰底部平台,将曲线底部约定为等于0。
3.2.1.3.2结果和成果
当接受说明性的本发明的化合物时所获得的数据记载在下表中。
表ix.说明性的本发明的化合物的pbmctnfα抑制
*>5000nm
**>1000-5000nm
***>100-1000nm
****0.1-100nm
na未测量
3.2.2.mdm分析:lps-触发的tnfα/il-10(elisa)
3.2.2.1.概述
sik抑制在lps触发的单核细胞衍生的巨噬细胞(mdm)和树突细胞(mddc)中抑制tnfα和增加il-10释放(clark等人,2012;sundberg等人,2014;ozanne等人,2015)。该分析评价了说明性的本发明的化合物在单核细胞衍生的巨噬细胞中对lps-诱导的tnfα和lps触发的il-10分泌的抑制。
3.2.2.2.方案
从人血液样品分离pbmc(血沉棕黄层)。将血沉棕黄层无菌转移至50mlfalcon管中,在pbs中1/2稀释。将falcon管装入20mllymphopreptm,在其上小心添加25ml血沉棕黄层,将所述管在不带刹车的控温离心机中于25℃以400g离心35分钟。从样品与lymphopreptm之间的白色连接层吸出pbmc。将pbmc在pbs中洗涤五次。将细胞再混悬于补充有10%fbs、1%p/s的rpmi1640完全培养基中,用血液分析仪(sysmexxs-500i)测定细胞密度。
将pbmc以300×g离心10分钟,以1.0e07个细胞/80μlmiltenyi缓冲液(pbs,ph7.4,1%fbs,2mmedta)的密度再混悬。
3.2.2.2.1cd14+单核细胞的阳性标记。
自此方案的该点开始,所有步骤在冰上进行。添加20μlcd14+微珠/1.0e07个细胞,将管混合,在冰箱中在4℃下培育15分钟。使用miltenyi缓冲液将细胞混悬液体积调整至100ml的总体积,轻轻混合,随后以300×g离心10分钟。弃去上清液,将细胞团块再混悬于12mlmiltenyi缓冲液中。
3.2.2.2.2磁性细胞分选
将四个ls柱放置在来自miltenyibiotec的macs分离器(磁铁)中,以3mlmacs缓冲液/柱冲洗进行预润湿。将3ml细胞混悬液添加至柱上(最多1*108个经标记细胞/柱),随后将柱用3mlmiltenyi缓冲液洗涤3次。
将柱自磁铁移除,将5mlmiltenyi缓冲液添加至柱中以通过将活塞推入柱内冲洗出cd14+级分。将冲洗出的级分收集在新鲜50mlfalcon中,用miltenyi缓冲液将体积调整至30ml,将细胞以300×g离心10分钟。将获得的细胞团块再混悬于10mlrpmiw/ofbs中,用血液分析器(sysmexxs-500i)测定细胞密度。将100000个细胞接种在96孔板的每孔中用于在补充有10%fbs、1%p/s和100ng/mlrhm-csf的rpmi1640培养基中分化至mdm。在第5天,将培养基用补充有10%fbs、1%p/s和100ng/mlrhm-csf的100μlrpmi1640培养基更换。
在第10天,触发mdm和添加化合物。
在100%dmso中通过10mm储备溶液的3倍稀释制备化合物稀释板。通过在rpmi培养基中将化合物稀释板稀释50倍制备中间稀释板(10x终浓度)。
使用多通道吸量管将培养基自细胞板小心移除,用80μl新鲜培养基更换。将10μl10x终浓度化合物添加至细胞中,于37℃培育1小时,然后添加触发剂。无触发剂条件/触发剂条件掺有相等最终dmso浓度的0.2%dmso。将10μl10xlps(终浓度200ng/ml)溶液添加至所有孔,除了“无触发剂孔”中添加10μl培养基。lps触发2小时(il-10测定)和20小时(tnfα测定)后收集上清液。
3.2.2.2.3tnfαelisa
将lumitrac600greiner384-孔板涂覆40μl捕获抗体(bdpharmingen,目录号551220),达到在1xpbs中1μg/ml的终浓度,于4℃储存过夜。
然后将板用pbst(pbs+0.05%tween20)洗涤一次,用pbs洗涤一次,接着添加100μl阻断缓冲液(1%牛血清白蛋白(bsa)-5%蔗糖),将板密封,于室温培育至少4小时。将板用pbst洗涤一次和用pbs洗涤一次后,添加40μl标准品或样品(使用1/2系列稀释自16000pg/ml开始制备tnfα标准曲线;在稀释缓冲液(pbs+1%bsa)中进行稀释)。将板用pbst洗涤两次,用pbs洗涤一次,之后添加35μl检测抗体(在稀释缓冲液中稀释,终浓度为0.25μg/ml),将板于室温培育至少2小时。将板用pbst洗涤两次,用pbs洗涤一次,之后添加35μlstrep-hrp偶联物(在稀释缓冲液中稀释,终浓度为0.5μg/ml)。将板在黑暗中于室温培育至少45分钟,但是不长于1小时。将板用pbst洗涤两次,用pbs洗涤一次。之后,向各孔中添加50μl鲁米诺(luminol)底物(根据制造商的说明制备),于室温避光培育5分钟。在envision2104上测量化学发光。
3.2.2.2.1il-10elisa
将immulon2hb96孔板(thermoelectronco.,目录号3455)涂覆40μl捕获抗体(在tris缓冲液(50mmtris;150mmnacl;ph9(用hcl调整))中稀释,终浓度为2μg/ml),于4℃储存过夜。第二天将板用pbst洗涤三次,随后添加200μl阻断缓冲液(1%bsa+5%蔗糖,在pbs-t中)。于37℃培育30分钟后,将板用pbst洗涤三次,添加100μl标准品或样品(使用1/2系列稀释自1000pg/ml开始制备il-10标准曲线;在稀释缓冲液pbs+1%bsa中进行稀释)。于37℃培育1小时后,将板用pbst洗涤三次,之后添加100μl检测抗体(bdpharmingen,目录号554499)(在tris缓冲液中稀释,终浓度为0.25μg/ml),将板于室温培育至少2小时。将板用pbst洗涤三次,之后添加100μlstrep-hrp偶联物(在稀释缓冲液中稀释,终浓度为0.5μg/ml)。将板在黑暗中于37℃培育30分钟。将板用pbst洗涤三次。制备总体积20ml的底物溶液,将18mlh2o、2ml柠檬酸乙酸缓冲液、200μltmb混合物(于4℃储存的四甲基联苯胺(tmb)101mg,dmso10ml)、2.5μl30%h2o2混合。向各孔添加100μl底物溶液,培育直至出现亮蓝色。通过添加50μl1mh2so4停止反应,之后在spectramaxi3,moleculardevices上在450nm处测定吸光度。
3.2.2.3.数据分析和结果
3.2.2.3.1tnfα抑制计算
为了测量lps诱导的tnfα的抑制,与对照相比计算了所有测试浓度的抑制百分数(pin)值。使用未经刺激的样品(无触发剂/溶媒(0.2%dmso))作为阴性对照(100%抑制)。作为阳性对照(0%抑制),使用经刺激的样品(触发剂/溶媒)。
其中rlu=相对化学发光光单位(减去背景),下标p和n分别指阳性对照和阴性对照的平均值。
将pin值以浓度-响应绘图,用graphpadprism软件、应用4-参数非线性回归(s形)曲线拟合推导出ec50值。因为未获得清晰底部平台,将曲线底部约定为等于0。
3.2.2.3.2il-10诱导计算
sik抑制诱导了il-10。为了定量这类诱导,对每个测试浓度计算了与“仅lps”相比的倍数变化(fc),并且计算了最大fc(il-10fcmax):
其中abs=在450nm处测量的吸光度。
报告了测试化合物的两个或更多个分析的最大fc中值(il-10fcmax中值)。
3.2.2.3.3结果和成果
当接受说明性的本发明的化合物时所获得的数据记载在下表中。
表x.说明性的本发明的化合物的mdmtnfα抑制和il-10诱导。
*>5000nm+≤1.5
**>1000-5000nm++>1.5-4.5
***>100-1000nm+++>4.5
****0.1-100nmna未测定
实施例4.体内分析
4.1.炎性肠病
4.1.1.dss模型(小鼠)
小鼠慢性dss-诱导炎性肠病模型(ibd)是炎性肠病的良好验证的疾病模型(wirtz等人,2007;sina等人,2009)。
为了诱导慢性结肠炎,给雌性balb/c小鼠喂食溶于饮用水中的4%葡聚糖硫酸钠(dss)持续4天,接着3天规则饮用水。重复此循环3次。此方案允许诱导强的结肠炎,同时避免了高死亡率。将动物分成若干组:
a.未进行改变的水;单独溶媒,n=10),
b.患病的(dss;单独溶媒,n=10),
c.用作参比的柳氮磺吡啶(sulfazalazine)(dss;20mg/kg/天,口服,n=10)和
d.测试化合物(dss;1、3、10、30mg/kg/天,口服,n=10)。
每隔一天测量临床参数。疾病活动指数(dai)为体重损失、粪便硬度和直肠出血的个体分数的复合度量组合。在实验的第20天根据sina等人(sina等人,2009)介绍的方案处死小鼠。在处死时,移出完整结肠,用无菌pbs冲洗。将远端结肠节段解剖用于组织学分析、基因表达和蛋白质含量测定。
4.2.cia模型
4.2.1.材料
完全弗氏(freund’s)佐剂(cfa)和不完全弗氏佐剂(ifa)购自difco。牛胶原蛋白ii型(cii)、脂多醣(lps)和enbrel分别获自chondrex(isled’abeau,法国);sigma(p4252,l’isled’abeau,法国)、whyett(25mg可注射注射器,法国)。所使用的所有其它试剂为试剂级,所有溶剂为分析级。
4.2.2.动物
dba1/j小鼠(雄性,7至8周龄)获自charlesriverlaboratories(法国)。将小鼠保持在12小时光照/黑暗循环(07h00-19h00)。温度维持在22℃,随意取食和饮水。
4.2.3.胶原蛋白诱导的关节炎(cia)
在实验前一天,用0.05m乙酸制备了cii溶液(2mg/ml),于4℃储存。在临免疫前,在冰水浴中在预冷玻璃瓶中通过均质器将等体积的佐剂(ifa)和cii混合。如果未形成乳液,可能需要额外的佐剂和延长的均质化。在第1天在各小鼠尾根部经皮内注射0.2ml乳液,在第22天进行第二次加强皮内注射(以2mg/ml在cfa0.1ml盐水中的cii溶液)。此免疫方法由公开方法(jou等人,2005;sims等人,2004)修改而来。
4.2.4.研究设计
在小鼠cia模型中测试了化合物的治疗效果。将小鼠随机分成相等组,每组包括10只小鼠。所有小鼠在第1天免疫接种,在第22天加强。阴性对照组用溶媒(mc0.5%)处理,阳性对照组用enbrel(10mg/kg,3x周,皮下)处理。通常以3个口服(p.o.)剂量测试所关注的化合物。在第32天,就临床评分进行组间随机化,将动物根据它们的组进行治疗处理直至第47天。每周两次记录体重和临床评分。
4.2.5.关节炎的临床评估
根据khachigian2006、lin等人2007和nishida等人2004的方法(khachigian2006;lin等人,2007;nishida等人,2004)对关节炎进行评分。利用如下的关节炎评分对四个爪中的每一个爪的肿胀进行分级:0-无症状;1-一种关节如踝或腕的轻微但是明确的发红和肿胀,或限于个别指/趾的明显发红和肿胀,不管受影响指/趾的数目;2-两种或更多种关节的中度发红和肿胀;3-全爪、包括指/趾的严重发红和肿胀;4-牵涉多关节的最大发炎四肢(每只动物最大累积临床关节炎评分为16)(nishida等人,2004)。
4.2.5.1.关节炎发作后的体重变化(%)
临床上,体重损失系与关节炎相关(argilés和lópez-soriano1998;rall和roubenoff2004;shelton等人,2005;walsmith等人,2004)。因此,关节炎发作后的体重变化可用作非特异性端点来评价小鼠模型中的治疗效果。如下计算在关节炎发作后的体重变化(%):
4.2.5.2.放射学
给每只个体动物的后爪拍摄x-射线照片。将随机盲身份号分配给每张照片,如下利用放射学拉森氏(larsen’s)评分系统由两个独立评分人对骨侵蚀严重度进行分级:0-正常,具有完整骨轮廓和正常关节间隙;1-轻微异常,其中任意一个或两个外跖骨显示出轻微骨侵蚀;2-明确早期异常,其中任意三至五个外跖骨显示出骨侵蚀;3-中度破坏性异常,其中所有外跖骨以及任意一个或两个内跖骨显示出明确骨侵蚀;4-严重破坏性异常,其中所有跖骨显示出明确骨侵蚀和至少一个内跖骨关节被完全侵蚀,留下一些部分保留的骨关节轮廓;5-致残异常,无骨轮廓。此评分系统改自salvemini等人,2001;bush等人,2002;sims等人,2004;jou等人,2005(bush等人,2002;jou等人,2005;salvemini等人,2001;sims等人,2004)。
4.2.5.3.稳态pk
在第42天,用肝素锂作为抗凝剂在下列时间点在后眶窦处收集血样:给药前、1小时、3小时和6小时。将全血样品离心,将所得血浆样品于-20℃储存待分析。通过lc-ms/ms方法测定各测试化合物的血浆浓度,其中质谱仪以正电喷雾模式操作。
4.2.6.结果
当在此方案中测试时,获得下列数据:
表xi.cia临床评分
ns:不显著|p-值:***(<0.001)-p-值:***(<0.01)-p-值:***(<0.05)vs疾病溶媒组,采用anova和dunnett’s检验
4.3.通过局部应用tlr7/8激动剂米喹莫德诱导的银屑病样表皮增生的鼠模型
4.3.1.材料
抗鼠il-12/il-23p40纯化抗体(c17.8)获自ebioscience(目录号16712385)。
4.3.2.动物
balb/cj小鼠(雌性,18至20g体重)获自janvierlabs(法国)。将小鼠保持在12小时光照/黑暗循环(07h00-19h00)。温度维持在22±2℃,随意取食和饮水。
4.3.3.研究设计
研究设计改自vanderfitsl.等人(vanderfits等人,2009)。
在第一天,在异氟烷浅麻醉下将小鼠在两耳周围刮除毛发。
将30mg可购买获得的米喹莫德乳霜(aldara5%乳霜)应用于各耳的内表面和外表面两者,连续4天,相应于1.5mg活性化合物的日剂量。对照动物接受相同量的凡士林。
第1天至第5天,在应用米喹莫德之前给予小鼠测试化合物(10或30mg/kg,口服,b.i.d.,在甲基纤维素0.5%中)(在第5天,在安乐死之前2小时对小鼠仅给药一次)。
在阳性参比组中,在第1天和第1天前的3天,动物接受两次抗鼠il-12/il-23p40抗体(10mg/kg)的腹膜内注射。
4.3.4.评估疾病
利用厚度计(mitutoyo,absolutedigimatic,547321)每日测量两耳的厚度。在实验开始时和在处死时评估体重。在第5天,在最后给药后2小时,处死小鼠。切下耳廓,排除软骨。将耳廓称重,然后浸入含有1ml
结果表示为平均值±sem,采用单因素anova、然后通过dunnett’s事后检验(posthoctest)相对于米喹莫德溶媒组进行统计分析。
4.3.5.基因表达分析
将耳从
4.4.通过皮内注射il-23诱导的银屑病样表皮增生的鼠模型
4.4.1.材料
小鼠重组il-23,无载体(14-8231)由e-bioscience提供。
4.4.2.动物
balb/c小鼠(雌性,18至20g体重)获自cerj(法国)。将小鼠保持在12小时光照/黑暗循环(07:00-19:00)。温度维持在22℃,随意取食和饮水。
4.4.3.研究设计
研究设计改自rizzohl.等人(rizzo等人,2011)。
在第一天(d1),将小鼠在两耳周围剃除毛发。
连续4天(d1至d4),小鼠在吸入异氟烷诱导的麻醉下在右耳廓接受小鼠重组il-23(1μg/20μl在pbs/0.1%bsa中)的皮内日剂量和在左耳廓接受20μlpbs/0.1%bsa。
d1至d5,在il-23注射前1小时,对小鼠给予测试化合物或溶媒。
4.4.4.评估疾病
利用自动测径器每日测量两耳的厚度。在实验开始时和在处死时评估体重。在第5天,在最后给药后2小时,处死小鼠。切下耳廓,排除软骨。将耳廓放入含有1ml
在d4,在临给药前(t0)和给药后1小时、3小时、6小时,还从后眶窦收集血液样品用于pk表征。
每组8只小鼠。结果表示为平均值±sem,采用单因素anova、然后通过dunnett’s事后检验相对于il-23溶媒组进行统计分析。
4.4.5.基因表达分析
将一半耳从
4.5.通过表皮应用米喹莫德诱导的全身性红斑狼疮的鼠模型
4.5.1.材料
小鼠抗双链dna抗体elisa试剂盒获自alphadiagnosticinternational(目录号5120)。小鼠尿白蛋白elisa试剂盒获自abcam(目录号ab108792)。尿肌酸酐分析试剂盒获自abnova(目录号ka4344)。
4.5.2.动物
balb/cj小鼠(雌性,18至20g体重)获自janvierlabs(法国)。将小鼠保持在12小时光照/黑暗循环(07:00-19:00)。温度维持在22±2℃,随意取食和饮水。
4.5.3.研究设计
研究设计改自yokogawam.等人(yokogawa等人,2014)。
在第一天(d1),将小鼠在右耳周围剃除毛发。
小鼠在右耳廓每周3次接受1.25mg米喹莫德的表皮应用,连续12周(d1至d86)。对照组接受相同量的凡士林。
d1至d86,对小鼠用测试化合物(30mg/kg,口服,q.d.,在甲基纤维素0.5%中)或用溶媒(10ml/kg)给药。
4.5.4.评估疾病
用自动量计(mitutoyo,absolutedigimatic,547-321)每周一次测量耳朵厚度。
在开始时和每周一次评估体重直至处死。在尸检时,还测量了脾重量。在最后给药后2小时,处死小鼠。
在不同时间点(例如在d28、d56和d84),将小鼠单独放入代谢笼中以进行尿分析和评估蛋白尿(白蛋白与肌酸酐比例)。
在不同时间点(例如在d28、d56和d86)收集血清以评估抗双链dnaigg水平。
在d13,在临给药前(t0)和给药后1小时、3小时、6小时,还从后眶窦收集血液样品用于pk表征。
每组8-19只小鼠。结果表示为平均值±sem,采用单因素anova、然后通过dunnett’s事后检验相对于米喹莫德溶媒组进行统计分析。
4.5.5.血浆中化合物水平的定量
通过lc-ms/ms方法测定了各测试化合物的血浆浓度,其中质谱仪以正或负电喷雾模式操作。
4.5.5.1.组织病理学
在各肾小球中,将4种不同读数(包括系膜增殖、毛细管内增殖、系膜基质增殖和节段性硬化)在0至2的标度上分级,然后加总。对于各肾脏,将约50个肾小球评分,然后取平均,给出一个肾小球病变评分(yokogawa等人,2014)。数据表示为平均值±sem,用kruskal-wallis检验、然后通过dunnett’s事后检验相对于米喹莫德溶媒组进行统计分析。
4.5.5.2.细胞定量
对于各细胞类型,在x20的放大下,对全组织切片使用图像分析(calopix软件,tribvnhealthcare)进行免疫组织化学分析。数据表示为平均值±sem,采用单因素anova、然后通过dunnett’s事后检验相对于米喹莫德溶媒组进行统计分析。
4.5.5.3.基因表达分析
在处死时,将左肾的第二个部分放入含有1.4mm陶瓷珠的管中,用bertininstruments
在处死时,将三分之一脾脏放入含有1.4mm陶瓷珠的管中,用bertininstruments
4.6.通过il-23过度表达诱导的银屑病性关节炎鼠模型
4.6.1.材料
小鼠il-23增强的附加型表达载体(eev)获自systembiosciences(目录号eev651a-1)。小鼠il-23quantikineelisa试剂盒获自r&dsystems(目录号m2300)。
4.6.2.动物
b10.riii小鼠(雄性,8周龄)获自charlesriver(法国)。小鼠保持在12小时光照/黑暗循环(07:00-19:00)。温度维持在22±2℃,随意取食和饮水。
4.6.3.研究设计
研究设计改自sherlockjp.等人(sherlock等人,2012)。
在第一天(d1),小鼠进行ringer或zairinger中的il-23eev的流体动力注射至尾静脉。
自d5起,每周两次,对小鼠临床症状评分直至实验结束。
在d5,通过下颌下静脉穿刺收集血液以评估血清il-23浓度。
在d9,来自所有组的小鼠接受
在d11,根据
自d12起,对小鼠给予测试化合物或溶媒。
在d19,在最后一次给药后的时间t0、t1h、t3h和t6h时采集血样。分离血浆并于20℃保持直至生物分析。
在d36,在最后一次施用化合物之后2小时,处死来自所有组的小鼠。
将总血液收集在血清血液管中,通过轻轻倒置8至10次混合。在凝块后,将血液样品以1800×g离心10分钟。离心后,将血清于-80℃储存。
4.6.4.评估疾病
在研究开始时、然后每周两次和在处死时评估体重。
每周两次,对炎症临床征兆评分:对于正常爪,0分;若一个指/趾肿胀,则1分;若两个或更多个指/趾肿胀,则2分;若全爪肿胀,则3分。将所有四肢的分数相加以产生整体评分。
在d32,来自所有组的小鼠接受
每组有10只小鼠。结果表示为平均值±sem,用单单因素anova、然后通过dunnett’s事后检验相对于用于评分和成像分析的患病溶媒组和相对于用于体重的假溶媒组进行统计分析。
最后注释
本领域技术人员将理解,前述说明是示例性及解释性的,其意欲阐述本发明及其优选实施方案。通过常规实验,本领域技术人员将意识到可以在不背离本发明宗旨的情况下进行的明显修改及变化。所有在所述权利要求的范围内的这类变化也意欲被包括在内。因此,本发明不意欲通过以上描述来定义,而是通过随后的权利要求书及其等同方案来定义。
本说明书引用的所有出版物、包括但不限于专利及专利申请均通过引用并入本文,如同各单独出版物被具体地和单独地指明如同整体给出那样通过引用并入本文。
应理解,诸如各化合物的有差别的细胞渗透能力等因素可促成化合物在体外生物化学和细胞分析中的活性之间的差异。
如本申请中给出和阐述的本发明的化合物的化学名称中的至少一些可以通过使用市售化学品命名软件程序自动生成,并且未经独立验证。实施该功能的代表性程序包括由openeyesoftware,inc出售的lexichem命名工具和由mdl,inc出售的autonomsoftware工具。在所指化学名称和所绘结构不同的情况下,以所绘的结构为准。
参考文献
argilésjm,lópez-sorianofj.1998.catabolicproinflammatorycytokines.curr.opin.clin.nutr.metab.care1,245–251。
ashourahmeda等人,2010.sik2isacentrosomekinaserequiredforbipolarmitoticspindleformationthatprovidesapotentialtargetfortherapyinovariancancer.cancercell18,109–121。
bundgaardh.1985.designofprodrugs,elsevier。
bushka等人,2002.reductionofjointinflammationandboneerosioninratadjuvantarthritisbytreatmentwithinterleukin-17receptorigg1fcfusionprotein.arthritisrheum.46,802–805。
charoenfupraserts等人,2011.identificationofsalt-induciblekinase3asanoveltumorantigenassociatedwithtumorigenesisofovariancancer.oncogene30,3570–3584。
clarkk等人,2012.phosphorylationofcrtc3bythesalt-induciblekinasescontrolstheinterconversionofclassicallyactivatedandregulatorymacrophages.proc.natl.acad.sci.u.s.a.109,16986–16991。
darlingnj等人,2017.inhibitionofsik2andsik3duringdifferentiationenhancestheanti-inflammatoryphenotypeofmacrophages.biochem.j.474,521–537。
vanderfitsl等人,2009.imiquimod-inducedpsoriasis-likeskininflammationinmiceismediatedviatheil-23/il-17axis.j.immunol.182,5836–5845。
joui-m等人,2005.thrombospondin1asaneffectivegenetherapeuticstrategyincollagen-inducedarthritis.arthritisrheum.52,339–344。
katohy等人,2004.salt-induciblekinase(sik)isoforms:theirinvolvementinsteroidogenesisandadipogenesis.mol.cell.endocrinol.217,109–112。
khachigianlm.2006.collagenantibody-inducedarthritis.nat.protoc.1,2512–2516。
kumagaia等人,2011.apotentinhibitorofsik2,3,3′,7-trihydroxy-4′-methoxyflavon(4′-o-methylfisetin),promotesmelanogenesisinb16f10melanomacells.plosone6。
linh-s等人,2007.anti-rheumaticactivitiesofhistonedeacetylase(hdac)inhibitorsinvivoincollagen-inducedarthritisinrodents.br.j.pharmacol.150,862–872。
liujz等人,2013.densegenotypingofimmune-relateddiseaseregionsidentifiesninenewrisklociforprimarysclerosingcholangitis.nat.genet.45,670–675。
nishidak等人,2004.histonedeacetylaseinhibitorsuppressionofautoantibody-mediatedarthritisinmiceviaregulationofp16ink4aandp21waf1/cip1expression.arthritisrheum.50,3365–3376。
nixonm等人,2016.skeletalmusclesaltinduciblekinase1promotesinsulinresistanceinobesity.mol.metab.5,34–46。
ozannej,prescottar,clarkk.2015.theclinicallyapproveddrugsdasatinibandbosutinibinduceanti-inflammatorymacrophagesbyinhibitingthesalt-induciblekinases.biochem.j.465,271–279。
ralllc,roubenoffr.2004.rheumatoidcachexia:metabolicabnormalities,mechanismsandinterventions.rheumatology43,1219–1223。
rizzohl等人,2011.il-23–mediatedpsoriasis-likeepidermalhyperplasiaisdependentonil-17a.j.immunol.186,1495–1502。
salveminid等人,2001.ameliorationofjointdiseaseinaratmodelofcollagen-inducedarthritisbym40403,asuperoxidedismutasemimetic.arthritisrheum.44,2909–2921。
sasakit等人,2011.sik2isakeyregulatorforneuronalsurvivalafterischemiaviatorc1-creb.neuron69,106–119。
sheltondl等人,2005.nervegrowthfactormediateshyperalgesiaandcachexiainauto-immunearthritis.pain116,8–16。
sherlockjp等人,2012.il-23inducesspondyloarthropathybyactingonror-γt+cd3+cd4-cd8-enthesealresidenttcells.nat.med.18,1069–1076。
simsna等人,2004.targetingosteoclastswithzoledronicacidpreventsbonedestructionincollagen-inducedarthritis.arthritisrheum.50,2338–2346。
sinac等人,2009.gprotein-coupledreceptor43isessentialforneutrophilrecruitmentduringintestinalinflammation.j.immunol.183,7514–7522。
sundbergtb等人,2014.small-moleculescreeningidentifiesinhibitionofsalt-induciblekinasesasatherapeuticstrategytoenhanceimmunoregulatoryfunctionsofdendriticcells.proc.natl.acad.sci.u.s.a.111,12468–12473。
walsmithj等人,2004.tumornecrosisfactor-alphaproductionisassociatedwithlessbodycellmassinwomenwithrheumatoidarthritis.j.rheumatol.31,23–29。
weinmn等人,2016.sikscontrolosteocyteresponsestoparathyroidhormone.nat.commun.7,13176。
wirtzs等人,2007.chemicallyinducedmousemodelsofintestinalinflammation.nat.protoc.2,541–546。
wutspgm,greenetw.2006.greene’sprotectivegroupsinorganicsynthesis第4版,wiley-interscience。
yaoc等人,2013.prostaglandine2promotesth1differentiationviasynergisticamplificationofil-12signallingbycampandpi3-kinase.nat.commun.4,1685。
yokogawam等人,2014.epicutaneousapplicationoftoll-likereceptor7agonistsleadstosystemicautoimmunityinwild-typemice:anewmodelofsystemiclupuserythematosus.arthritisrheumatol.66,694–706。
yuj等人,2013.salt-induciblekinase1isinvolvedinhighglucose-inducedmesangialcellproliferationmediatedbythealk5signalingpathway.int.j.mol.med.32,151–157。
- 还没有人留言评论。精彩留言会获得点赞!