癌症生物标志物及其使用方法与流程
本发明一般涉及单独使用cxcr4抑制剂(或与免疫治疗剂组合)治疗癌症。更具体地,本发明部分地涉及某些癌症生物标志物及其在用于治疗癌症(例如,评估和/或预测患者对治疗的反应)的方法中的用途。相关申请的交叉引用本申请要求于2017年11月7日提交的美国临时专利申请第62/582,877号;和于2018年4月13日提交的美国临时专利申请第62/657,406号的权益;其各自由此通过引用整体并入。
背景技术:
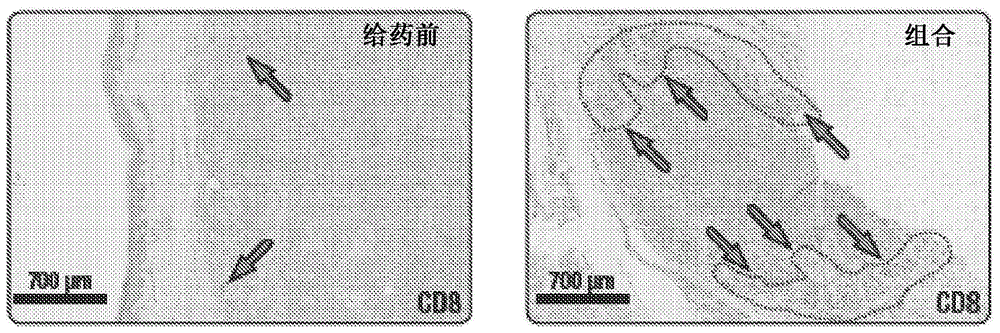
:美国癌症协会对2017年美国黑素瘤的估计为:将诊断出约87,110例新黑素瘤(男性约52,170例,女性约34,940例)。预计约9,730人死于黑素瘤。在过去的30年中,黑素瘤的发病率一直在上升。如果尽早发现,黑素瘤可高度治愈,在完全切除原发性黑素瘤后,i期黑素瘤的10年总生存率接近95%,ii期黑素瘤的总生存率接近45-77%。然而,手术治疗可能不适用于所有晚期黑素瘤患者。患有不可切除的或转移性疾病的患者接受全身性治疗,包含免疫疗法(例如,检查点抑制剂(cpi),例如抗pd-1和抗ctla-4抗体)和靶向疗法(例如,braf和/或mek抑制剂,针对患有已知遗传突变的患者)。检查点抑制剂免疫疗法和靶向疗法均延长了无进展生存期和总生存期。此外,已经完全切除原发性黑素瘤的患者中,有30%的患者将会发生局部、移行和/或淋巴结疾病复发。此外,有10%的黑素瘤患者出现淋巴结转移。在这些iii期患者之中,完全切除手术是可切除疾病患者的主要治疗方法;但是,手术后复发的风险很高。使用免疫调节药物(例如,高剂量干扰素-α和抗ctla-4抗体伊匹单抗(ipilimumab))的辅助疗法已表现出可改善可切除的iii期黑素瘤患者的无复发生存期。这些辅助治疗对总体生存期的影响尚未确定。新辅助化学疗法和免疫疗法的益处已在几种可手术的癌症中得到证实。然而,经常观察到肿瘤抗药性随着时间(例如,经由血管生成逃逸)的发展,并且这限制了这些疗法的有效性。还需要研究用于治疗多种癌症的cxcr4抑制剂。最初发现cxcr4是因为它参与了hiv进入和白细胞移动。它在超过23种人类癌症中也过表达。cxcr4经常在黑素瘤细胞上表达,特别是被认为代表黑素瘤干细胞的cd133+群;体外实验和小鼠模型已经证实,cxcl12(cxcr4的配体)对此类细胞具有趋化性。这些数据强调了研究cxcr4抑制剂以治疗由于cxcr4的过表达或异常表达而导致的细胞增生性病状的重大而未满足的需求。附图说明图1示出了用cd8+单标志物ihc染色剂染色的转移性黑素瘤人肿瘤样本的照片,其表明在用x4p-001和派姆单抗(pembrolizumab)的组合给药之后肿瘤边缘处的cd8+t细胞的大幅增加。图2示出了基线时(图2,图a)以及随后21天的x4p-001治疗(图2,图b)的代表性颗粒酶bihc染色。图2,图c示出了所有可评估样本的颗粒酶b治疗后阳性的倍数变化。使用halotm软件进行定量,并对整个肿瘤区域进行评分。图2,图d示出了x4p-001单剂治疗之前和之后可评估活检的5个患者的颗粒酶brna表达水平。使用如本文所述的纳米链(nanostring)获得图d中的rna表达数据。图3a示出了用x4p-001给药之前和之后的细胞毒性t淋巴细胞(ctl)基因标签的基因表达评分。从cd8a、cd8b、fltlg、gzmm和prf1标准化计数的几何平均值计算每个患者样本的基因评分。将平均值进行log10转换以生成基因表达评分。五个患者中的每一个患者的基因表达评分均升高。图3b示出了图3a中的患者以及另外的患者的ctl基因标签数据。在此处和随后的图6a、6b和图17a和17b中的纳米链分析中,每组数据均基于实验的每次单独运行中的一组管家基因进行标准化。使用纳米链算法对来自所有患者的数据集进行积分会基于来自组合数据集的标准化结果得出积分值,所述积分值可能不同于来自每个单独数据集的表观值。图4示出了用x4p-001给药之前和之后的#5患者的ihccd8染色结果。在给药之后,cd8表达明显增加。肿瘤微环境中的cd8+t细胞密度从每平方毫米1045增加到每平方毫米1370。图5示出了#5黑素瘤患者的mif结果的柱状图,其表明用x4p-001治疗增加了tme中cd4、cd8、pd-1和pdl-1阳性细胞的百分比。treg(foxp3+)细胞和巨噬细胞(cd68+/cd163+;24.1%对25.4%;未示出)的百分比未改变。图6a示出了在用x4p-001给药之前和之后的干扰素γ(ifn-γ)基因标签的基因表达评分。从ifn-γ、cxcl9、cxcl10、hla-dra、ido1和stat1标准化计数的几何平均值计算每个患者样本的基因评分。将平均值进行log10转换以生成基因表达评分。五个患者中的每一个患者的基因表达评分均升高。图6b示出了在用x4p-001给药之前和之后的另外的患者中的ifn-γ基因标签的基因表达评分。图7示出了通过halo获得的生物标志物cd8+、cd3+和foxp3的单标志物免疫组织化学(ihc)数据的信号定量。eot=治疗结束(三周x4p-001治疗+6周x4p-001与派姆单抗组合)。图8示出了为期九(9)周的x4p-001单一疗法以及与派姆单抗组合的给药方案。图9a示出了在x4p-001单一疗法之后在低放大率(图a)和高放大率(图b)下的活检样本的代表性cd8和foxp3染色。图9b示出了福尔马林固定石蜡包埋黑素瘤样本的图像。样本依次用6组分免疫表型抗体组(包含cd4、cd8、pd-1、pd-l1、巨噬细胞混合物(cd68+cd163)和foxp3)染色。dapi用作核复染剂。使用hrp催化的荧光酪酰胺底物(opal,珀金埃尔默(perkin-elmer))沉积检测抗体。使用光谱成像、自发荧光减除和解混(vectra3.0,珀金埃尔默)获得图像,并使用halotm图像分析软件进行分析。图10示出了黑素瘤患者2、3、5、8和9的mif结果的线图,其表明在x4p-001单一疗法之后,cd8细胞相对于treg细胞增加。图11示出了在来自患者5的整个活检的低倍扫描下(图1a)和在黑素瘤浸润前沿的解混高倍成像下(图1b)的代表性cd8、ki-67和黑素瘤细胞染色。图12示出了来自患者5的整个活检样本中的cd8+t细胞和增殖cd8+t细胞(ki-67+)密度的柱状图。左y轴是cd8+ki67+细胞(#细胞/mm2)。右y轴是cd+tc细胞(#细胞/mm2)。在图13、14和15中,图像表示来自最近相邻分析模块的图形输出,其中未标记细胞呈现为灰色。在x4p-001单一疗法之后,增殖cd8+t细胞围绕并浸润肿瘤病变。cd8+细胞和最近的肿瘤细胞之间的平均距离从基线时的95微米减少到x4p-001单一疗法之后的43微米,唯一相邻的数量增加,表明浸润增强。图13示出了第1天(治疗之前)的cd8+t细胞和其最近的黑素瘤相邻细胞之间的距离测量。图14示出了在用x4p-001单一疗法4周之后的cd8+t细胞和其最近的黑素瘤相邻细胞之间的距离测量。图15示出了治疗结束之后的cd8+t细胞和其最近的黑素瘤相邻细胞之间的距离测量。图16示出了用x4p-001给药之前和之后的抗原呈递/加工基因标签的基因表达评分。从b2m、cd74、ctsl、ctss、hla-dma、hla-dmb、hla-dob、hla-dpa1、hla-dpb1、hla-dqa1、hla-dqb1、hla-dra、hla-drb1、hla-drb3、psmb8、psmb9、tap1和tap2标准化计数的几何平均值计算每个患者样本的基因评分。将平均值进行log10转换以生成基因表达评分。五个患者中的每一个患者的基因表达评分均升高。图17a示出了用x4p-001给药之前和之后的肿瘤炎症基因标签的基因表达评分。从ccl5、cd27、cd274、cd276、cd8a、cmklr1、cxcl9、cxcr6、hla-dqa1、hla-drb1、hla-e、ido1、lag3、nkg7、pdcd1lg2、psmb10、stat1和tigit标准化计数的几何平均值计算每个患者样本的基因评分。将平均值进行log10转换以生成基因表达评分。五个患者中的每一个患者的基因表达评分均升高。图17b示出了用x4p-001给药之前和之后的图17a中的患者中的肿瘤炎症基因标签的基因表达评分,其中包含了另外的患者的数据。图18、图19和图20示出了在用对照、x4p-136、抗pd-l1、抗pd-l1+x4p-136、抗pd-1、抗pd-1+x4p-136、抗clta-4+抗pd-l1和抗ctla-4+抗pd-l1+x4p-136治疗十六(16)天的c57bl/6小鼠中的b16-ova肿瘤生长。图21示出了在治疗十六(16)天之后植入了b16-ova肿瘤的小鼠的代表性解剖。图22示出了柱状图,其描绘了在基线时和x4p-136注射后两(2)小时的外周白细胞的差异。图23示出了柱状图,其描绘了用标题下的疗法治疗之后的肿瘤微环境中的免疫细胞表型的变化。图24示出了蛋白质印迹,其描绘了所指示治疗对hif-2α表达和akt活性的作用。图25示出了蛋白质印迹,其描绘了所指示治疗对p21和p27诱导以及细胞周期素d1表达的作用。图26示出了柱状图,其描绘了x4p-136在常氧和低氧条件下对经由hif-2α反应元件的转录的剂量反应作用。图27示出了柱状图,其描绘了x4p-136在常氧和低氧条件下对体外肿瘤细胞浸润的剂量反应作用。图28和图29示出了多重ihc和halo图像数据,其表明x4p-001单一疗法增加了黑素瘤患者中肿瘤界面处的cd8+细胞密度。对具有正常组织的肿瘤边界内部或外部100μm之内的cd8标记细胞进行计数。相对于距边界的距离以25μm谱带绘制cd8+细胞数/mm2。在x4p-001单一疗法3周之后,边界区域内的cd8+细胞的总密度相较于基线增加四倍。图30示出了mif数据,其表明了单一疗法(x4p-001)之后的免疫细胞改变。在基线时(顶行)和x4p-001单一疗法结束时(底行)获得活检样本。左列示出了具有正常组织(外线)和肿瘤边界(内线)轮廓的活检样本。中间列示出了来自左列的放大框区域,用cd163、cd206、vista、cox-2、cd3、b7h3和dapi染色。右列含有中间图中的框选区域的更高放大率的视图。x4p-001导致肿瘤边界内的cd3+细胞数量增加以及vista(一种抑制t细胞活化和增殖的检查点分子)的表达降低。具体实施方式本发明的某些实施例的一般描述标识多组基因的肿瘤内表达模式、肿瘤微环境中的免疫相关细胞水平的变化或肿瘤微环境中的其它变化(在本文中通常被称为“生物标志物”,或在与基因表达模式相关时被更具体地称为“基因标签”、“基因表达生物标志物”或“分子标签”,这些都是癌症的特定类型或亚型的特性并与临床结果相关)大大有助于癌症的诊断、预后和治疗。此些生物标志物可能与临床结果相关。如果此关联可预测临床反应,则生物标志物可有利地用于将患者选择或分级为有更多(或更少,视情况而定)可能受益于治疗方案(例如,本文公开的那些)的方法。具有预测阳性治疗反应的生物标志物的肿瘤样本在本文中被称为“生物标志物阳性”或“生物标志物高值”。相反,具有未预测阳性反应的生物标志物模式的肿瘤样本在本文中被称为“生物标志物阴性”或“生物标志物低值”。可以取决于生物标志物来使用替代术语,但是通常可以使用替代术语(例如,“生物标志物阳性”或“生物标志物+”)来描述较高量或“生物标志物高值”,而通常可以使用替代术语(例如,“生物标志物阴性”或“生物标志物-”)来描述较低量的生物标志物或“生物标志物低值”。现在已经令人惊讶地发现,cd8+t细胞的水平(或cd8+t细胞/treg比);cd8+ki-67+t细胞;颗粒酶b;ifn-γ标签评分;ctl标签评分;抗原呈递/加工标签评分;肿瘤炎症标签评分;vista生物标志物组;和/或pd-l1表达可在本文描述的方法(例如,治疗或诊断癌症(例如,转移性黑素瘤)的方法)中用作生物标志物。因此,一方面,本发明提供了一种标识将受益于用cxcr4抑制剂治疗的癌性肿瘤患者的方法,所述方法包括:(a)在向所述患者施用所述cxcr4抑制剂之前获得第一肿瘤样本;(b)在所述第一肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞(或cd8+t细胞/treg比)、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;(c)向所述患者施用有效量的cxcr4抑制剂和任选的免疫治疗剂;(d)在向所述患者施用所述cxcr4抑制剂之后获得第二肿瘤样本;和(e)在所述第二种肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞(或cd8+t细胞/treg比)、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达。另一方面,本发明提供了一种标识可能受益于或相对于其它相似患者有更高概率受益于用cxcr4抑制剂(任选地与免疫治疗剂组合)治疗的癌症患者的方法,所述方法包括:(a)在向所述患者施用所述cxcr4抑制剂之前获得第一肿瘤样本;(b)在所述第一肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞(或cd8+t细胞/treg比)、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;(c)向所述患者施用有效量的cxcr4抑制剂和任选的免疫治疗剂;(d)在向所述患者施用所述cxcr4抑制剂之后获得第二肿瘤样本;和(e)在所述第二种肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞(或cd8+t细胞/treg比)、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;其中所述癌症对步骤(c)的反应基于所述癌症的反应相较于一或多个相似患者更大或更小来预测成功治疗所述癌症的可能性,并且使用一或多种所述生物标志物进行评估。在一些实施例中,体外或离体测定所述第一肿瘤样本和/或第二肿瘤样本。另一方面,本发明提供了一种体外或离体测定从患者取出的肿瘤样本以确定所述患者中的肿瘤是否会对用cxcr4抑制剂(任选地与免疫治疗剂组合)治疗有反应或有更高概率对其有反应,所述方法包括:(a)在向所述患者施用所述cxcr4抑制剂之前获得第一肿瘤样本;(b)在所述第一肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞(或cd8+t细胞/treg比)、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;和任选地,(c)如果所述患者中的所述肿瘤会对用cxcr4抑制剂(任选地与免疫治疗剂组合)治疗有反应或有更高概率对其有反应,则向所述患者施用有效量的cxcr4抑制剂和任选的免疫治疗剂。另一方面,本发明提供了一种治疗对免疫治疗剂单一疗法无反应或其癌症最初对免疫治疗剂单一疗法有反应但之后已变得难以治疗的患者中的癌症(例如,肿瘤)的方法,所述方法包括:(a)在向所述患者施用所述cxcr4抑制剂之前获得第一肿瘤样本;(b)在所述第一肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;(c)向所述患者施用有效量的cxcr4抑制剂和任选的免疫治疗剂;(d)在向所述患者施用所述cxcr4抑制剂之后获得第二肿瘤样本;和(e)在所述第二种肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;其中所述肿瘤对步骤(c)的反应基于所述肿瘤的反应相较于一或多个相似患者更大或更小来预测成功治疗所述肿瘤的可能性,并且使用一或多种所述生物标志物进行评估。在一些实施例中,本发明提供了一种预测癌症(例如,肿瘤)在用cxcr4抑制剂治疗之后是否会对用免疫治疗剂治疗有反应的方法,所述方法包括:(a)在向所述患者施用所述cxcr4抑制剂之前获得第一肿瘤样本;(b)在所述第一肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;(c)向所述患者施用有效量的cxcr4抑制剂和任选的免疫治疗剂;(d)在向所述患者施用所述cxcr4抑制剂之后获得第二肿瘤样本;和(e)在所述第二种肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;其中所述肿瘤对步骤(c)的反应基于所述肿瘤的反应相较于一或多个相似患者更大或更小来预测成功治疗所述肿瘤的可能性,并且使用一或多种所述生物标志物进行评估。在一些实施例中,用cxcr4抑制剂治疗引发了所述肿瘤微环境,使得所述肿瘤变得更有可能对免疫治疗剂有反应。在一些实施例中,所述肿瘤对pd-1抑制剂单一疗法无反应,但当与cxcr4抑制剂组合时被引发并对所述pd-1抑制剂有反应。在一些实施例中,所述肿瘤最初对所述pd-1抑制剂或另一检查点抑制剂有反应,但变得难以治疗。在一些实施例中,在用cxcr4抑制剂治疗之后,可以用所述pd-1抑制剂或其它免疫治疗剂有效地治疗所述肿瘤。在一些实施例中,所述cxcr4抑制剂与免疫治疗剂组合施用。在一些实施例中,所述cxcr4抑制剂是x4p-001或x4-136或其药学上可接受的盐。在一些实施例中,所述cxcr4抑制剂是x4p-001或其药学上可接受的盐。在一些实施例中,所述cxcr4抑制剂是x4-136或其药学上可接受的盐。x4p-001具有以下所描绘的结构:x4p-001及其合成在美国专利第7,354,934号中详细描述,其由此通过引用并入。x4-136具有以下所描绘的结构:x4-136及其合成在美国专利第7,550,484号中详细描述。在一些实施例中,所述免疫治疗剂是检查点抑制剂。在一些实施例中,所述检查点抑制剂是pd-1拮抗剂。在一些实施例中,所述pd-1拮抗剂选自纳武单抗(nivolumab)、派姆单抗、派姆单抗生物仿制药或派姆单抗变体。在一些实施例中,所述检查点抑制剂是派姆单抗。在一些实施例中,所述癌性肿瘤是实体瘤。在一些实施例中,所述实体瘤是黑素瘤。在一些实施例中,所述黑素瘤是恶性黑素瘤、晚期黑素瘤、转移性黑素瘤、或i、ii、iii或iv期黑素瘤。在一些实施例中,所述黑素瘤是可切除的。在一些实施例中,所述黑素瘤是不可切除的。在一些实施例中,所述黑素瘤是不可切除的晚期或不可切除的转移性黑素瘤。在一些实施例中,所述患者先前未进行过免疫检查点抑制剂(例如,抗ctla-4、pd-1或pd-l1)治疗,或先前未进行过溶瘤病毒疗法。在一些实施例中,以上方法可用于标识将受益于用cxcr4抑制剂(任选地与免疫治疗剂组合)治疗的患者。此类患者的特征在于,相较于所述第一肿瘤样本,所述第二肿瘤样本中的选自以下中的一或多种生物标志物的水平更高:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达。在一些实施例中,当相较于所述第一肿瘤样本,所述第二肿瘤样本中的选自以下中的一或多种生物标志物的水平更高:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达时,则向所述患者施用另外一或多个剂量的所述cxcr4抑制剂。这是因为此类患者被视为可能受益于用所述cxcr4抑制剂和任选的所述免疫治疗剂持续治疗。在一些实施例中,体外或离体测定所述第一肿瘤样本和/或第二肿瘤样本。另一方面,本发明提供了一种用cxcr4抑制剂治疗癌症的方法,所述方法包括(a)在向所述患者施用所述cxcr4抑制剂之前获得第一肿瘤样本;(b)在所述第一肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;(c)向所述患者施用有效量的cxcr4抑制剂和任选的免疫治疗剂;(d)在向所述患者施用所述cxcr4抑制剂之后获得第二肿瘤样本;和(e)在所述第二种肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;其中:当相较于所述第一肿瘤样本,所述第二肿瘤样本中的选自以下中的一或多种生物标志物的水平更高:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达时,则向所述患者施用另外一或多个剂量的所述cxcr4抑制剂和任选的所述免疫治疗剂。另一方面,本发明提供了一种评估患者对cxcr4抑制剂(任选地与免疫治疗剂组合)的反应的方法,所述方法包括以下步骤:(a)在向所述患者施用所述cxcr4抑制剂之前获得第一肿瘤样本;(b)在所述第一肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;(c)向所述患者施用有效量的cxcr4抑制剂和任选的免疫治疗剂;(d)在向所述患者施用所述cxcr4抑制剂之后获得第二肿瘤样本;和(e)在所述第二种肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;其中对所述肿瘤对步骤(c)的反应进行评估,以基于所述肿瘤的反应相较于一或多个相似患者更大或更小来将所述患者划分、分类或分级到两个或两个以上群组中的一个中。另一方面,本发明提供了一种预测患者对cxcr4抑制剂(任选地与免疫抑制剂组合)的反应的方法,所述方法包括以下步骤:(a)在向所述患者施用所述cxcr4抑制剂之前获得第一肿瘤样本;(b)在所述第一肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;(c)向所述患者施用有效量的cxcr4抑制剂和任选的免疫治疗剂;(d)在向所述患者施用所述cxcr4抑制剂之后获得第二肿瘤样本;和(e)在所述第二种肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;其中所述肿瘤对步骤(c)的反应基于所述肿瘤的反应相较于一或多个相似患者更大或更小来预测成功治疗所述肿瘤的可能性,并且使用一或多种所述生物标志物进行评估。另一方面,本发明提供了一种预测患者中的癌症对cxcr4抑制剂(任选地与免疫抑制剂组合)的治疗反应的方法,所述方法包括以下步骤:(a)在向所述患者施用所述cxcr4抑制剂之前获得肿瘤样本;(b)在所述肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;(c)治疗所述肿瘤样本或参考样本;(e)在所述治疗肿瘤或参考样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;(f)将所述治疗前肿瘤样本中的一或多种生物标志物与所述治疗血清样本或治疗参考样本中的一或多种生物标志物进行比较;和(g)任选地,如果预计施用相对于治疗所述癌症的替代方法具有相同或更高的成功可能性,则向所述患者施用所述cxcr4抑制剂(任选地与免疫治疗剂组合);其中响应于步骤(c)的所述生物标志物变化基于生物标志物变化相较于一或多个相似患者更大或更小来预测成功治疗所述癌症的可能性,并且使用一或多种所述生物标志物进行评估。在一些实施例中,所述参考样本来自另一患者,例如患有相似癌症的患者;或者所述参考样本可以是类似癌症的培养物或其它体外样本。在一些实施例中,体外或离体测定所述第一肿瘤样本和/或第二肿瘤样本。另一方面,本发明提供了一种监测患者对cxcr4抑制剂(任选地与免疫治疗剂组合)的反应的方法,所述方法包括以下步骤:(a)在向所述患者施用所述cxcr4抑制剂之前获得第一肿瘤样本;(b)在所述第一肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;(c)向所述患者施用有效量的cxcr4抑制剂和任选的免疫治疗剂;(d)在向所述患者施用所述cxcr4抑制剂之后获得一或多个后续肿瘤样本;和(e)在所述一或多个后续肿瘤样本中测量选自以下中的一或多种生物标志物的水平:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;其中可以比较所述第一肿瘤样本和后续肿瘤样本中的一或多种生物标志物的水平,并且一或多种所述生物标志物的变化指示了患者反应。在一些实施例中,所述患者对cxcr4抑制剂(任选地与免疫治疗剂组合)的反应每周或每两周测量一次。在一些实施例中,所述患者反应每月测量一次。在一些实施例中,所述患者的反应每两个月测量一次。在一些实施例中,患者的反应每季度测量一次(每三个月一次)。在一些实施例中,患者的反应是每年测量一次。在一些实施例中,在进行治疗的同时对所述患者对cxcr4抑制剂(任选地与免疫治疗剂组合)的反应进行监测。在一些实施例中,在治疗结束之后监测所述患者反应。另一方面,本发明提供了一种获得预测用cxcr4抑制剂(任选地与肿瘤pd-1拮抗剂组合)治疗的抗肿瘤反应的生物标志物标签的方法,所述方法包括:(a)从诊断具有所述肿瘤类型的患者组中的每个患者获得治疗前肿瘤样本;(b)针对所述组中的每个患者,获得用cxcr4抑制剂(任选地与pd-1拮抗剂组合)治疗之后的抗肿瘤反应值;(c)在生物标志物平台中针对每个基因测量每个肿瘤样本中的原始生物标志物水平,其中所述生物标志物平台包括cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达的临床反应生物标志物集;(d)针对每个肿瘤样本,使用一组标准化生物标志物的所述测量生物标志物水平对所述临床反应生物标志物的每个所述测量原始生物标志物水平进行标准化;和(e)将所有所述肿瘤样本的所述生物标志物水平和所述组中的所有所述患者的所述抗肿瘤反应值进行比较,以选择将所述患者组划分为满足目标生物标志物临床效用标准的所述生物标志物标签评分的分界值。在一些实施例中,所述生物标志物平台包括基因表达平台,所述基因表达平台包括临床反应基因集。在一些实施例中,所述方法进一步包括以下步骤:(f)针对每个肿瘤样本和每个生物标志物(例如,目标基因标签中的基因),使用所述基因的预定倍增系数对所述标准化生物标志物(例如,rna生物标志物)表达水平进行加权;(g)针对每个患者,对所述加权生物标志物(例如,rna生物标志物)表达水平进行相加,以针对所述组中的每个患者生成生物标志物标签评分(例如,基因标签评分)。另一方面,本发明提供了一种测试从患者取出的肿瘤样本是否存在所述肿瘤对cxcr4抑制剂(任选地与pd-1拮抗剂组合)的抗肿瘤反应的基因标签生物标志物的方法,所述方法包括:(a)在基因表达平台中针对每个基因测量所述肿瘤样本中的原始rna水平,其中所述基因表达平台包括选自以下的临床反应基因集:ifn-γ标签、ctl标签、抗原呈递/加工标签、肿瘤炎症标签、cd8a、cd8b、颗粒酶b基因表达或pd-l1表达,和管家基因的标准化基因集;并且任选地,其中约80%或约90%所述临床反应基因表现出与所述抗肿瘤反应呈正相关的肿瘤内rna水平;(b)使用所述标准化基因的所述测量rna水平对所述肿瘤样本的预定基因标签中的每个临床反应基因的所述测量原始rna水平进行标准化,其中所述预定基因标签由至少2个所述临床反应基因组成,从而获得基因标签评分;(c)将所述基因标签评分与所述基因标签和肿瘤的参考评分进行比较;和(d)将所述肿瘤样本分类为生物标志物高值或生物标志物低值;其中如果所生成的评分等于或大于所述参考评分,则将所述肿瘤样本分类为生物标志物高值;并且如果所生成的评分小于所述参考评分,则将所述肿瘤样本分类为生物标志物低值。在一些实施例中,在步骤(b)之后,所述方法包括以下另外步骤:(i)使用预定倍增系数对每个标准化rna值进行加权;(ii)对所述加权rna表达水平进行相加,以生成加权基因标签评分。在一些实施例中,所述标准化基因集包括约10到约12个管家基因,或约30-40个管家基因。另一方面,本发明提供了一种测试从患者取出的肿瘤样本是否存在所述肿瘤对cxcr4抑制剂(任选地与pd-1拮抗剂组合)的抗肿瘤反应的生物标志物标签的方法,所述方法包括:(a)在生物标志物平台中针对每个生物标志物测量所述肿瘤样本中的原始生物标志物水平,其中所述生物标志物平台包括选自以下的临床反应生物标志物集:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达,和标准化生物标志物集;并且任选地,其中约80%或约90%所述临床反应生物标志物表现出与所述抗肿瘤反应呈正相关的肿瘤内生物标志物水平;(b)使用所述标准化生物标志物的所述测量生物标志物水平对所述肿瘤样本的预定生物标志物标签中的每个临床反应生物标志物的所述测量原始生物标志物水平进行标准化,其中所述预定生物标志物标签由至少2个所述临床反应生物标志物组成;(c)将所述标准化生物标志物水平和所述肿瘤的一组参考生物标志物水平进行比较;和(d)将所述肿瘤样本分类为生物标志物高值或生物标志物低值;其中如果所述标准化生物标志物水平等于或大于所述参考生物标志物水平,则将所述肿瘤样本分类为生物标志物高值;并且如果所述标准化生物标志物水平小于所述参考生物标志物水平,则将所述肿瘤样本分类为生物标志物低值。在一些实施例中,所述标准化生物标志物集包括约10到约12个管家基因,或约30-40个管家基因。在一些实施例中,通过cd8a和/或cd8b表达来测量cd8+t细胞的水平。在一些实施例中,通过确定foxp3相较于cd8a和/或cd8b的表达水平来测量cd8+t细胞/treg比。另一方面,本发明提供了一种用于测试从患者取出的肿瘤样本是否存在所述肿瘤对cxcr4抑制剂(任选地与pd-1拮抗剂组合)的抗肿瘤反应的生物标志物标签的系统,所述系统包括:(i)样本分析仪,其用于在生物标志物平台中测量原始生物标志物水平,其中所述生物标志物平台由选自以下的一组临床反应生物标志物:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;和一组标准化生物标志物组成;和(ii)计算机程序,其用于接收和分析所述测量生物标志物水平,以:(a)使用所述标准化生物标志物的所述测量水平对所述肿瘤的预定生物标志物标签中的每个临床反应生物标志物的所述测量原始生物标志物水平进行标准化;(b)将所生成的生物标志物水平与所述生物标志物标签和肿瘤的参考水平进行比较;和(c)将所述肿瘤样本分类为生物标志物高值或生物标志物低值,其中如果所生成的评分等于或大于所述参考评分,则将所述肿瘤样本分类为生物标志物高值;并且如果所生成的评分小于所述参考评分,则将所述肿瘤样本分类为生物标志物低值。另一方面,本发明提供了一种用于测试从患者取出的肿瘤样本是否存在所述肿瘤对cxcr4抑制剂(任选地与pd-1拮抗剂组合)的抗肿瘤反应的生物标志物标签的系统,所述系统包括:(i)样本分析仪,其用于在生物标志物平台中测量原始生物标志物水平,其中所述生物标志物平台由选自以下的一组临床反应生物标志物:cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达;和一组标准化生物标志物组成;和(ii)计算机程序,其用于接收和分析所述测量生物标志物水平,以:(a)使用所述标准化生物标志物的所述测量水平对所述肿瘤的预定生物标志物标签中的每个临床反应生物标志物的所述测量原始生物标志物水平进行标准化;(b)使用预定倍增系数对每个标准化生物标志物水平进行加权;(c)对所述加权生物标志物水平进行相加,以生成生物标志物标签评分;(d)将所生成的评分与所述生物标志物标签和肿瘤的参考评分进行比较;和(e)将所述肿瘤样本分类为生物标志物高值或生物标志物低值,其中如果所生成的评分等于或大于所述参考评分,则将所述肿瘤样本分类为生物标志物高值;并且如果所生成的评分小于所述参考评分,则将所述肿瘤样本分类为生物标志物低值。在一些实施例中,所述生物标志物包括本文所述基因(例如,cd8a、cd8b、foxp3、颗粒酶b、ifn-γ标签基因、ctl标签基因、抗原呈递/加工标签基因、肿瘤炎症标签基因或pd-l1表达)的rna表达水平。在一些实施例中,所述生物标志物进一步包括cd3和/或ki67或cd4、cxcr4、cxcl12、精氨酸酶、fapα、cd33或cd11b的水平。在一些实施例中,所述生物标志物包括cd8+t细胞的水平或cd8+t细胞/treg比或颗粒酶b水平。在一些实施例中,此些水平通过免疫组织化学染色来测量。另一方面,本发明提供了一种用于测定从用cxcr4抑制剂(任选地与pd-1拮抗剂组合)治疗的患者取出的肿瘤样本以获得与所述肿瘤相关的基因标签的标准化rna表达评分的试剂盒,其中所述试剂盒包括:(a)一组杂交探针,其能够特异性结合到由每个所述基因表达的转录物;和(b)一组试剂,其被设计成量化与每种杂交探针形成的特异性杂交复合物的数量。在一些实施例中,所述基因标签选自以下中的两种或两种以上:cd8a、cd8b、foxp3、颗粒酶b、ifn-γ标签、ctl标签、抗原呈递/加工标签、肿瘤炎症标签或pd-l1表达。另一方面,本发明提供了一种用于治疗具有肿瘤的患者的方法,所述方法包括确定所述肿瘤样本针对生物标志物(例如,基因标签生物标志物)呈阳性还是阴性,并且如果所述肿瘤针对所述生物标志物呈阳性,则向所述患者施用cxcr4抑制剂(任选地与pd-1拮抗剂组合);并且如果所述肿瘤针对所述生物标志物呈阴性,则向所述受试者施用不包含cxcr4抑制剂或pd-1拮抗剂的癌症治疗,其中所述生物标志物(例如,基因标签生物标志物)是包括选自以下的所述临床反应生物标志物中的至少两种的生物标志物(例如,基因标签生物标志物):cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达。在一些实施例中,可以将多基因标签评分(例如,ifn-γ、ctl、抗原呈递/加工或肿瘤炎症标签评分)在与其它单个基因生物标志物相同的分组中用作一种“生物标志物”,以计算更具预测性的基因标签评分。另一方面,本发明提供了一种测试从患者取出的肿瘤样本以生成与对cxcr4抑制剂(任选地与pd-1拮抗剂组合)的抗肿瘤反应相关的基因标签的标签评分的方法,其中所述方法包括:(a)针对所述基因标签中的每个基因和标准化基因集中的每个基因,测量所述肿瘤样本中的原始rna水平,其中所述基因标签包括cd8a、cd8b、foxp3、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1;(b)使用所述标准化基因的所述测量rna水平对所述基因标签中每个基因的所述测量原始rna水平进行标准化;(c)将每个标准化rna值乘以所计算的评分权重集,以生成加权rna表达值;和(d)将所述加权rna表达值相加,以生成所述基因标签评分。在一些实施例中,可以将多基因标签评分(例如,ifn-γ或ctl标签评分)在与其它单个基因生物标志物相同的分组中用作一种“生物标志物”,以计算更具预测性的基因标签评分。在一些实施例中,测量步骤包括从所述组织样本分离rna,并与被设计成特异性杂交到所述rna的基因靶区域的一组探针一起温育所述组织样本。cxcr4抑制剂和免疫治疗剂在治疗癌症中的用途如下详细所述,已经令人惊讶地发现,用cxcr4抑制剂(例如,x4p-001或x4-136,任选地与免疫治疗剂(例如,派姆单抗)组合)治疗患者中的癌症(例如,转移性黑素瘤)产生了与患者中的抗肿瘤反应相关的临床反应基因集。癌症免疫疗法和靶向疗法(例如,用伊匹单抗或pd-1拮抗剂或抗体)可以针对具有广泛组织学的转移性癌症产生持久的反应。然而,需要改善对一些肿瘤如何避免免疫反应的理解,以便扩展其适用性。由于免疫系统和癌细胞之间的相互作用是连续的和动态的,这意味着它们从最初的癌症建立到转移的发展随时间而进化,这使得肿瘤能够避免免疫系统,因此难以研究这种机制。现在理解,单独使用免疫疗法可能会由于原发性、适应性和获得性抗性机制(“免疫逃逸”)而被阻碍或使其无效。参见例如夏尔马,p(sharma,p)等人,细胞(cell),2017,168,707-723[30]。最近的研究证实,cxcr4/cxcl12是主要的受体-配体对,癌细胞和周围的基质细胞可以用其来阻断正常的免疫功能并通过在肿瘤微环境中移动t效应细胞和t调节细胞以及髓源性抑制细胞(mdsc)来促进血管生成。癌细胞cxcr4过表达导致了肿瘤生长、浸润、血管生成、转移、复发和治疗抗性。因此,cxcr4拮抗作用代表了一种破坏肿瘤-基质相互作用、使癌细胞对细胞毒性药物敏感和/或减少肿瘤生长和转移负担的手段。cxcr4(c-x-c趋化因子受体4型)是在多种细胞类型(包含正常干细胞、造血干细胞(hsc)、成熟淋巴细胞和纤维母细胞[1])上表达的趋化因子受体。cxcl12(先前被称为sdf-1α)是cxcr4的唯一配体。cxcl12/cxcr4轴的主要生理功能包含胚胎发育期间(cxcr4-/-敲除胚胎在子宫内死亡)以及随后对损伤和炎症的反应中的干细胞的迁移。越来越多的证据表明cxcr4/cxcl12在恶性肿瘤中具有多种潜在作用。在若干肿瘤类型中已经观察到一或两种因子的直接表达。cxcl12由癌症相关纤维母细胞(caf)表达,并且经常以高水平存在于tme中。在多种肿瘤类型(包含乳腺癌、卵巢癌、肾癌、肺癌和黑素瘤)的临床研究中,cxcr4/cxcl12的表达与预后不良以及转移到淋巴结、肺、肝和大脑(它们是cxcl12表达的位点[2])的风险增加相关。cxcr4经常在黑素瘤细胞上表达,特别是表达于被认为代表黑素瘤干细胞的cd133+群上[2,3],并且体外实验和小鼠模型已经证实,cxcl12对这些细胞具有趋化性[4]。派姆单抗是一种人源化igg4κ单克隆抗体,其阻断pd-1和其配体pd-l1和pd-l2之间的相互作用[11]。它属于新兴类别的免疫治疗剂,被称为检查点调节剂(cpm)。这些试剂已经基于以下观察结果进行了研发:在多种类型的恶性肿瘤中,肿瘤通过利用通常用作“检查点”的反调节机制来抑制宿主抗肿瘤免疫反应,以防止免疫系统在感染和其它情况中的过度活化。在黑素瘤的情况下,pd-l1由tme中的细胞表达,与pd-1(cd8+效应t细胞上的膜相关受体)结合,并触发抑制性信号传导,从而降低细胞毒性t细胞的杀伤能力。派姆单抗目前已被fda批准用于治疗不可切除的或转移性黑素瘤。在3期试验中,客观反应率为33%,而伊匹单抗为12%(p<0.001)[11]。在较早的研究中,在治疗之前和治疗期间对肿瘤样本的分析表明,临床反应与肿瘤实质(中心)中的cd8+t细胞密度的增加相关,而疾病进展与这些细胞的持续低水平相关[12]。在胰腺腺癌的自发性(autochthonous)小鼠模型中,持续的肿瘤生长(尽管投与抗pd-l1)与肿瘤特异性细胞毒性t细胞进入tme失败(尽管它们存在于外周循环中)类似相关[7]。这种免疫抑制的表型与caf产生cxcl12相关。此外,投与cxcr4拮抗剂(amd3100)诱导了癌细胞之中的快速t细胞蓄积,并且在与抗pd-l1组合时协同地减少肿瘤生长。多个观察结果暗示,cxcl12/cxcr4轴导致了肿瘤对血管生成抑制剂的反应性的缺乏(或缺失)(也被称为“血管生成逃逸”)。在动物癌症模型中,已经证实,干扰cxcr4功能会通过多种机制(包含消除肿瘤血管再生[19,20]和增加cd8+t细胞与treg细胞之比[19,21,22])破坏肿瘤微环境(tme)并使肿瘤暴露于免疫攻击。这些作用导致异种移植同基因以及转基因癌症模型中的肿瘤负担显著降低和总生存期增加[19,21,20]。x4p-001(以前被称为amd11070)是一种强效的、口服生物可利用的cxcr4拮抗剂[23],其活性已经在实体和液体肿瘤模型中证实[24,以及未发表的数据],并且先前(名称为amd070和amd11070)已经用于1期和2a期试验,共涉及71个健康志愿者[23,25,26]和hiv感染受试者[27,28]。这些研究证实,口服施用高达400mgbid持续3.5天(健康志愿者)和200mgbid持续8-10天(健康志愿者和hiv患者)的耐受性良好,并且没有不良事件或临床显著实验室变化的模式。这些研究还证实了药代动力学活性及循环白细胞(wbc)的剂量和浓度相关变化;以及高分布量(vl),这表明组织渗透率高。x4-136(以前被称为amd12118)也是一种强效的、口服生物可利用的cxcr4拮抗剂。普乐沙福(plerixafor)(以前被称为amd3100,现在以出售)是目前获fda批准的唯一cxcr4拮抗剂。普乐沙福通过皮下注射施用,并被批准与粒细胞集落刺激因子(g-csf)组合使用,以将造血干细胞(hsc)动员到外周血,以用于非霍奇金淋巴瘤(nhl)和多发性骨髓瘤(mm)患者中的收集和随后的自体移植。x4p-001和普乐沙福均已在黑素瘤、肾细胞癌和卵巢癌的小鼠模型中进行了研究,并且证实了显著的抗肿瘤活性,包含转移减少和总生存期增加[6]。治疗作用已经与tme中的髓源性抑制细胞(mdsc)的存在减少和肿瘤特异性cd8+效应细胞的存在增加相关[7,8]。在一些实施例中,cxcr4抑制剂选自普乐沙福;usl-311(美国专利第9,353,086号),优库路单抗(ulocuplumab)(bms-936564;卡什亚普,m.k.(kashyap,m.k.)等人,癌症靶标(oncotarget),7:2809-22(2016))、bl-8040(bkt-140;穆赫塔,e.(mukhta,e.)等人,分子癌症治疗学(mol.cancer.ther.),13(2):275-84(2014))、t-140(雅各布森,o.(jacobson,o.)等人,核医学(nuclearmed.),51(11):1796-1804(2010),玉村,h.(tamamura,h.)等人,欧洲生物化学学会联合会(febs),569:99-104(2004))、ly2510924(高尔斯基,m.d.(galsky,m.d.)等人,临床癌症研究(clin.cancerres.),20(13):3581-88(2014))、tg-0054(布利沙福(burixafor);nct00822341)、pol6326(巴沙福肽(balixafortide);nct01905475)、prx177561(格拉维纳,g.l.(gravina,g.l.)等人,肿瘤生物学(tumorbiol),39(6):1-17(2017))、pf-06747143(张,y.(zhang,y.)等人,科学报告(sci.rep.),7:7305(2017))、化合物3等(李,z.(li,z.)等人,欧洲药物化学杂志(eur.j.med.chem.),149:30-44(2017))、gmi-1359(wo2016/089872)、化合物iq、iij等(白,r.(bai,r.)等人,欧洲药物化学杂志(eur.j.med.chem.),136:360-71(2017))、化合物49b等(赵,h.(zhao,h.)等人,生物有机化学与医药化学通讯(bio.med.chemlett.),25(21):4950-55(2015))和f-50067(515h7;第22届eortc-nci-aacr分子靶标与癌症治疗学研讨会(22ndeortc-nci-aacrsympmoleculartargcancerther)(柏林),2010,摘要225和241)。不希望受任何特定理论的束缚,据信施用x4p-001或x4-136将增加黑素瘤肿瘤细胞之中的cd8+t细胞的密度,并且当x4p-001或x4-136与另外的癌症疗法(例如,免疫检查点调节剂,例如派姆单抗)组合给予时,这种作用将得以维持。由于x4p-001和x4-136在体内具有良好的耐受性,并且可以增加机体建立稳健的抗肿瘤免疫反应的能力,因此,将x4p-001或x4-136与另外的癌症疗法(例如,检查点调节剂)在多种肿瘤类型中组合施用可以大大提高客观反应率、持久长期反应的频率并增加总生存期。进一步据信,由于预期不会以cxcr4靶向药物诱导骨髓和其它正常增殖细胞群中的细胞周期停滞,因此可以以相对较小的毒性获得这种结果。因此,本发明利用cxcr4抑制剂x4p-001和x4-136在某些癌症中的低毒性以及对mdsc移动、分化和肿瘤细胞基因表达的作用在治疗结果中提供了显著优势。例如通过x4p-001或x4-136进行的cxcr4拮抗作用可以用于通过多种机制用于治疗晚期黑素瘤和其它癌症的患者。参见wo2017/127811,其由此通过引用并入。在某些实施例中,x4p-001或x4-136的施用增加了cd8+t细胞的密度,从而导致抗肿瘤免疫攻击增加,例如经由肿瘤(例如,黑素瘤肿瘤)的t细胞浸润。在某些实施例中,x4p-001或x4-136的施用另外减少了新血管生成和肿瘤血管供应;并且干扰cxcr4及其唯一配体cxcl12的肿瘤表达增加的自分泌作用,从而潜在地减少了癌细胞转移。在一些实施例中,晚期癌症形式(包含黑素瘤(例如,转移性黑素瘤)或肺癌(例如,转移性非小细胞肺癌))患者用x4p-001或x4-136作为单一试剂(单一疗法)或与免疫检查点抑制剂(例如,派姆单抗)组合进行治疗。派姆单抗是pd-1的抗体,其结合到程序性细胞死亡1受体(pd-1),从而阻止受体结合到抑制性配体pd-l1;并压制了肿瘤抑制宿主抗肿瘤免疫反应的能力,被称为免疫检查点抑制剂。不希望受任何特定理论的束缚,据信通过将两种药物组合,可以通过增加机体建立稳健的抗肿瘤免疫反应的能力来进一步改善患者的治疗作用。一方面,本发明提供了一种选择或预测此类患者的一般人群中的哪些黑素瘤患者将可能(例如,比平均可能性高)受益于用x4p-001或x4-136或其药学上可接受的盐或其药物组合物(任选地与检查点抑制剂(例如,派姆单抗)组合)治疗的方法。在一些实施例中,所述方法包含同时或依次共同施用有效量的一或多种另外的治疗剂,例如本文所述的那些。在一些实施例中,所述方法包含共同施用一种另外的治疗剂。在一些实施例中,所述方法包含共同施用两种另外的治疗剂。在一些实施例中,x4p-001或x4-136和另外的一或多种治疗剂的组合协同作用以预防或减少癌症的免疫逃逸和/或血管生成逃逸。在一些实施例中,患者先前已施用另一种抗癌剂,例如辅助疗法或免疫疗法。在一些实施例中,癌症是难治性的。在一些实施例中,另外的治疗剂是派姆单抗。新辅助化学疗法和免疫疗法的益处已在几种可手术的癌症中得到证实。与辅助治疗相比,局部和区域晚期癌症患者中的新辅助疗法具有多个潜在益处,例如(1)减小原发性和转移性肿瘤的大小增加了实现切缘阴性的可能性;(2)在血液和淋巴管完好无损的同时,增加了肿瘤对潜在有效全身性疗法的暴露;和(3)在新辅助疗法之后收集肿瘤组织的术前和术中样本提供了对疗法对肿瘤细胞、肿瘤微环境(tme)和免疫系统的作用的实时体内评定。在一些实施例中,在禁食状态下向患者施用x4p-001或x4-136或其药学上可接受的盐。在一些实施例中,本发明提供了一种用于治疗患有以实体瘤(例如,黑素瘤)形式存在的癌症的患者的方法。在某些实施例中,患者患有可切除的黑素瘤,这意味着认为患者的黑素瘤易于通过手术切除。在其它实施例中,患者患有不可切除的黑素瘤,这意味着已经认为它不易通过手术切除。在一些实施例中,本发明提供了一种用于治疗有需要的患者中的晚期癌症(例如,黑素瘤或转移性黑素瘤)的方法,所述方法包括施用x4p-001、x4-136或其药学上可接受的盐和/或组合物。在某些实施例中,患者先前施用免疫检查点抑制剂。在一些实施例中,患者先前施用免疫检查点抑制剂,所述免疫检查点抑制剂选自由以下组成的群组:派姆单抗(默克(merck))、伊匹单抗(百时美施贵宝(bristol-myerssquibb));纳武单抗(百时美施贵宝)和阿特珠单抗(atezolizumab)(基因泰克)。在一些实施例中,癌症在用免疫检查点抑制剂治疗之后变得难以治疗。在一些实施例中,即使患者先前未施用检查点抑制剂,癌症也对于免疫检查点抑制剂是难以治疗的或耐药的。在某些实施例中,x4p-001或x4-136与免疫检查点抑制剂(例如,本文所述的那些)共同施用。在一些实施例中,免疫检查点抑制剂选自pd-1拮抗剂、pd-l1拮抗剂和ctla-4拮抗剂。在一些实施例中,将x4p-001或x4-136与免疫治疗药物组合施用,所述免疫治疗药物选自伊匹单抗(百时美施贵宝);阿特珠单抗(基因泰克);纳武单抗(百时美施贵宝);皮地利珠单抗(pidilizumab);阿维鲁单抗(avelumab)(辉瑞(pfizer)/默克集团(merckkga));得瓦鲁单抗(durvalumab)(阿斯利康(astrazeneca));pdr001;regn2810;或派姆单抗(默克;先前被称为mk-3475)。在一些实施例中,x4p-001或x4-136与派姆单抗组合施用。开发中的其它免疫检查点抑制剂可能也适合与x4p-001或x4-136组合使用。这些包含阿特珠单抗(基因泰克/罗氏(roche)),也被称为mpdl3280a,其是一种针对pd-l1的igg1同种型的完全人源化工程化抗体,用于非小细胞肺癌和晚期膀胱癌(例如,晚期尿路上皮癌)的临床试验中;并且用作辅助疗法以防止癌症在手术后复发;得瓦鲁单抗(阿斯利康),也被称为medi4736,用于转移性乳腺癌、多发性骨髓瘤、食道癌、骨髓增生异常综合征、小细胞肺癌、头颈癌、肾癌、胶质母细胞瘤、淋巴瘤和实体恶性肿瘤的临床试验中;皮地利珠单抗(治愈科技(curetech)),也被称为ct-011,其是一种结合到pd-1的抗体,用于弥漫性大b细胞淋巴瘤和多发性骨髓瘤的临床试验中;阿维鲁单抗(辉瑞/默克集团),也被称为msb0010718c,其是一种完全人源化igg1抗pd-l1抗体,用于非小细胞肺癌、默克尔细胞癌、间皮瘤、实体瘤、肾癌、卵巢癌、膀胱癌、头颈癌和胃癌的临床试验中;pdr001(诺华(novartis)),其是一种结合到pd-1的抑制性抗体,用于非小细胞肺癌、黑素瘤、三阴性乳腺癌和晚期或转移性实体瘤的临床试验中。适合用于本发明的其它免疫检查点抑制剂包含regn2810(再生元(regeneron)),其是一种在基础细胞癌(nct03132636);nsclc(nct03088540);皮肤鳞状细胞癌(nct02760498);淋巴瘤(nct02651662);和黑素瘤(nct03002376)患者中测试的抗pd-1抗体;皮地利珠单抗(治愈科技),也被称为ct-011,其是一种结合到pd-1的抗体,用于弥漫性大b细胞淋巴瘤和多发性骨髓瘤的临床试验中;阿维鲁单抗(辉瑞/默克集团),也被称为msb0010718c),其是一种完全人源化igg1抗pd-l1抗体,用于非小细胞肺癌、默克尔细胞癌、间皮瘤、实体瘤、肾癌、卵巢癌、膀胱癌、头颈癌和胃癌的临床试验中;pdr001(诺华),其是一种结合到pd-1的抑制性抗体,用于非小细胞肺癌、黑素瘤、三阴性乳腺癌和晚期或转移性实体瘤的临床试验中。替西木单抗(tremelimumab)(cp-675,206;阿斯利康)是一种针对ctla-4的完全人源化单克隆抗体,其已经在多种适应症的临床试验中进行了研究,包含:间皮瘤、结肠直肠癌、肾癌、乳腺癌、肺癌和非小细胞肺癌、胰腺导管腺癌、胰腺癌、生殖细胞癌、头颈鳞状细胞癌、肝细胞癌、前列腺癌、子宫内膜癌、肝脏转移癌、肝癌、大b细胞淋巴瘤、卵巢癌、子宫颈癌、转移性未分化甲状腺癌、尿路上皮癌、输卵管癌、多发性骨髓瘤、膀胱癌、软组织肉瘤和黑素瘤。agen-1884(艾吉纳斯(agenus))是一种抗ctla4抗体,其正在晚期实体瘤(nct02694822)的1期临床试验中进行研究。派姆单抗(默克)是一种靶向程序性细胞死亡(pd-1)受体的人源化抗体。派姆单抗的结构和其它性质在2016年1月18日访问的http://www.drugbank.ca/drugs/db09037中指定,其公开内容由此并入本文。派姆单抗已被批准用于治疗患者中的不可切除的黑素瘤和转移性黑素瘤以及转移性非小细胞肺癌的,所述患者的肿瘤表达pd-1并且用其它化学治疗剂治疗失败。另外,派姆单抗已经被测试或提及作为其它肿瘤适应症中的可能治疗,所述适应症包含实体瘤、胸腔肿瘤、胸腺上皮肿瘤、胸腺癌、白血病、卵巢癌、食道癌、小细胞肺癌、头颈癌、唾液腺癌、结肠癌、直肠癌、结肠直肠癌、尿路上皮癌、子宫内膜癌、膀胱癌、子宫颈癌、激素抵抗性前列腺癌、睾丸癌、三阴性乳腺癌、肾细胞和肾脏癌、胰腺腺癌和胰腺癌、胃腺癌、胃肠道和胃癌;脑肿瘤、恶性神经胶质瘤、胶质母细胞瘤、神经母细胞瘤、淋巴瘤、肉瘤、间皮瘤、呼吸道乳头状瘤、骨髓增生异常综合征和多发性骨髓瘤。在不可切除的或转移性黑素瘤的3期试验中,客观反应率为33%,而伊匹单抗为12%(p<0.001)[11]。在较早的研究中,在治疗之前和治疗期间对肿瘤样本的分析表明,临床反应与肿瘤实质(中心)中的cd8+t细胞密度的增加相关,而疾病进展与这些细胞的持续低水平相关[12]。在胰腺腺癌的自发性小鼠模型中,尽管施用抗pd-l1,但持续的肿瘤生长与肿瘤特异性细胞毒性t细胞进入tme失败类似相关(尽管它们存在于外周循环中)[7]。这种免疫抑制的表型与caf产生cxcl12相关。通过增加黑素瘤肿瘤细胞之中的cd8+t细胞的密度,将x4p-001或x4-136与派姆单抗或其它检查点调节剂在多种肿瘤类型中组合施用可以大大提高客观反应率、持久长期反应的频率并增加总生存期。在当前针对不可切除的或转移性黑素瘤的处方标签中,派姆单抗的推荐施用疗程为2mg/kg,每三周静脉输注30分钟。根据临床医师的判断,取决于个体耐受性,派姆单抗的处方剂量可以增加到每21天10mg/kg或每14天10mg/kg。根据临床医师的判断以及连同处方信息一起提供的警告,可以中断派姆单抗的施用,或在严重不良反应的情况下降低剂量。在一些实施例中,本发明提供了一种用于治疗患者中的转移性黑素瘤的方法,所述方法包括向患者施用x4p-001或x4-136或其药学上可接受的盐与免疫检查点抑制剂的组合。在一些实施例中,黑素瘤是可切除的和转移性的。在其它实施例中,黑素瘤是不可切除的和转移性的。在一些实施例中,免疫检查点抑制剂是派姆单抗。在一些实施例中,本发明提供了一种用于治疗患者中的可切除的转移性黑素瘤的方法,所述方法包括向患者施用x4p-001或x4-136或其药学上可接受的盐与免疫检查点抑制剂的组合。在完成根据本发明的治疗之后,可以进行切除手术。在其它实施例中,本发明提供了一种用于治疗患者中的不可切除的转移性黑素瘤的方法,所述方法包括向患者施用x4p-001或x4-136或其药学上可接受的盐与免疫检查点抑制剂的组合。在一些实施例中,免疫检查点抑制剂是派姆单抗。在完成根据本发明的治疗之后,患者可以根据治疗临床医师的判断继续接受使用派姆单抗的标准护理(soc)疗法或其它疗法,并且此类治疗可以包含用x4p-001或x4-136或其药学上可接受的盐进一步治疗。在一些实施例中,本发明提供了一种用于治疗有需要的患者中的难治性癌症的方法,其中所述方法包括向所述患者施用x4p-001或x4-136或其药学上可接受的盐与免疫检查点抑制剂的组合。在一些实施例中,难治性癌症是表达pd-l1的转移性黑素瘤。在一些实施例中,转移性黑素瘤表达pd-l1,并且在患者已经进行化学疗法或用免疫检查点抑制剂治疗而未用x4p-001或x4-136治疗之后表现出疾病进展。在一些实施例中,难治性癌症是表达pd-l1的转移性非小细胞肺癌(nsclc),并且在含铂化学疗法之后表现出疾病进展。在一些实施例中,难治性癌症是转移性黑素瘤,并且免疫检查点抑制剂是派姆单抗。在一些实施例中,一种提供的方法包括在禁食状态下向患者施用x4p-001或x4-136或其药学上可接受的盐,并在禁食状态或进食状态下向患者施用免疫检查点抑制剂。在某些实施例中,本发明提供了一种用于治疗有需要的患者中的癌症的方法,其中所述方法包括向所述患者施用x4p-001或x4-136或其药学上可接受的盐与免疫检查点抑制剂的组合,进一步包括从患者获得生物样本并测量疾病相关生物标志物的量的步骤。在一些实施例中,生物样本是血液样本或皮肤打孔活检。在某些实施例中,疾病相关生物标志物是循环的cd8+t细胞和/或pd-1和/或pd-l1的血浆水平。在一些实施例中,生物标志物是cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达中的一或多种。在某些实施例中,本发明提供了一种用于治疗有需要的患者中的晚期癌症(例如,黑素瘤或非小细胞肺癌)的方法,其中所述方法包括向所述患者施用x4p-001或x4-136或其药学上可接受的盐与派姆单抗的组合,进一步包括从患者获得生物样本并测量疾病相关生物标志物的量的步骤。在一些实施例中,生物样本是血液样本或皮肤打孔活检。在某些实施例中,疾病相关生物标志物是循环的cd8+t细胞和/或pd-1和/或pd-l1的血浆水平。在一些实施例中,疾病相关生物标志物是cd8+t细胞或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组或pd-l1表达中的一或多种。在本发明的其它实施例中,x4p-001或x4-136或其药学上可接受的盐与免疫检查点抑制剂组合施用。免疫检查点抑制剂可以是pd-1、pd-l1或ctla-4的抗体。在某些实施例中,免疫检查点拮抗剂选自由以下组成的群组:派姆单抗、纳武单抗和伊匹单抗。在一些实施例中,本发明提供了一种治疗有需要的患者中的癌症的方法,其中所述方法包括向所述患者施用x4p-001或x4-136或其药学上可接受的盐与免疫检查点抑制剂的组合,其中x4p-001或x4-136或其药学上可接受的盐和免疫检查点抑制剂协同作用。本领域普通技术人员将理解,当活性剂的组合产生的作用大于相加作用时,活性剂(例如,x4p-001或x4-136和免疫检查点抑制剂)协同作用。在一些实施例中,免疫检查点抑制剂是派姆单抗。在一些实施例中,本发明提供了一种用于使有需要的患者中的癌症增敏的方法,其中所述方法包括向所述患者施用cxcr4抑制剂(例如,x4p-001或x4-136或其药学上可接受的盐)与免疫检查点抑制剂的组合。在一些实施例中,所述方法包括在用免疫检查点抑制剂治疗之前向患者施用x4p-001或x4-136。在一些实施例中,癌症是实体瘤。在一些实施例中,所述方法包括首先从患者获得肿瘤样本(例如,患者的癌症或实体瘤的活检)、对用免疫检查点抑制剂治疗敏感的生物标志物的基线测量,并将基线测量与预先设定的用免疫检查点抑制剂治疗的阈值进行比较。如果基线测量不符合预先设定的对用免疫检查点抑制剂治疗敏感的生物标志物的阈值,则用cxcr4抑制剂(例如,x4p-001或x4-136或药学上可接受的盐)治疗患者,其期望作用为改变(例如,增加或减少,视情况而定)基线测量值,以实现改变后的测量满足预先设定的阈值。在已经用x4p-001或x4-136或其药学上可接受的盐治疗患者并发现满足预先设定的阈值之后,随后用免疫检查点抑制剂(例如,pd-1抑制剂或pd-l1抑制剂)治疗患者。同样在本发明内的情况是:即使患者的改变后的测量未满足预先设定的阈值,如果认为患者仍然可以受益于用免疫检查点抑制剂治疗,治疗临床医师也可以根据自己的判断用免疫检查点抑制剂治疗患者。可替代地,治疗临床医师可以继续用x4p-001或x4-136或其药学上可接受的盐治疗患者,并继续监测患者的生物标志物水平以达到预先设定的阈值。同样在本发明内的情况是:治疗临床医师根据自己的判断改变患者的治疗计划或完全中断治疗。在本发明中使用的免疫检查点抑制剂包含例如派姆单抗、纳武单抗、阿特珠单抗、阿维鲁单抗、得瓦鲁单抗、伊匹单抗和皮地利珠单抗。在某些实施例中,生物标志物是pd-l1。在其它实施例中,生物标志物包括相关途径或基因的基因标签。在某些实施例中,生物标志物包括干扰素γ(ifn-γ)的基因标签,其可以是基于选自ifn-γ、cxcl9、cxcl10、hla-dra、ido1或stat1的一些或所有基因的表达水平的基因标签。在一些实施例中,基因标签包括所有六个基因ifn-γ、cxcl9、cxcl10、hla-dra、ido1和stat1。在某些实施例中,预先设定的阈值已经并入处方信息中,所述处方信息包含在包装说明书中、包装上或与cxcr4抑制剂或所述免疫检查点抑制剂相关的网站上。如本发明所提供,可以治疗多种癌症。在一些实施例中,所述癌症选自肝细胞癌、卵巢癌、卵巢上皮癌、输卵管癌;乳头状浆液性囊腺癌或子宫乳头状浆液性癌(upsc);前列腺癌;睾丸癌;胆囊癌;肝胆管癌;软组织和骨滑膜肉瘤;横纹肌肉瘤;骨肉瘤;软骨肉瘤;尤文肉瘤;未分化甲状腺癌;肾上腺皮质腺瘤;胰腺癌;胰腺导管癌或胰腺腺癌;胃肠道/胃(gist)癌;淋巴瘤;头颈鳞状细胞癌(scchn);唾液腺癌;神经胶质瘤或脑癌;神经纤维瘤病1型相关的恶性周围神经鞘瘤(mpnst);华氏巨球蛋白血症;或髓母细胞瘤。在一些实施例中,所述癌症选自肝细胞癌(hcc)、肝母细胞瘤、结肠癌、直肠癌、卵巢癌、卵巢上皮癌、输卵管癌、乳头状浆液性囊腺癌、子宫乳头状浆液性癌(upsc)、肝胆管癌、软组织和骨滑膜肉瘤、横纹肌肉瘤、骨肉瘤、未分化甲状腺癌、肾上腺皮质腺瘤、胰腺癌、胰腺导管癌、胰腺腺癌、神经胶质瘤、神经纤维瘤病1型相关的恶性周围神经鞘瘤(mpnst)、华氏巨球蛋白血症或髓母细胞瘤。在一些实施例中,本发明提供了一种用于治疗以实体瘤(例如,肉瘤、癌或淋巴瘤)形式存在的癌症的方法,所述方法包括向有需要的患者施用x4p-001或x4-136或其药学上可接受的盐的步骤。实体瘤通常包括异常的组织块,通常不包含囊肿或液体区域。在一些实施例中,所述癌症选自肾细胞癌或肾癌;肝细胞癌(hcc)或肝母细胞瘤或肝癌;黑素瘤;乳腺癌;结肠直肠癌(colorectalcarcinoma/colorectalcancer);结肠癌;直肠癌;肛门癌;肺癌,例如非小细胞肺癌(nsclc)或小细胞肺癌(sclc);卵巢癌(ovariancancer/ovariancarcinoma)、卵巢上皮癌或输卵管癌;乳头状浆液性囊腺癌或子宫乳头状浆液性癌(upsc);前列腺癌;睾丸癌;胆囊癌;肝胆管癌;软组织和骨滑膜肉瘤;横纹肌肉瘤;骨肉瘤;软骨肉瘤;尤文肉瘤;未分化甲状腺癌;肾上腺皮质癌;胰腺癌;胰腺导管癌或胰腺腺癌;胃肠道/胃(gist)癌;淋巴瘤;头颈鳞状细胞癌(scchn);唾液腺癌;神经胶质瘤或脑癌;神经纤维瘤病1型相关的恶性周围神经鞘瘤(mpnst);华氏巨球蛋白血症;或髓母细胞瘤。在一些实施例中,所述癌症选自肾细胞癌、肝细胞癌(hcc)、肝母细胞瘤、结肠直肠癌(colorectalcarcinoma/colorectalcancer)、结肠癌、直肠癌、肛门癌、卵巢癌(ovariancancer/ovariancarcinoma)、卵巢上皮癌、输卵管癌、乳头状浆液性囊腺癌、子宫乳头状浆液性癌(upsc)、肝胆管癌、软组织和骨滑膜肉瘤、横纹肌肉瘤、骨肉瘤、软骨肉瘤、未分化甲状腺癌、肾上腺皮质癌、胰腺癌、胰腺导管癌、胰腺腺癌、神经胶质瘤、脑癌、神经纤维瘤病1型相关的恶性周围神经鞘瘤(mpnst)、华氏巨球蛋白血症或髓母细胞瘤。在一些实施例中,所述癌症选自肝细胞癌(hcc)、肝母细胞瘤、结肠癌、直肠癌、卵巢癌(ovariancancer/ovariancarcinoma)、卵巢上皮癌、输卵管癌、乳头状浆液性囊腺癌、子宫乳头状浆液性癌(upsc)、肝胆管癌、软组织和骨滑膜肉瘤、横纹肌肉瘤、骨肉瘤、未分化甲状腺癌、肾上腺皮质癌、胰腺癌、胰腺导管癌、胰腺腺癌、神经胶质瘤、神经纤维瘤病1型相关的恶性周围神经鞘瘤(mpnst)、华氏巨球蛋白血症或髓母细胞瘤。在一些实施例中,所述癌症是肝细胞癌(hcc)。在一些实施例中,所述癌症是肝母细胞瘤。在一些实施例中,所述癌症是结肠癌。在一些实施例中,所述癌症是直肠癌。在一些实施例中,所述癌症是卵巢癌(ovariancancer/ovariancarcinoma)。在一些实施例中,所述癌症是卵巢上皮癌。在一些实施例中,所述癌症是输卵管癌。在一些实施例中,所述癌症是乳头状浆液性囊腺癌。在一些实施例中,所述癌症是子宫乳头状浆液性癌(upsc)。在一些实施例中,所述癌症是肝胆管癌。在一些实施例中,所述癌症是软组织和骨滑膜肉瘤。在一些实施例中,所述癌症是横纹肌肉瘤。在一些实施例中,所述癌症是骨肉瘤。在一些实施例中,所述癌症是未分化甲状腺癌。在一些实施例中,所述癌症是肾上腺皮质癌。在一些实施例中,所述癌症是胰腺癌或胰腺导管癌。在一些实施例中,所述癌症是胰腺腺癌。在一些实施例中,所述癌症是神经胶质瘤。在一些实施例中,所述癌症是恶性周围神经鞘瘤(mpnst)。在一些实施例中,所述癌症是神经纤维瘤病1型相关的mpnst。在一些实施例中,所述癌症是华氏巨球蛋白血症。在一些实施例中,所述癌症是髓母细胞瘤。在一些实施例中,本发明提供了一种用于治疗选自白血病或血液癌的癌症的方法,所述方法包括向有需要的患者施用有效量的x4p-001或x4-136或其药学上可接受的盐或其药物组合物(任选地与另外的治疗剂(例如,本文所述的那些)组合)。在一些实施例中,所述癌症选自急性骨髓性白血病(aml)、慢性骨髓性白血病(cml)、急性淋巴细胞性白血病(all)、慢性淋巴细胞性白血病(cll)或病毒诱导的白血病。在一些实施例中,患者患有可切除的实体瘤,这意味着认为患者的肿瘤易于通过手术切除。在其它实施例中,患者患有不可切除的实体瘤,这意味着已经认为患者的肿瘤不易通过手术全部或部分地切除。在一些实施例中,所述癌症是晚期癌症,例如晚期肾癌或晚期肾细胞癌。疾病相关生物标志物通过标识多组基因的肿瘤内表达模式、肿瘤微环境中的免疫相关细胞水平的变化或肿瘤微环境中的其它变化(在本文中通常被称为“生物标志物”,或在与基因表达模式相关时被更具体地称为“基因标签”、“基因表达生物标志物”或“分子标签”,这些都是癌症的特定类型或亚型的特性并与临床结果相关)来改善癌症研究。如果此关联可预测临床反应,则生物标志物可有利地用于将患者选择或分级为有更多(或更少,视情况而定)可能受益于本文公开的治疗方案的方法。现在已经令人惊讶地发现,cd8+t细胞的水平或cd8+t细胞/treg比、cd8+ki-67+t细胞、颗粒酶b、ifn-γ标签评分、ctl标签评分、抗原呈递/加工标签评分、肿瘤炎症标签评分、vista生物标志物组和/或pd-l1表达可以在本文描述的方法(例如,治疗患者中的癌症、诊断患者中的癌症或预测患者对癌症(例如,转移性黑素瘤)治疗的反应的方法)中用作生物标志物。在一些实施例中,所述生物标志物包括本文描述的基因(例如,cd8a、cd8b、foxp3、颗粒酶b、ifn-γ标签基因、ctl标签基因、抗原呈递/加工标签基因、肿瘤炎症标签基因或pd-l1表达)的rna表达水平。在一些实施例中,所述生物标志物进一步包括cd3和/或ki67的水平。已经令人惊讶地发现,x4p-001和x4-136增加了癌症(例如,实体瘤,例如晚期或转移性黑素瘤)中的颗粒酶b(gzmb)表达。颗粒酶b与细胞毒性t淋巴细胞(ctl)、自然杀伤(nk)细胞和细胞毒性t细胞介导的细胞死亡/凋亡相关。因此,在一些实施例中,生物标志物是观察到的肿瘤中的颗粒酶b表达相对于对照的增加。在一些实施例中,癌症是实体瘤,例如晚期或转移性黑素瘤。已经令人惊讶地发现,x4p-001和x4-136增加了观察到的癌症(例如,实体瘤,例如晚期或转移性黑素瘤)中的cd8+t细胞和/或cd4+t细胞的数量。因此,在一些实施例中,生物标志物是观察到的肿瘤中cd8+t细胞和/或cd4+t细胞相对于对照的增加。在其它实施例中,生物标志物是cd8+t细胞与treg细胞之比的增加。在一些实施例中,通过cd8a和cd8b中的一或两种的免疫组织化学或表达水平观察到增加。在一些实施例中,来自已经用x4p-001或x4-136治疗的患者的肿瘤样本中的cd8+t细胞和/或cd4+t细胞或cd8+t细胞/treg比的增加与患者将受益于单独用x4p-001或用x4p-001与免疫治疗剂(例如,检查点抑制剂,例如pd-1拮抗剂)的组合继续治疗的可能性增加相关。在一些实施例中,pd-1拮抗剂选自纳武单抗和派姆单抗或此类pd-1拮抗剂的生物仿制药或变体。在一些实施例中,检查点抑制剂是纳武单抗。在一些实施例中,检查点抑制剂是纳武单抗生物仿制药或变体。在一些实施例中,检查点抑制剂是派姆单抗。在一些实施例中,检查点抑制剂是派姆单抗生物仿制药或变体。在一些实施例中,肿瘤是实体瘤,例如晚期或转移性黑素瘤。已经令人惊讶地发现,x4p-001和x4-136增加了一组ifn-γ相关基因(在本文中被称为“ifn-γ基因标签”)中的一或多种。在一些实施例中,ifn-γ基因标签选自ido1、cxcl10、cxcl9、hla-dra、stat1和ifn-γ中的一或多种的改变(即增加或减少),或肿瘤中的作为整体的群组相对于对照的净增加或减少。在一些实施例中,生物标志物是ido1。在一些实施例中,生物标志物是cxcl10。在一些实施例中,生物标志物是cxcl9。在一些实施例中,生物标志物是hla-dra。在一些实施例中,生物标志物是stat1。在一些实施例中,生物标志物是ifn-γ。在一些实施例中,生物标志物是ido1、cxcl10、cxcl9、hla-dra、stat1和ifn-γ中的两种或两种以上。在一些实施例中,生物标志物是ido1、cxcl10、cxcl9、hla-dra、stat1和ifn-γ中的三种或三种以上。在一些实施例中,生物标志物是ido1、cxcl10、cxcl9、hla-dra、stat1和ifn-γ中的四种或四种以上。在一些实施例中,生物标志物是ido1、cxcl10、cxcl9、hla-dra、stat1和ifn-γ中的五种或五种以上。在一些实施例中,生物标志物是ido1、cxcl10、cxcl9、hla-dra、stat1和ifn-γ中的全部。在一些实施例中,生物标志物是ido1、cxcl10、cxcl9、hla-dra、stat1和ifn-γ中的全部的增加。在一些实施例中,来自已经用x4p-001治疗的患者的肿瘤样本中的ido1、cxcl10、cxcl9、hla-dra、stat1和ifn-γ中的一种、两种、三种、四种、五种或全部的增加与患者将受益于单独用x4p-001或用x4p-001与免疫治疗剂(例如,检查点抑制剂,例如pd-1拮抗剂)的组合继续治疗的可能性增加相关。在一些实施例中,pd-1拮抗剂选自纳武单抗和派姆单抗或此类pd-1拮抗剂的生物仿制药或变体。在一些实施例中,检查点抑制剂是纳武单抗。在一些实施例中,检查点抑制剂是纳武单抗生物仿制药或变体。在一些实施例中,检查点抑制剂是派姆单抗。在一些实施例中,检查点抑制剂是派姆单抗生物仿制药或变体。在一些实施例中,肿瘤是实体瘤,例如晚期或转移性黑素瘤。在一些实施例中,生物标志物或其用途是艾尔斯(ayers)等人,临床研究杂志(journalofclinicalinvestigation),2017,127(8),2930-2940[29](“艾尔斯等人(2017)”)或wo2016/094377中描述的那些中的一种,其中每一个均由此通过引用并入。不希望受理论的束缚,据信由于高基础ifn-γ标签与较高的对检查点抑制剂反应的可能性相关,因此如果cxcr4抑制剂增加了ifn-γ标签,则cxcr4治疗增加了肿瘤对检查点抑制剂反应的可能性。在一些实施例中,用cxcr4抑制剂治疗引发了肿瘤微环境,使得肿瘤变得更有可能对免疫治疗剂有反应。在一些实施例中,肿瘤对pd-1抑制剂单一疗法无反应,但当与cxcr4抑制剂组合时被引发并对pd-1抑制剂有反应。在一些实施例中,肿瘤最初对pd-1抑制剂或另一检查点抑制剂有反应,但变得难以治疗。在一些实施例中,在用cxcr4抑制剂治疗之后,可以用pd-1抑制剂或其它免疫治疗剂有效地治疗肿瘤。在其它实施例中,生物标志物是扩展28基因免疫标签中的两种、三种、四种、五种、六种、七种、八种、约十种、约二十种或二十种以上或扩展10基因ifn-γ标签,所述扩展28基因免疫标签由以下组成:il2rg;cxcr6;cd3d;cd2;itgal;tagap;ciita;hla-dra;ptprc;cxcl9;ccl5;nkg7;gzma;prf1;ccr5;cd3e;gzmk;ifng;hla-e;gzmb;pdcd1;slamf6;cxcl13;cxcl10;ido1;lag3;stat1;和cxcl11;所述扩展10基因ifn-γ标签包括ifng、stat1、ccr5、cxcl9、cxcl10、cxcl11、ido1、prf1、gzma和mhciihla-dra。艾尔斯等人(2017)。在其它实施例中,生物标志物是一组抗原呈递/加工相关基因(在本文中被称为“抗原呈递/加工基因标签”)中的一或多种。在一些实施例中,抗原呈递/加工基因标签选自b2m、cd74、ctsl、ctss、hla-dma、hla-dmb、hla-dob、hla-dpa1、hla-dpb1、hla-dqa1、hla-dqb1、hla-dra、hla-drb1、hla-drb3、psmb8、psmb9、tap1和tap2中的一或多种的改变(即增加或减少),或肿瘤中的作为整体的群组相对于对照的净增加或减少。在一些实施例中,来自已经用x4p-001治疗的患者的肿瘤样本中的b2m、cd74、ctsl、ctss、hla-dma、hla-dmb、hla-dob、hla-dpa1、hla-dpb1、hla-dqa1、hla-dqb1、hla-dra、hla-drb1、hla-drb3、psmb8、psmb9、tap1和tap2中的一种、两种、三种、四种、五种、十种、十五种或全部的增加与患者将受益于单独用x4p-001或用x4p-001与免疫治疗剂(例如,检查点抑制剂,例如pd-1拮抗剂)的组合继续治疗的可能性增加相关。在其它实施例中,生物标志物是一组肿瘤炎症相关基因(在本文中被称为“肿瘤炎症基因标签”)中的一或多种。在一些实施例中,肿瘤炎症基因标签选自ccl5、cd27、cd274、cd276、cd8a、cmklr1、cxcl9、cxcr6、hla-dqa1、hla-drb1、hla-e、ido1、lag3、nkg7、pdcd1lg2、psmb10、stat1和tigit中的一或多种的改变(即增加或减少),或肿瘤中的作为整体的群组相对于对照的净增加或减少。在一些实施例中,来自已经用x4p-001治疗的患者的肿瘤样本中的ccl5、cd27、cd274、cd276、cd8a、cmklr1、cxcl9、cxcr6、hla-dqa1、hla-drb1、hla-e、ido1、lag3、nkg7、pdcd1lg2、psmb10、stat1和tigit中的一种、两种、三种、四种、五种、十种、十五种或全部的增加与患者将受益于单独用x4p-001或用x4p-001与免疫治疗剂(例如,检查点抑制剂,例如pd-1拮抗剂)的组合继续治疗的可能性增加相关。已经令人惊讶地发现,x4p-001和x4-136在未显著增加treg细胞的水平的情况下治疗癌症(例如,实体瘤,例如晚期或转移性黑素瘤)。不希望受理论的束缚,据信由于treg细胞抑制了免疫反应,因此这表明肿瘤微环境在这种免疫调节反应中表现出显著的增加,这通常会使肿瘤逃避宿主免疫。因此,在一些实施例中,生物标志物是肿瘤中的treg水平相对于对照的维持或降低。在一些实施例中,生物标志物是foxp3表达的水平,其用作确定treg水平的手段。在一些实施例中,生物标志物是肿瘤微环境或肿瘤样本中的cd8+t细胞/foxp3比的增加。在一些实施例中,测量出的来自已经用x4p-001或x4-136治疗的患者的肿瘤样本中的生物标志物的增加与患者将受益于单独用x4p-001或x4-136或用x4p-001或x4-136与免疫治疗剂(例如,检查点抑制剂,例如pd-1拮抗剂)的组合继续治疗的可能性增加相关。在一些实施例中,pd-1拮抗剂选自纳武单抗和派姆单抗或此类pd-1拮抗剂的生物仿制药或变体。在一些实施例中,检查点抑制剂是纳武单抗。在一些实施例中,检查点抑制剂是纳武单抗生物仿制药或变体。在一些实施例中,检查点抑制剂是派姆单抗。在一些实施例中,检查点抑制剂是派姆单抗生物仿制药或变体。在一些实施例中,肿瘤是实体瘤,例如晚期或转移性黑素瘤。已经令人惊讶地发现,x4p-001和x4-136在未显著调节肿瘤中的巨噬细胞的水平的情况下治疗癌症(例如,实体瘤,例如晚期或转移性黑素瘤)。因此,在一些实施例中,生物标志物是肿瘤中的巨噬细胞水平相对于对照的维持或近似维持。已经令人惊讶地发现,x4p-001和x4-136增加了肿瘤样本和肿瘤微环境中的pd-l1表达。不希望受理论的束缚,已经提出,pd-l1表达肿瘤细胞与pd-1表达t细胞相互作用以减弱t细胞活化和免疫监视的逃避,从而导致针对肿瘤的免疫反应受损。因此,在一些实施例中,生物标志物是pd-l1表达的增加。在一些实施例中,来自已经用x4p-001或x4-136治疗的患者的肿瘤样本中的生物标志物的增加与患者将受益于单独用x4p-001或x4-136或用x4p-001或x4-136与免疫治疗剂(例如,检查点抑制剂,例如pd-1拮抗剂)的组合继续治疗的可能性增加相关。在一些实施例中,pd-1拮抗剂选自纳武单抗和派姆单抗或此类pd-1拮抗剂的生物仿制药或变体。在一些实施例中,检查点抑制剂是纳武单抗。在一些实施例中,检查点抑制剂是纳武单抗生物仿制药或变体。在一些实施例中,检查点抑制剂是派姆单抗。在一些实施例中,检查点抑制剂是派姆单抗生物仿制药或变体。在一些实施例中,肿瘤是实体瘤,例如晚期或转移性黑素瘤。已经令人惊讶地发现,x4p-001和x4-136增加了肿瘤样本和肿瘤微环境中的一组细胞毒性t细胞(ctl)相关基因(在本文中被称为“ctl标签”)中的一或多种的基因表达。因此,在一些实施例中,生物标志物是ctl标签的增加。在一些实施例中,ctl标签包括cd8a、cd8b、fltlg、gzmm或prf1中的一或多种的增加。在一些实施例中,ctl标签包括cd8a、cd8b、fltlg、gzmm或prf1中的两种或两种以上、三种或三种以上、四种或四种以上或每一种的增加。在一些实施例中,生物标志物是ctl标签的总表达的净增加。在一些实施例中,来自已经用x4p-001或x4-136治疗的患者的肿瘤样本中的生物标志物的增加与患者将受益于单独用x4p-001或x4-136或用x4p-001或x4-136与免疫治疗剂(例如,检查点抑制剂,例如pd-1拮抗剂)的组合继续治疗的可能性增加相关。在一些实施例中,pd-1拮抗剂选自纳武单抗和派姆单抗或此类pd-1拮抗剂的生物仿制药或变体。在一些实施例中,检查点抑制剂是纳武单抗。在一些实施例中,检查点抑制剂是纳武单抗生物仿制药或变体。在一些实施例中,检查点抑制剂是派姆单抗。在一些实施例中,检查点抑制剂是派姆单抗生物仿制药或变体。在一些实施例中,肿瘤是实体瘤,例如晚期或转移性黑素瘤。已经令人惊讶地发现,x4p-001和x4-136调节了肿瘤样本和肿瘤微环境中的vista组生物标志物的水平。如本文使用,“vista组”是指cd163、cd206、vista、cox-2、cd3和b7h3生物标志物的组合。在一些实施例中,在用cxcr4抑制剂(例如,x4p-001或x4p-136)(任选地与免疫治疗剂组合)治疗之后,vista降低。在一些实施例中,调节了vista和一或多种另外的vista组成员。在一些实施例中,在用cxcr4抑制剂(任选地与免疫治疗剂组合)治疗之后,cd3增加。根据本发明,可以在用cxcr4抑制剂和任选的免疫治疗剂治疗之前,期间和/或之后测量生物标志物,然后将其与临床结果、反应率、预后或另一预测性或解释性测量相关。本发明的系统和方法部分地基于临床反应生物标志物(例如,基因)集和标准化生物标志物(例如,基因)集的组合,所述组合在本文中被称为“生物标志物表达平台”,其用作工具以用于获得具有治疗前肿瘤内生物标志物(例如,rna表达、针对多种肿瘤类型对cxcr4抑制剂(任选地与pd-1拮抗剂组合)的抗肿瘤反应的水平(“生物标志物标签”或“基因标签”))的多组不同基因。本生物标志物表达平台可用于获得评分算法,所述算法对标签中单个生物标志物对相关性的相对贡献进行加权,以生成所有生物标志物(例如,基因标签中的基因)的标准化生物标志物水平的算术合成(在本文中被称为“基因标签评分”)。通过将针对一组患有相同目标肿瘤类型并用cxcr4抑制剂(任选地与pd-1拮抗剂组合)治疗的患者获得的基因标签评分和抗肿瘤反应进行比较,可以选择分界评分,所述分界评分根据具有较高或较低的实现对治疗的抗肿瘤反应的可能性来对患者进行划分。特定肿瘤类型的预测标签评分在本文中被称为基因标签生物标志物。与肿瘤的生物标志物标签或基因标签生物标志物(根据本发明获得)测试为阴性的患者相比,肿瘤的生物标志物标签或基因标签生物标志物测试为阳性的患者更有可能受益于使用cxcr4抑制剂(任选地与pd-1拮抗剂组合)的疗法。因此,在第一方面中,本发明提供了一种获得可预测针对至少一种目标肿瘤类型对cxcr4抑制剂(任选地与pd-1拮抗剂组合)的抗肿瘤反应的基因标签生物标志物的方法。所述方法包括:(a)从诊断患有所述肿瘤类型的患者组中的每个患者获得治疗前肿瘤样本;(b)针对组中的每个患者,在用cxcr4抑制剂(任选地与pd-1拮抗剂组合)治疗之后获得抗肿瘤反应值;(c)在基因表达平台中针对每个基因测量每个肿瘤样本中的原始rna水平,其中所述基因表达平台包括一组临床反应基因和一组标准化基因;(d)针对每个肿瘤样本,使用标准化基因的测量rna水平对临床反应基因的每个测量原始rna水平进行标准化;(e)任选地,针对每个肿瘤样本和目标基因标签中的每个基因,使用所述基因的预定倍增系数对标准化rna表达水平进行加权;(f)任选地,针对每个肿瘤样本,对加权rna表达水平进行相加,以生成基因标签评分;和(g)将所有肿瘤样本的标准化rna水平或基因标签评分和组中的所有患者的抗肿瘤反应值进行比较,以分别选择rna水平或基因标签评分的分界值,所述分界值将患者组划分为满足目标生物标志物临床效用标准。在一个实施例中,所述方法进一步包括将基因标签评分等于或大于所选分界值的所述肿瘤类型的任何肿瘤样本指定为生物标志物高值,并且将基因标签评分低于所选分界值的所述肿瘤类型的任何肿瘤样本指定为生物标志物低值。发明人预期,使用本发明的上述方法获得的基因标签生物标志物将可用于多种临床研究和患者治疗设置,诸如例如仅将生物标志物高值患者选择性地纳入cxcr4抑制剂(任选地与pd-1拮抗剂组合)的临床试验中,以基于生物标志物高值或阴性状态对cxcr4抑制剂(任选地与pd-1拮抗剂组合)的临床试验的分析进行分级,或确定患者是否适于用cxcr4抑制剂(任选地与pd-1拮抗剂组合)治疗。因此,在第二方面中,本发明提供了一种用于测试从诊断患有特定肿瘤类型的患者取出的肿瘤样本是否存在所述肿瘤类型对cxcr4抑制剂(任选地与pd-1拮抗剂组合)的抗肿瘤反应的基因标签生物标志物的方法。所述方法包括:(a)在基因表达平台中针对每个基因测量肿瘤样本中的原始rna水平,其中所述基因表达平台包括一组临床反应基因和一组标准化基因;(b)针对所述肿瘤类型,使用标准化基因的测量rna水平对预定基因标签中的每个临床反应基因的测量原始rna水平进行标准化;(c)任选地,使用预定倍增系数对每个标准化rna值进行加权;(d)任选地,对加权rna表达水平进行相加,以生成基因标签评分;(e)将标准化rna水平或所生成的评分与基因标签和肿瘤类型的参考评分或参考rna水平进行比较;和(f)将肿瘤样本分类为生物标志物高值或生物标志物地址;其中如果所生成的评分等于或大于参考评分或测量rna水平大于参考rna水平,则将肿瘤样本分类为生物标志物高值,并且如果所生成的评分小于参考评分或测量rna水平小于参考rna水平,则将肿瘤样本分类为生物标志物低值。在第三方面中,本发明提供了一种用于测试从诊断患有特定肿瘤类型的患者取出的肿瘤样本是否存在所述肿瘤类型对cxcr4抑制剂(任选地与pd-1拮抗剂组合)的抗肿瘤反应的基因标签生物标志物的系统。所述系统包括(i)样本分析仪,其用于在基因表达平台中测量每个基因的原始rna表达水平,其中所述基因表达平台由一组临床反应基因和一组标准化基因组成,和(ii)计算机程序,其用于接收和分析测量rna表达水平,以(a)针对所述肿瘤类型,使用标准化基因的测量rna水平对预定基因标签中的每个临床反应基因的测量原始rna水平进行标准化;(b)任选地,使用预定倍增系数对每个标准化rna值进行加权;(c)任选地,对加权rna表达水平进行相加,以生成基因标签评分;(d)将标准化rna水平或所生成的评分与基因标签和肿瘤类型的参考rna水平或参考评分进行比较;和(e)将肿瘤样本分类为生物标志物高值或生物标志物地址,其中如果所生成的评分等于或大于参考评分或标准化rna水平大于参考水平,则将肿瘤样本分类为生物标志物高值,并且如果所生成的评分小于参考评分或标准化rna水平小于参考水平,则将肿瘤样本分类为生物标志物低值。在本发明的上述每个方面中,基因表达平台中的临床反应基因(a)与一种以上肿瘤类型中对标准化rna水平的抗肿瘤反应单独相关,并且(b)共同生成在每种肿瘤类型中基本上相似的协方差模式。临床反应基因集中的基因的第一子集表现出与抗肿瘤反应正相关的肿瘤内rna水平,而临床反应基因集中的基因的第二子集的肿瘤内rna水平与抗肿瘤反应负相关。在一个实施例中,临床反应基因集包括约2-25个基因。在本发明的任何上述方面的一些实施例中,基因表达平台中的标准化基因组包括如下基因:其单独表现出跨不同肿瘤类型的多个样本的低方差肿瘤内rna水平,并且共同表现出跨不同肿瘤类型中的临床反应基因的肿瘤内表达水平范围的一系列肿瘤内rna水平。在一些实施例中,标准化基因组包括约10到12个基因。在一些实施例中,生物标志物或基因标签或标准化基因组是wo2016/094377中公开的那些中的一种,其公开内容由此以引用方式并入。剂量和调配物x4p-001是一种cxcr4拮抗剂,分子式为c21h27n5;分子量为349.48amu;外观:白色至浅黄色固体;溶解度:在3.0到8.0的ph范围内易溶(>100mg/ml),在ph9.0下可溶(10.7mg/ml),并且在ph10.0下微溶(2.0mg/ml)。x4p-001仅微溶于水;熔点为108.9°δc。x4-136是一种cxcr4拮抗剂,分子式为c21h30n4;分子量为338.50amu。在某些实施例中,含有x4p-001或x4-136的组合物每天以约200mg到约1200mg的量口服投与。在某些实施例中,可以以分开的剂量每天两次提供剂量组合物,相隔大约12小时。在其它实施例中,可以每天一次提供剂量组合物。x4p-001的终末半衰期通常已确定为约12至约24小时之间,或大约14.5小时。口服投与的剂量可以为约100mg到约1200mg,每天一次或两次。在某些实施例中,可用于本发明的x4p-001的剂量为每天约200mg到约600mg。在其它实施例中,可用于本发明的x4p-001的剂量可以为每天约400mg到约800mg、约600mg到约1000mg或约800mg到约1200mg。在某些实施例中,本发明包括投与约10mg、约20mg、约25mg、约50mg、约75mg、约100mg、约125mg、约150mg、约200mg、约250mg、约300mg、约400mg、约450mg、约500mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1100mg、约1200mg、约1300mg、约1400mg、约1500mg或约1600mg的x4p-001。在一些实施例中,所提供方法包括向患者投与包括x4p-001或x4-136的药学上可接受的组合物,其中所述组合物被调配用于口服投与。在某些实施例中,所述组合物被以片剂或胶囊的形式调配用于口服投与。在一些实施例中,所述包括x4p-001或x4-136的组合物被以胶囊的形式调配用于口服投与。在某些实施例中,一种提供的方法包括向患者施用一或多种胶囊,所述胶囊包括100-1200mgx4p-001或x4-136活性成分;和一或多种药学上可接受的赋形剂。在某些实施例中,本发明提供了一种组合物,其包括x4p-001或x4-136或其药学上可接受的盐、一或多种稀释剂、崩解剂、润滑剂、助流剂和湿润剂。在一些实施例中,本发明提供了一种组合物,其包括10-1200mgx4p-001或x4-136或其药学上可接受的盐、微晶纤维素、磷酸氢钙二水合物、交联羧甲基纤维素钠、硬脂富马酸钠、胶体二氧化硅和月桂基硫酸钠。在一些实施例中,本发明提供了一种单位剂型,其中所述单位剂型包括组合物,所述组合物包括10-200mgx4p-001或x4-136或其药学上可接受的盐、微晶纤维素、磷酸氢钙二水合物、交联羧甲基纤维素钠、硬脂富马酸钠、胶体二氧化硅和月桂基硫酸钠。在某些实施例中,本发明提供了一种包括组合物的单位剂型,所述组合物包括存在量为约10mg、约20mg、约25mg、约50mg、约75mg、约100mg、约125mg、约150mg、约200mg、约250mg、约300mg、约400mg、约450mg、约500mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1100mg、约1200mg、约1300mg、约1400mg、约1500mg或约1600mg的x4p-001或x4-136或其药学上可接受的盐。在一些实施例中,每天一次、每天两次、每天三次或每天四次向患者施用提供的组合物(或单位剂型)。在一些实施例中,每天一次或每天两次向患者施用提供的组合物(或单位剂型)。在一些实施例中,本发明提供了一种包括组合物的单位剂型,所述组合物包括:(a)x4p-001或x4-136或其药学上可接受的盐——组合物的约30-40重量%;(b)微晶纤维素——组合物的约20-25重量%;(c)磷酸氢钙二水合物——组合物的约30-35重量%;(d)交联羧甲基纤维素钠——组合物的约5-10重量%;(e)硬脂富马酸钠——组合物的约0.5-2重量%;(f)胶体二氧化硅——组合物的约0.1-1.0重量%;和(g)月桂基硫酸钠——组合物的约0.1-1.0重量%。在一些实施例中,本发明提供了一种包括组合物的单位剂型,所述组合物包括:(a)x4p-001或x4-136或其药学上可接受的盐——组合物的约37重量%;(b)微晶纤维素——组合物的约23重量%;(c)磷酸氢钙二水合物——组合物的约32重量%;(d)交联羧甲基纤维素钠——组合物的约6重量%;(e)硬脂富马酸钠——组合物的约1重量%;(f)胶体二氧化硅——组合物的约0.3重量%;和(g)月桂基硫酸钠——组合物的约0.5重量%。派姆单抗已被fda批准用于治疗不可切除的或转移性黑素瘤或转移性非小细胞肺癌,通常以2mg/kg的剂量施用,静脉输注30分钟,每3周一次。通常,可用于本发明的派姆单抗或其它免疫检查点抑制剂的量将取决于所治疗患者的体型、体重、年龄和状况;病症或病状的严重性以及开处方医师的判断。由于可能需要施用活性化合物的组合,例如以用于治疗特定疾病或病状的目的,因此同样在本发明内的情况是:可以以适合于组合物的共同施用的试剂盒的形式方便地组合两种或两种以上药物组合物(其中至少一种含有根据本发明的化合物)。因此,在一些实施例中,本发明提供了一种试剂盒,其包含两种或两种以上单独的药物组合物(其中至少一种含有本发明的化合物)以及用于分开保存所述组合物的装置(例如,容器、分隔瓶或分隔铝箔包)。此试剂盒的一个实例是用于包装片剂、胶囊等的常见泡罩包装。本发明的试剂盒特别适合于施用不同的剂型(例如,口服剂型和肠胃外剂型),适合于以不同的剂量间隔施用不同的组合物,或适合于使不同的组合物彼此滴定。为了有助于依从性,所述试剂盒通常包含施用说明,并且可以设有记忆辅助工具。以下实例更详细地解释了本发明。给出以下制备和实例以使本领域技术人员能够更清楚地理解和实践本发明。然而,本发明的范围不受示范性实施例的限制,所述示范性实施例仅旨在用作本发明的单个方面的说明,并且功能上等同的方法也在本发明的范围内。实际上,除了本文描述的那些之外,根据前述描述和附图,本发明的各种修改对于本领域技术人员将变得显而易见。此些修改旨在落入所附权利要求的范围内。说明书中引用的每个文件的内容通过引用整体并入本文。实例实例1–cd8+t细胞的测量可以通过测量cd8+t细胞群来部分地评定本发明的有效性。扩大或增加cd8+t细胞(例如,cd8+t浸润淋巴细胞(til))的密度可以有助于提高肿瘤识别并最终提高肿瘤细胞杀伤。达德里(dudley)等人(2010),临床癌症研究(clin.cancerresearch),16:6122-6131。可以使用赫尔(herr)等人(1996),免疫学方法杂志(j.immunol.methods),191:131-142;赫尔等人(1997),免疫学方法杂志,203:141-152;和斯艾本伯根(scheibenbogen)等人(2000),免疫学方法杂志,244:81-89中所述的方法检测、分离和定量cd8+t细胞。这些出版物中的每一个的全部公开内容由此通过引用并入本文。实例2–评估实体瘤患者中的反应的标准实体瘤患者对治疗的反应可以使用recist1.1,艾森豪尔(eisenhauer)等人(2009),欧洲癌症杂志(eur.j.cancer),45:228-247中所述的标准进行评估,其全部公开内容由此通过引用并入本文。实例3–人黑素瘤异种移植模型为了评定本发明对人cd8+效应t细胞的存在、肿瘤微环境中treg的蓄积的作用以及最终对转移性黑素瘤的作用,可以使用人黑素瘤异种移植模型,如斯普朗格(spranger)等人(2013),科学转化医学(sci.transl.med.),5:200ra116中所述。也可以使用人免疫移植模型。实例4–临床治疗方案——可切除的或不可切除的转移性黑素瘤用x4p-001作为单一疗法或与检查点抑制剂(例如,派姆单抗)组合治疗可以按周期(例如,3周或9周周期)进行。在某些实施例中,周期为9周长。每天确定剂量为200mg到1200mg的x4p-001每天一次或每天分两次口服施用。向患者交代给药时间表和临近给药时的饮食相关要求。给药时间表。早晨第一件事就是服用日剂量。在分次给药的情况下,早晨服用第一日剂量,大约12小时后服用第二日剂量,遵循以下准则:每天应在同一时间±2小时给药。对于每天两次给药,连续剂量之间的间隔不应<9小时也不应>15小时。如果间隔>15小时,则应略去所述剂量,并在下一次给药时恢复通常的时间表。食物相关限制。吸收受食物影响,并向患者发出如下指示:对于早晨剂量–午夜后直到给药前不得饮食(水除外)–给药后2小时内不得饮食(水除外)。对于第二日剂量(如果适用)–给药前1小时内不得饮食(水除外)–给药后2时内不得饮食(水除外)。派姆单抗依照处方标签信息进行施用。从第1天每天施用x4p-001开始,可以施用用x4p-001和派姆单抗的联合治疗。在第4周和第7周随访时,在诊所中通过静脉输注30分钟以2mg/kg施用用派姆单抗的初始治疗。患者可以在临床医师的批准下更改派姆单抗的给药方案或剂量。临床医师可以按需调整x4p-001和/或派姆单抗的给药。可以根据临床医师的判断降低x4p-001和/或派姆单抗的剂量。如果接受x4p-001与派姆单抗的组合的患者经历>2级的不良事件,则可以根据临床医师的判断降低x4p-001和/或派姆单抗的剂量。如果患者成功完成前4周治疗,即没有经历任何大于2级的不良事件,则可以依照临床医师的判断增加x4p-001和/或派姆单抗的日剂量。在用x4p-001和派姆单抗组合治疗之后,患有可切除的转移性黑素瘤的患者通常将进行完全切除或尽可能完全的切除,并可以继续进行复发监测和/或进行标准护理(soc)治疗。这可能意味着继续使用派姆单抗,或者可能意味着根据临床医师的判断采取的一些其它治疗。患有不可切除的转移性黑素瘤的患者在治疗之后将继续进行soc治疗。这种soc治疗可能包含或不包含x4p-001(有或没有派姆单抗)的进一步方案。对治疗和疾病状态的反应的评估进行患者的基线放射学评定,以便确认患者是否患有可切除的疾病。在治疗结束时,将使用相同的方式进行重复成像。在初始评定时,患者被诊断为患有恶性黑素瘤,包含iii期(任何亚期)或iv期(仅患有孤立性皮肤转移)。对患者的皮肤/皮下病变(包含将临床活检的那些)进行评定。≥3mm的皮肤/皮下病变由研究者进行临床评定,包含病变的数量、分布和描述(例如,结节性、流行性、黄斑性、色素性等)。使用如事件时间表中指示的病变照片(包含标尺以及患者研究标识和日期)确定皮肤病变的大小。每次访视时检查淋巴结,并记录可触及的淋巴结的位置和大小。分别在第1天、第4周和第7周进行皮肤/皮下疾病的临床评定,如基于新的体征、症状或实验室检查结果所指示。评定将包含身体检查(包含淋巴结)和所有皮肤病变的照片(包含标有患者研究编号和日期的标尺)。生物标志物评定如果需要,可以对血液样本进行x4p-001和派姆单抗的血浆水平的药代动力学评定。按计划收集血液样本。例如,可以在第1天、第4周和第7周采集样本。使用反相高效液相色谱(rp-hplc)以及ms/ms检测分析样本的x4p-001浓度。本生物分析方法在血浆中的有效范围为30到3,000ng/ml。第1天的初始测量被指定为基线。在第4周和第7周,进行cd8+细胞的测量并与基线进行比较。初级比较是治疗前活检与第4周和eot活检中的肿瘤微环境中的具体细胞表型的密度。在治疗之前,在黑素瘤肿瘤实质中测量cd8+t细胞/mm-2。相较于基线的第4周的增加被认为是阳性反应。次级分析包含(a)第4周与eot活检中的细胞表型的比较,(b)外周血单核细胞(pbmc)之中的表型和血清生物标志物水平的随时间的变化。按需使用t检验和anova/ancova分析正态分布的连续变量。结果为非正态分布的变量通过非参数统计进行分析。对于分类变量,使用费希尔精确检验。派姆单抗的药代动力学评定可以使用多种技术来完成,例如帕特奈克(patnaik)等人(2015),临床癌症研究(clin.cancerres.),21:4286-4293中所述的那些,其全部公开内容由此通过引用具体地并入本文。实例5–生物标志物的测量单标志物和多重免疫荧光(mif)使用halotm空间分析工具分析了单标志物ihc(cd8和颗粒酶b)和多重ihc染色,并对每个样品的整个肿瘤区域进行了评分。(参见彤丝朵(tunstall),“使用halotm空间分析工具量化肿瘤微环境中的免疫细胞分布(quantifyingimmunecelldistributioninthetumormicroenvironmentusinghalotmspatialanalysistools)”,应用说明(applicationnote),7月216,(英迪卡实验室(indicalabs)),2017年11月1日访问,网址为https://thepathologist.com/fileadmin/issues/app_notes/0016-010-halo-app-note.pdf)。另参见雪莉(sherry)等人,“利用多重显色ihc和数字图像分析来评估nsclc肿瘤组织内的免疫细胞含量和空间分布(utilizingmultiplexchromogenicihcanddigitalimageanalysistoevaluateimmunecellcontentandspatialdistributionwithinnsclctumortissue)”,癌症研究(cancerresearch),(2017)77(13),副刊:摘要2937。使用小鼠单克隆抗体(dako目录#m7103,批次#20029542)测量了cd8抗体。按照标准方案使用了徕卡(leica)bondrx自动染色机。对于颗粒酶b,使用了小鼠单克隆抗体(dako#m7235)。按照标准方案使用了徕卡bondrx自动染色机。还使用单标志物ihc测量了cd3、foxp3和ki67。对于cd3,使用了兔多克隆抗体(dako目录#a0452,批次#20020069)。按照标准方案使用了徕卡bondrx自动染色机。对于foxp3,使用了小鼠单克隆抗体(abcam目录#ab20034,批次#gr251424-1)。按照标准方案使用了徕卡bondrx自动染色机。对于ki67,使用了兔单克隆抗体(abcam目录#ab16667,批次#gr266207-2)。按照标准方案使用了徕卡bondrx自动染色机。图7示出了通过halo获得的生物标志物cd8+、cd3+和foxp3的单标志物免疫组织化学(ihc)数据的信号定量。患者评估如图1中所示,用cd8+单标志物ihc染料染色的转移性黑素瘤人肿瘤样本的照片显示,在用x4p-001和派姆单抗的组合给药之后,cd8+t细胞向肿瘤微环境的浸润大大增加。多重免疫荧光(mif)将福尔马林固定石蜡包埋的(ffpe)组织切片在60℃下烘烤1小时。使用徕卡bond试剂进行脱蜡(脱蜡液(dewaxsolution)),抗原修复和抗体剥离(表位修复液2(epitoperetrievalsolution2))并在每个步骤后冲洗(bond洗涤液(bondwashsolution))来将玻片在徕卡bondrx染色机(徕卡,布法罗格罗夫,伊利诺伊州)上脱蜡并染色。在第二和第三应用之后,使用高盐tbst溶液(0.05mtris,0.3mnacl和0.1%吐温-20,ph7.2-7.6)进行高严格洗涤。opal聚合物hrp小鼠加兔(opalpolymerhrpmouseplusrabbit)(珀金埃尔默,霍普金顿,马塞诸塞州)用于所有第二应用。表1:air-5组抗原修复和抗体剥离步骤在100℃下进行,而所有其它步骤都在环境温度下进行。内源过氧化物酶用3%h2o2封闭8分钟,随后用tct缓冲液(0.05mtris,0.15mnacl,0.25%酪蛋白,0.1%吐温20,ph7.6+/-0.1)封闭蛋白质30分钟。首先应用第一一抗(位置1)60分钟,随后应用二抗10分钟,并应用第三tsa扩增试剂(珀金埃尔默opalfluor)10分钟。用修复液剥离一抗和二抗20分钟,然后从新应用3%h2o2开始,用第二一抗(位置2)重复所述过程。重复所述过程,直到完成所有6个位置;但是,在第6位置之后没有剥离步骤。将玻片从染色机上移出,并用spectraldapi(珀金埃尔默)染色5分钟,冲洗5分钟,并用prolonggoldantifade试剂(英杰(invitrogen)/生命科技(lifetechnologies),格兰德艾兰,纽约州)盖于其上。将玻片在室温下固化24小时,然后在珀金埃尔默vectra3.0自动成像系统上获取每个玻片的代表性图像。使用珀金埃尔默inform软件对图像进行光谱解混,然后将其导出为多图像tiff,以在halo软件(英迪卡实验室,科拉莱斯,新墨西哥州)中进行分析。在获取所有荧光图像之后,通过将玻片浸入bond洗涤液中过夜来轻轻地去除盖玻片,然后将湿玻片放置在徕卡bondrx染色机上,以使用徕卡bond聚合物精细检测试剂盒(徕卡#ds9800)进行显色染色;但是,在60分钟一抗温育之前,加入了tct10分钟封闭步骤。用cytosealxyl(理查德-阿兰科技(richard-allanscientific),卡拉马祖,密歇根州)盖在玻片上,并在aperioatturbo扫描显微镜(徕卡生物系统(leicabiosystems),努斯洛赫,德国)上获取20x图像。表2:显色染色然后使用halo图像分析软件(英迪卡实验室,科拉莱斯,新墨西哥州)对图像的细胞分析进行分析。在基于核识别(dapi染色)使细胞可视化之后,所述软件测量每个细胞的估计细胞质区域的荧光强度。使用高于本底的平均强度阈值来确定细胞质内每种荧光色素的阳性,从而针对每种标志物将细胞定义为阳性或阴性。然后使用阳性细胞数据来定义共定位群体并进行最近相邻空间分析。图5显示了#5黑素瘤患者的mif结果的柱状图,其表明用x4p-001治疗增加了tme中cd4、cd8、pd-1和pdl-1阳性细胞的百分比。treg(foxp3+)细胞和巨噬细胞(cd68/cd163+;24.1%对25.4%;未示出)的百分比未改变。将福尔马林固定石蜡包埋的黑素瘤样本依次用6组分免疫表型抗体组(包含cd4、cd8、pd-1、pd-l1、巨噬细胞混合物(cd68+cd163)和foxp3(treg))染色。dapi被用作核复染剂。使用hrp催化的荧光酪酰胺底物(opal,珀金埃尔默)沉积检测抗体。使用光谱成像、自发荧光减除和解混(vectra3.0,珀金埃尔默)获得图像,并使用halotm图像分析软件进行分析。颗粒酶b和cd8+t细胞评定:示出了基线时(图2,图a)以及随后21天的x4p-001治疗(图2,图b)的代表性颗粒酶bihc染色。图2,图c示出了所有可评估样本的颗粒酶b治疗后阳性的倍数变化。使用halotm软件进行定量,并对整个肿瘤区域进行评分。图2,图d示出了x4p-001单剂治疗之前和之后可评估活检的5个患者的颗粒酶brna表达水平。使用如本文所述的纳米链获得图d中的rna表达数据。单患者的cd8+ihc染色图4示出了用x4p-001给药之前和之后的#5患者的mifcd8染色结果。在给药之后,cd8表达明显增加。使用纳米链的生物标志物研究材料和方法ffpe基因表达分析:对于每种基因生物标志物,使用快而精(qiagen)的allprep试剂盒(目录号80234)从ffpe玻片提取rna,并使用具有pancancer免疫探针组的纳米链ncounter平台进行分析。使用30个管家基因的几何平均值对原始计数进行标准化,并将来自两组的标准化数据合并并使用nsolver软件(版本4.0)进行分析。干扰素基因标签基于艾尔斯等人(jci2017)并以以下方式计算。对于每个患者(pt)样本,从六个基因(ifn-γ、cxcl9、cxcl10、hla-dra、ido1、stat1)的标准化计数计算几何平均值,然后将平均值进行log10转换以生成基因表达评分。图6示出了在用x4p-001给药之前和之后的干扰素γ(ifn-γ)基因标签的基因表达评分。从ifn-γ、cxcl9、cxcl10、hla-dra、ido1和stat1标准化计数的几何平均值计算每个患者样本的基因评分。将平均值进行log10转换以生成基因表达评分。五个患者中的每一个患者的基因表达评分均升高。通过取每个基因集的标准化计数的几何平均值的log10以生成“基因标签评分”来从18个基因计算肿瘤炎症标签(tis)。参见例如里吉e(righie)、柏木s(kashiwagis)、袁j(yuanj)等人,“cxcl12/cxcr4阻断诱导了延长卵巢癌免疫感受态小鼠模型的生存期的多模态抗肿瘤作用(cxcl12/cxcr4blockadeinducesmultimodalantitumoreffectsthatprolongsurvivalinanimmunocompetentmousemodelofovariancancer)”,癌症研究(cancerres),2011;71(16):5522-5534。结果x4p-001增加了ifn-γ基因表达标签:使用从ffpe玻片提取的rna,利用pancancer免疫探针组进行纳米链ncounter分析。使用管家基因的几何平均值对原始计数进行标准化。通过基本上如艾尔斯(2017)等人,临床研究杂志(j.clin.invest.),127:2930-2940所述的程序来评定干扰素-γ基因标签评分。x4p-001增加了ctl基因表达标签:ctl基因表达标签包含cd8a、cd8b、fltlg、gzmm和prf1的表达。为了进行ctl标签测量,使用快而精的allprep试剂盒从ffpe玻片提取rna,并使用具有pancancer免疫探针组的纳米链ncounter平台进行分析。使用管家基因的几何平均值对原始计数进行标准化。纳米链ncounter验证在马尔科夫(malkov)等人(2009),bmc研究笔记(bmcresearchnotes),2:80;2017年11月2日访问,网址为https://bmcresnotes.biomedcentral.com/articles/10.1186/1756-0500-2-80;瓦戈特(waggott)等人(2012),生物信息学(bioinformatics),28:1546-1548中描述;另参见由纳米链公司(nanostringinc.)出版的分析系统用户手册(2015年7月),2017年11月2日访问,网址为https://www.nanostring.com/application/files/7114/8942/6665/man-c0035-05_ncounter_analysis_system_gen2.pdf。图3示出了用x4p-001给药之前和之后的细胞毒性t淋巴细胞(ctl)基因标签的基因表达评分。从cd8a、cd8b、fltlg、gzmm和prf1标准化计数的几何平均值计算每个患者样本的基因评分。将平均值进行log10转换以生成基因表达评分。五个患者中的每一个患者的基因表达评分均升高。x4p-001对cd8a、cd8b、颗粒酶b基因和foxp3的作用:使用类似于上述方法的提取和纳米链ncounter方法,观察到cd8a和cd8b表达增加;颗粒酶b表达增加;和相似或不变的foxp3水平。实例6–恶性黑素瘤患者的九周单一疗法和组合疗法研究及生物标志物的测量临床方案总共十六(16)个患者参加了对照研究。研究群体包含患有经组织学证实的恶性黑素瘤的成年男性和女性受试者(≥18岁)。进一步要求受试者具有至少两(2)处不同的皮肤或皮下病变,以适合于打孔活检(≥3mm)。如果受试者的东部肿瘤协作组(ecog)表现评分为二(2)或更高,则将受试者排除在外。如果受试者先前接受过检查点抑制剂疗法(例如,抗ctla-4、pd-1、pd-l1)或溶瘤病毒疗法,则进一步排除受试者。排除患有进行性hiv、丙型肝炎或无法控制的感染的受试者以及在过去六(6)个月内患有心肌梗塞、三(3)级或更高级出血、慢性肝脏疾病或其它活动性恶性肿瘤的受试者。首先筛选受试者并评估基线测量。纳入的参与者接受治疗一周期,所述周期涉及包括x4p-001单一疗法的第一时期和包括x4p-001和检查点抑制剂组合疗法的第二时期。研究的给药时间表总结在图8中。在治疗之前,从每个患者收集两(2)个基线血清样本。在筛选时收集一个基线血清样本,并且在一到四周后治疗的第1天在施用第一剂x4p-001之前收集另一个基线血清样本。除了基线血清样本之外,在施用x4p-001之前,在d1从每个患者收集基线打孔活检。从第1天开始,受试者口服接受400mgx4p-001,q.i.d.。一个患者口服接受200mg,b.i.d.。在整个为期九(9)周的研究中,向患者施用x4p-001。在开始治疗三(3)周后,从每个患者收集另外的血清样本。除非主治医师建议不要进行活检,否则还收集另外的活检样本。在样本收集之后,向受试者施用两剂派姆单抗中的第一剂(2mg/kg,i.v.)。在施用第一剂派姆单抗三(3)周后(从治疗开始六周),从每个患者收集另外的血清样本。然后向受试者施用第二剂派姆单抗(2mg/kg,i.v.)。在施用第二剂派姆单抗三(3)周后(从治疗开始九周),收集另外的血清样本。除非主治医师建议不要进行活检,否则还收集另外的活检样本。多重免疫荧光将从黑素瘤患者获得的肿瘤样本按照已知程序进行福尔马林固定和石蜡包埋(ffpe)。将ffpe组织切片在60℃下烘烤1小时。使用徕卡bond试剂进行脱蜡(脱蜡液),抗原修复和抗体剥离(表位修复液2)并在每个步骤后冲洗(bond洗涤液)来将玻片在徕卡bondrx染色机(徕卡,布法罗格罗夫,伊利诺伊州)上脱蜡并染色。在第二和第三应用之后,使用高盐tbst溶液(0.05mtris,0.3mnacl和0.1%吐温-20,ph7.2-7.6)进行高严格洗涤。使用halotm空间分析工具分析了多重ihc染色,并对每个样品的整个肿瘤区域进行了评分。(参见彤丝朵,“使用halotm空间分析工具量化肿瘤微环境中的免疫细胞分布(quantifyingimmunecelldistributioninthetumormicroenvironmentusinghalotmspatialanalysistools)”,应用说明(applicationnote),7月216,(英迪卡实验室(indicalabs)),2017年11月1日访问,网址为https://thepathologist.com/fileadmin/issues/app_notes/0016-010-halo-app-note.pdf)。另参见雪莉等人,癌症研究(cancerresearch),77(13),副刊:摘要2937(2017)。在多轮热诱导表位修复之后,用多个抗体组对玻片进行顺序染色,并通过抗体结合含hrp聚合物与荧光酪酰胺底物(opal,珀金埃尔默)进行检测。dapi被用作核复染剂。使用光谱去卷积和自发荧光减除(vectra3.0,珀金埃尔默)对具有光谱重叠的荧光色素进行成像。使用aperio-fl系统(徕卡生物系统)对全玻片扫描进行成像,然后转移到halo中进行定量数字图像分析。在基于核识别(dapi染色)使细胞可视化之后,所述软件测量每个细胞的估计细胞质区域的荧光强度。使用高于本底的平均强度阈值来确定细胞质内每种荧光色素的阳性,从而针对每种标志物将细胞定义为阳性或阴性。然后使用阳性细胞数据来定义共定位群体并进行最近相邻空间分析。使用表3和4中列出的抗体对cd4、cd8、pd-1、pd-l1、cd163/cd68(巨噬细胞)、foxp3、ki-67和黑素瘤细胞进行染色。opal聚合物hrp小鼠加兔(珀金埃尔默,霍普金顿,马塞诸塞州)用于所有第二应用。表3:细胞标志物可视化抗体表4:ifx4p-001单剂治疗之后的foxp3和cd8t细胞比在多轮热诱导表位修复之后,用六(6)种抗体对x4p-001单一疗法后收集的活检样本进行染色,以检测cd8、foxp3、pd-l1、pd-1、黑素瘤细胞和cd4。代表性cd8和foxp3染色在图9,图a和b中示出。图a示出了整个活检样本的低倍扫描。白框指示图b中放大的区域。图b示出了相同的活检样本的光谱解混高倍图像。cd8表现为洋红色;foxp3表现为红色;pd-l1表现为绿色;pd-1、黑素瘤细胞和cd4未示出。图10示出了黑素瘤患者2、3、5、8和9的mif结果的线图,其表明用x4p-001治疗增加了肿瘤微环境中(tme)的cd8+细胞相对于treg细胞(foxp3+)的百分比。x4p-001治疗之后tme中的增殖t细胞密度用三(3)种抗体对来自第1天、第4周和治疗结束(eot)的活检样本进行染色,以检测cd8、黑素瘤细胞和增殖细胞。dapi被用作核复染剂。来自患者5的给药前活检的代表性cd8、ki67和黑素瘤细胞染色在图11,图1a和1b中示出。图1a示出了整个活检样本的低倍扫描。图1b示出了浸润前沿的光谱解混高倍图像。cd8表现为绿色;黑素瘤细胞表现为黄色;ki67表现为蓝色。图12示出了来自患者5的整个活检样本中的cd8+t细胞密度和增殖cd8+t细胞(ki67+)密度的柱状图。单一疗法增加了两个细胞群的密度,对增殖t细胞具有更强的影响。治疗结束时的cd8+ki67+t细胞的缺乏与治疗之后患者5中不存在残留肿瘤块相一致(参见图15)。cd8+t细胞浸润到黑素瘤病变中在图13(第1天)、图14(第4周)和图15(治疗结束)中示出了cd8+t细胞和其最近的黑素瘤相邻细胞之间的代表性距离测量。使用荧光玻片扫描仪(aperio-fl,20x物镜)进行全玻片扫描。将图像导入halo进行数字图像分析。图像代表来自最近相邻分析模块的图形输出,从而计算最近的cd8到肿瘤细胞(蓝线)、cd8(绿色)、黑素瘤(黄色)、ki67(红色)、ki67+cd8+t细胞(黑色)。第1天的cd8+t细胞和最近的肿瘤细胞之间的平均距离为95微米。在x4p-001单一疗法4周之后,本距离减小到43微米。此外,唯一相邻的数量从3,826增加到5,239,表明cd8+t细胞浸润增强。在双重x4p-001/派姆单抗治疗结束时,没有残留的肿瘤(图15)。图28和图29示出了多重ihc和halo图像数据,其表明x4p-001单一疗法增加了黑素瘤患者中肿瘤界面处的cd8+细胞密度。对具有正常组织的肿瘤边界内部或外部100μm之内的cd8标记细胞进行计数。相对于距边界的距离以25μm谱带绘制cd8+细胞数/mm2。在x4p-001单一疗法3周之后,边界区域内的cd8+细胞的总密度相较于基线增加四倍。表5图30示出了ihc数据,其表明了组合治疗(x4p-001和派姆单抗)之后肿瘤-正常细胞界面处的免疫细胞改变。在基线时(顶行)和x4p-001单一疗法结束时(底行)获得活检样本。左列示出了具有正常组织(外线)和肿瘤边界(内线)轮廓的活检样本。中间列示出了来自左列的放大框区域,用cd163、cd206、vista、cox-2、cd3、b7h3和dapi染色。右列含有中间图中的框选区域的更高放大率的视图。x4p-001导致肿瘤边界内的cd3+细胞数量增加以及vista(一种抑制t细胞活化和增殖的检查点分子)的表达降低。表6使用纳米链的生物标志物研究对于每种基因生物标志物,使用快而精(qiagen)的allprep试剂盒(目录号80234)从ffpe玻片提取rna,并使用具有pancancer免疫探针组的纳米链ncounter平台进行分析。如上所述,使用管家基因的几何平均值对原始计数进行标准化。通过取十八(18)个基因(b2m、cd74、ctsl、ctss、hla-dma、hla-dmb、hla-dob、hla-dpa1、hla-dpb1、hla-dqa1、hla-dqb1、hla-dra、hla-drb1、hla-drb3、psmb8、psmb9、tap1和tap2)的标准化计数的几何平均值并且然后将平均值进行log10转换以生成基因表达评分来计算抗原呈递/加工基因标签。表7总结了患者2、3、5、8和9的治疗前和x4p-001后的log10转换几何基因计数方式。图16总结了每个患者的相较于x4p-001给药之前和之后的基因表达评分升高。表7:患者抗原呈递/加工基因表达评分通过取十八(18)个基因(ccl5、cd27、cd274、cd276、cd8a、cmklr1、cxcl9、cxcr6、hla-dqa1、hla-drb1、hla-e、ido1、lag3、nkg7、pdcd1lg2、psmb10、stat1和tigit)的标准化计数的几何平均值并且然后将平均值进行log10转换以生成基因表达评分来计算肿瘤炎症标签。表8总结了患者2、3、5、8和9的治疗前和x4p-001后的log10转换几何基因计数方式。图17总结了每个患者的相较于x4p-001给药之前和之后的基因表达评分升高。表8:患者肿瘤炎症标签基因表达评分患者给药前评分x4p-001后评分22.1232.22532.6472.79852.8713.25782.5082.83492.2332.597实例7–b16-ova同基因黑素瘤研究x4p-001单一疗法和组合疗法对肿瘤大小的影响将b16-ova细胞(~1x105)植入c57bl/6小鼠中。定期评估动物,并且当肿瘤的大小达到大约3mmx3mm时,将动物随机分组并治疗十六(16)天。表9总结了所使用的动物治疗。表9:同基因肿瘤模型中的治疗方案在治疗结束时,处死动物并解剖以评估和取样肿瘤肥大细胞。图18、19和20总结了肿瘤体积的变化。图21提供了对肿瘤解剖的描绘。尽管x4p在整个研究过程中显著减小了肿瘤体积,但与抗pd-1、抗pf-l1和抗ctcl-4+抗pd-l1的组合大大增强了肿瘤体积的减小。外周白细胞计数在治疗之前收集来自植入b16-ova肿瘤的c57bl/6小鼠的血清样本,并对外周白细胞进行计数。然后向小鼠注射媒剂或100mg/kgx4p-001,并且在注射后两小时收集第二血清样本,并再次对白细胞进行计数。图22总结了结果。相对于对照,x4p-001增加了外周白细胞的数量。tme中的免疫表型的调节通过用胶原酶治疗并使用流式细胞仪分析各种免疫细胞群来从肿瘤组织制备单细胞混悬液。细胞表面标志物包含cd3、cd8、穿孔素、cd15cd11b(mdsc)和foxp3(treg)。图23总结了tme免疫细胞表型的变化。相对于对照,x4p-001增加了tme中的淋巴细胞和cd8+t细胞的总数量。与抗pd-1的组合疗法的增强作用更大。重要的是,x4p-001单一疗法或与抗pd-1的组合疗法并未导致抑制细胞(treg和mdsc)的增加,而是大大减少了抑制细胞计数。用单一疗法或组合疗法治疗的肿瘤细胞的蛋白质印迹分析收集肿瘤组织,在液态n2中快速冷冻并根据已知方法溶解。对蛋白质的量进行标准化(例如,bca测定)并通过凝胶电泳分离。然后将蛋白质转移到膜上进行印迹。图24总结了hif-2α表达和akt活化的结果。图25总结了p21和p27诱导以及细胞周期素d1表达降低的结果。实例9–体外机械实验经由hif-2α反应元件的转录活化和浸润/迁移的抑制将常氧和低氧条件下的b16-ova细胞用phre-luc和prl-luc瞬时转染。然后将转染细胞与不同浓度(10nm到10μm)的x4p-001或对照一起温育。使用双重荧光素酶测定试剂盒测量每种条件下的细胞的荧光素酶活性。图26总结了荧光素酶测定的结果。使用transwell基质胶浸润小室来评定x4p-001对b16-ova细胞浸润的作用。根据制造商的指示准备基质胶插入物和配套板。将b16-ova细胞加入到具有x4p-001(0μm,7.5μm或15μm)(有或没有1ng/mlsdf-1a)的小室中将基质胶浸润小室在37℃,5%co2气氛下温育22小时。然后从上表面擦掉非浸润细胞。将下表面上的细胞固定并染色,并对细胞进行计数。通过确定基质胶插入膜和对照插入膜之间的浸润细胞比来计算浸润百分比。图27总结了细胞浸润测定的结果。参考文献1、拉塔伊恰克(ratajczak)等人,sdf-1-cxcr4轴在器官发生、再生和肿瘤发生中的多效性作用(thepleotropiceffectsofthesdf-1–cxcr4axisinorganogenesis,regeneration,andtumorigenesis),白血病(leukemia),2006:20;1915-1924。2、斯卡拉(scala)等人,cxcr4的表达预示了恶性黑素瘤患者的预后不良(expressionofcxcr4predictspoorprognosisinpatientswithmalignantmelanoma),临床癌症研究(clincancerres),2005:11;1835-1841。3、丰泽(toyozawa)等人,趋化因子受体cxcr4是皮肤恶性黑素瘤进展的新标志物(chemokinereceptorcxcr4isanovelmarkerfortheprogressionofcutaneousmalignantmelanoma),组织化学与细胞化学学报(actahistochemcytochem),2012;45:293-299。4、金(kim)等人,cxcr4信号传导通过淋巴转移微环境调节化疗耐药性黑素瘤细胞的转移(cxcr4signalingregulatesmetastasisofchemoresistantmelanomacellsbyalymphaticmetastaticniche),癌症研究(cancerres),2010;70:10411-10421。5、摩斯rm(mosirm)、阿纳斯塔索娃v(anastassovav)、考克斯j(coxj)等人,amd11070的分子药理学:一种口服生物可利用的cxcr4hiv进入抑制剂(themolecularpharmacologyofamd11070:anorallybioavailablecxcr4hiventryinhibitor),生物化学药理学(biochempharmacol),2012;83:472–479。6、德阿尔泰里奥(d'alterio)等人,基质cxcr4的抑制减少了肺转移的发生(inhibitionofstromalcxcr4impairsdevelopmentoflungmetastases),癌症免疫学与免疫治疗(cancerimmunolimmunother),2012:61;1713-1720。7、菲戈(feig)等人,从fap表达癌症相关纤维母细胞靶向cxcl12与抗pd-l1免疫疗法协同治疗胰腺癌(targetingcxcl12fromfap-expressingcarcinoma-associatedfibroblastssynergizeswithanti-pd-l1immunotherapyinpancreaticcancer),美国国家科学院院刊(pnas),2013;110:20212-20217。8、张(zhang)等人,cxcr4和cxcl12优先参与t细胞向黑素瘤细胞的迁移(preferentialinvolvementofcxcr4andcxcl12intcellmigrationtowardmelanomacells),癌症生物学与治疗(cancerbiolther),2006;5:1034-1312。9、斯通(stone)等人,选择性cxcr4受体抑制剂口服amd070在人类受试者中的安全性、药代动力学和生物活性的多剂量递增研究(multiple-doseescalationstudyofthesafety,pharmacokinetics,andbiologicactivityoforalamd070,aselectivecxcr4receptorinhibitor,inhumansubjects),抗菌剂与化学疗法(antimicrobagentschemother),2007;51(7):2351–2358。10、莫伊尔(moyle)等人,亲cxcr4性hiv1型的口服生物可利用的抑制剂amd11070的活性证明(proofofactivitywithamd11070,anorallybioavailableinhibitorofcxcr4-tropichivtype1),临床传染病(clininfectdis),2009;48:798–805。11、罗伯特(robert)等人,派姆单抗与依匹单抗治疗晚期黑素瘤(pembrolizumabversusipilimumabinadvancedmelanoma),新英格兰医学杂志(nengljmed),2015;372:2521-2532。12、图梅(tumeh)等人,pd-1阻断通过抑制适应性免疫抵抗诱导反应(pd-1blockadeinducesresponsesbyinhibitingadaptiveimmuneresistance),自然(nature),2014:515;568-571。13、塔尔西尼(tarhini)等人,对接受新辅助药物依匹单抗的局部晚期黑素瘤患者的血液循环和肿瘤微环境的免疫监测(immunemonitoringofthecirculationandthetumormicroenvironmentinpatientswithregionallyadvancedmelanomareceivingneoadjuvantipilimumab),公共科学图书馆·综合(plosone),2014;9(2):e87705。14、纽恩特(nyunt)等人,口服cxcr4拮抗剂amd070在健康志愿者中对cyp3a4和cyp2d6底物咪达唑仑(midazolam)和右美沙芬(dextromethorphan)的药代动力学作用(pharmacokineticeffectofamd070,anoralcxcr4antagonist,oncyp3a4andcyp2d6substratesmidazolamanddextromethorphaninhealthyvolunteers),获得性免疫缺陷综合征杂志(jacquirimmunedeficsyndr),2008;47:559-565。15、曹(cao)等人,低剂量利托那韦(ritonavir)在健康志愿者中对cxcr4拮抗剂amd070的药代动力学作用(effectoflow-doseritonavironthepharmacokineticsofthecxcr4antagonistamd070inhealthyvolunteers),抗菌剂与化学疗法(antimicrobagentschemother),2008;52:1630-1634。16、不良事件的通用术语标准(commonterminologycriteriaforadverseevents)(ctcae),4.0版本,2009年5月28日,美国卫生与公众服务部,国立卫生研究院,国家癌症研究所,nih出版物编号03-5410。17、ncictcaev4.03,2010年6月14日,可见于(2015年4月6日访问):http://evs.nci.nih.gov/ftp1/ctcae/ctcae_4.03_2010-06-14_quickreference_5x7.pdf18、wma赫尔辛基宣言——涉及人类的医学研究的伦理原则(wmadeclarationofhelsinki–ethicalprinciplesformedicalresearchinvolvinghumansubjects),可见于(2015年4月6日访问)http://www.wma.net/en/30publications/10policies/b3/19、万哈兰塔(vanharanta)等人,vhl-hif信号输出的表观遗传扩展驱动肾癌的多器官转移(epigeneticexpansionofvhl-hifsignaloutputdrivesmultiorganmetastasisinrenalcancer),自然医学(natmed),2013;19:50-6。20、戈尔(gale)和麦考尔(mccoll),趋化因子:所有场合下的细胞外信使?(chemokines:extracellularmessengersforalloccasions?),生物短评(bioessays),1999;21:17-28。21、海菲尔(highfill)等人,cxcr2介导的mdsc肿瘤移动的破坏增强了抗pd1的功效(disruptionofcxcr2-mediatedmdsctumortraffickingenhancesanti-pd1efficacy),科学转化医学(scitranslmed),2014;6:ra67。22、法希布尼(facciabene)等人,肿瘤缺氧经由ccl28和treg细胞促进了耐受性和血管生成(tumourhypoxiapromotestoleranceandangiogenesisviaccl28andtregcells),自然(nature),2011;475:226-230。23、蒙塔耐(montane)等人,通过ccl22介导的treg募集到胰岛来预防鼠自身免疫性糖尿病(preventionofmurineautoimmunediabetesbyccl22-mediatedtregrecruitmenttopancreaticislets),临床研究杂志(jclininvest),2011;121:3024-8。24、阿查里亚(acharyya)等人,cxcl1旁分泌网络将癌症化疗耐药性和转移联系在一起(cxcl1paracrinenetworklinkscancerchemoresistanceandmetastasis),细胞(cell),2012;150:165-78。25、赵(zhao)等人,tnf信号传导驱动了髓源性抑制细胞蓄积(tnfsignalingdrivesmyeloid-derivedsuppressorcellaccumulation),临床研究杂志(jclininvest),2012;122:4094-4104。26、席尔瓦(silva)等人,通过多重rna1筛选来分析人乳腺细胞中的必需基因(profilingessentialgenesinhumanmammarycellsbymultiplexrna1screening),科学(science),2008;319:617-20。27、施拉巴赫(schlabach)等人,通过功能基因组学的癌症增殖基因发现(cancerproliferationgenediscoverythroughfunctionalgenomics),科学(science),2008;319:620-24。28、沈(shen)等人,cxcr4介导的stat3活化对于cxcl12诱导的膀胱癌浸润至关重要(cxcr4-mediatedstat3activationisessentialforcxcl12-inducedinvasioninbladdercancer),肿瘤生物学(tumourbiol),2013;34:1839-45。29、艾尔斯(ayers)等人,ifn-γ相关mrna谱预测对pd-1阻断的临床反应(ifn-γ-relatedmrnaprofilepredictsclinicalresponsetopd-1blockade),临床研究杂志(journalofclinicalinvestigation),2017,127(8),2930-2940。30、夏尔马,p(sharma,p)等人,对癌症免疫治疗的原发性、适应性和获得性抗性(primary,adaptive,andacquiredresistancetocancerimmunotherapy),细胞(cell),2017,168,707-723。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1