一种禾谷镰刀菌单链环状DNA病毒FgGMTV1/HB58侵染性克隆的构建方法与流程
本发明涉及禾谷镰刀菌防治技术领域,特别是涉及一种禾谷镰刀菌dna病毒侵染性克隆的构建方法。
背景技术:
禾谷镰刀菌(fusariumgraminearumschw.)是镰刀菌中重要的一个种,能引起田间禾本科作物病害。如有小麦赤霉病。侵染麦粒或玉米后,生出白色絮状或绒状菌丝,后呈白色至玫瑰色、白色至粉红色或白色至砖红色。有性态为gibberellazeaeschw.petch属半知菌亚门真菌。无性态属子囊菌亚门真菌。在培养基中白色气生菌丝茂密,基内菌丝分泌红褐色色素。生活史包括有性世代和无性世代。有性世代产生子囊壳,梨形有口。棒状子囊丛生与子囊壳,每个子囊里有八个子囊孢子,子囊孢子纺锤形,通常有三个隔膜。无性世代产生分生孢子,呈镰刀状,通常有三到五个隔膜。
禾谷镰刀菌的寄主范围广泛,可侵染谷类作物小麦、大麦和玉米,并且可以分泌一些毒素物质——单端孢霉烯族毒素(trichothecenes)和雌激素类真菌毒素(oestrogenicmycotoxin)、玉米赤霉烯酮(zearelanone),含有一定水平毒素的谷物被人畜使用后会引起明显的中毒症状,包括恶心、呕吐甚至流产等。近年来,不同地区和不同品种上引起麦类赤霉病的优势种为禾谷镰刀菌(fusariumgraminearumschw)目前,禾谷镰刀菌引起的麦类赤霉病的防治主要以化学防治为主,多使用广谱性杀菌剂如阿米西达、噻菌灵和多菌灵等。化学药剂对赤霉病的防治效果较差,难以挽回损失。在发病严重的田块,会引起大量的减产。而大剂量频繁使用化学农药又会对自然环境包括土壤、地下水等造成严重的污染。药物残留会随着食物链逐渐聚集到人体内。土壤和地下水的污染会造成自然环境的不断恶化,影响人类的生存条件。第二种防治方法主要为农事管理。如要轮作栽培,防止因连作引起病原菌的积累。进行土壤、栽培基质消毒;栽培时发现病株应及时拔除并销毁,减少病菌的进一步扩散。还有掌握好植株栽培密度,加强通风透气,降低湿度,控制好土壤或基质的含水量,宜选用排水良好的基质。这些措施能够一定程度的防治赤霉病的大爆发及流行。
防治小麦赤霉病害比较有效的办法为培育抗病品种。但截至目前,还没有商品化的完全抗病或完全免疫的小麦品种。小麦对赤霉病的抗性分为五类,分别为一型抗侵入、二型抗扩展、三型抗毒素积累、四型籽粒抗侵染及五型耐病型五个类型。目前,单基因转化小麦培育转基因小麦品种在技术上已经能够实现。将一些已经鉴定的抗赤霉病基因转入优良小麦品种中能够有效的提高对赤霉病的抗性。小麦等寄主抗赤霉病基因鉴定数量有限限制了抗病品种的培育。已鉴定的抗性基因包括葡聚糖酶和几丁质酶等降解酶以及一些甜蛋白和阻碍脱氧雪腐镰刀菌烯醇聚集的蛋白。
真菌病毒存在于所有的主要类群真菌中。自1962年第一例真菌病毒被报道以后,大量的真菌病毒被发现并研究。但是真菌病毒的研究还没有得到足够的重视,并且表现出一定的滞后性。主要原因包括,第一,真菌病毒侵染不表现出明显的症状,不容易被学者所发掘和重视,而且多数真菌学家在接触到菌落异常的菌株时往往忽略是由于真菌病毒侵染导致的。第二,研究真菌病毒的病毒学家比较少。当前的研究热点主要集中在能减弱寄主致病性的真菌病毒,探索这些病毒的复制机制、蛋白功能以及在农业真菌病害生物防治上的应用。至今为止的真菌病毒系统中,仅栗疫菌低毒病毒chv1/ep713被成功用于生物防治,它在意大利发现及应用,拯救了因栗疫病危害而濒临绝灭的欧洲栗树林,另外核盘菌低毒衰退相关dna病毒1(sshadv-1)也成功地应用于生物防治,能有效降低油菜菌核病的发病程度,具有明显的防病效果。现阶段植物真菌病害的防治是一个难题,随着化学农药的大量施用,在病害防治的同时给环境造成巨大的污染,包括土壤污染、食品污染、大气污染和水污染。真菌病毒作为一项生物防治资源,将会为真菌病害的防治提供一个新的途径。
技术实现要素:
本发明的目的是提供一种禾谷镰刀菌单链环状dna病毒fggmtv1及其在减弱禾谷镰刀菌致病性方面的应用
为实现上述目的,本发明采用的技术方案具体如下:
禾谷镰刀菌hb58菌株,含有上述的禾谷镰刀菌单链环状dna病毒fggmtv1。该菌株从河北省发生赤霉病的小麦穗上分离,并于2019年1月15日送至中国微生物菌种保藏管理委员会普通微生物中心(cgmcc)保存,保藏编号为:cgmccno.17181,保藏地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
一种禾谷镰刀菌单链dna病毒fggmtv1/hb58侵染性克隆的构建方法,其中,所述病毒fggmtv1/hb58包含两个单链环状dna分子dna-a和dna-b,其基因组序列如seqidno:1-2所示;且不含有单链环状dna分子dna-c,其基因组序列如seqidno:3所示;
所述构建方法包括dna-a侵染性克隆构建、dna-b侵染性克隆构建及dna-c侵染性克隆构建。
其中,所述dna-a侵染性克隆构建的具体步骤包括:提取禾谷镰刀菌株hb58中fggmtv1/hb58的病毒粒子,从病毒粒子中提取核酸,对提取的核酸进行rca滚环扩增反应,用ecori和kpnⅰ限制性内切酶进行消化,获得两端带ecori酶切位点的长大约1.3kb的片段,然后连接到用ecori消化的pbluescriptⅱsk(+)(psk)载体上,形成带有一个拷贝dna-a分子的重组载体psk-1a,阳性克隆送公司测序,确认rca反应没有引入突变;然后,测序正确的psk-1a重组载体用ecori限制性内切酶消化后重新连接到用ecori消化的psk载体上,形成带有两个拷贝dna-a的重组载体psk-2a,阳性重组载体用限制性内切酶消化的方式来验证插入片段的方向。
其中,所述dna-b侵染性克隆构建的具体步骤包括:提取禾谷镰刀菌株hb58中fggmtv1/hb58的病毒粒子,从病毒粒子中提取核酸,对提取的核酸进行rca滚环扩增反应,用ecori和speⅰ限制性内切酶进行消化,获得两端带ecori酶切位点的长大约1.3kb的片段,然后连接到用ecori消化的pbluescriptⅱsk(+)(psk)载体上,形成带有一个拷贝dna-b分子的重组载体psk-1b,阳性克隆送公司测序,确认rca反应没有引入突变;然后,测序正确的psk-1b重组载体用ecori限制性内切酶消化后重新连接到用ecori消化的psk载体上,形成带有两个拷贝dna-b的重组载体psk-2b,阳性重组载体用限制性内切酶消化的方式来验证插入片段的方向。
其中,所述dna-c侵染性克隆构建的具体步骤如下:提取禾谷镰刀菌株hb58中fggmtv1/hb58的病毒粒子,从病毒粒子中提取核酸,对提取的核酸进行rca滚环扩增反应,用xbaⅰ限制性内切酶进行消化,获得两端带xbaⅰ酶切位点的长大约1.3kb的片段,然后连接到用xbaⅰ消化的pbluescriptⅱsk(+)(psk)载体上,形成带有一个拷贝dna-c分子的重组载体psk-1c,阳性克隆送公司测序,确认rca反应没有引入突变;然后,测序正确的psk-1c重组载体用xbaⅰ和claⅰ限制性内切酶消化后重新连接到用xbaⅰ和claⅰ消化的psk载体上,形成带有0.6个拷贝dna-c的重组载体psk-0.6c,然后psk-1c重组载体用xbaⅰ消化后获得单拷贝dna-c后再次连接到psk-0.6c重组载体的xbaⅰ位点,获得含有1.6个拷贝dna-c的重组载体psk-1.6c,阳性重组载体用限制性内切酶消化的方式来验证插入片段的方向。
本发明的禾谷镰刀菌单链dna病毒fggmtv1/hb58侵染性克隆的构建方法的有益效果在于:构建该侵染性克隆只需要使用一个细菌克隆载体pbluescriptⅱsk(+)进行克隆和转染真菌即可成功,简化了克隆和转染步骤,不需要多次pcr克隆,不需要多个克隆载体和转染载体,也不需要克隆到双元表达载体上即可完成转染。同时这是国际上首次对真菌dna病毒进行侵染性克隆构建,为今后国际同行对dna真菌病毒的研究提供了重要参考。
下面结合附图说明和具体实施例对本发明所述的禾谷镰刀菌单链dna病毒fggmtv1/hb58侵染性克隆的构建方法作进一步说明。
附图说明
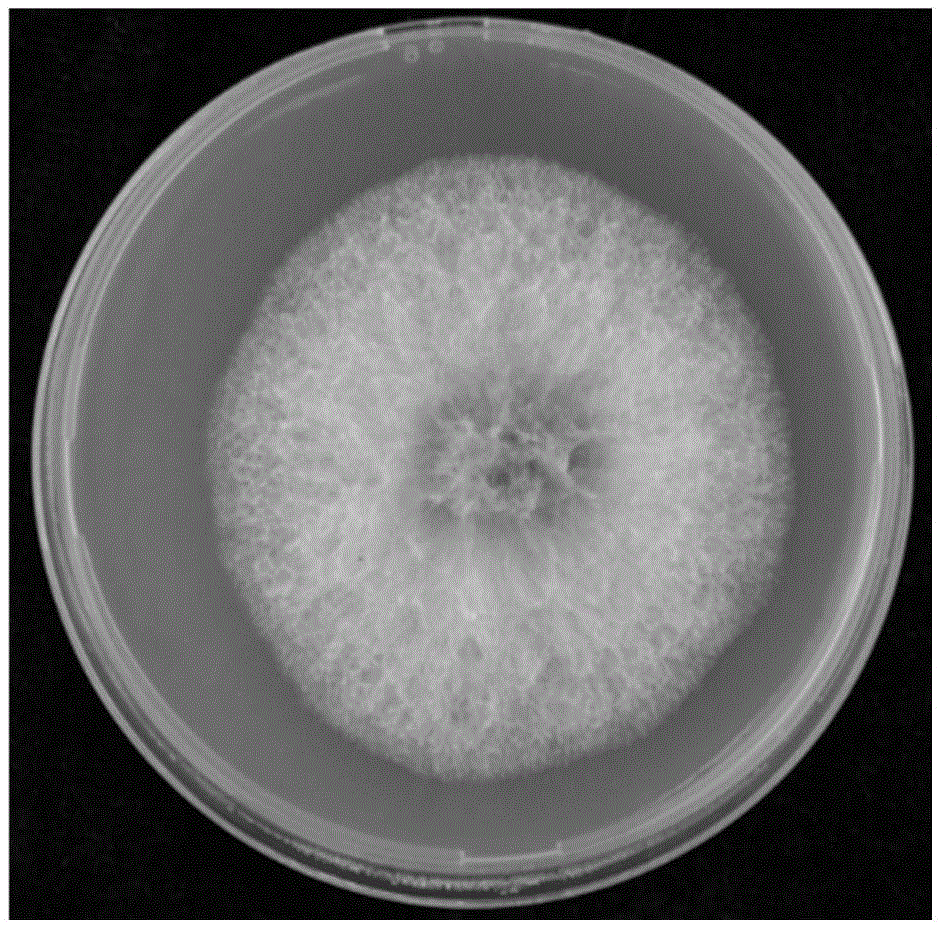
图1为本发明中禾谷镰刀菌菌株hb58的菌落形态图;25℃、黑暗、倒置培养3天;
图2为本发明中菌株hb58提取病毒的fggmtv1/hb58病毒粒子的电镜观察;病毒粒子直径均为19–21nm,图中标尺为50nm;
图3为本发明中菌株hb58提取的fggmtv1/hb58病毒粒子提取核酸的电泳观察;泳道1,dnamarker;泳道2,fggmtv1/hb58病毒粒子中提取的核酸,在1.3kb处有一条亮带;
图4为本发明中菌株hb58提取的fggmtv1/hb58病毒粒子提取的核酸用核酸酶消化的电泳观察;泳道1,dnamarker;泳道2,dnaseⅰ消化后产物;泳道3,exonucleaseⅲ消化后产物;泳道4,s1nuclease消化后产物;泳道5,exonucleaseⅰ消化后产物;
图5为本发明中菌株hb58提取的fggmtv1/hb58病毒粒子提取结构蛋白的电泳观察;泳道1,proteinmarker;泳道2,fggmtv1/hb58病毒粒子中提取的结构蛋白,一共有三条蛋白条带;
图6为本发明中菌株hb58提取的病毒fggmtv1/hb58的基因组结构,该病毒共包含三个单链环状dna分子片段(dna-a,dna-b和dna-c),dna-a包含一个orf,编码复制起始蛋白(replicationinitiationprotein,rep),dna-b包含一个orf,编码外壳蛋白(coatprotein,cp),dna-c包含一个orf,编码一个未知功能蛋白p26,dna-a和dna-b包含相同的茎环结构,dna-c包含一个不同的茎环结构,三个单链环状dna分子同时包含两个共同区域(cr-m和cr-sl);
图7为本发明中菌株hb58和fggmtv1/hb58病毒粒子提取的核酸的southern杂交结果;probea是地高辛标记的与dna-a环状分子特异的359bp的dna探针,probeb是地高辛标记的与dna-b环状分子特异的335bpdna探针,probec是地高辛标记的与dna-c环状分子特异的326bpdna探针,ocdsdna指dna的双链开环构型,scdsdna指dna的超螺旋构型,circularssdna指单链环状dna构型;
图8为本发明中菌株hb58提取的病毒fggmtv1/hb58的三个基因组片段侵染性克隆构建策略;psk-2a是包含两个拷贝dna-a分子的pbluescriptiisk(+)(psk)重组载体,psk-2b是包含两个拷贝dna-b分子的pbluescriptiisk(+)重组载体,psk-1.6c是包含1.6个拷贝dna-c分子的pbluescriptiisk(+)重组载体;
图9为野生菌株ph-1和转染子菌株s、a、b、c、a+b、a+c、b+c、a+b+c和virion的southern杂交结果;菌株s为空载体pbluescriptiisk(+)的转染子,菌株a为重组载体psk-2a的转染子,菌株b为重组载体psk-2b的转染子,菌株c为重组载体psk-2c的转染子,菌株a+b为重组载体psk-2a和psk-2b的转染子,菌株a+c为重组载体psk-2a和psk-1.6c的转染子,菌株b+c为重组载体psk-2b和psk-1.6c的转染子,菌株a+b+c为重组载体psk-2a、psk-2b和psk-1.6c的转染子,菌株virion为fggmtv1/hb58病毒粒子的转染子,probea是地高辛标记的与dna-a环状分子特异的359bp的dna探针,probeb是地高辛标记的与dna-b环状分子特异的335bpdna探针,probec是地高辛标记的与dna-c环状分子特异的326bpdna探针,ocdsdna指dna的双链开环构型,scdsdna指dna的超螺旋构型,circularssdna指单链环状dna构型;
图10为转染子菌株a+b和a+b+c的病毒粒子提取结果;两者的病毒粒子直径均为19–21nm,图中标尺为50nm;
图11为转染子菌株a+b和a+b+c的结构蛋白提取结果;泳道1,proteinmarker;泳道2,转染子菌株s提取的结构蛋白,作为阴性对照;泳道3,转染子菌株a+b提取的结构蛋白;泳道4,转染子菌株a+b+c提取的结构蛋白;泳道5,本发明中菌株hb58提取的结构蛋白,作为阳性对照;
图12为转染子菌株a+b和a+b+c的核酸提取结果;泳道1,dnamarker;泳道2,转染子菌株s提取的核酸,作为阴性对照;泳道3,转染子菌株a+b提取的核酸;泳道4,转染子菌株a+b+c提取的核酸;泳道5,本发明中菌株hb58提取的核酸,作为阳性对照;
图13为转染子菌株a+b和a+b+c的southern杂交结果;泳道1,转染子菌株s提取的核酸,作为阴性对照;泳道2,转染子菌株a+b提取的核酸;泳道3,转染子菌株a+b+c提取的核酸;泳道4,本发明中菌株hb58提取的核酸,作为阳性对照,probea是地高辛标记的与dna-a环状分子特异的359bp的dna探针,probeb是地高辛标记的与dna-b环状分子特异的335bpdna探针,probec是地高辛标记的与dna-c环状分子特异的326bpdna探针;
图14为野生菌株ph-1、本发明中菌株hb58和转染子菌株s、a+b、a+b+c和virion在pda培养基上的菌落形态比较;
图15为野生菌株ph-1、本发明中菌株hb58和转染子菌株s、a+b、a+b+c和virion在pda培养基上的菌落直径(a)和生长速度(b)比较;
图16为野生菌株ph-1、本发明中菌株hb58和转染子菌株s、a+b、a+b+c和virion的分生孢子产量比较;
图17为转染子菌株s、a+b和a+b+c通过分生孢子传播病毒能力的southern杂交;泳道1,转染子菌株s的分生孢子在pdb培养基中生长5天后收集的菌丝提取的核酸,作为阴性对照;泳道2,转染子菌株a+b的分生孢子在pdb培养基中生长5天后收集的菌丝提取的核酸;泳道3,转染子菌株a+b+c的分生孢子在pdb培养基中生长5天后收集的菌丝提取的核酸;probea是地高辛标记的与dna-a环状分子特异的359bp的dna探针;
图18为野生菌株ph-1、本发明中菌株hb58和转染子菌株s、a+b、a+b+c和virion的分生孢子接种小麦后的致病性比较;a是每麦穗发病小穗数统计,b是麦穗发病情况;
图19为野生菌株ph-1、本发明中菌株hb58和转染子菌株s、a+b、a+b+c和virion的菌丝块接种小麦后的致病性比较;a是每麦穗发病小穗数统计,b是麦穗发病情况。
具体实施方式
实施例1禾谷镰刀菌hb58菌株中病毒粒子提取和观察
从河北省发生赤霉病的小麦穗上分离得到禾谷镰刀菌菌株hb58,携带fggmtv1的禾谷镰刀菌菌株hb58在pdb培养基中培养1周;收集菌丝,多层滤纸干燥后,在液氮中碾磨至粉末状;按5ml磷酸钠缓冲液(0.1m):1g菌丝干粉的比例加入缓冲液,置于摇床孵育1–2h(100rpm,4℃)释放病毒粒子;低转速离心20min将大块杂质离下(5000rpm,4℃),取上清于新离心管中,加入等体积的氯仿至混合液,轻柔混合均匀,离心20min(12000rpm,4℃);取上清加入超速离心管(35ml)中,平衡各个离心管,超速离心3h(32000rpm,4℃);小心倒掉上清,底部沉淀加入1ml磷酸钠缓冲液(0.01m),4℃溶解过夜;待沉淀充分溶解后转移至1.5ml离心管,离心5min(12000rpm,4℃),取上清,4℃放置备用;
蔗糖梯度离心:使用0.01m的磷酸钠缓冲液配制蔗糖溶液,w/v分别为10%、20%、25%、30%和40%。向梯度离心管(13ml)内加入蔗糖溶液,从低浓度蔗糖溶液开始,用移液器沿管壁深入到管底,缓慢滴加,每个浓度加入2ml并保持各浓度之间的平衡,用记号笔标注每个蔗糖梯度的位置。最后在顶部加入上述病毒粒子溶液,若离心管不满,则要用0.01m的磷酸钠缓冲液补满离心管,超速离心3h以上(35000rpm,4℃)。离心结束后,从上到下将各梯度蔗糖溶液用移液器小心取出,每毫升分装一管共13管。fggmtv1的病毒粒子主要集中在25%和30%蔗糖溶液之间,即第8管和第9管;
选取上述两管进行脱糖纯化,在超速离心管(35ml)中加入2ml含有病毒的蔗糖溶液,用磷酸钠缓冲液(0.01m)补满,超速离心3h以上(35000rpm,4℃)。小心倒掉上清(或者用移液器缓慢吸取,此时的病毒粒子很容易随上清液倒出),加500μl磷酸钠缓冲液(0.01m)冰上溶解过夜。提取的病毒粒子溶液加入dmso终浓度为10%,-80℃保存备用。
fggmtv1病毒粒子的负染观察:取10μl病毒粒体悬浮液,小心滴加在铜网上,室温放置l–2min;待病毒粒体充分吸附在铜网上后,用滤纸吸去多余的病毒溶液;滴加一滴1%磷钨酸钠溶液,反应1min后用滤纸吸去多余的溶液,待铜网干燥后即可用透射电镜进行观察。
结果:菌株hb58是从河北省分离到的一个菌株,经形态鉴定和分子鉴定,确认该菌株为禾谷镰刀菌菌株(图1);利用蔗糖梯度离心的方法纯化病毒粒子,其病毒颗粒主要分布在25%–30%浓度的蔗糖梯度中。用透射电镜观察病毒粒子的负染样品,可以观察到fggmtv1的病毒粒子成等轴球形,直径为19–21nm(图2)。
本发明带毒菌株hb58已经于2019年1月15日在中国微生物菌种保藏管理委员会普通微生物中心(cgmcc)进行了保藏,登记入册编号保藏号cgmccno.17181。
实施例2禾谷镰刀菌hb58菌株中病毒粒子中核酸的提取和观察
取适量病毒提纯液20–100μl,加灭菌蒸馏水至200μl;加入等体积(200μl)抽提缓冲液(20mmtris-hclph8.0;1%sds;200mmnacl;5mmedta),加等体积饱和苯酚/氯仿(400μl),轻微振荡混合2–5分钟,12000rpm离心2分钟,取上清水相,再加等体积饱和苯酚/氯仿,混合抽提,12000rpm离心2分钟,加等体积氯仿/异戊醇(24:1)抽提一次,取上清水相加2.5倍体积无水冷乙醇,混匀、置-80℃下1小时,12000rpm离心15分钟,倒去乙醇,沉淀用70%冷乙醇(0.5ml)洗涤2次,真空干燥,2–5分钟,沉淀溶于30μl灭菌蒸馏水中,用1%琼脂糖凝胶电泳检测,最后-20℃保存。
结果:利用酚仿抽提的方法裂解病毒粒子并提取核酸检测,结果表明该病毒粒子中包裹有一条1.3kb大小的核酸片段(图3)。
实施例3禾谷镰刀菌hb58菌株中病毒粒子中核酸的核酸酶消化和观察
选择dna酶i、s1核酸酶、核酸外切酶i和核酸外切酶iii,分别对2–5μg病毒粒子核酸提取物进行处理,反应体系和反应时间按照各工具酶说明书进行。
结果:为了进一步对病毒粒子中的核酸特性进行鉴定,使用dna酶i、s1核酸酶、核酸外切酶i和核酸外切酶iii进行处理(图4)。结果,dna酶i处理的泳道没有dna条带存在,说明该核酸为dna;dna外切酶iii是处理双链核酸特异的核酸外切酶,用此酶处理的dna条带没有变化,证明该核酸不是双链线性dna;s1核酸酶是单链特异的核酸内切酶,用该酶处理的dna条带消失,证明该核酸是单链dna;核酸外切酶i是单链核酸的外切酶,用此酶处理的dna条带没有发生变化,证明该片段可能不是单链线性dna,亦或是末端有保护结构。综上结果推测,病毒粒子提取的核酸为单链环状dna或者两端有特殊保护结构的单链线性分子。
实施例4禾谷镰刀菌单链环状dna病毒fggmtv1基因组的克隆及序列分析
提取菌株hb58中fggmtv1/hb58的病毒粒子,用酚仿抽提的方法从病毒粒子中提取核酸,用试剂盒illustratempliphiamplificationkit(gehealthcare,usa)对提取的核酸进行滚环扩增反应(rollingcircleamplification,rca),1μl核酸与5μl样品溶液混匀后,95℃孵育3min后,立即插入冰上冷却2min,加入5μl反应溶液和0.2μlphi29dna聚合酶,然后30℃孵育3h后,65℃灭活10min,-20℃保存;rca样品分别用bamhⅰ、ecorⅰ、salⅰ、bglⅱ和kpnⅰ酶切消化,消化产物连接到用相应限制性内切酶处理的pet30a载体(novagen),重组载体转化到trans5α感受态细胞(transgen),然后用菌液pcr进行验证,阳性克隆送测序公司进行测序,并用dnaman软件和ncbi生物信息学网站对测序结果进行分析;
为了获得全长序列,设置背靠背引物dna-a-1f(5‘-ggttctggtgacaacttcg-3’)/1r(5‘-ccacacactgtcgtcaattacg-3’)用于扩增dna-a,dna-b-1f(5‘-ttgatccggcggtgtgcaagg-3’)/1r(5‘-acatcgtgtccatcacattc-3’)用于扩增dna-b,dna-c-1f(5‘-ctttagactggatgctctcg-3’)/1r(5‘-aggtgcttgtggctcagtt-3’)用于扩增dna-c,序列如seqidno:4-9所示,以病毒粒子提取的核酸为模板,进行pcr,连接,转化,测序,使用dnaman软件的序列拼接功能将得到的序列拼接起来,构成完整的病毒基因组序列。
结果:菌株hb58所携带病毒的基因组包含三个片段,分别是dna-a、dna-b和dna-c。其基因组序列如seqidno:1-3所示。danman软件预测和ncbi生物信息学网站分析,dna-a包含一个orf,编码复制起始蛋白(replicationinitiationprotein,rep),dna-b包含一个orf,编码外壳蛋白(coatprotein,cp),dna-c包含一个orf,编码一个未知功能蛋白p26,dna-a和dna-b包含相同的茎环结构,dna-c包含一个不同的茎环结构,三个环状单链dna分子同时包含两个共同区域(cr-m和cr-sl)(图6)。经过序列分析和系统发育分析,该病毒为新成立的单链环状dna病毒科genomoviridae的一个新病毒,所以,得到的三个片段都为单链环状dna分子。同时以前鉴定的genomoviridae和geminiviridae病毒科的rep和cp蛋白都在同一个环状分子上,而我们鉴定的病毒的rep和cp分别在不同的环状分子上,在进化上位于genomoviridae和geminiviridae病毒科病毒的早期。该病毒的发现可能解决了从质粒到geminiviridae病毒科病毒进化的中间体一直未被鉴定的问题。
实施例5southern杂交
电泳:提取禾谷镰刀菌菌株基因组dna后,在1%的琼脂糖凝胶中电泳30min,电压设定120v/cm。电泳结束后,切去点样孔及其它多余的凝胶。
转膜:方法参考《分子克隆》中的标准操作步骤。将凝胶浸入0.25mol/lhc1,处理10min;用蒸馆水洗胶两次后将凝胶于0.1mol/l的naoh溶液中浸泡20min,将凝胶移至0.1mol/l的tris-hcl(ph=8.0)中浸泡20min,再用20×ssc处理15min。用一块大于凝胶面积的有机玻璃作为平台,将其放入大的托盘内,倒入20×ssc使液面略低于平台表面,有机玻璃平台上面平铺一张新的滤纸,使滤纸均勾湿润,并且保证两端浸入20×ssc之中;上铺一层比凝胶稍大的滤纸,使其均匀湿润,将凝胶正面向下置于平台上湿润的滤纸上,在凝胶上方放置与凝胶同样大小的尼龙膜,尼龙膜预先在20×ssc中浸泡5min。在膜上放置两张与凝胶同样大小的滤纸,用约500g的重物压实。转膜约12h后小心移去吸水纸,取下尼龙膜,并用20×ssc清洗以除去其上的琼脂糖碎片。
紫外交联:先用10×ssc浸湿的whatman滤纸上,再将杂交膜置于whatman滤纸上,用uv-crossing仪器紫外交联后,将杂交膜在ddh2o中轻轻地摆一下,在通风橱中晾干;
杂交:用镊子将杂交膜轻轻地夹入杂交管(正面朝内),使其正面朝向管的内部,加入适量的预杂交液于杂交炉中42℃预杂交45min;在沸水中煮沸预先制备好的地高辛标记的dna探针,去4μl杂交探针,补ddh2o到50μl,沸水浴煮沸5min后,冰上迅速冷却;将变性后的探针加入杂交液中,轻轻混匀后再使杂交液接触杂交膜,42℃杂交炉中杂交过夜;杂交结束后,在杂交瓶中加入足量的低严谨洗膜液(2×ssc,0.1%sds溶液),轻微转动,洗涤2次,每次室温15min。倒掉溶液之后加入足量的高严谨洗膜液(0.5×ssc,0.1%sds溶液),轻微转动,65–68℃洗涤2次,每次15min;弃高严谨洗膜液,加入足量的washingbuffer,漂洗1–5min(用冰块冷却杂交炉至室温);弃washingbuffer,加入100mlblockingbuffer,室温漂洗30min;弃blockingbuffer,加入20mlantibodysolution,室温漂洗30min;弃antibodysolution,用足量washingbuffer冲洗两次,每次15min;弃washingbuffer,加入detectionbuffer,室温漂洗2–5min;取出杂交膜,点样面朝上放在杂交袋上,均匀滴加1mlcspd溶液到杂交膜上,使杂交袋夹层中的液体均匀分布,室温放置5min;杂交信号用tanon5200成像仪器进行检测。
结果:为了验证得到的三个分子片段的确存在于病毒粒子中,对菌株hb58提取的基因组dna和病毒粒子提取的核酸进行了southernblot分析。使用地高辛探针标记试剂盒分别制备与dna-a环状分子特异的359bp的dna探针probea、与dna-b环状分子特异的335bpdna探针probeb和与dna-c环状分子特异的326bpdna探针probec;这些探针都可与菌株hb58和病毒粒子携带的病毒片段杂交,有明显的杂交信号,并呈现出双链开环(opencircular,oc)、双链超螺旋(supercoiled,sc)和单链环状三种分子形式(图7)。说明得到的三个分子片段的确存在于菌株hb58和病毒粒子中。
实施例6禾谷镰刀菌hb58菌株中病毒粒子中结构蛋白的提取和观察
配制分离胶,将分离胶小心地灌注在预先装配好的模具中,流出浓缩胶所需空间,并在分离胶上加一层无菌ddh2o。分离胶聚合后配制浓缩胶,倾倒模具使ddh2o流出,小心地将浓缩胶灌注在分离胶的上层,立即插入梳子等待胶全部凝聚;最后小心拔出梳子,将凝胶安置在电泳槽中,在内外电泳槽中加入电泳缓冲液,使上样孔中都充满缓冲液。
在10μl病毒粒体悬浮液加入4μl上样缓冲液于沸水处理5min,然后立即置于冰上冷却,混匀后小心地加入点样孔中。当样品处于浓缩胶中时,用80v的恒定电压进行电泳;当样品处于浓缩胶与分离胶的交界处时,蛋白质样品将被压缩成一条带,此时使用100v恒定电压进行电泳;当溴酚蓝到达胶底部的时候停止电泳。
将电泳完毕后的凝胶小心地从模具中剥离下来,切去浓缩胶,使用蒸馈水冲洗分离胶数次。置于考马斯亮蓝r-250染色液中染色1h。将染色液倒掉后,用脱色液进行脱色,脱色3h以上,直到可以观察到清晰的蛋白质条带为止。
结果:将得到的纯化病毒粒子进行sds-page电泳,可见三条明显的蛋白条带,较大的两个条带在25–35kda之间,最小的条带在10kda左右(图5);通过对三个条带蛋白进行质谱鉴定,发现三条蛋白得到的氨基酸序列与预测的外壳蛋白序列一致,因此可以证实dna-b编码的蛋白的确是外壳蛋白,并且这三条蛋白条带可能是cp蛋白降解的产物。
实施例7禾谷镰刀菌单链环状dna病毒fggmtv1三个基因组片段的侵染性克隆构建
dna-a侵染性克隆构建的具体步骤如下:提取菌株hb58中fggmtv1/hb58的病毒粒子,用酚仿抽提的方法从病毒粒子中提取核酸,用试剂盒illustratempliphiamplificationkit(gehealthcare,usa)对提取的核酸进行滚环扩增反应(rollingcircleamplification,rca),用ecori和kpnⅰ限制性内切酶进行消化,获得两端带ecori酶切位点的长大约1.3kb的片段,然后连接到用ecori消化的pbluescriptⅱsk(+)(psk)载体上,形成带有一个拷贝dna-a分子的重组载体psk-1a,阳性克隆送公司测序,确认rca反应没有引入突变;然后,测序正确的psk-1a重组载体用ecori限制性内切酶消化后重新连接到用ecori消化的psk载体上,形成带有两个拷贝dna-a的重组载体psk-2a,阳性重组载体用限制性内切酶消化的方式来验证插入片段的方向;
dna-b侵染性克隆构建的具体步骤如下:提取菌株hb58中fggmtv1/hb58的病毒粒子,用酚仿抽提的方法从病毒粒子中提取核酸,用试剂盒illustratempliphiamplificationkit(gehealthcare,usa)对提取的核酸进行滚环扩增反应(rollingcircleamplification,rca),用ecori和speⅰ限制性内切酶进行消化,获得两端带ecori酶切位点的长大约1.3kb的片段,然后连接到用ecori消化的pbluescriptⅱsk(+)(psk)载体上,形成带有一个拷贝dna-b分子的重组载体psk-1b,阳性克隆送公司测序,确认rca反应没有引入突变;然后,测序正确的psk-1b重组载体用ecori限制性内切酶消化后重新连接到用ecori消化的psk载体上,形成带有两个拷贝dna-b的重组载体psk-2b,阳性重组载体用限制性内切酶消化的方式来验证插入片段的方向;
dna-c侵染性克隆构建的具体步骤如下:提取菌株hb58中fggmtv1/hb58的病毒粒子,用酚仿抽提的方法从病毒粒子中提取核酸,用试剂盒illustratempliphiamplificationkit(gehealthcare,usa)对提取的核酸进行滚环扩增反应(rollingcircleamplification,rca),用xbaⅰ限制性内切酶进行消化,获得两端带xbaⅰ酶切位点的长大约1.3kb的片段,然后连接到用xbaⅰ消化的pbluescriptⅱsk(+)(psk)载体上,形成带有一个拷贝dna-c分子的重组载体psk-1c,阳性克隆送公司测序,确认rca反应没有引入突变;然后,测序正确的psk-1c重组载体用xbaⅰ和claⅰ限制性内切酶消化后重新连接到用xbaⅰ和claⅰ消化的psk载体上,形成带有0.6个拷贝dna-c的重组载体psk-0.6c,然后psk-1c重组载体用xbaⅰ消化后获得单拷贝dna-c后再次连接到psk-0.6c重组载体的xbaⅰ位点,获得含有1.6个拷贝dna-c的重组载体psk-1.6c,阳性重组载体用限制性内切酶消化的方式来验证插入片段的方向;
结果:具体构建策略如图8所示。根据侵染性实验(图9)和病毒粒子重新提取实验(图10-13)表明,该侵染性克隆构建成功。构建该侵染性克隆只需要使用一个细菌克隆载体pbluescriptⅱsk(+)进行克隆和转染真菌即可成功,简化了克隆和转染步骤,不需要多次pcr克隆,不需要多个克隆载体和转染载体,也不需要克隆到双元表达载体上即可完成转化。同时这是国际上首次对真菌dna病毒进行侵染性克隆构建,为今后国际同行对dna真菌病毒的研究提供了重要参考。
实施例8禾谷镰刀菌原生质体制备、转染和再生
原生质体制备:接种pda平板上的赤霉菌到装有100mlcmc液体培养基的250ml三角瓶中,25℃,180rpm培养3-5天;用灭菌的三层擦镜纸过滤培养基,在室温下4000rpm离心5min,弃上清液;加入灭菌水,重悬分生孢子沉淀并稀释到108个孢子/ml的浓度;将3×108个孢子转移到含有100mlyepd液体培养基的250ml三角瓶中,25℃,180rpm摇12–14小时;用三层灭菌擦镜纸过滤培养过夜的培养基,用无菌水冲洗2–3次,然后用1m蔗糖冲洗1–2次,用灭菌滤纸沥干,收集菌丝体;用灭菌镊子将菌丝转移至20ml原生质体酶解液中,90rpm,28℃,轻摇2–3h,每隔0.5h镜检原生质体质粒和数量。(原生质体制备过程中需注意酶解消化时间,1h后原生质体已开始大量释放,2h左右基本酶解完全,酶解时间过长容易造成原生质体活力下降,转染效率降低);用二层灭菌擦镜纸过滤酶解混合物到无菌50ml离心管中,并用1m蔗糖溶液冲洗2次,将尽可能多的原生质体冲洗下来;将原生质体2600rpm,4℃离心1min,弃上清,用冰上预冷的stc缓冲液重悬并按上述离心条件洗涤原生质体3次;最后用stc缓冲液重悬原生质体,并将其终浓度调至2–5×107个/ml;分装200μl/管,加终浓度为7%的二甲基亚砜(dmso),混匀,-80℃保存;
peg介导的转染:将原生质体从-80℃取出,冰上融化;2ml离心管中加入200μlph-1原生质体和30ug(约30μl)的质粒或病毒粒子,轻弹管底混匀后,冰上放置20min;1.25mlptc一滴滴加到2ml离心管中,用枪头(去头)吸打混匀后室温静置20min;将2ml离心管中的原生质体转入15ml离心管中,用5mltb3(含50μg/ml氨苄青霉素)反复冲洗2ml离心管,然后加入到以上15ml离心管中,25℃,90rpm,轻摇过夜(16h);将原生质体再生物4000rpm离心5min,弃上清,加600μlstc重悬沉淀,依次各取200μl放于9cm培养皿的中央,加20ml含50ug/ml氨苄青霉素的tb3固体培养基(要冷却至40℃左右),要从四周向中央慢慢加,轻轻摇晃培养皿;将平板面朝上放置,25℃,黑暗培养过夜。第二天倾斜平板出去浮于表面的stc。继续培养5d;观察菌丝形态,从边缘不同位置切取小块菌丝转移到pda平板上,继续培养,观察表型变化。
结果:经过原生质体的制备、转染和再生,共得到9个转染子菌株(s、a、b、c、a+b、a+c、b+c、a+b+c和virion),经过southernblot分析(图9),只有a+b、a+b+c和virion三个转染子菌株有病毒存在。表明dna-a和dna-b对于复制和增殖来说是彼此需要的关系,dna-c的复制和增殖需要dna-a和dna-b的存在。
实施例9禾谷镰刀菌单链环状dna病毒fggmtv1的生物学功能
(1)菌株的菌落形态及生长速度测定
用5mm打孔器打取带毒菌株hb58和各转染子菌株的菌饼置于pda培养基平板的中央,活化菌株;用5mm打孔器打取活化菌株的菌落边缘菌饼,将菌饼转移到pda培养基平板的中央,分别五个重复;25℃黑暗培养4d后观察菌落形态和测量菌落直径并统计分析。
(2)菌株的分生孢子形态观察及产量测定
用5mm打孔器打取带毒菌株hb58和各转染子菌株的菌饼置于pda培养基平板的中央,活化菌株;用5mm打孔器打取活化菌株的菌落边缘菌饼,将一块菌饼转移到装有50mlcmc培养基的三角瓶中,25℃,180rpm/min摇床培养5d;用三层擦镜纸过滤孢子悬浮液后取过滤液在显微镜下观察孢子形态并用血球计数板计量孢子浓度,每个处理五次重复。
(3)菌株的致病力测定
种植小麦品种安农8455,待小麦生长至扬花盛期时用于小麦穗接种。此时籽粒还没有长出,利于禾谷镰刀菌的侵染;按上述方法制备带毒菌株hb58和各转染子菌株的分生孢子,并用血球计数板计量孢子浓度后将孢子浓度调节为3×105个/ml待用;同时,按上述方法制备带毒菌株hb58和各转染子菌株的菌丝块;选取长势基本一致的小麦穗,自下而上查到第五个小穗时,用手指将小穗的内颖和外颖分开,注意不要弄伤小穗。用移液枪吸取10μl制备好的孢子液注入或者将大小一致的菌丝块放置于内颖和外颖之间的根部,轻轻闭合保持其自然状态。记号笔标记接种小穗并在小麦杆上挂上标签,记录接种菌株、接种方法、接种日期、接种人等信息。每个菌株至少接种15个小麦穗;用喷壶向保鲜袋内部喷入水,套到接种的小麦穗上,底下轻轻扎住,25℃光照黑暗交替(16h/18h)保湿培养48h;取下保鲜袋并继续培养14d后,观察小麦穗发病情况,剪下小麦穗拍照并统计每穗发病小穗数。
结果:通过对菌落直径、生长速率、孢子产量和致病力的检测,发现a+b菌株能够显著抑制真菌寄主的生长、孢子产量和致病力,具有潜在的生物防治潜力。(图14-19)
以上所述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
序列表
<110>中国农业科学院植物保护研究所
<120>一种禾谷镰刀菌单链环状dna病毒fggmtv1/hb58侵染性克隆的构建方法
<160>9
<170>siposequencelisting1.0
<210>1
<211>1316
<212>dna
<213>禾谷镰刀菌dna病毒fggmtv1dna-a(genomoviridaefggmtv1)
<400>1
ttcttctctttcttagatttgtgaccgtgacccaagtttgatttatatactagttatgtg60
ttgactaaggtacagagaggggtagtgatctccacaataatggcgttagcgtccatccat120
ttccaatcaatatcagtgcaggtacggcgtggatcttcattggctatgtagatgcacggc180
ttaccccacatgacccgctgttttcctttgtacttgtcggtagctacgaattctcgttgg240
ccgaaccattgtttgtaatttggaaaagaggagaacccaccaatcaagtcatcaaacacc300
gcgtagtttacgttagggtgaaagtcagagagcatgaacatgcctgggaagtaggcgtga360
ttggctagacttcgcgcccatagagttttaccgaggcgggaagcgccgaataaaatgaga420
cttatgggtcggtatgatgtgttgttcgtgacgtaattgtcaacccagtctttgagttcg480
ggatagtcagagtaattgacagtaatttgtggagattcgtatgtgctctgtggtggaccg540
aatttccattcagcaaatgacttgatgttgttccagcatttgatggattggttaggtagt600
tcggtggcagccaagtgtaaaaattcttttgcggaagttgattggtcgatgatacgcaac660
cattctttatccatgttcttttggttcaaggatggttggtgtgggggtgtaccctcttcc720
cattggatgtcgttatctttttttacgtaattgacgacagtgtgtggggttctggtgaca780
acttcgatgttggggtgaacaccacagaaatcgaagtcccgtgcgttgtttgaagtgtga840
atagtttcaacttcccaatacacgtgatggtggaatccgccatctttgtgttgttctttt900
gagatgacgagatagacaagaagtggacttttttctttgaacatttcggcgagtttagtt960
gcgtcgaactcatcaggtgtttgggaataagtgaaaagccattttttacatcggagtcgg1020
tatctgtgatcactagttagttagttgggaatagcttcactttttggcaattgagttaag1080
taagggtcattgcaccatcatgggggagggacctccgggggggccccatgtggggctgta1140
cccgcgtcagaagcccaagctctggaataaaaaaaataaaaaatacgtactggttgcgtt1200
gtcgtttttgtggctgaggtgtttctgagtcacatgattcggaagcgcgtttggacattg1260
tggctgaagagtggctttgcggaggtcaagaaatctaagaaagagaggatttaaga1316
<210>2
<211>1320
<212>dna
<213>禾谷镰刀菌dna病毒fggmtv1dna-b(genomoviridaefggmtv1)
<400>2
ttcttctctttcttagatttgtgaccgtgacccaggtttgattttgggtatataagggag60
gggtagccaccatttttgctagtctgtttttggacttaaaaaatttattttttaacacaa120
aacattattacgtcgacaaaaatggcttctacaaagaagaaatcatacaacaacaagaag180
gcttataaaaaaaaagaatggaagtcgaagaagacttgggacaagtctagttattacgac240
aattaccagtcgaagatgaatatttcgaatatgcagacgaagagggacaacatgatgtgt300
gtgacgtcacattgtggtgttccgaatgcggcgttactggagaattctgttgtgggtgaa360
attccagccaatatgggagttcattatattatgtggtctcctacgtatcgagaggcggta420
ccaccgaatcgagcggcacagttggatcggcaatccgcaaacacattttttactggttgg480
aaggataatttgtcctatcaatttaagggacagattacagggattcacctgagggttgtg540
atatctacccgaagagaagtggagtccgcgcagccttttattgggccggggaatacgctg600
tgcagaaacttggcggttcgtgatatgtcggatgagacattggaccagtttttgtcgggt660
acccgggatgttgattggacgttggtgaatgtgatggacacgatgtttgatccggcggtg720
tgcaaggtgttgtttcggcagaggaagattttaggtgcagctgatgcgttgttgaagacg780
gaggagttttatcaccgtatccgtcggcctatggtgtacggcgataggcaggatggtttg840
gagtttgtgtctagtggttgggctggaagggagtcggagaacatatacgtcattgatatg900
tactctttgatttcggcagccccaccgttaggtaatttgttggatggagagggaaatatt960
gttttggatgacaagaaacggcctattcccgtatatgcgaagttaaatattagtggaaat1020
agtatagtgtattggagggagtagggtaattttagtgtagcaaaattgagttggtgatag1080
cttcatttttttggatccactttgtgacaattgagttgaagtaagggtcattgcaccatc1140
atgggggagggacctccgggggggccccatgtggggctgtacccgcgtcagaagcccaag1200
ctccggaataaaaaaaaatcaaaagtagactgtcggttaaagttcggttgggtaggatta1260
gtcagcaaattttcaaccaatagcggaggtcaagaaatctaagaaagagaggatttaaga1320
<210>3
<211>1309
<212>dna
<213>禾谷镰刀菌dna病毒fggmtv1dna-c(genomoviridaefggmtv1)
<400>3
ttctctttcctaaaagtctgaccgtgactccctttggccttgacgacgttattggtggag60
gattggaatgttacccgcaatttcacgtgacatgtggaaatgtggtgacatgaagaattg120
tgggacggcacaattttaattgggtggaacacagcagggtaggattaggcagaatgaggc180
agatttaggcagcggaaatttatttttaaattggagcattgtctaaatctagaagtacat240
ggtaccagtcatcatcgtttggttgatgatctggtatgtccacccaatcaggatcattta300
aattatgtacaattgaattgttatgatttgtaaaaaaaaaagataggtaatcgcataacg360
tgtttttgttgaataaaataatacacgtgtttgcgtattgttgtaccatgtcatgtgggt420
cgggattgttgtggagatgacacgtgttagtgctggtatgaactcgcaggagtgtagtac480
cagtcgacaaaggcttggatgtgttggcggtgtcgttggagtagtgtagggtgagtttcc540
tcgaaacgactaagaaacgccccttgatttggctcggagaaaagttgttgccagaagggg600
tcagatgtggctgagcaaagatctgcatccccgaactgagccacaagcacctctttagac660
tggatgctctcgtataccgggcctgcatgtgtgtatattggcagaatagaaggcataact720
ccgctgtaagcgagttgtaggcttcgttggaggggaatgtttccagtatcgatgtagata780
tcgagatcacagttcccattagttcttgtattgtaaccggcgatgaatctctttggattg840
atgtccatttggagttgagaagtgaaattatctgattgttttgggtcgacatctttatat900
tgtaaaaaatatttgtaactgtaaataattagttggtgatagcttcattttttttactcc960
actttgtgacaattgagttaagtaagggtcattgcaccatcatgggggagggacctccgg1020
gggggccccatgtggggctgtacccgcgtcagaagcccaagctctttgttgagccgagcg1080
cagcggtaatttggagtcacgtgaggtaaaataaaatgtggacttacgttcttggaattg1140
atgattgagacattttgaaaaagtgttggagtggttggggtatttatggtcaaggacatg1200
tttggtggtgtcattggttaatataggtactgtcggtagatagttgttgcggttgaagta1260
taatgcgtggagcaccgaggtcagaacttttaggaaagacgatttaaga1309
<210>4
<211>19
<212>dna
<213>引物dna-a-1f(artificialsequence)
<400>4
ggttctggtgacaacttcg19
<210>5
<211>22
<212>dna
<213>引物dna-a-1r(artificialsequence)
<400>5
ccacacactgtcgtcaattacg22
<210>6
<211>21
<212>dna
<213>引物dna-b-1f(artificialsequence)
<400>6
ttgatccggcggtgtgcaagg21
<210>7
<211>20
<212>dna
<213>引物dna-b-1r(artificialsequence)
<400>7
acatcgtgtccatcacattc20
<210>8
<211>20
<212>dna
<213>引物dna-c-1f(artificialsequence)
<400>8
ctttagactggatgctctcg20
<210>9
<211>19
<212>dna
<213>引物dna-c-1r(artificialsequence)
<400>9
aggtgcttgtggctcagtt19
- 还没有人留言评论。精彩留言会获得点赞!