一种以Pickering乳液法制备GelMA大孔水凝胶的方法及应用与流程
本发明涉及水凝胶材料的技术领域,尤其是指一种以pickering乳液法制备gelma大孔水凝胶的方法及应用。
背景技术:
骨损伤已是临床常见的外科疾病,目前临床治疗上所采用的骨移植体,主要有自体骨、同种异体骨和异种骨,这三种临床骨移植体各有优缺点,且来源有限,因此每年临床治疗均需要大量的骨修复材料。临床所使用的各种骨修复材料也均存在一定的问题,例如医用金属材料骨传导性较差,与人体天然骨组织的弹性模量不匹配;磷酸钙骨水泥机械强度差,不能用于承重骨的修复;生物活性玻璃降解速度与骨组织生长速度不匹配,导致骨组织生长速度过慢或骨缺损修复不完整等问题。
骨组织成分复杂,当中含有多种微量金属元素,如mg、sr、zn、fe、cu等。在骨修复材料的研究中,掺入微量金属元素可以提高材料的骨修复性能。在多种微量金属元素中,mg元素参与骨组织形成、骨代谢和骨矿物结晶等生理过程,对成骨细胞的粘附、增殖和成骨分化行为具有促进作用。
高分子水凝胶是一种由亲水性高分子交联而形成的三维网络与水分子共同结合组成的材料体系。常用于骨修复水凝胶制备的材料有胶原、明胶、丝素蛋白、壳聚糖、海藻酸钠和透明质酸等天然生物质高分子。由这些天然高分子制成的水凝胶,在成分上与机体的细胞外基质相似,同时具有良好的生物学性能和降解性能,以及促使细胞在材料上粘附等优势,已广泛应用于骨修复植入物的研究当中。目前已有多种制备方式将天然生物质高分子材料制成多种形态的水凝胶支架。
大孔凝胶支架在组织工程、生物医药等方面有着极大的应用价值,水凝胶内部相互连通的孔洞结构能够促进营养物质的输送、代谢产物的排出以及细胞间的交流,可作为良好的组织工程支架。一般将有效孔径在10nm~10μm范围内的水凝胶称为微孔水凝胶,有效孔径大于10μm的水凝胶称为大孔水凝胶。目前常见用于制备生物医用的大孔支架的方法中,要么无法形成连通孔,要么需要引入额外化学品增加毒性,不利于材料的生物相容性。本设计根据pickering乳液法制备大孔水凝胶支架材料的原理和特点,将mgo纳米粒子作为pickering乳液的稳定剂,拟设计一种gelma大孔水凝胶支架,作为性能优良的骨修复支架。
技术实现要素:
本发明的目的在于克服现有技术的缺点与不足,提出了一种以pickering乳液法制备gelma大孔水凝胶的方法及应用,该方法制备的大孔水凝胶具有大孔结构的优势,能够促进营养物质的输送、代谢产物的排出以及细胞间的交流;且包载有mg元素的成分,对小鼠骨髓间充质干细胞具有促进粘附、增殖和促进成骨分化的作用,具备优良的生物相容性,可作为良好的组织工程支架,在骨修复领域具有巨大的临床应用潜能。
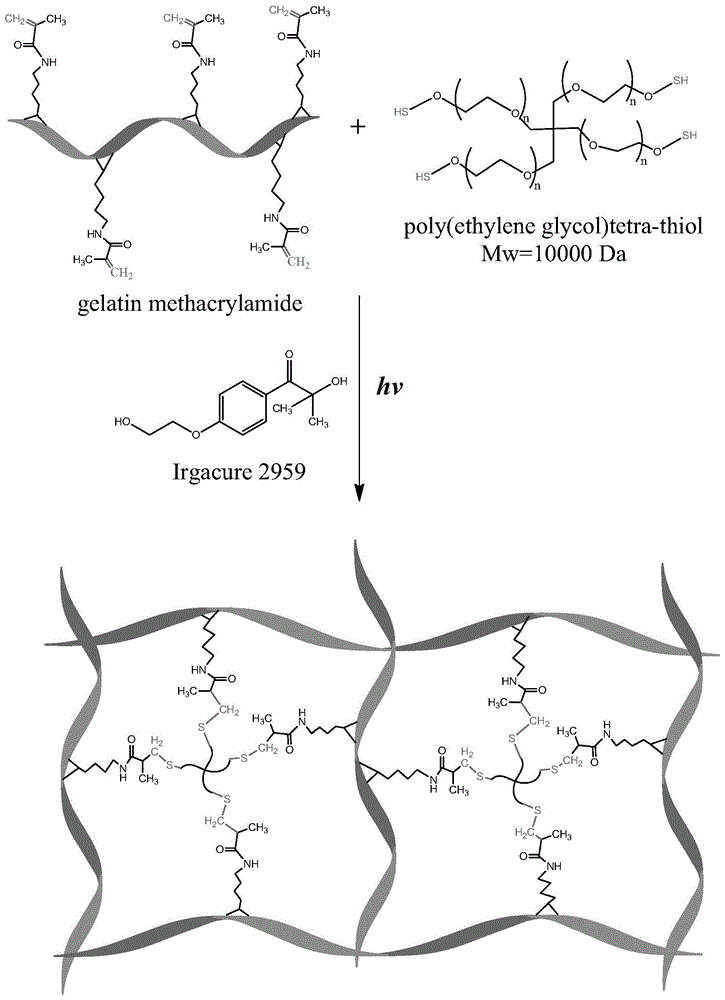
为实现上述目的,本发明所提供的技术方案为:一种以pickering乳液法制备gelma大孔水凝胶的方法,首先,用甲基丙烯酸酐对明胶分子链进行接枝改性,得到甲基丙烯酸化的明胶,即gelma,利用其上的双键,在光引发剂i2959的催化下,在uv光照下与四臂的peg-4sh上的巯基发生thiol-ene点击反应,快速形成水凝胶,通过在凝胶前驱液,即水相中加入由mgo纳米颗粒与十二烷构成的油相溶液,在均质机高速搅拌下制备稳定均一的pickering乳液,再uv光照成胶,洗去作为模板的十二烷油滴,即得到以mgo纳米颗粒为pickering乳液稳定剂的gelma大孔水凝胶。
所述方法包括以下步骤:
1)将gelma和peg-4sh溶解于pbs(1×)缓冲液中,得到水相溶液;
2)将mgo纳米颗粒加入十二烷中,搅拌之后再超声分散,得到油相溶液;
3)将水相与油相溶液混合,加入i2959光引发剂,用均质机高速搅拌,制得均一稳定的pickering乳液;
4)将乳液注入pdms模具中,经uv光照,乳液成胶,脱模,用无水乙醇和去离子水透析,冻干,即得以mgo纳米颗粒为pickering乳液稳定剂的gelma大孔水凝胶。
在步骤1)中,所述gelma的取代度大于70%,peg的分子量为2~20kda。
在步骤1)中,所述gelma与peg-4sh的质量比为1:0.5~1。
在步骤2)中,所述mgo纳米颗粒的粒径为20~100nm。
在步骤2)中,所述超声的时间为10~60min。
在步骤3)中,所述i2959光引发剂的加入量为0.01~0.1wt%。
在步骤3)中,所述均质机高速搅拌的转速为1~2万转/min,搅拌时间为30~90s。
在步骤4)中,所述pdms模具的厚度为2~5mm,孔径为5~10mm,uv光照时间为模具正、反面各30~90s。
通过上述方法制得的gelma大孔水凝胶作为组织工程支架应用于骨修复。
本发明与现有技术相比,具有如下优点与有益效果:
本发明得到的gelma大孔水凝胶材料具有良好的生物相容性和可降解性。thiol-ene点击反应条件温和,成胶时间短,并且结合了明胶的细胞粘附性和peg优良的理化性能,制备出一种在成分上是均匀的,细胞相容性好的,并且在化学和机械性能方面是可调的组织工程支架材料,较好地模拟了天然细胞外基质。mgo纳米粒子的引入,不仅作为pickering乳液稳定剂,赋予了材料大孔结构,促进营养物质的输送、代谢产物的排出以及细胞间的交流,还有效提高了材料的力学强度,并且mg2+的释放可以有效促进细胞的增殖与成骨分化能力,有望成为优良的骨修复水凝胶支架。具有巨大的临床应用潜能。
附图说明
图1为gelma大孔水凝胶的成胶机理图。
图2为gelma与明胶的1hnmr。
图3为mgo纳米粒子的接触角测试照片。
图4为gelma大孔水凝胶支架的压缩模量测试图。
图5a为gelma大孔水凝胶支架的eds能谱图(整体面扫)。
图5b为gelma大孔水凝胶支架的eds能谱图(局部扫描)。
图6a为gelma大孔水凝胶支架的mg2+体外释放曲线图之一。
图6b为gelma大孔水凝胶支架的mg2+体外释放曲线图之二。
图7a、图7b、图7c、图7d为不同mgo浓度的gelma大孔水凝胶支架的sem照片。
图8为mbmscs种植在不同mgo浓度的gelma大孔水凝胶支架上,细胞1,3,7天的增殖情况图。
图9为mbmscs种植在不同mgo浓度的gelma大孔水凝胶支架上,培养到第7天,live/dead染色的激光共聚焦照片。
具体实施方式
以下结合实例对本发明的具体实施做进一步的说明,但本发明的实施方式不限于此。
实施例1(明胶的修饰与表征)
一、明胶的修饰
gelma是由明胶经甲基丙烯酸酐修饰改性得到的,通过将甲基丙烯酸酐接枝到明胶分子链上,在明胶分子链上引入反应活性高的碳碳双键,利于与四臂的peg-4sh分子上的巯基发生thiol-ene点击反应,在uv光照下交联成凝胶网络。gelma大孔水凝胶的成胶机理见图1。
5g明胶溶于50mlpbs(1×)缓冲液,于60℃水浴中,搅拌至完全溶解。10ml甲基丙烯酸酐在0.5ml/min的速率下滴入搅拌中的明胶溶液,50℃水浴,反应3小时。稍冷却,用40℃的pbs(1×)稀释反应物至5倍,以终止反应。用12-14kda的透析袋透析7天,于40℃水浴内透析,最后冻干,得产物于4℃下储存。
二、明胶修饰产物的1hnmr表征
对上述明胶与gelma进行核磁共振氢谱(1hnmr)分析,测定其分子结构,两种分子的1hnmr谱见图2。
图2上方谱线为gelma,下方谱线为明胶,可以看出两个核磁曲线基本一致,gelma在5.35ppm和5.6ppm处有两个化学位移,即甲基丙烯酰胺基的特征峰,说明甲基丙烯酸酐已成功修饰到明胶主链上。
实施例2(mgo纳米颗粒的接触角测试)
pickering乳液是以超细固体颗粒作为乳化剂而得到的乳状液。假设固体粒子为球状,粒子在油水相中的状态,粒子-水、粒子-油、水-油之间的表面能对于乳液的形成类型至关重要。若粒子和水相之间的接触角θ<90°,即表示固体粒子与水相的润湿性较好,此时体系易形成水包油(o/w)乳液;若粒子和水相之间的接触角θ>90°,即粒子与油相的润湿性更好,体系易形成油包水(w/o)乳液。所以,我们可以通过粒子与水的接触角大致判断乳液的类型,而且粒子的亲疏水性必须适中,太过于亲水或太过于疏水都无法得到稳定的乳液。
将mgo粉末分散在无水乙醇中,超声30min,充分分散均匀,然后滴在很薄的玻璃圆片上,待乙醇完全挥发,再滴一滴,将mgo粉末均匀涂布在玻璃圆片上,成膜,再进行接触角测试。mgo纳米粒子的接触角测试照片见图3。测得mgo纳米粒子接触角测试平均值为36.1°。
测得的结果表明,mgo纳米粒子是亲水性的无机颗粒,可以形成稳定的o/w乳液。
实施例3(gelma大孔水凝胶支架的压缩性能测试)
将0.05ggelma溶于0.25mlpbs溶液(1×)中,搅拌至充分溶解。将0.25ml0.2g/ml的peg-4sh(1万分子量)溶液与gelma溶液混合均匀。将1.5mg纳米mgo加入0.5ml十二烷中,超声15min。将gelma、peg-4sh、十二烷、i2959光引发剂混合,用均质机在1.6万转/min下搅拌60s。将乳液转移至厚5mm,直径1cm的pdms模具中,uv光照,正、反面各60s。最终制得用于压缩模量测试的gelma大孔水凝胶支架。0.3wt%与0.5wt%mgo含量的水凝胶支架的压缩曲线见图4。
0.5wt%的组mgo含量较高,乳滴粒径较小,因此水凝胶的孔径较小,所以mgo含量高的样品,压缩模量较高,符合一般规律。由图中前20%形变区域的斜率,计算得,0.3wt%mgo含量的样品,压缩模量为6.99kpa;0.5wt%mgo含量的样品,压缩模量为12.33kpa。
实施例4(gelma大孔水凝胶支架的元素分析)
将0.1ggelma溶于0.25mlpbs溶液(1×)中,搅拌至充分溶解。将0.25ml0.2g/ml的peg-4sh(8千分子量)溶液与gelma溶液混合均匀。将2.5mg纳米mgo加入0.5ml十二烷中,超声20min。将gelma、peg-4sh、十二烷、i2959光引发剂混合,用均质机在2万转/min下搅拌60s。将乳液转移至厚2mm,直径8mm的pdms模具中,uv光照,正、反面各90s。脱模,经无水乙醇与去离子水透析7天之后,于-20℃条件下预冻,再冻干,最终制得用于元素含量定性分析的gelma大孔水凝胶支架。
将冻干的支架用液氮淬锻后掰开,用导电胶固定在电镜台上,喷金60s,用扫描电子显微镜进行eds能谱测试,定性分析gelma大孔水凝胶支架的元素含量。eds能谱图的整体面扫结果见图5a,局部扫描结果见图5b。挑选某一个孔周围进行扫描,图中标明的圆形区域内,mg元素含量为1.14wt%,高于整体视野范围内mg元素的含量。
实施例5(gelma大孔水凝胶支架的mg2+体外释放定量表征)
将冻干的各组水凝胶支架称重,按照10mg支架浸入1mlpbs(ph=7.4)中的浓度,分别将支架置于24孔板中,加入对应量的pbs溶液浸泡。在37℃恒温摇床中温育14天获得每组的镁离子释放曲线。摇床转速为100rpm。在每个固定的时间点,将pbs溶液取出,通过电感耦合等离子体发射光谱法(icp-oes,perkinelmer,optima2100dv,usa)检测镁离子的释放。每天更换新的pbs溶液。gelma大孔水凝胶支架的mg2+体外释放曲线见图6a和图6b。
图6a为每天的mg元素释放量,加了mgo的组,mg2+的释放,是有一个突释过程的,前两天的含量很高,第三天开始,含量降低,7天之后,释放量趋于平缓,浓度较低。前5天,每天的释放量均在20-500ppm范围内。图6b是10天内mg元素的累计释放量,7天以后,趋于平缓。
实施例6(不同mgo浓度的gelma大孔水凝胶支架的内部形貌表征)
将冻干的各组水凝胶支架用液氮淬锻后掰开,用导电胶固定在电镜台上,喷金60s,用扫描电子显微镜观察各组水凝胶支架的截面,以观察水凝胶支架的内部形貌与孔径规律。不同mgo浓度的gelma大孔水凝胶支架的sem照片见图7。(a:0wt%mgo;b:0.3wt%mgo;c:0.5wt%mgo;d:0.7wt%mgo)不经pickering乳液法造孔的组,水凝胶没有均匀的孔结构,由于力学强度脆弱,同样的处理方法,该组凝胶内部形貌皱缩、坍塌情况严重,孔壁呈鳞片状。
0.3wt%mgo组:有均匀的大孔结构,孔径在180μm左右。
0.5wt%mgo组:有均匀的大孔结构,孔径在110μm左右。
0.7wt%mgo组:孔的均匀性差一些,孔径在90μm左右。
孔径符合理论上,mgo含量越低,孔径越大的趋势,孔结构也较为均匀。
实施例7(不同mgo浓度的gelma大孔水凝胶支架的细胞相容性实验)
将由厚2mm,直径8mm的pdms模具中制备出的水凝胶支架,经透析,冻干,灭菌后,种植上第9代的mbmscs,种植密度为5万细胞/支架。每两天换一次液。
对培养到1,3,7天的支架进行cck-8检测,用酶标仪测定cck-8工作液的吸光度,以定量分析细胞在支架上的增殖情况。细胞1,3,7天的增殖情况见图8。
由图8可以看出,在培养到第3天的时候,只有0.5wt%的组略微增殖,前三组皆未增殖。在培养到第7天的时候,0wt%的nonporous水凝胶组仍未增殖,0.1wt%,0.3wt%的组略微增殖,0.5wt%的组增殖明显。说明,mgo浓度较低时,相较于nonporous凝胶,是大孔的结构优势,促进细胞增殖,但是效果不明显;mgo浓度较高时,虽然孔径减小,但是mg元素促进细胞增殖的作用更加突显。
对培养到第7天的支架进行live/dead染色,用激光共聚焦显微镜观察细胞在支架上的分布情况及细胞状态。第7天,live/dead染色的激光共聚焦照片见图9。
说明具有大孔结构的水凝胶支架,细胞在支架上的增殖情况更好,细胞数量更多,且细胞状态较好,呈铺展贴附的状态。细胞生长时,可以渗透到凝胶内部更深的区域,而不是仅仅在支架表面生长。
以上所述实施例只为本发明之较佳实施例,并非以此限制本发明的实施范围,故凡依本发明之形状、原理所作的变化,均应涵盖在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!