同时检测中药材污染四类产毒真菌的多重PCR引物、方法及试剂盒与流程
本发明涉及同时检测4类产毒真菌的多重pcr引物、方法及试剂盒,属于生物技术检测领域,特别涉及同时检测中药材污染4类产毒真菌的多重pcr引物、方法及试剂盒。
背景技术:
中药材受自身性质(含有大量淀粉、多糖等)的影响,在生产、加工、运输、贮存过程中,很容易污染各种真菌而发生霉变,不但药效价值降低,人误服后会引起中毒。针对上述中药材受真菌污染问题,我国已经制定了若干管理规范,但污染检测方面仍然存在许多空白。
例如《中国药典》仅对强致癌物黄曲霉毒素规定了检测方法和限量标准,《中国药典》2015年版一部收录了桃仁等十九味中药中黄曲霉毒素的检测方法,而对赭曲霉毒素、杂色曲霉毒素等其他多种真菌毒素没有相应的限量要求,也缺乏相应的数据支持。虽然目前已经对真菌毒素出台了相关限量标准。然而,真菌毒素的检测方法只能在真菌产生真菌毒素的情况下才能发挥作用,无法在产毒真菌尚未产生真菌毒素时,主动采取相关防范措施。一旦所检中药材的真菌毒素含量超标,只能采取抛弃等被动处理方法,很容易造成资源浪费。因此,建立一种针对中药材污染真菌的预警方法是非常必要的。
目前,在产毒真菌的种类检测和鉴定方面已有深入的研究和广泛的应用。比较成熟的方法是多聚酶链式反应(pcr)技术、分子标记技术等。其中,pcr技术是建立中药材污染真菌的检测方法的有效手段。多重pcr检测技术,是指在一个pcr反应体系中加入两对或者两对以上引物,能够同时扩增出多个dna片段,具有高效、快速、经济等优点。国内外均有不少研究报道。实现多重pcr检测,引物的设计极为关键,直接影响着方法的特异性。例如:在赭曲霉毒素生物合成途径基因pks设计引物aolc3512l/aolc3512r和aootal/aootar,其中aolc35-12l/aolc35-12r引物仅仅对产赭曲霉毒素产生菌特异性,该二重pcr检测方法成功鉴别赭曲霉毒素产生菌与不产毒菌株。rodríguez等根据flug该基因设计了特异性引物f-flugc/r-flugc,建立的多重实时荧光定量pcr,成功鉴别产杂色曲霉毒素菌株与不产毒菌株。
秦文彦等根据黄曲霉毒素生物合成途径中aflr、ver-1、omta-1等基因上设计引物,成功建立了多重pcr检测方法,并应用于食品及饲料表面中污染的黄曲霉菌和寄生曲霉菌的检测。结果显示,aflr、ver-1和omt-1基因上设计的引物能够扩增出相应大小、清晰明亮的电泳条带。而其余如青霉、烟曲霉、杂色曲霉和黑曲霉菌株的样品只检测出真菌保守区域共有的its片段。上述文献报道均仅仅针对一类产毒真菌,例如黄曲霉毒素产生菌、赭曲霉毒素产生菌或者杂色曲霉毒素产生菌,而对于该四类产毒真菌之间的组合的检测方法的相关报道甚少。目前,针对产毒真菌分子鉴定方法很多,但仅仅针对一类产毒真菌或者两类产毒真菌,检测范围小,没有系统性对中药材受产毒真菌污染的情况进行详细的分析。
传统的中药材污染产毒真菌分子鉴定方法需在菌株分离、纯化的基础上进行种属的鉴定以及产毒性能的分析,操作步骤多、周期长,无法做出及时的判断,更无法对中药材在加工、生产过程中真菌的污染水平进行监控。目前尚未见不经过分离纯化,直接对中药材污染产毒真菌进行多重pcr检测分析。目前产毒真菌dna的提取方法主要有naoh裂解法、chelex-100裂解法、ctab法等,不仅经济实惠,而且提取效率高。
综上所述,在食品及农产品中污染的产毒真菌的分子鉴定方法(单重pcr和多重pcr),已经是非常成熟。但是,对于中药材感染产毒真菌的多重pcr方法研究相对较少,尚未成熟,原因之一是中药材基质比较复杂。
因此,建立一种针对中药材污染产毒真菌的多重pcr快速鉴定方法是非常必要的。应用多重pcr技术,不经过菌株分离纯化,直接鉴别中药材的产毒真菌污染情况,是今后对药材产毒真菌污染检测技术的发展趋势,同时是本发明的主要研究目标。
技术实现要素:
为了克服现有技术的不足,本发明目的是主要针对黄曲霉毒素、杂色曲霉毒素、赭曲霉毒素、伏马菌素4种主要毒素的产生菌,提供同时检测中药材污染4类产毒真菌的多重pcr引物、方法及试剂盒。本发明建立了一种不经过分离纯化,直接检测中药材表面污染产毒真菌的多重pcr体系。
为了达到上述目的,本发明采用以下技术方案:
本发明提供同时检测中药材污染4类产毒真菌的多重pcr引物,上述4类产毒真菌为黄曲霉毒素产生菌、杂色曲霉毒素产生菌和赭曲霉毒素产生菌、伏马菌素产生菌,包括能在同一反应管中进行pcr反应的第一引物对、第二引物对、第三引物对和第四引物对,第五引物对,其中,
第一引物对用以扩增真菌rdna基因wen,包括正向引物wen2f和反向引物wen2r,分别包括seqidno.01和seqidno.02所示的序列;正向引物wen2f为5’-ttccatgcgagcccaacctccc-3’,反向引物wen2r为5’-aggggacgacgacccaaaca-3’,扩增产物大小为370bp;
第二引物对用以扩增黄曲霉毒素合成基因af,包括正向引物af-1f和反向引物af-1r,分别包括seqidno.03和seqidno.04所示的序列;正向引物af-1f为5’-gtggacggacctagtccgacatcac-3’,反向引物af-1r为5’-gtcggcgccacgcactgggttgggg-3’,扩增产物大小为780bp;
第三引物对用以扩增黄曲霉毒素、杂色曲霉毒素共同的合成基因afst,包括正向引物afst-1f和反向引物afst-1r,分别包括seqidno.05和seqidno.06所示的序列;正向引物afst-1f为5’-ggcccttgtggtggggttcaaatcggtga-3’,反向引物afst-1r为5’-cttaggtgacgacttggcgggctttgatc-3’,扩增产物大小为1400bp;
第四引物对用以扩增赭曲霉毒素合成基因ota,包括正向引物ota-1f和反向引物ota-1r,分别包括seqidno.07和seqidno.08所示的序列;正向引物ota-1f为5’-gccagaccatcgacactgcatgctc-3’,反向引物ota-1r为5’-cgactggcgttccagtaccatgagcc-3’,扩增产物大小为540bp;
第五引物对用以扩增伏马菌素合成基因fum,包括正向引物fum-1f和反向引物fb-1r,分别包括seqidno.09和seqidno.10所示的序列;正向引物fb-f为5’-gagcttgtccttctcactgg-3’,反向引物fb-r为5’-gagccgacatcataatcagt-3’。
本发明提供上述多重pcr引物在制备同时检测中药材污染4类产毒真菌的试剂或器械中的应用;所述4类产毒真菌为黄曲霉毒素产生菌、杂色曲霉毒素产生菌和赭曲霉毒素产生菌、伏马菌素产生菌。
本发明提供同时检测中药材污染四类产毒真菌的多重pcr方法,上述四类产毒真菌为黄曲霉毒素产生菌、杂色曲霉毒素产生菌、赭曲霉毒素产生菌和伏马菌素产生菌,所述多重pcr方法包括以下步骤:
1)提取、纯化产毒菌dna,采用改良的ctab法,作为模板dna;所述改良的ctab法为ctab法结合核酸纯化柱;
2)利用一组4对引物对、pcr体系对模板dna进行多重pcr扩增。
所述一组4对引物对包括能在同一反应管中进行pcr反应的第一引物对、第二引物对、第三引物对和第四引物对,其中,
第一引物对用以扩增真菌rdna基因wen,包括正向引物wen2f和反向引物wen2r,分别包括seqidno.01和seqidno.02所示的序列;正向引物wen2f为5’-ttccatgcgagcccaacctccc-3’,反向引物wen2r为5’-aggggacgacgacccaaaca-3’,扩增产物大小为370bp;
第二引物对用以扩增黄曲霉毒素合成基因af,包括正向引物af-1f和反向引物af-1r,分别包括seqidno.03和seqidno.04所示的序列;正向引物af-1f为5’-gtggacggacctagtccgacatcac-3’,反向引物af-1r为5’-gtcggcgccacgcactgggttgggg-3’,扩增产物大小为780bp;
第三引物对用以扩增黄曲霉毒素、杂色曲霉毒素共同的合成基因afst,包括正向引物afst-1f和反向引物afst-1r,分别包括seqidno.05和seqidno.06所示的序列;正向引物afst-1f为5’-ggcccttgtggtggggttcaaatcggtga-3’,反向引物afst-1r为5’-cttaggtgacgacttggcgggctttgatc-3’,扩增产物大小为1400bp;
第四引物对用以扩增赭曲霉毒素合成基因ota,包括正向引物ota-1f和反向引物ota-1r,分别包括seqidno.07和seqidno.08所示的序列;正向引物ota-1f为5’-gccagaccatcgacactgcatgctc-3’,反向引物ota-1r为5’-cgactggcgttccagtaccatgagcc-3’,扩增产物大小为540bp;
第五引物对用以扩增伏马菌素合成基因fum,包括正向引物fum-1f和反向引物fb-1r,分别包括seqidno.09和seqidno.10所示的序列;正向引物fb-f为5’-gagcttgtccttctcactgg-3’,反向引物fb-r为5’-gagccgacatcataatcagt-3’;
3)对扩增产物进行检测;
从而对所述中药材中四类产毒真菌的存在与否进行分析。
进一步地,步骤1)中,所述改良的ctab法包括以下步骤:
收集药材于ep管中,加入管体积3/5的0.1%吐温20,剧烈振荡,取混悬液滤过,收集滤液,离心,弃上清,取菌体加入裂解液,振荡10~15min,恒温水浴15~25min,放置2~3min,添加等量的氯仿:异戊醇(24:1),振荡,离心,取上清,加入2/3v/v异丙醇混匀,转移至核酸dna纯化柱中,静置3~5min,高速离心1~2min,加入70%乙醇洗涤,空柱子离心2~3min,收集洗脱液,-20℃保存。
进一步地,步骤2)中,所述pcr体系为:
所述多重pcr扩增的反应条件为:
进一步地,步骤2)中,在20μlpcr反应体系中,最佳引物配比是af-1:afst-1:ota-1:wen2=2:1:2:2。
进一步地,步骤3)中,所述对扩增产物进行检测为琼脂糖凝胶电泳分离以及凝胶成像系统拍照观察;其具体步骤为:
配制1.5%琼脂糖凝胶,将5μlpcr扩增产物加入凝胶点样孔中,在220v电压、110ma电流下进行电泳分离;电泳产物在凝胶成像仪中成像,确定有无目的条带。通过与dnadl2000marker比对分子量大小,确定目的条带的有无,记录并保存数据。
本发明提供同时检测中药材污染四类产毒真菌的多重pcr试剂盒,上述四类产毒真菌为黄曲霉毒素产生菌、杂色曲霉毒素产生菌、赭曲霉毒素产生菌和伏马菌素产生菌,基于多重pcr检测方法,包括一组4对引物对、反应缓冲液、4种脱氧核苷三磷酸和dna聚合酶;
所述一组4对引物对包括能在同一反应管中进行pcr反应的第一引物对、第二引物对、第三引物对和第四引物对,其中,
第一引物对用以扩增真菌rdna基因wen,包括正向引物wen2f和反向引物wen2r,分别包括seqidno.01和seqidno.02所示的序列;正向引物wen2f为5’-ttccatgcgagcccaacctccc-3’,反向引物wen2r为5’-aggggacgacgacccaaaca-3’,扩增产物大小为370bp;
第二引物对用以扩增黄曲霉毒素合成基因af,包括正向引物af-1f和反向引物af-1r,分别包括seqidno.03和seqidno.04所示的序列;正向引物af-1f为5’-gtggacggacctagtccgacatcac-3’,反向引物af-1r为5’-gtcggcgccacgcactgggttgggg-3’,扩增产物大小为780bp;
第三引物对用以扩增黄曲霉毒素、杂色曲霉毒素共同的合成基因afst,包括正向引物afst-1f和反向引物afst-1r,分别包括seqidno.05和seqidno.06所示的序列;正向引物afst-1f为5’-ggcccttgtggtggggttcaaatcggtga-3’,反向引物afst-1r为5’-cttaggtgacgacttggcgggctttgatc-3’,扩增产物大小为1400bp;
第四引物对用以扩增赭曲霉毒素合成基因ota,包括正向引物ota-1f和反向引物ota-1r,分别包括seqidno.07和seqidno.08所示的序列;正向引物ota-1f为5’-gccagaccatcgacactgcatgctc-3’,反向引物ota-1r为5’-cgactggcgttccagtaccatgagcc-3’,扩增产物大小为540bp。
第五引物对用以扩增伏马菌素合成基因fum,包括正向引物fum-1f和反向引物fb-1r,分别包括seqidno.09和seqidno.10所示的序列;正向引物fb-f为5’-gagcttgtccttctcactgg-3’,反向引物fb-r为5’-gagccgacatcataatcagt-3’。
进一步地,各成分以如下体系包含于20μl的pcr最终反应溶液中:
所述多重pcr扩增的反应条件为:
进一步地,在20μlpcr反应体系中,最佳引物配比是af-1:afst-1:ota-1:wen2=2:1:2:2;
阳性对照dna来自黄曲霉菌as3.4410、杂色曲霉菌as3.4413、赭曲霉菌as3.4520、串珠镰刀菌bncc340687。
与现有技术相比,本发明具有以下有益效果:
1、目前,发现中药材易受到黄曲霉毒素(ⅰ致癌物)产生菌、杂色曲霉毒素(ⅱ致癌物)产生菌、赭曲霉毒素(ⅱ致癌物)产生菌等多种产毒真菌的污染,其中又以杂色曲霉毒素产生菌的污染最为普遍,严重威胁着使用者的生命安全。本发明建立一种同时检测中药材污染4类产毒真菌的多重pcr方法。
2、本发明首先建立基于纯菌的4类产毒真菌的多重pcr检测体系,方法的检出限为103cfu;在此基础下,建立基于人工感染中药材的四种产毒真菌的多重pcr检测体系,方法的检出限为103~104cfu/g;收集市场上的中药材,应用多重pcr技术和lc-ms/ms分别检测产毒真菌和真菌毒素,结果表明多重pcr方法的预警准确率超过90%。
附图说明
图1为实施例1中多重pcr同时检测四种产毒菌的灵敏度,
图中,lanes1~8:1cfu;10cfu;102cfu;103cfu;104cfu;105cfu;106cfu;无菌水(阴性对照);
图2为实施例1中多重pcr引物特异性考察,
图2a中,各泳道所含菌株模板分别为:
lanes1~4:af1+st1;af1+st2;af2+st1;af2+st2;
lanes5~8:af1+ota1;af1+ota2;af2+ota1;af2+ota2;
lanes9~12:af1+fb1;af1+fb2;af2+fb1;af2+fb2;
lanes13~16:st1+ota1;st1+ota2;st2+ota1;st2+ota2;
lanes17~20:st1+fb1;st1+fb2;st2+fb1;st2+fb2;
lanes21~24:fb1+ota1;fb2+ota1;fb1+ota2;fb2+ota2;
图2b中,各泳道所含菌株模板分别为:
lanes1~4:af1+ota1+st1;af1+ota2+st2;af2+ota1+st1;af2+ota2+st2;
lanes5~8:ota1+af1+fb1;ota1+af2+fb2;ota2+af1+fb1;ota2+af2+fb2;
lanes9~12:fb1+ota1+st1;fb1+ota2+st2;fb2+ota1+st1;fb2+ota1+st2;
lanes13~16:fb1+ota2+st1;fb1+ota1+st2;fb2+ota2+st2;fb2+ota2+st2;
图2c中,各泳道所含菌株模板分别为:
lanes1~2:af1+ota1+st2;af1+ota2+st1;
lanes3~6:ota1+af1+fb2;ota1+af2+fb1;ota2+af1+fb2;ota1+af2+fb2;
lanes7~8:af1+fb1+st1;af2+fb2+st2。
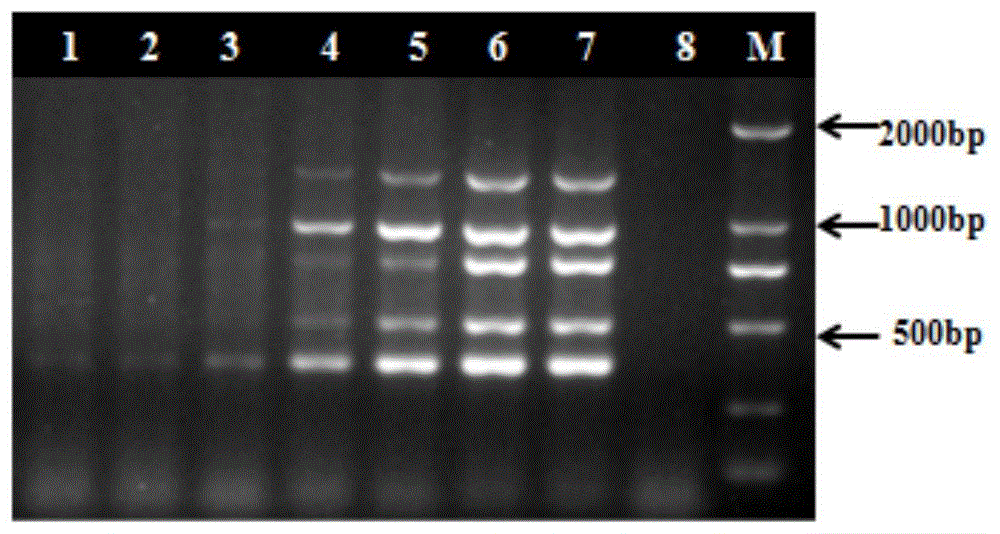
图3为实施例2中党参基质对多重pcr检测灵敏度的影响,
图中,lanes1~8:1cfu;10cfu;102cfu;103cfu;104cfu;105cfu;106cfu;无菌水(阴性对照);
图4为实施例2中15种药材基质对多重pcr检测灵敏度的影响;
图5为实施例3中多重pcr检测人工污染党参中4种产毒菌的检出限,
图中,lanes1~8:1cfu/g;10cfu/g;102cfu/g;103cfu/g;104cfu/g;105cfu/g;106cfu/g;无菌党参药材(阴性对照);
图6为实施例3中多重pcr检测人工感染15种药材中4种产毒菌的检出限。
具体实施方式
目前,对黄曲霉毒素产生菌、杂色曲霉毒素产生菌、赭曲霉毒素产生菌等4类产毒真菌同时进行多重pcr检测还没见报道。本发明利用一组5对引物对,选用黄曲霉毒素合成基因af,黄曲霉毒素、杂色曲霉毒素共同的合成基因afst,赭曲霉毒素合成基因ota,鉴定样品是否属于真菌的真菌rdna基因wen,fum并利用优化的pcr体系(引物配比、模板量、pcr扩增梯度等),可以同时鉴别这四类产毒真菌。
目前,多重pcr检测技术主要应用于食品微生物的检测,而在中药材方面报道甚少。基于建立的多重pcr方法,结合优化的中药材表面污染4类产毒真菌菌体的洗脱、裂解以及dna提取及纯化方法,可以对常见的多种中药材表面污染的产毒真菌的情况做出准确判断。
目前传统分离纯化耗长,至少一周;而利用本发明的方法直接检测,从药材表面菌获取、表面菌dna提取、pcr扩增,总耗时不超过6小时,显著提高了效率。
基于本发明的多重pcr方法的pcr产物序列,可进一步利用环介导等温扩增技术、基因芯片、dna阵列技术等开发相关的快速检测方法。
本发明的多重pcr方法,还可以应用于食品的检测,如花生、玉米、大米、芝麻等。
现结合附图与具体实施例对本发明作进一步说明。
本发明所用的实验材料为产afs菌、产st菌、产fb菌以及产ota菌。产afs菌包括黄曲霉菌(a.flavusas3.4410)、寄生曲霉(a.parasiticusas3.6156),产st菌包括杂色曲霉菌(a.versicoloras3.4413)、产st菌1(苦杏仁中分离),产ota菌包括赭曲霉菌(a.ochraceusas3.4520)和鲜绿青霉(p.viridicatumas3.4520)等菌株,购买于中国科学院微生物所菌种保藏中心(gcmcc)或者药材表面分离得到;产fb菌包括串珠镰刀菌(fusariumverticillioidesbncc340687)、fusariummoniliforme(bncc195387)购买自北纳创联生物有限公司。
实施例1建立多重pcr及方法学考察
1.产毒菌dna的提取、纯化方法(改良的ctab法)。
取浓度为2×107cfu/mlafs产生菌菌液1ml,10000rpm/min离心5min,弃上清。并参考传统的ctab法以及结合核酸纯化柱,对真菌基因组dna进行提取、纯化。
具体步骤如下:
将培养好的产毒菌从pda平板上洗脱,离心收集。往菌体中加入玻璃珠0.3g,加入真菌裂解液,振荡15min,恒温水浴25min,放置3min,添加等量的氯仿:异戊醇(24:1),振荡,离心,取上清,加入2/3v/v异丙醇混匀,转移至核酸dna纯化柱中,静置3min,高速离心1min,加入70%乙醇洗脱,收集洗脱液,-20℃保存,备用。
2.引物
本发明所用引物如表1所示。
表1引物序列
pcr反应体系如下:
反应条件优化参数如下:
3.方法学考察
3.1.灵敏度
将4种产毒菌株(as3.4410、as3.4520和as3.4413、fusariumverticillioides)分别接种于pda平板上,培养,收集菌株,加入适量0.1%吐温20稀释成8×107cfu/ml,等量混合,然后十倍法逐步稀释(2×102~107cfu/ml),使用改良ctab法提取dna,作为模板,进行多重pcr灵敏度试验。pcr反应条件及体系按照上述2项进行。
所得pcr产物进行琼脂糖凝胶电泳分离以及凝胶成像系统拍照观察。
结果见图1,显示:多重pcr同时检测4类产毒真菌的灵敏度均达103cfu,均符合实验要求。
3.2.特异性
收集8株菌株(2株afs菌、2株st菌、2株ota菌,2株fum菌将各菌株涂布于pda平板上,培养,接着按照改良的ctab方法提取dna,作为模板(不同产毒菌模板之间组合),进行多重pcr扩增。pcr反应条件及体系按照上述2项进行。所得pcr产物进行琼脂糖凝胶电泳。
结果见图2a-2c,显示:多重pcr反应体系的引物af-1、ota-1、afst-1、fum-1这4对引物特异性强,能够同时检测产生这4种毒素的菌株。
4.总结
选用产afs菌、st菌以及ota菌等作为研究对象,采用改良的ctab法提取产毒真菌基因组dna作为模板,建立了五重pcr同时检测4类产毒真菌方法,方法学考察结果显示:鉴定各引物特异性强,多重pcr检测灵敏度均达103cfu,检测灵敏度高。
实施例2建立中药材表面污染4类产毒真菌的多重pcr检测体系
1.药材
党参、百合、枸杞、麦冬、黄芪、人参、三七、岗梅、苦杏仁、桃仁、巴戟天、山药、石斛、熟地、佛手。以党参作为代表药材,基于利用纯菌建立的4类产毒真菌的多重pcr检测方法,建立中药材表面污染4类产毒真菌的多重pcr检测体系。
2.基于中药材的多重pcr检测灵敏度考察
称取党参1.0g,采用改良ctab法(按照实施例1中1项方法)提取药材基质,记为a;分别提取4种产毒菌混合菌(as3.4410菌、as3.4520菌和as3.4413菌、fusariumverticillioides菌,菌量2×10~106cfu)基因组dna,记为b;将a与b等量混合(单位ng/g),作为模板,进行多重pcr扩增(按照实施例1中3项方法),电泳检测。
结果见图3,显示:含有党参药材基质检测体系中,多重pcr检测灵敏度均可达103cfu,与纯菌检测结果比较,灵敏度没有明显提高或者降低。因此,4种产毒菌检测灵敏度不受党参药材基质干扰。
同时,也完成了巴戟天等其他15种药材基质对多重pcr检测灵敏度试验,结果见图4,显示:4种产毒菌多重pcr检测灵敏度均达103~104cfu间(除枸杞外),均符合实验要求。
3.总结
以党参药材为代表,建立一种基于中药材表面污染4类产毒真菌的多重pcr检测体系,方法学考察结果显示:引物特异性强;多重pcr检测灵敏度均达103~104cfu,与纯菌株结果比较,药材基质对灵敏度影响较低;以此同时,选择三七等15种药材作为研究对象,对多重pcr普遍适用性考察,结果表明该多重pcr检测药材适用范围广。
实施例3应用所建立的多重pcr检测体系,对阳性药材进行检测
人工感染药材检出限试验:
取空白党参药材6份,每份2.0g,分别浸泡于不同浓度梯度(2×102~107cpu/ml)的产毒菌溶液中30s,取出,吸干,于无菌培养皿中,放置12~16h后(室内开抽风),分别收集于50mlep管中,加入0.1%吐温20,剧烈振荡,取混悬液滤过,收集滤液(滤渣药材烘干),离心,弃上清,取菌体加入裂解液,按照改良的ctab方法(按照实施例1中1项方法)提取药材表面菌dna,备用。作为模板,进行多重pcr检出限试验。pcr反应条件及体系按照实施例1中3项方法。所得pcr产物进行琼脂糖凝胶电泳。
结果见图5,显示:4种产毒菌各自的多重pcr检出限可达103cfu/g,符合实验要求,成功完成人工感染党参药材检出限试验。
同时,也完成了巴戟天等15种人工感染药材产毒真菌多重pcr检出限试验,结果见图6,显示:除了枸杞外,其他14种药材的四种产毒菌单重pcr检出限均达103~104cfu/g之间;枸杞中产毒菌检出限在105cfu/g,但符合实验要求。
本发明并不局限于上述实施方式,如果对本发明的各种改动或变型不脱离本发明的精神和范围,倘若这些改动和变型属于本发明的权利要求和等同技术范围之内,则本发明也意图包含这些改动和变动。
序列表
<110>广州中医药大学
<120>同时检测中药材污染四类产毒真菌的多重pcr引物、方法及试剂盒
<160>10
<170>siposequencelisting1.0
<210>1
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttccatgcgagcccaacctccc22
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
aggggacgacgacccaaaca20
<210>3
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>3
gtggacggacctagtccgacatcac25
<210>4
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>4
gtcggcgccacgcactgggttgggg25
<210>5
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>5
ggcccttgtggtggggttcaaatcggtga29
<210>6
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>6
cttaggtgacgacttggcgggctttgatc29
<210>7
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>7
gccagaccatcgacactgcatgctc25
<210>8
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>8
cgactggcgttccagtaccatgagcc26
<210>9
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>9
gagcttgtccttctcactgg20
<210>10
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>10
gagccgacatcataatcagt20
- 还没有人留言评论。精彩留言会获得点赞!