一种L-2-氨基丁酸的制备方法与流程
本发明属于酶催化领域,尤其涉及一种l-2-氨基丁酸的制备方法。
背景技术:
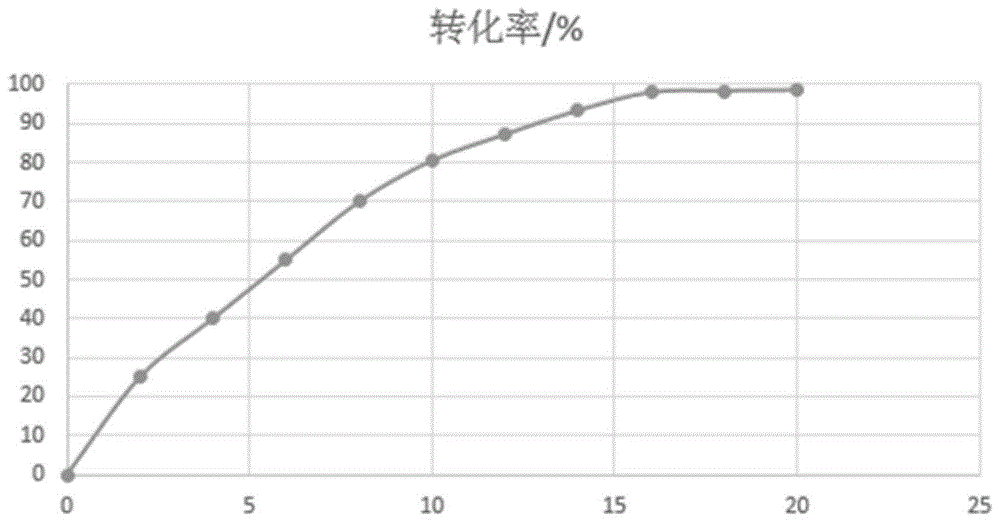
:l-2-氨基丁酸是一种非天然手性氨基酸,具有抑制人体神经信息传递、加强葡萄糖磷酸酯酶的活性和促进脑细胞代谢的作用,是一种重要的化工原料和医药中间体,已经广泛应用于药物合成,例如抑菌抗结核药物乙胺丁醇盐酸盐、抗癫痫药物左乙拉西坦和布瓦西坦等。目前,国内外l-2-氨基丁酸的生产方法分为化学法和生物酶法,化学法是比较经典的方法,主要有化学合成和化学拆分。化学合成主要是以正丁酸和溴为起始原料,经过α卤代反应制得α-溴丁酸,在氨水中合成氨基丁酸,化学拆分法是用手型拆分剂,但是因为使用到昂贵的手型拆分试剂,成本比较高,工业生产不宜采用,而且产生大量的有机废溶剂污染环境。生物酶法包括微生物发酵法和酶催化转化法,微生物发酵法反应产物成分复杂,分离繁琐,酶催化转化则是一种高选择性反应,从而达到定向转化的目的。酶催化转化法制备l-2-氨基丁酸主要有两种:一是对消旋的α-氨基丁酸进行酶法拆分制备,主要是用醋酐乙酰化氨基丁酸,然后再用氨基酰化酶进行拆分,反应步骤多,收率偏低;二是以α-羰基丁酸为原料,此法反应底物浓度低,生产成本高。申请号为201010146920.6,名称为“一种酶法制备l-2-氨基丁酸的方法”的中国专利,其公开的方案是:采用l-苏氨酸为起始原料,首先通过苏氨酸脱氨酶使其转化为2-酮丁酸,然后利用亮氨酸脱氢酶使2-酮丁酸转化生成l-2-氨基丁酸,反应中加入用于辅酶再生的甲酸脱氢酶。这种方法制备l-2-氨基丁酸,以结晶的方式进行产物分离,大大提高了产物纯度,但是却并未涉及到l-2-氨基丁酸的转化率的问题。技术实现要素:本发明的目的在于提供一种高转化率、低成本且易于工业化大生产的l-2-氨基丁酸的制备方法。为实现上述目的,本发明采用的技术方案为:一种l-2-氨基丁酸的制备方法,在底物中加入酶催化剂和酶激活剂,所述底物为苏氨酸和甲酸铵,所述酶催化剂为苏氨酸脱氨酶、亮氨酸脱氢酶和甲酸脱氢酶,所述酶激活剂为磷酸盐。上述制备l-2-氨基丁酸的方法,采用磷酸盐作为酶激活剂,与亮氨酸脱氢酶配合使用,将反应的中间产物迅速转化,使三种酶的催化速率相互匹配,提高了酶催化的转化效率,避免了副产物的堆积现象,不仅提高了产物的收率,更加有利于产物的分离提纯。作为优选方案,所述l-2-氨基丁酸的制备方法,其具体步骤为:a)向水中加入苏氨酸和甲酸铵,配制成转化液a;b)向转化液中加入磷酸盐得溶液b;c)向溶液b中加入苏氨酸脱氨酶、亮氨酸脱氢酶和甲酸脱氢酶,在(30±5)℃条件下反应16~20h,反应结束后即得l-氨基丁酸溶液。优选的,苏氨酸与甲酸铵的质量比为2:(1~2)。具体地,苏氨酸和甲酸铵加入后,二者浓度分别为100~200g/l和50~200g/l。合成过程中所用水为自来水,无需对用水作蒸馏或者去离子等处理,因此本发明的方法降低了对反应环境的要求,同时也降低了生产成本投入。优选的,磷酸盐加入量为:磷酸根离子浓度为0.5mmol~20mmol/l。磷酸根离子作为酶激活剂,可以提高酶活性,配合亮氨酸脱氢酶使用,快速转化中间产物,进一步促进了初始反应的速率,三种酶的催化速率相互匹配,提高了酶催化的转化效率,避免了副产物的堆积现象。但是大量引入磷酸根离子后增加了去除难度,最终会影响产品纯度,因此在实现酶激活剂的作用的同时,需要尽可能少的引入磷酸根离子。具体地,所述磷酸盐为磷酸二氢铵、磷酸氢二钠、磷酸二氢钠、磷酸氢二铵、磷酸氢钙、磷酸钙、焦磷酸钙、磷酸二氢钾、磷酸氢二钾、酸式焦磷酸钠、磷酸钠、焦磷酸钠中的至少一种。加入磷酸盐后,加入ph调节剂调节混合溶液的ph值至7~8,所述ph调节剂为氨水、氢氧化钠、氢氧化钾中的至少一种。优选的,加入产苏氨酸脱氨酶、亮氨酸脱氢酶和甲酸脱氢酶的微生物菌液后,总酶浓度为3~6u。其中,酶活定义为:每毫升转化液每分钟产生1μmol的l-2-氨基丁酸为一个酶活单位。本发明方案中酶的来源为:将大肠杆菌来源的l-苏氨酸脱氨酶(核苷酸序列是ncbi上geneid:948287)、芽孢杆菌来源的l-亮氨酸脱氢酶(ncbi上geneid:1206507)、博伊丁假丝酵母的甲酸脱氢酶(ncbi上genbank:km454879.1),通过基因工程菌的方法导入到大肠杆菌中,构建同时产l-苏氨酸脱氢酶、l-亮氨酸脱氢酶、甲酸脱氢酶的基因工程菌,避免酶的纯化步骤,使用更方便。附图说明图1为实施例1的反应过程中转化率随时间变化的折线图。具体实施方式一、制备实施例1向10l反应釜中加入1200g苏氨酸、1200g甲酸铵、磷酸二氢铵,加水搅拌溶解,然后用20-25%氨水调节ph至7.5,升温至30℃,然后加入产苏氨酸脱氨酶、亮氨酸脱氢酶和甲酸脱氢酶的菌泥,其中,磷酸根离子浓度为20mmol/l,混合液中总酶浓度为6u,将混合液置于30℃恒温条件下搅拌反应,16h后反应结束,得到l-氨基丁酸溶液。实施例2向10l反应釜中加入1200g苏氨酸、600g甲酸铵、磷酸氢二铵,加水搅拌溶解,然后用20-25%氨水调节ph至7.5,升温至30℃,然后加入产苏氨酸脱氨酶、亮氨酸脱氢酶和甲酸脱氢酶的菌泥,其中,磷酸根离子浓度为10mmol/l,混合液中总酶浓度为4u,将混合液置于30℃恒温条件下搅拌反应,20h后反应结束,得到l-氨基丁酸溶液。实施例3向10l反应釜中加入1200g苏氨酸、800g甲酸铵、焦磷酸钠,加水搅拌溶解,然后用20-25%氨水调节ph至7.7,升温至30℃,然后加入产苏氨酸脱氨酶、亮氨酸脱氢酶和甲酸脱氢酶的菌泥,其中,磷酸根离子浓度为15mmol/l,混合液中总酶浓度为6u,将混合液置于30℃恒温条件下搅拌反应,18h后反应结束,得到l-氨基丁酸溶液。二、检测将实施例1反应过程中,每隔两小时用液相色谱仪检测反应体系中苏氨酸和l-氨基丁酸的含量,并计算转化率。检测方法如下:在ep管中依次加入ph=9.5的硼酸缓冲液300ul,转化液样品250ul,衍生剂200ul(取0.3430g邻苯二甲醛+5ml无水乙醇+0.1472gn-乙酰-l半胱氨酸,用0.1mol/l硼砂缓冲液(ph=9.5)定溶到25ml,避光备用),混匀后等待2分钟,严格控制时间和试剂添加量,然后进样。所需的化合物用0.05mol/l醋酸钠缓冲液∶甲醇=63∶35进行洗脱,流速1.0ml/min,采集时间为10min。色谱条件为xdb-c8(150mm)中性柱,柱温30℃,检测波长334nm。各个时间点所得的转化率记录入表1中,并作出转化率随时间变化的折线图,见附图1。表1实施例1各时间点的转化率反应时间/h2468101214161820转化率/%25.240.055.370.180.587.293.498.098.498.6由表1可知,采用实施例1的制备方法制备的l-氨基丁酸溶液,苏氨酸转化为l-氨基丁酸的转化率为98.6%。按照上述方法,检测实施例2和实施例3反应过程中和反应结束后体系的转化率,得到最终结果:实施例2中反应的转化率为98.1%,实施例3中反应的转化率为98.4%,可见,本发明的制备方法制备l-氨基丁酸,转化率高达98%以上。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1