耳坠型卟啉衍生物及其制备方法和应用与流程
本发明涉及光学材料领域,特别是涉及一种耳坠型卟啉衍生物及其制备方法和应用。
背景技术:
卟啉类化合物具有独特的结构和优越的物理化学性能,它们在生命科学、生物化学、药物化学、材料化学及超分子化学等领域得到了广泛的研究和应用,例如电子相互作用的卟啉阵列由于在光电器件、传感器、光伏器件、非线性光学材料和光动力疗法染料等领域的潜在应用而受到广泛的关注。最近报道的耳坠型卟啉作为一类新型的卟啉衍生物,具有两个或三个空腔,每个空腔可以配位一个金属。金属配位促进了“耳坠”与卟啉的电子相互作用,使化合物的吸收光谱发生大幅度红移,在近红外区域的吸收有所增强。但是,耳坠型卟啉虽然在近红外区域有吸收,但吸收仍然较弱,还需要寻找方法提高其在近红外区域的吸收。
技术实现要素:
基于此,有必要提供一种在近红外区域的吸收较强的耳坠型卟啉衍生物。
一种耳坠型卟啉衍生物,所述耳坠型卟啉衍生物选自如下通式1~12所示的化合物:
其中,ar1为
本发明通过在耳坠型卟啉上引入了噻吩基或吡咯基,且进一步通过氧化偶联使卟啉环与杂环稠合起来,得到噻吩或吡咯稠合的环桥联耳坠型卟啉。通过光谱测定发现,与文献报道的耳坠型卟啉相比,本发明合成的如通式1~12所示的耳坠型卟啉衍生物在近红外区域的吸收进一步增强,为开发新型的近红外材料提供了一类新的分子模块。
在其中一个实施例中,所述耳坠型卟啉衍生物选自通式2~3、通式7~8和通式10~12所示的化合物。
在其中一个实施例中,所述耳坠型卟啉衍生物选自通式2、通式7和通式10~12所示的化合物。
在其中一个实施例中,所述m为镍。
本发明还提供了一种上述耳坠型卟啉衍生物的制备方法,包括以下步骤:
通过如下通式13所示的化合物与n-溴代琥珀酰亚胺反应,得到如下通式14所示的化合物;
通过通式14所示的化合物与如下通式15所示的化合物反应,得到通式1所示的化合物;
通过通式14所示的化合物与如下通式16所示的化合物反应,得到通式2~4所示的化合物;
通过通式14所示的化合物与吡咯反应,得到通式5所示的化合物;
分别通过通式1~4所示的化合物与醋酸钯反应,得到通式6~9所示的化合物;
分别通过通式6和通式9所示的化合物经关环反应,得到通式10和通式11所示的化合物;
通过通式11所示的化合物脱去保护基团boc,得到通式12所示的化合物。
在其中一个实施例中,通式13所示的化合物与n-溴代琥珀酰亚胺反应的反应条件为:以三氯甲烷为溶剂,在0℃~5℃与n-溴代琥珀酰亚胺反应。
在其中一个实施例中,通式14所示的化合物与通式15所示的化合物反应的反应条件为:以三(二亚苄基丙酮)二钯为催化剂、2-双环己基磷-2',6'-二甲氧基联苯为配体、碳酸铯和氟化铯为碱,以甲苯、n,n-二甲基甲酰胺为溶剂,在惰性气体保护下回流反应45小时~50小时。
在其中一个实施例中,通式1~4所示的化合物与醋酸钯反应的反应条件为:以二氯甲烷和甲醇为溶剂,在碱性条件下于20℃~30℃反应。
在其中一个实施例中,所述关环反应的条件为:以三氯化铁为氧化剂,以二氯甲烷和硝基甲烷为溶剂,在惰性气体保护下于0℃~5℃反应。
本发明还提供了上述耳坠型卟啉衍生物在制备近红外吸收材料中的应用。
附图说明
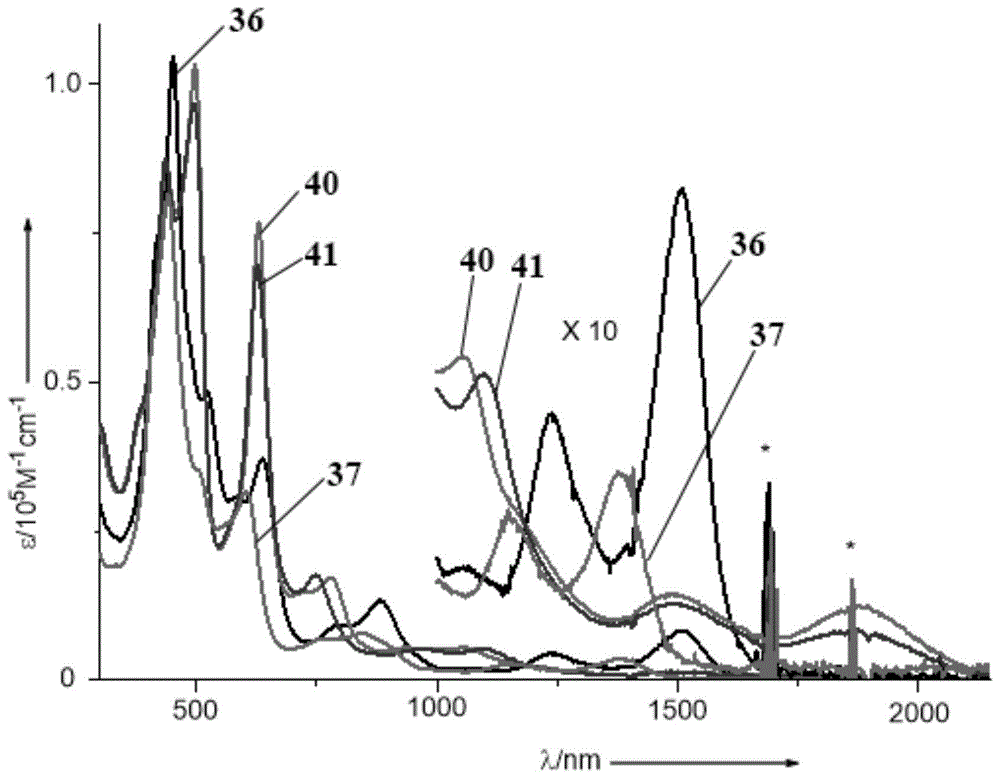
图1为结构式36、37、40和41所示的化合物的的紫外吸收图谱;
图2为现有的耳坠型卟啉金属衍生物和结构式34、38所示的化合物的紫外吸收图谱;
图3结构式29、30、31所示的化合物的紫外吸收图谱。
具体实施方式
为了便于理解本发明,下面将对本发明进行更全面的描述,并给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
本发明一实施例的耳坠型卟啉衍生物,选自如下通式1~12所示的化合物:
其中,ar1为
本发明通过在耳坠型卟啉上引入了噻吩基或吡咯基,且进一步通过氧化偶联使卟啉环与杂环稠合起来,得到噻吩或吡咯稠合的环桥联耳坠型卟啉。通过光谱测定发现,与文献报道的耳坠型卟啉相比,本发明合成的如通式1~12所示的耳坠型卟啉衍生物在近红外区域的吸收进一步增强,为开发新型的近红外材料提供了一类新的分子模块。
在一个具体示例中,耳坠型卟啉衍生物选自通式2~3、通式7~8和通式10~12所示的化合物,这些耳坠型卟啉衍生物在近红外区域的吸收显著增强。
在一个具体示例中,耳坠型卟啉衍生物选自通式2、通式7和通式10~12所示的化合物,这些耳坠型卟啉衍生物在近红外区域的吸收最强。
可选地,m为金属镍。可以理解,不限于此,m也可以是钒、铁、铜、钴、锌等。
本发明一实施例的耳坠型卟啉衍生物的制备方法,包括以下步骤s1~s7:
s1、通过如下通式13所示的化合物与n-溴代琥珀酰亚胺反应,得到如下通式14所示的化合物;
s2、通过通式14所示的化合物与如下通式15所示的化合物反应,得到通式1所示的化合物;
s3、通过通式14所示的化合物与如下通式16所示的化合物反应,得到通式2~4所示的化合物;
s4、通过通式14所示的化合物与吡咯反应,得到通式5所示的化合物。
s5、分别通过通式1~4所示的化合物与醋酸钯反应,得到通式6~9所示的化合物。
s6、分别通过通式6和通式9所示的化合物经关环反应,得到通式10和通式11所示的化合物。
s7、通过通式11所示的化合物脱去保护基团boc,得到通式12所示的化合物。
可以理解,在制备耳坠型卟啉衍生物时,步骤s1~s7不一定都要执行,在已经得到相应的目标物之后,用于获得其他物质的步骤则无需执行。
在一个具体示例中,通式13所示的化合物与n-溴代琥珀酰亚胺(nbs)反应的反应条件为:以三氯甲烷(chcl3)为溶剂,在0℃~5℃与n-溴代琥珀酰亚胺反应。
在一个具体示例中,通式14所示的化合物与通式15所示的化合物反应的反应条件为:以三(二亚苄基丙酮)二钯(pd2(dba)3)为催化剂、2-双环己基磷-2',6'-二甲氧基联苯(sphos)为配体、碳酸铯(cs2co3)和氟化铯(csf)为碱,以甲苯(toluene)、n,n-二甲基甲酰胺(dmf)为溶剂,在惰性气体保护下回流反应45小时~50小时。
在一个具体示例中,通式1~4所示的化合物与醋酸钯反应的反应条件为:以二氯甲烷和甲醇为溶剂,在碱性条件下于20℃~30℃反应。
在一个具体示例中,关环反应的条件为:以三氯化铁为氧化剂,以二氯甲烷和硝基甲烷为溶剂,在惰性气体保护下于0℃~5℃反应。
在一个具体示例中,通式14所示的化合物与通式16所示的化合物反应的反应条件为:以三(二亚苄基丙酮)二钯为催化剂、2-双环己基磷-2',6'-二甲氧基联苯为配体、碳酸铯和氟化铯为碱,以甲苯、n,n-二甲基甲酰胺为溶剂,在惰性气体保护下回流反应45小时~50小时。
在一个具体示例中,通式11所示的化合物脱去保护基团boc的反应条件为:以三氟乙酸为催化剂,以二氯甲烷为溶剂,在室温下反应。
在一个具体示例中,通式14所示的化合物与吡咯反应的反应条件为:以三(二亚苄基丙酮)二钯为催化剂、2-双环己基磷-2',6'-二甲氧基联苯为配体、t-buona(叔丁醇钠)为碱,以甲苯、n,n-二甲基甲酰胺为溶剂,在惰性气体保护下回流反应45小时~50小时。
以下为具体实施例。
一、合成溴代耳坠型卟啉
向干燥的500ml单口瓶中加入结构式23所示的化合物(277mg,0.2mmol),再加入150ml三氯甲烷充分溶解,在冰水浴中搅拌10min。称取nbs(71.2mg,0.4mmol)溶解在10ml三氯甲烷中,然后向500ml单口瓶中缓慢滴加。滴加完成后,点板监测反应进程,等到反应混合物基本为结构式24所示的化合物时,取少量丙酮淬灭,再用分液漏斗水洗两次,三氯甲烷为溶剂萃取,静置分层,下层用无水硫酸钠干燥,旋转蒸发回收溶剂。残余固体用硅胶柱层析分离,再用二氯甲烷和甲醇重结晶,得到黑色固体(197.5mg,0.128mmol),产率为64%,反应式如下所示,核磁共振数据:1hnmr(500mhz,cdcl3)δ=16.57(s,1h,nh),15.42(s,1h,meso-h),9.18(s,2h,β-h),8.42(d,j=4.5hz,2h,β-h),8.36(d,j=4.5hz,2h,β-h),7.72(s,2h,ar-o-h),7.69(br,4h,ar-o-h),7.63(s,3h,ar-p-h),6.89(s,4h,ar-m-h),6.46(s,2h,pyrrole-h),5.51(s,2h,pyrrole-h),2.32(s,6h,me-h),2.24(s,12h,me-h),1.42(m,54h,t-bu-h)ppm;maldi-tof-ms:m/z=1543.51[m]+,calcdfor(c94h97n7br2ni)+=1543.55。
二、合成噻吩桥联的耳坠型卟啉衍生物
向干燥的schlenk反应管中依次加入结构式24所示的化合物(100mg,0.065mmol),通式15所示的化合物(68.25mg,0.325mmol),pd2(dba)3(5.95mg,0.0065mmol),sphos(10.67mg,0.026mmol),cs2co3(42.36mg,0.13mmol),csf(19.75mg,0.13mmol),用注射器加入4ml超干甲苯,2ml超干dmf。然后,冷冻、抽真空循环三次,第三次冷冻结束之后通入氩气,在氩气保护的状态下加热回流反应48h。待反应完成后,冷却至室温,水洗两次,用三氯甲烷萃取,萃取后下层倒入硫酸钠和短硅胶的柱子上,旋转蒸发回收溶剂。剩余物用硅胶柱层析分离,再用二氯甲烷和甲醇重结晶,得到黑色固体即结构式27所示的化合物(26.2mg,0.0169mmol),产率为26%,反应式如下所示,核磁共振数据:1hnmr(500mhz,cdcl3):δ=16.28(s,1h,pyrrole-nh),15.33(s,1h,meso-h),8.45(d,j=5.0hz,2h,β-h),8.42(d,j=5.0hz,2h,β-h),7.91(s,2h,β-h),7.74(d,j=1.5hz,2h,ar-o-h),7.65(m,1h,ar-p-h),7.54(m,2h,ar-p-h),7.49(d,j=1.5hz,4h,ar-o-h),7.00(d,j=5.0hz,2h,thiophene-α-h),6.89(s,4h,ar-m-h),6.70–6.65(m,2h,thiophene-β-h),6.62(d,j=3.0hz,2h,thiophene-β-h),6.38(s,2h,pyrrole-β-h),5.59(s,2h,pyrrole-β-h),2.32(d,j=6.0hz,6h,me-h),2.28(s,12h,me-h),1.43(s,18h,t-bu-h),1.38(s,36h,t-bu-h)ppm;maldi-tof-ms:m/z=1548.65[m]+,calcdfor(c102h103n7nis2)+=1548.71。
三、合成吡咯桥联的耳坠型卟啉衍生物
向schlenk反应管中依次加入结构式24所示的化合物(100mg,0.065mmol),通式16所示的化合物(68.6mg,0.325mmol),pd2(dba)3(6.0mg,0.007mmol),sphos(10.67mg,0.026mmol),cs2co3(42.36mg,0,13mmol),csf(19.75mg,0.13mmol),用注射器加入4ml超干甲苯,2ml超干dmf。然后,冷冻、抽真空循环三次,第三次冷冻结束之后通入氩气,在氩气保护的状态下加热115℃回流反应48h。待反应完成后,冷却至室温,水洗两次,用三氯甲烷萃取,萃取后下层倒入硫酸钠和短硅胶的柱子上,旋转蒸发回收溶剂。剩余物用硅胶柱层析分离,再用二氯甲烷和甲醇重结晶,可以得到黄绿色固体即结构式29所示的化合物(10.8mg,0.007mmol),产率为11%,棕黑色固体即结构式30所示的化合物(8.4mg,0.0052mmol),产率为8%,另一棕黑色固体即结构式31所示的化合物(2.2mg,0.0013mmol),产率为2%。当该反应体系在85℃下加热反应22h,进行同样的后处理,过柱分离后能得到微量的结构式29所示的化合物,结构式30所示的化合物(2.3mg,0.0014mmol),产率为2.2%,结构式31所示的化合物(35.6mg,0.021mmol),产率为32%,反应式如下所示。结构式29所示的化合物的核磁共振数据:1hnmr(500mhz,cdcl3)δ=19.07(s,1h,nh),17.40(s,1h,meso-h),8.38(d,j=5.0hz,2h,β-h),8.24(d,j=5.0hz,2h,β-h),7.87(d,j=1.5hz,4h,ar-o-h),7.79(d,2h,j=1.5hz,ar-o-h),7.69(m,1h,ar-p-h),7.51(m,2h,ar-p-h),6.90(s,4h,ar-m-h),6.04(d,j=4.0hz,2h,pyrrole-h),5.87(d,j=3.0hz,2h,pyrrole-h),5.83(s,2h,pyrrole-h),5.52(t,j=3.5hz,2h,pyrrole-h),5.22(s,2h,pyrrole-h),2.37(s,12h,me-h),2.32(s,6h,me-h),1.49(s,18h,t-bu-h),1.34(s,36h,t-bu-h)ppm,maldi-tof-ms:m/z=1510.76[m]+,calcdfor(c102h101n9ni)+=1510.84。结构式30所示的化合物的核磁共振数据:1hnmr(500mhz,cdcl3)δ=17.87(s,1h,nh),16.21(s,1h,meso-h),8.49(d,j=5.0hz,1h,β-h),8.36(d,j=5.0hz,1h,β-h),8.29(d,j=5.0hz,1h,β-h),8.24(d,j=5.0hz,1h,β-h),7.83(d,j=1.5hz,2h,ar-h),7.68(s,1h,ar-h),7.59(s,1h,ar-h),7.52(s,1h,ar-h),6.93(s,2h,ar-h),6.86(s,2h,ar-h),6.84(m1h,β-h),6.61(s,1h,pyrrole-h),6.13(d,j=3.5hz,1h,pyrrole-h),6.07(s,1h,pyrrole-h),6.04(s,1h,pyrrole-h),5.88(m,2h,pyrrole-h),5.71(t,j=3.0hz,1h,pyrrole-h),5.56(t,j=3.5hz,1h,pyrrole-h),5.42(dd,j=4.0,2.0hz,1h,pyrrole-h),5.37(dd,j=4.0,2.0hz,1h,pyrrole-h),2.37(s,5h,me-h),2.35(s,4h,me-h),2.32(s,5h,me-h),2.28(s,4h,me-h),1.48(s,17h,t-bu-h),1.46(s,20h,t-bu-h),1.33(s,17h,t-bu-h),0.84(s,9h,boc-h)ppm。结构式31所示的化合物的核磁共振数据:1hnmr(500mhz,cdcl3):δ=16.76(s,1h,meso-h),15.95(s,1h,pyrrole-nh),8.42(m,4h,β-h),7.75(m,2h,ar-p-h),7.66(m,1h,ar-o-h),7.61(m,3h,ar-o-h),7.54(m,3h,ar-p-h),7.19(s,2h,β-h),6.88(m,6h,ar-m-handpyrrole-h),6.19(s,2h,pyrrole-h),5.94(m,2h,pyrrole-h),5.75(t,j=3.5hz,2h,pyrrole-h),5.49(d,j=2.0hz,2h,pyrrole-h),2.32(s,12h,me-h),2.30(s,6h,me-h),1.55(s,18h,boc-h),1.45(m,56h,t-bu-h)ppm,maldi-tof-ms:m/z=1714.94[m]+,calcdfor(c112h121n9nio4)+=1714.89。
向schlenk反应管中依次加入结构式24所示的化合物(100mg,0.065mmol),吡咯(0.03ml,0.325mmol),pd2(dba)3(6.0mg,0.007mmol),sphos(10.67mg,0.026mmol),t-buna(18.7mg,0.195mmol),用注射器加入6ml超干甲苯,2ml超干dmf。然后,冷冻、抽真空循环三次,第三次冷冻结束之后通入氩气,在氩气保护的状态下加热回流反应48h。待反应完成后,冷却至室温,水洗两次,用三氯甲烷萃取,萃取后下层倒入硫酸钠和短硅胶的柱子上,旋转蒸发回收溶剂。剩余物用硅胶柱层析分离,再用二氯甲烷和甲醇重结晶,可以得到红色固体即结构式32所示的化合物(11.8mg,0.0078mmol),产率为12%,反应式如下所示,核磁共振数据:1hnmr(500mhz,cdcl3):δ=16.20(s,1h,nh),15.23(s,1h,meso-h),8.47(s,4h,β-h),7.93(s,2h,β-h),7.84(m,2h,ar-p-h),7.74(m,2h,ar-o-h),7.66(m,1h,ar-p-h),7.55(s,2h,pyrrole-h),7.51(s,4h,ar-o-h),6.90(s,4h,ar-m-h),6.47(br,2h,pyrrole-h),6.29(s,2h,pyrrole-h),6.00(br,2h,pyrrole-h),5.95(br,2h,pyrrole-h),5.57(s,2h,pyrrole-h),2.33(s,6h,me-h),2.28(s,12h,me-h),1.44(s,18h,t-bu-h),1.37(s,36h,t-bu-h)ppm。
四、合成耳坠型卟啉金属衍生物
称量结构式27所示的化合物(46.5mg,0.03mmol)、醋酸钯(16.8mg,0.075mmol)、醋酸钠(7.4mg,0.09mmol)加入到100ml单口瓶中,再加入16ml二氯甲烷和2ml甲醇,在25℃下搅拌溶解。反应后点板监测,待反应只有一个绿色的带时,停止搅拌。将反应混合物过短硅胶除杂,用二氯甲烷洗脱。待洗脱完毕,旋转蒸发回收洗脱液,剩余物用少量二氯甲烷溶解,加甲醇重结晶,得到绿色固体即结构式34所示的化合物(46.3mg,0.028mmol),产率为95%,反应式如下所示,核磁共振数据:1hnmr(500mhz,cdcl3)δ=7.93(s,4h,β-h),7.60(s,2h,ar-o-h),7.58(s,1h,ar-p-h),7.47(s,2h,ar-p-h),7.36(s,4h,ar-o-h),6.82(d,j=4.0hz,2h,thiophene-h),6.77(s,4h,ar-m-h),6.52(s,2h,β-h),6.48–6.45(m,2h,thiophene-h),6.41(d,j=1.5hz,2h,thiophene-h),5.58(s,2h,pyrrole-h),5.19(s,2h,pyrrole-h),2.31(s,12h,me-h),2.22(s,6h,me-h),1.40(s,18h,t-bu-h),1.38(s,36h,t-bu-h)ppm,maldi-tof-ms:m/z=1653.55[m]+,calcdfor(c102h101n7nipds2)+=1653.60。
称量结构式29所示的化合物(15mg,0.01mmol)、醋酸钯(5.6mg,0.025mmol)、醋酸钠(2.5mg,0.03mmol)加入到100ml单口瓶中,再加入8ml二氯甲烷和1ml甲醇,在25℃下搅拌溶解。反应后点板监测,待反应只有一个绿色的带时,停止搅拌。将反应混合物过短硅胶除杂,用二氯甲烷洗脱。待洗脱完毕,旋转蒸发回收洗脱液,剩余物用少量二氯甲烷溶解,加甲醇重结晶,得到绿色固体即结构式36所示的化合物(14.5mg,0.009mmol),产率为90%,反应式如下所示,核磁共振数据:1hnmr(500mhz,cdcl3)δ=7.98(d,j=5.0hz,2h,β-h),7.84(d,j=5.0hz,2h,β-h),7.76(d,j=1.0hz,4h,ar-o-h),7.60(s,3h,ar-h),7.43(s,2h,ar-p-h),6.78(s,4h,ar-m-h),5.61(d,j=3.5hz,2h,py-h),5.25(t,j=3.5hz,2h,py-h),5.20(d,j=3.0hz,2h,py-h),4.92(s,2h,py-h),4.77(s,2h,py-h),2.40(s,12h,me-h),2.23(s,6h,me-h),1.43(s,18h,t-bu-h),1.32(s,36h,t-bu-h)ppm。
称量结构式30所示的化合物(15mg,0.01mmol)、醋酸钯(5.6mg,0.025mmol)、醋酸钠(2.5mg,0.03mmol)加入到100ml单口瓶中,再加入12ml二氯甲烷和3ml甲醇,在25℃下搅拌溶解。反应后点板监测,待反应只有一个绿色的带时,停止搅拌。将反应混合物过短硅胶除杂,用二氯甲烷洗脱。待洗脱完毕,旋转蒸发回收洗脱液,剩余物用少量二氯甲烷溶解,加甲醇重结晶,得到绿色固体即结构式37所示的化合物(14.8mg,0.0086mmol),产率为86%,反应式如下所示,核磁共振数据:1hnmr(500mhz,cdcl3)δ=8.05(d,j=5.0hz,1h,β-h),7.95(d,j=5.0hz,1h,β-h),7.82(d,j=5.0hz,1h,β-h),7.77(d,j=5.0hz,1h,β-h),7.61(s,2h,ar-h),7.51(m,4h,ar-h),7.42(s,2h,ar-h),6.88–6.73(m,4h,ar-h),6.70(s,1h,β-h),5.75–5.69(m,2h,py-h),5.61(s,1h,py-h),5.49(s,1h,py-h),5.31(d,j=3.0hz,1h,py-h),5.23(s,2h,py-h),5.19(s,1h,py-h),4.98(m,2h,py-h),2.62(s,5h,me-h),2.27(s,4h,me-h),2.18(s,5h,me-h),2.03(s,4h,me-h),1.45(s,38h,t-bu-h),1.27(s,16h,t-bu-h),1.15(s,9h,boc-h)ppm。
称量结构式31所示的化合物(51.5mg,0.03mmol)、醋酸钯(16.8mg,0.075mmol)、醋酸钠(7.4mg,0.09mmol)加入到100ml单口瓶中,再加入16ml二氯甲烷和2ml甲醇,在25℃下搅拌溶解。反应后点板监测,待反应只有一个绿色的带时,停止搅拌。将反应混合物过短硅胶除杂,用二氯甲烷洗脱。待洗脱完毕,旋转蒸发回收洗脱液,剩余物用少量二氯甲烷溶解,加甲醇重结晶,得到绿色固体即结构式38所示的化合物(51mg,0.028mmol),产率为95%,反应式如下所示,核磁共振数据:1hnmr(500mhz,cdcl3)δ=7.93(m,4h,β-h),7.61(s,2h,β-h),7.59(m,2h,ar-h),7.50(br,4h,ar-h),7.36(m,3h,ar-h),6.75(m,6h,ar-h),5.86(br,2h,pyrrole-h),5.69(br,2h,pyrrole-h),5.63(br,2h,pyrrole-h),5.43(s,2h,pyrrole-h),5.12(s,2h,pyrrole-h)ppm。
五、合成环桥联耳坠型卟啉衍生物
向schlenk反应管中加入结构式34所示的化合物(29.8mg,0.018mmol),反复抽真空通氩气排除反应管中的空气,用注射器加入6ml无水二氯甲烷,在氩气保护的状态下,放置在室温下搅拌溶解。另一根schlenk反应管中加入fecl3(58.4mg,0.36mmol),在氩气保护的状态下用注射器加入2ml硝基甲烷,置于室温下搅拌,待固体完全溶解。用注射器将三氯化铁溶液缓慢加入到反应物的二氯甲烷溶液中,在室温下搅拌反应3h,加入碳酸氢钠溶液淬灭,水洗两次,用二氯甲烷萃取,无水硫酸钠干燥,旋转蒸发回收溶剂。剩余物用硅胶柱层析分离,再用二氯甲烷和甲醇重结晶,得到绿色固体即结构式40所示的化合物(15.5mg,0.0094mmol),产率为52%,反应式如下所示,核磁共振数据:1hnmr(500mhz,cdcl3)δ=7.61(d,j=1.5hz,4h,ar-o-h),7.54(d,j=5.0hz,2h,β-h),7.47(m,1h,ar-p-h),7.38(d,j=5.0hz,2h,β-h),7.32(d,j=1.5hz,2h,ar-o-h),7.30(m,2h,ar-p-h),6.55(s,4h,ar-m-h),5.69(d,j=5.5hz,2h,thiophene-h),4.22(d,j=5.5hz,2h,thiophene-h),3.51(s,2h,pyrrole-β-h),3.36(s,2h,pyrrole-β-h),2.50(s,12h,me-h),2.06(s,6h,me-h),1.34(s,18h,t-bu-h),1.29(s,43h,t-bu-h)ppm,maldi-tof-ms:m/z=1650.60[m]+,calcdfor(c102h97n7nipds2)+=1649.57。
向schlenk反应管中加入结构式38所示的化合物(20mg,0.012mmol),反复抽真空通氩气排除反应管中的空气,用注射器加入15ml无水二氯甲烷,在氩气保护的状态下,放置在冰水浴中搅拌溶解。另一根schlenk反应管中加入fecl3(15.6mg,0.1mmol),在氩气保护的状态下用注射器加入1ml硝基甲烷,置于冰水浴中搅拌,待固体完全溶解。用注射器将三氯化铁溶液缓慢加入到反应物的二氯甲烷溶液中,在冰水浴中搅拌反应50min,加入碳酸氢钠溶液淬灭,水洗两次,用二氯甲烷萃取,无水硫酸钠干燥,旋转蒸发回收溶剂。剩余物用硅胶柱层析分离,再用少量二氯甲烷溶解,甲醇重结晶,得到绿色固体即结构式41所示的化合物(10.9mg,0.006mmol),产率为50%,反应式如下所示,核磁共振数据:1hnmr(500mhz,cdcl3)δ=7.57(d,j=2.0hz,4h,ar-o-h),7.46(m,1h,ar-p-h),7.44(d,j=5.0hz,2h,β-h),7.36(d,j=5.0hz,2h,β-h),7.34(d,j=2.0hz,2h,ar-o-h),7.32(m,2h,ar-p-h),6.52(s,4h,ar-m-h),5.88(d,j=4.0hz,2h,pyrrole-h),3.91(s,2h,pyrrole-h),3.54(s,2h,pyrrole-h),3.31(d,j=4.0hz,2h,pyrrole-h),2.47(s,12h,me-h),2.04(s,6h,me-h),1.33(s,18h,t-bu-h),1.30(s,36h,t-bu-h),0.99(s,18h,boc-h)ppm。
向50ml的圆底反应瓶中加入结构式41所示的化合物(14.4mg,0.008mmol),再加入10ml二氯甲烷溶解,加入2ml三氟乙酸,在室温下搅拌。tlc监测反应完全后,将反应液倒入分液漏斗中,先用碳酸氢钠溶液洗,再水洗两次,用二氯甲烷萃取,无水硫酸钠干燥,旋转蒸发回收溶剂。剩余物用硅胶柱层析分离,再用二氯甲烷和甲醇重结晶,得到绿色固体即结构式42所示的化合物(4.8mg,0.003mmol),产率为37%,反应式如下所示,核磁共振数据:1hnmr(500mhz,cdcl3)δ=7.53(d,j=2.0hz,4h,ar-o-h),7.45(m,1h,ar-p-h),7.35(d,j=5.0hz,2h,β-h),7.34(d,j=2.0hz,2h,ar-o-h),7.30(d,j=5.0hz,2h,β-h),7.29(d,j=2.0hz,2h,ar-p-h),6.54(s,4h,ar-m-h),6.30(br,2h,nh),5.33–5.31(m,2h,pyrrole-h),3.59(s,2h,pyrrole-h),3.24(s,2h,pyrrole-h),3.09–3.07(m,2h,pyrrole-h),2.46(s,12h,me-h),2.06(s,6h,me-h),1.33(s,18h,t-bu-h),1.29(s,36h,t-bu-h)ppm,maldi-tof-ms:m/z=1615.50[m]+,calcdfor(c102h99n9nipd)+=1615.64。
如图1所示为结构式36、37、40和41所示的化合物的的紫外吸收图谱,对比报道过的现有耳坠型卟啉(即结构式23所示的化合物)的紫外吸收图谱和数据,本发明制备的化合物相较于现有的耳坠型卟啉发生了明显的红移,在近红外区域的吸收显著增强。并且稠合噻吩和吡咯之后的耳坠型卟啉衍生物40和41,soret带出现了明显的裂分,吸收峰变宽。这些现象可能是由于稠合之后共轭体系增大,电子相互作用增强。图中把800nm~2500nm的吸收扩大了十倍,发现在近红外区域,结构式40和41所示的化合物相对于现有的耳坠型卟啉发生了大幅度的红移,结构式40所示的化合物最大吸收达到了1894nm,结构式41所示的化合物最大吸收达到了1868nm。而氮稠合的结构式36和37所示的化合物虽然对比碳稠合的耳坠型卟啉红移较少,但是其在近红外区域的吸收更强。结构式36所示的化合物在1239nm和1511nm有显著的吸收,氮稠合一边的结构式37所示的化合物则吸收相对结构式36所示的化合物蓝移,在1149nm和1407nm有显著的吸收,说明共轭体系越大,吸收更加红移。
如图2所示为现有的耳坠型卟啉金属衍生物23和耳坠型卟啉单键连上噻吩、吡咯的金属衍生物的紫外对比图。通过对比结构式34所示的化合物、结构式38所示的化合物和现有的耳坠型卟啉金属衍生物,发现单键连接噻吩和吡咯的耳坠型卟啉吸收略微增强,这说明单键连接噻吩和吡咯对耳坠型卟啉的光谱性能影响较小,更进一步说明稠合关环在显著改变耳坠型卟啉光谱性能的优势地位。
如图3所示为结构式29、30、31所示的化合物的紫外吸收图谱,对比可知,氮稠合的化合物(结构式29和30所示的化合物)吸收光谱相对来说显著红移,并且吸收增强,并且稠合两个的化合物红移更多。这是由于氧化稠合使化合物的π体系扩大,电子离域作用增强,进而光谱性能发生改变。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!