一种杂合抗菌肽BM16R及其制备方法和应用与流程
本发明多肽抗菌药物技术领域,具体涉及一种杂合抗菌肽BM16R及其制备方法和应用。
背景技术:
目前,抗生素滥用特别严重,全球每年消耗的抗生素总量中90%用在畜牧业生产上,越来越多的细菌产生对抗生素的耐药性。2015发现了质粒介导的黏菌素耐药基因mcr-1,对人类滥用抗生素的行为敲响了警钟。抗菌肽(antimicrobial peptides,AMPs)是宿主自身先天性免疫防御系统产生的一类抵抗外界大多数病原微生物感染的、具有杀菌活性的小分子多肽,是先天免疫防御病原体入侵的重要效应分子,也是机体重要的天然屏障。抗生素的不规范使用日趋严重,使越来越多的耐药性菌株产生,严重地威胁着人类的健康。抗菌肽生物体内经诱导产生的一种具有生物活性的小分子多肽,由20~60个氨基酸残基组成,与传统抗生素相比,具有抗菌谱广、热稳定性好、不宜产生耐药性等优点,越来越多的被应用在医药、食品及畜牧业领域,被视为抗生素的替代品,具有广阔的应用前景。
大部分天然抗菌肽抑菌活性不强,部分抗菌肽对病原微生物有杀灭活性的同时往往伴随着对真核生物的溶血作用。因此,如何降低其毒性和提高其活性成为对抗菌肽分子进行改造的目的,也是目前开发抗菌肽药物的难点与热点。抗菌肽BuforinⅡ是Park从蟾蜍胃组织中分离得到的抗菌肽,BuforinⅡ抗菌活性很强,抗菌谱广,有研究表明,抗菌肽BuforinⅡ与其他阳离子抗菌肽相似,两亲性结构可能是其拥有抗菌活性的主要因素;MDAP-2是在家蝇体内分离得到的抗菌肽,对大肠杆菌和沙门氏菌有抑菌活性,无溶血活性。周靖然等在《杂合抗菌肽 BM16 的原核表达及其生物学活性分析》论文中报道,选取蛙胃黏膜抗菌肽BuforinⅡ的α螺旋部分第14~21个氨基酸和家蝇抗菌肽MDAP- 2的α螺旋部分第1~8个氨基酸进行片段间的杂合,得到新型杂合抗菌肽,简称BM16,其对革兰阴性菌和革兰阳性菌均具有抑菌活性,达到2~8μg/mL,最低溶血浓度(MHC)为16μg/mL。
技术实现要素:
本发明目的是为提高杂合抗菌肽的抗菌活性,缩短杀菌时间,而提供一种杂合抗菌肽BM16R及其制备方法和应用。
一种杂合抗菌肽,它的氨基酸序列如序列表SEQ NO.1所示;
所述的一种杂合抗菌肽,N端进行乙酰化,C端进行酰胺化。
一种杂合抗菌肽的制备方法,它包括:
1)截取抗菌肽BuforinⅡC端8个氨基酸和抗菌肽MDAP-2 N端8个氨基酸,通过片段间杂合形成杂合抗菌肽BM16;
2)用精氨酸(R)取代杂合肽BM16中的苯丙氨酸(F)和甘氨酸(G),形成新的杂合抗菌肽BM16R;
3)采用固相合成法合成杂合抗菌肽BM16R;
所述的的杂合抗菌肽在制备治疗细菌感染性疾病药物中的应用;
所述的细菌为大肠杆菌、沙门氏菌、铜绿假单胞菌、克雷伯氏肺炎杆菌、肠球菌、金黄色葡萄球菌、嗜酸乳杆菌或枯草芽孢杆菌。
本发明提供了一种杂合抗菌肽,它的氨基酸序列如序列表SEQ NO.1所示;一种杂合抗菌肽的制备方法,它包括:1)截取抗菌肽BuforinⅡC端8个氨基酸和抗菌肽MDAP-2 N端8个氨基酸,通过片段间杂合形成杂合抗菌肽BM16;2)用精氨酸(R)取代杂合肽BM16中的苯丙氨酸(F)和甘氨酸(G),形成新的杂合抗菌肽BM16R;3)采用固相合成法合成杂合抗菌肽BM16R;本发明的优点在于杂合抗菌肽BM16R对细菌杀菌效果较好,有较强的抗菌活性,杀菌时间短,而且溶血活性低,并且对一些致病菌和耐药菌也具有杀菌作用。
附图说明
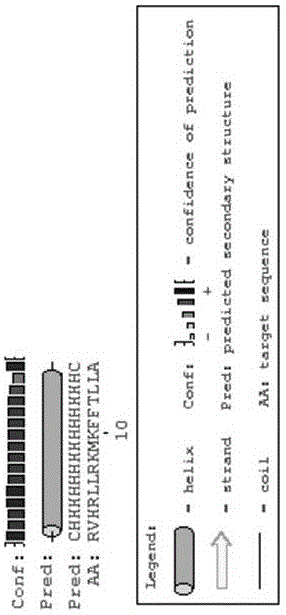
图1为杂合抗菌肽BM16R的二级结构预测;
图2为杂合抗菌肽BM16和BM16R的螺旋轮疏水性分析;
图3为杂合抗菌肽BM16R的三维空间结构模型图;
图4为BM16R分别对E.coli ATCC25922和S.aureusATCC25923的杀菌动力学结果;A)为 BM16R对E.coli ATCC25922的杀菌动力学结果Contral(实心方块),1×MIC(实心圆),2× MIC(空心圆)。B)为 BM16R对S.aureusATCC25923的杀菌动力学结果Contral(实心方块),1×MIC(实心三角),2× MIC(实心圆;
图5为杂合抗菌肽BM16R的溶血活性图;
图6为杂合抗菌肽BM16R作用30分钟后大肠杆菌和沙门氏菌的扫描电镜图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1 杂合抗菌肽BM16R的结构设计和改造
BuforinⅡ抗菌肽是从从蟾蜍胃组织中分离得到的抗菌肽,BuforinⅡ抗菌活性很强,抗菌谱广;MDAP-2是在家蝇体内分离得到的抗菌肽,对大肠杆菌和沙门氏菌有抑菌活性,无溶血活性;对抗菌肽BuforinⅡ和抗菌肽MDAP-2进行二级结构分析,将抗菌肽BuforinⅡC端形成α螺旋部分的8个氨基酸与抗菌肽MDAP-2 N端形成α螺旋部分的8个氨基酸进行片段间杂合,形成一个α螺旋型抗菌肽,命名为BM16;
在BM16的基础上,用精氨酸(R)取代杂合肽BM16中的苯丙氨酸(F)和甘氨酸(G),形成新的杂合抗菌肽BM16R,上述抗菌肽的氨基酸序列如序列表SEQ NO.1所示(BM16氨基酸序列:CGTGTGCATCGTCTGCTGCGTAAAATGAAATTTTTTACCCTGCTGGCA,BM16R氨基酸序列:CGTGTGCATCGTCTGCTGCGTAAAATGAAACGTTTTACCCGTCTGGCA)。
注:实测分子量为质谱测得分子量,Ac:乙酰化 NH2:酰胺化
有关研究显示,抗菌肽螺旋轮疏水面的分布对抗菌活性及细胞毒性有一定的影响,如图2所示,BM16和BM16R是具有非完美两亲性的抗菌肽。
实施例2 抗菌肽的合成
将上述抗菌肽由上海吉尔(GL)生化有限公司来合成,方法采用固相化学合成抗菌肽的制备从C端到N端逐一进行,采用FMOC(9-fluorenylmethyloxycarbonyl,9-药甲氧揣基)保护合成法,通过多肽合成仪来完成,合成后的抗菌肽利用高效液相色谱(HPLC)纯化,然后再利用电喷雾质谱法对抗菌肽进行鉴定。
实施例3 抗菌肽最小抑菌浓度和溶血活性测定
利用改良的微量肉汤稀释法,测定杂合抗菌肽对多种菌的最小抑菌浓度,最低抑制浓度是抗菌肽可以抑制细菌生长的最低浓度,测试至少进行三次重复;结果如表2所示;表中,GM表示MIC值几何平均数对这个表中所有微生物菌株;治疗指数(TI)是指MHC的值与MIC几何平均数(GM)的比值,较大的值说明有较好细胞选择性;
最低溶血浓度(MHC)是指肽能够引起人红细胞(hRBC)发生10%溶血时的最低浓度,在128μg/mL时没有观察到10%溶血时,浓度128μg/mL用于计算治疗指数(图5)。
抗菌肽BM16R的杀菌动力学曲线如图4所示,(A)为 BM16R对E.coli ATCC25922的杀菌动力学结果Contral(实心方块),1×MIC(实心圆),2× MIC(空心圆)。B)为 BM16R对S.aureusATCC25923的杀菌动力学结果Contral(实心方块),1×MIC(实心三角),2× MIC(实心圆);杀菌动力学结果表明A)在1×MIC下,BM16R在40分钟杀灭E.coli ATCC2592,在2×MIC下,BM16R在30分钟杀灭E.coli ATCC2592,B)在1×MIC下,BM16R在60分钟杀灭S.aureusATCC25923
,在2×MIC下,BM16R在50分钟杀灭S.aureusATCC25923。
实施例4 杂合抗菌肽的理化活性分析
以E.coli ATCC25922为研究对象,按照MIC值的测定方法,以此来评价盐离子、胰酶和热处理对杂合抗菌肽活性的影响,结果见表3。
实施例5 对杂合抗菌肽抑菌机理的检测
扫描电镜观察抗菌肽BM16R处理大肠杆菌ATCC25922后细胞膜变化如图6所示;通过进一步检测杂合的抑菌机理发现,杂合肽可使细菌有内膜和外膜去极化,扫描电子显微镜则进一步表明,杂合肽可以破坏细胞的细胞膜,损害膜的完整性从而杀死细菌。
实施例6 动物体内急性毒性试验
采用固相合成法合成蜂毒肽Melittin纯度大于95%,作为阳性对照,生理盐水为阴性对照,检测杂合抗菌肽BM16R对动物的毒性。
昆明小鼠60只,分三组每组20只,雌雄各半,体重为20±0.52g,抗菌肽按照5000mg/kg计量,一次尾静脉注射,观察小鼠死亡情况,结果,经过7天观察,抗菌肽BM16R和生理盐水组小鼠全部存活,阳性对照组蜂毒肽Melittin全部死亡,证明抗菌肽BM16R无毒性作用。
实施例7杂合抗菌肽BM16R对腹腔感染大肠杆菌小鼠的保护作用
使用大肠杆菌K88感染昆明小鼠实验模型,实验步骤如下:
将大肠杆菌K88接种于LB液体培养基,震荡培养至OD600的值为0.5时,调整菌液浓度为1×109CFU/ml,40只雄性BALB/c小鼠体重为20±0.52g,分为10组,每组4只,攻毒剂量分别为0.2ml,腹腔注射,对照组注射生理盐水,10分钟内尾静脉注射不同剂量的抗菌肽0.2ml,10天观察小鼠存活情况。结果如表3所示,合成抗菌肽尾静脉注射0.125mg/kg时,能够100%保护小鼠大肠杆菌感染。该实验表明,合成抗菌肽BM16R对大肠杆菌K88急性腹腔感染具有很好的治疗作用。
注:盐离子的终浓度为NaCl:150 mM, KCl:4.5 mM, NH4Cl:6 μM, MgCl2:1 mM, CaCl2:2 mM, ZnCl2:8 μM, FeCl3:4 μM,热处理为水浴100℃1小时,胰蛋白酶(Trypsin)终浓度为1mg/mL,37℃作用30分钟,65℃灭活30分钟。
申请人声明,本发明通过上述实施例来说明本发明的工艺方法,但本发明并不局限于上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用的材料的等效替换及药物成分的选择等,均落在本发明的保护范围和公开范围之内。
序列表
<110> 吉林农业大学
<120> 一种杂合抗菌肽BM16R及其制备方法和应用
<160> 1
<170> SIPOSequenceListing 1.0
<210> 1
<211> 48
<212> DNA
<213> BM16R
<400> 1
cgtgtgcatc gtctgctgcg taaaatgaaa cgttttaccc gtctggca 48
- 还没有人留言评论。精彩留言会获得点赞!