一种利用293细胞生产制备溶瘤病毒的方法与流程
本发明涉及生物医药领域,具体涉及一种利用293贴壁细胞和293sus悬浮细胞生产制备溶瘤vsv病毒的方法。
背景技术:
目前,被批准可用以疫苗制备及病毒生产基质的细胞主要包括vero、293、bhk、cho等;哺乳细胞的大规模培养方式主要有三种:贴壁培养,微载体培养,无血清悬浮培养,这三种方式均可用于293细胞的大规模培养。在之前的实验中我们使用vero细胞进行vsv病毒的生产制备,病毒滴度在e9pfu/ml,为了获得更高的产毒量、降低生产成本,以使工艺更具经济性,更有行业竞争力及后续纯化工艺的进行,这里我们尝试使用贴壁培养的293细胞和悬浮培养的293sus细胞进行vsv病毒的生产,以期得到更加高效、稳定、方便简易的生产vsv病毒的方法。
癌症和常规的癌症治疗剂目前在情绪/身体痛苦、失去生命和增加医疗保健成本方面带来了显著的社会经济负担。常规的疗法显示出一些有益的临床效果但是伴随着产生降低患者的生活质量的毒副作用。临床治疗中需要有更有效的且更低的毒副作用的癌症疗法。
目前小分子药物、单克隆抗体等被开发应用于肿瘤的新型治疗,但治愈率不高,有待更多的研究。另外,仅用单一药物治疗可能会导致肿瘤细胞出现耐药性,因此急需开发有效的生物治疗方法。溶瘤病毒是一种通过遗传学改变而具有复制能力的病毒,经过高度稀释的减毒病毒能利用肿瘤(靶)细胞中抑癌基因的失活或缺陷,选择性地在靶细胞内复制,最终导致肿瘤细胞的溶解和死亡,而在正常细胞内它只是少量存在或不能增殖。利用这种病毒进行的肿瘤治疗称为溶瘤病毒治疗。溶瘤病毒不但自身在肿瘤细胞内复制,导致细胞溶解和死亡;而且通过死亡的细胞释放出病毒颗粒,产生一种级联效应,放大溶细胞效果,直至肿瘤细胞被清除。同时,肿瘤细胞的破裂会导致肿瘤抗原从肿瘤细胞中释放,从而诱导体内系统性的抗肿瘤免疫反应,这可能会增强病毒的溶细胞活性。溶瘤病毒进入肿瘤细胞后由于自我复制可陆续破坏宿主细胞,进而向周围扩散,进入其他肿瘤细胞。如此反复循环,可发挥有效的抗肿瘤效果。
随着rna病毒遗传技术的进展,水疱性口炎病毒属载体已被开发成为一种有效的治疗制剂。vsv(水疱性口炎病毒)载体是一种高效的溶瘤弹状病毒载体,具有非常广的溶瘤范围。根据资料报道,vsv载体几乎能够侵染溶解所有的肿瘤细胞,在体外实验中vsv载体的溶瘤率都在50%以上,在体内实验中vsv载体能够显著延长荷瘤动物模型的寿命。vsv载体也被开发成为一种有效的疫苗载体,vsv载体作为疫苗载体应用到获得性免疫缺陷综合症病毒、流感病毒、丙型肝炎病毒和乙肝病毒等疫苗的研制过程中。因此水疱性口炎病毒载体具有非常好的应用前景。
vsv为弹状病毒科成员,是一种不分节段单股负链rna病毒,病毒基因组长约11kb并且不会整合到宿主基因组内,主要以节肢动物为传播媒介,可感染大多数哺乳动物。在自然界中,vsv感染猪、牛和马,并在口和足附近导致水痘性疾病。尽管有报道表明vsv可感染人,但是vsv在人类中没有导致任何严重的症状。vsv编码5种蛋白,包括核壳蛋白(n)、磷蛋白(p)、基质蛋白(m)、表面糖蛋白(g)和rna依赖性rna聚合酶(l)。由vsv基质蛋白(m)阻断宿主细胞蛋白合成会诱导细胞死亡。
vsv病毒颗粒呈子弹状或圆柱状,长度约为直径的3倍(150-180nm×50-70nm),病毒粒子表面有囊膜,囊膜上均匀密布短的纤突,长约10nm。vsv病毒粒子分子量为265.6×103±13.3×103kd,其中蛋白占74%,类脂质占20%,糖类占3%,rna占3%。
综上所述,一种能够稳定、高效、简便、节约成本的vsv病毒的生产工艺,将会具有广阔的应用前景。
技术实现要素:
本发明旨在基于现有技术中存在的问题,提供一种利用293细胞高效稳定制备溶瘤病毒的方法。
本发明采用的技术方案为,一种制备溶瘤病毒的方法,将病毒起始接毒感染复数按moi=0.01-0.1,用dmem-0或opti-mem培养基作为病毒稀释液稀释后感染293贴壁细胞2-3h;然后吸弃病毒液,更换成含体积百分比为3%的fbs的dmem培养基作为病毒扩增液,培养24h后收获病毒液。
进一步地,该方法包括以下具体步骤:
s1、在培养板的n个孔中的n-1个孔中加入293细胞(atcc)悬液,体积为2ml,使细胞量达到5×105个/孔,37℃,co2体积百分比为5%培养24h;
s2、取其中一孔中的细胞消化后进行计数,其余孔的细胞分别按moi=0.01将病毒用dmem-0作为病毒稀释液稀释至1ml并吸弃掉培养基,将病毒液分别加入到孔中,在37℃,co2体积百分比为5%条件下感染2h-3h,其中所述病毒为弹状病毒科水疱性口炎病毒属,具备特异性杀伤肿瘤细胞特性,并且可以在293细胞中扩增和复制,具备反复侵染293细胞的能力;
s3、吸弃病毒液,加入含体积百分比为3-6%fbs的dmem完全培养基2ml作为病毒扩增液,在37℃、体积百分比为5%co2的条件下培养24h,收集病毒液2500rpm离心15min,并使用0.22μm滤器进行过滤备用。
进一步地,其中s2中,可直接将病毒按moi=0.01-0.1稀释至含3%fbs的dmem培养基中直接感染293贴壁细胞,在37℃、体积百分比5%co2的条件下培养24h,收集病毒液2500rpm离心15min,并使用0.22μm滤器进行过滤备用。
本发明采用的另一技术方案为,一种制备溶瘤病毒的方法,将病毒按moi=0.01感染293sus悬浮细胞,在37℃、体积百分比5%co2的条件下培养24h。
进一步地,该方法包括以下具体步骤:
s1、在125ml细胞摇瓶中,接入293sus悬浮细胞,37℃,体积百分比为5%co2培养,每隔一天按1500rpm离心5min进行换液;
s2、取200μl细胞悬液至1.5ml管中吹打成单后进行计数,待细胞密度达到e7/ml左右时,离心更换新鲜培养基,按moi=0.01将病毒液加入细胞中,在37℃,体积百分比为5%co2条件下感染24h,其中所述病毒为弹状病毒科水疱性口炎病毒属,具备特异性杀伤肿瘤细胞特性,并且可以在293sus悬浮细胞中扩增和复制,具备反复侵染293sus悬浮细胞的能力;
s3、收集病毒液3500rpm离心15min,并使用0.22μm滤器进行过滤备用。
进一步地,所述病毒为重组溶瘤弹状病毒,选自水疱性口炎病毒。
进一步地,所述病毒为重组溶瘤弹状病毒,选自水疱性口炎病毒印第安纳株。
进一步地,所述病毒为重组溶瘤病毒,选自vsvmuddsummer亚型株。
本发明的另一目的在于进一步地提供一种大规模制备溶瘤病毒的方法,该方法根据上述两种方法制备溶瘤病毒,其中,制备中所用的培养容器替换为适合贴壁细胞培养的反应器(293贴壁细胞)或替换为适合悬浮细胞培养的滚瓶;制备中所用的病毒稀释液的体积及病毒扩增液的体积以等比例扩大,为制备中体积的2.5-20倍。
本发明的再一目的在于提供一种重组溶瘤弹状病毒,所述重组溶瘤弹状病毒根据上述方法得到,所述重组溶瘤弹状病毒包含改性基质蛋白(m),所述改性基因蛋白(m)与减毒弹状病毒的m蛋白同样存在可正常维持蛋白质的功能的保守突变,编码所述改性基质蛋白(m)的氨基酸序列与减毒弹状病毒的m蛋白(seqidno:1所示)的氨基酸序列相比,具有至少80%,优选至少90%,更优选至少95%,最优选至少98%相同的序列;并且,所述氨基酸序列和减毒弹状病毒的m蛋白(seqidno:1所示)相比,在第51位置、第221位置、第226位置同时具有氨基酸替换。
在另一个实施方案中,本公开涉及一种重组溶瘤弹状病毒的改性基质蛋白(m),其特征在于,编码所述改性基质蛋白(m)的氨基酸序列与seqidno:1所示的氨基酸序列相比,具有至少80%,优选至少90%,更优选至少95%,最优选至少98%相同的序列;并且,所述氨基酸序列和seqidno:1相比,在第51位置、第221位置、第226位置同时具有氨基酸替换。
在一个实施方案中,本公开涉及一种改性基质蛋白(m),其中,所述重组溶瘤弹状病毒选自vsv病毒水疱性口炎病毒;优选的,所述重组溶瘤弹状病毒选自vsv病毒的水疱性口炎病毒muddsummer株。
在一个实施方案中,本公开涉及一种重组溶瘤弹状病毒,其中,所述重组溶瘤弹状病毒包含改性基质蛋白(m),其中,所述改性基质蛋白(m)的氨基酸序列为如上所示的氨基酸序列;优选的,所述重组溶瘤弹状病毒为减毒的溶瘤弹状病毒。
在一些优选的实施方案中,本公开的溶瘤弹状病毒是野生型水疱性病毒(vesiculovirus)或重组水疱性口炎病毒,例如野生型或重组vsv、金迪普拉,maraba或carajas,包括其变体。在其他实施方案中,溶瘤弹状病毒是野生型或重组非水疱性口炎病毒,例如muirsprings、farmington或大巴伊亚病毒病毒,包括其变体。
在特别优选的实施方案中,本公开的表达肿瘤抗原的溶瘤病毒是野生型maraba株弹状病毒或其变体,其任选地经遗传修饰,例如以提高肿瘤选择性。
在一些优选的实施方案中,复制型溶瘤病毒为例如水疱性口炎病毒(vsv)或maraba弹状病毒等弹状病毒,其优选包含一种或多种遗传修饰从而增加病毒对癌症细胞的选择性。
在本公开的一个实施方案中,选取的溶瘤病毒包括减毒弹状病毒以及包含减毒弹状病毒的组合物,所述减毒弹状病毒编码与减毒弹状病毒的m蛋白(即如seqidno:1所示的氨基酸序列)具有20%、30%、40%、50%、60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%以及这些数值之间所有范围和百分数的氨基酸同一性的变异m蛋白。上述减毒弹状病毒的m蛋白具有特定百分数的同一性指的是,减毒弹状病毒的m蛋白存在可正常维持蛋白质的功能的保守突变。保守突变的代表性例子为保守置换。此外,上述减毒弹状病毒的m蛋白的同一性突变还包括起因于基因所来源的弹状病毒的个体差异、株、种的差异时等的天然产生的突变。
在一个实施方案中,本公开涉及溶瘤vsv病毒的制备方法,具体方法如下:
1、在6孔培养板中每孔加入293贴壁细胞悬液2ml,使细胞量达到5×105个/孔,共5个孔,37℃,5%co2培养16h;
2、取其中一孔中的细胞消化后进行计数,其余孔的细胞分别按moi=0.01-0.1将vsv病毒用dmem-0稀释至1ml,并将其加入到吸弃掉培养基的相对应的孔中,37℃,5%co2感染2h-3h;优选的直接将病毒按moi=0.01-0.1稀释到含3%fbs的dmem培养基中37℃,5%co2感染24h后收集病毒液;
3、移液管去除病毒液,加入含体积百分比为3%fbs的dmem培养基2ml,37℃,体积百分比为5%co2培养24h,收集病毒液2500rpm离心15min,并使用0.22μm滤器进行过滤备用。
在另一个实施方案中,本公开涉及溶瘤vsv病毒的制备方法,具体方法如下:
1、在125ml细胞摇瓶中,接入293sus悬浮细胞20ml,37℃,体积百分比为5%co2培养,每隔一天按1500rpm4℃离心5min的条件,进行新鲜培养基换液;
2、取200μl细胞悬液至1.5ml管中吹打成单后进行计数,待细胞密度达到e7/ml左右时,离心更换新鲜培养基,按moi=0.01将病毒液加入细胞中,在37℃,体积百分比为5%co2条件下感染24h;
3、收集病毒液3500rpm4℃离心15min,并使用0.22μm滤器进行过滤备用。
优异性:本发明制备溶瘤病毒的方法,采用293细胞(贴壁细胞或悬浮细胞)稳定制备高滴度溶瘤病毒特别是vsv病毒,根据本发明的方法制备的溶瘤病毒粒子可应用于生物医药技术研究,并可应用到操作规范(gmp)生产条件下进行大规模溶瘤病毒产品生产时,降低成本显著提高产品得率。
本发明的有益效果主要体现在以下几个方面:第一,与目前的传统利用vero细胞进行溶瘤弹状病毒生产相比,本公开能大幅缩减成本,在同样的培养体系中,按本专利公开的技术方法进行病毒生产能力的比较,在293细胞中的病毒产量于vero细胞的产毒量进行比较,能获得至少10倍以上的产毒量提升,便于后续大规模病毒生产及病毒下游纯化工艺的实施;进一步,一步病毒感染法在病毒生产工艺上缩减了病毒感染时更换新鲜培养基的步骤,从而简化生产工艺,节约人力成本,降低产品污染的可能性。
附图说明
通过以下列出的附图的描述可以更深入地示出本公开的实施方案。
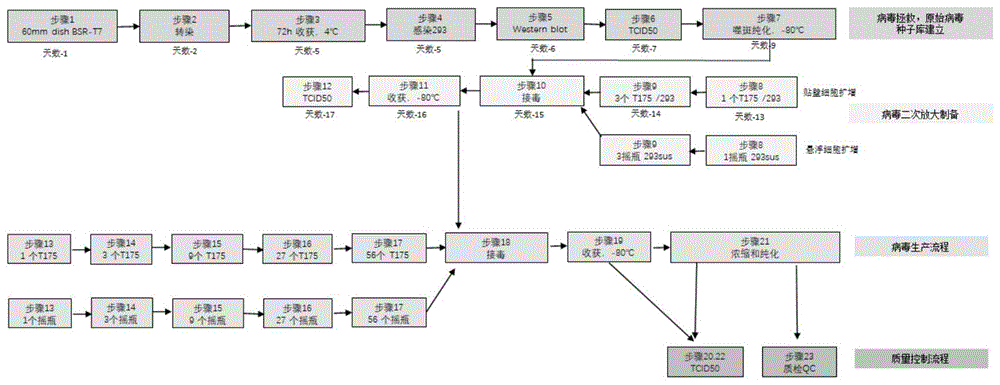
图1所示的是溶瘤病毒生产制备的流程图。
图2所示的不同moi值的接毒量分别在vero、293贴壁细胞、293sus悬浮细胞中的病毒产率,比较生产扩增后得到的病毒滴度的变化情况。
图3所示的是不同病毒稀释液对病毒生产的滴度影响。
图4所示的是不同血清浓度对病毒扩增的影响。
图5所示的是不同扩增时间条件下的产毒量。
图6所示的是不同温度条件下扩增病毒的产量影响。
图7所示的是优选的一步感染法在293贴壁细胞中的病毒产量影响。
图8所示的是在293sus悬浮细胞产毒时,不同的细胞密度对病毒产量的影响。
图9所示的是按最优条件进行病毒放大扩增的病毒产量。
具体实施方案
定义:
如本领域技术人员都能理解的那样,除非另有说明,否则本节和其他节中描述的定义和实施方案旨在应用于本文所述申请的所有实施案例。
在理解本申请的范围时,如本文所使用的术语“包含”及其衍生词旨在是开放式术语,其指定存在所述特征,元素,组分,组,整数和/或步骤,但不排除存在其他未说明的功能、元素、组分、组、整数和/或步骤。前述内容也适用于具有相似含义的词语,例如术语“包括”、“具有”及其衍生词。本文使用的术语“由......组成”及其衍生词旨在是封闭式术语,其指定存在所述特征、元素、组分、组、整数和/或步骤,但排除存在其他未说明的特征的存在、元素、组分、组、整数和/或步骤。如本文所用的,术语“基本上由......组成”旨在指定存在所述特征、元素、组分、组、整数和/或步骤以及不会实质上影响特征、元素、组分、组、整数和/或步骤的基本和新颖特征的那些。
本文使用的诸如“基本上”、“约”和“近似”的程度术语意为修饰术语的合理偏差量,这个改变不会导致结果产生显著变化。如果该偏差不会否定其修饰的词的根本含义的话,这些程度术语的使用应被限定为偏离修饰的术语的定义控制范围在正负百分之五。
如在本申请中所使用的,单数形式“一个/种(a/an)”和“所述(the)”包括复数指代,除非内容另有明确说明。例如,包括“一个t细胞”的实施方案应理解为具有一种物质或两种及两种以上其他物质的组分。
在包含“另一”或“第二”组分,例如另一或第二细胞因子的实施方案中,如本文所用的第二组分在化学上不同于其他组分或第一组分。“第三”组分与其他组分、第一组分和第二组分不同,并且进一步列举的与“另一”组分不同的相似点。
本文所用的术语“和/或”是指所列出的项单独存在或组合使用。实际上,该术语意为所列项中已经存在或者在使用的“至少一个/种”或“一个/种或多个/种”。
当在权利要求和/或说明书中与术语“包含”联用时,词语“一(a)”或“一(an)”可以指“一个”,但也可以指“一个或多个”、“至少一个”以及“一个或多于一个”。
如在权利要求和说明书中所使用的,词语“包含”、“具有”、“包括”或“含有”是指包括在内的或开放式的,并不排除额外的、未引述的元件或方法步骤。
在整个申请文件中,术语“约”表示:一个值包括测定该值所使用的装置或方法的误差的标准偏差。
虽然所公开的内容支持术语“或”的定义仅为替代物以及“和/或”,但除非明确表示仅为替代物或替代物之间相互排斥外,权利要求中的术语“或”是指“和/或”。
病毒生产的具体实施例:
本公开采用的试剂及耗材如下:
pbs(hyclonesh30256.01),dmem高糖培养基(gibcoc11995500),cd293无血清培养基gibco11913-019,双抗体(gibco15140-122),胎牛血清(gibco10091-148),opti-mem®ireducedserummedium(gibco31985-070),96孔细胞培养板(corning3599),6孔细胞培养板(corning3516),0.22um滤器(milliporeslgp033rb),dmso(macklind806645),t175细胞瓶(corning431080),细胞摇瓶(125ml)(corning431143/431145)。
细胞系:
将293贴壁细胞培养在37℃、含5%co2的特定培养环境中(thermo150i细胞培养箱),采用dmem高糖完全培养基进行培养;293sus悬浮细胞培养在37℃、含5%co2的特定培养环境中(thermobb15细胞培养箱),采用cd293无血清培养基进行培养。
病毒:
在一个技术方案中,所述重组水疱性口炎病毒muddsummer亚型株的改性基质蛋白(m)选自第51位置、第221位置和第226位置同时具有氨基酸替换,所述氨基酸替换方式为:第51甲硫氨酸m替换为精氨酸r,第221位缬氨酸v替换为苯丙氨酸f,第226位甘氨酸g替换为精氨酸r。
实施例1不同moi值的接毒量感染vero、293贴壁细胞、293sus悬浮生产细胞,比较生产扩增得到的病毒滴度的总量变化情况。
在vero和293贴壁细胞中,用opti-mem更换原有的完全培养基,然后将vsv病毒分别按不同moi感染vero/293贴壁细胞,2h-3h后更换成完全培养基感染48h;293sus悬浮细胞进行离心更换培养基,计数后按e5/孔铺至6孔板中,按不同moi进行感染24h;收集上清检测不同原始病毒接种(moi)情况下,制备得到的病毒滴度(tcid50)变化情况,整体实验流程参照图1中描述的具体实施方案。
上述实验过程的具体步骤如下:
1、vero-e6:在6孔培养板中每孔加入vero-e6细胞悬液2ml,使细胞量达到4×105个/孔,37℃,体积百分比为5%co2培养24h;293贴壁细胞:在6孔培养板中每孔加入293贴壁细胞悬液2ml,使细胞量达到5×105个/孔,37℃,体积百分比为5%co2培养24h;293sus悬浮细胞:1500rpm离心5min后用新鲜培养基重悬,计数后每孔e5细胞铺至6孔板中,按不同moi进行感染24h,收集病毒液并使用0.22μm滤器进行过滤;
2、两种贴壁细胞各取其中一孔中的细胞消化后进行计数,其余孔细胞分别按不同moi将vsv病毒用opti-mem稀释至1ml,并将其加入到吸弃掉培养基的相对应的孔中,37℃,体积百分比为5%co2感染2h-3h;
3、吸弃病毒液,加入完全培养基后37℃,5%co2培养48h,收集病毒液并使用0.22μm滤器进行过滤;
4、在1.5mlep管中将步骤2中收获的上清作连续10倍的稀释,从10-1-10-11,共11个滴度;
5、将稀释好的上清接种到96孔培养板中,每一稀释度接种一列共8孔,每孔接种100µl,设正常细胞对照组一列;
6、48h后观察每孔细胞荧光情况,有荧光则记为此孔被感染;
7、按karber法计算tcid50。
上述病毒的滴度检测结果如图2所示:
从图2a中的检测结果可以发现:用vero细胞进行病毒扩增时,病毒滴度随着首次接种的moi值的增加先增高随后下降,在感染复数moi=5时病毒产毒量最高,因此表明针对vsv溶瘤病毒的规模化制备时,病毒起始接种量即moi为5,病毒滴度在e9pfu/ml左右,单细胞产毒量在e3pfu左右。
如图2b所示,用293贴壁细胞进行病毒生产时,moi在0.01-0.1之间时产毒量最高,当起始接毒量即moi超过0.1时病毒滴度逐渐降低,考虑到病毒生产时毒种库的建立问题,因此用293贴壁细胞针对vsv溶瘤病毒的规模化制备时,病毒起始接种量即moi为0.01,病毒滴度在e10pfu/ml以上,单细胞产毒量超过了e4pfu(图2c)。
进一步用293悬浮细胞进行病毒生产时,如图2d所示,当病毒滴度随着首次接种的moi值的增加逐渐后下降,在感染复数moi=0.01时病毒产毒量最高,因此表明针对vsv溶瘤病毒的规模化制备时,病毒起始接种量即moi为0.01,病毒滴度在e9pfu/ml左右,单细胞产毒量在e3-e4pfu左右,考虑到悬浮细胞的高密度生长情况,因而该细胞需要进行悬浮生长条件下的病毒产毒量摸索。
实施例2进一步为了增强病毒对细胞的感染能力,特选择pbs、dmem-0、opti-mem作为u400病毒感染的稀释液进行细胞感染时的溶剂(vero选择moi=5,293贴壁细胞选择moi=0.1)
如图3a,待细胞长满后,在vero和293贴壁细胞中分别用pbs、dmem-0、opti-mem更换原有的培养基,然后分别按moi=5和0.1加入vsv病毒感染2h后更换成完全培养基,vero细胞48h后收集上清,293贴壁细胞24h后收集上清检测病毒株产生的病毒的滴度(tcid50)。
检测上述病毒的滴度的具体操作步骤如下:
1、vero-e6:在6孔培养板中每孔加入vero-e6细胞悬液2ml,使细胞量达到4×105个/孔,37℃,体积百分比为5%co2培养24h;293贴壁细胞:在6孔培养板中每孔加入293贴壁细胞悬液2ml,使细胞量达到5×105个/孔,37℃,体积百分比为5%co2培养24h;
2、待细胞密度达到95%以上时,vero和293贴壁细胞各取其中一孔中的细胞消化后进行计数,其余孔细胞分别按moi=5(vero)和moi=0.01(293)将vsv病毒用pbs、dmem-0、opti-mem稀释至1ml,并将其加入到吸弃掉培养基的相对应的孔中,37℃,体积百分比为5%co2感染2h-3h;
3、吸弃病毒液,加入完全培养基后vero和293贴壁细胞分别在37℃,体积百分比为5%co2培养48h和24h,收集病毒液并使用0.22μm滤器进行过滤;
4、在1.5mlep管中将步骤2中收获的上清作连续10倍的稀释,从10-1-10-11,共11个滴度;
5、将稀释好的上清接种到96孔培养板中,每一稀释度接种一列共8孔,每孔接种100µl。设正常细胞对照组一列;
6、48h后观察每孔细胞荧光情况,有荧光则记为此孔被感染;
7、按karber法计算tcid50。
上述病毒的滴度的检测结果如图3所示。
从图3a中可以发现,vero细胞用pbs、dmem-0、opti-mem作为病毒稀释液感染细胞时,所获得的病毒液滴度没有实质上的区别,为便于后续实验,决定以dmem-0作为病毒感染稀释液。如图3b,当293贴壁细胞用pbs、dmem-0、opti-mem作为病毒稀释液感染细胞时,pbs组在感染2-3h时更换完全培养基时细胞严重脱落,所获得的病毒滴度也较dmem-0和opti-mem组的滴度低,因而利用293细胞进行病毒生产时,优选以dmem-0作为病毒感染时的稀释液。
实施例3培养基中血清浓度对病毒产毒量的影响
在传统的病毒制备的过程中会发现,一些病毒在扩增的过程中,培养基中的血清浓度会严重影响病毒的滴度的提高,为了解决这个问题,并进一步提高病毒滴度,优化病毒扩增工艺,在vero(图4a)和293贴壁细胞(图4b)中,用dmem-0更换原有的培养基,然后vsv病毒分别按moi=5和0.1感染,2h-3h后分别用含体积百分比为0%、1.5%、3%、6%、9%不同浓度的fbs配置的dmem培养基进行病毒扩增,待细胞完全裂解后,收集上清检测不同血清浓度培养情况下的病毒的滴度(tcid50)。
检测上述病毒的滴度的具体步骤如下:
1、vero-e6:在6孔培养板中每孔加入vero-e6细胞悬液2ml,使细胞量达到4×105个/孔,37℃,体积百分比为5%co2培养24h;293贴壁细胞:在6孔培养板中每孔加入293贴壁细胞悬液2ml,使细胞量达到5×105个/孔,37℃,体积百分比为5%co2培养24h;
2、待细胞密度达到95%以上时,vero和293贴壁细胞各取其中一孔中的细胞消化后进行计数,其余孔细胞分别按moi=5(vero)和moi=0.01(293)将vsv病毒用dmem-0稀释至1ml,并将其加入到吸弃掉培养基的相对应的孔中,37℃,体积百分比为5%co2感染2h-3h;
3、吸弃病毒液,加入含体积百分比为0%、1.5%、3%、6%、9%fbs的dmem培养基,37℃,体积百分比为5%co2培养48h(vero细胞)和24h(293贴壁细胞),收集病毒液并使用0.22μm滤器进行过滤;
4、在1.5mlep管中将步骤2中收获的上清作连续10倍的稀释,从10-1-10-11,共11个滴度;
5、将稀释好的上清接种到96孔培养板中,每一稀释度接种一列共8孔,每孔接种100µl。设正常细胞对照组一列;
6、48h后观察每孔细胞荧光情况,有荧光则记为此孔被感染;
7、按karber法计算tcid50。
根据图4a中的结果可以发现,在vero细胞中,随着血清浓度的提高,病毒滴度显著升高,当血清浓度达到体积百分比为3%以上时,病毒滴度维持在相对稳定的水平;在图4b中,当在293贴壁细胞中进行不同血清进行操作时,情况与vero细胞类似,无血清时病毒滴度较低,在3%fbs时病毒滴度趋于稳定,因此,就本病毒而言,其高效扩增需要一定浓度的血清来维持,血清浓度为3%体积百分比血清浓度就足以保证vsv病毒的高效扩增。维持dmem+3%fbs血清的培养基,降低血清对病毒下游纯化的影响。
实施例4不同时间点收取病毒液对病毒产量的影响
已有的实验表明,vsv溶瘤病毒长时间处于37℃会导致病毒的活力下降,而较短的培养时间又会导致细胞裂解不彻底,导致病毒滴度下降,因而需要优化病毒的收获时间。具体步骤如下:
1、vero-e6:在6孔培养板中每孔加入vero-e6细胞悬液2ml,使细胞量达到4×105个/孔,37℃,体积百分比为5%co2培养24h;293贴壁细胞:在6孔培养板中每孔加入293贴壁细胞悬液2ml,使细胞量达到5×105个/孔,37℃,体积百分比为5%co2培养24h;293sus悬浮细胞:1500rpm离心5min后用新鲜培养基重悬,计数后每孔e5细胞铺至6孔板中,按moi=0.01于37℃,体积百分比为5%co2感染24h和48h,收集病毒液并使用0.22μm滤器进行过滤;
2、待贴壁细胞密度达到95%以上时,vero和293贴壁细胞各取其中一孔中的细胞消化后进行计数,其余孔细胞分别按moi=1(vero)和moi=0.01(293)将vsv病毒用dmem-0稀释至1ml,并将其加入到吸弃掉培养基的相对应的孔中,37℃,体积百分比为5%co2感染2h-3h;
3、吸弃病毒液,分别加入dmem完全培养基2ml37℃,体积百分比为5%的co2培养24h、36h、48h,293贴壁细胞后来又细化为20h、24h、28h,收集病毒液,使用0.22μm滤器进行过滤;
4、在1.5mlep管中将步骤2中收获的上清作连续10倍的稀释,从10-1-10-11,共11个滴度;
5、将稀释好的上清接种到96孔培养板中,每一稀释度接种一列共8孔,每孔接种100µl。设正常细胞对照组一列;
6、48h后观察每孔细胞荧光情况,有荧光则记为此孔被感染;
7、按karber法计算tcid50。
根据图5a的统计结果可知,在vero细胞中进行病毒生产制备,在同样的条件下,接种相同数目的原始病毒种子,分别在相同的制备体系,进行病毒的生产扩增,可以发现当感染复数为1时,病毒在细胞中感染36h后,上清中病毒粒子数达到一个峰值,进一步证明病毒制备的最佳感染时间点在36h,超过36h后病毒的产量逐级下降,不利于规模化生产;而293贴壁细胞(图5c)和悬浮293sus细胞(图5d)在病毒感染24h时病毒滴度达到最高,较短的产毒时间得到较高的病毒产量,更加有利于后续病毒的大规模生产及稳定性(图5b);因而,就gmp生产而言,在生产同等量的病毒条件下,293细胞的这种相对较短的产毒周期,相对较高的病毒产量将大大节约成本及加快下游生产纯化工艺的推进。
实施例5不同温度条件下扩增病毒对病毒产量的影响
由于vsv病毒长时间处于37℃会导致病毒稳定性下降,如果该病毒能在较低的扩增温度下能获得同样甚至更高的病毒产量的话,将更有利于病毒的稳定,因而需要优化病毒扩增的温度。具体步骤如下:
1、293贴壁细胞:在6孔培养板中每孔加入293贴壁细胞悬液2ml,使细胞量达到5×105个/孔,37℃,体积百分比为5%co2培养24h;293sus悬浮细胞:1500rpm离心5min后用新鲜培养基重悬,计数后每孔e5细胞铺至6孔板中,按moi=0.01分别于30℃、34℃、37℃,体积百分比为5%co2感染24h,收集病毒液并使用0.22μm滤器进行过滤;
2、待293贴壁细胞密度达到95%以上时,293贴壁细胞取其中一孔中的细胞消化后进行计数,其余孔细胞按moi=0.1(293贴壁细胞)将vsv病毒用dmem-0稀释至1ml,并将其加入到吸弃掉培养基的相对应的孔中,37℃,体积百分比为5%co2感染2h-3h;
3、吸弃病毒液,加入dmem完全培养基2ml分别于30℃、34℃、37℃,体积百分比为5%的co2培养24h,收集病毒液,使用0.22μm滤器进行过滤;
4、在1.5mlep管中将步骤2中收获的上清作连续10倍的稀释,从10-1-10-11,共11个滴度;
5、将稀释好的上清接种到96孔培养板中,每一稀释度接种一列共8孔,每孔接种100µl。设正常细胞对照组一列;
6、48h后观察每孔细胞荧光情况,有荧光则记为此孔被感染;
7、按karber法计算tcid50。
根据图6a-6b结果可知,293贴壁细胞中,在同样的条件下,接种相同数目的原始病毒种子,分别在相同的制备体系,进行病毒的生产扩增,可以发现当感染复数为0.1时,病毒感染24h后,在37℃上清中病毒滴度较高;在293susu悬浮细胞中,可以发现当感染复数为0.01时,病毒感染24h后,30℃的产毒量极低,34℃的产毒量相对于30℃虽然得到极大的提升但相对于37℃的产毒量仍旧较低,所以该细胞也是在37℃时能够获得相对较高的病毒滴度(图6c-6d)。
实施例6一步感染法对293贴壁病毒产量的影响:
在之前的实施例中,病毒感染时我们是通过将病毒稀释到无血清的培养基如dmem或opti-mem中感染2-3h后再更换成含3%fbs的dmem培养基进行病毒的扩增,这种首先通过将病毒稀释至无血清的培养基中进行感染2-3h,然后更换成含3%fbs的两步病毒扩增法在病毒的大规模扩增时将加大工作量,复杂生产工艺流程及增加污染的可能,因而这里我们尝试一步扩增法,即:在病毒感染时直接将病毒稀释至含3%fbs的dmem培养基中,病毒感染24h后收获病毒液,该方案的具体实施步骤如下:
1、293贴壁细胞:在6孔培养板中每孔加入293贴壁细胞悬液2ml,使细胞量达到5×105个/孔,37℃,体积百分比为5%co2培养24h;
2、待293贴壁细胞密度达到95%以上时,取其中一孔中的细胞消化后进行计数,其中两孔细胞按moi=0.1将vsv病毒用新鲜的含3%fbs的dmem培养基稀释至2ml,并将其加入到吸弃掉原有培养基的相对应的孔中;另外两孔细胞则先用dmem-0稀释病毒感染2-3h后更换成含3%fbs的dmem培养基,37℃,体积百分比为5%co2感染24h,收集病毒液,使用0.22μm滤器进行过滤;
3、在1.5mlep管中将步骤2中收获的上清作连续10倍的稀释,从10-1-10-11,共11个滴度;
4、将稀释好的上清接种到96孔培养板中,每一稀释度接种一列共8孔,每孔接种100µl。设正常细胞对照组一列;
5、48h后观察每孔细胞荧光情况,有荧光则记为此孔被感染;
6、按karber法计算tcid50。
从图7结果可知,一步病毒感染法相对于两步感染法,在病毒滴度上只是略低于两步感染法,并无实质区别,但该法能够缩减工作量,简化生产工艺流程及减少污染的可能,因而这里我们可选择一步扩增法进行后续病毒的扩增。
实施例7293sus悬浮细胞在生长至不同细胞密度时的病毒产量:
在之前利用悬浮细胞进行vsv病毒生产优化的实验中我们发现,293sus悬浮细胞按moi=0.01的比例于37℃感染24h收获病毒,其单细胞产毒量在e3-e4左右,较vero细胞的单细胞产毒量也只是略微高一些,比之293贴壁细胞要低很多,鉴于悬浮细胞可高密度生长的特性,我们这里尝试在摇瓶中待细胞密度达到最大时进行病毒产量的探索,该方案具体包括以下步骤:
1、293sus悬浮细胞:按细胞密度e3/ml,加入293sus悬液20ml,37℃,体积百分比为5%co2培养24h;
2、每天在特定的时间取200μl至1.5ml管中吹打散后进行细胞计数,并且每隔一天进行离心换液,待细胞生长至中期时,取其中的一瓶细胞直接按moi=0.01加入vsv病毒,另一瓶则通过离心换液后按moi=0.01加入vsv病毒,另外,待细胞生长至平台期时,取其中的一瓶细胞直接按moi=0.01加入vsv病毒,另一瓶则通过离心换液后按moi=0.01加入vsv病毒;37℃,体积百分比为5%co2感染24h,收集病毒液,使用0.22μm滤器进行过滤;
3、在1.5mlep管中将步骤2中收获的上清作连续10倍的稀释,从10-1-10-11,共11个滴度;
4、将稀释好的上清接种到96孔培养板中,每一稀释度接种一列共8孔,每孔接种100µl。设正常细胞对照组一列;
5、48h后观察每孔细胞荧光情况,有荧光则记为此孔被感染;
6、按karber法计算tcid50。
从图8a结果可知,293sus悬浮细胞在90rpm/min的最大密度能达到e7/ml,细胞在达到平台期时并没有出现因细胞密度较大营养不足等原因导致病毒产量降低,即细胞在达到中间密度及最大密度时只要在病毒感染时通过更换新鲜的培养基都能得到足够高的病毒滴度(图8b-8c)
实施例8按最优条件进行病毒放大扩增的病毒产量
在病毒的生产过程中,病毒放大生产制备是检验病毒扩增条件稳定性的必经步骤,这也关系到后续中试放大及gmp生产的顺利进行,因而,这里我们通过将先前优化的病毒生产制备条件进一步放大至t175瓶来检验该条件下的病毒生产稳定性(图9)。该方案具体包括:
1、vero-e6:在t175培养瓶中每瓶加入vero-e6细胞悬液30ml,37℃,体积百分比为5%co2培养;293贴壁细胞:在t175培养瓶中每瓶加入293贴壁细胞悬液30ml,,37℃,体积百分比为5%co2培养;293sus悬浮细胞:按实施例7进行;
2、待贴壁细胞密度达到95%以上时,vero和293贴壁细胞各取其中一瓶中的细胞消化后进行计数,其余细胞分别按moi=5(vero)和moi=0.1(293)将vsv病毒用dmem-0稀释至10ml,并将其加入到吸弃掉培养基瓶中,37℃,体积百分比为5%co2感染2h-3h。
3、吸弃病毒液,分别加入含3%fbs的dmem培养基30ml37℃,体积百分比为5%的co2培养24h(293)和36h(vero),收集病毒液,使用0.22μm滤器进行过滤;
4、在1.5mlep管中将步骤2中收获的上清作连续10倍的稀释,从10-1-10-11,共11个滴度;
5、将稀释好的上清接种到96孔培养板中,每一稀释度接种一列共8孔,每孔接种100µl。设正常细胞对照组一列;
6、48h后观察每孔细胞荧光情况,有荧光则记为此孔被感染;
7、按karber法计算病毒的滴度(tcid50)。
进一步根据图8和图9结果可知,在293细胞中,按照本专利优化的病毒生产制备方法进行病毒的放大培养时仍能获得足够稳定及高产的病毒产量,因而本公开提供了一种利用293细胞(贴壁或悬浮细胞)进行稳定高效病毒生产制备方法,该方法能够用于后续的放大培养,并为gmp大规模生产提供数据支持。
与目前的利用vero细胞进行溶瘤病毒生产相比,本公开的病毒扩增制备方法能大幅缩减生产成本,在同样的培养体系中,按本方法进行病毒生产能获得至少10倍或更多倍的病毒产量,便于后续大规模病毒生产及病毒下游纯化工艺的实施。并且一步病毒感染法在病毒生产工艺上缩减了病毒感染时更换新鲜培养基的步骤,从而简化生产工艺,节约人力成本,减少污染的可能。
- 还没有人留言评论。精彩留言会获得点赞!