一种具有抑制巨噬细胞增殖活性的海参多肽及其应用的制作方法
本发明属于生物医药技术领域,具体涉及一种具有抑制巨噬细胞增殖活性的海参多肽及其应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
海参,属海参纲(holothuroidea),是生活在海边至8000米的海洋棘皮动物,距今已有六亿多年的历史,海参全身长满肉刺,广布于世界各海洋中。海参同人参、燕窝、鱼翅齐名,是世界八大珍品之一。海参不仅是珍贵的食品,也是名贵的药材。据《本草纲目拾遗》中记载:海参,味甘咸,补肾,益精髓,摄小便,壮阳疗痿,其性温补,足敌人参,故名海参。据报道,海参具有提高记忆力、延缓性腺衰老,防止动脉硬化以及抗肿瘤等作用。海参是一种典型的高蛋白、低脂肪、低胆固醇的食物,其中蛋白质高达55%。现代研究表明:海参多肽具有抗氧化,降血压,抗肿瘤,血糖调节,免疫调节等活性作用。
巨噬细胞广泛分布在机体的组织和器官中,在病原体防御、炎症反应、稳态维持及损伤修复中发挥重要作用,还可作为专职抗原提呈细胞加工提呈抗原激活适应性免疫应答。其通常是不能进一步进行细胞分裂终末分化细胞。然而,现代生物医学研究表明,巨噬细胞增殖涉及某些严重的增殖性疾病,例如淋巴瘤、心血管疾病和肾硬化等。gabrielian等还报道了巨噬细胞渗透在创伤性增殖性玻璃体视网膜病中的作用。然而,发明人发现,截至目前,有关海参多肽对巨噬细胞的作用报道甚少。
技术实现要素:
基于上述现有技术的不足,本发明提供具有抑制巨噬细胞增殖活性的海参多肽,本发明海参多肽能够通过抑制巨噬细胞增殖用于预防或治疗与巨噬细胞增殖相关性疾病,包括但不限于:如淋巴瘤、心血管疾病、肾硬化和创伤性增殖性玻璃体视网膜病等;同时本发明的海参多肽也可作为巨噬细胞增殖抑制剂剂抑制巨噬细胞的体外培养,从而为巨噬细胞及其相关科学研究提供材料。本发明具有良好的实际应用之价值。
本发明的一个方面,提供一种具有抑制巨噬细胞增殖活性的海参多肽,组成海参多肽的氨基酸序列为:
wdgvgvsgr(seqidno.1)。
该海参多肽具有体外抑制巨噬细胞增殖活性的作用,可以采用固相多肽合成法合成。
本发明的第二个方面,提供编码所述海参多肽的核苷酸,其包含下组中的任一种:
(a)编码具有所述氨基酸序列的多肽的核苷酸;
(b)与(a)所述核苷酸互补的核苷酸。
本发明的第三个方面,提供上述海参多肽在制备抑制巨噬细胞增殖的药物中的应用。
进一步的,所述药物能够通过抑制巨噬细胞增殖预防或治疗与巨噬细胞增殖相关的疾病,优选的,所述疾病包括但不限于:如淋巴瘤、心血管疾病、肾硬化和创伤性增殖性玻璃体视网膜病。
本发明的第四个方面,提供上述海参多肽作为非治疗目的的巨噬细胞增殖抑制剂的用途。根据本发明,所述“非治疗目的”例如在体外抑制巨噬细胞增殖,通过对巨噬细胞施加本发明的海参多肽,有利于研究巨噬细胞增殖信号通路及基因表达交互作用,从而为进一步研究巨噬细胞增殖相关性疾病提供原始材料并奠定基础。
本发明的第五个方面,提供一种体外抑制巨噬细胞增殖的方法,所述方法包括给予体外培养的巨噬细胞上述海参多肽。
进一步的,所述巨噬细胞为raw264.7;
进一步的,所述海参多肽氨基酸序列为wdgvgvsgr(seqidno.1)。
进一步的,所述海参多肽浓度10~1000μg/ml,更进一步为25~400μg/ml;所述海参多肽浓度包括但不限于25μg/ml,100μg/ml,400μg/ml。
本发明的有益技术效果:
本发明从海参中获取具有抑制巨噬细胞增殖活性的海参多肽,经人工合成后采用mtt法检测人工合成海参多肽对巨噬细胞的作用,经试验表明,本发明人工合成的海参多肽对巨噬细胞增殖具有明显的抑制作用,且呈现明显的剂量效应关系,本发明海参多肽不仅能够通过抑制巨噬细胞增殖用于预防或治疗与巨噬细胞增殖相关性疾病,同时也可作为巨噬细胞增殖抑制剂剂抑制巨噬细胞的体外培养,从而为巨噬细胞及其相关科学研究提供材料。因此具有良好的实际应用之前景。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1是本发明mtt法预实验测定细胞接种最适浓度图。
图2是本发明实施例1中不同浓度的海参多肽p1对巨噬细胞增殖率影响图。
图3是本发明实验例1中不同浓度的海参多肽p2对巨噬细胞增殖率影响图。
图4是本发明实验例2中不同浓度的海参多肽p3对巨噬细胞增殖率影响图。
图5是本发明实验例3中不同浓度的海参多肽p4对巨噬细胞增殖率影响图。
图6是本发明实验例4中不同浓度的海参多肽p5对巨噬细胞增殖率影响图。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本发明使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
本发明的一个典型实施方式中,提供一种具有抑制巨噬细胞增殖活性的海参多肽,组成海参多肽的氨基酸序列为:
wdgvgvsgr(seqidno.1)。
该海参多肽具有体外抑制巨噬细胞增殖活性的作用,可以采用固相多肽合成法合成。
本发明的又一具体实施方式中,提供编码所述海参多肽的核苷酸,其包含下组中的任一种:
(a)编码具有所述氨基酸序列的多肽的核苷酸;
(b)与(a)所述核苷酸互补的核苷酸。
本发明的又一具体实施方式中,提供上述海参多肽在制备抑制巨噬细胞增殖的药物中的应用。
本发明的又一具体实施方式中,所述药物能够通过抑制巨噬细胞增殖预防或治疗与巨噬细胞增殖相关的疾病,优选的,所述疾病包括但不限于:如淋巴瘤、心血管疾病、肾硬化和创伤性增殖性玻璃体视网膜病。
本发明的又一具体实施方式中,提供上述海参多肽作为非治疗目的的巨噬细胞增殖抑制剂的用途。根据本发明,所述“非治疗目的”例如在体外抑制巨噬细胞增殖,通过对巨噬细胞施加本发明的海参多肽,有利于研究巨噬细胞增殖信号通路及基因表达交互作用,从而为进一步研究巨噬细胞增殖相关性疾病提供原始材料并奠定基础。
本发明的又一具体实施方式中,提供一种体外抑制巨噬细胞增殖的方法,所述方法包括给予体外培养的巨噬细胞上述海参多肽。
本发明的又一具体实施方式中,所述巨噬细胞为raw264.7;
本发明的又一具体实施方式中,所述海参多肽氨基酸序列为wdgvgvsgr(seqidno.1)。
本发明的又一具体实施方式中,所述海参多肽浓度10~1000μg/ml,更进一步为25~400μg/ml;所述海参多肽浓度包括但不限于25μg/ml,100μg/ml,400μg/ml。
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。
1.实验材料及设备
1.1实验材料
(1)细胞培养及样品处理相关材料
小鼠单核巨噬细胞raw264.7:中国科学院上海细胞库
人工合成海参多肽:生工生物工程(上海)股份有限公司
细胞培养板(96孔,24孔,6孔):nest公司
一次性滤器(0.22μm):德国minisart
滤纸:西安名煌过滤纸厂家,国产
dmem(dulbecco'smodifiedeaglemedium)培养基:gibco,美国
青霉素和链霉素:invitrogn,美国
胰蛋白酶(solarbio公司):solarbio公司,北京
胎牛血清(fetalbovineserum,fbs):gibco公司,美国
(2)mtt实验相关材料
dmso(dimethylsulphoxide):sigma,美国
mtt:sigma,美国
1.2实验仪器
鼓风干燥箱
超声波清洗仅(kq巧00型):昆山市超声仪器有限公司
超净工作实验台::哈东联公司
移液器(2.5μl,10μl,100μl,200μl,1000μl):德国eppendorf
血细胞计数板:上海求精生化试剂仪器有限公司
酶标仪:sunrise,tecan,奥地利
电热恒温水浴锅:德国ika
高压蒸汽灭菌锅:英国astell
真空泵抽滤设备:vzcuubrand公司,德国
倒置生物显微镜:德国leicadmirb
电子分析天平(ab204-s,pb403-s,pb3002-s):瑞士mettleroledo
超纯水系统:millipore-q,millipore,美国
二氧化碳恒温细胞培养箱:mco-15ac,sanyo,日本
台式高速冷冻离心机:5810r,eppendorf,德国
高速组织匀浆仪(t18basic):ika,德国
紫外分光光度计(8453e):agilent公司,美国
涡旋仪:德国ika
水浴锅:德国heidolphin
1.3主要试剂及配制方法
(1)10%的dmem:
取基础培养基100ml,胎牛血清10ml,在无菌条件下,将两者混合,并加入5ml双抗,6mlhepes,分装,4℃保存备用。
(2)磷酸盐缓冲液(pbs,ph=7.2):
称量nac18.00g,kcl0.20g,na2hpo4.12h2o3.47g,kh2po40.20g,溶于适量超纯水中,充分溶解后,定容至1000ml,于超净台中用0.22μm一次性滤膜过滤除菌,分装,放置于4℃保存备用。
(3)mtt的配制:
称取100mgmtt粉末,溶于20mlpbs(ph7.2),超声波震荡溶解,待完全溶解后用0.22μm一次性滤膜过滤除菌,即得5mg/ml的mtt染液,用4ml无菌ep管分装,-20℃避光保存备用。
2.试验方法
2.1细胞复苏
(1)将冷冻管从液氮中取出,迅速投入37℃水浴中融化,细胞融化后(约1min)要尽快移出37℃水浴。37℃水浴时间延长会提高细胞死亡率,复苏过程中一般细胞死亡率在20%~25%之间。
(2)将细胞冻存管在无菌条件下打开,并将冻存细胞悬液转移到15ml无菌离心管中,加入5ml含10%fbs的dmem培养基。
(3)1000rpm/min离心5min,弃上清。
(4)向离心管中加入5-6ml完全培养基,吹打均匀,制成细胞悬液,转入t75培养瓶中,置于37℃,5%co2培养箱中进行培养。
(5)24h后更换培养液后继续培养,待贴壁细胞覆盖培养瓶底面积80%时,进行传代。
2.2细胞传代
(1)显微镜下观察细胞密度,待细胞覆盖培养瓶底面积约80%时,进行传代。
(2)在无菌环境下,将细胞培养瓶中的培养液倒掉。加入2mlpbs,清洗三次,吸弃pbs。
(3)加入2-3ml10%dmem,在培养瓶底部用刮刀使细胞脱壁,用移液器多次进行吹打混匀,使其分散。
(4)以合适的细胞密度(一般以1:4分配进行细胞传代培养)接种于另一培养瓶中。
(5)记录细胞名称、传代次数、操作者姓名以及传代日期,置于37℃,5%co2培养箱中继续培养。
(5)记录细胞名称、传代次数、操作者姓名以及传代日期,置于37℃,5%co2培养箱中继续培养。
2.3细胞冻存
(1)配制细胞冻存液(50%dmem,40%血清,10%dmso)
(2)选取传代3次后呈对数生长期的细胞,pbs清洗,加入2ml胰酶消化液进行消化3min,再加入等体积培养基终止消化,用移液器轻轻吹打,使细胞脱壁并分散为单个细胞后,将细胞转移至15ml无菌离心管中。
(3)1000rpm,5min离心。
(4)弃上清液,加入细胞冻存液,吹打均匀,调节冻存液中的细胞密度至(5-10)×106/ml。
(5)将细胞悬液分装于冻存管内(1ml/管)。
(6)拧紧管盖,封口膜封口,标明raw264.7巨噬细胞,操作者和冻存日期。
(7)将冻存管先后在4℃放置30min,-40℃放置48h,最终放入液氮罐长期冻存。
2.4mtt法预实验测定细胞接种最适浓度的选择
(1)收集对数期细胞,调整细胞悬液浓度分别为5000,6000,7000,8000,9000个/ml,每孔100ul,边缘孔用无菌pbs填充。
(2)培养细胞:5%co2,37℃培养箱孵育。
(3)呈色:48h后,每孔加mtt溶液10ul,培养箱中孵育4-6h。终止培养,吸弃孔内上清液,每孔加100uldmso。振荡10min,使结晶物充分溶解。
(5)比色:酶标仪570nm波长处测量od值。
(6)数据处理分析。
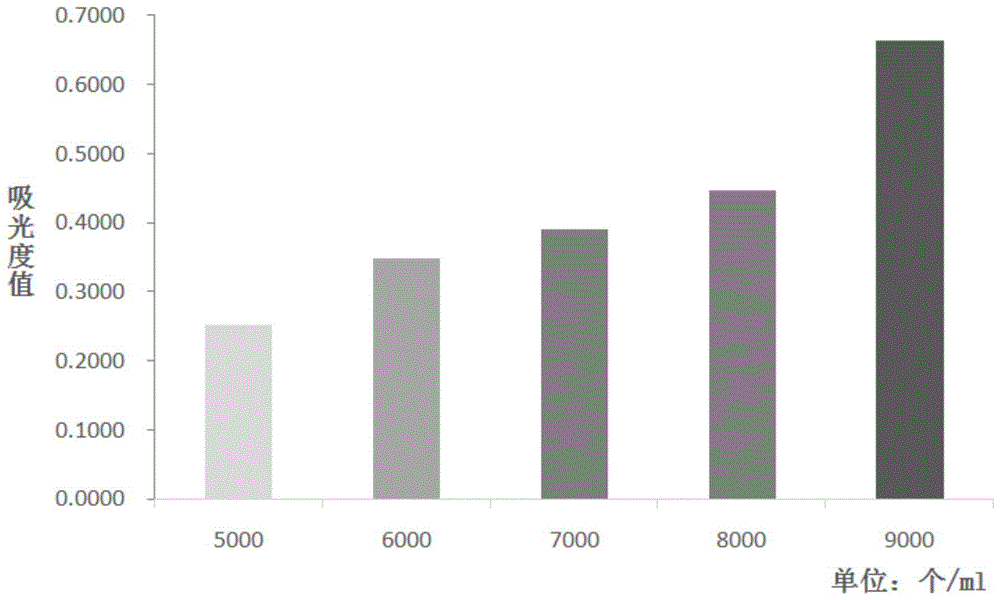
根据mtt法预实验测定细胞接种最适浓度的方法,实验结果如图1所示:当细胞浓度为5000个/ml时,吸光度值是0.2512;当细胞浓度为6000个/ml时,吸光度值是0.3473;当细胞浓度为7000个/ml时,吸光度值是0.3903;当细胞浓度为8000个/ml时,吸光度值是0.4468;当细胞浓度为9000个/ml时,吸光度值是0.6632。查阅资料可知,吸光度在0.2-0.8之间才能保证测量的相对误差较小。但是由于每次实验时巨噬细胞的状态以及数量不同,为避免吸光度值过小(<0.2)或过大(>0.8),吸光度值应保持在0.4-0.5之间,故细胞悬液的最佳浓度应在7000-8000个/ml范围内,在此实验中,选择7500个/ml的细胞悬液浓度进行实验。
2.5mtt法检测人工合成海参多肽对raw264.7巨噬细胞免疫调节作用的研究
(1)接种细胞:收集对数期细胞,调整细胞悬液浓度7500个/ml,每孔100ul,边缘孔用无菌pbs填充。
(2)培养细胞:5%co2,37℃培养箱孵育。
(3)加药:24h后,将8种合成多肽分别以25、100、400ug/ml的药物浓度进行换液,每孔100ul。
(4)呈色:48h后,每孔加mtt溶液10ul,培养箱中孵育4-6h。终止培养,吸弃孔内上清液,每孔加100uldmso。振荡10min,使结晶物充分溶解。
(5)比色:酶标仪570nm波长处测量od值。
(6)数据处理分析。
各人工合成海参多肽试验结果见各实施例和实验例。
实施例1p1(多肽序列5’-3’为wdgvgvsgr,seqidno.1)海参合成肽对巨噬细胞增殖率的研究结果
采用mtt法检测p1对巨噬细胞增殖活性的影响,五组平行实验实验结果表明p1有明显的生物活性,与空白对照组相比,p1在25μg/ml、100μg/ml、400μg/ml时的增值率分别为23.13%、39.52%、57.39%。在进行t-test检验时,p<0.001,有非常显著性差异。这说明p1对raw264.7巨噬细胞有明显的抑制作用。
实验例1p2(多肽序列5’-3’为wvdgvgsgr,seqidno.2)参合成肽对巨噬细胞增殖率的研究结果
采用mtt法检测p2对巨噬细胞增殖活性的影响。实验结果如图3所示,经t-test检验没有显著性差异,说明p2对巨噬细胞没有生物活性。
实验例2p3(多肽序列5’-3’为wdvgvgsgr,seqidno.3)海参合成肽对细胞增殖率的研究结果
采用mtt法检测p3对巨噬细胞增殖活性的影响。实验结果如图4所示,经t-test检验没有显著性差异,p3对巨噬细胞并没有生物活性。
实验例3p4(多肽序列5’-3’为wdgvgsgvr,seqidno.4)海参合成肽对巨噬细胞增殖率的研究结果
采用mtt法检测p4对巨噬细胞增殖活性的影响,五组平行实验结果表明p4在25μg/ml、100μg/ml、400μg/ml时增值率分别为4.13%、16.32%、7.60%。且在p4的浓度为100μg/ml时,p<0.05,有显著性差异。因此可以认为p4对巨噬细胞的增殖作用并不明显。
实验例4p5(多肽序列5’-3’为wdgvgsgrv,seqidno.5)海参合成太对巨噬细胞增殖率的研究结果
采用mtt法检测p5对巨噬细胞增殖活性的影响,五组平行实验实验结果表明p5在25μg/ml、100μg/ml、400μg/ml时增值率分别为11.00%、17.16%、11.06%,且p5在25μg/ml时有显著性差异,但总体来看增殖效果并不明显。总体方差太小,不符合mtt实验结果。
最后应该说明的是,以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。上述虽然对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
sequencelisting
<110>山东大学
<120>一种具有抑制巨噬细胞增殖活性的海参多肽及其应用
<130>
<160>5
<170>patentinversion3.3
<210>1
<211>9
<212>prt
<213>人工合成
<400>1
trpaspglyvalglyvalserglyarg
15
<210>2
<211>9
<212>prt
<213>人工合成
<400>2
trpvalaspglyvalglyserglyarg
15
<210>3
<211>9
<212>prt
<213>人工合成
<400>3
trpaspvalglyvalglyserglyarg
15
<210>4
<211>9
<212>prt
<213>人工合成
<400>4
trpaspglyvalglyserglyvalarg
15
<210>5
<211>9
<212>prt
<213>人工合成
<400>5
trpaspglyvalglyserglyargval
15
- 还没有人留言评论。精彩留言会获得点赞!