用于早期诊断骨科疾病的分子标志物的制作方法
本发明属于生物医学领域,涉及早期诊断骨科疾病的分子标志物,具体涉及loc105373465在诊断男性骨质疏松症中的用途。
背景技术:
骨质疏松症是以骨量减少及骨组织微结构退变为特征的一种全身性骨骼疾病,伴有骨脆性增加、易发生骨折,常"静悄悄"发病。一旦被发现,多已发展到一定程度。原发性骨质疏松最主要的两个类型为:女性绝经期后骨质疏松和老年性骨质疏松。而与颇受重视的女性骨质疏松不同,男性骨质疏松发病原因多样、骨折发生率及骨折后相关的死亡率往往更高。原发性骨质疏松主要是随年龄增加,体内性激素突然减少及生理性退行性变所致。由于雌激素不仅可以抑制破骨细胞对骨质的吸收,而且可促进胶原合成并有利于骨的形成,所以随着绝经期后性激素水平的下降,骨质疏松的发病率女性远高于男性(女男=61)。与女性绝经期后50~70岁的发病高峰相比,男性骨质疏松常晚于女性10年左右,这主要是由于男性对雌激素的依赖水平较低,且全身骨量较女性多8%~10%有关。美国患有骨质疏松症的男性占总人口的3%~6%,我国没有确切数据报告,但发病率应不低于这一比例,并将随着人口老龄化逐年增高。
与女性骨质疏松相同,普通x线仍是诊断男性骨质疏松和相关骨折的必要手段。首要表现为脊柱和骨盆的骨质密度减低。椎体骨皮质变薄,横行骨小梁减少或消失,纵行骨小梁相对明显,严重时椎体内结构消失;椎体变扁,其上下缘内凹、椎间隙增宽,椎体呈双凹状,常因轻微外伤而压缩呈楔形。在长骨上可见骨小梁变细、数量减少、骨皮质变薄和出现分层现象。严重时可在弥漫性骨质密度减低的基础上出现散在分布的数毫米大小的点状透亮区,其边界清楚或模糊,易误诊为骨质破坏。但x线平片对诊断骨质疏松的敏感性和准确性低,对骨质疏松的早期诊断帮助不大。因此亟待开发一种在骨质疏松症早期即可诊断骨质疏松症的方法。
在分子水平上对骨质疏松症进行诊断已成为未来的发展趋势,越来越多的发明人在该领域进行了专利布局,如专利:201510725408.x201711476456.5201510629348.1201610115194.9201610116151.2等。上述专利研究方向为基因与骨质疏松症诊断的关系,但还未见研究非编码rna与骨质疏松症诊断的关系。
自1939年waddington提出表观遗传学(epigenetics)的概念以来,其已逐渐成为生命科学研究领域的前沿。表观遗传学是指不依赖于dna序列改变的可遗传的基因表达变化的学科。表观遗传学包括dna甲基化、组蛋白修饰和非编码rna调控的范畴。近年来,越来越多的研究表明,非编码rna调控在肿瘤发生发展中具有重要的作用。
人类基因组中研究最多最好的是编码蛋白的基因,但这部分基因只占据了人类基因组的1.5-2%。基因组中约70-90%的基因组dna被转录但是不编码蛋白质,其转录产物被认为是“暗物质”或“垃圾”。(johnnyt.y.kung,davidcolognori,jeanniet.lee.longnoncodingrnas:past,present,andfuture.genetics.2013.193:651–669.manelesteller.non-codingrnasinhumandisease.naturereviews|genetics.2011.12:861-874.)近些年越来越多的研究发现这些转录产物可以参与到细胞分裂、分化等生命活动,具有重要的生物学功能。这些不编码蛋白的转录本被称为非编码rna。非编码rna包括小非编码rna和长链非编码rna两大部分。根据长度和生源分类,小非编码rna包括mirna、sirna、pirna等。长链非编码rna是长度大于200nt并且不能编码功能性蛋白的一类转录本。大多数的非编码rna具有poly(a)尾。(timr.mercer,marcele.dingerandjohns.mattick.longnon-codingrnas:insightsintofunctions.naturereviews|genetics.2009.10(3):155-159.manelesteller.non-codingrnasinhumandisease.natureeviews|genetics.2011.12:861-874.carlernst.cynthiac.morton.identificationandfunctionoflongnon-codingrna.frontiersincellularneuroscience.2013.7(168):1-9.)越来越多的研究显示,长链非编码rna参与到了染色体的修饰、转录调控、转录后调控等重要的生物学过程,同时对于疾病的发生发展有着重要的调控作用。(timr.mercer,marcele.dingerandjohns.mattick.longnon-codingrnas:insightsintounctions.naturereviews|genetics.2009.10(3):155-159.)
随着研究技术的发展,尤其是二代测序技术和芯片技术的日臻成熟。越来越多的长链非编码rna被发现,但是其功能的研究仍不是很清楚。(johnrprensner,matthewkiyer,oalejandrobalbinetal.transcriptomesequencingacrossaprostatecancercohortidentifiespcat-1,anunannotatedlincrnaimplicatedindiseaseprogression.2011.29(8):742-750.jiagenli,1zhaolichen,liqingtian.lncrnaprofilestudyrevealsathree-lncrnasignatureassociatedwiththesurvivalofpatientswithoesophagealsquamouscellcarcinoma.gut2014.0:1–11.)有研究显示,长链非编码rna参与到了细胞的增殖、细胞周期、细胞衰老和凋亡等生物学过程。(maruyama,r.andh.suzuki,longnoncodingrnainvolvementincancer.bmbrep.2012.45(11):604-611.)在疾病的发生发展过程中具有重要的作用。
本申请的发明人为了填补目前的技术空白,利用芯片筛选与骨质疏松症相关的非编码rna,并进行了相关验证,为临床上进行分子诊断提供了一种新的策略和方法。
技术实现要素:
本发明所要解决的一个技术问题是针对现有技术的现状提供一种与男性骨质疏松症诊断相关的长链非编码rna标志物。
本发明所要解决的另一个技术问题是提供一种上述lncrna标志物的检测方法,该检测方法不直接用于疾病的诊断与治疗。
本发明所要解决的又一个技术问题是提供一种上述lncrna标志物在制备诊断男性骨质疏松症的产品中的应用。
本发明为解决上述技术问题,采用了如下技术方案:
本发明一方面,提供了一种与男性骨质疏松症诊断相关的分离的长链非编码rna,所述长链非编码rna是loc105373465。
在另一优选例中,所述lncrna分离自人或非人哺乳动物的血液和/或组织。
在另一优选例中,所述的血液为血浆和/或血清。
在另一优选例中,所述的血液不包括血细胞。
在另一优选例中,所述的非人哺乳动物为小鼠、大鼠、兔、猪、牛、羊等。
在另一优选例中,所述lncrna分离自人血液。
本发明第二方面,提供了一种分离的多核苷酸,所述多核苷酸能被人细胞转录成本发明第一方面的长链非编码rna。
本发明第三方面,提供了一种载体,所述载体含有本发明第二方面的多核苷酸,或表达本发明第一方面的长链非编码rna。
本发明第四方面,提供了一种试剂,所述试剂是能够检测本发明第一方面的长链非编码rna表达量的试剂。
进一步,所述试剂包括利用sybrgreen、taqman探针、分子信标、双杂交探针、或复合探针检测所述长链非编码rna表达量时使用的pcr扩增引物。
在本发明的具体实施例中,所述引物序列如seqidno.1和seqidno.2所示。
本发明第五方面,提供了一种诊断骨质疏松症的芯片,所述芯片包括固相载体以及以及有序固定在所述固相载体上的寡核苷酸探针,所述寡核苷酸探针特异性地对应于本发明第一方面的长链非编码rna。
本发明第六方面,提供了本发明第五方面的芯片的用途,用于制备诊断男性骨质疏松症的试剂盒。
本发明第七方面,提供了一种试剂盒,所述试剂盒含有本发明第一方面的长链非编码rna或本发明第四方面的试剂,或本发明第五方面的芯片。
进一步,本发明的试剂盒还可以包含rt-pcr反应所需的下列成分:pcrbuffer、10mmdntps、hotstarttaq酶、ddh2o。
进一步,本发明的试剂盒还可以包含长链非编码rna反转录得到的cdna,作为检测上述引物可行性的阳性模板。
本发明第八方面,提供了本发明第一方面的长链非编码rna、或本发明第四方面的试剂的用途,用于制备诊断男性骨质疏松症的芯片或试剂盒。
本发明的试剂盒的使用方法具有以下记载:
(1)从来自检测对象的样本中提取本发明第一方面的lncrna;
(2)对lncrna含量进行检测,并将结果与正常人群中的lncrna含量进行比较,若样本中的lncrna的含量e1显著高于正常人群的lncrna含量e0,则说明该检测对象患有骨质疏松或者患有骨质疏松的概率高。
在另一优选例中,所述显著高于是指e1/e0≥1.5,优选地,≥2.0,更优选地,≥5。
在另一优选例中,所述检测对象包括未患有骨质疏松的正常男性、疑似患有骨质疏松的男性患者或确诊骨质疏松的男性患者。
在本发明的上下文中,“诊断骨质疏松症”包括判断受试者是否已经患有骨质疏松症、判断受试者是否存在患有骨质疏松症的风险。
如本文所用,术语“lncrna”、“长链非编码rna”、“longnon-codingrna”含义相同,互换使用,都是指一种由rna聚合酶ii转录、不编码蛋白的、一般长度大于200bp的rna片段。
如本文所用,术语“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多聚核苷酸和多肽是没有分离纯化的,但同样的多聚核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。
当然,还可以根据数据库中相对于的lncrna序列或其互补序列,根据常规技术化学合成lncrna或其检测试剂(如可以与lncrna相结合的寡核苷酸作为探针,并进一步制备成芯片),或采用其cdna序列制备成表达载体,并转录为lncrna。
多核苷酸构建物
根据本发明所提供的人lncrna序列,可设计出在被导入后可被加工成可影响相应的mrna表达的lncrna的多核苷酸构建物,也即所述多核苷酸构建物能够在体内上调相应的lncrna的量。因此,本发明提供了一种分离的多核苷酸(构建物),所述的多核苷酸(构建物)可被人细胞转录成lncrna。
通常,所述的多核苷酸构建物位于表达载体上。因此,本发明还包括一种载体,它含有所述的lncrna,或所述的多核苷酸构建物。所述的表达载体通常还含有启动子、复制起点和/或标记基因等。
本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如卡拉霉素、庆大霉素、潮霉素、氨苄青霉素抗性。
芯片
lncrna表达谱芯片通常含有多达几百个探针,涵盖多种rna,利用dna双链同源互补的原理在全基因组水平上检测样本中所含各种rna的含量。因此,可在同一时间对待测样本中全基因组范围内的rna的转录水平进行检测。
利用本发明所述的lncrna序列,还可以制备相应的lncrna检测芯片,进而研究其表达谱以及lncrna的调节方式。
具体地,可根据本发明所述的lncrna,设计出适合的探针,固定在固相载体上,形成“寡核苷酸阵列”。所述的“寡核苷酸阵列”是指具有可寻址位置(即以区别性的,可访问的地址为特征的位置)的阵列,每个可寻址位置均含有一个与其相连的特征性寡核苷酸。根据需要,可将寡核苷酸阵列分成多个亚阵。
所述固相载体可采用基因芯片领域的各种常用材料,例如但不限于尼龙膜,经活性基团(如醛基、氨基等)修饰的玻片或硅片、未修饰的玻片、塑料片等。
所述的lncrna芯片的制备可采用本领域已知的生物芯片的常规制造方法。例如,如果固相载体采用的是修饰玻片或硅片,探针的5’端含有氨基修饰的聚dt串,可将寡核苷酸探针配制成溶液,然后采用点样仪将其点在修饰玻片或硅片上,排列成预定的序列或阵列,然后通过放置过夜来固定,就可得到本发明的mirna芯片。如果核酸不含氨基修饰,则其制备方法也可参照:王申五主编的《基因诊断技术-非放射性操作手册》;j.l.erisi,v.r.iyer,p.o.brown.exploringthemetabolicandgeneticcontrolofgeneexpressiononagenomicscale.science,1997;278:680和马立人,蒋中华主编.生物芯片.北京:化学工业出版社,2000,1-130。
试剂盒
本发明所述的试剂盒可用于检测血液中所述lncrna的表达。优选的,所述的试剂盒中还含有用于标记rna样品的标记物,以及与所述标记物相对应的底物。优选地,本发明所述试剂盒中所含有的lncrna也可以用于进行阳性对照。此外,所述的试剂盒中还可包括用于提取rna、pcr、杂交、显色等所需的各种试剂,包括但不限于:抽提液、扩增液、杂交液、酶、对照液、显色液、洗液、抗体等。此外,所述的试剂盒中还可包括使用说明书和/或芯片图像分析软件。
附图说明
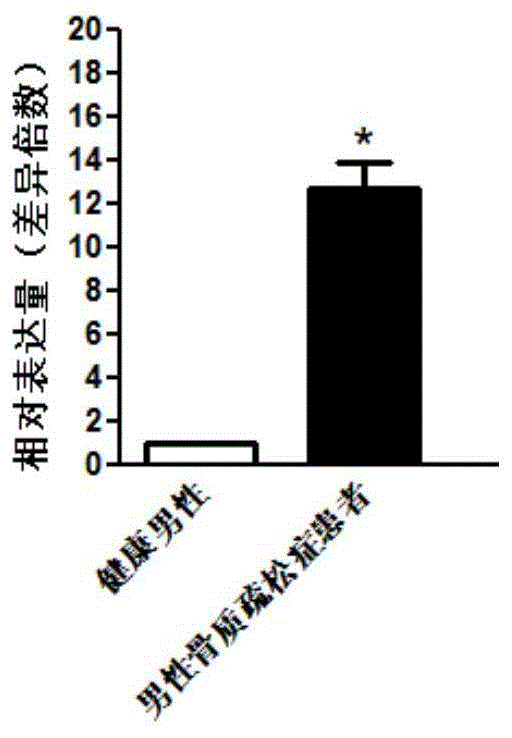
图1显示利用qpcr检测loc105373465的差异表达情况的统计图。
具体的实施方式
下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1筛选差异表达非长链编码rna
1、病例收集
收集医院体检行dxa测定bmd的年龄50岁以上男性6人,排除继发性骨质疏松症和已接受抗骨质疏松治疗的患者。另收集5例体检健康男性作为对照。
bmd测量使用美国hologic公司asy-00409型dxa测量左侧股骨颈(不能测量者测量右侧股骨颈)和腰椎l1-4bmd。骨质疏松症使用《原发性骨质疏松诊治指南(2011年)》的诊断标准:bmd值低于同性别、同种族正常成人的骨峰值不足1个标准差(t值≥-1)属正常,降低1~2.5个标准差(-2.5<t值<-1)为骨量低下,降低程度等于和大于2.5个标准差(t值≤-2.5)为骨质疏松,腰椎以l1-4中的最低值计算。
2、血液总rna提取
使用promega公司的rna提取试剂盒提取总rna。具体步骤如下:
1)取1ml收集在肝素或edta处理过的试管中的全血,放进无菌离心管中;
2)3000rpm离心5min,小心地从样品顶部吸走上清;
3)加1ml血细胞裂解液,小心吸放4-5次,重悬沉淀物,3000rpm离心5min;
4)重复步骤3两次;
5)避开细胞沉淀物,小心吸走几乎所有上清,只保留100μl上清液;确认一下bme已经加到rna裂解液中,然后加175μlrna裂解液到细胞中,吸放重悬并裂解细胞;
6)加350μlrna稀释液,颠倒混合3-4次,室温下13000g离心10min,将清亮裂解物转移到一支无菌离心管中;
7)向澄清裂解液中加入200μl95%乙醇,用移液枪吸放3-4次以混合;将此混合物转移到离心柱装配体中,13000g离心1min;
8)从离心柱装配体上拿下离心柱,弃去收集管中的液体,将离心柱装回到收集管上,加600μlrna洗涤液于离心柱装配体,13000g离心1min;
9)弃去收集管中的液体,将离心柱装回到收集管上,将50μl新鲜制备的dnase孵育混合物直接加到离心柱内的膜上;
10)室温下孵育15min,向离心柱中加入200μldna酶终止缓冲液,13000g离心1min;
11)加入600μlrna洗涤液,13000g,离心1min;
12)清空收集管,向离心柱内加入250μlrna洗涤液(已加入乙醇),高速离心2min;
13)将离心柱从收集管上转移到洗脱管上,向膜上加100μl无核酸酶水,将离心柱装配体放进离心机并使洗脱管的盖子朝外,13000g离心1min,丢弃离心柱,盖好盛有rna的洗脱管,存于-70℃。
3、rna样品的质量分析
利用nanodrop2000对所提取的rna浓度和纯度进行检测,琼脂糖凝胶电泳检测rna完整性,agilent2100测定rin值。浓度≥200ng/μl,od260/280介于1.8~2.2之间。
4、使用quickamplabelingkit,one-color(agilentp/n5190-0442)合成、标记双链cdna。
5、标记的双链cdna纯化后杂交于arraystar公司的human8x60klncrnaexpressionarrayinformation芯片。
6、杂交漂洗之后由agilentmicroarrayscanner(agilentp/ng2565ba)扫描仪进行扫描分析。
7、原始数据分析由agilentfeatureextractionsoftware软件完成,差异基因的筛选使用配对随机方差模型的方法,差异基因的标准为变化表达2倍以上及p值≤0.05。
8、结果
测序结果显示:与健康男性相比,男性骨质疏松症患者血液中存在的差异表达lncrna为256个,其中上调的为175个,下调的为81个。
实施例2大样本验证筛选出的差异表达lncrna
基于前期芯片测序的结果,根据pvalue的大小,我们选择loc105373465进行验证。
1、样本收集
按照实施例1的方法收集骨质疏松症患者和男性健康对照各30例。
2、在rna水平上进行验证
试剂:反转录试剂盒(ddr037a)购自宝生物工程(大连)有限公司。荧光实时(real-time)定量pcr(polymerasechainreaction)所用的sybrpremixextaqtm(tlirnasehplus)试剂盒为日本takara公司生产。
2.1提取血液总rna
步骤同实施例1。
2.2逆转录
以提取的总rna(1μg)为模板,加入以下反应体系,具体为:
2.3qpcr
按照日本takara公司的
结果釆用相对定量法,运用公式2-△△ct计算。实验重复3次。
引物设计:根据loc105373465转录本序列,通过ncbi的引物设计工具(primerblast)设计引物,引物序列如下所示:上游引物:5’-ttggttaggttcgttgagtt-3’(seqidno.1);下游引物:5’-gcagcatacacagacacta-3’(seqidno.2)。根据gapdh(内参基因)序列设计引物,上游引物:5’-ggagcgagatccctccaaaat-3’(seqidno.3);5’-ggctgttgtcatacttctcatgg-3’(seqidno.4)。
3、结果
结果显示,与健康男性的平均水平相比,30例男性骨质疏松症患者中有29例患者血液中loc105373465水平显著高于健康对照。统计结果如图1所示,与健康男性相比,男性骨质疏松症患者血液中loc105373465水平明显升高,差异具有统计学意义(*p<0.05)。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
序列表
<110>昌乐县人民医院
<120>用于早期诊断骨科疾病的分子标志物
<160>4
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttggttaggttcgttgagtt20
<210>2
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>2
gcagcatacacagacacta19
<210>3
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>3
ggagcgagatccctccaaaat21
<210>4
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>4
ggctgttgtcatacttctcatgg23
- 还没有人留言评论。精彩留言会获得点赞!