一种生产人胱抑素C的基因工程菌及方法与流程
本发明属于生物技术领域,具体涉及一种生产人胱抑素c的基因工程菌及方法。
背景技术:
胱抑素c(cystatinc)由120个氨基酸组成,含有四个保守的半胱氨酸残基可以形成两个二硫键。它属于半胱氨酸蛋白酶抑制剂家族,广泛分布人体中并能够在大多数体液中被发现。胱抑素c的血液浓度与肾小球滤过率相关(gfr),是肾脏健康的重要标志。胱抑素c能被肾小球自由过滤并且在管状细胞中并无分泌,并且它几乎能被管状上皮细胞完全吸收,然后被分解代谢。因此,胱抑素c在血液中的浓度几乎完全依赖于肾小球滤过率,且基本上不受饮食或营养状况的影响。此外,血液浓度胱抑素c也独立于肌肉质量、年龄或性别,与昼夜节律也无关。虽然血清肌酐水平已被用于诊断肾功能几十年,但是现在普遍接受的观点认为,血清肌酐水平的测量在指示肾功能早期急性变化所需的特异性上缺乏灵敏度。而且在诊断肾功能不全时,测量胱抑素c水平明显优于血清肌酐水平。最近有证据表明在血清肌酐水平升高的1或2天前,血清中的胱抑素c水平就已显著升高。许多研究也表明胱抑素c在检测肾小球滤过率减少的微小变化上与肌酐相比的优越性。因此,胱抑素c的血液浓度或其尿液排泄量可以作为肾功能不全的内源性标志物,并用于诊断急性肾小管损伤的严重程度。
重组胱抑素c蛋白,可以用作抗原以开发抗胱抑素c抗体,还可以作为诊断试剂盒中的对照。市面上现存的胱抑素c检测试剂盒大多为使用免疫比浊法,进口的试剂盒价格昂贵,而国产的则大多存在胱抑素c蛋白不纯,且试剂盒中所使用的多克隆抗体质量不稳定、批次间差异大等缺点。虽然现今已有研究对于胱抑素c的可溶表达量进行了优化、提升,但其未能解决其在纯化过程中产生的二聚、多聚等问题,从而导致胱抑素c的纯化回收率及产品纯度不佳,导致免疫动物效果不佳或太多假阳性克隆细胞,进而难以利用其制备得到单克隆抗体。
技术实现要素:
本发明所要解决的技术问题是为了克服现有技术中人胱抑素c的纯化回收率低、纯度不佳,进而免疫动物效果不佳等缺陷,提供一种生产人胱抑素c的基因工程及方法。利用本发明的基因工程菌制备胱抑素c蛋白时,纯化过程中不会产生胱抑素c蛋白二聚、多聚体,提高了无标签胱抑素c的产量;且获得的蛋白纯度高,几乎无杂蛋白存在;进一步获得的不带任何标签的胱抑素c蛋白生物活性良好,利用其制备得到的单抗能够识别人血清中胱抑素c且效价高。
本发明人首次发现在胱抑素c蛋白c端连接多肽lvprgs-n×his可以解决胱抑素c在纯化过程中易聚集的问题,且意外发现将组氨酸标签连接在胱抑素c蛋白的c端,能够保证其n端的活性中心不受影响。
本发明提供一种生产人胱抑素c的基因工程菌,其是在大肠杆菌(esherichiacoli)中表达人胱抑素c的基因的基因工程菌,所述的人胱抑素c基因的3’端带有表达多肽lvprgs-n×his的基因,其中:4≤n≤8,且所述n为整数。
所述的人胱抑素c的氨基酸序列较佳地如序列表中seqidno.1所示。
所述的人胱抑素c基因的核苷酸序列较佳地如序列表中seqidno.2所示。
所述的n较佳地为6。
其中,根据本领域常识,所述的人胱抑素c的基因和所述的表达多肽lvprgs-n×his的基因可通过同源重组等方法整合到宿主大肠杆菌中进行表达,亦可通过表达载体将两者导入大肠杆菌中进行表达。本发明中,优选使用携带含有所述人胱抑素c基因的表达载体和所述表达多肽lvprgs-n×his的基因的表达载体。较佳地,所述表达载体的骨架为质粒pet-22b(+)。
本发明中所述的大肠杆菌较佳地为大肠杆菌bl21(de3)菌株。
本发明还提供一种包含人胱抑素c基因的表达载体,所述人胱抑素c基因的3’端带有表达多肽lvprgs-n×his的基因,其中:4≤n≤8,且所述n为整数。所述的n较佳地为6。
所述的人胱抑素c基因的核苷酸序列较佳地如序列表中seqidno.2所示。
如上所述,所述表达载体的骨架较佳地为质粒pet-22b(+)。
所述的大肠杆菌较佳地为大肠杆菌bl21(de3)菌株。
本发明还提供一种生产人胱抑素c的方法,所述的方法包括以下步骤:
(1)将如上所述的基因工程菌发酵;
(2)收集菌体、破碎离心得含有人胱抑素c的上清,纯化即得。
为增加人胱抑素c在发酵过程中的表达,较佳地,在步骤(1)中的所述发酵的过程中对所述的基因工程菌进行诱导表达。
步骤(2)中所述纯化可为本领域常规的纯化,为提高纯化效率和产量,所述的纯化较佳地为镍磁珠亲和纯化。
所述镍磁珠亲和纯化的方法可为本领域常规。较佳地包括下述步骤:
(1)溶液配制;所述的溶液可为平衡缓冲液(50mmtris-hcl,150mmnacl,ph8.0),洗涤缓冲液(50mmtris-hcl,150mmnacl,50mmimidazole,ph8.0)以及洗脱缓冲液2(50mmtris-hcl,150mmnacl,300mmimidazole,ph8.0);
(2)磁珠预处理:镍磁珠悬浮液在离心管中充分混匀,磁性分离去除上清液,随后依次各用1倍磁珠体积的去离子水及平衡缓冲液洗涤磁珠,充分混匀磁珠,再用磁性分离去除上清液;
(3)上样:将超声破碎离心所得的上清加入装有已平衡的磁珠的离心管中,放置于旋转混合仪上,室温旋转孵育30min;
(4)洗涤:30min后,磁性分离并保留上清液以备后续检测,随后向离心管中加入1倍磁珠体积的洗涤缓冲液,反复颠倒离心管使磁珠重悬,磁性分离,倒出上清以备后续检测,重复2~3次;
(5)洗脱:取0.5ml磁珠移入一个新的离心管中,加入1ml的洗脱缓冲液2,充分混匀磁珠,在涡旋仪上涡旋10min,随后磁性分离,取出洗脱液。
较佳地,所述的方法还包括步骤(3):使用凝血酶酶切步骤(2)所得的带有his标签的人胱抑素c,后除去溶液中的凝血酶;优选使用苯甲脒亲和层析除去溶液中的凝血酶。
本发明还提供一种利用如上所述的方法制备得到的人胱抑素c。
本发明还提供一种如上所述的人胱抑素c在制备抗人胱抑素c单克隆抗体中的应用。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:
利用本发明的基因工程菌制备胱抑素c蛋白时,纯化过程中不会产生胱抑素c蛋白二聚、多聚体,提高了无标签胱抑素c的产量,1l工程菌液中可获得50mg以上的蛋白;且获得的蛋白纯度高,几乎无杂蛋白存在,经sds-page灰度分析纯度>97%;进一步获得的不带任何标签的胱抑素c蛋白生物活性良好对于木瓜蛋白酶的抑制活性>98%,利用其通过免疫balb/c小鼠以及杂交瘤等技术制备得到的单抗能够识别人血清中胱抑素c且效价高,表明所制备得到高活性胱抑素c为制备单克隆抗体提供了必要的保证,而该单抗能够检出人血清中胱抑素c进一步表明该蛋白及其抗体的质量十分优良,可以作为诊断试剂盒的原料试剂。
附图说明
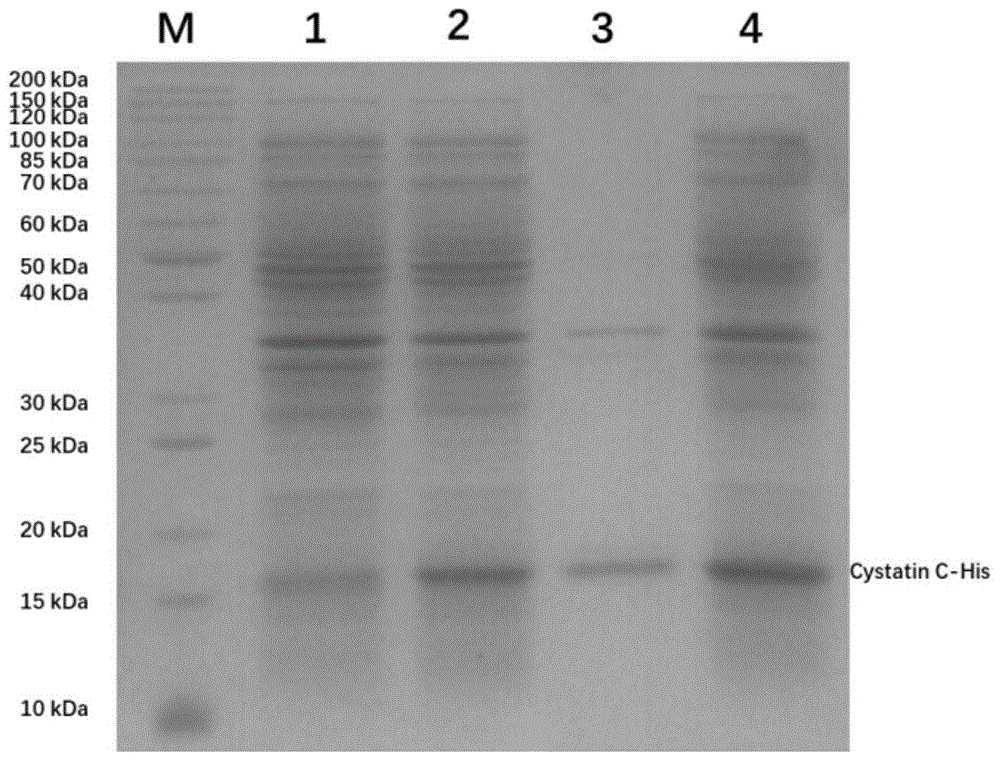
图1为重组cystatinc-his在大肠杆菌bl21(de3)中iptg诱导表达后经超声破菌后离心所得产物的sds-page图;其中,m为蛋白marker,1:非诱导对照,2:上清,3:沉淀,4:全细胞;重组cystatinc-his蛋白的对应位置在marker的15~20kda条带之间。
图2为重组cystatinc-his经镍磁珠亲和纯化的sds-page图;其中,m为蛋白marker,1:镍磁珠上样上清液,2:镍磁珠上样后穿出,3:50mm咪唑tris缓冲液洗涤,4:300mm咪唑tris缓冲液洗脱所得cystatinc-his。
图3为重组cystatinc-his凝血酶酶切及无标签cystatinc纯化的sds-page图;其中,m为蛋白marker,1:镍磁珠上样上清液,2:凝血酶酶切后磁珠中蛋白残留,3:酶切后磁性分离所得上清,4:酶切后上清经苯甲脒柱纯化后(无标签cystatinc)。
图4为无标签cystatinc蛋白的动态光散射结果;测得无标签胱抑素c蛋白分子的直径约为4.3nm,多分散系数(pdi)为0.03507。
图5为无标签cystatinc蛋白的圆二色谱结果;利用cdnn软件计算测得无标签cystatinc蛋白分子的二级结构为α-螺旋12.7%、β折叠40.5%、β转角15.4%、无规则卷曲31.4%。
图6为无标签cystatinc木瓜蛋白酶活性抑制结果;无标签胱抑素c在与木瓜蛋白酶同浓度时能够达到98%的抑制效果。
图7为血清中人胱抑素c蛋白免疫印迹结果;其中,1:重组人胱抑素c,2:人血清胱抑素c(10倍浓缩),3:人血清胱抑素c,4:阴性对照(fbs)。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
以下实施例中的胱抑素c-lvprgs-6×his均简称为cystatinc-his。
实施例1cystatinc-his在大肠杆菌bl21(de3)中的表达
对胱抑素c的基因进行密码子优化,委托上海生工生物公司合成优化后的核苷酸序列(seqidno.2)。利用ncoⅰ及xhoⅰ双酶切构建pet-22b(+)-cystatinc质粒,再利用反向pcr将表达lvprgs的基因插入到pet-22b(+)自带的c端6×his标签基因与胱抑素c的基因之间,构建表达载体pet22b(+)-cystatinc-his。利用本领域的常规手段将表达载体转化进入宿主菌大肠杆菌bl21(de3)。
将pet22b(+)-cystatinc-his/bl21(de3)菌液复苏活化后以1:100扩陪,即取10ml菌液加入到1l的液体lb培养基内(氨苄霉素浓度为100mg/l),37℃摇床培养约4~5h。在菌液od600值到达0.7~0.8时,加入终浓度为1mm的iptg,16℃低温摇床过夜培养(约14h),完成后5000rpm离心30min,收集菌体沉淀。得到菌体沉淀之后,进行菌体破碎,向菌体中加入重悬液(50mmtris-hcl,ph7.0),进行超声破碎(破碎条件:300w,工作1s,间歇1s,30min)。破碎完成后,取少量作为全细胞样品,其余的5000rpm离心30min,收集上清(含有带his标签的重组人胱抑素c蛋白),剩余沉淀再加等体积的重悬液重悬。取上清、沉淀和全细胞样品进行变性聚丙烯酰胺凝胶电泳(sds-page),观察重组人cystatinc-his的表达情况。表达结果如图1所示。通过计算所得的重组cystatinc-his蛋白分子量约为15kda,与蛋白marker位置进行比对结果一致,确认重组cystatinc-his蛋白在细胞破碎上清中具有可观的可溶表达量。
实施例2重组cystatinc-his镍磁珠亲和纯化
利用镍磁珠与cystatinc蛋白c端的组氨酸标签之间的强亲和力,纯化cystatinc-his。
1)溶液配制:平衡缓冲液(50mmtris-hcl,150mmnacl,ph8.0)、洗涤缓冲液(50mmtris-hcl,150mmnacl,50mmimidazole,ph8.0)、洗脱缓冲液2(50mmtris-hcl,150mmnacl,300mmimidazole,ph8.0);
2)磁珠预处理:镍磁珠悬浮液在离心管中充分混匀,磁性分离去除上清液,随后依次各用1倍磁珠体积的去离子水及平衡缓冲液洗涤磁珠,充分混匀磁珠,再用磁性分离去除上清液;
3)上样:将超声破碎离心所得的上清加入装有已平衡的磁珠的离心管中,放置于旋转混合仪上,室温旋转孵育30min;
4)洗涤:30min后,磁性分离并保留上清液以备后续检测,随后向离心管中加入1倍磁珠体积的洗涤缓冲液,反复颠倒离心管使磁珠重悬,磁性分离,倒出上清以备后续检测,重复2~3次;
5)洗脱:取0.5ml磁珠移入一个新的离心管中,加入1ml的洗脱缓冲液2,充分混匀磁珠,在涡旋仪上涡旋10min,随后磁性分离,取出洗脱液;
考马斯亮蓝法测定洗脱液蛋白浓度,计算纯化所得cystatinc-his产量约为92.9±1.9mg/llb培养基,完成之后根据所得蛋白浓度进行sds-page,确定所得cystatinc-his的纯度。结果如图2所示。利用bandscan软件灰度计算得纯化后的重组cystatinc-his蛋白纯度达85%以上。
实施例3重组cystatinc-his的凝血酶酶切及无标签cystatinc蛋白的纯化
将载有重组cystatinc-his的镍磁珠所处缓冲液换为pbs且根据其载量将其浓度调整至约为1mg蛋白/1mlpbs,在pbs体系中直接将cystatinc从磁珠上酶切下来。酶切条件经优化后确定为:在每1ml酶切体系中加入20u的凝血酶,置于37℃恒温摇床中进行过夜震荡酶切。
在磁珠上直接酶切cystatinc-his,磁性分离所得的上清中的主要成分为无标签cystatinc以及小部分的杂蛋白:凝血酶。将所得的上清经过0.22μm的滤膜除菌,利用苯甲脒亲和层析直接将凝血酶除去,而无标签cystatinc蛋白与苯甲脒之间无亲和力,在柱上无结合。由此,便可得到纯净的酶切产物无标签cystatinc蛋白。首先,将苯甲脒柱(10ml)先用双纯水洗涤5倍柱体积,除去柱子中酒精,随后使用20倍柱体积pbs平衡柱子。其次,待洗涤液即将流干时,将酶切反应产物溶液缓缓倒入苯甲脒柱,并待流干时加入两倍柱体积的pbs洗涤,收集穿出液,进行sds-page确认结果。最后,吸附在苯甲脒柱上的凝血酶可以使用1mnacl的pbs缓冲液洗脱回收。
酶切及纯化sds-page结果如图3所示。最终经考马斯亮蓝法测定蛋白浓度,并计算1l培养基中能获得50.3±3.1mg无标签cystatinc蛋白,且为单体形式,基本无二聚及多聚体产生,纯度经bandscan软件灰度计算达97%以上。
实施例4无标签cystatinc蛋白的表征
1)动态光散射测定粒径
将制备得到的无标签cystatinc超滤换缓冲液为pbs缓冲液,浓度为0.5mg/ml。送至动态光散射仪上样,测量所制备无标签cystatinc的粒径。结果如图4所示。半径约为2.131nm,直径约为4.3nm;且无其它更大粒径的蛋白存在,表明无多聚体形成。由于胱抑素c的晶体结构是非球面的,所以其直径具有一定的变化幅度。多分散系数(pdi)较小,为0.03507,可以说明其粒径分布很窄,未发生聚集,表明制得的无标签cystatinc蛋白为单体且纯度较高[多分散系数(pdi值)小于0.05表明为单分散体系,与sds-page结果相符,故纯度较高]。
2)圆二色谱测定二级结构
将制得的无标签cystatinc蛋白(1mg/ml)使用g25脱盐柱的方法置换缓冲液为10mmpb,再分别用10mmpb稀释至0.3、0.5、0.8mg/ml。随后使用圆二色谱仪进行检测。结果如图5所示。将所得数据使用cdnn软件进行二级结构计算后,得到各浓度所计算得到的二级结构基本相同,为α-螺旋12.7%、β折叠40.5%、β转角15.4%、无规则卷曲31.4%。
3)木瓜蛋白酶活性抑制实验测定生物活性
由于胱抑素c对于木瓜蛋白酶的活性具有一定的抑制作用,所以可以利用该抑制作用来测定所制备胱抑素c的生物活性。木瓜蛋白酶能够使得底物nα-benzoyl-l-arginine4-nitroanilide(l-bapa)分解,并显出黄色。因此本发明采用显色底物法,将不同浓度的胱抑素c加入到木瓜蛋白酶与l-bapa的显色反应体系中,在孵育一段时间后,测定其在405nm波长下的吸光度值,并与对照实验组做对比,测得所制备胱抑素c的生物活性。
a)首先将胱抑素c梯度稀释至不同浓度(2~30μm),随后加入反应体系中。反应体系如下:
胱抑素c样品(2~30μm)50μl
木瓜蛋白酶(30μm)50μl
磷酸盐缓冲液(400mm,ph6.5)50μl
b)将体系静置于室温15min,使得胱抑素c于木瓜蛋白酶重复混合。
c)向体系中加入10μl显色底物l-bapa(100μm)并置于37℃培养箱孵化1.5小时。
d)1.5小时后,取出反应体系,加入50μl30%醋酸水溶液终止反应,并使用酶标仪测定各浓度的吸光值a405。
*阳性样品(positive):不加胱抑素c,用pbbuffer替代。
*空白样品(blank):在加入底物l-bapa前,先加入30%醋酸水溶液使木瓜蛋白酶失活。
在测得吸光度值后使用如下公式,算得胱抑素c对于木瓜蛋白酶活性的抑制率。
木瓜蛋白酶活性抑制实验结果如图6所示,制得的无标签胱抑素c对于木瓜蛋白酶存在抑制活性,并且在与木瓜蛋白酶同浓度时能够达到98%的抑制效果。在7.14μm的木瓜蛋白酶以及4.76mml-bapa的条件下,测得其ic50值约为22.7μg/ml(1.64μm)。其对于木瓜蛋白酶的抑制效果与从hek293细胞中制备得到的重组人胱抑素c(sigma#h5041)类似,说明蛋白的活性较好,c端标签切除后残留氨基酸对其生物活性无明显影响,生物活性>98%。
实施例5无标签cystatinc单克隆抗体的制备
用实施例3中制备的无标签胱抑素c蛋白作为免疫原,对balb/c小鼠进行四次免疫,每次免疫200μg蛋白。将蛋白与弗氏佐剂充分混合至乳化后,对小鼠进行多点皮下注射。三次佐剂免疫后,采用间接elisa的方法对小鼠血清进行效价测定,测得小鼠的效价均高于32000,可以用于细胞融合。随后选择效价最高的小鼠直接腹腔注射蛋白作加强免疫,三天后取小鼠脾细胞与ns1细胞(10:1,个/个)进行peg化学融合,再用hat筛选,并以间接elisa测融合细胞效价。最终,经扩大培养及3次亚克隆后,获得了一株产抗胱抑素c单克隆抗体的杂交瘤细胞3d11g3。之后,又成功用该细胞株制备了小鼠腹水(小鼠在弗氏不完全佐剂腹腔注射一周后,再腹腔注射106个杂交瘤细胞),从小鼠腹水中获得了单克隆抗体。用elisa测得其稀释效价为256000,随后将该单克隆抗作体为一抗(稀释比1:1000),羊抗鼠igg-hrp为二抗对人血清胱抑素c及重组胱抑素c进行免疫印迹(western-blot),结果如图7所示,表明该抗体能够准备识别血清中人胱抑素c。
sequencelisting
<110>华东理工大学
<120>一种生产人胱抑素c的基因工程菌及方法
<130>p19011365c
<160>2
<170>patentinversion3.5
<210>1
<211>120
<212>prt
<213>homosapiens
<400>1
serserproglylysproproargleuvalglyglyprometaspala
151015
servalgluglugluglyvalargargalaleuaspphealavalgly
202530
glutyrasnlysalaserasnaspmettyrhisserargalaleugln
354045
valvalargalaarglysglnilevalalaglyvalasntyrpheleu
505560
aspvalgluleuglyargthrthrcysthrlysthrglnproasnleu
65707580
aspasncysprophehisaspglnprohisleulysarglysalaphe
859095
cysserpheglniletyralavalprotrpglnglythrmetthrleu
100105110
serlysserthrcysglnaspala
115120
<210>2
<211>360
<212>dna
<213>artificialsequence
<220>
<223>人胱抑素c基因
<400>2
agctctccgggtaaaccgccgcgtctggttggtggtccgatggatgcgagcgttgaagaa60
gaaggtgttcgtcgtgcactggatttcgctgttggtgaatataacaaagcgtctaacgat120
atgtatcactctcgtgcactgcaggttgttcgtgctcgtaaacagatcgttgcgggtgtt180
aactacttcctggatgttgaactgggtcgtaccacctgcaccaaaacccagccgaacctg240
gataactgtccgtttcatgatcagccgcacctgaaacgtaaagctttctgctcttttcag300
atttatgcggttccgtggcagggtaccatgaccctgtctaaatctacctgccaggatgca360
- 还没有人留言评论。精彩留言会获得点赞!