重组溶瘤病毒以及制备方法、应用和药物与流程
本发明涉及生物
技术领域:
,具体而言,涉及一种重组溶瘤病毒以及制备方法、应用和药物。
背景技术:
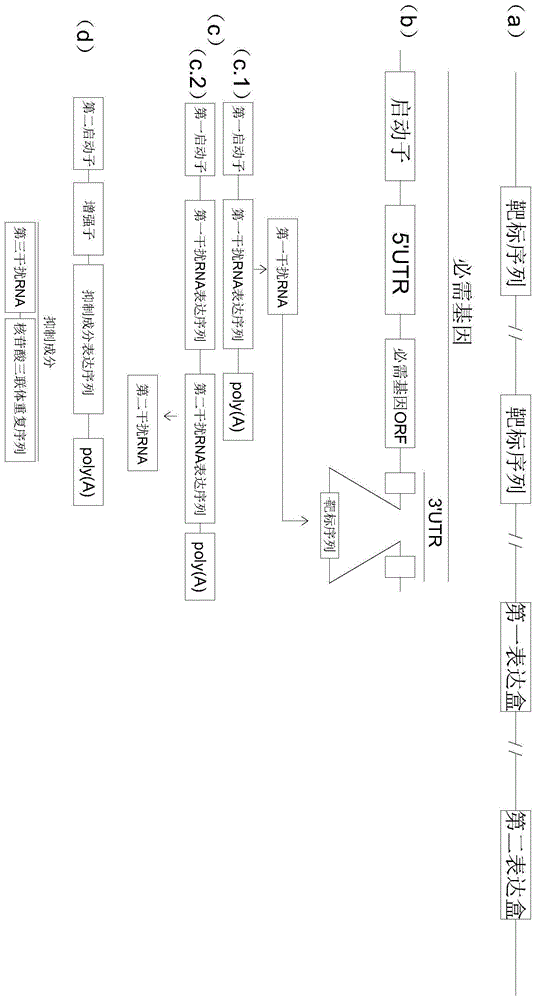
:癌症已经成为威胁人类健康的主要杀手。《2015全球癌症统计》数据显示:2015年全球新增病例约1410万例,死亡人数达820万。2015年中国新发癌症病例429万人和死亡病例达281万人。目前治疗癌症主要靠传统的手术切除,放疗和化疗。手术切除一定程度上能解除患者痛苦,但对于位于体内深部的癌症无以为助,并对已扩散的肿瘤更是无能为力。放疗和化疗在临床上已使用多年,但因无选择性副作用大且存在着大剂量致死性的潜在风险。近年来尤其在过去的五年,抗体和cart在治疗癌症方面的潜力和应用越来越受到关注。抗体治疗能缓解癌症病情发展,但普遍治疗效果欠佳,现广泛认为抗体治疗更适宜做辅助治疗。cart治疗精准靶向且有可能彻底根除癌症,但cart治疗主要适合血癌,且一个治疗方案只适合一个给定的病人,因此治疗费用对一般癌症患者高不可及,更大的问题是cart治疗一旦脱靶,将置病人于死地。为了安全高效治疗癌症和减少癌症患者的痛苦,用全新的策略开发新药物是势在必行。在多项可能的选择中,遗传工程改造溶瘤病毒治疗癌症显得尤为有吸引力因为溶瘤病毒治疗无耐药性,安全且有效。病毒感染延缓肿瘤增大或让肿瘤消失早在100年前已有临床观察,随后人们甚至用乙肝病人血浆或乙肝病人血浆提取物来治疗霍奇金病。但人们并不认为病毒是治疗癌症的可行性选择因为无法让病毒仅在癌细胞中生长和繁殖。20世纪90年代,分子生物学技术的进步为遗传工程改造病毒使其拥有癌细胞特异的趋向性铺平了道路。早期研究主要发展繁殖缺陷型裂解病毒(病毒感染后,在细胞中繁殖杀死细胞,从杀死的细胞中释放出来并感染临近细胞。比如腺病毒,新城疫病毒和疱疹病毒)和繁殖缺陷型非裂解病毒(比如腺病毒相关病毒及慢病毒)表达免疫分子(gmcsf,il-12,il-17)或免疫反应刺激因子(tnfα,ifnα)通过增强免疫反应来治疗癌症。由于基于病毒的免疫疗法像传统的免疫治疗一样,临床效果普遍欠佳,认为应主要作为辅助治疗。为了增强病毒在癌症治疗上的作用,近年来的研究主要是关注于利用遗传工程改造裂解病毒使其选择性地在癌细胞中繁殖(溶瘤病毒)通过瘤内注射让其在原灶肿瘤细胞中繁殖杀死癌细胞(溶瘤性)并通过裂解的癌细胞碎片次生引发癌症特异的免疫反应杀灭已扩散的癌细胞从而达到治疗癌症的目的。由于溶瘤病毒安全并且一个溶瘤病毒拥有治疗多种癌症的潜力,溶瘤病毒在治疗癌症方面的应用前景值得预期。美国,欧盟及澳大利亚于2015和2016年先后批准临床使用美国amgen公司的基于i型疱疹病毒的溶瘤病毒tvec治疗黑色素瘤开创了溶瘤病毒在治疗癌症方面的新纪元。随后溶瘤病毒研发如火如荼,仅2017年全世界就有多达80个用溶瘤病毒治疗各种癌症的临床测试。多种溶瘤病毒在单一动物模型上都有不错的表现,但在临床上虽然安全但普遍响应率和治愈率远不理想。技术实现要素:本发明的目的包括但不限于提供一种新的重组溶瘤病毒、用于制备该病毒的核酸序列和方法、该重组溶瘤病毒在癌症治疗方面的相关应用以及含有该重组溶瘤病毒的药物等。该重组溶瘤病毒的繁殖或复制受到其基因组序列上所插入的外源元件调控,通过这些外源元件的调控,使得该重组溶瘤病毒可以在不同类型的细胞中选择性繁殖或复制,通过选择性的繁殖或复制进而可选择性地杀死靶细胞(如肿瘤细胞)而对非靶细胞(例如正常细胞)不造成伤害。本发明是这样实现的:目前的溶瘤病毒主要通过消除一个或多个病毒非必须基因或把一个或多个必须基因置于癌症特异性启动子驱动下表达的策略来达到溶瘤病毒在癌细胞选择性的繁殖的目的。病毒在体外繁殖不需要非必须基因,但非必须基因在体内行使多种功能比如拮抗寄主抗病毒机制等以利于病毒繁殖。利用把一个或多个必须基因置于癌症特异性启动子驱动下表达的策略构建的溶瘤病毒虽然病毒基因完整但改变了病毒基因表达在时间上的高度协调性。因此,删除非必须基因或把必须基因置于癌症特异性启动子驱动下表达都会影响病毒在体内繁殖。简而言之,目前的溶瘤病毒在临床上的不佳表现归功于现有的设计策略。为了增加溶瘤病毒的有效性和广谱性,设计溶瘤病毒时保持病毒基因组完整同时不影响病毒基因表达的时间上的高度协调性至关重要。以此为指南,本发明采用了新奇策略发展和制作了全新的溶瘤病毒。第一方面,本发明提供了一种重组溶瘤病毒,所述重组溶瘤病毒的基因组序列上含有如下外源元件:(1)含有第一启动子和第一干扰rna表达序列的第一表达盒;(2)靶标序列;以及(3)第二表达盒;其中,所述第一干扰rna表达序列用于表达结合至所述靶标序列的第一干扰rna;所述第一干扰rna表达序列由所述第一启动子驱动以在第一细胞中表达所述第一干扰rna;所述靶标序列位于所述重组溶瘤病毒复制所必需的必需基因的5’末端非编码区或3’末端非编码区;所述第二表达盒含有第二启动子和抑制成分表达序列;所述抑制成分表达序列用于表达抑制成分,所述抑制成分用于抑制酶的生物合成和/或生物活性,所述酶为参与干扰rna生物合成所需的酶;所述抑制成分表达序列由所述第二启动子驱动以在第二细胞中不在所述第一细胞中表达所述抑制成分;所述第一细胞和所述第二细胞的类型不同。本发明提供的重组溶瘤病毒通过在其基因组上插入外源的第一干扰rna的靶标序列、第一表达盒和第二表达盒等外源元件(参考图1),并利用第一启动子驱动在第一细胞(非靶细胞,如正常细胞)中表达第一干扰rna,利用第二启动子驱动在第二细胞(靶细胞,如肿瘤细胞)中表达抑制成分且在第一细胞中不表达该抑制成分的调控策略,使得在该重组溶瘤病毒感染第一细胞时,表达的第一干扰rna结合至位于病毒必需基因的5’末端或3’末端的非编码区的干扰rna的靶标序列上阻止必需基因的翻译,进而抑制病毒的繁殖或复制,对第一细胞不产生或产生很低的杀伤作用,而当重组溶瘤病毒感染第二细胞时,由于第二动子驱动表达的抑制成分抑制了参与干扰rna合成的酶的生物合成和/或生物活性,第一干扰rna不能实现干扰功能。这样必需基因可以正常转录和翻译,进而该重组溶瘤病毒可以在第二细胞中进行繁殖或复制,对第二细胞造成杀伤效果。与现有的重组溶瘤病毒不同,本发明提供的重组溶瘤病毒既能保持病毒基因组完整又不打乱病毒基因高度有序的表达,同时可以选择性地在第二细胞中以如野生型病毒或接近野生型病毒的能力繁殖或复制对第二细胞造成杀伤而对第一细胞无杀伤作用,对第一细胞安全。因此,该重组溶瘤病毒具有广泛的用途,例如利用本发明的重组溶瘤病毒可以实现以较高的杀伤效率对第二细胞例如肿瘤细胞产生杀伤作用,而对第一细胞例如正常细胞不具有杀伤作用,达到安全高效的目的。进一步地,在本发明的一些实施方案中,所述第一表达盒还具有用于表达第二干扰rna的第二干扰rna表达序列,所述第二干扰rna作用于所述重组溶瘤病毒复制非必需的非必需基因的开放阅读框以干扰所述非必需基因表达,所述第二干扰rna表达序列由所述第一启动子驱动表达。通过利用第二干扰rna,当病毒感染第一细胞时,第二干扰rna同样可结合至病毒的非必需基因的开放阅读框,抑制非必需基因的翻译,干扰其表达,与第一干扰rna的作用类似,以尽可能地抑制在第一细胞中的病毒繁殖或复制,提高对第一细胞的安全性。进一步地,在本发明的一些实施方案中,所述第一干扰rna和所述第二干扰rna各自独立地为小干扰rna(sirna)或microrna(mirna)。进一步地,在本发明的一些实施方案中,所述第二细胞为哺乳动物肿瘤细胞,所述第一细胞为哺乳动物非肿瘤细胞。进一步地,在本发明的一些实施方案中,所述哺乳动物为人。进一步地,在本发明的一些实施方案中,所述肿瘤细胞为肺癌细胞、肝癌细胞、乳腺癌细胞、胃癌细胞、前列腺癌细胞、脑肿瘤细胞、人结肠癌细胞、宫颈癌细胞、肾癌细胞、卵巢癌细胞、头颈部癌细胞、黑色素瘤细胞、胰腺癌细胞或食道癌细胞。需要说明的是,本发明提供的重组溶瘤病毒不限于用于对肿瘤细胞的选择性杀伤,也可以用于其他非肿瘤类型的感兴趣的细胞杀伤。也就是说任何感兴趣的细胞都可以作为上述的第二细胞即靶细胞,不感兴趣的细胞作为第一细胞即非靶细胞。例如可以将神经细胞、红细胞、白细胞、血小板、吞噬细胞、上皮细胞、心肌细胞、卵细胞、精子等中的任意一种细胞作为第二细胞进行杀伤,即哺乳动物来源的任何细胞都可以作为第二细胞,未被选作为第二细胞的细胞中的任意一种、多种或全部作为第一细胞,该重组溶瘤病毒对这些第一细胞不具有杀伤作用。另外,还需要说明的是,本发明的重组溶瘤病毒并不限于溶瘤病毒,其他类型的病毒也可以适用本发明,在本发明所提供的技术方案基础上将其他类型的病毒(无论是何种类型)替换成本发明的溶瘤病毒,以实现选择性杀伤靶细胞的效果,也是属于本发明的保护范围。进一步地,在本发明的一些实施方案中,所述靶标序列选自非哺乳动物的基因的小段序列;优选的,在本发明的一些实施方案中,所述靶标序列选自所述非哺乳动物的基因中的开放阅读框长为19-23个核苷酸的核苷酸序列;优选的,在本发明的一些实施方案中,所述非哺乳动物为酵母、水母、大肠杆菌、昆虫、鱼或植物;优选的,在本发明的一些实施方案中,所述非哺乳动物的基因为源自水母的绿色荧光蛋白基因、源自大肠杆菌的β-半乳糖苷酶基因和源自萤火虫的荧光素酶基因中的任意一种。进一步地,在本发明的一些实施方案中,所述靶标序列的碱基序列如seqidno.1所示,所述第一干扰rna的碱基序列如seqidno.2所示。进一步地,在本发明的一些实施方案中,所述重组溶瘤病毒的一个或多个必需基因的5’末端非编码区或3’末端非编码区插入有所述靶标序列;优选的,所述靶标序列在其所插入的任意一位置上的拷贝数为一个或多个。进一步地,在本发明的一些实施方案中,所述重组溶瘤病毒选自单纯疱疹病毒(herpessimplexvirus,hsv)、腺病毒、牛痘病毒、新城疫病毒、脊髓灰质炎病毒、柯萨奇病毒、麻疹病毒、腮腺炎病毒、牛痘病毒、水泡性口炎病毒(vesicularstomatitisvirus,vsv)和流感病毒中的任意一种。优选的,当所述重组溶瘤病毒为单纯疱疹病毒时,必需基因选自包膜糖蛋白l、尿嘧啶dna糖基化酶、衣壳蛋白、螺旋酶原酶亚基、dna复制起始结合解旋酶、肉豆蔻酸衍生物蛋白、脱氧核糖核酸酶、外被丝氨酸/苏氨酸蛋白激酶、dna包装末端酶亚基1、外被蛋白ul16、dna包装蛋白ul17、衣壳三链亚基2、主要衣壳蛋白、包膜蛋白ul20、核蛋白ul24、dna包装蛋白ul25、衣壳成熟蛋白酶、衣壳蛋白、包膜糖蛋白b、单链dna结合蛋白、dna聚合酶催化亚基、核出口层蛋白、dna包装蛋白ul32、dna包装蛋白ul33、核出口膜蛋白、大衣壳蛋白、衣壳三链亚基1、核糖核苷酸还原酶亚基1、核糖核苷酸还原酶亚基2、被膜宿主关闭蛋白、dna聚合酶加工性亚基、膜蛋白ul45、外被蛋白vp13/14、反式激活蛋白vp16、外被蛋白vp22、包膜糖蛋白n、外被蛋白ul51、解旋酶-引发酶引物酶亚基、包膜糖蛋白k、icp27、核蛋白ul55、核蛋白ul56、转录调节因子icp4、调节蛋白icp22、包膜糖蛋白d和膜蛋白us8a,非必需基因选自icp34.5、icp0、核蛋白ul3、核蛋白ul4、螺旋酶原酶螺旋酶亚基、表皮蛋白ul7、包膜糖蛋白m、外被蛋白ul14、外被蛋白ul21、包膜糖蛋白h、胸苷激酶、dna包装终止酶亚基2、小衣壳蛋白、外壳蛋白ul37、包膜蛋白ul43、包膜糖蛋白c、外被蛋白vp11/12、脱氧尿苷三磷酸酶、icp0、病毒蛋白us2、丝氨酸/苏氨酸蛋白激酶u3、膜g醣蛋白、包膜糖蛋白j、包膜糖蛋白i、包膜糖蛋白e、膜蛋白us9、病毒蛋白us10、表皮蛋白us11和icp47中的一种或多种;优选的,当所述重组溶瘤病毒为腺病毒时,必需基因选自早期蛋白1a、早期蛋白1b19k、早期蛋白1b55k、壳体化蛋白iva2、dna聚合酶、末端蛋白前体ptp、壳体化蛋白52k、衣壳蛋白前体piiia、五邻体基质、核心蛋白pvii、核心蛋白前体px、核心蛋白前体pvi、六邻体、蛋白酶、单链dna结合蛋白、六聚体组装蛋白100k、蛋白33k、壳体化蛋白22k、衣壳蛋白前体、蛋白u、纤维蛋白、调控蛋白e4开放阅读框6/7、调控蛋白e434k、调控蛋白e4开放阅读框4、调控蛋白e4开放阅读框3、调控蛋白e4开放阅读框2和调控蛋白e4开放阅读框1中的一种或多种,非必需基因选自衣壳蛋白ix、蛋白13.6k、核心蛋白v、调控蛋白e312.5k、膜糖蛋白e3cr1-α、膜糖蛋白e3gp19k、膜糖蛋白e3cr1-β、膜糖蛋白e3cr1-δ、膜糖蛋白e3rid-δ和膜糖蛋白e314.7k中的一种或多种;优选的,当所述重组溶瘤病毒为牛痘病毒时,必需基因选自核苷酸还原酶小亚基、丝氨酸/苏氨酸激酶、dna结合病毒核心蛋白、聚合酶大亚基、rna聚合酶亚基、dna聚合酶、巯基氧化酶、假定dna结合病毒核蛋白、dna结合磷蛋白、病毒核心半胱氨酸蛋白酶、rna螺旋酶nph-ii、假定金属蛋白酶、转录延伸因子、谷胱甘肽类蛋白、rna聚合酶、假定病毒核蛋白、晚期转录因子vltf-1、dna结合病毒核蛋白、病毒衣壳蛋白、聚合酶小亚基、依赖于dna的rna聚合酶亚单元rpo22、依赖于dna的rna聚合酶亚单元rpo147、丝氨酸/苏氨酸蛋白磷酸酶、imv肝素结合表面蛋白、dna依赖性rna聚合酶、晚期转录因子vltf-4、dna拓扑异构酶ⅰ型、mrna盖酶大亚基、病毒核心蛋白107、病毒核心蛋白108、尿嘧啶-dna糖基酶、三磷酸酶、早期基因转录因子vetf的70kda小亚基、依赖于dna的rna聚合酶亚单元rpo18、核苷三磷酸水解酶-i、mrna盖酶小亚基、利福平靶点、晚期转录因子vltf-2、晚期转录因子vltf-3、二硫键形成途径、核心蛋白4b前体p4b、核心蛋白39kda、依赖于dna的rna聚合酶亚单元rpo19、早期基因转录因子vetf的82kda大亚基、转录因子vitf-3的32kda小亚基、imv膜蛋白128、核心蛋白4a前体p4a、imv膜蛋白131、磷酸化imv膜蛋白、imv膜蛋白a17l、dna解旋酶、病毒dna聚合酶加工因子、imv膜蛋白a21l、棕榈酰蛋白、中间基因转录因子vitf-3的45kda大亚基、依赖于dna的rna聚合酶亚单元rpo132、依赖于dna的rna聚合酶rpo35、imv蛋白a30l、假定的atp酶、丝氨酸/苏氨酸激酶、eev成熟蛋白、棕榈酰化的eev膜糖蛋白、imv表面蛋白a27l、eev膜磷酸糖蛋白、iev和eev膜糖蛋白、eev膜糖蛋白、二硫键形成途径蛋白、假定的病毒核蛋白、imv膜蛋白i2l、痘病毒肉豆蔻酰基蛋白、imv膜蛋白l1r、晚期16kda假定的膜蛋白、假定的病毒膜蛋白h2r、imv膜蛋白a21l、趋化因子结合蛋白、表皮生长因子样蛋白和il-18结合蛋白中的一种或多种,非必需基因选自分泌补体结合蛋白、kelch样蛋白、类毒力因子、假定的α-氨基蛋白敏感蛋白、丝氨酸蛋白酶抑制剂类蛋白、磷脂酶d类蛋白、无特征蛋白质k7r、cd47类假定膜蛋白、信号素类蛋白、c型凝集素类ⅱ型膜蛋白、分泌性糖蛋白、脱氧尿苷三磷酸酶、kelch样蛋白f3l、假定肉豆蔻酰化蛋白、核糖核苷酸还原酶大亚基、牛痘病毒a型包涵体蛋白、锚蛋白类蛋白、6kda胞内病毒蛋白、肿瘤坏死因子α受体样蛋白215、肿瘤坏死因子α受体样蛋白217、锚蛋白类蛋白b4r、锚蛋白类蛋白213、锚蛋白类蛋白211、锌指状蛋白207、锌指状蛋白208、锚蛋白类蛋白014、锚蛋白类蛋白015、锚蛋白类蛋白016、锚蛋白类蛋白017、锚蛋白类蛋白019、锚蛋白类蛋白030、假定的单甘油酯脂肪酶036、假定的单甘油酯脂肪酶037、假定的单甘油酯脂肪酶038、锚蛋白类蛋白199、锚蛋白类蛋白203/假定蛋白、a型包涵体蛋白、鸟苷酸激酶和锚蛋白类蛋白188中的一种或多种;优选的,当所述重组溶瘤病毒为柯萨奇病毒时,必需基因选自蛋白vpg、核心蛋白2a、蛋白2b、rna解旋酶2c、蛋白3a、蛋白酶3c、逆转录酶3d、外壳蛋白vp4和蛋白vp1中的一种或多种,非必需基因选自衣壳蛋白vp2和vp3中的一种或多种;优选的,当所述重组溶瘤病毒为麻疹病毒时,必需基因选自核蛋白n、磷蛋白p、基质蛋白m、跨膜糖蛋白f、跨膜糖蛋白h和rna依赖性rna聚合酶l中的一种或多种,非必需基因选自rna依赖性rna聚合酶附件蛋白c和rna依赖性rna聚合酶附件蛋白v中的一种或多种;当所述重组溶瘤病毒为腮腺炎病毒时,必需基因选自核蛋白n、磷蛋白p、融合蛋白f、rna聚合酶l中的一种或多种,非必需基因选自磷蛋白v、膜蛋白m和血凝素神经氨酸酶蛋白hn中的一种或多种;优选的,当所述重组溶瘤病毒为水泡性口炎病毒时,必需基因选自糖蛋白g、核蛋白n、磷酸蛋白p和rna聚合酶l中的一种或多种,非必需基因为基质蛋白m;优选的,当所述重组溶瘤病毒为脊髓灰质炎病毒时,必需基因选自衣壳蛋白vp1、衣壳蛋白vp2、衣壳蛋白vp3、半胱氨酸蛋白酶2a、蛋白2b、蛋白2c、蛋白3a、蛋白3b、蛋白酶3c、蛋白3d和rna指导rna聚合酶中的一种或多种,非必需基因为衣壳蛋白vp4;优选的,当所述重组溶瘤病毒为流感病毒时,必需基因选自血凝素、神经氨酸酶、核蛋白、膜蛋白m1、膜蛋白m2、聚合酶pa、聚合酶pb1-f2和聚合酶pb2中的一种或多种,非必需基因选自非结构蛋白ns1和非结构蛋白ns2中的一种或多种。进一步地,在本发明的一些实施方案中,所述重组溶瘤病毒为i型单纯疱疹病毒,所述必需基因为icp27,非必需基因为icp34.5。进一步地,在本发明的一些实施方案中,所述第二干扰rna的序列如seqidno.3所示。进一步地,在本发明的一些实施方案中,所述第一启动子为组成型启动子;优选的,当多个必需基因的5’末端非编码区或3’末端非编码区插入有所述靶标序列时,所述第一表达盒仅表达所述第一干扰rna,所述第一启动子为人类hu6或h1启动子;优选的,当仅有1个必需基因的5’末端非编码区或3’末端非编码区插入有所述靶标序列时,所述第一表达盒表达所述第一干扰rna和所述第二干扰rna,所述第一启动子选自cmv、sv40和cba启动子中的任意一种。进一步地,在本发明的一些实施方案中,所述第二启动子为人类癌症特异性启动子;优选的,人类癌症特异性启动子选自端粒酶逆转录酶启动子(htert)、人表皮生长因子受体-2(her-2)启动子、e2f1启动子、骨钙蛋白启动子(osteocalcin)、癌胚抗原(carcinoembryonicantigen)启动子,survivin启动子和血浆铜蓝蛋白(ceruloplasmin)启动子中的任意一种。进一步地,在本发明的一些实施方案中,所述酶选自drosha、dicer和agonauts中的任意一种。进一步地,在本发明的一些实施方案中,所述抑制成分包括干扰所述酶的基因表达以抑制所述酶的生物合成的第三干扰rna;优选的,所述酶为drosha。进一步地,在本发明的一些实施方案中,所述第三干扰rna的碱基序列如seqidno.4所示。进一步地,在本发明的一些实施方案中,所述抑制成分还包括用于抑制drosha活性的核苷酸三联体重复序列或抑制dicer活性的非编码rna,优选的,所述核苷酸三联体重复序列具有如下通式:(cgg)n,其中,n为等于或大于20的自然数;优选的,n的取值范围为60-150;优选的,n的取值为100;优选的,所述抑制dicer活性的非编码rna为5型腺病毒va1rna;优选的,所述5型腺病毒va1rna的碱基序列如下所示(seqidno.8):agcgggcacucuuccguggucugguggauaaauucgcaaggguaucauggcggacgaccgggguucgagccccguauccggccguccgccgugauccaugcgguuaccgcccgcgugucgaacccaggugugcgacgucagacaacgggggagugcuccuuu。进一步地,在本发明的一些实施方案中,所述第二表达盒还含有用于增强所述抑制成分表达序列表达的增强子序列;优选的,所述增强子序列选自为cmv或sv40增强子序列。进一步地,在本发明的一些实施方案中,上述重组溶瘤病毒的保藏编号为cctccno.v201919。该病毒于2019.4.24日保藏于位于武汉市武昌珞珈山武汉大学的中国典型培养物保藏中心(cctcc)。第二方面,本发明还提供了另一种重组溶瘤病毒,该重组溶瘤病毒的基因组序列上含有如下外源元件:干扰rna的靶标序列和表达盒;所述表达盒含有启动子和干扰rna表达序列,干扰rna表达序列用于表达结合所述靶标序列的所述干扰rna。其中,所述rna靶标序列位于所述重组溶瘤病毒复制所必需的必需基因的5’末端非编码区或3’末端的非编码区;所述干扰rna表达序列由所述第一细胞特异性启动子驱动以在第一细胞中表达且在第二细胞中不表达所述rna;所述第一细胞与所述第二细胞的类型不同。基于第一方面的重组溶瘤病毒杀伤细胞的原理,本发明还提供了另外一种重组溶瘤病毒,该重组溶瘤病毒相较于第一方面的重组溶瘤病毒而言,其不具有第二表达盒,其干扰rna表达序列由第一细胞特异性启动子驱动表达,该第一细胞特异性启动子驱动干扰rna在第一细胞中表达但不在第二细胞中表达。通过该第一细胞特异性启动子的调控,可以实现当该重组溶瘤病毒感染第一细胞时,干扰rna表达并结合至干扰rna靶标序列,以阻止或抑制必需基因的翻译,病毒的繁殖或复制受到阻止或抑制,对第一细胞不产生杀伤作用,对第一细胞安全;当该重组溶瘤病毒感染第二细胞时,第一细胞特异性启动子不驱动表达,干扰rna的表达受到抑制,必需基因可以正常转录和翻译,实现繁殖或复制,对第二细胞造成杀伤。第二方面的重组溶瘤病毒与第一方面的重组溶瘤病毒可以实现类似的可选择性繁殖或复制的效果即选择性的杀伤细胞,即对第二细胞例如肿瘤细胞造成预期的杀伤效果而对第一细胞例如正常细胞不具有杀伤效果。进一步地,在本发明的一些实施方案中,所述第一细胞为哺乳动物的非肿瘤细胞,所述第二细胞为肿瘤细胞。第三方面,本发明提供了一种用于制备如上所述的重组溶瘤病毒的核酸序列,所述核酸序列具有如下元件中的一种或几种:所述靶标序列、所述第一表达盒以及所述第二表达盒。第四方面,本发明提供了一种用于制备如上所述的重组溶瘤病毒的组合物,其包括如上所述的核酸序列,以及亲本病毒和/或互补寄主细胞;其中,所述亲本病毒的基因组序列相对野生型病毒的基因组序列缺失所述必需基因;所述互补寄主细胞含有表达所述必需基因的dna片段。第五方面,本发明提供了制备如上所述的重组溶瘤病毒的方法,其包括:将如上所述的核酸序列整合至野生型溶瘤病毒的基因组中。进一步地,在本发明的一些实施方案中,该制备方法包括:将所述核酸序列与亲本病毒和互补寄主细胞共培养,从培养物中收集得到所述重组溶瘤病毒;其中,所述亲本病毒的基因组序列相对野生型溶瘤病毒的基因组序列缺失所述必需基因;所述互补寄主细胞含有表达所述必需基因的dna片段。进一步地,在本发明的一些实施方案中,所述方法的具体操作步骤包括:制备表达icp27的vero细胞株、制备亲本病毒、构建遗传工程改造的icp27及调控成分表达质粒、构建重组溶瘤疱疹病毒。第六方面,本发明提供了如上所述的重组溶瘤病毒在制备选择杀伤细胞的药物中的应用。进一步地,在本发明的一些实施方案中,所述细胞为肿瘤细胞。第七方面,本发明提供了一种杀死细胞的方法,其包括:将如上所述的重组溶瘤病毒与靶细胞接触。进一步地,在本发明的一些实施方案中,所述靶细胞为肿瘤细胞。进一步地,在本发明的一些实施方案中,所述方法是以非疾病的治疗为目的。第八方面,本发明提供了一种杀死细胞的药物,其含有上所述的重组溶瘤病毒以及药学上可接受的辅料。进一步地,在本发明的一些实施方案中,所述细胞为肿瘤细胞。第九方面,本发明提供了检测如上所述的重组溶瘤病毒的方法,所述方法的具体操作步骤包括:重组溶瘤病毒的滴度测定、重组溶瘤病毒的放大、重组溶瘤病毒的纯化、mrna表达分析、蛋白质表达分析以及mirna表达分析。附图说明为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。图1:为本发明提供的重组溶瘤病毒的基因组序列上的所插入的外源元件的结构以及调控关系示意图;图中:(a):外源元件在基因组序列上的结构模式图,靶标序列的数量可以是1个或多个;(b):靶标序列插入在必需基因上3’末端非编码区(3’utr)的结构示意图;(c):第一表达盒不具有(c1)和具有(c2)第二干扰rna表达序列时的结构示意图,第一干扰rna表达序列表达出第一干扰rna,第一干扰rna结合至靶标序列,抑制必需基因的表达;第二干扰rna表达序列表达出第二干扰rna,第二干扰rna结合至非必需基因,抑制非必需基因的表达;(d):第二表达盒的结构示意图,抑制成分表达序列表达出抑制成分以抑制参与干扰rna合成的酶的生物合成和/或生物活性。图2:为用于构建表达hsv-1icp27互补细胞所需质粒的亲本质粒pcdna3.1-egfp的结构示意图,含有cmv驱动下表达egfp表达序列及组成型表达新霉素的dna序列。图3:本发明实施例中的重组溶瘤病毒ohsv-bjr的基因组序列上所插入的外源元件的结构示意图。图4:在正常细胞中egfp和icp34.5mirna从重组溶瘤病毒ohsv-bjr表达,靶标基因icp27和icp34.5蛋白质生物合成受到抑制。vero细胞用0.25moi(病毒数/细胞)hsv-1野生型病毒kos或溶瘤病毒ohsv-bjr感染,一天后,收集部分细胞,分离小rna,北点印记(northernblot)检测mirna(a)。感染二天后,收集余下细胞,分离蛋白质,西点印记(westernblot)检测hsv-1必需基因icp27和非必需基因icp34.5蛋白质(b)。图5:癌细胞具有功能性小干扰rna生物合成途径,重组溶瘤病毒ohsv-bjr感染的癌细胞drosha微量表达,小干扰rna生物合成途径受到显著抑制或完全关闭,靶标基因icp27和icp34.5从ohsv-bjr像从野生型病毒kos一样正常表达。为检测癌细胞是否有功能性小干扰rna生物合成途径,子宫颈瘤hela细胞,子宫颈鳞癌siha细胞,乳腺癌sk-br3细胞和乳腺癌me-180细胞分别用icp27表达质粒或icp27+靶向序列和mirna同时表达的质粒转导,二天后,收集细胞,分离蛋白质,西点印记检测hsv-1必需基因icp27蛋白质(a)。为检测在癌细胞中抑制性三联体和drosahsirna从溶瘤病毒ohsv-bjr表达是否影响drosha的表达和是否阻遏或关闭小干扰rna生物合成途径,及icp27及icp34.5是否能从溶瘤病毒正常表达,癌细胞hela,siha,sk-br3和me-180分别用kos或溶瘤病毒ohsv-bjr(0.5moi)感染,一天后,收集细胞,提取小rna和蛋白质。北点印记检测三联体和droshasirna(b),及egfp和icp34.5mirna(d),西点印记检测drosha(c),icp27和icp34.5蛋白质(e)。图6:溶瘤病毒ohsv-bjr和野生型病毒kos在癌细胞中的繁殖动力学基本一致。用0.1moi的kos或ohsv-bjr感染各种癌细胞,不同天后,收取细胞和培养基,通过三个冻融循环让存留于细胞中的病毒释放到培养基中。用病毒感染互补细胞,通过空斑法测定病毒滴度(空斑形成单位/毫升,pfu/ml)。a:子宫颈瘤hela细胞;b:子宫颈鳞癌siha细胞;c:乳腺癌sk-br3细胞;d:乳腺癌me-180细胞。图7:重组溶瘤病毒ohsv-bjr在动物上显著抑制肺癌,胃癌,肝癌及直肠癌增生。人源肺癌,胃癌,肝癌小鼠癌症模型分别用体外培养的人非小细胞肺癌a549细胞,胃癌nci-n87细胞,肝癌sk-hep-1细胞皮下接种balb/c(肺癌及胃癌)或npg小鼠(肝癌),当肿瘤增生到一定大小时,取出肿瘤,切成小块,在植入相应小鼠,让肿瘤长到40-120mm3,开始瘤内注射病毒。直肠癌模型直接向balb/c小鼠皮下接种直肠腺癌细胞株hct-8而构建,当肿瘤长到40-120mm3,开始瘤内注射溶瘤病毒。溶瘤病毒瘤内每3天注射一次共3次,每次2×107感染单位(悬浮于40μlpbs)多点注射。以注射pbs(不含溶瘤病毒)为阴性对照。溶瘤病毒注射后,每周测试肿瘤大小2次,共测试25-32天(根据阴性对照动物需安乐处死的时间而定)。根据肿瘤大小制作肿瘤生长曲线(a:肺癌;b:肝癌;c:胃癌;d:直肠癌),并根试验结束时测试组肿瘤大小与阴性对照比较分析计算相对抑制率(e)。具体实施方式为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。以下结合实施例对本发明的特征和性能作进一步的详细描述。实施例1制备重组溶瘤病毒以i型疱疹病毒(hsv-1)kos为实验材料进行改造构建本实施例所提供的重组溶瘤病毒,该重组溶瘤病毒的基因组序列具有如下结构特点:(1)以其必需基因icp27和非必需icp34.5基因为mirna的靶标基因,在hsv基因组的必需基因icp27基因3’末端非编码区(3’utr)插入绿色萤光蛋白mirna(egfpmirna,即第一干扰rna)的靶标序列(该靶标序列根据egfp基因序列设计,其序列与egfp基因的orf相应区段序列一致,后文命名为egfpmirna靶标序列)、第一表达盒和第二表达盒;(2)第一表达盒包括:cmv启动子、cmv启动子驱动下表达egfpmirna的egfpmirna表达序列(即第一干扰rna表达序列)、表达针对hsv非必需基因icp34.5的特异性mirna(即第二干扰rna,后文命名为icp34.5mirna)的icp34.5mirna表达序列(即第二干扰rna表达序列)以及位于icp34.5mirna表达序列后的poly(a)序列;(3)第二表达盒包括:癌细胞特异启动子htert和cmv增强子相连所形成的复合启动子及抑制成分表达序列。该抑制成分表达序列在复合启动子驱动下可表达出抑制成分,该抑制成分包括用于抑制或阻断drosha酶合成的droshasirna(即第三干扰rna)和用于抑制drosha酶的活性的cgg三联体(即核苷酸三联体重复序列),该cgg三联体具有如下通式:(cgg)100;抑制成分表达序列包括droshasirna表达序列和cgg三联体表达序列,以及位于抑制成分表达序列下游的poly(a)序列。该重组溶瘤病毒ohsv-bjr的制备方法如下:以egfp基因替代icp27的kos为亲本病毒来制作重组溶瘤病毒,以非洲绿猴肾细胞(vero细胞)为寄主建立表达icp27的互补细胞以支持重组溶瘤病毒制作繁殖和放大。重组溶瘤病毒ohsv-bjr在互补细胞通过亲本病毒与质粒dna同源重组构建。具体操作步骤如下:(1)制备表达icp27的vero细胞株以野生型疱疹病毒dna为模板,用pcr扩增icp27基因的编码区,扩增片段插入表达抗新霉素基因的质粒pcdna3.1-egfp(见图2)的hindiii和xba位点替代egfp。加工后的质粒命名为pcdna3.1-icp27,icp27基因在cmv启动子驱动下表达。用不同浓度的g418处理vero细胞,每3天换取含有g418培养基,6天后,观察细胞死亡情况,以确定细胞死亡所需的最低g418浓度,并以此作为建立细胞株g418的施用浓度。向6孔细胞培养板每孔植入3.5×105vero细胞,在无抗生素培养液中隔夜培养,用脂质体(lipofectamine2000)转导pcdna3.1-icp27表达质粒(用量:4μg/孔)。24小时后,按1:5,1:10及1:20比例稀释转板并培养于含g418的培养液中,每三天换一次液。经6-7次换液,收集克隆,并从24孔板逐级放大。然后,分离蛋白质,用蛋白印迹法(westernblot)检测icp27的表达。选择高表达icp27的克隆起源的细胞,作为互补细胞(命名为vero-c1cp27,简称c1cp27)。该互补细胞于2019.4.24日保藏于位于武汉市武昌珞珈山武汉大学的中国典型培养物保藏中心(cctcc),保藏编号为cctccno.c201974。(2)制备亲本病毒亲本病毒hsv-egfp是以egfp基因替代icp27基因的过渡的i型疱疹病毒,通过质粒和野生型疱疹病毒kos同源重组而获得以方便溶瘤病毒筛选。人工合成包括icp27基因5’末端序列,cmv启动子,egfp编码框,牛生长激素poly(a)(bghpoly(a))以及icp27基因3’末端序列的dna片段a,dna片段a的碱基序列如seqidno.5所示,其中,第1-6位:无关序列,增加末端长度利于酶切;第7-12位:xho1位点,c/tcgag;第13-575位:icp275’末端序列;第576-1163位:cmv启动子序列;第1164-1174位:间隔序列;第1175-1180位:kozak序列,增加蛋白表达;第1181-1900位:egfp编码框;第1901-2144位:bghpoly(a);第2145-2667位:icp273’末端序列;第2668-2773位:hindiii位点,a/agctt;第2774-2779位:无关序列,增加末端长度利于酶切。酶切dna片段a,将其连接到质粒pcdna3.1-egfp(见图2)的hindiii和xho1位点,改造后的质粒命名为egfp表达质粒。将每孔3.5×105互补细胞cicp27植于6孔细胞培育板,在无抗生素培养液中经隔夜培养,分别用0.1、0.5、1、3moi(病毒/细胞)野生型病毒kos感染细胞,1小时后,借助lipofectamine2000向细胞转导上述步骤得到的egfp表达质粒(4μgdna/孔)。4小时后,用完全培养基替换转导溶液。待所有细胞感染后,收集细胞及培养液,经过三次冻融,离心收集上清液。稀释上清液,感染互补细胞cicp27,用空斑分离法分离病毒。感染4-5天后,在荧光显微镜下选取绿色病毒斑。然后对得到的病毒斑进行2或3轮筛选直到得到纯的病毒斑。将其繁殖扩大,即得到亲本病毒hsv-egfp。该亲本病毒与野生型疱疹病毒相比较,亲本病毒的icp27基因被egfp基因替代。(3)构建遗传工程改造的icp27及调控成分表达质粒遗传工程改造ta克隆质粒,让多克隆位点仅包括xhoi位点(质粒ta-xhoi)。人工合成包括icp275’末端序列(含天然icp27启动子),icp27开放阅读框,二拷贝的egfpmirna靶标序列(单拷贝的egfpmirna靶标序列如seqidno.1所示,碱基序列见表1)、sv40poly(a)序列及icp273’末端序列的dna片段b(5’和3’末端各含有一个xhoi位点,sv40poly(a)与icp273’末端序列间包含一个hindiii位点);dna片段b的碱基序列如seqidno.6所示,其中,第1-6位:无关序列,增加末端长度利于酶切第7-12位:xho1位点,c/tcgag;第13-683位:icp275’末端序列(含icp27启动子);第684-2222位:icp27阅读框;第2223-2227位:间隔序列;第2228-2249,2253-2274位:egfpmirna靶标序列(seqidno.1);第2250-2252位:间隔序列;第2275-2800位:sv40poly(a);第2801-2806位:hindiii位点,a/agctt;第2807-3326位:icp273’末端序列;第3327-3332位:xho1位点;第3333-3338:无关序列,增加末端长度利于酶切。dna片段b经xhoi酶解,插入质粒ta-xhoi的xhoi位点,以此而产生质粒ta-xhoi-micp27。人工合成包括有cmv启动子,egfpmirna表达序列、icp34.5mirna表达序列,bghpoly(a)、htert-cmv复合启动子,droshasirna表达序列及cgg三联体表达序列和sv40poly(a)序列的dna片段c(逆向互补),5’和3’末端各含有一个hindiii位点。dna片段c的碱基序列如seqidno.7所示,其中,第1-8位:无关序列,增加末端长度利于酶切;第9-14位:hindiii位点a/agctt;第15-629位:cmv启动子;第630-706位:egfpmirna表达序列(所表达的egfpmirna的碱基序列如seqidno.2所示,碱基序列见表1);第707-762位:无关序列,充当间隔;第763-830位:icp34.5mirna表达序列(所表达的icp34.5mirna的碱基序列如seqidno.3所示,碱基序列见表1);第831-989位:无关序列,充当间隔;第990-1213位:bghpoly(a);第15-1213位序列构成第一表达盒;第1214-1660位:逆向互补sv40poly(a);第1661-1667位:无关序列,充当间隔;第1668-1967位:逆向互补cgg三联体重复序列(即cgg三联体表达序列,所表达cgg三联体的通式为:(cgg)100);第1968-1976位:无关序列,充当间隔;第1977-2026位:逆向互补droshasirna表达序列(所表达的droshasirna的碱基序列如seqidno.4所示,碱基序列见表1);第2027-2044位:无关序列,充当间隔;第2045-2152位:逆向互补cmv增强子;第2153-2608位:逆向互补htert启动子;第1214-2608位构成第二表达盒;第2609-2614位:hindiii位点,a/agctt;第2615-2622位:无关序列,增加末端长度利于酶切。dna片段c经hiniii酶切,插入上述质粒ta-xhoi-micp27的hindiii位点,从而产生重组质粒ta-xhoi-micp27-reg-rna,用于制备重组溶瘤病毒。表1(4)构建重组溶瘤疱疹病毒ohsv-bjr重组溶瘤疱疹病毒在互补细胞cicp27中经质粒ta-xhoi-micp27-reg-rna和亲本病毒hsv-egfp同源重组而获得。操作方法如下:3.5×105互补细胞cicp27植于6孔细胞培育板,在无抗生素培养液中经隔夜培养,用不同moi(0.1,0.5,1,3)的亲本病毒hsv-egfp感染细胞,1小时后,借助lipofectamine2000向细胞转导重组质粒ta-xhoi-micp27-reg-rna(4μgdna/孔),4小时后,用完全培养基替换转导溶液。待所有细胞感染后,收集细胞及培养液,经过三次冻融,离心收集上清液。稀释上清液,感染互补细胞cicp27,用空斑分离法分离病毒。4-5天后,在荧光显微镜下,选取黑色病毒斑。然后对得到的病毒斑进行2或3轮筛选至到得到纯的病毒斑。繁殖扩大病毒,分离感染细胞dna,用特异性引物,pcr扩增检测片段并测序确证,得到重组溶瘤病毒,命名为ohsv-bjr。该重组溶瘤病毒ohsv-bjr于2019.4.24日保藏于位于武汉市武昌珞珈山武汉大学的中国典型培养物保藏中心(cctcc),保藏编号为cctccno.v201919。得到的重组溶瘤病毒ohsv-bjr的基因组序列上插入有如下元件(各元件插入位置关系可参考图3):插入在必需基因icp27的3’末端非编码区的egfpmirna靶标序列和sv40poly(a)序列;位于sv40poly(a)序列下游的包括有cmv启动子、egfpmirna表达序列、icp34.5mirna表达序列、bghpoly(a)的第一表达盒;以及位于第一表达盒下游的包括有htert-cmv复合启动子,droshasirna表达序列、cgg三联体表达序列和sv40poly(a)序列的第二表达盒(逆向互补序列)。实施例2溶瘤病毒滴度分析、繁殖放大及纯化、mirna,mrna和蛋白质表达分析及癌细胞培养(1)重组溶瘤病毒ohsv-bjr的滴度测定3.5×105互补细胞cicp27植于6孔细胞培育板,在培养液中隔夜培养。实施例1得到的重组溶瘤病毒ohsv-bjr的病毒液10倍系列稀释,用0.1ml不同稀释倍数的病毒感染细胞。1小时后,吸出培养液,向每孔细胞加入3ml含有1.25%甲基纤维的培养基。细胞在co2培养箱中培养5天,用配制于50%甲醇50%乙醇0.1%紫晶蓝染色,数病毒斑。计算病毒滴度(pfu/ml)。(2)重组溶瘤病毒ohsv-bjr的放大5.5×106互补细胞cicp27植于150ml培养瓶,隔夜培养。用0.03moi(病毒数/细胞)的实施例1得到的重组溶瘤病毒ohsv-bjr感染细胞,在co2培养箱中培养直到所有细胞被感染。收集细胞,即得到重组溶瘤病毒ohsv-bjr初提液。(3)重组溶瘤病毒ohsv-bjr的纯化重组溶瘤病毒ohsv-bjr初提液经-80℃/37℃三次冻融,在4℃下3500rpm离心,收集上清液。用0.6μm正切流(中空纤维)过滤,用0.1μm正切流超过滤浓缩,浓缩液经heparan亲和层析纯化及0.1μm正切流浓缩即得到纯化的重组溶瘤病毒ohsv-bjr。(4)mrna表达分析收集细胞,用qiagenrna纯化试剂合分离rna。用thermofisher逆转录试剂合成cdna。然后用icp27或icp34.5特异性引物结合半定量pcr(20个循环pcr)分析icp27或icp34.5mrna表达。以β-actin作为上样控制。(5)蛋白质表达分析收集细胞,1倍pbs洗涤,离心,用ripa缓冲液提取蛋白质。以bsa为标样,用bca法测定蛋白质含量。在4%-20%梯度sds-page分离蛋白质,电转移到pvdf膜上。用含有5%奶粉pbst(pbs中含0.05%tween20)固定,膜在室温下在含有2.5%奶粉及一抗的pbst溶液中保温2小时。pbst洗膜三次,膜在室温下在二抗pbst溶液中保温1小时。pbst洗膜三次,然后用piece公司的化学荧光底物染色,并用伯乐公司的化学荧光试剂成像仪检测蛋白质谱带。β-actin作为上样控制。(6)mirna表达分析用thermofisherpuremirna分离试剂盒分离mirna,用roche公司的的digrna标记试剂盒标记rna探针,用北点印记(northernblotting)分析mirna。(7)癌细胞培养子宫癌细胞hela,子宫颈麟癌细胞siha,乳腺癌细胞sk-br3及乳腺癌细胞me-180均购自美国atcc。hela,siha及me-180培养于含10%牛血1×青霉素/链霉素的dmem培养液中,sk-br3培养于含10%牛血1×青霉素/链霉素的mccoy培养液中。每三天转瓶繁殖扩大。实施例3引入的mirna在正常细胞中表达并显著影响靶标病毒基因的表达为了检测引入的mirna是否如预期地在正常细胞中从重组病毒ohsv-bjr表达并阻褐靶标病毒基因的生物合成,用3moi的重组溶瘤病毒ohsv-bjr和野生型病毒kos分别感染vero细胞,一天后收集细胞,分离小rna和提取蛋白质。用北点印记分别检测egfp和icp34.5mirna,用西点印记(westernblot)检测hsv-1icp27及icp34.5蛋白质。对野生型病毒kos感染的细胞而言,无egfp相关的初级(pri-mirna),前体(pre-mirna)及成熟mirna产生;对野生型病毒kos感染的细胞而言,icp34.5特异性的pri-mirna,pre-mirna及成熟mirna都达可检测水平,但pre-mirna及成熟mirna的量大大高于pri-mirna(寄主细胞编码icp34.5特异性的mirna抑制hsv-1繁殖已有文献报道)。ohsv-bjr感染的细胞,egfp和icp34.5相关的pri-mirna,pre-mirna及成熟mirna都表达到可检测水平,pre-mirna及成熟mirna的量都显著多于pri-mirna,且icp34.5pre-mirna及成熟mirna量明显高于kos感染的细胞(图4a)。相应地在野生型病毒kos感染的细胞icp27和icp34.5蛋白表达到易检测水平,而在ohsv-bjr感染的细胞中icp27和icp34.5的表达量低于检测极限(图4b)。结果表明引入的mirna即egfpmirna和icp34.5mirna在正常细胞中从重组病毒ohsv-bjr健康地表达并抑制靶标病毒基因表达。实施例4癌细胞具有功能性小干扰rna生物合成途径,重组溶瘤病毒ohsv-bjr感染的癌细胞drosha微量表达,小干扰rna生物合成途径受到显著抑制或完全关闭,靶标基因icp27和icp34.5从重组溶瘤病毒ohsv-bjr像从野生型病毒kos一样正常表达。为检测癌细胞是否有功能性小干扰rna生物合成途径,癌细胞hela,siha,sk-br3和me-180分别用icp27表达质粒或icp27+靶向序列和mirna同时表达的质粒转导,二天后,收集细胞,分离蛋白质,西点印记检测hsv-1必需基因icp27蛋白质。为检测在癌细胞中抑制性三联体和droshasirna从重组溶瘤病毒ohsv-bjr表达是否影响drosha的表达和是否阻遏或关闭小干扰rna生物合成途径,及icp27及icp34.5是否能从溶瘤病毒正常表达,癌细胞hela,siha,sk-br3和me-180分别用kos或溶瘤病毒ohsv-bjr(0.5moi)感染,一天后,收集细胞,提取小rna和蛋白质。北点印记检测三联体和droshasirna,及egfp和icp34.5mirna,西点印记检测drosha,icp27和icp34.5蛋白质。在四种癌细胞中egfpmirna表达抑制带有靶标序列的icp27表达(图5a)。cgg三联体重复及pri-droshasirna杂合rna表达到易检测水平(图5b),但pre-droshasirna和成熟droshasirna低于可检测水平(结果无展示)。在四种癌细胞中,野生型病毒kos感染的细胞,drosha蛋白达可检测水准,但在ohsv-bjr感染的四种癌细胞中,drosha蛋白量都甚微(图5c)。pri-egfp和icp34.5mirna达已检测范围,但pre-egfp及成熟egfp和icp34.5mirna或量甚微或检测不到(图5d)。与在ohsv-bjr感染的细胞中极低水平的成熟egfp和icp34.5mirna相对应的是,在ohsv-bjr感染的四种癌细胞中,icp27和icp34.5蛋白表达量基本与kos感染的细胞基本一致(图5e)。结果表明被重组溶瘤病毒ohsv-bjr感染的癌细胞干扰rna合成途径受到抑制或关闭,靶标病毒基因可从ohsv-bjr像从野生型病毒kos一样正常表达。实施例5重组病毒ohsv-bjr在癌症细胞中基本保持野生型病毒kos的繁殖动力为了分析重组病毒ohsv-bjr的杀灭癌细胞的能力,分析了重组溶瘤病毒ohsv-bjr在不同癌细胞中的繁殖能力,用0.1moi的kos或ohsv-bjr分别感染子宫颈瘤hela细胞,子宫颈鳞癌siha细胞,乳腺癌sk-br3细胞和乳腺癌me-180细胞。不同天后,收取细胞和培养基,通过三个冻融循环让存留于细胞中的病毒释放到培养基中。用病毒感染互补细胞,通过空斑法测定病毒滴度(空斑形成单位/毫升,pfu/ml)。虽然重组病毒ohsv-bjr在hela(图6a),siha(图6b),sk-br3(图6c)和me-180(图6d)中繁殖速度有所不同,但在每种细胞中的繁殖动力学基本和kos一致。实施例6重组溶瘤病毒ohsv-bjr像野生型病毒kos一样杀灭癌症细胞为了分析重组溶瘤病毒ohsv-bjr杀灭癌细胞的能力,用0.25或0.5moi的野生型kos或ohsv-bjr分别感染子宫颈瘤hela细胞,子宫颈鳞癌siha细胞,乳腺癌sk-br3细胞和乳腺癌me-180细胞,不同天后分析细胞死亡率,结果见表2-表5。表2-表5反应了不同癌细胞受两种病毒感染下的死亡率。虽然重组溶瘤病毒ohsv-bjr杀灭hela(表2),siha(表3),sk-br3(表4)和me-180(表5)的能力有些差异,但对每种癌细胞的杀伤效率基本和kos一致。表2ohsv-bjr感染杀灭癌细胞hela细胞的效率基本与野生型病毒一致(表中数据为细胞死亡率,单位为%)表3ohsv-bjr感染对癌细胞siha细胞的杀灭效率与野生型病毒基本一致(表中数据为细胞死亡率,单位为%)表4ohsv-bjr与野生型病毒基本无差地杀死癌细胞sk-br3细胞(表中数据为细胞死亡率,单位为%)表5ohsv-bjr像野生型病毒一样高效杀灭癌细胞me-180(表中数据为细胞死亡率,单位为%)实施例7重组溶瘤病毒ohsv-bjr基本不影响正常细胞活性为了了解重组溶瘤病ohsv-bjr的安全性,将重组溶瘤病毒ohsv-bjr(2moi)及野生病毒kos(0.5moi)感染vero细胞或原代人角膜上表皮细胞。ohsv-bjr感染及无处理的细胞三天后测活性,野生病毒kos感染的细胞二天后测活性。各组细胞存活率检测结果见表6。kos感染二天后,vero细胞和原代人角膜上表皮细胞全部死亡(表6)。ohsv-bjr感染三天,vero细胞和原代人角膜上表皮细胞基本无死亡(表6),存活率达95%,与无处理组的细胞存活率基本一致。这表明实施例1得到的重组溶瘤病毒ohsv-bjr对正常细胞非癌细胞具有相对可靠的安全性。表6野生型病毒杀灭正常细胞但ohsv-bjr对正常细胞活性影响很低(表中数据为细胞存活率,单位为%)病毒ohsv-bjrkos无处理vero细胞92±3095±5角膜上表皮细胞95±3097±3实施例8实施例1的重组溶瘤病毒ohsv-bjr在动物上显著抑制肺癌,胃癌,肝癌及直肠癌增生为了测试溶瘤病毒ohsv-bjr治疗癌症的有效性和广谱性,人源肺癌,胃癌,肝癌小鼠癌症模型分别用体外培养的人非小细胞肺癌a549细胞,胃癌nci-n87细胞,肝癌sk-hep-1细胞皮下接种balb/c(肺癌及胃癌)或npg小鼠(肝癌),当肿瘤增生到800-1000mm3时,取出肿瘤,切成30mm3小块,再植入相应小鼠,让肿瘤长到40-120mm3,开始瘤内注射实施例1得到的重组溶瘤病毒ohsv-bjr。直肠癌模型直接向balb/c小鼠皮下接种直肠腺癌细胞株hct-8而构建,当肿瘤长到40-120mm3,开始瘤内注射实施例1得到的重组溶瘤病毒ohsv-bjr。重组溶瘤病毒ohsv-bjr瘤内每3天注射一次共3次,每次2×107感染单位(悬浮于40μlpbs)多点注射。每种模型注射动物8只,以注射40μlpbs为阴性对照。重组溶瘤病毒注射后,每周测试肿瘤大小2次,共测试25-32天(根据阴性对照动物需安乐处死的时间而定)。根据肿瘤大小制作肿瘤生长曲线,结果见图7(图7中:a:肺癌;b:肝癌;c:胃癌;d:直肠癌)。并根试验结束时测试组肿瘤大小与阴性对照比较分析计算相对抑制率,结果见图7e。图7的结果显示,注射重组溶瘤病毒ohsv-bjr后随着时间的推移,其肿瘤大小明显小于阴性对照组,说明重组溶瘤病毒ohsv-bjr能够抑制肿瘤的增长速率,且该重组溶瘤病毒ohsv-bjr对肺癌、肝癌、胃癌以及直肠癌等肿瘤都具有抑制增殖的作用,具有一定的广谱抗癌性能。综上,针对现有的多种溶瘤病毒的缺陷,发明人发现原因主要在于与目前溶瘤病毒构建的设计策略有关:目前的设计策略是以牺牲病毒繁殖能力(溶瘤能力)来换取溶瘤病毒在癌细胞中繁殖的选择性,从而损伤了溶瘤病毒在体外尤其在体内的繁殖。目前溶瘤病毒设计大致采用三个策略:1)删除一个或多个拮抗正常细胞抗病毒机制的非必需基因。因癌细胞不同于正常细胞,癌细胞抗病毒机制相对受损或相对较弱,因此溶瘤病毒选择性地在癌细胞中繁殖生长。病毒编码的任何基因包括非必需基因都直接或间接影响病毒复制,体外试验证明利用该策略制作的溶瘤病毒体外繁殖速度较野生型低数倍或一个数量级以上,体内繁殖低1-3数量级。2)用癌细胞特异性启动子驱动一个或二个病毒必需基因。这种策略发展的溶瘤病毒保持了病毒基因组的完整性,但破坏了病毒基因表达的时间上的高度协调性因为病毒感染细胞后,病毒基因分批次时间上高度协调的表达(早期基因表达后,必需关闭,中晚期基因表达才得以启动)。体外体内试验证明用这种策略制作的溶瘤病毒繁殖能力一定程度上还不如第一种策略发展的溶瘤病毒。3)向病毒必需基因3’末端非编码区插入组织特异性mirna靶向序列。由于特异性mirna在正常组织中表达,但相应的mirna在该组织癌症细胞中不表达或低水平表达,因此,溶瘤病毒仅能在癌细胞中繁殖并杀死癌细胞。但是对任何给定种类的癌症病人群体,由于个病人成癌机理各有不同,起源于不同病人的癌细胞抗病毒能力或组织特异mirna表达水平差异很大,因此利用上述三种策略发展的溶瘤病毒对任何给定种类的癌症响应率和治愈率都较低或有可能无效。为了增强溶瘤病毒治疗癌症的有效性和发展治疗各种癌症广谱性溶瘤病毒,本发明采用了于完全不同于现有策略的思路设计发展溶瘤病毒治疗癌症:保持病毒基因完整并让病毒基因在其内源启动子驱动下表达但向一个或二个病毒必需基因3’非编码区插入非哺乳动物mirna靶向序列;通过向病毒基因组插入一段在强组成型启动子驱动下表达非哺乳动物mirna(同时攻击二个病毒必需基因)或同时表达非哺乳动物mirna(攻击一个病毒必需基因)和一个靶向一个病毒非必需基因orf的mirna的dna序列,从而使病毒不能在正常细胞中繁殖,并双重保险保证安全性;同时通过向病毒基因组插入一段在杂合启动子:广谱性癌细胞特异启动子(众多癌细胞中都有表达活性)+强启动子的增强子(增强启动子活性,确保在癌细胞特异启动子活性的的癌细胞中表达产物高表达)驱动下表达靶向抑制干扰rna(sirna,mirna)生物合成酶类的sirna和抑制干扰rna(sirna,mirna)生物合成酶类活性的核苷酸三联体重复的dna序列,使癌细胞中抑制干扰rna生物合成途径快速并持续地受到抑制或完全关闭,解除mirna对病毒基因的攻击,从而病毒向野生型病毒或接近野生型病毒在癌细胞中快速繁殖并杀灭癌细胞。体外试验表明利用我们的策略构建的基于i型疱疹病毒的溶瘤病毒对正常细胞安全但像野生型病毒一样高效繁殖并杀灭各种癌细胞。动物试验表明该溶瘤病毒能显著抑制肺癌肝癌胃癌及直肠癌增生。以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。sequencelisting<110>伍泽堂<120>重组溶瘤病毒以及制备方法、应用和药物<130>250<160>8<170>patentinversion3.5<210>1<211>22<212>dna<213>人工序列<400>1caagctgaccctgaagttcata22<210>2<211>21<212>rna<213>人工序列<400>2augaacuucagggucagcuug21<210>3<211>22<212>rna<213>人工序列<400>3cuugccugucuaacucgcuagu22<210>4<211>25<212>rna<213>人工序列<400>4cuugcugaauacuugguccuuggug25<210>5<211>2679<212>dna<213>人工序列<400>5aaataactcgagctgcgggcgctgttgttccatcatcctgtcgggcatcgcaatgcgatt60gtgttatatcgccgtggtggccggggtggtgctcgtggcgcttcactacgagcaggagat120ccagaggcgcctgtttgatgtatgacgtcacatccaggccggcggaaaccggaacggcat180atgcaaactggaaactgtcctgtcttggggcccacccacccgacgcgtcatatgtaaatg240aaaatcgttcccccgaggccatgtgtagcctggatcccaacgaccccgcccatgggtccc300aattggccgtcccgttaccaagaccaacccagccagcgtatccacccccgcccgggtccc360cgcggaagcggaacggtgtatgtgatatgctaattaaatacatgccacgtacttatggtg420tctgattggtccttgtctgtgccggaggtggggcgggggccccgcccggggggcggaact480aggaggggtttgggagagccggccccggcaccacgggtataaggacatccaccacccggc540cggtggtggtgtgcagccgtgttccaaccacggtcgttgacattgattattgactagtta600ttaatagtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttac660ataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtc720aataatgacgtatgttcccatagtaacgccaatagggactttccattgacgtcaatgggt780ggactatttacggtaaactgcccacttggcagtacatcaagtgtatcatatgccaagtac840gccccctattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgac900cttatgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatggt960gatgcggttttggcagtacatcaatgggcgtggatagcggtttgactcacggggatttcc1020aagtctccaccccattgacgtcaatgggagtttgttttggcaccaaaatcaacgggactt1080tccaaaatgtcgtaacaactccgccccattgacgcaaatgggcggtaggcgtgtacggtg1140ggaggtctatataagcagagctctctggctaactgccaccatggtgagcaagggcgagga1200gctgttcaccggggtggtgcccatcctggtcgagctggacggcgacgtaaacggccacaa1260gttcagcgtgtccggcgagggcgagggcgatgccacctacggcaagctgaccctgaagtt1320catctgcaccaccggcaagctgcccgtgccctggcccaccctcgtgaccaccctgaccta1380cggcgtgcagtgcttcagccgctaccccgaccacatgaagcagcacgacttcttcaagtc1440cgccatgcccgaaggctacgtccaggagcgcaccatcttcttcaaggacgacggcaacta1500caagacccgcgccgaggtgaagttcgagggcgacaccctggtgaaccgcatcgagctgaa1560gggcatcgacttcaaggaggacggcaacatcctggggcacaagctggagtacaactacaa1620cagccacaacgtctatatcatggccgacaagcagaagaacggcatcaaggtgaacttcaa1680gatccgccacaacatcgaggacggcagcgtgcagctcgccgaccactaccagcagaacac1740ccccatcggcgacggccccgtgctgctgcccgacaaccactacctgagcacccagtccgc1800cctgagcaaagaccccaacgagaagcgcgatcacatggtcctgctggagttcgtgaccgc1860cgccgggatcactctcggcatggacgagctgtacaagtaacgggcctcgactgtgccttc1920tagttgccagccatctgttgtttgcccctcccccgtgccttccttgaccctggaaggtgc1980cactcccactgtcctttcctaataaaatgaggaaattgcatcgcattgtctgagtaggtg2040tcattctattctggggggtggggtggggcaggacagcaagggggaggattgggaagacaa2100tagcaggcatgctggggatgcggtgggctctatggcttctgaggtacaataaaaacaaaa2160catttcaaacaaatcgccccacgtgttgtccttctttgctcatggccggcggggcgtggg2220tcacggcagatggcgggggtgggcccggcgtacggcctgggtgggcggagggaactaacc2280caacgtataaatccgtccccgctccaaggccggtgtcatagtgcccttaggagcttcccg2340cccgggcgcatccccccttttgcactatgacagcgacccccctcaccaacctgttcttac2400gggccccggacataacccacgtggcccccccttactgcctcaacgccacctggcaggccg2460aaacggccatgcacaccagcaaaacggactccgcttgcgtggccgtgcggagttacctgg2520tccgcgcctcctgtgagaccagcggcacaatccactgctttttctttgcggtatacaagg2580acacccaccatacccctccgctgattaccgagctccgcaactttgcggacctggttaacc2640acccgccggtcctacgcgaactggtcgaagctttttata2679<210>6<211>3338<212>dna<213>人工序列<400>6cccaaactcgagctgcgggcgctgttgttccatcatcctgtcgggcatcgcaatgcgatt60gtgttatatcgccgtggtggccggggtggtgctcgtggcgcttcactacgagcaggagat120ccagaggcgcctgtttgatgtatgacgtcacatccaggccggcggaaaccggaacggcat180atgcaaactggaaactgtcctgtcttggggcccacccacccgacgcgtcatatgtaaatg240aaaatcgttcccccgaggccatgtgtagcctggatcccaacgaccccgcccatgggtccc300aattggccgtcccgttaccaagaccaacccagccagcgtatccacccccgcccgggtccc360cgcggaagcggaacggtgtatgtgatatgctaattaaatacatgccacgtacttatggtg420tctgattggtccttgtctgtgccggaggtggggcgggggccccgcccggggggcggaact480aggaggggtttgggagagccggccccggcaccacgggtataaggacatccaccacccggc540cggtggtggtgtgcagccgtgttccaaccacggtcacgcttcggtgcctctccccgattc600gggcccggtcgcttgctaccggtgcgccaccaccagaggccatatccgacaccccagccc660cgacggcagccgacagcccggtcatggcgactgacattgatatgctaattgacctcggcc720tggacctctccgacagcgatctggacgaggacccccccgagccggcggagagccgccgcg780acgacctggaatcggacagcaacggggagtgttcctcgtcggacgaggacatggaagacc840cccacggagaggacggaccggagccgatactcgacgccgctcgcccggcggtccgcccgt900ctcgtccagaagaccccggcgtacccagcacccagacgcctcgtccgacggagcggcagg960gccccaacgatcctcaaccagcgccccacagtgtgtggtcgcgcctcggggcccggcgac1020cgtcttgctcccccgagcggcacgggggcaaggtggcccgcctccaacccccaccgacca1080aagcccagcctgcccgcggcggacgccgtgggcgtcgcaggggtcggggtcgcggtggtc1140ccggggccgccgatggtttgtcggacccccgccggcgtgcccccagaaccaatcgcaacc1200cggggggaccccgccccggggcggggtggacggacggccccggcgccccccatggcgagg1260cgtggcgcggaagtgagcagcccgacccacccggaggcccgcggacacggagcgtgcgcc1320aagcaccccccccgctaatgacgctggcgattgcccccccgcccgcggacccccgcgccc1380cggccccggagcgaaaggcgcccgccgccgacaccatcgacgccaccacgcggttggtcc1440tgcgctccatctccgagcgcgcggcggtcgaccgcatcagcgagagcttcggccgcagcg1500cacaggtcatgcacgacccctttggggggcagccgtttcccgccgcgaatagcccctggg1560ccccggtgctggcgggccaaggagggccctttgacgccgagaccagacgggtctcctggg1620aaaccttggtcgcccacggcccgagcctctatcgcacttttgccggcaatcctcgggccg1680catcgaccgccaaggccatgcgcgactgcgtgctgcgccaagaaaatttcatcgaggcgc1740tggcctccgccgacgagacgctggcgtggtgcaagatgtgcatccaccacaacctgccgc1800tgcgcccccaggaccccattatcgggacggccgcggcggtgctggataacctcgccacgc1860gcctgcggccctttctccagtgctacctgaaggcgcgaggcctgtgcggcctggacgaac1920tgtgttcgcggcggcgtctggcggacattaaggacattgcatccttcgtgtttgtcattc1980tggccaggctcgccaaccgcgtcgagcgtggcgtcgcggagatcgactacgcgacccttg2040gtgtcggggtcggagagaagatgcatttctacctccccggggcctgcatggcgggcctga2100tcgaaatcctagacacgcaccgccaggagtgttcgagtcgtgtctgcgagttgacggcca2160gtcacatcgtcgcccccccgtacgtgcacggcaaatatttttattgcaactccctgtttt2220aggatcgcaagctgaccctgaagttcatagtccaagctgaccctgaagttcatacgtcca2280catgaagcagcacgacttctgaccacatgaagcagcacgacttgatccagacatgataag2340atacattgatgagtttggacaaaccacaactagaatgcagtgaaaaaaatgctttatttg2400tgaaatttgtgatgctattgctttatttgtaaccattataagctgcaataaacaagttaa2460caacaacaattgcattcattttatgtttcaggttcagggggaggtgtgggaggtttttta2520aagcaagtaaaacctctacaaatgtggtatggctgattatgatcctgcaagcctcgtcgt2580cctggccggaccacgctatctgtgcaaggtccccggccccggacgcgcgctccatgagca2640gagcgcccgccgccgaggcgaagactcgggcggcgccctgcccgtcccaccaggtcaaca2700ggcggtaaccggcctcttcatcgggaatgcgcgcgaccttcagcatcgccggcatgtccc2760cctggcggacgggaagtatccagctcgaccaagctgttttaagcttgtacaataaaaaca2820aaacatttcaaacaaatcgccccacgtgttgtccttctttgctcatggccggcggggcgt2880gggtcacggcagatggcgggggtgggcccggcgtacggcctgggtgggcggagggaacta2940acccaacgtataaatccgtccccgctccaaggccggtgtcatagtgcccttaggagcttc3000ccgcccgggcgcatccccccttttgcactatgacagcgacccccctcaccaacctgttct3060tacgggccccggacataacccacgtggcccccccttactgcctcaacgccacctggcagg3120ccgaaacggccatgcacaccagcaaaacggactccgcttgcgtggccgtgcggagttacc3180tggtccgcgcctcctgtgagaccagcggcacaatccactgctttttctttgcggtataca3240aggacacccaccatacccctccgctgattaccgagctccgcaactttgcggacctggtta3300accacccgccggtcctacgcgaactgctcgaggggaaa3338<210>7<211>2622<212>dna<213>人工序列<400>7aataatataagcttgttgacattgattattgactagttattaatagtaatcaattacggg60gtcattagttcatagcccatatatggagttccgcgttacataacttacggtaaatggccc120gcctggctgaccgcccaacgacccccgcccattgacgtcaataatgacgtatgttcccat180agtaacgccaatagggactttccattgacgtcaatgggtggagtatttacggtaaactgc240ccacttggcagtacatcaagtgtatcatatgccaagtacgccccctattgacgtcaatga300cggtaaatggcccgcctggcattatgcccagtacatgaccttatgggactttcctacttg360gcagtacatctacgtattagtcatcgctattaccatggtgatgcggttttggcagtacat420caatgggcgtggatagcggtttgactcacggggatttccaagtctccaccccattgacgt480caatgggagtttgttttggcaccaaaatcaacgggactttccaaaatgtcgtaacaactc540cgccccattgacgcaaatgggcggtaggcgtgtacggtgggaggtctatataagcagagc600tcgtttagtgaaccgtcagatcgcctggatgctgatgaacttcagggtcagcttggtttt660ggccactgactgaccaagctgactgaagttcatcaggctggctcagcactgctatgttgc720ctgctcttactggctggagtgaagaccagcaaaggccattcctgctgatgaacttcaggg780tcagcttggttttggccactgactgaccaagctgactgaagttcatcaggcctgctgagt840gacagcacccctttggagccccctcccttatatctaatggaagattatgtgggcaacccg900gtggtagccggggtggtagagtttgacaggcaagcatgtgcgtgcagaggcgagtagtgc960ttgcctgtctaactcgctagtctcggcgactgtgccttctagttgccagccatctgttgt1020ttgcccctcccccgtgccttccttgaccctggaaggtgccactcccactgtcctttccta1080ataaaatgaggaaattgcatcgcattgtctgagtaggtgtcattctattctggggggtgg1140ggtggggcaggacagcaagggggaggattgggaagacaatagcaggcatgctggggatgc1200ggtgggctctatgggatacttcccgtccgccagggggacatgccggcgatgctgaaggtc1260gcgcgcattcccgatgaagaggccggttaccgcctgttgacctggtgggacgggcagggc1320gccgcccgagtcttcgcctcggcggcgggcgctctgctcatggagcgcgcgtccggggcc1380ggggaccttgcacagatagcgtggtccggccaggacgacgaggcttgcaggatcataatc1440agccataccacatttgtagaggttttacttgctttaaaaaacctcccacacctccccctg1500aacctgaaacataaaatgaatgcaattgttgttgttaacttgtttattgcagcttataat1560ggttacaaataaagcaatagcatcacaaatttcacaaataaagcatttttttcactgcat1620tctagttgtggtttgtccaaactcatcaatgtatcttatcaggatccccgccgccgccgc1680cgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgc1740cgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgc1800cgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgc1860cgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgc1920cgccgccgccgccgccgccgccgccgccgccgccgccgccgccgccgtctagagtaaagg1980accaagtattcagcaagttcgcttgctgaatacttggtccttgctgcctagttcaaagtc2040gccgtccaggcgccgcgctgttccgtttcttgctgcctcaagatcctccaggcgatctga2100cggttcactaaacgagctctgcttatataggcctcccaccgtacacgcctaccgcggggg2160tggccggggccagggcttcccacgtgcgcagcaggacgcagcgctgcctgaaactcgcgc2220cgcgaggagagggcggggccgcggaaaggaaggggaggggctgggagggcccggaggggg2280ctgggccggggacccgggaggggtcgggacggggcggggtccgcgcggaggaggcggagc2340tggaaggtgaaggggcaggacgggtgcccgggtccccagtccctccgccacgtggggagc2400gcggtcctgggcgtctgtgcccgcgaatccactgggagcccggcctggccccgacagcgc2460agctgctccgggcggacccgggggtctgggccgcgcttccccgcccgcgcgccgctcgcg2520ctcccagggtgcagggacgccagcgagggccccagcggagagaggtcgaatcggcctagg2580ctgtggggtaacccgagggaggggccataagcttatatataa2622<210>8<211>162<212>rna<213>人工序列<400>8agcgggcacucuuccguggucugguggauaaauucgcaaggguaucauggcggacgaccg60ggguucgagccccguauccggccguccgccgugauccaugcgguuaccgcccgcgugucg120aacccaggugugcgacgucagacaacgggggagugcuccuuu162当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1