一种具有肿瘤靶向性的吉西他滨前体药物及其制备方法和用途与流程
本发明属于靶向药物和药物治疗领域,特别涉及一种具有肿瘤靶向性的吉西他滨前体药物及其制备方法和用途。
背景技术:
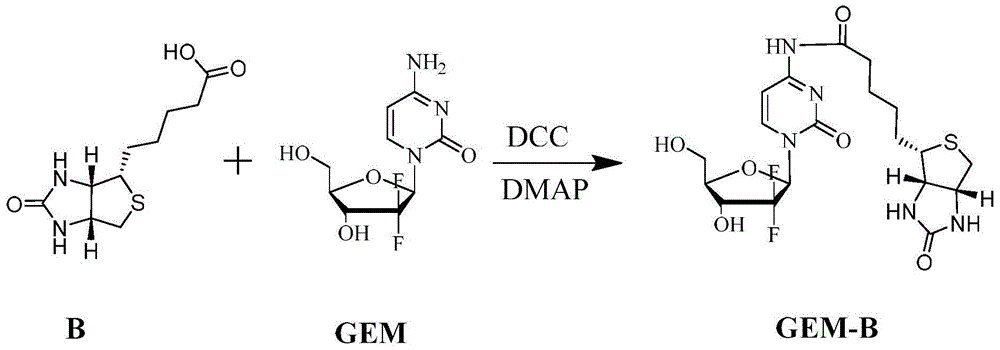
:癌症是严重危害人类健康的一大顽症,现已成为仅次于心血管病的第二大杀手,所以寻找安全、有效、低毒的抗肿瘤药物及其系统和研究其作用机理,具有重要意义。癌症传统治疗手段之化疗,除了具有杀伤癌细胞/组织的作用外,其非靶向选择性会对非癌部位的细胞产生毒副作用,比如骨髓造血细胞,毛囊,口腔、消化道、生殖系统的细胞等;使得化疗药物在临床上的最大耐受用药剂量非常有限,降低了化疗药物对癌症的真实治疗效果和药物经济。吉西他滨(gemcitabine,gem)是一种拮抗核苷酸代谢的核苷类抗肿瘤药物,该类药物体内经细胞内三磷酸化后,通过抑制脱氧核苷三磷酸(dntps)的合成、掺入dna或rna分子中干扰细胞复制、竞争性抑制dna聚合酶等作用,特异性干扰核酸的代谢,阻止细胞的分裂和繁殖,最终导致肿瘤细胞死亡。吉西他滨进入体内后,被在肝脏、肾脏、血液和其他组织中脱氧胞苷脱氨酶快速而完全代谢,转化为无活性的代谢产物2’-脱氧-2’,2’-二氟尿苷(2'-deoxy-2',2'-difluorouridine);同时,因肝脏和血液中大量存在的脱氧胞苷脱氨酶的快速脱氨作用,将核苷类药物活性氨基进行酰胺化可延缓药物被快速代谢钝化及降低毒副作用(依诺他滨(enocitabine)为抗肿瘤作用更强的糖胞苷(cytarabine)氨基酰化衍生物);此外,核苷类抗肿瘤药物易发生耐药,虽然其磷酸酯前药能够减少耐药发生(如已经进入临床研究的磷酸酯前药nuc-1031(slusarczykm,etal.jmedchem.2014;57(4):1531-42.),但磷酸酯前药不能延缓其被脱氧胞苷脱氨酶的代谢,亦不能减少其对非肿瘤组织的毒副作用;吉西他滨磷酸酯前药氨基酰化(wo2015/134334)能够延缓药物被脱氧胞苷脱氨酶的代谢,仍然无法减少药物对非肿瘤组织的毒副作用。众所周知,现代癌症治疗中如何解决高效安全地将抗肿瘤药物靶向递送到肿瘤器官或组织,提高癌症治疗效率,同时降低药物的毒副作用,真正达到肿瘤靶向给药的目的,仍然是靶向给药系统的重点科学问题。在主动靶向肿瘤治疗的配体中,主要还是基于靶向基团(dna/rna片段、单克隆抗体、多肽、糖类、脂蛋白、维生素叶酸/生物素类等)高特异性亲和和识别肿瘤细胞表面过度表达的受体或基因片段的功能,将靶向基团或载体与药物进行修饰连接,进而达到靶向递送的目的。其中生物素(biotin)因其结构简单,分子量低,高肿瘤特异性及其生物素受体在肿瘤组织膜表面广泛高表达而被作为一种靶向配体广泛应用于各种抗癌药物的靶向递送运输。生物素(biotin,b)又称维生素h、辅酶r,是水溶性维生素,也属于维生素b族,分子量为244.31,基本结构为双环结构:i环为咪唑酮环,是与亲和素结合的部位;ii为噻吩环,含一个戊酸侧链,其末端羧基可与生物大分子连接,形成生物素标记抗原、抗体、酶等。其化学结构中有咪唑酮环,可与亲和素(avidin,av)和链霉亲和素(streptavidin,sa)特异性结合。生物素与亲和素之间结合的亲和力高(结合常数约为1×10-15mol/l,且可视为不可逆结合)、特异性强,各自均可以与各型大小分子结合,一分子链霉亲合蛋白可与四分子生物素结合,二者“链霉亲和素-生物素”结合反应时具有多级放大作用等优越性,其相关技术被广泛应用在各种标记免疫分析技术和肿瘤靶向治疗药物领域中。这为b介导的癌组织靶向成像和药物靶向于癌症靶向精准治疗奠定了良好的分子基础。通过国内外文献和专利检索,尚未发现有生物素偶联吉西他滨构建前体药物实现癌症靶向给药方案先例。技术实现要素:为了克服现有技术的缺点与不足,本发明的首要目的在于提供一种具有肿瘤靶向性的吉西他滨前体药物;该类化合物是通过酰氨键将生物素修饰的吉西他滨化合物。本发明的另一目的在于提供一种上述具有肿瘤靶向性的吉西他滨前体药物的制备方法。本发明的再一目的在于提供上述具有肿瘤靶向性的吉西他滨前体药物的用途。本发明的目的通过下述技术方案实现:一种具有肿瘤靶向性的吉西他滨前体药物,该药物具有如式(i)所示的结构:gem-b(i)其中,gem为吉西他滨,b为生物素,生物素以酰胺键与吉西他滨偶联。上述的一种具有肿瘤靶向性的吉西他滨前体药物的制备方法,包括以下操作步骤:取生物素溶于a溶剂中,在脱水剂n,n'-二环己基碳二亚胺(dcc)或1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,以及催化剂对二甲氨基吡啶(dmap)作用下,0℃搅拌反应1~12h;然后滴加入溶于a溶剂中的吉西他滨,生物素和吉西他滨的摩尔比为1:1~3;从冰浴中升高温度至室温,避光搅拌过夜;过滤除副产物,滤液浓缩,冰乙醚或异丙醇重结晶,层析或制备液相纯化,冻干即得具有肿瘤靶向性的吉西他滨前体药物。所述a溶剂为ch2cl2、tea、dmso和dmf中的一种以上;所述搅拌反应的时间为3.0h;所述室温为25℃。所述生物素、脱水剂和催化剂的摩尔比为1:1:1~1:30:30。上述的一种具有肿瘤靶向性的吉西他滨前体药物的制备方法,包括以下操作步骤:取生物素的活性酯溶解于无水dmso/tea中,加入与生物素的活性酯等摩尔的吉西他滨,无水条件下室温反应过夜,真空干燥,重结晶分离或色谱纯化,即得具有肿瘤靶向性的吉西他滨前体药物。所述无水dmso/tea中dmso和tea的体积比为2:1。具有通式(ⅰ)结构的具有肿瘤靶向性的吉西他滨前体药物的合成示意图如图1所示。上述的具有肿瘤靶向性的吉西他滨前体药物或其药学上可接受的盐及其组合物在制备治疗癌症药物中的用途。所述治疗癌症药物中含有治疗有效量的具有肿瘤靶向性的吉西他滨前体药物或其药学上可接受的盐及药学上可接受的载体。所述治疗癌症药物为口服剂型或非肠道药物注射剂剂型,所述口服剂型为口服固体、胶囊和液体制剂。所述药学上可接受的盐可以是:生物素偶联的吉西他滨的化学结构上羟基成钠、镁、钙盐或其他盐。本发明的原理:基于生物素受体介导肿瘤细胞亲和靶向递送原理,以生物素修饰吉西他滨解决吉西他滨药物的肿瘤靶向性、脱氨酶导致吉西他滨活性钝化和肿瘤细胞核酸转运载体表达量降低导致产生的耐药性及半衰期短(吉西他滨的半衰期<75min,临床上需持续的静脉给药来维持其抗癌细胞的毒性作用)等问题,同时生物素具有很好的溶解性、生物相容性和无免疫源性等优点,可以获得具有肿瘤靶向作用的生物素偶联吉西他滨前体药物,提高吉西他滨的药效,增加肿瘤细胞选择性,降低毒副作用,更适合抗癌临床使用。本发明人在设计和实验发明中发现通过靶向分子生物素化学修饰的吉西他滨前体药物具有更好的溶解性,显著增加其肿瘤细胞选择性,提高了抗癌活性和降低了核苷转运载体表达的依赖性,大大降低了原型药物的毒性。本发明所涉及的前体药物具有肿瘤靶向选择性和更优的抗癌活性及核酸转运载体的非依赖性。经过mtt法测试细胞毒表明,本发明化合物对具有生物素受体阳性表达的肿瘤细胞(宫颈癌hela、胰腺癌bxpc-3、乳腺癌mda-mb-231和肝癌hepg2等)体外生长抑制作用ic50比原型药物吉西他滨显著提高5~7倍。对正常肝脏细胞lo2毒性数据表明本发明化合物比原型药物对非癌细胞具有大于3倍的ic50值,提示吉西他滨前体药物具有更低的毒性和更好的肿瘤靶向性;且核酸转运载体竞争实验表明,本发明的前体药物体外细胞转运作用几乎不受核酸转运载体抑制剂的影响。本发明所涉及的前体药物具有更优的体内血浆药物半衰期。采用大鼠尾静脉注射的给药方式,药动学参数结果表明,前体药物gem-b在静脉注射后可维持更高的吉西他滨药物浓度和更长的血药持续时间,其auc和半衰期t1/2为原形药物吉西他滨的3倍多。本发明所涉及的前体药物具有更优的抗肿瘤治疗效果。以接种乳腺癌mda-mb-231细胞的裸鼠为评价模型结果表明,与吉西他滨原形药相比,前体药物gem-b具有更强的体内抗肿瘤疗效。在癌细胞靶向分子生物素的介导驱动下,本发明的生物素偶联吉西他滨前体药物在机体内可以很快进入生物素受体高表达的肿瘤细胞,改善吉西他滨药物的抗癌生物活性,提高其细胞膜穿透性和癌组织穿透性,降低毒副作用。与现有技术相比,本发明具有以下优点及有益效果:通过体外mtt检测实验,发现其对肿瘤细胞株(宫颈癌hela、胰腺癌bxpc-3、乳腺癌mda-mb-231和肝癌hepg2细胞等)具有更好的抑制效果,比吉西他滨药物强5-7倍,但对正常肝细胞lo2的毒性低3倍以上;该生物素偶联的吉西他滨前体药物具有生物素受体介导靶向肿瘤的特性,可克服吉西他滨类抗癌药物选择性低、核苷转运载体蛋白表达依赖性强、被脱氧胞苷脱氨酶的快速代谢、半衰期短和易多耐药性的问题,通过靶向拮抗肿瘤细胞的代谢等途径抑制癌细胞增殖达到清除癌细胞的效果。附图说明图1为本发明具有通式(ⅰ)结构的具有肿瘤靶向性的吉西他滨前体药物的合成示意图。图2为吉西他滨前体药物的体内抗癌效应及其对裸鼠体重影响图。具体实施方式下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。实施例1:生物素-吉西他滨前体药物的制备取生物素(0.18mmol)溶于60ml的dmso中,在脱水剂dcc(4.0mmol)和催化剂dmap(4.0mmol)作用下,0℃搅拌6h;然后滴加入溶于dmso中的吉西他滨,生物素和吉西他滨的摩尔比为1:3;从冰浴中升高温度至室温25℃,避光搅拌过夜;过滤除副产物,滤液浓缩,冰乙醚或异丙醇重结晶,层析或制备液相纯化,冻干即可获得具有肿瘤靶向性的吉西他滨前体药物gem-b,c19h25f2n5o6s,理论mw为489.5(收率约70%),质谱鉴定离子峰ms+为490.6。结构表征数据如下,确定其结构如式(ⅰ)所示:1h-nmr(300mhz,dmso):δ1.25-1.28(m,ch2,2h),1.55-1.60(m,2ch2,4h),2.35-2.37(d,ch2,2h),2.95-3.07(d,ch2,2h),3.28-3.33(d,ch2,2h),3.53-3.60(d,ch2,2h),3.96(s,oh,1h),4.42(s,oh,1h),4.51-4.60(d,2ch,2h),5.26(s,ch,1h),5.55(s,ch,1h),7.25(s,ch,1h),8.97(s,ch,1h),9.23(s,br,nh,1h),10.86(s,br,2nh,2h)。实施例2:生物素-吉西他滨前体药物的制备1)生物素活性酯(b-nhs)的制备:取生物素(0.62g,2.5mmol)溶解于40ml无水dmf中,加入0.5mltea三乙胺混合并于无水环境下室温避光搅拌均匀;然后混合0.51g(2.5mmol)的dcc和0.28g(2.5mmol)nhs,避光搅拌24h,过滤除去副产物二环己脲,低温真空干燥除去dmf和tea,产物用乙醚沉淀得到生物素活性酯b-nhs。2)生物素-吉西他滨前体药物的制备:取生物素活性酯b-nhs(0.15mmol)溶于50ml的无水dmso/tea(体积比2:1)中,取与b-nhs等摩尔的吉西他滨加入混合溶液中于无水条件下避光反应过夜,真空干燥反应液,冰乙醚或异丙醇重结晶,层析或制备液相纯化,冻干即可获得癌细胞靶向性吉西他滨前体药物gem-b(收率约70%),质谱鉴定离子峰ms+为490.6。结构表征数据如下,确定其结构如式(ⅰ)所示:1h-nmr(300mhz,dmso):δ1.25-1.27(m,ch2,2h),1.54-1.61(m,2ch2,4h),2.34-2.37(d,ch2,2h),2.96-3.07(d,ch2,2h),3.29-3.33(d,ch2,2h),3.54-3.60(d,ch2,2h),3.95(s,oh,1h),4.43(s,oh,1h),4.52-4.60(d,2ch,2h),5.26(s,ch,1h),5.55(s,ch,1h),7.25(s,ch,1h),8.96(s,ch,1h),9.25(s,br,nh,1h),10.88(s,br,2nh,2h)。实施例3:细胞毒性检测评价实验gem和gem-b的体外抗癌效应评价比较。鉴于吉西他滨类核苷药物是广谱抗癌细胞毒剂,本实施例中采用多种癌组织来源的生物素受体阳性表达的肿瘤细胞(hela、hepg2、bxpc-3、mda-mb-231和sk-ov-3)对实施例2制备的相应偶联产物gem-biotin及其原型化合物进行药效评价,同时lo2肝脏细胞对其进行正常细胞的毒实验测试。取对数生长期的细胞,根据细胞的大小接种2~10×103个于96孔板上,待生长24h后,弃上清,然后按以下分组给药:癌细胞设不加药组和加药组(浓度0.05~50μm对癌细胞,浓度0.5~100μm对lo2细胞;其中生物素浓度设置0.5~100μm),吉西他滨作为阳性药物和对照比较,对实施例1或2制备的相应偶联产物gem-b进行细胞毒性检测。每组设4~6个复孔,培养72h后,弃上清,加入100μl含0.5mg/ml的mtt(四氮唑盐)无血清培养液培养4h,加入100μldmso(二甲亚砜),放置于微型振荡仪上振荡10min,再置于酶标仪上570nm处检测od值。正常人细胞系lo2做对照。每次实验均重复3次。结果显示(表1),随着药物浓度增加,与非处理对照组比较,细胞增殖活性分别下降,说明gem-b呈浓度依赖性抑制癌细胞的生长增殖;且前药显著增加抗增殖效应,ic50浓度显著降低5-7倍。而对正常肝细胞系lo2细胞的增殖活性未有明显变化,ic50浓度值增加3倍,显示出该前药对正常细胞具有低毒特性(表1)。表1不同细胞的ic50值(72h)及不同化合物ic50比值实施例4:实施例2制备的前体药物gem-b体外细胞膜转运机制评价核苷酸类药物是平衡核苷转运蛋白和浓缩核苷转运蛋白(含ent和cnt)的底物,具体通过人ent1、ent2、cnt1和cnt3转运,但不通过嘌呤选择性浓缩转运蛋白cnt2转运(mackeyjr,etal.,cancerres.1998;58:4349-57;j.natl.cancerinst.1999;91:1876-81.)。吉西他滨在人细胞内摄取转运载体主要是通过人平衡型核苷转运蛋白1(hent1),hent1转运载体表达量的调控或抑制,在临床上会引起吉西他滨耐药性的产生。通常在体外可通过加入核酸转运载体抑制剂来模拟其耐药性,而gem-b前体药物对核酸转运载体抑制剂不敏感。本试验采用两种核苷转运载体抑制剂进行底物抑制竞争验证实验(100μmnbmpr(s-(4-硝基苄基)-6-硫肌苷,s-(4-nitrobenzyl)-6-thioinosine)和5μg/mldpam(双嘧达莫,dipyridamole))。在加入各种浓度的前体药物或原形药物之前,预先用核苷转运体抑制剂处理靶细胞30~60min,然后继续完成体外细胞毒性实验的评价程序。研究结果表明(表2),两种抑制剂处理后的mda-mb-231细胞,对吉西他滨的细胞毒活性分别降低了约21倍和20倍,而对gem-b的细胞毒活性只分别降低约1.6倍和1.3倍;bxpc-3细胞则对吉西他滨的细胞毒活性分别降低约35倍和35倍,而对gem-b的细胞毒活性只分别降低了1.5倍和1.3倍。这说明吉西他滨的转运需要hent1载体,而gem-b的跨细胞转运可不依赖于hent1载体,这可减少吉西他滨的耐药发生。表2不同核苷抑制剂对肿瘤细胞的ic50值(72h)的改变实施例5:肝s9组分进行体外代谢转化释放试验在通过组织匀浆及高速离心(10,000~12,000×g/min,20min)获得的鼠肝s9组分中,分别平行将实施例2制备的前药药物和原药以10μm浓度与肝s9组分混合均匀,于37℃水浴振荡器中进行孵育,一式两份。在0min和60min取样;阴性对照(无s9组分)和阳性对照(7-乙氧基香豆素和7-羟基香豆素)对本测试进行确证。采用安捷伦uplc-ms/ms分析全部样本,监控母体化合物的消耗和吉西他滨的形成(与等摩尔浓度的吉西他滨药物进行百分比计算)。研究结果表明(表3),经过肝脏s9组分处理后的gem-b前药可以很好地释放出吉西他滨原型系列药物,证明了本发明设计的有效性和潜在转化价值。表3吉西他滨前药的肝脏转化及释放实施例6:前体药物gem-b体内静脉注射后的药物动力学研究将实施例2制备的前体药物溶解在peg-200和10%乙醇的混合溶媒(1:4,v/v)中,用生盐水稀释配制成注射液;同时,将盐酸吉西他滨用生理盐水中配制成注射液。在雄性sd大鼠尾静脉按10mg/kg注射,给药后眼眶取血,用高效液相法测定血浆中药物浓度。研究结果表明(表4),与原形药相比,静脉注射gem-b前体药物后血浆中的游离吉西他滨浓度显著较高,并且血浆中药物半衰期和auc分别增加了3~4倍。表4.静脉注射gem-b前药和盐酸吉西他滨注射后血浆中游离吉西他滨药物动力学参数(每组3只大鼠)药动学参数gem-b盐酸吉西他滨t1/2(h)8.78±1.022.35±0.31auc0-24(mg*h/l)34.69±3.157.45±1.08mrt0-24(h)6.68±0.592.11±0.34cl(l/h/kg)0.27±0.091.12±0.20实施例7:尾静脉注射前体药物的抗肿瘤药效学评价将实施例2制备的gem-b溶解在peg-200和10%乙醇的混合溶媒(1:4,v/v)中,用生盐水稀释配制成注射液,将盐酸吉西他滨直接溶解在生理盐水中配制成注射液。雌性balb/c裸鼠(初始重量18±g,上海动物实验中心提供),接种5×106/只裸鼠的bxpc-3细胞后形成实体瘤,待长成50-100mm3后分组,按25mg/kg吉西他滨进行3天/次进行尾静脉注射给药6次,末次给药后72h进行裸鼠牺牲,采用游标卡尺测定瘤体尺寸,并计算瘤体大小。研究结果表明(如图2所示),与生理盐水对照组相比,gem-b与盐酸吉西他滨注射液均具有良好地抗裸鼠移植瘤增殖效应,其中静脉注射前药组gem-b的抗肿瘤效应更为优,且统计具有显著性(##,p<0.01);模型组比较,前药组和吉西他滨组裸鼠的体重均未呈降低趋势,且前药组的体重比吉西他滨组要偏重(##,p<0.01),可能与前药组改善和降低吉西他滨在裸鼠体内的毒性有关。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1