一种酪氨酸酶抑制肽及其应用的制作方法
本发明属于食品深加工技术领域,具体涉及一种提取自核桃粕的酪氨酸酶抑制肽及其制备方法与应用。
背景技术:
核桃(juglansregial.)是市面上常见的坚果类作物之一,具有丰富的营养价值和药用功效。核桃榨油后产生大量的副产物核桃脱脂粕,通常以饲料低价出售,不仅造成核桃蛋白资源的浪费,也严重阻碍了核桃产业的发展。生物酶解技术作为一种绿色生物转化手段,一方面有助于提高底物的生物利用率,另一方面可以将核桃粕蛋白分解成更利于人体吸收的小分子化合物,增加功能活性,提高营养价值。
生物活性肽是指亲本蛋白质片段在特定蛋白酶的作用下分解成小分子片段,可以调节机体代谢机制或具有特殊生物活性的一类物质的总称,通常每分子含有2-20个氨基酸残基,分子量小于6000da。生物活性肽存在于牛奶、乳制品、植物、动物和微生物蛋白中,在胃肠消化或食品加工过程中大分子蛋白被分解释放小分子肽,作为调节化合物或类激素物质在生物体内发挥重要生理作用,近年来,已有广泛的科学研究表明生物活性肽对人类健康有益。有许多方法可以制备具有生物活性的多肽,最常见的方法是:生物酶解法、微生物发酵法、化学合成法及生物工程法。
黑色素在色素细胞特有的膜性细胞器黑素小体内合成,其类型、含量及在周围角质形成细胞中的分布决定了人体皮肤的实际颜色,黑色素过度沉积将会引发皮肤病和一些其它疾病,如黄褐斑、黑色素瘤等。酪氨酸酶是一种含铜混合功能氧化酶,在哺乳动物大脑中发现酪氨酸酶活性与帕金森病和其它神经退行性疾病相关,在农产品加工与贮藏中与水果、蔬菜、菌类例如蘑菇的瘀伤或长期储存时发生的褐变有关。在黑色素合成过程中,酪氨酸酶催化l-酪氨酸氧化成l-多巴,随后将l-多巴氧化成l-多巴醌,再通过一系列非酶促过程转换为黑色素,前一步和后一步反应分别定义为单酚酶和二酚酶反应。因此,对于酪氨酸酶抑制剂的开发引起了医药、食品和化妆品领域极大的兴趣,而已知的酪氨酸酶抑制剂显示出高细胞毒性和不稳定性,并且缺乏控制其使用的安全规定,不能广泛用于医药、食品或化妆品行业中。因此,需要开发没有毒性和长期稳定性的新型抑制剂。
目前,曲酸、熊果苷和对苯二酚是在化妆品领域应用较为广泛的酪氨酸酶抑制剂,虽然这些药物能够产生较强的治疗效果,但同时也具有严重的副作用。自20世纪60年代以来,曲酸和对苯二酚已成为市售美白产品中的活性成分,但可能具有遗传毒性和致癌作用,熊果苷是从小麦、梨皮和蓝莓叶中提取的糖基化氢醌,很容易在皮肤表面转化为有害的对苯二酚。因此,迫切需要开发安全稳定的黑色素抑制剂。
技术实现要素:
为了解决上述技术问题,本发明以冷榨核桃粕为原料,利用生物酶解法制备核桃多肽,并对多肽酶解过程的工具酶进行筛选,采用响应面法优化核桃粕蛋白酶解工艺。采用超滤、葡聚糖凝胶层析等方法分离纯化核桃粕蛋白酶解液,并测定酪氨酸单酚酶及二酚酶抑制率,筛选出酪氨酸酶抑制活性较高的多肽组分,对纯化后的核桃粕多肽进行液质分析,确定核桃粕多肽的氨基酸序列及分子量分布。利用autodockvina进行分子对接确定目标多肽,人工合成目标多肽并对其进行酪氨酸酶抑制动力学研究和体外消化稳定性研究,最终获得一种性能优越的酪氨酸酶抑制多肽。
本发明提供一种酪氨酸酶抑制多肽fpy,所述酪氨酸酶抑制多肽fpy的氨基酸序列为phe-pro-tyr,c端为tyr,n端为phe。
所述酪氨酸酶抑制多肽fpy相对分子量为498.23da。fpy与酪氨酸酶的对接构象显示,三肽fpy主要对接在受体蛋白酪氨酸酶(2y9x)的凹槽中,它们之间的相互作用主要有三类:氢键、疏水相互作用、静电相互作用。酶动力学研究结果显示,人工合成短肽fpy对酪氨酸酶单酚酶和二酚酶均有抑制作用,其ic50分别为0.47±0.01mg/ml、1.37±0.03mg/ml。fpy对酪氨酸单酚酶的抑制作用类型为竞争性可逆抑制,米氏常数km=3.56mmol/l,抑制常数ki=22.04mmol/l,对酪氨酸二酚酶的抑制作用类型为竞争性可逆抑制,米氏常数km=4.09mmol/l,抑制常数ki=4.82mmol/l;且在体外胃肠蛋白酶作用下能保持良好的酪氨酸酶抑制活性。
本发明还提供多肽fpy在酪氨酸酶抑制中的应用。
有益效果:
1.本发明提供的人工合成短肽fpy对酪氨酸酶单酚酶和二酚酶均有抑制作用,且具有剂量依赖性,随着fpy浓度的增加,酪氨酸单酚酶和二酚酶抑制率迅速上升,其ic50分别为0.47±0.01mg/ml、1.37±0.03mg/ml。
2.本发明提供的fpy对酪氨酸单酚酶及二酚酶的抑制类型,结果显示,随着fpy浓度的增加,vmax值不变,而km值增大,因此,fpy对酪氨酸酶单酚酶的抑制作用类型为竞争性可逆抑制,抑制常数ki=22.04mmol/l;fpy对酪氨酸酶二酚酶的抑制作用类型为竞争性可逆抑制,抑制常数ki=4.82mmol/l。
3.本发明提供的fpy在主要胃肠蛋白酶消化后,其对酪氨酸单酚酶及二酚酶的ic50值分别为0.48±0.02mg/ml、1.38±0.04mg/ml,与消化前相比无明显差异。rp-hplc鉴定结果显示,fpy消化前后的保留时间、峰面积和峰高并无明显变化,表明酪氨酸酶抑制肽fpy具有良好的体外消化稳定性。
附图说明:
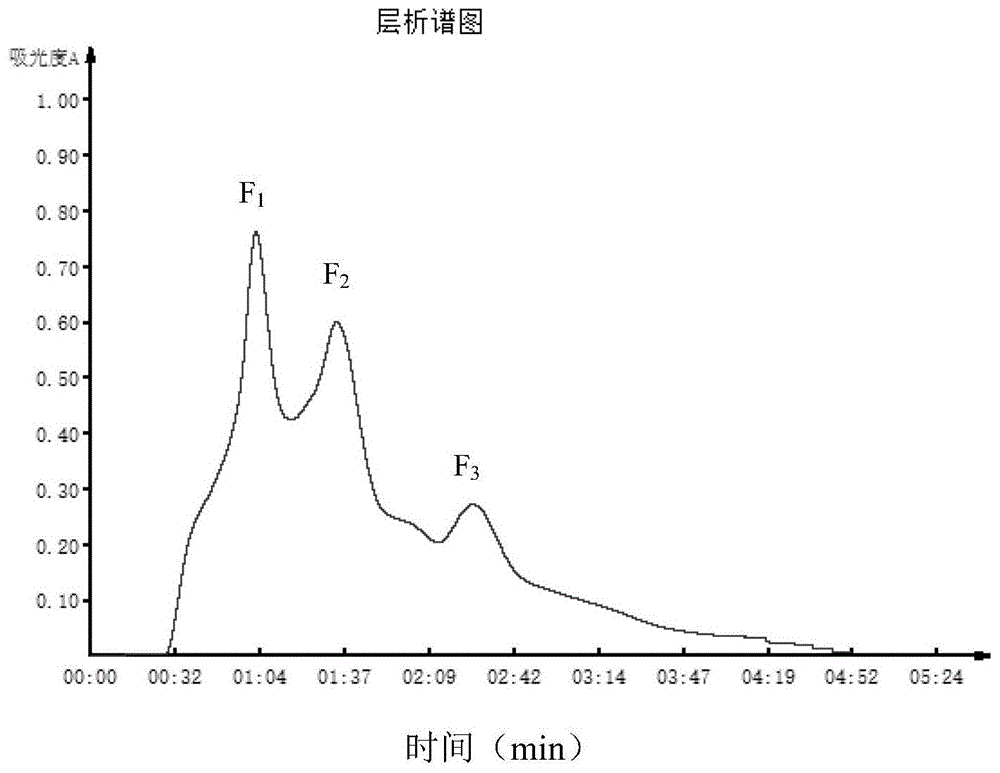
图10-3kda分子量多肽的sephadexg-25层析色谱图;
图2总离子流图;
图3fpy的3d结构图;
图4fpy质谱分析图;
图5酪氨酸酶(2y9x)的3d结构图;
图6fpy与酪氨酸酶的相互作用;
其中,a:立体图;b:平面图;
图7fpy对酪氨酸酶活性的影响;
图8不同浓度fpy对酪氨酸单酚酶的催化活性与酶浓度的关系;
图9fpy对酪氨酸单酚酶的抑制类型和抑制常数的测定;
图10不同浓度fpy对酪氨酸二酚酶的催化活性与酶浓度的关系;
图11fpy对酪氨酸二酚酶的抑制类型和抑制常数的测定;
图12消化前fpy反相高效液相色谱图;
图13消化后fpy反相高效液相色谱图。
具体实施方式:
为了使本专利的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本专利进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本专利,并不用于限定本发明。
本发明所述的酪氨酸酶抑制多肽fpy可以从核桃粕中提取,也可通过人工合成的方法获取,以下将以从核桃粕中提取酪氨酸酶抑制多肽fpy以及人工合成多肽fpy验证酶学特性为例对本发明进行解释说明。
实施例1酪氨酸酶抑制多肽fpy的提取
1、核桃粕蛋白的制备
核桃粕粉碎过40目筛,以1∶5的料液比加入石油醚抽提2h,过滤,收集残渣,连续提取3次,置于通风橱中挥干有机溶剂,即得核桃粕脱脂粉,于4℃条件下保存备用。
准确称取10g核桃粕脱脂粉于400ml的烧杯中,加入200ml的蒸馏水,调节ph至10.0,在磁力搅拌器上搅拌5min,然后超声处理20min,超声结束后立即取出,静置1h,6000r/min离心20min,取上清液备用。用1mol/l的hcl调节ph至4.5,静置1h,6000r/min离心20min,得到核桃粕蛋白沉淀,用1mol/lnaoh调ph值至7.0,得到核桃粕蛋白,真空冷冻干燥备用。
2、多肽的制备
将制备的核桃粕蛋白冻干粉以1∶20的料液比(w/v)与蒸馏水混合,并在90℃条件下预煮30min。预煮结束后,待温度降至60℃,以1mol/l的naoh溶液将ph值调至10.0,添加5%(w/w)碱性蛋白酶水解核桃粕蛋白溶液5h。水解过程中通过加入1mol/l的naoh溶液使反应的ph始终保持在10.0。酶解结束后,煮沸10min以终止酶促反应,以1mol/l的hcl溶液将ph调至蛋白质等电点以去除大分子蛋白质,6000r/min离心20min,取上清液并将ph调至7.0,冻干备用。
核桃粕多肽经过超滤后得到不同分子量范围(0-3kda、3-5kda、5-10kda、>10kda)的多肽组分,以熊果苷(一种已知的高效酪氨酸酶抑制剂)为阳性对照,分别测定各多肽组分对酪氨酸单酚酶及二酚酶的抑制率,并计算ic50值,结果如表1所示。
表1不同分子量多肽对酪氨酸单酚酶及二酚酶的ic50
由表1可见,核桃粕多肽超滤组分中多肽分子量越小,其对酪氨酸单酚酶和二酚酶的ic50值越小,即对酪氨酸酶活性的抑制效果越好。分子量在0-3kda的核桃粕多肽组分对酪氨酸单酚酶和二酚酶的抑制活性显著高于其他组分,但低于阳性对照组,其ic50值分别为3.52±0.03mg/ml、2.65±0.04mg/ml。因此,进一步采用sephadexg-25凝胶层析方法从分子量范围在0-3kda的核桃多肽组分中分离酪氨酸酶抑制活性更高的核桃粕多肽组分。
3、sephadexg-25凝胶层析后多肽的酪氨酸酶抑制率
分子量在0-3kda的核桃粕多肽组分经过sephadexg-25凝胶层析后得到三个组分(f1、f2、f3),如图1所示,分别收集各多肽组分,冻干备用。以熊果苷(一种已知的高效酪氨酸酶抑制剂)为阳性对照,分别测定各多肽组分对酪氨酸单酚酶及二酚酶的抑制率,并计算ic50值,结果如表2所示。
表2凝胶层析后多肽组分对酪氨酸单酚酶及二酚酶的ic50
由表2可知,f1多肽组分对酪氨酸单酚酶和二酚酶的抑制活性显著高于其他组分,但低于阳性对照组,其ic50值分别为1.43±0.05mg/ml、1.72±0.02mg/ml。所以f1多肽组分对酪氨酸酶活性的抑制效果最好,进一步采用lc-ms/ms确定f1多肽组分的氨基酸序列及分子量分布。
4、核桃粕多肽液质分析
本实验采用lc-ms/ms对sephadexg-25层析纯化后的f1多肽组分进行结构鉴定,其总离子流图如图2所示。经过lc-ms/ms分析,酪氨酸酶抑制活性多肽f1组分中氨基酸个数在10个以下的多肽结构存在606个,为了进一步筛选具有更高活性的核桃粕酪氨酸酶抑制肽,对lc-ms/ms鉴定得到的多肽序列与酪氨酸酶(pdb:2y9x)进行虚拟筛选,根据打分结果确定对酪氨酸酶抑制作用最好的核桃粕多肽序列,并进行单个多肽分子对接观察具体结合位点和结合方式。
分子对接结果:
将lc-ms/ms分析鉴定得到的氨基酸个数少于10的606个核桃粕多肽与酪氨酸酶(2y9x)进行分子对接,其中对接能最低的10种核桃粕多肽其氨基酸序列和对接能如表3所示。
表3核桃粕多肽与酪氨酸酶分子对接结果
由表3可知,fpy(phe-pro-tyr)的对接能最低,为-8.2kcal/mol,表明fpy与酪氨酸酶活性中心结合的最稳定。
fpy的3d结构见图3。
fpy的质谱分析图见图4,图中最右边为三肽fpy的离子峰,其相对分子量大小为498.23da,其它峰为fpy的碎片离子峰。
酪氨酸酶2y9x的3d结构图如图5所示,可以看出该酶由8条链组成。为阐明肽fpy的酪氨酸酶抑制机制,分别以酪氨酸酶2y9x为受体,三肽fpy为配体进行分子对接,结果显示,“-cdocker_interaction_energy”值为40.183kcal/mol,表明两者之间可以紧密结合。
图6显示了酪氨酸酶与三肽fpy之间相互作用的立体图和平面图(a为立体图,b为平面图),由相互作用图可以看出,作为配体的三肽fpy主要对接在受体蛋白酪氨酸酶2y9x的凹槽中,它们之间的相互作用主要有三类:氢键、疏水相互作用、静电相互作用。
在三肽fpy和酪氨酸酶2y9x的结合中,主要形成了四个氢键,其中,酪氨酸酶的asn81上的hd22和fpy中tyr上的o15形成氢键,键长为
酪氨酸酶的his259上的ne2和fpy中的phe可以产生静电相互作用,加强两者之间的结合。
疏水相互作用主要包括五个,其中,酪氨酸酶的val283上的hg22可以和fpy中phe形成疏水相互作用,酪氨酸酶的his263可以和fpy中phe形成疏水相互作用,酪氨酸酶的ser282上的c、o以及val283上的n可以和fpy中phe形成疏水相互作用,fpy中的phe可以和酪氨酸酶的ala286形成疏水相互作用。
这些结果表明,多肽fpy与酪氨酸酶(2y9x)之间具有较强的相互作用,这可能导致其具有较强的酪氨酸酶抑制活性。
实施例2人工合成短肽fpy酶抑制动力学性质
申请人委托公司合成短肽fpy,并对酶抑制动力学性质进行检测,具体如下:
1、fpy对酪氨酸酶的半抑制浓度
以l-酪氨酸或l-多巴为底物,用磷酸盐缓冲液将人工合成短肽fpy配制成不同浓度的溶液用于研究其对酪氨酸酶活性的影响。在总体积为200μl的反应体系中,固定底物l-酪氨酸或l-多巴的浓度,加入一定量的酪氨酸酶,反应后测定不同浓度的fpy对酪氨酸酶催化活性的影响,以酪氨酸酶抑制率对fpy浓度绘制剂量响应曲线,依据回归方程计算fpy对酪氨酸酶的ic50值。
人工合成短肽fpy对酪氨酸酶的抑制具有剂量依赖性,如图7所示,随着fpy浓度的增加,酪氨酸单酚酶和二酚酶抑制率迅速上升,酪氨酸单酚酶和二酚酶的活性与抑制剂分子(fpy)浓度直接相关,人工合成短肽fpy对酪氨酸酶的抑制作用随fpy浓度升高而抑制作用明显。
根据fpy对酪氨酸酶抑制曲线计算ic50值,如表4所示,可得人工合成短肽fpy对酪氨酸单酚酶和二酚酶的ic50值分别为:0.47±0.01mg/ml、1.37±0.03mg/ml。
表4fpy对酪氨酸单酚酶及二酚酶的半抑制浓度
2、fpy对酪氨酸酶的抑制作用
在总体积为200μl的反应体系中,固定底物l-酪氨酸或l-多巴浓度,改变酪氨酸酶的浓度,加入不同浓度的人工合成短肽fpy,分别测定不同浓度fpy对酪氨酸单酚酶及二酚酶的催化活性与酶浓度的关系。以酪氨酸单酚酶或二酚酶浓度为横坐标,酶活力为纵坐标绘制曲线。
2.1fpy对酪氨酸单酚酶的抑制作用
固定底物(l-酪氨酸)浓度8.2mmol/l,加入不同浓度的酪氨酸酶,测定不同浓度的人工合成短肽fpy对酪氨酸单酚酶催化活性的影响。如图8所示,在不同fpy浓度下,酶浓度对酶活性的曲线是一组通过原点的直线,增加fpy的浓度导致直线的斜率下降,表明人工合成短肽fpy对酪氨酸单酚酶的抑制是可逆的,即fpy的存在不会降低有效酶的量,但会导致酶活性的抑制和下降。
2.2fpy对酪氨酸单酚酶的抑制作用类型和抑制常数
使用lineweaver-burk双倒数作图法更详细地研究fpy对酪氨酸酶的抑制机制。如图9所示,在不同fpy浓度下,底物浓度的倒数1/[s]对酶促反应速度的倒数1/v0的结果显示,具有不同斜率的四条直线在纵坐标的相同点处相交,即增加fpy浓度导致一系列直线在1/v0轴上具有共同截距但具有不同的斜率。随着fpy浓度的增加,vmax值不变,而km值增大,表明人工合成三肽fpy是酪氨酸单酚酶的竞争性抑制剂,即只与游离酶结合,而不与酶底物复合物结合。通过绘制斜率与相应fpy浓度的关系曲线,确定fpy的抑制常数ki为22.04mmol/l。
fpy对酪氨酸二酚酶的抑制动力学参数如表5所示。
表5fpy对酪氨酸单酚酶的抑制动力学参数
2.3fpy对酪氨酸二酚酶的抑制作用
固定底物(l-dopa)浓度7.6mmol/l,加入不同浓度的酪氨酸酶,测定不同浓度的人工合成短肽fpy对酪氨酸二酚酶催化活性的影响。如图10所示,在不同fpy浓度下,酶浓度对酶活性的曲线是一组通过原点的直线,增加fpy的浓度导致直线的斜率下降,表明人工合成短肽fpy对酪氨酸二酚酶的抑制是可逆的,即fpy的存在不会降低有效酶的量,但会导致酶活性的抑制和下降。
2.4fpy对酪氨酸二酚酶的抑制作用类型和抑制常数
如图11所示,在不同fpy浓度下,底物浓度的倒数1/[s]对酶促反应速度的倒数1/v0的结果显示,具有不同斜率的四条直线在纵坐标的相同点处相交。即增加fpy浓度导致一系列直线在1/v0轴上具有共同截距但具有不同的斜率。随着fpy浓度的增加,vmax值不变,而km值增大,表明人工合成三肽fpy是酪氨酸二酚酶的竞争性抑制剂,即只与游离酶结合,而不与酶底物复合物结合。通过绘制斜率与相应fpy浓度的关系曲线,确定fpy的抑制常数ki为4.82mmol/l。
fpy对酪氨酸二酚酶的抑制动力学参数如表6所示。
表6fpy对酪氨酸二酚酶的抑制动力学参数
实施例3人工合成短肽fpy消化稳定性分析
根据ao等人所述方法进行了两阶段水解(ao,li,2013):以人工合成短肽fpy水溶液(10mg/ml)为原料制备水解产物。fpy水溶液先用胃蛋白酶恒温振荡水解2h,酶底比为1∶50,温度为37℃,ph值为2.0。胃蛋白酶消化结束后,用胰蛋白酶恒温振荡水解4h,酶底比为1∶25,温度为37℃,ph值为7.5。胰蛋白酶消化结束后,反应液在95℃水浴加热10min停止反应,然后冷却至室温,离心除去酶,-20℃保存备用。
为了进一步研究模拟消化过程中酪氨酸酶抑制肽fpy消化产物的酪氨酸单酚酶及二酚酶抑制活性变化及结构变化,利用酶标比色法测定消化前后fpy对酪氨酸单酚酶及二酚酶的抑制活性,并利用rp-hplc系统比较人工合成短肽fpy消化前后的结构变化。
如表7所示,fpy在主要胃肠蛋白酶消化后,其对酪氨酸单酚酶及二酚酶的ic50值分别为0.48±0.02mg/ml、1.38±0.04mg/ml,与消化前相比无明显差异。
表7fpy在主要胃肠蛋白酶消化下的稳定性
图12为消化前fpy反相高效液相色谱图,图13为消化后fpy反相高效液相色谱图,rp-hplc鉴定结果显示,fpy消化前后的保留时间、峰面积和峰高并无明显变化,说明酪氨酸酶抑制肽fpy具有良好的体外消化稳定性。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本专利构思的前提下,上述各实施方式还可以做出若干变形、组合和改进,这些都属于本专利的保护范围。因此,本专利的保护范围应以权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!