一种亲水性短肽的纯化方法与流程
本发明涉及纯化方法,具体涉及一种亲水性短肽的纯化方法。
背景技术:
近年来,一些活性多肽被发现,例如富含精氨酸的穿膜肽等,这些多肽有几个共同的特点:1.肽链较短,一般少于30个氨基酸的长度,比较常见的如二肽、三肽等;2.含有较多的亲水氨基酸(精氨酸、赖氨酸、组氨酸、谷氨酸等),这些氨基酸在纯化时处理出现了一些问题,由于极性比较大,在反相制备柱中保留效果比较差,所以样品的分离效果也比较差。
目前多肽的合成一般采用的是固相合成的方法,通过boc法或者fmoc法把氨基酸依多肽序列偶联在一起,所以合成的粗品中可能会含有和目标肽性质极其相近的残肽,这样的残肽和目标多肽一般比较难以分离开来。
反相色谱纯化多肽的方法已经比较成熟,但还是存在不尽如人意的方面,例如上面所述的两种情况。所以开发其他纯化方法具有现实意义。
离子交换层析(ionexchangechromatography简称为iec)是以离子交换剂为固定相,依据流动相中的组分离子与交换剂上的平衡离子进行可逆交换时的结合力大小的差别而进行分离的一种层析方法。离子交换层析中,基质是由带有电荷的树脂或纤维素组成。带有正电荷的称之阴离子交换树脂;而带有负电荷的称之阳离子树脂。离子交换层析同样可以用于蛋白质和多肽的分离纯化。由于多肽有等电点,当蛋白质处于不同的ph条件下,其带电状况也不同。阴离子交换基质结合带有负电荷的多肽,所以这类多肽被留在柱子上,然后通过提高洗脱液中的盐浓度等措施,将吸附在柱子上的多肽洗脱下来。结合较弱的多肽首先被洗脱下来。反之阳离子交换基质结合带有正电荷的多肽,结合的多肽可以通过逐步增加洗脱液中的盐浓度或是提高洗脱液的ph值洗脱下来。
含有多个碱性氨基酸的短肽纯化比较困难,是由于多肽本身的性质决定的,在纯化过程中不容易在常规的反相柱中有保留,而且,由于比较亲水,使用乙醚或石油醚将其从切割液中析出比较困难。目前对这类多肽的制备方法报道很少,一般采用反相制备的延长柱子长度,改变填料的方法纯化得到成品,但该方法只能有限的增加短肽保留时间,而且会一定程度造成柱子的损坏,成本消耗较高。有鉴于上述的缺陷,本设计人,积极加以研究创新,以期创设一种亲水性短肽的纯化方法,能够提高多肽的收率,使其更具有产业上的利用价值。
技术实现要素:
本发明要解决的技术问题是提供一种亲水性短肽的纯化方法,其亲水性短肽容易析出,在反相色谱中保留能力强,纯化后的纯度高。
为了解决上述技术问题,本发明提供了一种亲水性短肽的纯化方法,包括以下步骤:
s1,切割液后处理:
a.在无法析出亲水性短肽的三氟乙酸切割液中,加入0.1~10倍体积的水,液氮预冻后上冻干机,直至冻干瓶中出现固体;
b.而后加入适量的0.1%三乙胺溶液调节ph到5~7,获得中和后的多肽溶液。
s2,凝胶色谱脱盐换盐:
c.将多肽溶液上样到凝胶柱中,总上样量为1~10倍凝胶柱的体积;
d.选用1~5倍凝胶柱体积的无盐水或ph为4~5的0.1%醋酸-乙酸铵作为洗脱液进行洗脱冲洗;
e.洗脱后收集各组分,质谱确认目标峰后作为凝胶柱收集液。
s3,离子交换色谱纯化:
f.将阳离子树脂置入交换柱中,先用水浸洗,直至浸洗水不带颜色和泡沫;
g.选用4~5%的hcl和naoh在交换柱中依次交替浸泡2~4小时,浸泡后,分别用水冲洗至流出水的ph呈中性为止;
h.最后用4~5%的hcl将树脂改变为h+型;
i.将凝胶柱收集液加入到交换柱中,依次用0、0.1、0.2、0.5m氯化钠溶液洗脱,收集洗脱液,即为纯化后的多肽。
作为优选的,步骤b包括以下步骤:
加入适量的0.1%三乙胺溶液调节ph到6,获得中和后的多肽溶液。
作为优选的,步骤c中所述凝胶柱为凝胶柱pd-10或凝胶柱g-25。
作为优选的,步骤c中所述总上样量为1.5或2倍凝胶柱的体积。
作为优选的,步骤e包括以下步骤:
洗脱后收集各组分,经质谱确认后,将纯度大于90%的组分收集在一起,作为凝胶柱收集液。
作为优选的,阳离子树脂为阳离子树脂d001或阳离子树脂001*7。
作为优选的,所述凝胶柱中的凝胶为交联葡聚糖和/或交联琼脂糖。
作为优选的,所述阳离子树脂为磺酸根树脂。
作为优选的,包括以下步骤:
s1,切割液后处理:
a.在无法析出亲水性短肽的三氟乙酸切割液中,加入相同体积的双蒸水,液氮预冻后上冻干机,冻干两天后,重复加水冻干,直至三氟乙酸基本去除;
b.而后加入适量的0.1%三乙胺溶液调节ph到6,获得中和后的多肽溶液。
s2,凝胶色谱脱盐换盐:
c.将多肽溶液上样到凝胶柱pd-10中,总上样量为2倍凝胶柱的体积,流速为3ml/min;
d.选用1~5倍凝胶柱体积的且ph为4~5的0.1%醋酸-乙酸铵作为洗脱液进行洗脱冲洗;
e.洗脱后收集各组分,经质谱确认后,将纯度大于90%的组分收集在一起,作为凝胶柱收集液。
s3,离子交换色谱纯化:
f.将阳离子树脂d001置入交换柱中,先用水浸洗,直至浸洗水不带颜色和泡沫;
g.用4~5%的hcl和naoh在交换柱中依次交替浸泡2~4小时,浸泡后,分别用水冲洗至水的ph呈中性为止;
h.最后用4~5%的hcl将树脂改变为h+型;
i.将凝胶柱收集液加入到阳离子交换柱中,依次用0、0.1、0.2、0.5m氯化钠溶液洗脱,收集洗脱液,即为纯化后的多肽。
作为优选的,包括以下步骤:
s1,切割液后处理:
a.在无法析出亲水性短肽的三氟乙酸切割液中,加入相同体积的双蒸水,液氮预冻后上冻干机,冻干两天后,重复加水冻干,直至三氟乙酸基本去除;
b.而后加入适量的0.1%三乙胺溶液调节ph到7,获得中和后的多肽溶液。
s2,凝胶色谱脱盐换盐:
c.将多肽溶液上样到凝胶柱g-25中,总上样量为1.5倍凝胶柱的体积,流速为3ml/min;
d.选用1~5倍凝胶柱体积的且ph为4~5的0.1%醋酸-乙酸铵作为洗脱液进行洗脱冲洗;
e.洗脱后收集各组分,经质谱确认后,将纯度大于90%的组分收集在一起,作为凝胶柱收集液。
s3,离子交换色谱纯化:
f.将阳离子树脂001*7置入交换柱中,先用水浸洗,直至浸洗水不带颜色和泡沫;
g.用4~5%的hcl和naoh在交换柱中依次交替浸泡2~4小时,浸泡后,分别用水冲洗至水的ph呈中性为止;
h.最后用4~5%的hcl将树脂改变为h+型;
i.将凝胶柱收集液加入到阳离子交换柱中,依次用0、0.1、0.2、0.5m氯化钠溶液洗脱,收集洗脱液,即为纯化后的多肽。
与现有技术相比,本发明的有益效果是:
1、本发明提供了一种纯化亲水性短肽的简便方法,在这一类多肽纯化中能够得到广泛的应用,在纯化过程中,能够在普通反相柱中保留多肽,放大多肽的生产,得到的产品纯度高,尤其是对于含有碱性氨基酸的个数超过总氨基酸个数的60%的短肽或分子量小于1000da且含有2个以上碱性氨基酸的短肽,其纯化效果更为优良。
2、本发明降低了样品在反相柱中的质量变化,提高了产品的收率,生产周期缩短,降低了能耗和生产成本,能够一步实现产品的纯化,快速、简便、高效、温和。
3、本发明通过对三氟乙酸冻干和中和,解决了三氟乙酸溶液对普通反相柱的损害,减少了财产损失,降低了成本。
4、作为本发明的进一步改进,上述亲水性多肽为含有碱性氨基酸的短肽,碱性氨基酸的个数超过总氨基酸个数的60%
附图说明
为了更清楚的说明本发明实施例技术中的技术方案,下面将对实施例技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还能够根据这些附图获得其他的附图。
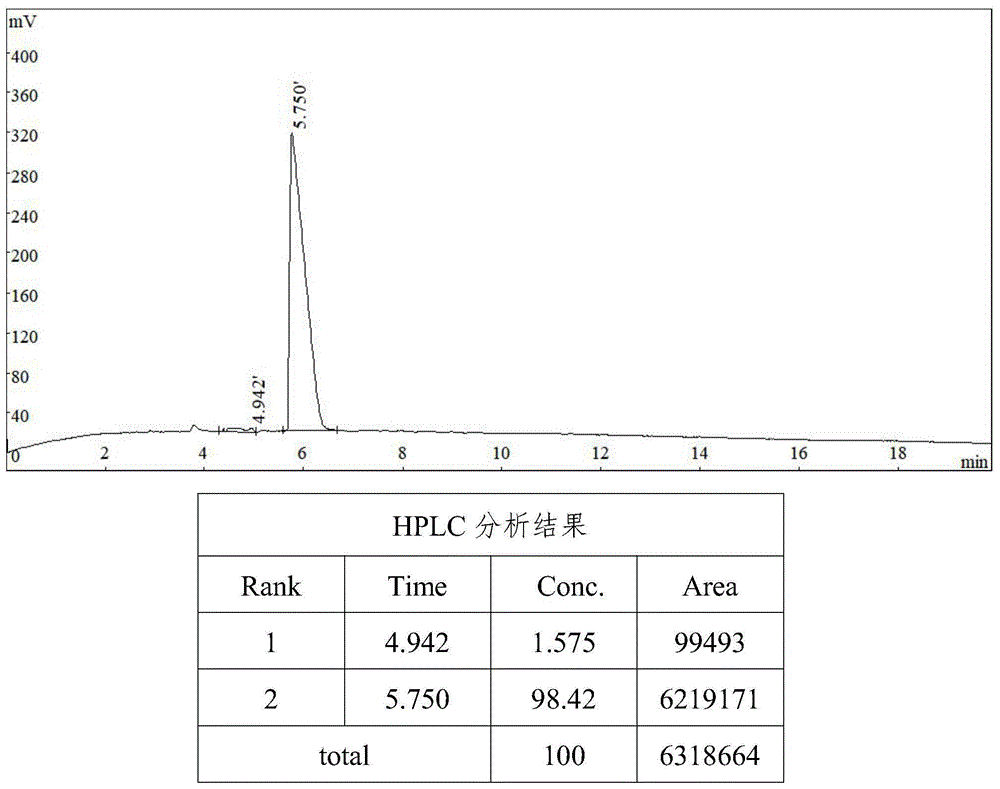
图1为hhhd以实施例1纯化后的测试结果;
图2为kke以实施例2纯化后的测试结果。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本实用型中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
本发明公开了一种亲水性短肽的纯化方法,包括以下步骤:
s1,切割液后处理:
a.在无法析出亲水性短肽的三氟乙酸切割液中,加入0.1~10倍体积的水,液氮预冻后上冻干机,直至冻干瓶中出现固体;
b.而后加入适量的0.1%三乙胺溶液调节ph到5~7,获得中和后的多肽溶液。
s2,凝胶色谱脱盐换盐:
c.将多肽溶液上样到凝胶柱中,总上样量为1~10倍凝胶柱的体积;
d.选用1~5倍凝胶柱体积的无盐水或ph为4~5的0.1%醋酸-乙酸铵作为洗脱液进行洗脱冲洗;
e.洗脱后收集各组分,质谱确认目标峰后作为凝胶柱收集液。
s3,离子交换色谱纯化:
f.将阳离子树脂置入交换柱中,先用水浸洗,直至浸洗水不带颜色和泡沫;
g.选用4~5%的hcl和naoh在交换柱中依次交替浸泡2~4小时,浸泡后,分别用水冲洗至流出水的ph呈中性为止;
h.最后用4~5%的hcl将树脂改变为h+型;
i.将凝胶柱收集液加入到交换柱中,依次用0、0.1、0.2、0.5m氯化钠溶液洗脱,收集洗脱液,即为纯化后的多肽。
作为本发明的进一步改进,上述凝胶柱中的凝胶为交联葡聚糖和/或交联琼脂糖。
作为本发明的进一步改进,上述阳离子树脂为磺酸根树脂。
实施例2
s1,切割液后处理:
b.在无法析出亲水性短肽的三氟乙酸切割液中,加入相同体积的双蒸水,液氮预冻后上冻干机,冻干两天后,重复以上操作,直至三氟乙酸基本去除;
b.而后加入适量的0.1%三乙胺溶液调节ph到6,获得中和后的多肽溶液。
s2,凝胶色谱脱盐换盐:
c.将多肽溶液上样到凝胶柱pd-10中,总上样量为2倍凝胶柱的体积,流速为3ml/min;
d.选用1~5倍凝胶柱体积的且ph为4~5的0.1%醋酸-乙酸铵作为洗脱液进行洗脱冲洗;
e.洗脱后收集各组分,经质谱确认后,将纯度大于90%的组分收集在一起,作为凝胶柱收集液。
s3,离子交换色谱纯化:
f.将阳离子树脂d001置入交换柱中,先用水浸洗,直至浸洗水不带颜色和泡沫;
g.用4~5%的hcl和naoh在交换柱中依次交替浸泡2~4小时,浸泡后,分别用水冲洗至水的ph呈中性为止;
h.最后用4~5%的hcl将树脂改变为h+型;
i.将凝胶柱收集液加入到阳离子交换柱中,依次用0、0.1、0.2、0.5m氯化钠溶液洗脱,收集洗脱液,即为纯化后的多肽。
实施例3
s1,切割液后处理:
a.在无法析出亲水性短肽的三氟乙酸切割液中,加入相同体积的双蒸水,液氮预冻后上冻干机,冻干两天后,重复以上操作,直至三氟乙酸基本去除;
b.而后加入适量的0.1%三乙胺溶液调节ph到7,获得中和后的多肽溶液。
s2,凝胶色谱脱盐换盐:
c.将多肽溶液上样到凝胶柱g-25中,总上样量为1.5倍凝胶柱的体积,流速为3ml/min;
d.选用1~5倍凝胶柱体积的且ph为4~5的0.1%醋酸-乙酸铵作为洗脱液进行洗脱冲洗;
e.洗脱后收集各组分,经质谱确认后,将纯度大于90%的组分收集在一起,作为凝胶柱收集液。
s3,离子交换色谱纯化:
f.将阳离子树脂001*7置入交换柱中,先用水浸洗,直至浸洗水不带颜色和泡沫;
g.用4~5%的hcl和naoh在交换柱中依次交替浸泡2~4小时,浸泡后,分别用水冲洗至水的ph呈中性为止;
h.最后用4~5%的hcl将树脂改变为h+型;
i.将凝胶柱收集液加入到阳离子交换柱中,依次用0、0.1、0.2、0.5m氯化钠溶液洗脱,收集洗脱液,即为纯化后的多肽。
纯化测试
质谱确认目标峰后,采用反相高效液相色谱检测。
以实施例1中的方法和条件,对hhhd(his-his-his-asp)进行纯化,其检测条件为:检测柱为innovalods-2,5μm,4.6*250mm;流动相a液为0.05%~0.2%三氟乙酸的水溶液,流动相b液为乙腈,a:b为99:1到95:5;时间:0~20min;流速:1.00ml/min;波长:220nm;进样量为20μl;梯度检测的检测器为紫外检测器。得到图1中的结果,可以看到,其纯度为98.42%。
以实施例2中的方法和条件,对kke(lys-lys-glu)进行纯化,其检测条件为:检测柱为innovalods-2,5μm,4.6*250mm;流动相a液为0.05%-0.2%三氟乙酸的水溶液,流动相b液为乙腈,a:b为99:1到90:10;时间:0~20min;流速:1.00ml/min;波长:220nm;进样量为20μl;梯度检测的检测器为紫外检测器。得到图2中的结果,可以看到,其纯度为99.14%。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理能够在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!