一种产蛋白酶的乔治亚海杆菌及其应用的制作方法
本发明属于生物技术领域,具体地说,本发明涉及一种产蛋白酶的乔治亚海杆菌及其应用。
背景技术:
蛋白酶是水解蛋白质的酶类,被广泛应用于生态环境治理等领域。蛋白酶包括植物、动物和微生物蛋白酶,而其中,由于微生物生长的高效率,微生物蛋白酶易大规模发酵生产,因此微生物蛋白酶越来越成为主要制备来源。
蛋白酶占酶制剂市场份额的65%以上,其中微生物产蛋白酶占据世界工业酶总量的约40%。蛋白酶主要用于加酶洗涤剂,另外还可以应用于食品、医疗、制革、丝绸等行业。由于蛋白酶的广泛用途以及产酶效率不高等原因,我国的蛋白酶主要依赖进口。
我国是一个海洋大国,海洋面积广阔,资源丰富。海洋微生物是海洋中生物资源的重要组成部分,种类可达2~10亿种,但人们所开发利用的还不足其中的1%。我国海洋微生物资源的探索、研究和利用正逐步追赶发达国家。因此,探索并利用海洋来源的产蛋白酶微生物具有极高的研究、应用以及商业价值。
本领域技术人员致力于开发新型的蛋白酶生产菌株及蛋白酶,一方面希望提高蛋白酶的生产效率,另一方面期望获得具有不同特性的蛋白酶以满足不同应用领域的需求。
技术实现要素:
本发明的目的在于提供一种产蛋白酶的乔治亚海杆菌(marinobacteriumgeorgiense)及其应用。
在本发明的第一方面,提供了一种产蛋白酶的微生物菌株,所述微生物菌株为:
菌株1:乔治亚海杆菌(marinobacteriumgeorgiense)x-18,保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏编号为cgmccno.17511;或
菌株2:所述菌株2为菌株1的衍生菌株,比如,菌株1经基因突变或基因工程改造获得的菌株。
本发明的第二方面,提供了一种蛋白酶,所述蛋白酶由乔治亚海杆菌(marinobacteriumgeorgiense)发酵制得。
在另一优选例中,所述蛋白酶由本发明第一方面所述的微生物菌株发酵制得。
本发明的第三方面,提供了一种制备蛋白酶的方法,所述方法包括步骤:
(1)发酵本发明第一方面所述的微生物菌株;
(2)从发酵液中分离获得蛋白酶。
在另一优选例中,所述步骤(1)中,发酵使用的碳源为可溶性淀粉、蔗糖、或麦芽糖。
在另一优选例中,所述步骤(1)中,发酵温度25-35℃,优选为约30℃。
在另一优选例中,所述步骤(1)中,发酵起始ph为6.0-7.5;优选为约7.0。
在另一优选例中,所述步骤(1)中,发酵盐度为5‰-20‰(w/w);优选为约15‰(w/w)。
本发明的第四方面,提供了一种生物酶制剂,所述生物酶制剂包括本发明第二方面所述的蛋白酶。
在另一优选例中,所述生物酶制剂还包括选自下组的一种或多种生物酶:
木聚糖酶、果胶酶、脂肪酶、纤维素酶、和酯酶。
在另一优选例中,所述生物酶制剂为固体颗粒。
在另一优选例中,所述生物酶制剂为液体制剂。
本发明第五方面,提供了乔治亚海杆菌(marinobacteriumgeorgiense)在制备蛋白酶中的应用。
在另一优选例中,所述乔治亚海杆菌(marinobacteriumgeorgiense)为本发明第一方面所述的微生物菌株。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
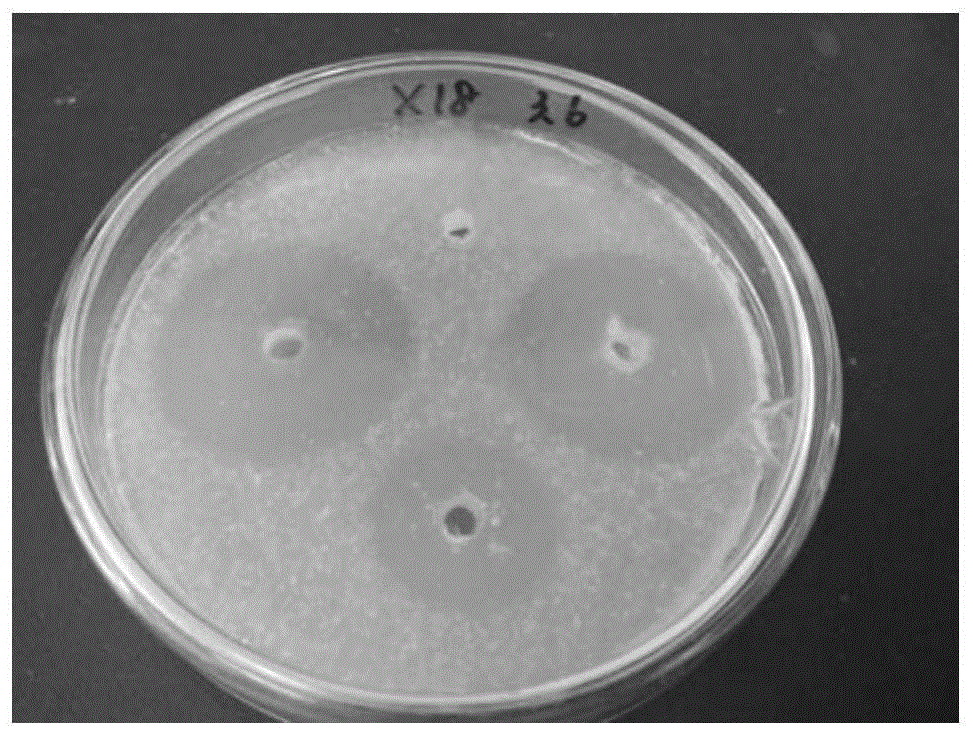
图1:x-18菌株酪蛋白酶培养基上筛选透明圈。
图2:菌株电镜照片。
图3:x-18菌株生长曲线。
图4:碳源对x-18菌株生长的影响。
图5:培养基初始ph值对x-18菌株生长的影响。
图6:培养基盐度对x-18菌株生长的影响。
图7:培养温度对x-18菌株生长的影响。
图8:酪氨酸标准曲线。
具体实施方式
本发明人通过广泛而深入的研究,获得一株来自藤壶附生菌的乔治亚海杆菌(marinobacteriumgeorgiense)x-18,其具有较高的蛋白酶生产能力,在初步优化的发酵条件下发酵液蛋白酶酶活力能够达到240.00u/ml;并且,x-18菌株产蛋白酶对金属离子的耐受能力较强,对铬离子表现出了及其优异的耐受性,因此,x-18菌株产蛋白酶特别适用于制革工业。
在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,本发明的范围将仅由所附的权利要求书限制。
除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
虽然在本发明的实施或测试中可以使用与本发明中所述相似或等价的任何方法和材料,本文在此处例举优选的方法和材料。
如本文所用,术语“本发明菌株”指保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏编号为cgmccno.17511的菌株或由该菌株得到的衍生菌株,其中包括经传代培养得到的菌株。
藤壶(balanus),是附着在海边岩石上的簇状灰色、硬质外壳的滤食性节肢动物。主要捕食浮游动物中的桡脚类及蔓足类的幼体。其食物来源中含大量蛋白类物质,因此,本发明人猜想藤壶附生菌中存在产蛋白酶菌株,以帮助其消化、利用食物。
本发明菌株是如下获得的:
(a)自山东沿海污染海域的纹藤壶分离附生菌;
(b)对分离获得的附生菌菌株进行筛选,成功地筛选到一株蛋白酶活性优异的菌株,即本发明的乔治亚海杆菌(marinobacteriumgeorgiense)x-18。
菌种保藏
本发明的上述菌种已于2019年4月2日保藏在中国微生物菌种保藏管理委员会普通微生物中心(chinageneralmicrobiologicalculturecollectioncenter,cgmcc),地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmccno.17511,名称为:乔治亚海杆菌(marinobacteriumgeorgiense)x-18。
本发明的主要优点在于:
(1)乔治亚海杆菌(marinobacteriumgeorgiense)x-18具有较高的蛋白酶生产能力,在初步优化的发酵条件下,x-18菌株产蛋白酶酶活力能够达到240.00u/ml;
(2)x-18菌株产蛋白酶具有较宽的ph适应范围,在ph7.5-11.0范围内能够保留90%以上的酶活力。
(3)x-18菌株产蛋白酶对金属离子的耐受能力较强,对铬离子表现出了及其优异的耐受性,因此,x-18菌株产蛋白酶特别适用于制革工业。
下面结合具体实施例,进一步详陈本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如美国sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
实施例1产蛋白酶菌株的筛选和培养条件的优化
1.1材料与试剂
1.1.1材料
纹藤壶:山东省威海市黄海沿海污染海域(北纬37°31′59″,东经122°3′43″);河豚毒素假交替单胞菌(pseudoalteromonastetraodonis);乔治亚海杆菌(marinobacteriumgeorgiense);杀鱼假交替单胞菌(pseudoalteromonaspiscicida);康氏菌(kangiellajaponica)。
1.1.2试剂
福林试剂:美国sigma公司;其他化学试剂为分析纯,生物试剂为生物纯。
1.1.3培养基
富集培养基、种子培养基、发酵培养基:2216e液体培养基;平板分离固体培养基:2216e固体培养基;酪蛋白酶(casease)培养基。
1.3方法
1.3.1样品的采集
样品采集于于威海黄海污染海域岸边礁石上,对样品采用无菌采集。
1.3.2样品的处理
将纹藤壶机体剥离,均质30s,接种在富集培养液。置28℃、110r/min震荡培养,分别于第0、7、12、24、36d涂布展开。
1.3.3纹藤壶附生菌的分离纯化
富集培养液进行10-1~10-n梯度稀释,分别将菌液用涂布棒涂布于分离固体培养基平板上,28℃下恒温培养48h,依菌落形态筛选目标菌。
1.3.4高产蛋白酶菌株的筛选
制备纯化菌株的菌悬液,将20ul菌液加入到已点孔的含有1%的酪蛋白酶培养基平板上,
使用蛋白酶为阳性对照,ph7.2的缓冲液为阴性对照。测量蛋白酶水解圈直径。
1.3.5高产蛋白酶菌株的电镜超薄切片观察及鉴定
菌株的电镜观察:由于光学显微镜的分辨率仅为0.2μm,光学显微镜无法清晰观测菌株体内直径在0.2μm以下的物质颗粒,电子显微镜的分辨率达到1~2nm。所以,应用高放大倍数的电镜来对菌体进行精准观察。由青岛大学医学院电镜室拍摄。
参照文献(buchananre,gibbensne.伯杰细菌鉴定手册[m].8版.北京:科学出版社,1984:274-325;黄文芳.粘质沙雷氏菌(serratiamarcescens)的研究ⅰ—serratiamarcescens9-2菌株分离、分类鉴定和形态特征[j].华南师范大学学报:自然科学版,2003(3):108-111)进行菌株形态学、生理生化测试及分子生物学鉴定。
pcr扩增16srdna,产物电泳验证后,由华大基因测序。结果在genbank数据库中比对。
1.3.6高产蛋白酶菌株生长曲线的测定
菌种的复苏和发酵培养:由1.3.3中分离并保存的单个菌落分离纯化。
生长曲线测定:取1ml种子液接种到发酵液体培养基中,于28℃,110r/min下发酵培养。分别于培养的0、3、6、9、12、15、18、21h测定od600值,每个时间重复测定3次。
以四株菌菌液培养时间为横坐标,所测菌液的平均od600值为纵坐标,绘制生长曲线。
1.3.7高产蛋白酶菌株发酵条件优化
在各菌株发酵量达到最大的培养时间下,采用单因素试验设计,探究碳源、初始ph值、盐度、温度对菌株生长的影响。
基于初始发酵培养基,探究不同碳源(葡萄糖、麦芽糖、蔗糖、乳糖和可溶性淀粉)对菌株生长的影响。调节培养基的初始ph值,研究培养基初始ph值(4、5、6、7、8、9、10)对菌株生长的影响。研究不同培养基盐度(5‰、10‰、15‰、20‰、25‰、30‰、35‰)对菌株生长的影响。考察不同培养温度(15℃、20℃、25℃、30℃、35℃、40℃)对菌株生长的影响。最后在上述最适条件下培养该菌株,确定蛋白酶活力。
1.3.8蛋白酶活力的测定
酪氨酸标准曲线:采用gb/t23527—2009《蛋白酶制剂》法。以酪氨酸浓度c为横坐标,吸光度a为纵坐标,绘制标准曲线。粗酶液的制备参照文献[20]。
蛋白酶活力的测定:参照gb/t23527—2009《蛋白酶制剂》法。
蛋白酶活力以x表示,按下式计算:
(1)x=c×4×n/1×10。
式中:c为由标准曲线得出的样品最终稀释液的活力,μg/ml;4为反应试剂的总体积,ml;
n为样品的稀释倍数;1为参与反应的酶量,ml;10为反应时间,min。
2结果与分析
2.1菌株的分离、筛选和鉴定
2.1.1纹藤壶附生菌的分离纯化
经分离纯化,自纹藤壶中共获得54种菌株,编号x1-x54。
2.1.2高产蛋白酶菌株的筛选结果
经比较纹藤壶附生菌株的酪蛋白水解圈直径与菌落直径的比值,筛选得到四株高产蛋白酶菌株,分别为x-8、x-18、x21、x48,菌株于酪蛋白酶培养基上的水解圈见图1。图1:x-18菌株酪蛋白酶培养基上筛选透明圈。
2.1.3电镜观察
四种菌株的电镜照片见图2。
通过图2可知,x-18为杆状菌,有鞭毛。
2.1.4形态学观察及生理生化鉴定结果
依菌株的形态及生理生化检测结果,进行菌种的初步归属(参考文献:郑朝成等.污泥中一株产耐高温蛋白酶菌株的分离、鉴定及酶学特性[j].环境科学学报,2012,32(3):577-583)。x18菌产白色菌落,表面光滑,边缘不规则。菌株的生理生化特征见表1。
表1菌株生理生化结果
注:“+”表示结果阳性;“-”表示结果阴性。
2.1.5分子生物学鉴定
经测序并比对序列,x18菌株序列与乔治亚海杆菌的16srdna序列同源性高达99%。结合电镜及形态学观察、生理生化特征测试结果,鉴定菌株x-18为乔治亚海杆菌(marinobacteriumgeorgiense)。
x-18菌株16srdna:
cggcatggcgcagctaccatgcagtcgagcggtaacatatagtaccttgctactttgctgacgagcggcagaggggtgagtagtgcttgggatgtgccgtggtgtgggggacaacttttggaaaccagtgctaataccgcatagtgtctagggaccaaggggggcttcggctctcgcctttatagtgccccatgtgggattatctatttggtgaggtagtgtctccccagcgccactatccctatctggtttgagaggatgatcacccactctgggactgacacacggcccacactcctacgggaggcagcagtggagaatattgcacagtgggcgcacccctgatgcccccgtgccgcgtgtgtgaaaaaggccttcgggttgtaaagctctttcactcgagaagaaaggttaatatttaatacctgctatctgtgactttactgacaaaaaaagccccggctaactccgtgccagcacccgcggtaatacagagggtgagagcgttaatcagatttactgggcgtaaagcgtacgcgcgcgttttgttaagcgagatgtgaaagccccggtctcaacctggaaactgcttttcaaactggcactctagagtgtgatagagtgtggtagaatttcgtgtgtagcggtgatgtgcatagagatctgagagaatacctatggcgaacgcccccccctgtctcaactctgactctcatgtacgaaagcgtggagagcacacgagattatataccctggtactccacgccatacaatatgtctactaaaatctcagaacctctgctctgtttttcaaagctcacgcaatatgtacaccgccgggagagtaccggccgcgatgataacactcatgatgaatttgacggggcgcccgcacaagctgggagagcgatggtggtttttatcttctgatgcacgcagagactcatcctctactcgttgatcactacagagcagtcttaccagaggatggttgtgggtgctg(seqidno.:1)
2.2高产蛋白酶菌株的生长曲线
在振荡培养的条件下,测得x-18菌培养0、3、6、9、12、15、18、21h的od600值,每个时间点重复测定3次,取其平均值。菌株的生长曲线见图3。
菌液的浓度与浑浊度呈正比,浑浊度越大,所测得的od600值越大,菌液的浓度越大,细菌数量越多。从图3中可以看出,随着培养时间的延长,菌株的od600值经历了先增大后又逐渐减少的过程,说明三株菌的细菌数量随着培养时间的增加经历了先增多后减少的过程。
由图3可知,乔治亚海杆菌x-18在0~3h为生长延迟期,3~15h为对数生长期,15~18h为平台期,18h以后为衰亡期;因此,对这种细菌进行研究时,选定18h为最佳培养时间。
2.3高产蛋白酶菌株发酵条件优化
2.3.1碳源对菌株生长的影响
在最适发酵时间的基础上,不同碳源(含量2‰)对菌株生长的影响结果见图4。
由图4可知,可溶性淀粉作为碳源时,乔治亚海杆菌x-18可以获得最大培养密度,蔗糖、麦芽糖等次之。
2.3.2培养基初始ph值对菌株生长的影响
在最适发酵时间的基础上,液体发酵培养基不同初始ph值对菌株生长的影响结果见图5。
由图5可知,随着初始ph值升高,乔治亚海杆菌x-18菌液的密度逐渐增大;当初始ph值>6时,菌液浓度下降。
2.3.3培养基盐度对菌株生长的影响
在最适发酵时间的基础上,液体发酵培养基不同盐度对菌株生长的影响结果见图6。
由图6可知,随着盐度的升高,乔治亚海杆菌x-18菌液的浓度逐渐增大;当盐度>15‰时,细菌浓度下降。
2.3.4培养温度对菌株生长的影响
在最适发酵时间的基础上,液体发酵培养基不同培养温度对菌株生长的影响结果见图7。
由图7可知,随着培养温度的升高,乔治亚海杆菌x-18菌液的密度逐渐增大,细菌数量增多;当温度>30℃时,菌液浑浊度开始下降,细菌数量开始下降。故30℃为发酵的最适温度。
2.4蛋白酶活力的测定
2.4.1酪氨酸标准曲线
按照前面蛋白酶活力的测定中的操作方法,得到酪氨酸标准曲线回归方程,见图8.该曲线拟合度较好,精密度较高。
2.4.2福林法测定蛋白酶活力
依据1.3.8蛋白酶活性的测定方法,在优化后发酵条件下,经计算,x-18菌株产蛋白酶酶活力达到240.00u/ml。
本研究从山东沿海污染海域的纹藤壶中筛选得到高产蛋白酶的菌株,编号为x-18,鉴定为乔治亚海杆菌(marinobacteriumgeorgiense)。
通过测定菌株的生长曲线,确定菌株x-18发酵量最高的培养时间为18h。
基于最佳培养时间,通过单因素多水平试验,获得x-18菌株的最佳发酵条件:可溶性淀粉5.0‰、初始ph7.0、培养基盐度15‰、培养温度30℃。在此初步优化发酵条件下,x-18菌株产蛋白酶酶活力达到了240.00u/ml。
实施例2酶的纯化以及性质研究
在实施例1优化后的培养条件下培养菌株x-18。发酵液经3900r/min冷冻离心10min,得粗酶液。获得的粗酶液分别经30%、80%饱和度硫酸铵分步盐析,然后在4℃条件下透析过夜。浓缩透析后样品,再依次过sephadexg-25层析柱和sephadexg-100层析柱进行凝胶过滤,获得纯化蛋白酶。经sds-page检测,纯化获得的蛋白酶为单一条带。
(1)最适ph及ph稳定性测试
纯化后的蛋白酶在不同的ph下进行酶活测定,结果表明,本发明蛋白酶x-18在ph7.5-11.0范围内能够保留90%以上的酶活力,ph9.5为最适ph。
将酶液在不同的ph缓冲液中进行10倍稀释,进行ph稳定性测试。4℃放置过夜后测定残余的酶活。结果显示蛋白酶x-18在ph6.5至ph7.5的条件下能够保持75%以上的酶活;在ph8.0至ph11的条件下能够保持85%以上的酶活;在ph11.5以上的条件下酶活损失较大。
(2)最适温度及温度稳定性测试
将纯化后的蛋白酶在不同的温度(30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃)下测定酶活,结果表明,本发明蛋白酶x-18的最适反应温度为55℃,在45℃-65℃的条件下能够保持80%以上的酶活。
将酶液在不同的温度(4℃、10℃、20℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃)条件下保温,进行蛋白酶的温度稳定性测试,保温1小时后测定残余的酶活。结果表明,本发明蛋白酶在20℃以下的条件下稳定性较好,保温1h后仍然能够维持80%以上的活力,超过50℃时酶活损失严重。
(3)金属离子对蛋白酶活性的影响
在纯化的蛋白酶酶液中加入不同的金属离子进行测试,各实验组中分别控制金属离子浓度为20mm,混合均匀后进行酶活测试,设三组平行,检测不同金属离子对蛋白酶活性的影响。
检测结果表明,蛋白酶x-18对cr6+的耐受能力显著优于其它几株蛋白酶,表现出了及其优异的耐铬特性,对fe2+的耐受能力也较强。在制革工业中,cr6+残留较高的情况下,对普通蛋白酶的活性影响极大,导致蛋白酶难以发挥效果。本发明的x-18菌株所产蛋白酶能够有效耐受铬离子,因此其在制革工业中具有较佳的应用前景。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>威海银河生物技术有限公司
<120>一种产蛋白酶的乔治亚海杆菌及其应用
<130>1916002
<160>1
<170>siposequencelisting1.0
<210>1
<211>1003
<212>dna
<213>乔治亚海杆菌(marinobacteriumgeorgiense)
<400>1
cggcatggcgcagctaccatgcagtcgagcggtaacatatagtaccttgctactttgctg60
acgagcggcagaggggtgagtagtgcttgggatgtgccgtggtgtgggggacaacttttg120
gaaaccagtgctaataccgcatagtgtctagggaccaaggggggcttcggctctcgcctt180
tatagtgccccatgtgggattatctatttggtgaggtagtgtctccccagcgccactatc240
cctatctggtttgagaggatgatcacccactctgggactgacacacggcccacactccta300
cgggaggcagcagtggagaatattgcacagtgggcgcacccctgatgcccccgtgccgcg360
tgtgtgaaaaaggccttcgggttgtaaagctctttcactcgagaagaaaggttaatattt420
aatacctgctatctgtgactttactgacaaaaaaagccccggctaactccgtgccagcac480
ccgcggtaatacagagggtgagagcgttaatcagatttactgggcgtaaagcgtacgcgc540
gcgttttgttaagcgagatgtgaaagccccggtctcaacctggaaactgcttttcaaact600
ggcactctagagtgtgatagagtgtggtagaatttcgtgtgtagcggtgatgtgcataga660
gatctgagagaatacctatggcgaacgcccccccctgtctcaactctgactctcatgtac720
gaaagcgtggagagcacacgagattatataccctggtactccacgccatacaatatgtct780
actaaaatctcagaacctctgctctgtttttcaaagctcacgcaatatgtacaccgccgg840
gagagtaccggccgcgatgataacactcatgatgaatttgacggggcgcccgcacaagct900
gggagagcgatggtggtttttatcttctgatgcacgcagagactcatcctctactcgttg960
atcactacagagcagtcttaccagaggatggttgtgggtgctg1003
- 还没有人留言评论。精彩留言会获得点赞!