一种多胺前体脂质及其应用的制作方法
本发明属于高分子材料技术领域,具体涉及一种基于肿瘤微环境胞外酶活化的多胺前体脂质及其在药物制剂中的应用。
背景技术:
酶作为一种生物体内重要的刺激因子,对维持体内正常生理功能具有重要作用。在某些病理环境下,酶的表达会发生变化,如某些蛋白酶、糖苷酶或磷脂酶可作为炎症、肿瘤以及神经退行性疾病诊断和治疗的生物标记物。将肿瘤组织过表达的酶与纳米递送载体如聚合物、脂质体结合,利用酶对底物催化特异性与高效性特点,设计肿瘤细胞外酶响应型递送系统,实现发挥电荷翻转、细胞穿模、主动靶向、触发释药等功能,达到对肿瘤精准诊断、治疗或者集两者为一体的诊疗的目的。
脂质体作为新的抗肿瘤药物载体具有改善药物体内药动学性质、增加抗肿瘤作用、降低药物毒副作用等优点。临床上使用的脂质体药物如阿霉素脂质体\紫杉醇脂质体均显示良好的抗肿瘤效果。然而,临床上脂质体制剂存在着肿瘤靶向性低、肿瘤细胞摄取慢、释药慢等问题,限制了脂质体抗肿瘤制剂在临床上应用。近年来,研究人员开发了基于肿瘤微环境的ph敏感脂质体、胞外酶敏感脂质体、ros敏感脂质体等,以改善脂质体制剂靶向性差、肿瘤细胞摄取效率低及释药慢的缺陷。
技术实现要素:
本发明的目的是提供一种基于肿瘤微环境胞外酶活化的多胺前体脂质利用肿瘤组织高表达β-葡萄糖醛酸酶特点,采用β-葡萄糖醛酸修饰多胺脂质,形成多胺前体脂质,可降低阳离子多胺脂质体对人体毒副作用。
一种多胺前体脂质,其结构式如式i所示:
i
其中,r为取代的三(2-氨基乙基)胺基,所述取代的三(2-氨基乙基)胺基中至少有一个氨基被脂肪酸所取代。
进一步地,所述脂肪酸为c8-c18的饱和脂肪酸或c8-c18的不饱和脂肪酸;所述脂肪酸以n-烷基链或酰胺键-烷基链与氨基相连。
进一步地,所述r的结构如式ⅱ所示:
其中r1和r2各自并独立地选自油酸、亚油酸、硬脂酸、月桂酸、棕榈酸、亚麻酸、葵酸或辛酸。
一种脂质体,包括磷脂、胆固醇和上述多胺前体脂质;所述磷脂和胆固醇的质量比为2-20:1,多胺前体脂质的质量为磷脂和胆固醇的总质量的5%-20%。
进一步地,所述磷脂为大豆卵磷脂及其衍生物、蛋黄卵磷脂及其衍生物、磷脂酰胆碱及其衍生物、磷脂酰乙醇胺及其衍生物、磷脂酰甘油及其衍生物、磷脂酰丝氨酸及其衍生物、磷脂酸及其衍生物、磷脂酰肌醇及其衍生物中的一种或几种的混合物。
进一步地,所述磷脂为大豆卵磷脂及其衍生物、二硬脂酰基磷脂酰乙醇胺及其衍生物、二硬脂酰基磷脂酰胆碱及其衍生物或1,2-棕榈酰磷脂酰甘油及其衍生物中的一种或几种的混合物。
进一步地,所述磷脂为大豆卵磷脂、二棕榈酰磷脂酰胆碱或1-肉豆蔻酰基-2-硬脂酰基卵磷脂中的一种或几种的混合物。
进一步地,上述脂质体还包括抗肿瘤药物。
进一步地,所述抗肿瘤药物选自顺铂、奥沙利铂、紫杉醇、去氧鬼臼毒素、依托泊苷、sn-38、紫杉醇、多西紫杉醇、氯尼达明或阿霉素。
上述多胺前体脂质在制备治疗肿瘤的药物中的应用。
有益效果:本发明的多胺前体脂质由于带有β-葡萄糖醛酸修饰基团,在人体生理条件下保持较强的负电荷,用于制成脂质体后,可使脂质体具有较好的血液相容性。而在肿瘤组织高表达的葡萄糖醛酸酶下,发生酶解反应,释放游离的多胺脂质,实现表面电荷由负电荷转变成正电荷,易于与带负电荷的肿瘤细胞结合,实现有效内吞进入肿瘤细胞内。经细胞内吞进入溶酶体后,溶酶体内具有高活性的β-葡萄糖醛酸酶,可水解葡萄糖醛酸,释放游离的伯胺。多胺脂质捕获质子,发挥质子海绵效应或者与溶酶体膜作用,裂解溶酶体膜,使多胺脂质体进入细胞浆内,并通过静电作用在线粒体内聚集。
附图说明
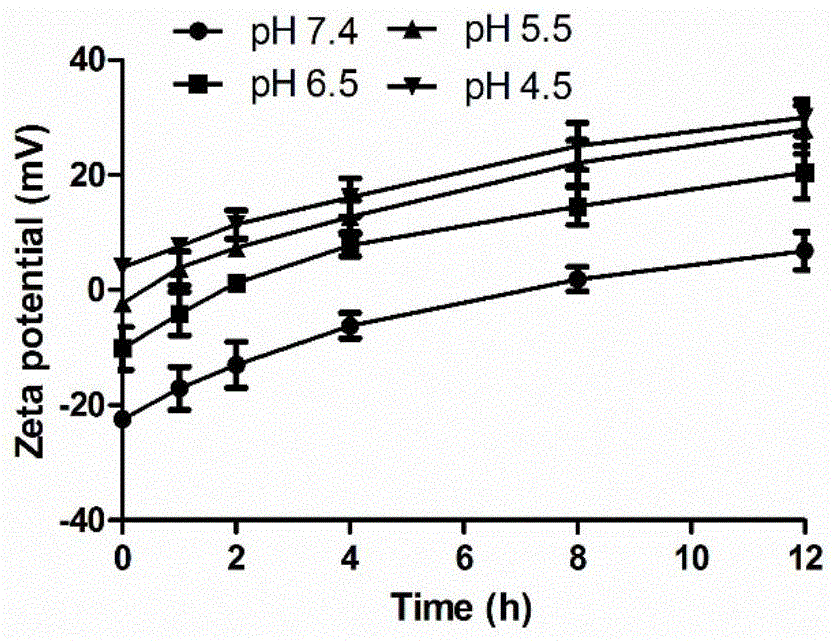
图1为实施例1中gluacna脂质体的电位-时间曲线。
图2为实施例1中各类脂质体的缓冲能力曲线。
图3为实施例2中脂质体的细胞毒性曲线。
具体实施方式
本发明公开了一种基于肿瘤微环境胞外酶活化的多胺前体脂质及其在脂质体制剂中的应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明所述产品和应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
在具体实施方式中,本发明的设计思路为:
针对阳离子多胺脂质体对人体具有毒副作用这一技术问题,本发明设计了一类β-葡萄糖醛酸酶敏感型的多胺前体脂质,该脂质材料以三(2-氨基乙基)胺为连接臂,将亲水性的β-葡萄糖醛酸修饰在油酸衍生物上。
在本发明中,油酸衍生物优选自以下中的一种:
由于肿瘤组织内高表达β-葡萄糖醛酸酶,尤其是在肿瘤坏死区域,本发明利用肿瘤组织高表达β-葡萄糖醛酸酶特点,采用β-葡萄糖醛酸修饰多胺脂质,形成多胺前体脂质,将该多胺前体脂质掺到脂质体中,可降低阳离子多胺脂质体对人体毒副作用。同时,该多胺前体脂质可在肿瘤区域内经β-葡萄糖醛酸酶水解,暴露游离的多胺脂质,增加肿瘤细胞对脂质体摄取。由于,三(2-氨基乙基)胺含有叔胺结构,有利于脂质体通过质子海绵效应,从溶酶体内部逃逸进入胞内,在正电荷驱动下,可在线粒体内部聚集,从而递送药物至肿瘤细胞线粒体,实现逐级递送,电荷驱动靶向线粒体的目的。
本发明的多胺前体脂质材料为淡黄色固体粉末,易溶于二氯甲烷和氯仿。在β-葡萄糖醛酸酶作用下,可断裂葡萄糖醛酸苷链,并经过1,6自消除反应,释放多胺脂质。该多胺前体多胺脂质可与不同量的磷脂、胆固醇等制备成β-葡萄糖醛酸酶响应的脂质体。在肿瘤酸性与高表达的β-葡萄糖醛酸酶作用下,脱去负电性的β-葡萄糖醛酸,形成带正电荷的多胺阳离子脂质体,如图1所示。多胺阳离子脂质体具有很强的ph缓冲能力,可保证脂质体在溶酶体酸性条件下,发生质子海绵效应,从溶酶体中逃逸出来,如图2所示。
下面就本发明提供的基于肿瘤微环境胞外酶活化的多胺前体脂质及其应用做详细说明,实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件
实施例1
1、n-2-硝基-(4-p-ndoa-氨基甲酸酯基)-β-葡萄糖醛酸甲酯n-[4-o-(β-d-glucopyranuronate)-3-nitrobenzyloxycarbonyl]staramine(gluacna)的合成
取0.8g(1.57mmol)三乙酰基葡萄糖醛酸甲酯-间硝基苯甲醇溶于30ml二氯甲烷,加入745.122mg吡啶,向其中滴加溶于5ml的949.3476mg对硝基苯基氯甲酸酯的二氯甲烷溶液,冰浴下反应。1h后,撤去冰浴,继续反应5h,过滤除去吡啶盐酸盐,干法过硅胶层析柱,洗脱剂为石油醚:乙酸乙酯=5:1、4:1、3:1、1:1。旋转蒸发去除溶剂得到产物2,3,4-o-乙酰基-(2-硝基-4-p-硝基苯基碳酸酯基)-β-葡萄糖醛酸甲酯(ace-gluacna-pnp)。取1.73gace-gluacna-pnp(mw650,0.77mmol)溶于10ml无水二氯甲烷,加入三乙胺350μl,加入0.311gn,n’-二油酰三羟甲基氨基甲烷(2-氨基乙基)胺(ndoa)1.8g,40℃水浴回流下反应24h,硅胶柱层析纯化(4%-10%甲醇/二氯甲烷)得到产物n-2,3,4-o-乙酰基-(2-硝基-4-p-ndoa-氨基甲酸酯基)-β-葡萄糖醛酸甲酯(ace-gluacna)。称取1gace-gluacna与0.63g氧化二丁基锡(snobu2),加入30ml甲醇,氮气保护下加热回流24h。硅胶柱层析纯化(5%-12%甲醇/二氯甲烷),得到淡黄色产物n-2-硝基-(4-p-ndoa-氨基甲酸酯基)-β-葡萄糖醛酸甲酯(gluacna)。
13cnmr(151mhz,cdcl3)δ175.07,130.88,130.47,130.26,130.02,129.76,129.65,128.11,127.90,127.71,77.31,77.06,76.80,37.13,32.70,32.58,31.97,31.95,31.79,31.54,31.46,30.48,29.89,29.82,29.76,29.73,29.59,29.38,29.36,29.27,27.29,27.22,27.13,25.67,22.72,22.61,22.58,14.15,14.11,1.04,0.02.1hnmr(500mhz,dmso-d6)δ7.85(s,1h),7.70(m,2h),7.45(d,j=8.8hz,1h),5.34(tt,j=18.1,8.7hz,7h),5.17(d,j=7.4hz,1h),5.03(s,2h),3.66(d,j=9.0hz,1h),3.07(dq,j=14.7,6.1hz,6h),2.82–2.69(m,2h),2.48(t,j=6.8hz,6h),2.05(ddd,j=35.4,18.0,7.8hz,12h),1.50(q,j=7.3hz,4h),1.28(d,j=12.9hz,40h),0.88(t,j=6.7hz,6h);tof-ms-es:[m-h]-calcdforc56h94n5o13,1044.7;found,1044.8.
2、多胺阳离子脂质体制备及性质
采用薄膜分散法制备ndoa脂质体。按下表称取处方量的大豆卵磷脂(spc)和胆固醇,置500ml茄形瓶中,加入精密称取的n,n’-二油酰三羟甲基氨基甲烷(2-氨基乙基)胺(ndoa),溶于氯仿后,40℃旋转蒸发有机溶剂,得到透明的脂质膜,经水性介质水化后探头超声,高压过滤挤出器过100nm聚碳酸酯膜三次,分散粒径。
表1不同ndoa比例下ndoa脂质体粒径及电位
3、含有多胺前体脂质的脂质体制备及表面电荷反转
采用薄膜分散法制备gluacna脂质体。分别准确称取处方量的大豆卵磷脂(soybeanlecithin,spc)、胆固醇和gluacna(100:25:16,w:w:w)置500ml茄形瓶中,溶于氯仿后,40℃旋转蒸发有机溶剂,得到透明的脂质膜,经水性介质水化后探头超声,高压过滤挤出器过100nm聚碳酸酯膜三次,分散粒径。
如图1所示,gluacna脂质体粒径为92.7nm,在不同ph及133u/mlβ-葡萄糖醛酸酶作用下,电位随时间变化。由此可知,gluacna脂质体在不同的ph条件下均可发生电荷反转,其中在ph4.5条件下,电荷反转需要时间最短,ph7.4条件下电荷反转能力最差,表明gluacna脂质体在β-葡萄糖醛酸酶下电荷反转能力与ph有关。
4、缓冲能力测试
取2mg/mlgluacna脂质体溶液(gluacna-lip)和ndoa脂质体(ndoa-lip)溶液,1mnaoh调节ph至10.00,使用0.05m或0.01mhci滴定,直到ph·为3.3,停止滴加hci,记录使用的hci体积,以大豆卵磷脂脂质体溶液(spca-lip)为对照,结果见图2,表明ndoa阳离子脂质体具有很强的缓冲能力,在酸性溶酶体环境下,可吸附质子,破坏溶酶体膜完整性,具有溶酶体逃逸功能,除此之外,相比spc脂质体,gluacna脂质体由于含有叔胺结构,也具有很好的缓冲能力。
实施例2
1、载氯尼达明的gluacna脂质体制备
采用薄膜分散法制备载药gluacna脂质体。分别准确称取处方量的大豆卵磷脂(soybeanlecithin,spc)、gluacna、胆固醇和氯尼达明(100:16:25:10,w:w)置500ml茄形瓶中,溶于氯仿后,40℃旋转蒸发有机溶剂,得到透明的脂质膜,经水性介质水化后探头超声,高压过滤挤出器过100nm聚碳酸酯膜三次,分散粒径。得到载氯尼达明gluacna脂质体粒径为107.5nm,zeta电位为-26.58mv,包封率为95.71%。
2、细胞毒性试验
取对数生长的l-02细胞,经0.25%含edta-胰酶消化、终止消化、离心、重悬等步骤,制备成单细胞悬液,以5×103个/孔接种于96孔板中,放进细胞培养箱中,在37℃,5%co2浓度下,培养24h后,吸去上清液,并用pbs洗涤三次,加入不同浓度的空白大豆磷脂脂质体(spc-lip)、不含β-葡萄糖醛酸酶的gluacna脂质体(gluacna-lip)与含有β-葡萄糖醛酸酶的gluacna脂质体(β-g+gluacna),每个浓度3个复孔,放入细胞培养箱,孵育48h后,每孔加入5mg/mlmtt溶液20μl,放回细胞培养箱,继续孵育4h。采用真空泵小心吸去上层培养液,每孔加入150μldmso,小型振动器低速震荡10min,待紫色结晶完全溶解后,采用酶标仪在波长490nm下,测定其吸光度值(opticaldensity,od),并按照以下公式计算得到细胞存活率:
结果见图3,空白spc脂质体与gluacna脂质体对正常肝细胞l-02无明显毒副作用,加入β-葡萄糖醛酸酶后,较高浓度下的gluacna脂质体可对l-02产生细胞毒性。
- 还没有人留言评论。精彩留言会获得点赞!