一种全能核酸内切酶的表达纯化方法与流程
本发明属于基因工程和蛋白质工程技术领域,具体涉及一种全能核酸内切酶表达纯化方法,。
背景技术:
全能核酸酶单体含有245个氨基酸残基,分子量为30kda,两个单体由两个二硫键连接成为具有活性的二聚体结构。全能核酸酶是一种核酸内切酶,它能高效降解任何形式(包括双链、单链、线状、环状)的dna和rna成为2~5个碱基的5’单磷酸核苷酸。全能核酸酶能有效降低蛋白样品粘度,去除蛋白样品中核酸的污染。在降低粘性的同时,也具有多种其他用途,如:减少了样品处理时间,增加了蛋白产量,离心时使沉淀和上清分离的更彻底,更便于溶液的离心(尤其是超滤);提高色谱纯化的效率等。
目前,商品化的全能核酸酶来自重组毕赤酵母分泌表达,毕赤酵母培养条件较细菌表达更严苛,培养基原料价格高,造成生产成本较高。
技术实现要素:
本发明所要解决的技术问题在于,提供一种全能核酸内切酶的表达纯化方法,可以有效降低全能核酸内切酶的生产成本,缩短纯化时间,获得高活性的全能核酸内切酶,有利于该全能核酸内切酶在科研和工业领域的应用。
为解决上述技术问题,本发明采用的技术方案为:
一种全能核酸酶表达纯化方法,其特征在于:包括以下步骤:
1)表达步骤:含目的基因的大肠杆菌在基础培养基生长,并加入诱导剂异丙基-p-d-硫代半乳糖对目的蛋白进行诱导表达;所述目的基因含全能核酸酶序列,且全能核酸酶序列的前端具有编码6xhis标签;所述目的蛋白为包涵体;
2)包涵体变复性:所述步骤1)得到的包涵体通过稀释变复性获得可溶的有活性的目的蛋白;
3)纯化步骤:目的蛋白通过亲和层析纯化、酶切、反挂,得到高纯度的全能核酸酶。
具体的,所述基础培养基为仅能满足微生物野生型菌株生长需要的培养基,又称无机盐培养基。所述基本培养基包括碳源、氮源、水、无机盐和微量元素。
一种优选的实施方式中,所述基本培养基为m9培养基,每升配方为磷酸一氢钠6克,磷酸二氢钾3克,氯化钠nacl0.5克,氯化铵0.5克,七水合硫酸镁246毫克,氯化钙44毫克,10%葡萄糖(w/v)20毫升,乙二胺四乙酸50毫克,六水合氯化铁8.3毫克,氯化锌0.84毫克,二水合氯化铜0.13毫克,六水合氯化钴0.1毫克,硼酸0.1毫克,六水合氯化锰16微克。
具体的,所述目的基因中全能核酸酶序列的前端还具有tev酶切位点。
具体的,所述步骤1)中,当大肠杆菌浓度达到od60为0.6-0.8时,加入诱导剂。
具体的,所述步骤1)中,加入诱导剂异丙基-p-d-硫代半乳糖(iptg)的终浓度为0.1-1mm。
具体的,所述诱导表达的时间是8-16小时,温度是25-30℃。
具体的,所述步骤2)中,将细胞破碎后离心的沉淀用含有0-1m尿素的包涵体清洗液重悬,再离心,去除上清,反复操作数次(2~5次),得提纯的包涵体。
具体的,所述步骤2)中,将提纯的包涵体用含6m尿素的包涵体变性液充分溶解,离心,得含变性的目的蛋白的上清溶液。
具体的,所述步骤2)中,将含变性的目的蛋白的上清溶液在0~4℃下缓慢加入至少10倍体积的不含尿素的复性液,持续搅拌,得到目的蛋白。
一种优选的实施方式中,所述步骤2)中,包涵体清洗液配方为:20mmtris-盐酸ph8.2,50mm氯化钠,1mm乙二胺四乙酸(edta),1murea尿素。
一种优选的实施方式中,所述步骤2)中,包涵体变性液配方为:20mmtris-盐酸ph8.2,1mm乙二胺四乙酸edta,2mmtcep还原剂,6m尿素。
一种优选的实施方式中,所述步骤2)中,复性液配方为:20mmtris-盐酸ph8.0,20mm氯化钠,10%甘油,2mm氯化镁。
具体的,所述步骤3)中,将步骤2)得到的目的蛋白用镍亲和层析柱纯化,包括以下步骤:柱平衡,上样,清洗,低浓度咪唑清洗,高浓度咪唑洗脱。目的蛋白的his标签会与镍亲和层析柱发生特异吸附,吸附后用高浓度咪唑与目的蛋白竞争结合,从而将目的蛋白洗脱下来。
一种优选的实施方式中,所述低浓度咪唑溶液配方为:20mmtris-盐酸ph8.0,20mm氯化钠,10%甘油,1mm氯化镁,10mm咪唑。
一种优选的实施方式中,所述高浓度咪唑溶液配方为:20mmtris-盐酸ph8.0,20mm氯化钠,10%甘油,1mm氯化镁,500mm咪唑。
一种优选的实施方式中,所述平衡液配方为:20mmtris-盐酸ph8.0,20mm氯化钠,10%甘油,1mm氯化镁,10mm咪唑。
具体的,所述步骤3)中,将亲和层析洗脱下来的蛋白溶液中加入6xhis标签的tev酶,tev酶可将目的蛋白的his标签切割下来,得游离状态的目的蛋白的溶液,然后透析,降低溶液中咪唑浓度,得透析的目的蛋白溶液。
一种优选的实施方式中,所述透析液配方为:20mmtris-盐酸ph8.0,20mm氯化钠,10%glycerol,2mm氯化镁。
具体的,所述步骤3)中,反挂,即将透析的目的蛋白溶液进行第二次镍亲和层析柱纯化,包括柱平衡,上样,清洗和高浓度咪唑洗脱。上样溶液为酶切并透析后的溶液,收集上样流出液和清洗液,得到目的蛋白,高浓度咪唑将吸附在镍亲和层析柱的his标签和tev酶洗脱下来。
与现有商品化的全能核酸酶的表达方法相比较,本发明的方法具有以下优点:
1)本发明使用大肠杆菌替代毕赤酵母作为表达菌株,培养条件简单,显著降低了蛋白表达的难度。
2)本发明使用基础培养基表达蛋白,基本培养基仅碳源、氮源、水、无机盐和微量元素。而且基础培养基各组分总量约10克,用量极少,大幅降低了蛋白表达的成本。
3)本发明使用稀释复性法,操作简便,能大量获得可溶的且有活性的目的蛋白。
4)本发明采用2次镍亲和层析柱纯化,获得高纯度的目的蛋白,目的蛋白的纯度可达90%以上。
附图说明
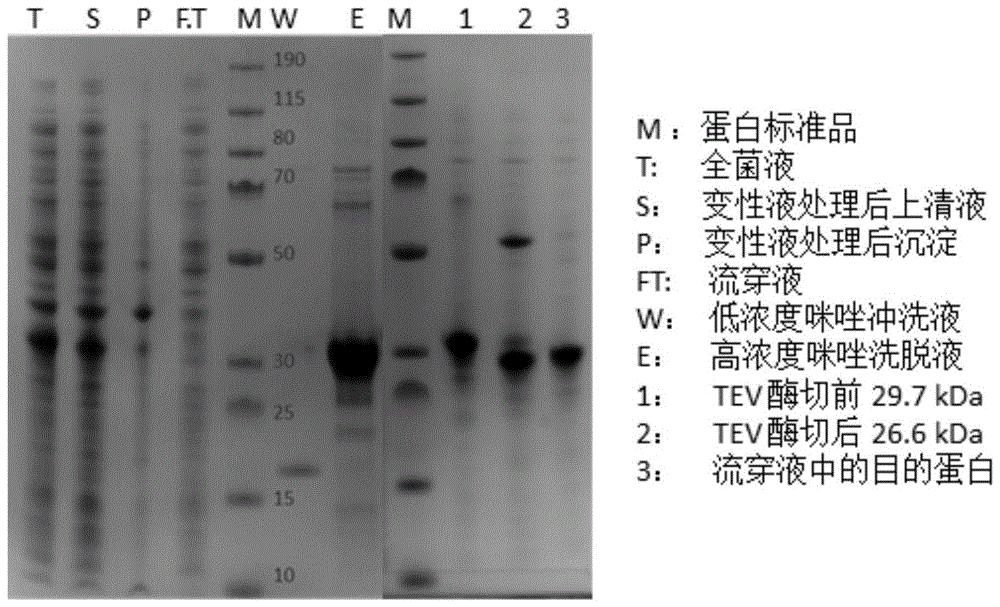
图1为目的蛋白纯化电泳图。
图2为全能核酸酶活性测试。
具体实施方式
下面将对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例一
本实施例首先通过基因改造,在全能核酸酶基因序列的前端加入6xhis标签,构建重组质粒(表达的蛋白序列见s1),导入大肠杆菌中,接种于基础培养基。当od600达到0.6-0.8时,加入终浓度为0.1-1mm的诱导剂iptg,在30度8小时或25度16hr进行诱导表达。
s1:蛋白表达序列:
mgsshhhhhhdlgtenlyfq*gsmsidncavgcptggsskvsivrhaytlnnnsttkfanwvayhitkdtpasgktrnwktdpalnpadtlapadytganaalkvdrghqaplaslagvsdweslnylsnitpqksdlnqgawarledqerklidradissvytvtgplyerdmgklpgtqkahtipsaywkvifinnspavnhyaaflfdqntpkgadfcqfrvtvdeiekrtgliiwaglpddvqaslkskpgvlpelmgck
其中,hhhhhh:表示6xhis标签;enlyfq*g:表示tev酶切位点,*表示酶切位置;大写字母表示全能核酸酶序列。
基础培养基每升配方:磷酸一氢钠6克,磷酸二氢钾3克,氯化钠nacl0.5克,氯化铵0.5克,七水合硫酸镁246毫克,氯化钙44毫克,10%葡萄糖(w/v)20毫升,乙二胺四乙酸50毫克,六水合氯化铁8.3毫克,氯化锌0.84毫克,二水合氯化铜0.13毫克,六水合氯化钴0.1毫克,硼酸0.1毫克,六水合氯化锰16微克。
将诱导表达的产物离心7000g,15分钟收集细胞,每升培养基平均收集5g菌。使用高压均质仪在800-1100pa破碎细胞2到3次,10000xg4摄氏度高速离心30分钟,去除上清。用包涵体清洗液(配方如下所示)重悬沉淀,10000xg4摄氏度高速离心30分钟,去除上清,再重悬离心,重复3次。然后用包涵体变性液(配方如下所示)溶解包涵体,4度搅拌,待充分溶解后47900xg4摄氏度高速离心30分钟,丢弃沉淀,变性的目的蛋白存在于上清中。蛋白溶液置于4度下,用10倍体积的复性液(配方如下所示)逐滴(3-10秒/滴)滴入,并缓持续搅拌过夜。
包涵体清洗液:20mmtris-盐酸ph8.2,50mm氯化钠,1mm乙二胺四乙酸(edta),1murea尿素。
包涵体变性液:20mmtris-盐酸ph8.2,1mm乙二胺四乙酸edta,2mmtcep还原剂,6m尿素。
复性液:20mmtris-盐酸ph8.0,20mm氯化钠,10%甘油,2mm氯化镁。
第二天,蛋白溶液用孔径为0.22微米的滤器过滤。用平衡液(配方如下所示)冲洗镍亲和层析柱5倍柱体积以上,基线稳定柱后上样,样品为过滤后的蛋白溶液。待蛋白溶液全部流过,用低浓度咪唑溶液(配方如下所示)清洗10倍以上柱体积,基线水平后用高浓度咪唑溶液(配方如下所示)洗脱。洗脱下来的蛋白溶液中加入6xhis标签的tev酶,tev酶将目的蛋白的his标签切割下来,使目的蛋白呈游离状态;把目的蛋白和tev的混合溶液装入截留分子量不超过10kda的透析袋中夹好,放入100倍样品体积的透析液(配方如下所示),4度透析过夜。再用用平衡液(配方如下所示)平衡镍亲和层析柱,上样,用平衡液清洗数倍柱体积后,用高浓度咪唑洗脱。上样溶液为酶切并透析后的溶液,收集上样流出液和清洗液,得到目的蛋白,高浓度咪唑将吸附在镍亲和层析柱的his标签和tev酶洗脱下来。最后将收集到的目的蛋白透析到存储液(配方如下所示)中,每升m9培养基(配方如下所示)可纯化出约17mg的核酸内切酶分装纯化后的蛋白,-80度冻存。
平衡液(低浓度咪唑溶液):20mmtris-盐酸ph8.0,20mm氯化钠,10%甘油,1mm氯化镁,10mm咪唑。
高浓度咪唑溶液:20mmtris-盐酸ph8.0,20mm氯化钠,10%甘油,1mm氯化镁,500mm咪唑。
透析液:20mmtris-盐酸ph8.0,20mm氯化钠,10%glycerol,2mm氯化镁。
存储液:20mmtris-盐酸ph8.0,20mm氯化钠,50%glycerol,2mm氯化镁。
商品化的全能核酸酶常采用毕赤酵母作为表达菌株,仅表达就需要3-4天,酵母培养时还需定期加入甲醇,费时费力。本发明在大肠杆菌中表达全能核酸酶,并用变复性和两步镍亲和层析的方法,3天内能获得高纯度的全能核酸酶,蛋白表达纯化的总时长缩短了40%以上。本发明采用基础培养基,表达成本低廉,获得的全能核酸酶纯度可达90%以上,活性可达到250u/微升,与商品化的酶相当。
图1为目的蛋白纯化电泳图,其中显示全能核酸酶经过变复性,镍亲和层析,tev酶切后,纯度可达到90%以上。
图2为全能核酸酶活性测试,其中显示经过本发明获得的全能核酸酶具有降解dna的活性。
综上所述,上述各实施例仅为本发明的较佳实施例而已,并不用以限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,皆应包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!