一种新型微肽HMMW及其应用的制作方法
一种新型微肽hmmw及其应用
技术领域
[0001]
本发明属于生物医药研发领域,更具体地说,涉及一种新型微肽hmmw在肿瘤检测和治疗中的应用。
背景技术:
[0002]
随着转录组学、蛋白组学和生物信息学分析手段的发展,科学家发现过去被定义为非编码rna分子(如lncrnas,circrnas和mirnas)实际上包含具有编码能力的小开放阅读框(sorf,small open reading frame,核苷酸序列不超过300bp),由sorf编码的多肽(sorf-encoded peptides,seps)称为微肽(micropeptides,长度不超过100个氨基酸)。2015年cell期刊上发表科学家通过生物信息学的方法筛选出骨骼肌特异性编码多肽myoregulin(mln)的lncrna,并且确定了mln是骨骼肌生理的一个重要调节因子。近两年国际上关于lncrna能编码微肽的报道并不多,研究领域主要集中在肌肉分化和骨骼肌发育。因此发现和鉴定新的由lncrna编码的微肽,并探究新的应用领域对打开非编码rna的编码大门具有重要意义。
[0003]
肿瘤(tumor)是一类严重危害人类生命健康的恶性疾病,无限生长、侵袭和转移是肿瘤的恶性标志,也是导致治疗失败和死亡的主要原因。目前,临床上对癌症患者最主要的治疗方式有手术疗法、化学疗法(化疗/药物疗法)。对于大多数肿瘤来说,手术疗法适应早期、中期和局限性肿瘤的根治性治疗,晚期肿瘤的姑息治疗,虽然手术治疗不存在化疗耐药、放射抗拒,但存在创伤性较大,有些部位手术难度大,对于亚临床转移灶无效的问题。对于大多数肿瘤来说,化疗适应中、晚期肿瘤,且作为一种全身性治疗手段,化疗对原发灶、转移灶和亚临床转移灶均有治疗作用,但化疗药物的选择性差,在取得治疗效果的同时,常出现不同程度的毒副作用;且长期接受化疗的癌症患者由于免疫抑制作用和直接致癌作用可以发生新的恶性肿瘤。
[0004]
多肽类药物由于具有特异性高、毒副作用小、作用机制明确,不会伤及正常的细胞、组织和器官等优势,在癌症、心血管疾病、免疫相关疾病、代谢类疾病、传染性疾病的治疗中应用被逐步开发。目前全球已经有80余个多肽药物上市,年总销售额超过200亿美元,我国多肽类药物的市场销售额虽然保持快速增长的势头,但大多数均为仿制类多肽药物。
[0005]
目前,有关微肽在包括头颈癌、甲状腺癌、肺癌、食管鳞癌等恶性肿瘤检测和治疗方面的研究仍是空白,本专利利用生物信息学分析和实验验证在肿瘤中发现新型微肽,并探讨其在肿瘤检测和治疗中的应用,为肿瘤的检测和治疗提供新的方案。
技术实现要素:
[0006]
1.要解决的问题
[0007]
本发明的目的之一,是为了提供一种新型微肽hmmw及其氨基酸序列,微肽hmmw为首次发现的全新的人体内源性多肽;
[0008]
本发明的目的之二,是为了提供一种核苷酸,所述核苷酸序列可以编码得到所述
微肽hmmw;
[0009]
本发明的目的之三,是为了提供含有编码微肽hmmw的核苷酸序列的重组载体;
[0010]
本发明的目的之四,是为了将微肽hmmw或编码所述微肽hmmw的核苷酸在制备肿瘤检测用试剂和肿瘤治疗药物中得到应用,具体包括在人的头颈癌、甲状腺癌、肺癌、食管鳞癌、胃癌、乳腺癌、肾癌、皮肤癌中的检测和治疗作用。
[0011]
2.技术方案
[0012]
本发明所采用的技术方案如下:
[0013]
一种新型微肽hmmw在制备肿瘤检测用试剂和/或肿瘤治疗药物中的应用,所述微肽hmmw的氨基酸序列含有如seq id no.2所示的序列。
[0014]
一种新型微肽hmmw在制备肿瘤检测用试剂或肿瘤治疗药物中的应用,所述微肽hmmw的氨基酸序列与seq id no.2所示的氨基酸序列至少具有85%的同源性,或具有90%同源性,或具有95%同源性,或具有98%同源性,且这些与seq id no.2具有同源性的序列保留了抑制肿瘤细胞生长、增殖、侵袭或迁移的功能,可用于制备肿瘤检测用试剂或肿瘤治疗药物。
[0015]
本专利中所述的“同源性”是指在两种或多种氨基酸序列比较中序列相同或相似的百分率。可用电子方法测定相同性百分率,如通过megalign程序(lasergene sof tware package,dnastar,inc.,madison wis.).megalign程序可根据不同的方法如cluster法比较两种或多种序列(higgins,d.g.和p.m.sharp(1988)gene 73:237-244)。cluster法通过检查所有配对之间的距离将各组序列排列成簇。然后将各簇以成对或成组分配。两个氨基酸序列如序列a和序列b之间的同源性百分比通过下式计算:
[0016]
(序列a与序列b之间匹配的残基个数*100)/(序列a的残基数-序列a中间隔残基数-序列b中间隔残基数)。
[0017]
一种新型微肽hmmw在制备肿瘤检测用试剂或肿瘤治疗药物中的应用,所述新型微肽hmmw为seq id no.2所示的氨基酸序列。
[0018]
一种核苷酸,所述核苷酸为a或b或c中的任一种:
[0019]
(a)编码含有如seq id no.2所示氨基酸序列的微肽hmmw的核苷酸;
[0020]
(b)编码与seq id no.2所示的氨基酸序列至少具有85%的同源性的微肽hmmw的核苷酸;
[0021]
(c)编码权利要求3中所述的seqid no.2所示的氨基酸的核苷酸为seq id no.1所示。
[0022]
一种重组载体,所述重组载体含有任一上述的核苷酸。
[0023]
任一上述的核苷酸在制备肿瘤检测用试剂和/或肿瘤治疗药物中的应用。
[0024]
一种肿瘤检测用试剂盒,所述的试剂盒含有针对任一上述的核苷酸序列的特异性引物对。
[0025]
优选地,所述的特异性引物对序列为seq id no.3和seq id no.4所示。
[0026]
一种治疗肿瘤的药物,所述的药物至少含有以上任一所述的微肽hmmw或以上任一所述的核苷酸或以上所述的重组载体,及药学上可接受的载体。
[0027]
优选地,所述的药物为具有如(a1)-(a4)功能的药物,其中:
[0028]
(a1)为抑制肿瘤生长;
[0029]
(a2)为抑制肿瘤细胞增殖;
[0030]
(a3)为抑制肿瘤细胞侵袭;
[0031]
(a4)为抑制肿瘤细胞迁移。
[0032]
优选地,所述的肿瘤包括人的头颈癌、甲状腺癌、肺癌、食管鳞癌、胃癌、乳腺癌、肾癌或皮肤癌。
[0033]
3.有益效果
[0034]
相比于现有技术,本发明的有益效果为:
[0035]
(1)本发明提供了一种具有全新氨基酸序列的微肽hmmw,经数据库(blast,uniprot)和文献资料检索,未发现与微肽hmmw具有同源性序列的蛋白或多肽片段;
[0036]
所述微肽hmmw由51个氨基酸组成,其在肿瘤检测及治疗方面具有重要作用,可以作为肿瘤包括人的头颈癌、甲状腺癌、肺癌、食管鳞癌、胃癌、乳腺癌、肾癌、皮肤癌的肿瘤标志物,即在以上肿瘤中hmmw微肽呈低表达。
[0037]
(2)本发明提供了一种全新氨基酸序列的微肽hmmw,所述微肽hmmw在体外能够显著抑制人头颈癌scc4细胞、甲状腺癌sw579细胞、肺癌a549细胞、食管鳞癌te13细胞、胃癌mgc803细胞、乳腺癌mda-mb-231细胞、肾癌uok262细胞、皮肤癌a431细胞的增殖、迁移侵袭;
[0038]
所述微肽hmmw在体内能够明显抑制人头颈癌scc4细胞、甲状腺癌sw579细胞、肺癌a549细胞、食管鳞癌te13细胞、胃癌mgc803细胞、乳腺癌mda-mb-231细胞、肾癌uok262细胞、皮肤癌a431细胞的肿瘤的生长;
[0039]
且微肽hmmw可以作为恶性肿瘤的检测及治疗药物,极大拓展了该微肽的治疗谱,为恶性肿瘤药物的开发提供了新思路。
附图说明
[0040]
附图1为过表达微肽hmmw的pcdna3.1质粒图谱;
[0041]
附图2为western blot检测的目的条带表达情况;
[0042]
附图3为微肽hmmw对人头颈癌scc4细胞的增殖抑制作用;
[0043]
附图4为微肽hmmw对人甲状腺癌sw579细胞的增殖抑制作用;
[0044]
附图5为微肽hmmw对人肺癌a549细胞的增殖抑制作用;
[0045]
附图6为微肽hmmw对人食管鳞癌te13细胞的增殖抑制作用;
[0046]
附图7为微肽hmmw对人胃癌mgc803细胞的增殖抑制作用;
[0047]
附图8为微肽hmmw对人乳腺癌mda-mb-231细胞的增殖抑制作用;
[0048]
附图9为微肽hmmw对人肾癌uok262细胞的增殖抑制作用;
[0049]
附图10为微肽hmmw对人皮肤癌a431细胞的增殖抑制作用;
[0050]
附图11为微肽hmmw对人头颈癌scc4细胞体内肿瘤生长的抑制作用;
[0051]
附图12为微肽hmmw对人甲状腺癌sw579细胞体内肿瘤生长的抑制作用;
[0052]
附图13为微肽hmmw对人肺癌a549细胞体内肿瘤生长的抑制作用;
[0053]
附图14为微肽hmmw对人食管鳞癌te13细胞体内肿瘤生长的抑制作用;
[0054]
附图15为微肽hmmw对人胃癌mgc803细胞体内肿瘤生长的抑制作用;
[0055]
附图16为微肽hmmw对人乳腺癌mda-mb-231细胞体内肿瘤生长的抑制作用;
[0056]
附图17为微肽hmmw对人肾癌uok262细胞体内肿瘤生长的抑制作用;
[0057]
附图18为微肽hmmw对人皮肤癌a431细胞体内肿瘤生长的抑制作用;
[0058]
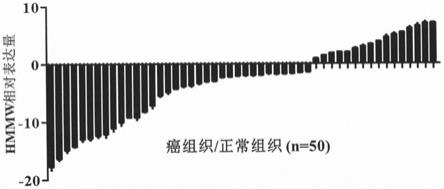
附图19为利用qpcr方法检测微肽hmmw在癌组织/正常组织中的表达水平。
具体实施方式
[0059]
下面结合具体实施例对本发明进一步进行描述。
[0060]
实施例1
[0061]
本实施例中,对hmmw微肽的编码能力进行检测。
[0062]
在体外构建带有flag标签,含有的cdna(其核苷酸序列如seq id no.1所示)的过表达载体为pcdna-hmmw,其中空质粒pcdna3.1图谱如图1所示。将上述质粒通过lipo3000脂质体转染试剂导入293t细胞中,转染48h后收集细胞,离心后弃上清收集沉淀细胞,利用pbs润洗沉淀细胞两次,离心弃上清收集沉淀细胞。向收集的沉淀细胞中加入ripa裂解液,冰上裂解20min,然后12000g离心10min收集上清。然后加入1xsds上样缓冲液,吹打混匀后煮沸变性5min。10%sds-page凝胶分离总蛋白,然后转移到pvdf膜上,5%脱脂奶粉室温封闭2h,与flag第一抗体(abcam)4℃孵育过夜,tbst洗涤3次。第二抗体室温孵育1h,tbst洗涤3次。ecl超敏化学发光液显影,经tannon成像系统成像检测是否有目的条带。
[0063]
结果如图2,经western blot(免疫印迹)检测发现转染重组质粒后,有微肽hmmw的目的条带出现,进一步说明微肽hmmw蛋白具有编码能力。
[0064]
实施例2
[0065]
本实施例中,利用固相合成法得到微肽hmmw,并对得到的微肽hmmw进行了检验。
[0066]
采用多肽固相合成法合成微肽hmmw,采用制备型hplc对合成的微肽hmmw进行分离纯化,利用分析型rp-hplc测定微肽hmmw的纯度。多肽固相合成法是以fmoc-wang-resin或fmoc-ctc-resin为起始原料,然后用保护氨基酸依次接二肽至五十一肽,接肽工作完成后充分洗涤,然后切肽、后处理即得血管生成抑制剂粗品。将粗品溶解,用制备型高效液相经过两次纯化,浓缩冻干得到纯品,最后经过第三次纯化得到微肽精制品。该方法不仅能保证合成的效率,还可提高产物纯度。具体如下:
[0067]
1.接肽(包括接二肽至五十一肽):
[0068]
称取fmoc-wang-resin或fmoc-ctc-resin适量,倒入玻璃砂芯反应柱中,加入ch2cl2适量使树脂充分膨胀。
[0069]
a.脱帽:加入六氢吡啶/n,n-二甲基甲酰胺(dmf)的脱帽液适量,反应一段时间后将脱帽液抽干,中间用dmf洗涤一次,然后再加入一次脱帽液适量反应,脱去fmoc保护基;
[0070]
b.洗涤:将脱帽液抽干,用dmf洗涤树脂,充分洗净副产物;
[0071]
c.缩合:将用于接肽的保护氨基酸和激活剂溶于dmf和缩合剂中,摇匀,温度控制在34℃左右,在反应釜中充分反应;
[0072]
d.洗涤:将反应液抽干,用dmf充分洗涤树脂,洗净副产物。
[0073]
2.切肽:
[0074]
将抽干的树脂装入圆底烧瓶中,加入切割液充分裂解合好的三十六肽中间体,用砂芯漏斗将树脂与多肽分离,所述的切割液的成分及各成分的体积组成为:三氟乙酸∶苯酚∶水∶苯甲硫醚∶edt=90∶3∶3∶2∶2。
[0075]
3.后处理:
[0076]
先加无水乙醚到切割液中将多肽析出,然后离心,把清液倒掉,然后再用无水乙醚洗涤多肽,抽干得多肽粗品。
[0077]
4.纯化:
[0078]
a.溶解:称取粗品配制成5-20g/l的溶液,用孔径为0.45μm的混合滤膜过滤。
[0079]
制备:通过半制备型高效液相色谱进行一次纯化、二次纯化和三次纯化得到多肽精制合格品,流动相:a为乙腈,b为0.1%tfa水溶液。
[0080]
一次纯化:用10%-90%的乙腈和20%-80%的缓冲溶液,流速为50ml/min-100ml/min,冲洗10min平衡制备柱。溶解过滤后的粗品用输液泵上样。
[0081]
表1一次纯化的洗脱梯度
[0082][0083]
收集紫外波长220nm吸收值大于200mv的溶液,检测纯度大于95%的合并作为峰顶,待做二次分离纯化。
[0084]
二次纯化:将一次纯化收到的峰顶旋转蒸发去除有机溶剂后,用5-95%的乙腈和15-85%的缓冲溶液,流速为50-100ml/min,用输液泵上样。
[0085]
表2二次纯化洗脱梯度
[0086][0087]
收取在紫外波长220nm吸收大于200mv的溶液,通过检测纯度大于98%的作为合格。
[0088]
b.浓缩、过滤、冻干:将合格溶液用旋转蒸发仪37℃减压浓缩,除去残留溶剂和注射用水。最后用0.22μm滤膜过滤,滤液装入冻干盘中,用冷冻干燥机进行冷冻干燥得纯品。
[0089]
三次纯化:二次纯化所得纯度大于98%的合格样品进行三次纯化,用5-95%的乙腈和10-90%的缓冲溶液,流速为50-100ml/min,制备多肽精制品。
[0090]
表3三次纯化洗脱梯度
[0091][0092]
收取在紫外波长220nm吸收大于220mv的溶液,通过检测合并大于99.5%的样品,即为精制合格品。
[0093]
5.纯度检测
[0094]
收集冻干后的纯化产物,通过分析型rp-hplc进行多肽纯度检测。分析条件为:流动相:acn(+0.1%tfa)、h2o(+0.1%tfa);乙腈线性梯度:10%-100%;流速:1ml/min;运行时间:20min;上样量:20μl;检测波长:220nm。
[0095]
表4 rp-hplc检测血管生成抑制剂多肽i-vi的纯度
[0096][0097]
合成的多肽经反向液相色谱分析进行纯度鉴定,结果发现制备的微肽hmmw纯度高达98.87%,大于95%,符合设计要求。
[0098]
本实验成功采用固相合成法合成微肽hmmw,此方法重复性高,可操作性强,污染少;实验可采用两种树脂来合成多肽即:wang resin或ctc resin;实验用wang resin,相对其它树脂比较稳定,副反应少,工艺粗品峰型较好,纯化相对收率高,所以成本相对较低;实验用ctc resin反应受温度影响小,反应速率快;并使用反相高效液相法纯化多肽,使用梯度洗脱相对于等度洗脱来说,分离效果更好,分离过程中,保留时间合适,生产效率高,纯度高。
[0099]
实施例3
[0100]
本实施例中检测微肽hmmw对人肿瘤细胞增殖能力的影响。
[0101]
将人头颈癌scc4细胞、甲状腺癌sw579细胞、肺癌a549细胞、食管鳞癌te13细胞、胃癌mgc803细胞、乳腺癌mda-mb-231细胞、肾癌uok262细胞、皮肤癌a431在37℃、5%co2的培养箱中培养至密度90%时用胰蛋白酶消化收集,用培养液重悬细胞并在显微镜下计数,将细胞浓度调整为3.0
×
104个/ml,将细胞悬液接种到96孔板中,每孔100μl,并于37℃,5%co2培养箱中培养过夜。待细胞完全贴壁后,以加入不同剂量的微肽hmmw作为给药组,紫杉醇(taxol)作为阳性对照组,以不加任何药物的培养液作为空白对照组,用培养液稀释到各个预定浓度。将各个稀释液分别加入96孔板中,每孔100μl,在37℃,5%co2培养箱孵育48h。向96孔板中每孔加入20μl 5mg/ml的mtt,继续培养4h。吸去培养基,每孔加入100μl dmso溶解。用酶标仪在检测波长为570nm,参比波长为630nm处测定吸光值,并计算生长抑制率(proliferation inhibition,pi),公式为pi(%)=1-给药组/阴性组。试验独立重复3次,试验得到的结果以mean
±
sd表示,并进行统计t检验,*p<0.05为显著性差异,**p<0.01为极显著性差异。
[0102]
结果见图3-10,与阴性对照相比,在1-32μm剂量下,微肽hmmw能够在不同程度显著抑制人头颈癌scc4细胞(图3)、甲状腺癌sw579细胞(图4)、肺癌a549细胞(图5)、食管鳞癌te13细胞(图6)、胃癌mgc803细胞(图7)、乳腺癌mda-mb-231细胞(图8)、肾癌uok262细胞(图9)、皮肤癌a431(图10)的增殖,并且呈现剂量依赖关系,因此可考虑微肽hmmw作为抗肿瘤药物,考察是否能通过干扰如肿瘤细胞迁移、侵袭能力、进而抑制肿瘤进程。
[0103]
实施例4
[0104]
微肽hmmw对人肿瘤细胞迁移能力的影响
[0105]
将人头颈癌scc4细胞、甲状腺癌sw579细胞、肺癌a549细胞、食管鳞癌te13细胞、胃癌mgc803细胞、乳腺癌mda-mb-231细胞、肾癌uok262细胞、皮肤癌a431细胞接种到transwell小室中,每孔100μl,同时每个小室加入不同剂量的微肽hmmw 100μl。然后在transwell下室加入0.6ml含10%fbs的完全培养基刺激细胞迁移,于5%co2,37℃培养24h。弃去孔中培液,用90%酒精常温固定30min,0.1%结晶紫常温染色10min,清水漂净,用棉签轻轻擦掉上层未迁移细胞,显微镜下观察并选择四个视野拍照计数。按照公式计算细胞的迁移抑制率(migration inhibition rate,mir):
[0106][0107]
其中ntest为测试组(表格中剂量为1、4、14μm的各组)的细胞迁移数,ncontrol为空白对照组(表格中剂量为0μm的各组)的细胞迁移数。
[0108]
试验独立重复3次,试验得到的结果计算mean
±
sd,并进行统计t检验,此处所述的试验独立重复3次是指表中任一类型的细胞的每种剂量,重复实验三次后,利用上述公式计算得到细胞迁移数(mean
±
sd)。利用p值表示统计学意义上的差异,结果的统计学意义是结果真实程度(能够代表总体)的一种估计方法,*p<0.05为显著性差异,**p<0.01为极显著性差异。
[0109]
表5微肽hmmw对人肿瘤细胞迁移能力的抑制作用
[0110]
[0111][0112]
结果见表5,与阴性对照相比,在1-16μm剂量下,微肽hmmw能够在不同程度显著抑制人头颈癌scc4细胞、甲状腺癌sw579细胞、肺癌a549细胞、食管鳞癌te13细胞、胃癌mgc803细胞、乳腺癌mda-mb-231细胞、肾癌uok262细胞、皮肤癌a431细胞的迁移,并且呈现剂量依赖关系,这说明微肽hmmw可以作为治疗药物抑制恶性肿瘤细胞的迁移能力。
[0113]
实施例5
[0114]
微肽hmmw对人肿瘤细胞侵袭能力的影响。
[0115]
将10mg/ml matrigel用培养基以1∶3稀释,涂布于transwell小室膜上,室温风干。将培养到对数生长期的人头颈癌scc4细胞、甲状腺癌sw579细胞、肺癌a549细胞、食管鳞癌te13细胞、胃癌mgc803细胞、乳腺癌mda-mb-231细胞、肾癌uok262细胞、皮肤癌a431细胞用胰蛋白酶消化,收集,用pbs洗涤两次后用空白培养基重悬。将细胞浓度调整到1
×
105个/ml。将细胞接种到transwell小室中,每孔100μl,同时每个小室加入不同剂量的微肽hmmw100μl。在transwell下室加入0.6ml含10%fbs的完全培养基刺激细胞侵袭,于5%co2,37℃培养24h。弃去孔中培液,用90%酒精常温固定30min,0.1%结晶紫常温染色10min,清水漂净,用棉签轻轻擦掉上层未发生侵袭的细胞,显微镜下观察并选择四个视野拍照计数。按照公式计算侵袭抑制率(invasion inhibition rate,iir):
[0116][0117]
其中n
test
为测试组(表格中剂量为1、4、16μm的各组)的细胞侵袭数,n
control
为空白对照组(表格中剂量为0μm的各组)的细胞侵袭数。试验独立重复3次,试验得到的结果计算mean
±
sd,并进行统计t检验。利用p值表示统计学意义上的差异,结果的统计学意义是结果
真实程度(能够代表总体)的一种估计方法,*p<0.05为显著性差异,**p<0.01为极显著性差异。
[0118]
表6微肽hmmw对人肿瘤细胞侵袭能力的抑制作用
[0119][0120][0121]
结果见表7,与阴性对照相比,在1-16μm剂量下,微肽hmmw能够在不同程度显著抑制人头颈癌scc4细胞、甲状腺癌sw579细胞、肺癌a549细胞、食管鳞癌te13细胞、胃癌mgc803细胞、乳腺癌mda-mb-231细胞、肾癌uok262细胞、皮肤癌a431细胞的侵袭,并且呈现剂量依赖关系,这说明微肽hmmw可以作为治疗药物抑制恶性肿瘤细胞的侵袭能力。
[0122]
实施例6
[0123]
微肽hmmw对人肿瘤细胞体内生长的影响。
[0124]
(1)大量培养人头颈癌scc4细胞、甲状腺癌sw579细胞、肺癌a549细胞、食管鳞癌te13细胞、胃癌mgc803细胞、乳腺癌mda-mb-231细胞、肾癌uok262细胞、皮肤癌a431细胞,采用0.25%胰酶溶液消化,终止消化后细胞悬液1000rpm离心5min,用无血清的dmem培养基重悬细胞后计数,调整细胞浓度至5
×
107个/ml;
[0125]
(2)每只裸鼠(订购4-6周龄、体重在14-16g的雌性,在spf级动物饲养室适应性饲养1周)左侧腋下接种100μl对应组别的细胞悬液,注射细胞量为5
×
106个;
[0126]
(3)接种后密切观察裸鼠接种部位的肿瘤生长情况,接种后第7天,接种部位出现白色结节,触摸后可于皮下活动,随肿瘤组织生长,接种部位逐渐形成坚硬瘤块,约14天肿瘤组织平均体积达到100mm3,将balb/c裸鼠随机分至三组(生理盐水组为空白对照,微肽hmmw使用量为10mg/kg的为低剂量,微肽hmmw使用量为15mg/kg的为高剂量),每组6只,开始给药时动物体重为16-18g;
[0127]
(4)每隔两日测量并记录移植瘤体积,肿瘤体积(tumor volume,tv)计算公式如下:
[0128]
肿瘤体积=0.5
×
a
×
b^2
[0129]
其中,a为移植瘤长度(mm),b为移植瘤宽度(mm)。
[0130]
结果见图11-18,与生理盐水对照组相比,微肽hmmw能够在不同程度显著抑制人头颈癌scc4细胞(图11)、甲状腺癌sw579细胞(图12)、肺癌a549细胞(图13)、食管鳞癌te13细胞(图14)、胃癌mgc803细胞(图15)、乳腺癌mda-mb-231细胞(图16)、肾癌uok262细胞(图17)、皮肤癌a431(图18)细胞的体内成瘤能力,并且呈现剂量依赖关系,因此可考虑微肽hmmw作为一种新型的抗肿瘤多肽。
[0131]
实施例7
[0132]
hmmw在肿瘤病人及正常癌旁组织中的表达情况。
[0133]
tcga标准方法下载包括头颈癌、脑胶质瘤、甲状腺癌、食管鳞癌、肺癌、肝癌、胃癌、肾癌、乳腺癌、卵巢癌、宫颈癌、膀胱癌、结直肠癌、胰腺癌、骨肉瘤、皮肤癌在内的16种肿瘤的癌组织和正常组织的rna-seq测序文件及临床信息,分析微肽hmmw的差异表达(判断标准:(1)|癌/癌旁的表达量|>2,(2)p<0.05)。
[0134]
表7微肽hmmw在人肿瘤组织和正常组织中的表达量分析(癌/癌旁)
[0135][0136]
由表7所示,与正常组织比较,微肽hmmw在人头颈癌、甲状腺癌、肺癌、食管鳞癌、胃癌、乳腺癌、肾癌、皮肤癌8种肿瘤组织中的表达水平显著降低。说明微肽hmmw的表达与多种肿瘤的发展呈显著负相关。
[0137]
实施例8
[0138]
hmmw在头颈癌临床病人及正常癌旁组织中的表达情况。
[0139]
(1)标本的采集
[0140]
在患者知情同意的情况下,于术中采集头颈癌及癌旁组织标本,生理盐水清洗后,保存于液氮或-80℃冰箱中备用。
[0141]
(2)引物设计
[0142]
根据微肽hmmw对应的核苷酸序列采用primer premier5.0设计引物,序列如下:
[0143]
上游引物(序列如seq id no.3所示)
[0144]
下游引物(序列如seq id no.4所示)
[0145]
(3)实时定量pcr检测hmmw在头颈癌病人及正常癌旁组织中的表达。
[0146]
按life公司的trizol说明书提取收集样本的总rna,再用nanodrop nd-1000核酸定量仪定量所提取的rna的纯度和浓度,琼脂糖质检确保提取rna的完整性。采用takara试剂盒primescripttm rt reagent kit with gdna eraser(perfect real time)对提取的总rna反转录合成cdna。采用takara试剂盒premix ex taq
tm
ii(tlirnaseh plus)进行qpcr反应。反应体系如下表:
[0147]
表8 pcr反应体系
[0148][0149]
将上述组份混合均匀后按以下程序:95℃30s预变性,40个循环;95℃5s,60℃30s。根据熔解曲线判断反应的特异性,利用2-δδct
法计算hmmw的相对表达量。结果见图19,在75%左右的头颈癌样本中,hmmw的表达水平显著低于正常癌旁组织。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1