一种索玛鲁肽主肽链及其制备方法与流程
本发明涉及基因工程及多肽制备方法技术领域,具体涉及一种索玛鲁肽主肽链及其制备方法。
背景技术:
糖尿病是一组以高血糖为特征的代谢性疾病。高血糖则是由于胰岛素分泌缺陷或其生物作用受损,或两者兼有引起。糖尿病时长期存在的高血糖,导致各种组织,特别是眼、肾、心脏、血管、神经的慢性损害、功能障碍。
1型糖尿病,原名胰岛素依赖型糖尿病,多发生在儿童和青少年,也可发生于各种年龄。起病比较急剧,体内胰岛素绝对不足,容易发生酮症酸中毒,必须用胰岛素治疗才能获得满意疗效,否则将危及生命。其中,1型糖尿病患者占10%,2型糖尿病患者占90%。
索玛鲁肽(semaglutide)由novenordisk公司研发的长效glp-1类似物,该药物只需要进行每周一次的皮下注射给药,目前还处于临床三期阶段。从结构上看,semaglutide需要将26位lys接上peg、谷氨酸和十八烷酸脂肪链,其中8位采用非天然氨基酸氨基异丁酸。与liraglutide相比,semaglutide的脂肪链更长,疏水性增加,但是semaglutide经过短链的peg修饰,亲水性大大增强。peg修饰后不但可以与白蛋白紧密结合,掩盖dpp-4酶水解位点,还能降低肾排泄,可延长生物半衰期,达到长循环的效果。
索玛鲁肽作为胰高血糖素肽(glp-1)类似物的代表药物之一,在多个临床试验研究已经证明联合不同的口服降糖药可以有效控制血糖,并能够使患者减轻体重、减少收缩压及改善胰岛β细胞功能。
索玛鲁肽结构式如下:
h-his7-aib8-glu9-gly10-thr11-phe12-thr13-ser14-asp15-val16-ser17-ser18-tyr19-leu20-glu21-gly22-gln23-ala24-ala25-lys26(peg-peg-γ-glu-octadecanedioicacid)-glu27-phe28-ile29-ala30-trp31-leu32-val33-arg34-gly35-arg36-gly37-oh。
由以上结构式可知:索玛鲁肽分子式为c187h291n45o59,分子量为4113.58,cas号为910463-68-2,是在天然glp-1分子结构上将第34位的赖氨酸lys改为精氨酸arg,其中8位采用非天然氨基酸氨基异丁酸,并在26位增加了1条18碳脂肪酸(peg-peg-γ-glu-octadecanedioicacid)侧链而得到的衍生物。
索玛鲁肽最早由诺和诺德公司开发研制,通过基因重组技术,利用酵母生产获得。现有技术中中间体多肽arg34glp-1(9-37)(第34位氨基酸由lys突变为arg)的合成方法主要采用化学合成,如专利cn201410784161.4公开了使用多种大量有机溶剂,对环境不友好,且步骤繁琐不利于大规模工业放大;工艺杂质多;总收率低。
另外涉及生物制备方法的专利cn104745597a中公开了表达方式为胞内可溶性表达,表达量较低,不利于工业化放大。专利cn104592381a中公开了包涵体溶解耗时过长,体积过大,使用大量的尿素;包涵体需要长时间复性并且复性蛋白浓度低,复性所需体积过大,不利于工业放大。
本
技术实现要素:
本发明的目的在于提供一种利用大肠杆菌基因重组工程制备索玛鲁肽主肽链arg34glp-1(9-37)的方法,通过基因重组技术,利用大肠杆菌发酵诱导表达获得前导肽-ddddk-arg34glp-1(9-37)重组蛋白,其中前导肽作为重组蛋白的前导肽,有助于重组蛋白的高水平表达和索玛鲁肽中间体多肽的复性;ddddk表示天冬氨酸-天冬氨酸-天冬氨酸-天冬氨酸赖氨酸,作为肠激酶识别位点,用于切除重组蛋白的前导肽;arg34glp-1(9-37)表示人胰高血糖素样肽的9位-37位氨基酸序列片段(第34位氨基酸由lys突变为arg),是目的蛋白序列。上述重组蛋白经过溶解、变复性、酶切、分离等操作获得高收率和高纯度的多肽arg34glp-1(9-37),解决了现有技术中存在的杂质多、收率低、使用大量有机试剂对环境不友好,胞内可溶性表达导致表达量低,包涵体溶解和变复性时间长,蛋白浓度低导致变复性体积过大,不适合大规模生产,并限制了产能提升的问题。
目前,缺乏一种高纯度和高收率的索玛鲁肽主肽链及其制备方法。
发明内容
本发明的目的是针对上述问题,本发明提供了一种高纯度和高收率的索玛鲁肽主肽链及其制备方法。
为了实现上述目的,本发明提供如下的技术方案:本发明的一种索玛鲁肽中间体多肽的重组蛋白,其特征在于:所述索玛鲁肽中间体多肽的重组蛋白为前导肽-ddddk-glp-1(9-37),所述索玛鲁肽中间体多肽的重组蛋白的氨基酸序列为seqidno.1所示;
在索玛鲁肽中间体制备中,可采用如下前导肽:
(1)mflkgdgyvqgiinfeglhhlvalglv;(2)ksi;(3)trxa;(4)dsba、(5)dsbc;(6)sumo;(7)gst;(8)intein;(9)kpstyi。
本发明的一种基因重组表达质粒,含有编码权利要求1所述重组蛋白的编码基因。
本发明的一种包含所述的基因重组表达质粒的重组工程菌,采用所述的基因重组表达质粒转入到大肠杆菌bl21(de3),hms174(de3)、jm109(de3)、t7express、bl21(de3plyss)和rosetta2(de3)中任意一种得到。
本发明的一种所述的重组工程菌在重组索玛鲁肽中间体glp-1(9-37)表达方面的应用。
本发明的一种索玛鲁肽主肽链的制备方法,其特征在于包括以下步骤:
(1)合成编码基因,所述编码基因编码所述的重组蛋白;
(2)将编码基因连接到表达载体中,得到重组表达载体;
(3)将带有编码基因的重组表达载体转化到大肠杆菌宿主中,构建重组工程菌;
(4)利用抗性平板筛选含有目的基因重组表达质粒的重组工程菌;
(5)重组工程菌发酵,诱导胞内不溶性包涵体形式的重组蛋白的表达,所述重组蛋白包含seqidno.1所示的氨基酸序列;
(6)将菌体进行高压均质,收集包涵体,然后将包涵体经过洗涤和变复性;
(7)酶切转化和分离纯化得到中间体多肽glp-1(9-37);
(8)将中间体多肽与二肽(fmoc-his-aib-su)于碱性水溶液中,合成索玛鲁肽主肽链。
进一步地,在步骤(2)中,所述的基因重组表达质粒:通过将所述的编码基因克隆进入质粒载体pet-24a(+)、pet-28a(+)、pet-29a(+)、pet-31b(+)或者pet-39b(+)中获得重组表达载体pet-24a(+)-前导肽-ddddk-glp-1(9-37),pet-28a(+)-前导肽-ddddk-glp-1(9-37),pet-29a(+)-前导肽-ddddk-glp-1(9-37)、pet-31b(+)-前导肽-ddddk-glp-1(9-37)或pet-39b(+)-前导肽-ddddk-glp-1(9-37)。
进一步地,在步骤(2)中,编码基因与表达载体的连接方式为通过alwni/xhoi、hindiii/xhoi、hindiii/ncoi、xhoi/eagi或者saci/sali酶切位点插入到质粒载体pet-24a(+)、pet-28a(+)、pet-29a(+)、pet-31b(+)或者pet-39b(+)中的任意一种相应酶切位点中;所述步骤(5)中,重组工程菌进行发酵培养,诱导表达所用的诱导剂为异丙基硫代半乳糖苷。
更进一步地,在步骤(6)中,将洗涤后的包涵体在ph为7.5-14的碱性条件下,按照蛋白浓度为5-40g/l加入包涵体溶解缓冲液,进行包涵体溶解变性。
进一步地,在步骤(7)中,所述酶切转化、分离纯化的具体方式为:步骤(6)变复性后的重组蛋白经肠激酶所述的溶液的ph范围为10.0-11.0;步骤(6)变复性后的重组蛋白经肠激酶酶解8-12h后即可得到中间体多肽、标签和连接肽的混合液,混合液使用离子交换分离即可获得纯度符合要求的中间体多肽样品;。
进一步地,在步骤(8)中,索玛鲁肽主肽链合成反应溶液为纯化水,或者为纯化水与甲醇的混合溶液;溶液的ph范围为9.5-11.5。
有益效果:本发明制备的索玛鲁肽中间体多肽纯度高,达到89%以上,收率大于82%,本发明采用离子交换分离纯化,分离度高,纯化效果好,杂质少,操作简单。
本发明相对现有技术,具有以下优势:(1)通过改变前导肽序列,构建前导肽-ddddk-glp-1(9-37)重组蛋白,表达方式变为胞内不溶性包涵体表达,表达量显著增加;(2)洗涤后的包涵体采用碱溶,无需使用大量的变性剂,按照蛋白浓度为30-50g/l的高浓度加入包涵体溶解缓冲液,变复性时间大大缩短不超过1h,溶解后既可以酶切,肠激酶酶解时间大大缩短;减少复性工序,缩小酶切体系,降低化学试剂成本,有利于工业化放大。
附图说明
下面将结合附图进一步说明,附图中:
图1实施例1中重组质粒的构建图。
图2实施例3索玛鲁肽中间体多肽tfa-rp-hplc谱图,相对保留时间4.99min。
图3索玛鲁肽中间体多肽ms谱图。
图4索玛鲁肽主肽链tfa-rp-hplc谱图,相对保留时间10.46min。
图5索玛鲁肽主肽链多肽ms谱图。
具体实施方式
为便于本领域技术人员理解本发明内容,下面将结合具体实施例进一步描述本发明的技术方案,但以下内容不应以任何方式限制本发明权利要求书请求保护的范围。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
本发明的一种索玛鲁肽中间体多肽的重组蛋白,其特征在于:所述索玛鲁肽中间体多肽的重组蛋白为前导肽-ddddk-glp-1(9-37),所述索玛鲁肽中间体多肽的重组蛋白的氨基酸序列为seqidno.1所示;
在索玛鲁肽中间体制备中,可采用如下前导肽:
(1)mflkgdgyvqgiinfeglhhlvalglv;(2)ksi;(3)trxa;(4)dsba、(5)dsbc;(6)sumo;(7)gst;(8)intein;(9)kpstyi。
本发明的一种基因重组表达质粒,含有编码权利要求1所述重组蛋白的编码基因。
本发明的一种包含所述的基因重组表达质粒的重组工程菌,采用所述的基因重组表达质粒转入到大肠杆菌bl21(de3),hms174(de3)、jm109(de3)、t7express、bl21(de3plyss)和rosetta2(de3)中任意一种得到。
本发明的一种所述的重组工程菌在重组索玛鲁肽中间体glp-1(9-37)表达方面的应用。
本发明的一种索玛鲁肽主肽链的制备方法,包括以下步骤:
(1)合成编码基因,所述编码基因编码所述的重组蛋白;
(2)将编码基因连接到表达载体中,得到重组表达载体;所述的基因重组表达质粒:通过将所述的编码基因克隆进入质粒载体pet-24a(+)、pet-28a(+)、pet-29a(+)、pet-31b(+)或者pet-39b(+)中获得重组表达载体pet-24a(+)-前导肽-ddddk-glp-1(9-37),pet-28a(+)-前导肽-ddddk-glp-1(9-37),pet-29a(+)-前导肽-ddddk-glp-1(9-37)、pet-31b(+)-前导肽-ddddk-glp-1(9-37)或pet-39b(+)-前导肽-ddddk-glp-1(9-37)。编码基因与表达载体的连接方式为通过alwni/xhoi、hindiii/xhoi、hindiii/ncoi、xhoi/eagi或者saci/sali酶切位点插入到质粒载体pet-24a(+)、pet-28a(+)、pet-29a(+)、pet-31b(+)或者pet-39b(+)中的任意一种相应酶切位点中。
(3)将带有编码基因的重组表达载体转化到大肠杆菌宿主中,构建重组工程菌;
(4)利用抗性平板筛选含有目的基因重组表达质粒的重组工程菌;
(5)重组工程菌发酵,诱导胞内不溶性包涵体形式的重组蛋白的表达,所述重组蛋白包含seqidno.1所示的氨基酸序列;重组工程菌进行发酵培养,诱导表达所用的诱导剂为异丙基硫代半乳糖苷。
(6)将菌体进行高压均质,收集包涵体,然后将包涵体经过洗涤和变复性;将洗涤后的包涵体在ph为7.5的碱性条件下,按照蛋白浓度为40g/l加入包涵体溶解缓冲液,进行包涵体溶解变性。
(7)酶切转化和分离纯化得到中间体多肽glp-1(9-37);所述酶切转化、分离纯化的具体方式为:步骤(6)变复性后的重组蛋白经肠激酶所述的溶液的ph范围为10.0;步骤(6)变复性后的重组蛋白经肠激酶酶解8h后即可得到中间体多肽、标签和连接肽的混合液,混合液使用离子交换分离即可获得纯度符合要求的中间体多肽样品。
(8)将中间体多肽与二肽(fmoc-his-aib-su)于碱性水溶液中,合成索玛鲁肽主肽链。索玛鲁肽主肽链合成反应溶液为纯化水,溶液的ph范围为9.5。
实施例2
实施例2与实施例1的区别在于:
本发明的一种索玛鲁肽主肽链的制备方法,包括以下步骤:
在步骤(6)中,将菌体进行高压均质,收集包涵体,然后将包涵体经过洗涤和变复性;将洗涤后的包涵体在ph为14的碱性条件下,按照蛋白浓度为30g/l加入包涵体溶解缓冲液,进行包涵体溶解变性。
在步骤(7)中,酶切转化和分离纯化得到中间体多肽glp-1(9-37);所述酶切转化、分离纯化的具体方式为:步骤(6)变复性后的重组蛋白经肠激酶所述的溶液的ph范围为11.0;步骤(6)变复性后的重组蛋白经肠激酶酶解12h后即可得到中间体多肽、标签和连接肽的混合液,混合液使用离子交换分离即可获得纯度符合要求的中间体多肽样品。
在步骤(8)中,将中间体多肽与二肽(fmoc-his-aib-su)于碱性水溶液中,合成索玛鲁肽主肽链。索玛鲁肽主肽链合成反应溶液为纯化水与甲醇的混合溶液;溶液的ph范围为10。
实施例3
实施例3与实施例1的区别在于:
本发明的一种索玛鲁肽主肽链的制备方法,包括以下步骤:
在步骤(6)中,将菌体进行高压均质,收集包涵体,然后将包涵体经过洗涤和变复性;将洗涤后的包涵体在ph为12的碱性条件下,按照蛋白浓度为5g/l加入包涵体溶解缓冲液,进行包涵体溶解变性。
在步骤(7)中,酶切转化和分离纯化得到中间体多肽glp-1(9-37);所述酶切转化、分离纯化的具体方式为:步骤(6)变复性后的重组蛋白经肠激酶所述的溶液的ph范围为10.5;步骤(6)变复性后的重组蛋白经肠激酶酶解10h后即可得到中间体多肽、标签和连接肽的混合液,混合液使用离子交换分离即可获得纯度符合要求的中间体多肽样品。
在步骤(8)中,将中间体多肽与二肽(fmoc-his-aib-su)于碱性水溶液中,合成索玛鲁肽主肽链。索玛鲁肽主肽链合成反应溶液为纯化水,溶液的ph范围为11.5。
实施例4
重组工程菌的构建
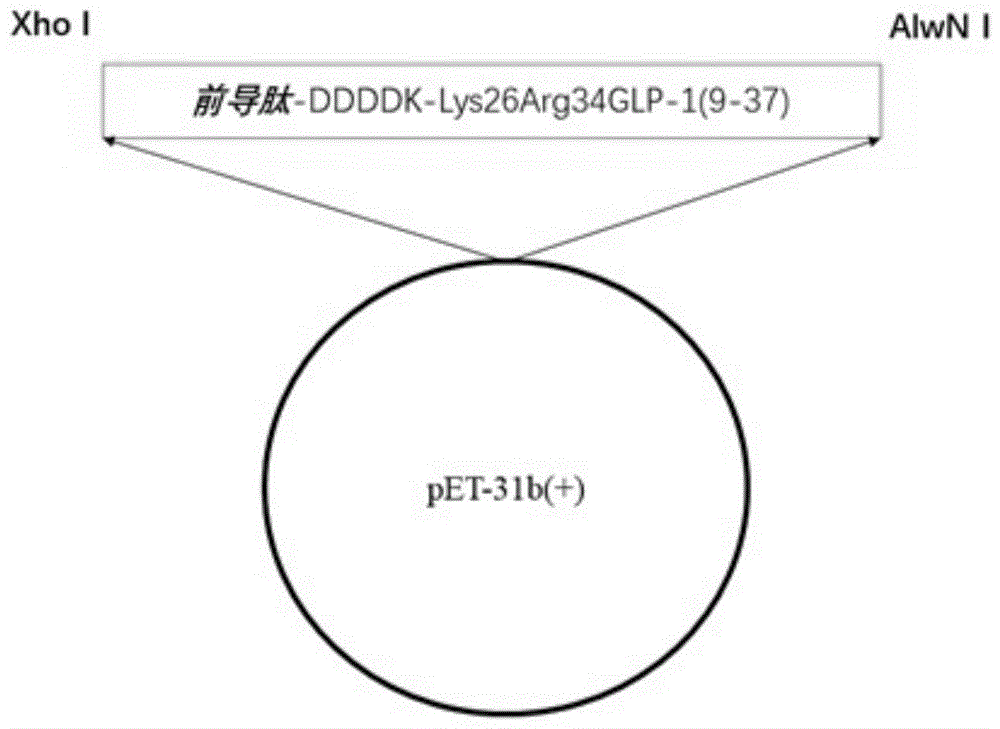
利用常规的化学合成方法合成前导肽-ddddk-glp-1(9-37)重组蛋白的基因,将获得的序列cdna通过alwni/xhoi酶切位点插入到质粒pet-31b(+)相应酶切位点中,构建成的重组质粒如图1所示,插入编码前导肽-ddddk-glp-1(9-37)重组蛋白基因的重组质粒通过常规的化学转化法转入到宿主大肠杆菌bl21(de3)中。
实施例5
工程菌发酵培养
接种实施例1所得的重组工程菌阳性克隆于lb培养基中,在37℃振荡培养至od600值达到1-2时作为种子液,接入7l的发酵培养基中进行培养。当发酵液od600值达到19-21时加入iptg进行诱导,诱导8h后放罐。放罐后离心收集菌体。
实施例6
中间体多肽的纯化
将实施例5所得的发酵液放罐后离心收集菌体,按照重量体积比1:7加入破碎缓冲液,通过高压均质机破碎菌体,离心收集包涵体沉淀。将沉淀按重量体积比1:15加入洗涤缓冲液。将洗涤后的包涵体按照蛋白浓度为40g/l加入包涵体溶解缓冲液,调节ph为碱性溶解1h进行变复性。溶解后的包涵体溶液加入肠激酶,在37℃下酶解12h后即可得到中间体多肽、标签和连接肽的混合液。取含27.6g目的蛋白的混合液,使用离子交换纯化后获得纯度为93.2%的中间体多肽样品。取目的峰样品进行hplc和质谱检测,hplc检测的目的蛋白的纯度为98.6%,hplc图谱如图2所示,收集到的目的蛋白为24.1g,收率为87.3%;质谱检测出目的蛋白的分子量为3174.86da,m/z:850.2190[m+4h]4+,和索玛鲁肽多肽中间体分子量一致,如图3所示。
实施例7
中间体多肽的纯化
将实施例5所得的发酵液放罐后离心收集菌体,按照重量体积比1:7加入破碎缓冲液,通过高压均质破碎菌体,离心收集包涵体沉淀。将沉淀按重量体积比1:15加入洗涤缓冲液,洗涤后离心收集的沉淀用洗涤液洗涤3次。将洗涤后的包涵体按照蛋白浓度为50g/l加入包涵体溶解缓冲液,调节ph为碱性溶解1h进行变复性。溶解后的包涵体溶液加入肠激酶,在37℃下酶解7h后即可得到中间体多肽、标签和连接肽的混合液。取含目的蛋白的混合液进行离子交换层析纯化,取洗脱峰样品进行hplc和质谱检测,hplc检测目的蛋白的纯度为98.8%和收集到的目的蛋白收率为88.2%;质谱检测出目的蛋白的分子量和索玛鲁肽多肽中间体分子量一致。
实施例8
中间体多肽的纯化
将实施例5所得的发酵液放罐后离心收集菌体,按照重量体积比1:7加入破碎缓冲液,通过高压均质机破碎菌体,离心收集包涵体沉淀。将沉淀按重量体积比1:15加入洗涤缓冲液。将洗涤后的包涵体按照蛋白浓度为30g/l加入包涵体溶解缓冲液,调节ph为碱性溶解1h进行变复性。溶解后的包涵体溶液加入肠激酶,在37℃下酶解12h后即可得到中间体多肽、标签和连接肽的混合液。取含26.8g目的蛋白的混合液进行离子交换层析纯化,取洗脱峰样品进行hplc和质谱检测,目的蛋白的纯度为97.9%,收集到的目的蛋白收率为87.7%;质谱检测出目的蛋白的分子量与索玛鲁肽中间体分子量一致。
实施例9
索玛鲁肽主肽链的合成
将实施例7中的收集的目的蛋白加至水中,用1mol/l氢氧化钠溶液调至ph10.6,搅拌使其完全溶解。滴加二肽fmoc-his-aib-su的乙腈溶液,控制整个滴加过程溶液ph10.5。搅拌反应30min,hplc监测反应完全。用乙酸调至ph5.0等电点,有白色沉淀生成,离心得白色固体。减压冷冻干燥得白色索玛鲁肽粗品收率97%,hplc纯度98.2%,如图4所示。目的蛋白的分子量为3396.84da,m/z:850.2190[m+4h]4+,和索玛鲁肽多肽中间体分子量一致,如图5所示。
实施例10
索玛鲁肽主肽链的合成
将实施例7中的收集的目的蛋白加至水中,用1mol/l氢氧化钠溶液调至ph10.6,搅拌使其完全溶解。滴加二肽fmoc-his-aib-su的乙腈溶液,控制整个滴加过程溶液ph10.0。搅拌反应30min,hplc监测反应完全。用乙酸调至ph5.0等电点,有白色沉淀生成,离心得白色固体。减压冷冻干燥得白色索玛鲁肽粗品收率97%,hplc纯度94.95%。质谱检测出目的蛋白的分子量与索玛鲁肽主肽链分子量一致。
实施例11
索玛鲁肽主肽链的合成
将实施例7中的收集的目的蛋白加至水中,用1mol/l氢氧化钠溶液调至ph10.6,搅拌使其完全溶解。滴加二肽fmoc-his-aib-su的乙腈溶液,控制整个滴加过程溶液ph9.5。搅拌反应30min,hplc监测反应完全。用乙酸调至ph5.0等电点,有白色沉淀生成,离心得白色固体。减压冷冻干燥得白色索玛鲁肽粗品收率97%,hplc纯度92.45%。质谱检测出目的蛋白的分子量与索玛鲁肽主肽链分子量一致。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,本发明要求保护范围由所附的权利要求书、说明书及其等效物界定。
序列表
<110>南京迪维奥医药科技有限公司
<120>一种索玛鲁肽主肽链及其制备方法
<130>2019
<160>1
<170>siposequencelisting1.0
<210>1
<211>40
<212>prt
<213>人工序列(前导肽的氨基酸序列)
<400>1
lysproserthrtyrileaspaspaspasplysgluglythrphethr
151015
seraspvalsersertyrleugluglyglnalaalalysglypheile
202530
alatrpleuvalargglyarggly
3540
- 还没有人留言评论。精彩留言会获得点赞!