一种赤藓糖醇发酵生产方法与流程
本发明涉及赤藓糖醇生产
技术领域:
,特别是涉及一种赤藓糖醇发酵生产方法。
背景技术:
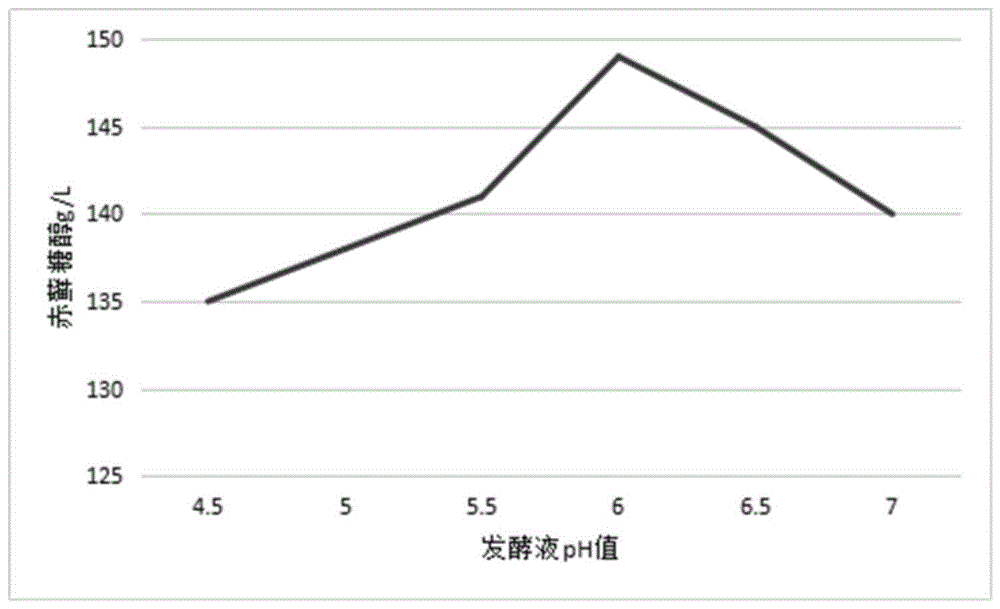
:赤藓糖醇,又叫赤藓醇,是一种新型糖醇类食品甜味剂。赤藓糖醇具有结晶性好,低热量、高稳定性、甜味协调、无吸湿性、冰点低、无龋齿性、不会引起肠胃不适等特点,赤藓糖醇不参与糖代谢,适合糖尿病人食用,可作为糖尿病人的替代性甜味剂;另外赤藓糖醇对热和酸十分稳定,在一般食品加工条件下,几乎不会出现褐变或分解现象。目前在国际甜味剂市场,赤藓糖醇作为新型功能食品添加剂具有较强的竞争力。在食品加工方面,赤藓糖醇有以下几个方面的优势:赤藓糖醇的甜度较高,可用做食品和饮料的甜味剂;赤藓糖醇分子量小,相同浓度的溶液具有较高的渗透压和较低的水分活度,可用于低水分活度食品的加工保藏;赤藓糖醇的溶解热较大,故用它制造的固体食品和糖果由较明显的凉爽感;赤藓糖醇的甜味爽净,在与其他高甜度甜味剂如蛋白糖、甜菊糖等复配时可有效地掩盖这些甜味剂的后苦味;赤藓糖醇的热量低,因而可用于生产低热量食品和饮料;赤藓糖醇还可促进溶液中的乙醇分子与水分子的结合,从而降低酒类饮料的酒精的异味和感官刺激,改善蒸馏酒和葡萄酒的质量。在医药化工等行业赤藓糖醇也有广泛的用途。在医药工业中赤藓糖醇可作为药品的矫味剂和片剂的赋形剂,可有效改善药品的口感。以赤藓糖醇为原料可以合成多种药物,如赤藓糖醇脱氧后生成的二脱氧赤藓糖具有抗hiv活性,赤藓糖醇硝化后生成的硝基赤藓糖醇可用于治疗心脑血管疾病和气喘病。在化工行业,赤藓糖醇作为有机合成的中间体,可以用于醇酸树脂、聚酯、聚醚的合成以及油漆、炸药制造等。在化妆品方面,赤藓糖醇可以代替部分甘油添加,可以防止化妆品变质。随着技术进步,赤藓糖醇新用途将不断被开发出来。赤藓糖醇可以通过三种工艺技术生产,分别是提取、化学合成和生物发酵。在某些蘑菇品种和海藻中赤藓糖醇的含量可高达5%,因此可以通过直接提取的方法生产,但通常这些菌类和藻类还含有甘露醇和其它多元醇类,如何将这些性质比较相似的多元醇有效分离以及经济性等成为提取法生产赤藓糖醇面临的难题。化学合成法可以由丁烯二醇与过氧化氢反应合成,也可以淀粉为原料用高碘酸氧化裂解生成赤藓糖醇,但化学合成生产赤藓糖醇的工艺方法存在流程长、成本高、条件要求高、产品安全性差等不足。发酵法是以葡萄糖为原料,经耐高渗酵母菌株发酵生产赤藓糖醇,经分离、提取、精制,获得高纯度的赤藓糖醇产品,与化学合成法相比,发酵法具有条件温和、易于控制、环境友好、污染少、产品安全、原料来源丰富、成本低等优点,更易于实现规模生产。目前赤藓糖醇常用的发酵生产法为连续发酵工艺,将产赤藓糖醇的菌株通过多级种子罐培养后,接至发酵罐,再向发酵罐内流加糖源、泡敌等,进行培养,待培养达到所要求的稳定产率后,所得发酵液进一步提取得到赤藓糖醇。连续发酵生产法的缺点是发酵周期较长,并且发酵罐易染菌,发酵产率也较低,生产成本较高。技术实现要素:本发明主要解决的技术问题是提供一种赤藓糖醇发酵生产方法,通过一次性投料发酵,可以缩短生产周期,提高产率。为解决上述技术问题,本发明采用的一个技术方案是:一种赤藓糖醇发酵生产方法,采用一次性投料方式将发酵培养基投入发酵罐内,之后高温灭菌,降温至32~37℃后向发酵罐内再移入od值为0.5~0.9的种子,发酵培养生产赤藓糖醇;所述发酵培养基的配方为:葡萄糖浓度30~40%,酵母膏浓度0.9~1.3%,尿素浓度0.12~0.18%,七水硫酸亚铁浓度0.0015~0.0025%,七水硫酸锌浓度0.0015~0.0025%;ph值为6.0~7.0;发酵培养的条件为:培养温度28~32℃,压力0.08~0.1mpa,ph值5.0~7.0,通风量4000~5000m3/h;其中,种子的接入量为发酵培养基重量的8~12%。作为一种优选的实施方式,所述种子的培养方法为:将种子培养基泵入空消的种子罐,经高温灭菌,之后降温至32~36℃,然后按8~12%的重量比例接入菌种,培养至od值为0.5~0.9,结束培养,得到培养好的种子。可选地,菌种可以为解脂假丝酵母。优选地,所述种子培养基配方为:所述种子培养基配方为:葡萄糖37~43g/l,酵母膏4~6g/l,尿素1~3g/l,水为溶剂;ph值6.0~7.0。优选地,种子的培养条件为:培养温度30~36℃,ph值6.0~7.0,压力0.1~0.15mpa,通风量0.3~0.8v/v·m,溶解氧为30~60%。优选地,种子培养时,培养至od值为0.6~0.7时结束培养。优选地,所述发酵培养基中葡萄糖浓度为35~40%。优选地,所述发酵罐内发酵液中赤藓糖醇产率浓度大于14g/dl,残还原糖质量百分比含量小于0.5%,产率浓度趋于稳定,即可停止培养。优选地,所述发酵培养的条件为:培养温度30~32℃,ph值5.5~6.5。优选地,所述种子的接入量为发酵培养基重量的10%。本发明提供的赤藓糖醇发酵方法,主要是针对现有的发酵采用连续性流加进料,这种连续流加发酵工艺复杂,控制难度高;在连续流加物料发酵过程中,流加物料会导致糖浓度控制不稳定,同时会带入热量导致发酵环境温度高于菌种生长所需温度,抑制菌种生长,温度过高或糖浓度过高都会抑制菌种生长,导致发酵周期较长,生成赤藓糖醇能力减退,转化率降低,发酵液中残余物较多,不利于提取,降低提取收率;这种连续流加发酵过程易染菌,产生的泡沫量较大,不利于发酵的进行。本发明采用一次性进料发酵工艺,即将发酵所需的发酵培养基一次性全部投入发酵罐内,之后高温灭菌,降温后向发酵罐内再移入培养好的种子,发酵培养生产赤藓糖醇。将发酵需要的糖源、氮源、无机盐等一次性的加入到发酵罐中,灭菌降温后,接入种子进一步发酵培养,在发酵过程中不需要再流加物料。采用一次性投料发酵,有效降低了发酵罐染菌风险,有利于发酵培养的菌种生长,提高了发酵转化率,缩短了发酵周期,还可以提高赤藓糖醇产率。当然,发酵过程也需要控制合适的环境条件,才能达到好的发酵效果。通过发酵培养基成分的选择,以及发酵过程中空气量、发酵培养温度、ph值等条件的控制,达到了缩短发酵周期、提高赤藓糖醇产率及转化率的效果。本发明提供的赤藓糖醇发酵方法,当发酵罐内发酵液产率浓度大于14g/dl,且残还原糖小于0.5%(w/w),产率浓度趋于稳定后,即可停止培养,将发酵液进一步提取即得到赤藓糖醇。采用本发明发酵方法,发酵周期小于100小时,转化率大于50%,赤藓糖醇产率大于14%,获得了发酵周期短、产率高的预料不到的效果。附图说明图1是本发明中发酵液ph值对赤藓糖醇含量的影响曲线图;图2是本发明中不同种子接种量对赤藓糖醇含量的影响曲线图。具体实施方式下面对本发明的技术方案进行详细说明。本发明提供的赤藓糖醇发酵生产方法,是通过一次性投料发酵,即采用一次性投料方式将发酵培养基投入发酵罐内,之后高温灭菌,于121℃下灭菌30min,然后降温至35℃后向发酵罐内再移入种子,发酵培养生产赤藓糖醇。在研究过程中,分别对发酵温度、发酵ph值、种子接种量等因素进行了考察。采用的发酵培养基的配方为:葡萄糖浓度35%,酵母膏浓度1.1%,尿素浓度0.15%,七水硫酸亚铁浓度0.002%,七水硫酸锌浓度0.002%;ph值6.0~7.0。其中的百分数(%)均为质量百分比。种子的培养方法为:将种子培养基泵入空消的种子罐,空消温度123-125℃,之后种子罐内物料于121℃下灭菌30min,之后降温至36℃,然后按10%(质量百分数)的比例接入菌种,菌种为解脂假丝酵母,购买于山东省食品发酵工业研究设计院。培养至od值为0.6,结束培养,得到培养好的种子。其中种子培养基配方为:葡萄糖40g/l、酵母膏5g/l、尿素2g/l,采用自来水为溶剂,ph值6.0。在种子罐内种子的培养条件为:培养温度30~33℃,ph值6.0~7.0,压力0.1mpa,通风量0.3~0.8v/v·m,溶解氧为30~60%。发酵罐内发酵液中赤藓糖醇产率浓度大于14g/dl,残还原糖质量百分比含量小于0.5%,产率浓度趋于稳定,停止培养。首先对发酵温度进行考察。一、发酵温度发酵过程必须提供微生物合适的生长温度,酶的活性受温度影响也很明显。在酶适宜的生长代谢温度范围内,酶活性随着温度的升高而提高,发酵反应速度增快,菌种生长代谢加快,可缩短发酵周期,但温度过高,酶会失活,菌种提前衰老自溶,产量下降,转化率降低;温度还会影响菌体的生产合成方向及菌体的代谢调节。因此,适宜的发酵温度有利于赤藓糖醇的生产。选择50l发酵罐,发酵压力控制在0.08~0.1mpa范围内,ph值控制为6.0~6.5,通风量在4000~4500m3/h范围内。向发酵罐内移入培养好的种子时,培养好的种子的接入量为发酵培养基重量的10%。分别考察发酵初期、发酵中期、发酵后期不同的温度控制的影响,进行实验,其结果见表1。表1由上表实验结果可以得出:在发酵初期温度控制在30℃,可促进菌体快速生长,缩短菌种对发酵环境的适应性,缩短周期;发酵中期温度控制在32℃,可提高发酵液中溶解氧,加速菌种的快速生长增殖;进入发酵后期,继续控制发酵温度在32℃,提高赤藓糖醇的合成,加快发酵速度,尽快完成发酵。因此,优选发酵培养的条件为:发酵温度控制为30~32℃。二、发酵ph值ph值也是微生物生长代谢活动的显著指标,它对菌体生长和产物积累有着很大影响,同时ph值的变化反映菌种生长代谢过程的不同阶段,特别是起始阶段控制发酵液的ph值,选择最适宜的ph值,利于菌种的生长和合成,提高发酵产量。选择50l发酵罐,发酵压力控制在0.08~0.1mpa范围内,通风量在4000~4500m3/h范围内,发酵温度控制为30~32℃。向发酵罐内移入培养好的种子时,培养好的种子的接入量为发酵培养基重量的10%。在4.5~7范围内选择不同的ph值进行实验,得到的发酵液ph值对赤藓糖醇含量的影响曲线见图1所示。由图1可以得出:生产最适宜ph值在5.5-6.5之间,ph值在6.0时赤藓糖醇产量最高,随着ph值逐渐升高,产量随之下降。分析原因为发酵初期主要是菌种生长适应期,加速菌种的生长繁殖;ph值过低时,菌种未进入大量繁殖期,导致菌种数量较少,菌种生长不足,产量低;ph值过高时,发酵菌种生长和代谢是体内各种酶催化作用合成的,酶的活性受ph影响明显,酶活性随着ph值的升高而降低,发酵反应速度降低,菌种生长减缓甚至菌种出现死亡,导致产量下降。优选发酵培养的条件为:ph值控制为5.5~6.5。三、种子接种量种子接种量的大小影响到酵母菌在发酵罐中生长速度,接种量大,可以缩短菌体生长周期,使发酵转化提前,接种量过多,常常使菌体生长过快,发酵液变稠,往往会导致溶解氧不足,从而会使菌体提前衰退,菌体出现自溶;反之,接种量过小,则发酵周期会延长,种子活力差,容易染菌,从而使发酵产量下降。因此,要提高赤藓糖醇的产率就必须对接种量进行研究。实验以周期20小时的种子按不同接种量进行接种,在50l发酵罐发酵100小时,发酵压力控制在0.08~0.1mpa范围内,ph值控制为6.0~6.5,通风量在4000~4500m3/h范围内。发酵温度控制为30~32℃。向发酵罐内移入培养好的种子时,培养好的种子的接入量选择4%~13%,进行实验,得到的不同种子接种量对赤藓糖醇含量的影响曲线见图2所示。由图2可知,赤藓糖醇的含量随接种的增加先升高后减少,接种量为10%时赤藓糖醇含量最高。原因是接种量较少,菌种量较少,生长繁殖到发酵正常所需的菌种量的时间较长,传代多,发酵含量偏低;而接种量过多,菌种生长繁殖、消耗代谢较快,培养基营养不足,种子发酵周期短,含量偏低。优选培养好的种子的接入量为发酵培养基重量的10%。下面提供了一个具体实施例。实施例1本实施例提供的赤藓糖醇发酵生产方法,采用的发酵培养基的配方为:葡萄糖浓度35%,酵母膏浓度1.1%,尿素浓度0.15%,七水硫酸亚铁浓度0.002%,七水硫酸锌浓度0.002%;ph值6.8。其中的百分数(%)均为质量百分比。采用一次性投料方式将发酵培养基投入空消的发酵罐内,发酵液体积定容380m3,发酵罐容积480m3,空消温度123-125℃,之后发酵罐内物料于121℃下灭菌30min,然后降温至32℃,之后向发酵罐内再移入培养好的种子,然后在发酵培养条件为:温度30~32℃、压力0.1mpa、ph值6.0~6.5、通风量4000~5000m3/h的条件下,发酵培养生产赤藓糖醇,当发酵罐内发酵液中赤藓糖醇产率浓度大于14g/dl,残还原糖质量百分比含量小于0.5%且不呈下降趋势时,发酵培养结束。向发酵罐内移入培养好的种子时,培养好的种子的接入量为发酵培养基重量的10%。移入的培养好的种子的培养过程为:将种子培养基泵入空消的种子罐,空消温度123-125℃,之后种子罐内物料于121℃下灭菌30min,之后降温至32℃,然后按10%(质量百分数)的比例接入菌种,采用菌种为解脂假丝酵母,购买于山东省食品发酵工业研究设计院;培养至od值为0.6,结束培养,得到培养好的种子。其中,种子培养基配方为:葡萄糖40g/l,酵母膏5g/l,尿素2g/l,自来水为溶剂;ph值6.0。在种子罐内种子的培养条件为:培养温度30~33℃,ph值6.0~7.0,压力0.1mpa,通风量0.3~0.8v/v·m,溶解氧为30~60%。向发酵罐内移入培养好的种子时,种子罐压力保持为0.12-0.15mpa,发酵罐压力为0.05-0.08mpa,以保证移种的顺利进行,二级种子罐内发酵液平板实验结果为非染菌状态方可移种。本实施例发酵试验,发酵周期为95小时,赤藓糖醇产率14.5%,转化率达到52%。按照实施例1的步骤重复试验5次,分别记为实施例2-实施例6,各实施例的发酵周期、赤藓糖醇产率和转化率见下表所示。表2通过以上实验数据可以看出,发酵周期都比较短,在100h以内,赤藓糖醇产率在14%以上,转化率高,均高于50%。对比例1该对比例提供的赤藓糖醇发酵生产方法,为现有的连续发酵方法,即在发酵过程中需要流加物料。采用的发酵培养基、种子与实施例1相同。具体如下。采用的发酵培养基的配方为:葡萄糖浓度35%,酵母膏浓度1.1%,尿素浓度0.15%,七水硫酸亚铁浓度0.002%,七水硫酸锌浓度0.002%;ph值6.8。将发酵培养基投入空消的发酵罐内,空消温度123-125℃,初始发酵液体积定容在150m3,之后发酵罐内物料于121℃下灭菌30min,然后降温至32℃,之后向发酵罐内再移入培养好的种子,然后在发酵培养条件为:温度30~33℃、压力0.1mpa、ph值6.0~7.0、通风量4000~4500m3/h的条件下,发酵培养生产赤藓糖醇,发酵30小时,残糖下降至10%左右,开始流加浓度为5%的营养盐溶液、10%的辅料溶液和35%的葡萄糖溶液,其中营养盐溶液为:0.6t硫酸镁、0.2t硫酸亚铁溶解后高温灭菌的溶液;辅料溶液为:0.5t磷酸二氢钾、0.4t磷酸氢二钾、0.2t硫酸锌;当发酵罐内残还原糖质量百分比含量小于0.5%且不呈下降趋势时,发酵培养结束。向发酵罐内移入培养好的种子时,培养好的种子的接入量为发酵培养基重量的10%。其中移入的培养好的种子的培养过程为:将种子培养基泵入空消的种子罐,空消温度123-125℃,之后种子罐内物料于121℃下灭菌30min,之后降温至32℃,然后按10%的比例接入菌种,采用菌种为解脂假丝酵母,购买于山东省食品发酵工业研究设计院;培养至od值为0.6,结束培养,得到培养好的种子。其中,种子培养基配方为:葡萄糖40g/l,酵母膏5g/l,尿素2g/l,自来水为溶剂;ph值6.0。在种子罐内种子的培养条件为:培养温度30~33℃,ph值6.0~7.0,压力0.1mpa,通风量0.3~0.8v/v·m,溶解氧为30~60%。对比例发酵试验,发酵周期为110小时,赤藓糖醇产率13.5%,转化率达到45%。比较可知,连续流加方式发酵的发酵周期长,赤藓糖醇产率和转化率都降低。按照对比例1的步骤重复试验5次,分别记为对比例2-对比例6,各对比例的发酵周期、赤藓糖醇产率和转化率见下表所示。表3对比例发酵周期(h)赤藓糖醇产率(%)转化率(%)211213.244311413.046411013.544511313.443611413.246通过以上实验数据可以看出,发酵周期最短为110h,赤藓糖醇的产率≤13.5%,转化率也低于50%。此外还发现,采用流加物料的发酵方式,在常规赤藓糖醇发酵中,使用本实验室的相同设备,从一级种子罐到发酵罐因染菌而无法继续进行发酵的批次占总试验批次的5%。而采用一次性投料的发酵方式,一级种子罐到发酵罐因染菌而无法继续进行发酵的批次仅占总试验批次的1%。由此可见,采用本发明的一次性投料发酵方法能够有效降低种子罐的染菌风险。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1