一种共固定化酶及其制备方法和用途与流程
本发明涉及酶固定技术,尤其是一种共固定化酶及其制备方法和用途。
背景技术:
共固定化酶指通过把两种及以上的酶同时在同一个载体内进行固定化而产生共固定化体系的一种固定化技术。共固定化酶可以充分发挥不同种酶的各自催化特点,结合各自的酶催化特性,将两者协同起来充分利用,增加其对于复杂底物的催化反应效率。同时可减少其反应的步骤和时间,能更好地提升产品的效能。
现有技术中有学者将纤维素酶和溶菌酶共固定化于氨基功能化磁性纳米颗粒表面,用于细胞壁降解反应。固定化过程中纤维素酶与溶菌酶的竞争是由于mnps活性位点有限所致。最大限度活性位点中78.9%纤维素酶和69.6%溶菌酶是双酶共固定化的协同效应。共固定化酶半衰期的热稳定性为3h,对细胞壁水解具有较高的催化效率。此外,与游离酶相比,共固定化酶具有更高的热稳定性和较宽的ph耐受性。经过再循环6次使用后,共固定化酶保留了60%的残余活性。
专利申请cn107012138a公开了一种硅/碳基复合固定化酶环保材料及其制备方法。该环保材料是将复合生物酶固定化于改性处理后的硅-碳基载体上,这些载体含有纳米尺度微晶结构共聚体,形成改性硅-碳基固定化酶生物材料。这种材料必须先经过改性,操作复杂。
技术实现要素:
本发明的目的是为了克服现有的酶固定技术不足,材料的稳定性不佳的问题,提供一种共固定化酶及其制备方法和用途。
本发明的关键之一在于制备出酶与载体结合效果好的共固定化酶,发明人发现,其影响因素从主到次的排列为:活性炭投加量>海藻酸钠浓度>cacl2浓度。由于活性炭的影响最大,则其投加量越多吸附越好,而对于海藻酸钠溶液和cacl2溶液,两者浓度越高胶球内部各组分就越紧密而不利于底物的传质,产生位阻效应。故最优方案为:复合酶溶液200ml,活性炭投加量为0.15g,海藻酸钠浓度为2%,cacl2浓度为2%。在该条件下,该空碳胶球的吸附性能和传质效果最佳,若将游离酶附着在胶球内制备出固定化酶,底物在胶球中进出也更容易,即传质效果更好,且内部酶与其底物会得到更好的接触效果,从而催化反应速率更高,可表现出更好的酶活性,因此在本研究中采用该条件来制备固定化酶。
本发明所使用的固定化载体是海藻酸钠-活性炭复合载体,采用吸附和包埋的方法对漆酶和过氧化氢酶进行共固定,与常规固定化载体和固定化方法具有明显的不同之处。因此,本发明的固定化方法操作性更加简单,固定材料也较简易;且本发明的复合载体无需改性。
具体方案如下:
一种共固定化酶,所述共固定化酶是以海藻酸钠-cacl2凝胶和活性炭为载体,将过氧化氢酶和漆酶进行固定。
进一步的,所述共固定化酶的最适温度为45℃;
任选的,所述共固定化酶的操作稳定性高,在25℃下经过5次的循环使用后,过氧化氢酶和漆酶仍然保留超过61%和超过74%的活性。
进一步的,所述共固定化酶的贮存稳定性好,在4℃下贮存30日后,固定化过氧化氢酶和漆酶仍然保留超过65%和超过61%的活性。
一种所述的共固定化酶的制备方法,包括以下步骤:
步骤1:配置过氧化氢酶和漆酶的混合缓冲溶液;
步骤2:将复合酶溶液与活性炭混合均匀,待吸附完全后,加入海藻酸钠,继续搅拌均匀并降温,采用注射器来制粒,将混合液滴加进cacl2的水溶液中,生成光滑小球,固定化胶球在cacl2的水溶液中被硬化,之后用水洗涤,干燥,得到共固定化酶。
进一步的,所述步骤1包括1a将过氧化氢酶冻干粉用磷酸盐缓冲液溶解,得到过氧化氢酶溶液,1b将漆酶冻干粉用醋酸-醋酸钠缓冲液溶解,得到漆酶溶液,1c将过氧化氢酶溶液和漆酶溶液混合。
进一步的,所述磷酸盐缓冲液的ph=6-7,浓度为0.05-0.1m;
任选的,所述过氧化氢酶溶液中过氧化氢酶的浓度为0.5-1.25mg/ml;
任选的,所述醋酸-醋酸钠缓冲液的ph=4-5,浓度为0.2-0.3m;
任选的,所述漆酶溶液中漆酶的浓度为0.5-1.25mg/ml;
任选的,所述过氧化氢酶溶液和漆酶溶液混合时,过氧化氢酶和漆酶的质量比为1:2-2:1。
进一步的,所述步骤2中,活性炭的加量与复合酶溶液w:v的比例为1:100,海藻酸钠溶液的加量与复合酶溶液的体积比例为1:5;
任选的,海藻酸钠为质量浓度1-3%的水溶液。
进一步的,所述步骤2中,cacl2的水溶液质量浓度为1-3%。
进一步的,所述步骤2中,冰水浴降温至0-4℃,固定化时间为30-60min。
本发明还保护所述的共固定化酶的用途,用于苯胺废水处理。
有益效果:
本发明采用包埋法和物理吸附法两种方法相结合进行酶固定化,所得到的共固定化酶的耐热性、耐酸碱性、贮存稳定性和操作稳定性均得到明显提升,对苯胺废水具有优异处理效果,对苯胺废水的操作稳定性较好,可以极大地降低实际应用于废水处理的成本。
附图说明
为了更清楚地说明本发明的技术方案,下面将对附图作简单的介绍,显而易见地,下面描述中的附图仅仅涉及本发明的一些实施例,而非对本发明的限制。
图1是本发明一个实施例2提供的游离酶浓度对固定化酶活的影响图;
图2是本发明一个实施例3提供的固定化时间对固定化酶活的影响图;
图3是本发明一个实施例4提供的过氧化氢酶和漆酶的比例对共固定化酶活的影响图;
图4是本发明一个实施例5提供的反应温度对共固定化酶活的影响图;
图5是本发明一个实施例6提供的反应ph对共固定化酶活的影响图;
图6是本发明一个实施例7提供的贮存时间对共固定化酶活的影响图;
图7是本发明一个实施例8提供的重复使用次数对共固定化酶活的影响图;
图8是本发明一个实施例9提供的游离过氧化氢酶与固定化后过氧化氢酶的双倒数图;
图9是本发明一个实施例9提供的游离漆酶与固定化后漆酶的双倒数图。
具体实施方式
下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。在下面的实施例中,如未明确说明,“%”均指重量百分比。
以下使用的测试方法包括:
一、酶活的测定:由于本发明实施例所使用的酶均为市售工业制品,其纯品难以生产,酶冻干粉里或多或少会存在有一定杂质,故所配制的酶溶液中酶的含量可以用其催化反应的能力来表示,即酶活力。酶活力也是催化反应的速度。酶催化反应速度是指单位时间内产物生成的量或底物减少的量。酶活力并不等于酶的绝对含量,它只是一种相对含量的表示方式。
先绘制标准曲线,如下:
(1)过氧化氢标准曲线的绘制:
准确配制出不同浓度的h2o2溶液,在h2o2的特征波长240nm下测定其吸光度值a,其溶液浓度(mmol/l)作为横坐标,所对应的吸光度值a作为纵坐标,进行线性拟合分析,可得过氧化氢标准曲线。
(2)abts(中文名:2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)自由基标准曲线的绘制:
准确配制出不同浓度的abts溶液,采用漆酶催化分解不同浓度abts,在反应足够长的时间后得到不同浓度的abts自由基溶液,在abts自由基的特征波长420nm下测定其吸光度值a,其溶液浓度(mmol/l)作为横坐标,所对应的吸光度值a作为纵坐标,得到abts自由基标准曲线。
游离过氧化氢酶酶活的测定:
将0.05ml一定浓度的过氧化氢酶液滴加到10ml的h2o2底物溶液(10mm)中,在25℃,140rpm转速下恒温震荡10min,反应完后立即取出,用磷酸盐缓冲液作为参比溶液,用紫外分光光度计测定溶液中h2o2于240nm处由于过氧化氢酶的催化所产生的吸光度值的变化值。以反应的线性范围计算酶活,1个酶活力单位(u)是指每分钟降解1μmol过氧化氢所需的酶量。
固定化过氧化氢酶酶活的测定:
将上述步骤中的0.05ml的过氧化氢酶酶溶液替换为使用0.5g固定化酶,最后将固定化酶从底物溶液中过滤出来,中止反应。其余步骤与游离酶的酶活性测定过程相同。以反应的线性范围计算酶活,以每分钟降解1μmolh2o2所需的酶量定义为一个活力单位,以u表示。
游离漆酶酶活的测定:
将0.05ml一定浓度的漆酶溶液滴入10ml的abts底物溶液中,于25℃,140rpm转速下恒温震荡10min,反应完后立即取出,用醋酸-醋酸钠缓冲液作为参比溶液,用紫外分光光度计测定溶液中的abts自由基在420nm处由于漆酶催化氧化所产生的吸光值的改变值。以反应的线性范围计算酶活,1个酶活力单位(u)是指每分钟将使1μmol的底物吸光度升高0.001所需的酶量。
固定化漆酶酶活的测定:
将上述步骤中的0.05ml的漆酶酶溶液替换为使用0.5g固定化酶,最后将固定化酶从底物中过滤出来,中止反应。其余步骤与游离酶活性的测定过程相同。以反应的线性范围计算酶活,1个酶活力单位(u)是指每分钟将使1μmol的底物吸光度升高0.001所需的酶量。
固定化酶的相对酶活计算方法:
固定化酶的相对酶活是指在同一组实验中以最高的活性为100,与其他的固定化酶或游离酶的活力比,以百分数(%)表示。
二、米氏常数的测定
(1)过氧化氢酶的米氏常数
分别配制底物浓度为2mm、4mm、6mm、8mm、10mm、12mm的过氧化氢溶液反应体系,分别测定游离过氧化氢酶和共固定化酶在240nm处吸光度变化,计算其酶反应动力学的初速度。根据lineweaer-burk法,以酶反应初速度的倒数为纵坐标,以底物浓度的倒数为横坐标来作图,可得到双倒数图。测定反应后(3min)的吸光度值a,以吸光度值的倒数1/a作为纵坐标,代表其反应速度的倒数1/v。以该直线在x轴和y轴的截距,利用米氏方程得到米氏常数km和最大反应速度vmax。
(2)漆酶的米氏常数
分别配制底物浓度为0.2mm、0.4mm、0.6mm、0.8mm、1.0mm、1.2mm的abts溶液反应体系,分别测定游离漆酶和共固定化酶在420nm处吸光度变化,计算其酶反应动力学的初速度。根据lineweaer-burk法,以酶反应初速度的倒数为纵坐标,以底物浓度的倒数为横坐标来作图,如上述所说,可得到双倒数图并根据米氏方程得到米氏常数km和最大反应速度vmax。
计算游离酶和共固定化酶的km,可见式(1)。
式中,v为反应初速度,μmol/(l·min);v为最大反应速度,μmol/(l·min);[s]为底物浓度,mol/l;km为米氏常数,mol/l。
实施例1
按照以下步骤制备共固定化酶:
步骤1:配置过氧化氢酶和漆酶的混合缓冲溶液。
磷酸盐缓冲液的配制:
称取na2hpo43.4092g,nah2po41.5944g,用蒸馏水溶解,调节ph7.0,定容至500ml,得到0.05m的磷酸盐缓冲液,于4℃下保存(使用前煮沸)。
过氧化氢酶溶液的配制:
在电子天平上精确称量过氧化氢酶冻干粉一定质量,用ph=7的0.05m的磷酸盐缓冲液中溶解,得到一定浓度的酶溶液,配制好后置于4℃的冰箱中冷藏,并尽快使用。
醋酸-醋酸钠缓冲液的配制:
溶液1:0.2mol/l醋酸钠溶液,取8.2g乙酸钠,去离子水溶解并定容于500ml容量瓶。
溶液2:0.2mol/l醋酸溶液,取6g冰醋酸,加去离子水定容于500ml容量瓶。
将溶液1和溶液2按照特定体积比例混合,ph计测定所配缓冲液的ph值,配比的体积如下表所示。选择ph=4.5的体积比,配置500ml缓冲液,4℃下储存备用。
漆酶溶液的配制:
在电子天平上精确称量漆酶冻干粉一定质量,用ph=4.5的0.2m的醋酸-醋酸钠缓冲液溶解,得到一定浓度的酶溶液,配制好后置于4℃的冰箱中冷藏,并尽快使用。
将过氧化氢酶溶液和漆酶溶液混合,得到复合酶溶液。
步骤2:将复合酶溶液与活性炭混合均匀,待吸附完全后,加入海藻酸钠,继续搅拌均匀并降温,采用注射器来制粒,将混合液滴加进cacl2的水溶液中,生成光滑小球,固定化胶球在cacl2的水溶液中被硬化,之后用水洗涤,干燥,得到共固定化酶。具体加量为:复合酶溶液200ml,0.15g的活性炭,2%的海藻酸钠溶液,2%的cacl2溶液,0.75mg/ml的酶液浓度,40min的固定化时间,1:1.8的过氧化氢酶与漆酶体积比(即酶活比233:1)。
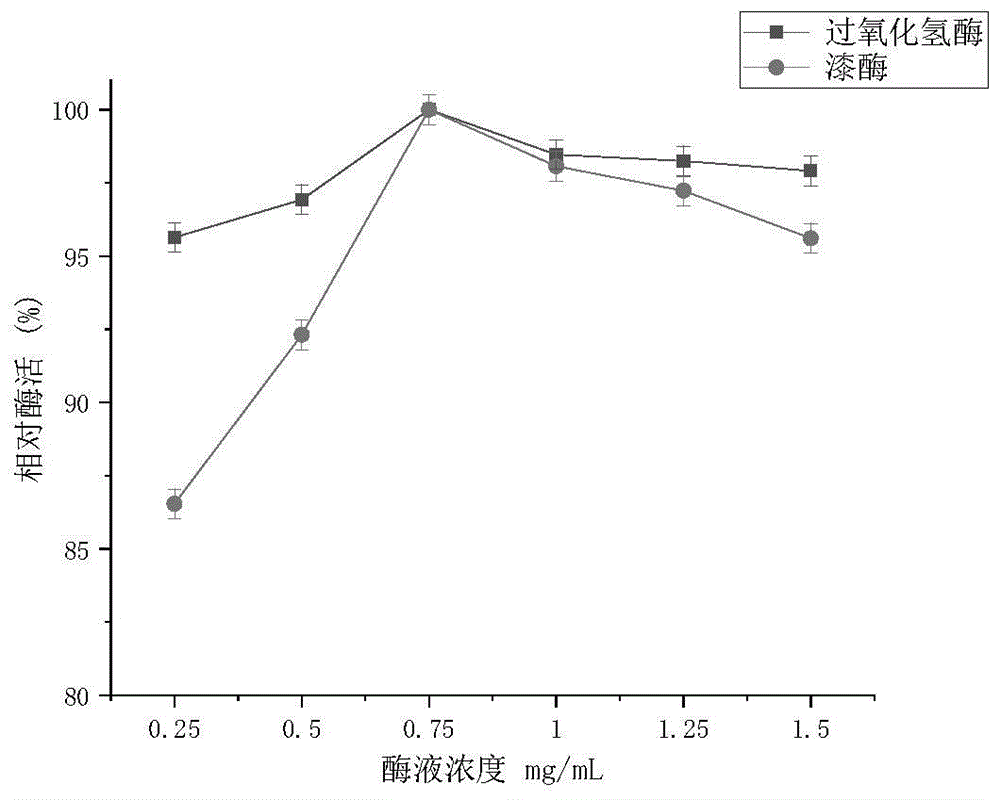
实施例2
在实施例1的基础上,改变酶溶液的浓度,结果见图1,从图1可以看出,固定化漆酶和过氧化氢酶的相对酶活随酶液浓度的增加而不断增加,当其浓度达到0.75mg/ml时,固定化酶后两种酶的相对酶活最大;但之后随着酶液浓度的再增加,两者固定化酶的相对酶活却都在降低,原因可能是在制粒大小和载体质量一定的条件下,载体颗粒的内部空间也一定,而且其活性基团数量也是有限的。在固定化载体的结合位点未达到饱和之前,两种固定化酶活力不断增大;但当载体内部空间的活性位点饱和以后,其载酶量将会到达极限,给酶量再增加其活性也不再增加。一是某些酶分子在固定化时进入到载体活性炭内部的微孔深处,使底物的扩散阻力增加,使酶的催化能力下降;二是当酶分子的数量过多时,酶蛋白之间也会产生阻滞作用,且酶分子空间结构的可塑性也降低,不能使其自身充分发挥催化作用,导致固定化后的酶活性产生下降。因此,在固定化酶制备过程中,所加入的酶液浓度选择0.75mg/ml为最佳。
实施例3
在实施例1的基础上,改变固定化时间,结果见图2,从图2可以看出,在cacl2溶液中的固定化时间为40min时,固定化漆酶和过氧化氢酶的相对酶活为最高,再增加固定化时间,两者固定化酶的相对活性开始降低。这是因为ca离子与海藻酸钠反应后载体会形成网格化模型,将吸附有游离酶的活性炭稳定地固定在其中,达到一定的硬化时间后,酶分子在cacl2溶液中的稳定性不太高,溶液中的ca离子对酶分子存在一定抑制作用,使固定化酶的相对活力下降。另外,硬化时间越久,固定化酶内部各组分的结合就越紧密,酶分子与其他组分之间会变得更拥挤,酶分子空间结构的可塑性降低,产生位阻效应而不利于底物的传质,所以导致整体酶活力产生降低。因此,在固定化酶制备过程中,选择固定化时间40min为最佳。
实施例4
在实施例1的基础上,分别采用过氧化氢酶和漆酶不同的酶配比,结果见图3,从图3可以看出,在共固定化酶中,随着一种酶比例的增加其酶活性也相应增加,两种酶的活性随各自酶液在混合酶液中的占比增大而随之增加。当双酶的混合比为1:1.8(w/w)时,过氧化氢酶和漆酶都有较好的活性。因此,在共固定化酶的制备过程中,选择过氧化氢酶和漆酶的比例1:1.8(w/w)为最佳。
此外,即使过氧化氢酶和漆酶的混合比例相同(1:1)时,过氧化氢酶和漆酶在共固定化酶中的相对活性不一致,这是由于过氧化氢酶和漆酶在共固定化过程中存在竞争效应。过氧化氢酶和漆酶的活性位点互相作用,使得自由电子相互传递而竞相吸收电子,相互竞争自由氧原子进行配位结合。过氧化氢酶催化h2o2反应生成大量·oh自由基,而漆酶的催化还原态底物反应使底物被氧化产生自由基。同时,漆酶的各种非酶促次级反应(羟化、歧化和聚合等)吸收电子传递到漆酶活性中心,通过双电子反应形成超氧化物过渡体再被还原成水。反应的整体过程需要连续的单电子氧化作用以满足漆酶的充分还原。过氧化氢酶可以快速清除溶液中底物反应产生的一些h2o2等过氧化物,减少对漆酶的主催化反应产生其他影响。将两种酶结合成双酶体系后,该竞争效应的存在也会使自由电子和氧原子在各个活性位点之间的传递变得更加高效,减少一些次级反应,从而提高催化氧化的效率。总之,一定量过氧化氢酶的加入,使得共固定化酶的整体催化性能更高效。
实施例5
取实施例1制备的共固定化酶,在15-65℃的范围内改变酶的反应温度,并保持在水浴中温度,研究温度对游离及固定化后过氧化氢酶和漆酶的活性影响(以各自酶活性的最高者为100%),结果见图4,从图4可以看出,在较低温度区间,与一般的催化剂相似,酶的活性随着反应温度的增加而增大,当游离酶的反应温度达到35℃后,两种游离酶都开始失活,其活性开始下降;而固定化后过氧化氢酶和漆酶的最佳温度都在45℃,可以看出,固定化后的酶更能适应温度的变化,具有更高的稳定性。这主要是由于高温会破坏酶蛋白中的高级结构,致使酶分子产生热变性现象,最终引起失活。由于固定化后的酶通过物理化学作用被稳定地固定在载体小球的内部,引起共固定化酶的物理化学性质的改变,导致产生酶学性质的改变,因此,在较高的温度下,固定化后的酶仍然能保持蛋白质的三级结构不变,并继续进行催化反应,酶活力保持较高水平,固定化后酶对高温有更强的适应性,为共固定化酶在实际的应用中创造了可能性。
实施例6
取实施例1制备的共固定化酶,在ph=2至ph=9的范围内改变酶的反应酸碱性,并保持在25℃的恒温水浴中反应,研究ph对游离及固定化后过氧化氢酶和漆酶的活性影响(以各自酶活性的最高者为100%),结果见图5,从图5可以看出,游离过氧化氢酶的最适ph=7,而其固定化后最适ph值为8;游离漆酶最适ph值是5,而其固定化后的最适ph=4。可以看出,经过固定化后的酶能够适应ph值的变化,更耐酸碱性且具有更高的稳定性。酶固定化的过程通常对其电离状态、解离状态和酶分子构象有一定的影响,这与固定化酶的ph值、稳定性和催化活性存在相关影响。这表明固定化过程对酶提供了一个稳定结构,防止酶蛋白分子的不可逆展开,从而使固定化后的酶相对于游离酶的ph更稳定。在相对较低或较高ph范围内对酶活性抑制变化可能是由以下两个原因所造成,一是酶分子的构象可能发生变化,对酶的氨基酸残基进行不利的电荷分配;二是ph环境的变化会对酶分子内的氢键产生影响,导致酶的构象不准确,从而使酶活性降低。
两种酶都有其各自的最适ph反应条件,即在该ph值下能够表现出最高的催化反应速度。改变反应体系中的ph值,都会使载体的带电性质发生改变,并且引起酶活性中心的基团离子化,导致酶活性减弱。当反应体系中ph值的改变较大时,一些维持酶分子三级结构的化学键会受到影响,致使酶蛋白分子自身引起不可逆转的变性。总之,ph的改变在很大程度上会改变游离酶的酶活,而由于固定化载体改变了酶分子周围的微环境[41],固定化后的酶对酸碱性的变化具有更高的稳定性,同时,也为共固定化酶在实际的应用中创造了可能性。
实施例7
取实施例1制备的共固定化酶,在4℃下贮存30日后,研究存放时间对游离及固定化后过氧化氢酶和漆酶的活性影响(以刚放入的各自酶活性为100%),比较分析存放30日前后共固定化酶活性的差异。其结果见图6,从图6可以看出,相比游离酶,固定化酶在4℃下的贮存稳定性较好。在第30天时,游离过氧化氢酶酶活剩余39.5%,游离漆酶酶活剩下45.76%,而固定化后过氧化氢酶的剩余酶活为65.51%,固定化后漆酶的剩余酶活为61.35%。在存放过程中,游离酶会逐渐失去活性,同时发现酶液会变得有些浑浊,也存在一些絮状物,这是由于酶变性所析出的蛋白类物质。而酶在载体内部固定后,由于物理包埋和化学键的存在,在酶分子周围创造了相对稳定的微环境并能维持酶分子的结构,使酶蛋白的变性速度下降。因此,相比游离酶,共固定化酶的贮存稳定性高得多,这也是共固定化酶的实际应用可能性的评价因素之一。
实施例8
取实施例1制备的共固定化酶,在25℃下经过5次的循环使用后,研究重复使用次数对游离及固定化后过氧化氢酶和漆酶的活性影响(以第一次使用的各自酶活性为100%),比较分析每次循环使用前后共固定化酶活性的差异。其结果见图7,从图7可以看出,共固定化酶中过氧化氢酶和漆酶的酶活性都随着重复使用次数的增加而在逐渐降低,但两者的操作稳定性都较好,经过5次循环使用以后,过氧化氢酶剩余61.44%的活性,漆酶仍然有74.24%的活性。同时,从图中也可看出,曲线不会立刻下降,该共固定化酶活性不会马上降低,这说明该共固定化酶的载体及内部结构都较稳定,产生酶泄漏的现象较少,也可能是在循环使用时固定化载体胶球会不断吸水膨胀,不断暴露出新的催化活性位点参与到酶的催化作用中,催化底物的反应。但是所制备的共固定化酶只能循环使用5次是由于其中的过氧化氢酶引起会强烈的h2o2催化反应生成大量氧气,容易产生固定化载体胶球内部空间的急剧挤压作用,造成胶球膨胀溶烂的现象,从而使酶泄漏出来不可再次重复使用。总之,共固定化酶与其游离酶相比,最大的一个优点是能够多次循环使用,这可以极大地降低实际应用中的生产成本,这也是共固定化酶在实际应用中的重要评价因素。
实施例9
米氏常数km是酶反应中基本的动力学常数,可以表示底物与酶之间的亲和力大小,酶的km越小,表示底物与酶之间的亲和力越大。任何酶反应的速度都受到特定酶底物浓度的决定性影响,这一关系符合michaelis-menten动力学。通过画lineweaver-burk图计算出游离酶和共固定化酶的km,进行反应动力学分析,其双倒数图可见图8和图9。
通过图8计算可得,游离过氧化氢酶km=8.58mmol/l,固定化后过氧化氢酶km=8.65mmol/l。这一结果表明,与固定化后过氧化氢酶相比,游离过氧化氢酶对底物h2o2之间具有更大的亲和力。这是由于固定化载体内部的扩散限制和空间位阻效应。
通过图9计算可得,游离漆酶km=0.19mmol/l,固定化后漆酶km=0.52mmol/l。这一结果表明,与固定化后漆酶相比,游离漆酶对底物abts之间具有更大的亲和力。这是由于固定化载体内部的扩散限制和空间位阻效应。
在酶催化反应中,游离酶比固定化后的酶更易与底物合成活化的中间复合物,而酶分子经过固定化后被载体包围,其反应空间变得相对狭小,使底物的传质受到一定程度限制。载体附近微环境的底物浓度会比底物溶液中的浓度相对较低,使酶与底物结合的概率变低,从而降低了两者之间的亲和力。扩散限制的问题可以分为内扩散限制和外扩散限制:内扩散限制发生于载体内部的大量孔隙中,底物从共固定化酶的颗粒表面转运到酶活性中心;外扩散限制则发生在共固定化酶颗粒附近的微环境中,底物从宏观体系转移到颗粒表面。这是共固定化酶所构成的反应体系,底物在宏观环境中都会存在扩散限制的问题,当扩散速度很低而酶催化活性又很强时,这种效应会显著。
实施例10
称取实施例1制备的共固定化酶,5g共固定化酶放入250ml锥形瓶中,加入100ml的苯胺模拟废水,加入h2o2作为助氧化剂,投加量为苯胺模拟废水(准确称取200mg苯胺液体,用1l蒸馏水配制200mg/l的苯胺溶液,作为苯胺模拟废水)的0.3wt%,调节ph=5,将各组锥形瓶置于35℃,140rpm转速的恒温摇床中,震荡反应,总反应时间为24h,反应结束后测得苯胺去除率高达73.17%。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合。为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
- 还没有人留言评论。精彩留言会获得点赞!