一种联用双抗生素进行毕赤酵母转化子维持培养的方法与流程
本发明涉及一种联用双抗生素以维持毕赤酵母转化子生长及外源基因保持的培养方法,属于毕赤酵母转化子维持培养领域。
背景技术:
在生物发酵技术中,毕赤酵母作为重要的真核细胞宿主,可以表达多种具有复杂三级及四级结构的外源蛋白。本发明联用氨苄西林和遗传霉素两种抗生素进行毕赤酵母转化子的液体培养。
毕赤酵母作为基因重组技术中重要的真核细胞宿主,在复杂的外源蛋白表达中具有重要的应用。但作为真核细胞,毕赤酵母对多数抗生素不敏感,这使得毕赤酵母转化子的阳性克隆筛选和维持培养具有一定的难度;同时毕赤酵母的不同亚型具有不同的代谢特征,使得毕赤酵母很难以代谢特征作为通用的阳性筛选和维持培养手段。
遗传霉素(geneticin,g418)是一种氨基糖苷类抗生素,通过抑制转座子tn601及tn5而干扰核糖体功能而阻断蛋白质合成,在不同浓度下对原核细胞、真菌、高等植物细胞及哺乳动物细胞都具有一定的毒性。但遗传霉素的使用存在短期效价不高且易产生天然抗性等缺点,因此以遗传霉素进行转化子的维持培养效率并不理想。本研究联用β内酰胺类抗生素氨苄西林和氨基糖苷类抗生素遗传霉素,以减少毕赤酵母天然抗性体的发生并有效抑制毕赤酵母非转化子的活性,从而实现对毕赤酵母转化子的维持培养。
技术实现要素:
本发明针对现有技术中存在的不足,本发明提供一种毕赤酵母转化子的维持培养方法,本发明联用β内酰胺类抗生素氨苄西林和氨基糖苷类抗生素遗传霉素,可以显著减少毕赤酵母天然抗性的发生,并抑制毕赤酵母非转化子的活力,且有利于毕赤酵母转化子质粒的维持。本方法简单易行,成本低廉,且可用于多种亚型的毕赤酵母,对于毕赤酵母在生物发酵中的应用具有极大的益处。
为实现上述目的,本发明采用的技术方案如下:
一种联用双抗生素进行毕赤酵母转化子维持培养的方法,培养步骤如下:
(1)用去离子水配制10mg/ml氨苄西林溶液,用去离子水配制100mg/ml遗传霉素溶液,并将溶液过滤除菌;
(2)制备培养基,灭菌;
(3)待培养基冷却后,加入10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液摇匀;
(4)将酵母转化子接种于步骤(3)配置的培养基中进行培养。
优选的,所述步骤(2)中培养基的制备步骤为溶液培养或者平板培养。
优选的,所述溶液培养的制备步骤如下:将yepd固体加入去离子水中,使得yepd的最终浓度为50g/l,即可得到。
优选的,所述平板培养的制备步骤如下:将yepd固体及琼脂糖固体加入去离子水中,使得yepd的最终浓度为50g/l且琼脂糖的最终浓度为15~20g/l,即可得到。
优选的,所述步骤(2)中灭菌的反应条件为:105℃~115℃下灭菌20~25min。
优选的,所述步骤(3)中培养基冷却后的温度为50-60℃。
优选的,所述步骤(3)中摇均后氨苄西林最终浓度为20~100μg/ml,遗传霉素的最终浓度为200~1000μg/ml。
优选的,所述步骤(1)中过滤除菌的步骤为:将配置氨苄西林溶液和遗传霉素溶液分别使用0.22μm无菌滤菌膜过滤除菌。
由于采用了以上技术,本发明较现有技术相比,具有的有益效果如下:
1、本发明操作简便,材料常见,成本低廉,且可广泛应用于毕赤酵母的多种亚型的固体及液体培养;
2、本方法联用遗传霉素和氨苄西林两种生物发酵技术中常用的抗生素,有效抑制了遗传霉素天然抗性的发生,并能够明显抑制毕赤酵母非转化子的活性,同时高浓度遗传霉素的存在有利于毕赤酵母转化子外源基因的保持。因此本方法可广泛应用于毕赤酵母转化子的实验室及工业化维持培养。
附图说明
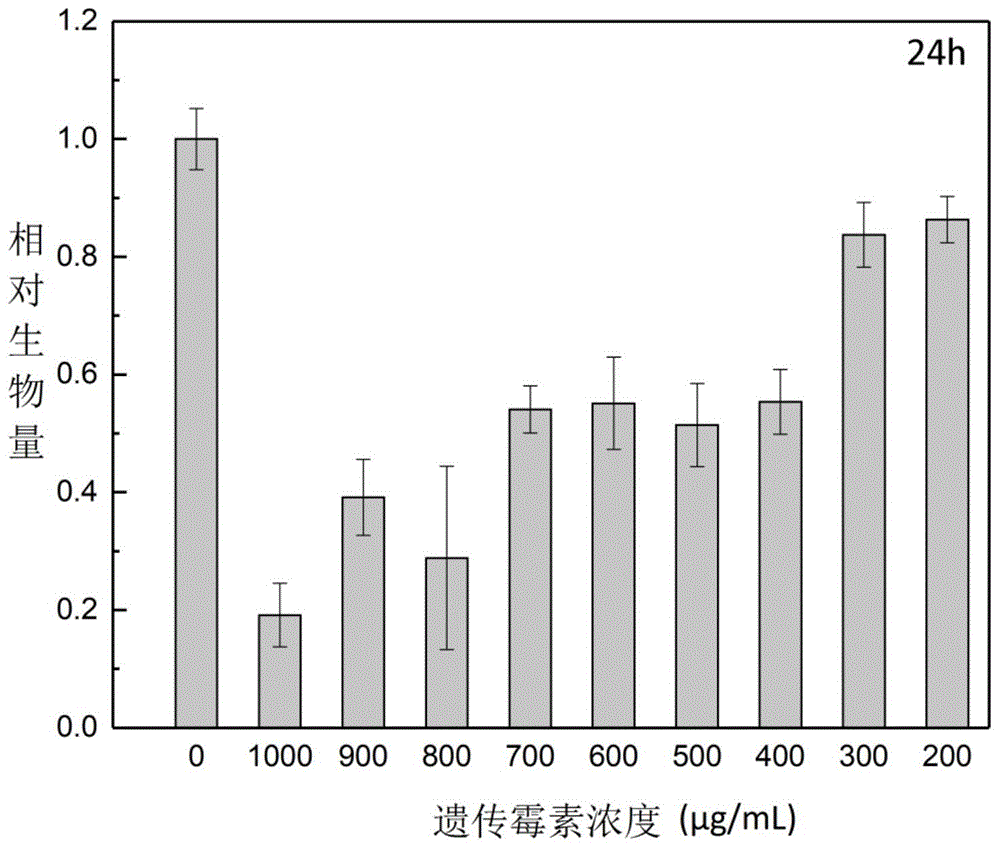
图1为毕赤酵母gs115生长于实施例2-10液体培养基24h后对比实施例11(阴性对照)的相对生物量,证明在高浓度遗传霉素下毕赤酵母非转化子的生长受到明显抑制;
图2为毕赤酵母gs115生长于实施例2-10液体培养基48h后对比实施例11(阴性对照)的相对生物量,证明在高浓度遗传霉素下毕赤酵母非转化子的生长受到明显抑制;
图3为毕赤酵母gs115生长于实施例1平板24h后的照片,照片结果显示24h后平板上仅有小体积单菌落出现,证明毕赤酵母非转化子在实施例1的平板上生长受到明显抑制,且鲜见天然抗遗传霉素突变体出现;
图4为毕赤酵母gs115生长于实施例1平板48h后的照片,照片结果显示48h后平板上仅有小体积单菌落出现,证明毕赤酵母非转化子在实施例1的平板上生长受到明显抑制,且鲜见天然抗遗传霉素突变体出现。
具体实施方式
下面结合附图和具体实施方式,进一步阐明本发明。
实施例1:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基及1g琼脂溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶及500μl100mg/ml遗传霉素溶液并摇匀后倒平板,使得氨苄西林最终工作浓度为100μg/ml,遗传霉素的最终工作浓度为1000μg/ml。将50μl酵母菌液均匀涂布于平板,于28℃倒置培养。24h后,培养基表面可见较小体积单菌落出现;48h后,培养基表面单菌落体积没有明显改变,且没有新的单菌落出现,证明24h~48h内毕赤酵母非转化子的活性受到明显抑制。
实施例2:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶及500μl100mg/ml遗传霉素溶液并摇匀,使得氨苄西林最终工作浓度为100μg/ml,遗传霉素的最终工作浓度为1000μg/ml。接种50μl毕赤酵母于28℃,200rpm条件下培养。液体培养24h后毕赤酵母非转化子的相对生物量大量减少,约为对照组(实施例11)的20%;48h后毕赤酵母非转化子的相对生物量有轻微波动但仍保持较低水平,约为对照组(实施例11)的30%。
实施例3:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶及450μl100mg/ml遗传霉素溶液并摇匀,使得氨苄西林最终工作浓度为100μg/ml,遗传霉素的最终工作浓度为900μg/ml。接种50μl毕赤酵母于28℃,200rpm条件下培养。液体培养24h后毕赤酵母非转化子的相对生物量大量减少,约为对照组(实施例11)的30%;48h后毕赤酵母非转化子的相对生物量仍保持较低水平,约为对照组(实施例11)的30%。
实施例4:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶及400μl100mg/ml遗传霉素溶液并摇匀,使得氨苄西林最终工作浓度为100μg/ml,遗传霉素的最终工作浓度为800μg/ml。接种50μl毕赤酵母于28℃,200rpm条件下培养。液体培养24h后毕赤酵母非转化子的相对生物量大量减少约为对照组(实施例11)的30%;48h后毕赤酵母非转化子的相对生物量仍保持较低水平,约为对照组(实施例11)的30%。
实施例5:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶及350μl100mg/ml遗传霉素溶液并摇匀,使得氨苄西林最终工作浓度为100μg/ml,遗传霉素的最终工作浓度为700μg/ml。接种50μl毕赤酵母于28℃,200rpm条件下培养。液体培养24h后毕赤酵母非转化子的相对生物量明显降低,约为对照组(实施例11)的50%;48h后毕赤酵母非转化子的相对生物量没有明显改变,约为对照组(实施例11)的50%。
实施例6:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶及300μl100mg/ml遗传霉素溶液并摇匀,使得氨苄西林最终工作浓度为100μg/ml,遗传霉素的最终工作浓度为600μg/ml。接种50μl毕赤酵母于28℃,200rpm条件下培养。液体培养24h后毕赤酵母非转化子的相对生物量明显降低,约为对照组(实施例11)的60%;48h后毕赤酵母非转化子的相对生物量继续降低,约为对照组(实施例11)的50%。
实施例7:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶及250μl100mg/ml遗传霉素溶液并摇匀,使得氨苄西林最终工作浓度为100μg/ml,遗传霉素的最终工作浓度为500μg/ml。接种50μl毕赤酵母于28℃,200rpm条件下培养。液体培养24h后毕赤酵母非转化子的相对生物量。明显降低,约为对照组(实施例11)的60%;48h后毕赤酵母非转化子的相对生物量没有明显改变,约为对照组(实施例11)的60%。
实施例8:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶及200μl100mg/ml遗传霉素溶液并摇匀,使得氨苄西林最终工作浓度为100μg/ml,遗传霉素的最终工作浓度为400μg/ml。接种50μl毕赤酵母于28℃,200rpm条件下培养。液体培养24h后毕赤酵母非转化子的相对生物量。明显降低,约为对照组(实施例11)的60%;48h后毕赤酵母非转化子的相对生物量没有明显改变,约为对照组(实施例11)的60%。
实施例9:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶及150μl100mg/ml遗传霉素溶液并摇匀,使得氨苄西林最终工作浓度为100μg/ml,遗传霉素的最终工作浓度为300μg/ml。接种50μl毕赤酵母于28℃,200rpm条件下培养。液体培养24h后毕赤酵母非转化子的相对生物量轻微降低,约为对照组(实施例11)的80%;48h后毕赤酵母非转化子的相对生物量没有明显改变,约为对照组(实施例11)的80%。
实施例10:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶及100μl100mg/ml遗传霉素溶液并摇匀,使得氨苄西林最终工作浓度为100μg/ml,遗传霉素的最终工作浓度为200μg/ml。接种50μl毕赤酵母于28℃,200rpm条件下培养。液体培养24h后毕赤酵母非转化子的相对生物量轻微降低,约为对照组(实施例11)的90%;48h后毕赤酵母非转化子的相对生物量没有明显改变,约为对照组(实施例11)的90%。
实施例11:
用去离子水配置10mg/ml氨苄西林溶液及100mg/ml遗传霉素溶液,并用0.22μm无菌滤菌膜滤菌。将2.5gyepd固体培养基溶于50ml去离子水中,在115℃下灭菌20min。待培养基冷却至50℃~60℃后,加入500μl10mg/ml氨苄西林溶液摇匀,使得氨苄西林最终工作浓度为100μg/ml。接种50μl毕赤酵母于28℃,200rpm条件下培养。以本实施例在液体培养24h和48h后的生物量为标准参比评估实施例2~10的相对生物量。
上述实施例仅为本发明的优选技术方案,而不应视为对于本发明的限制,本发明的保护范围应以权利要求记载的技术方案,包括权利要求记载的技术方案中技术特征的等同替换方案为保护范围,即在此范围内的等同替换改进,也在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!