一种黄曲霉毒素产毒基因nor-1的荧光传感器制备和检测方法与流程
本发明涉及荧光传感领域,具体是涉及利用荧光共振能量转移的信号淬灭和目标物特异性识别的荧光恢复机制,构建的一种源头检测黄曲霉毒素产毒基因nor-1的荧光传感器的制备及其对nor-1的快速检测方法。
背景技术:
黄曲霉毒素早于1961年即被鉴定为致癌物质,尤其是其中的黄曲霉毒素b1的毒性分别是砒霜的68倍和氰化钾的10倍,是至今为止发现的毒性和致癌性最强的天然污染物,而且据世界粮农组织报道,全球每年约有25%的粮食因霉变而产生黄曲霉毒素,粮食中黄曲霉毒素污染已成为全球性的问题。若能从源头检测黄曲霉毒素产毒菌,从源头进行有效的监控,则能减少黄曲霉毒素的产生而导致的安全性和经济效益问题。
黄曲霉毒素的产毒菌主要是黄曲霉菌和寄生曲霉菌,属于腐生型真菌,目前国内外对产毒菌的常用检测主要集中在传统的形态学鉴定、鉴别培养基鉴定、多重pcr检测、免疫传感检测等,这些方法繁琐复杂、检测周期长、灵敏度差、判误率高,无法满足日常实时、快速、精确的监测要求。由于dna传感器具有操作简单,灵敏度高、特异性强、检测速度快的优点,已成为微生物致病菌检测的研究热点,黄曲霉毒素生物合成过程中的基因nor-1也被称为afld基因,它能够编码一个分子量为29kda的催化酶,在aft合成中起到重要的作用。目前已有报道是检测aft产毒菌的特异性基因nor-1的电化学dna传感器,但是电化学的dna检测方法具有电极间差异较大、电极修饰过程繁琐耗时、检测界面存在于固-液两相之间等缺陷,因此,构建基于dna检测的简单、快速、稳定的aft产毒菌nor-1基因检测方法,能够为aft的产毒菌检测提供新思路,且为dna传感器在微生物致病菌的检测和监控领域提供技术支持。同时,dna荧光传感器因为具有均相、步骤简单、灵敏度高、特异性强等优点,将其应用于nor-1基因的检测,是解决aft产毒菌检测中现存科学问题的有效途径。
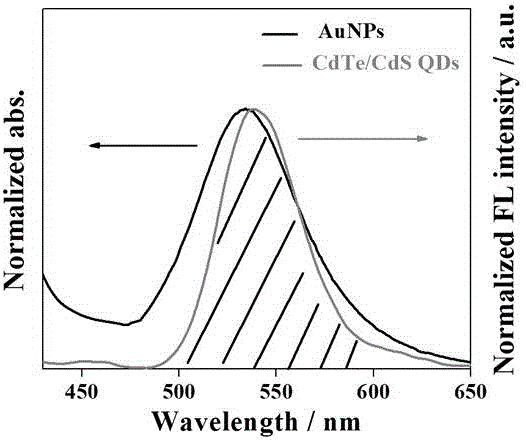
半导体纳米材料量子点的具有发射波长可调,荧光性能相对稳定等特性,目前已被用于荧光生物探针的信号标志物,但是单一的量子点直接作为标记物时,存在难以分散、容易团聚、荧光强度容易受到粒径大小和分散状态影响等缺陷,制备核壳型量子点可以有效改善这些缺陷,是荧光生物传感器的有效方法。而金属纳米粒子紫外光谱和量子点的荧光发射光谱高度重叠时,当两者之间距离足够近时,能够发生荧光共振能量转移(fret)而使荧光淬灭,所以筛选合适的荧光能量供体和受体,对荧光传感器的检测效果也起到决定性的作用,因此,合理使用荧光能量供体-受体对,设计合理的空间距离,是制备荧光生物传感器的重要因素。
技术实现要素:
为了解决上述问题,本发明提供黄曲霉毒素产毒基金的一种源头检测的方法,制备基于荧光共振能量转移和目标物特异性识别的荧光机制的黄曲霉毒素产毒基因nor-1的荧光传感器,选用cdte/cds-金纳米粒子(aunps)作为能量供-受体对,并利用发夹探针回形设计拉进两者的距离促使荧光共振能量转移的产生,通过nor-1对发夹探针的dna互补配对原则特异性识别并拉伸发夹探针,增大能量供-受体对的距离,阻碍荧光共振能量转移致使荧光恢复,通过荧光恢复强度的变化,实现对nor-1的快速灵敏检测。
为了达到上述目的,本发明是通过以下技术方案来实现的:
本发明的一种黄曲霉毒素产毒基因nor-1的荧光传感器的制备方法,荧光传感器为基于特异性识别黄曲霉毒素产毒基因nor-1的长臂发夹探针,在所述长臂发夹探针的两端分别带有nh2和sh,nh2修饰上核壳结构的cdte/cds量子点,sh修饰上金纳米粒子aunps,在没有目标物出现时,cdte/cds量子点和aunps空间距离靠近,发生荧光共振能量转移,从而导致cdte/cds量子点的荧光淬灭,当目标物nor-1出现时,nor-1与发夹探针特异性互补配对,使发夹探针伸直,拉大了cdte/cds量子点和aunps的距离,阻断了荧光共振能量转移,从而使cdte/cds量子点的荧光恢复,通过荧光恢复强度测定nor-1的浓度,采用荧光恢复机制构建的方法建立了一种荧光传感器;制备所述荧光传感器的步骤如下:
1)制备cdte/cds量子点溶液备用;
2)制备aunps备用;
3)长臂发夹探针的修饰:a、将步骤1制备的cdte/cds量子点溶液超声分散,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)溶液,振荡均匀,加入n-羟基琥珀酰亚胺(nhs)溶液,振荡均匀,加入发夹探针储备液,在室温下反应,震荡过夜得到cdte/cds-发夹探针,随后使用乙醇洗涤,离心,最后将cdte/cds-发夹探针分散于tris-hcl缓冲液中备用;b、移取适量制备的aunps加入a步骤中制备的cdte/cds-发夹探针分散液中,加入nacl溶液调节钠离子浓度到一定值,常温下震荡反应24h,随后水洗离心得到cdte/cds-发夹探针-aunps。
本发明的进一步改进在于:步骤3的a步骤中cdte/cds量子点、edc、nhs与发夹探针的体积比为50:2.2:2.2:1,edc溶液的浓度为380mm,nhs溶液的浓度为190mm,发夹探针的浓度为100μm。
本发明的进一步改进在于:步骤3的a步骤中tris-hcl缓冲溶液与分散到tris-hcl缓冲溶液中的cdte/cds量子点的体积比为52:42,tris-hcl缓冲溶液浓度为10mm,ph为7.4。
本发明的进一步改进在于:步骤3的b步骤中nacl溶液的浓度为6m,调节钠离子浓度为2m。
本发明的进一步改进在于:步骤3的b步骤中cdte/cds-发夹探针与aunps的体积比为30:1。
本发明的一种黄曲霉毒素产毒基因nor-1的荧光传感器的检测方法,将数组20μl不同浓度的产毒基因nor-1的标准液加入到制备好的0.1mlcdte/cds-发夹探针-aunps溶液中,采用ph7.4的tris-hcl缓冲液定容至2ml,恒温震荡孵育,形成cdte/cds-发夹探针-aunps/nor-1的复合物,采用荧光分光光度计在380nm下测量溶液的荧光强度,并建立荧光恢复强度与nor-1的标准曲线。
本发明的进一步改进在于:所述不同浓度的产毒基因nor-1的标准液为10组,每组的浓度分别为0.05,0.5,5,10,20,40,50,100,150,200nm。
本发明的进一步改进在于:所述孵育时间为40-60min。
本发明的有益效果是:选用cdte/cds作为能量供体,而金纳米粒子(aunps)作为能量受体,分别修饰到发夹探针的两端,制备了dna荧光传感器。运用荧光共振能量转移原理和dna互补配对原则,建立了一种荧光恢复机制的nor-1快速检测的dna荧光传感器,为黄曲霉毒素的检测提供了一种新的方法,该方法较其他黄曲霉毒素检测方法而言,该传感器所需要的核壳型量子点cdte/cds荧光性能稳定,分散性好;该传感器是基于荧光共振能量转移原理和dna互补配对原则构建,理论基础成熟,可靠性强;发夹探针为拉进能量供体和能量受体两者空间距离的媒介,通过与目标物nor-1的特异性识别而扩大两者的距离,从而引起荧光恢复,通过荧光恢复程度的测定,实现对nor-1的检测;该方法操作简单,检测迅速,适用于快速检测分析。此外,本方法源头检测黄曲霉毒素的产毒基因,有望为抑制黄曲霉毒素产毒菌的扩增提供依据。
附图说明
图1是cdte/cds荧光发射光谱与aunps紫外光谱重叠情况示意图。
图2是荧光传感器的制备及其对nor-1的检测原理示意图;
图3是检测不同浓度的nor-1的荧光强度标准曲线图。
具体实施方式
为了加强对本发明的理解,下面将结合附图和实施例对本发明作进一步描述,以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制,在不背离本发明实质的情况下,对本发明方法、步骤或条件所作的修改和替换,均属于本发明的范围。
本发明是一种黄曲霉毒素产毒基因nor-1的荧光传感器的制备方法,荧光传感器为基于特异性识别黄曲霉毒素产毒基因nor-1的长臂发夹探针,在所述长臂发夹探针的两端分别带有nh2和sh,nh2修饰上核壳结构的cdte/cds量子点,sh修饰上金纳米粒子aunps,在没有目标物出现时,cdte/cds量子点和aunps空间距离靠近,发生荧光共振能量转移,从而导致cdte/cds量子点的荧光淬灭,当目标物nor-1出现时,nor-1与发夹探针特异性互补配对,使发夹探针伸直,拉大了cdte/cds量子点和aunps的距离,阻断了荧光共振能量转移,从而使cdte/cds量子点的荧光恢复,通过荧光恢复强度测定nor-1的浓度,采用荧光恢复机制构建的方法建立了一种荧光传感器;制备所述荧光传感器的步骤如下:
1)制备cdte/cds量子点溶液备用;
具体制备过程为:将0.0673gnabh4和0.0957gte粉加入10ml比色管中,加入4ml二次水,通氮除氧15min,于4℃冰箱内反应得到上清液呈紫色透明的nahte溶液;在100ml三颈烧瓶中,加入50ml二次水,0.1142gcdcl2和75μlmpa,在搅拌条件下通氮保护,加入naoh调节溶液ph至8.5;迅速加入2ml上述新鲜制备的nahte溶液,充分搅拌后,100℃下回流0.5h得到cdte量子点。按化学计量比称取氯化镉加入已得到的cdte量子点中,反应0.5h后加入cn2h4s继续回流得到核壳型的cdte/cds量子点。
2)制备aunps备用;
具体制备过程为:将一定量的浓度为200μm的氯金酸溶液放入烧瓶中,在搅拌下加热至剧烈沸腾,在剧烈搅拌下将0.4ml浓度大小为350mm的柠檬酸钠溶液加入沸腾的氯金酸溶液中,当溶液颜色由淡黄色变为酒红色之后,在搅拌条件下持续加热沸腾15min。然后将合成的金纳米粒子在搅拌条件下慢慢冷却至室温,随后将合成好的溶液通过0.8μm的多微孔膜过滤,得到所需的aunps。
3)长臂发夹探针的修饰:a、将步骤1制备的cdte/cds量子点溶液超声分散,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)溶液,振荡均匀,加入n-羟基琥珀酰亚胺(nhs)溶液,振荡均匀,加入发夹探针储备液,在室温下反应,震荡过夜得到cdte/cds-发夹探针,随后使用乙醇洗涤,离心,最后将cdte/cds-发夹探针分散于tris-hcl缓冲液中备用;b、移取适量制备的aunps加入a步骤中制备的cdte/cds-发夹探针分散液中,加入nacl溶液调节钠离子浓度到一定值,常温下震荡反应24h,随后水洗离心得到cdte/cds-发夹探针-aunps。
黄曲霉毒素产毒基因nor-1的荧光传感器的检测方法,在检测前将产毒基因nor-1的标准液分为十组,每组的均为20μl,浓度分别为0.05,0.5,5,10,20,40,50,100,150,200nm,备用的cdte/cds-发夹探针-aunps溶液分为十组,每组0.1ml,将十组产毒基因nor-1的标准液分别加入到十组cdte/cds-发夹探针-aunps溶液中,采用ph7.4的tris-hcl缓冲液定容至2ml,恒温震荡孵育40-60min,优选的为50min,形成cdte/cds-发夹探针-aunps/nor-1的复合物,采用荧光分光光度计在380nm下测量溶液的荧光强度,并建立荧光恢复强度与nor-1的标准曲线。
将制备的荧光传感器对黄曲霉毒素产生霉菌的实际样品进行检测,确认产毒菌株是否含有黄曲霉毒素的产毒基因。检测过程如下:将100μl含有1%,5%,10%黄曲霉产毒菌dna提取物的pcr扩增产物加入到400μl制备好的cdte/cds-发夹探针-aunps分散液中,加入nacl调节钠离子浓度至2m,持续孵育50min后,采用荧光分光光度计,测定荧光传感器的荧光恢复强度,通过标准曲线的回归计算,确认产毒菌株是否含有黄曲霉毒素的产毒基因。通过本方法从源头检测黄曲霉毒素的产毒基因,检测迅速,适用于快速检测分析。
- 还没有人留言评论。精彩留言会获得点赞!