一种调控中性粒细胞活性的方法与流程
本发明属于生物技术领域,具体涉及一种调控中性粒细胞活性的方法。
背景技术:
中性粒细胞在人体免疫系统中有着重要的作用。目前,在药物研发以及如何使中性粒细胞作用于癌细胞的效果得以提升等问题上,缺少一个有效的参考依据和控制手段,基于此,如何调控中性粒细胞的活性就显得意义重大。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种调控中性粒细胞活性的方法,使得中性粒细胞作用于癌细胞的效果得以控制。
为了实现上述目的或者其他目的,本发明是通过以下技术方案实现的,本发明提供一种调控中性粒细胞活性的方法,通过调节中性粒细胞和/或靶细胞表面的电荷密度来调控中性粒细胞的活性。
在一实施例中,所述通过调节中性粒细胞和/或靶细胞表面的电荷密度来调控中性粒细胞的活性的过程具体包括:
将带电荷颗粒制成电荷悬液,和/或
将糖酵解通路抑制剂稀释成抑制剂悬液;
将所述电荷悬液与中性粒细胞混合孵育,和/或
将所述抑制剂悬液或所述电荷悬液与靶细胞混合孵育;
通过所述电荷悬液调节中性粒细胞表面的电荷密度和/或通过所述抑制剂悬液或所述电荷悬液调节靶细胞表面的电荷密度来调控中性粒细胞的活性。
在一实施例中,通过所述电荷悬液调节中性粒细胞表面的电荷密度来调控中性粒细胞的活性的具体步骤包括:
将所述电荷悬液与中性粒细胞混合孵育,获得调控后的中性粒细胞;
将所述调控后的中性粒细胞作用于孵育在细胞培养板上的待测靶细胞;
在所述细胞培养板中加入检测试剂;
检测所述细胞培养板中吸光度的变化;
根据所述吸光度的变化判断所述中性粒细胞的活性。
在一实施例中,所述调控后的中性粒细胞与所述待测靶细胞之间的效靶比为(3-20):1。
在一实施例中,通过所述抑制剂悬液或所述电荷悬液调节靶细胞表面的电荷来调控中性粒细胞的活性的具体步骤包括:
提供培养板;
在所述培养板上接种靶细胞;
向所述培养板中加入所述抑制剂悬液或所述电荷悬液,获得调控后的靶细胞;
将待测中性粒细胞加入到所述调控后的靶细胞中共孵育;
向所述培养板中添加检测试剂;
检测所述培养板中吸光度的变化;
根据所述吸光度的变化判断所述待测中性粒细胞的活性。
在一实施例中,所述带电荷颗粒为正电纳米颗粒或者负电纳米颗粒。
在一实施例中,所述带电荷颗粒包括经过表面修饰的四氧化三铁颗粒、金颗粒、多孔硅颗粒、二氧化硅颗粒和硅量子点中的一种或多种组合。
在一实施例中,所述电荷悬液的制备过程包括:
将所述带电荷颗粒分散于磷酸盐缓冲溶液中,获得所述电荷悬液。
在一实施例中,所述电荷悬液的浓度为0μg/ml-500μg/ml。
在一实施例中,所述糖酵解通路抑制剂为3-溴丙酮酸或者二氯乙酸。
在一实施例中,所述细胞培养板和所述培养板均为96细胞培养板。
在一实施例中,所述检测试剂为细胞增殖/毒性检测试剂、噻唑蓝试剂或台盼蓝试剂中的一种。
在本发明中,通过调节细胞表面的电荷强弱,从而调控中性粒细胞的作用效果。本发明对未来药物的研发以及使中性粒细胞作用于癌细胞的效果得以调控等方面提供新的思路、参考依据和控制手段。本发明填补了技术领域的空白,首次通过调节中性粒细胞或者靶细胞表面的电荷密度来调控中性粒细胞的作用效果,具有重要的意义。
附图说明
图1为本发明一实施例中通过调节中性粒细胞和/或靶细胞表面的电荷密度来调控中性粒细胞的活性的流程示意图;
图2为本发明一实施例中,利用不同浓度正电纳米颗粒屏蔽癌细胞表面负电荷后,中性粒细胞活性的变化;
图3为本发明一实施例中,利用不同浓度负电纳米颗粒屏蔽中性粒细胞表面正电荷后,中性粒细胞活性的变化;
图4为本发明一实施例中,不同浓度的糖酵解通路抑制剂(3-溴丙酮酸)对肺癌细胞a549存活率的影响;
图5为本发明一实施例中,不同浓度3-溴丙酮酸对中性粒细胞作用于肺癌细胞a549效率的影响;
图6为本发明一实施例中,不同浓度3-溴丙酮酸对正电纳米颗粒捕获肺癌细胞a549效率的影响;
图7为本发明一实施例中,不同浓度的3-溴丙酮酸对肺癌细胞a549乳酸分泌量的影响。
具体实施方式
以下通过特定的具体实施例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。需说明的是,在不冲突的情况下,以下实施例及实施例中的特征可以相互组合。还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
本发明通过调节中性粒细胞或者靶细胞表面的电荷密度来调节中性粒细胞的活性,使得中性粒细胞作用于靶细胞的效果得以调控。
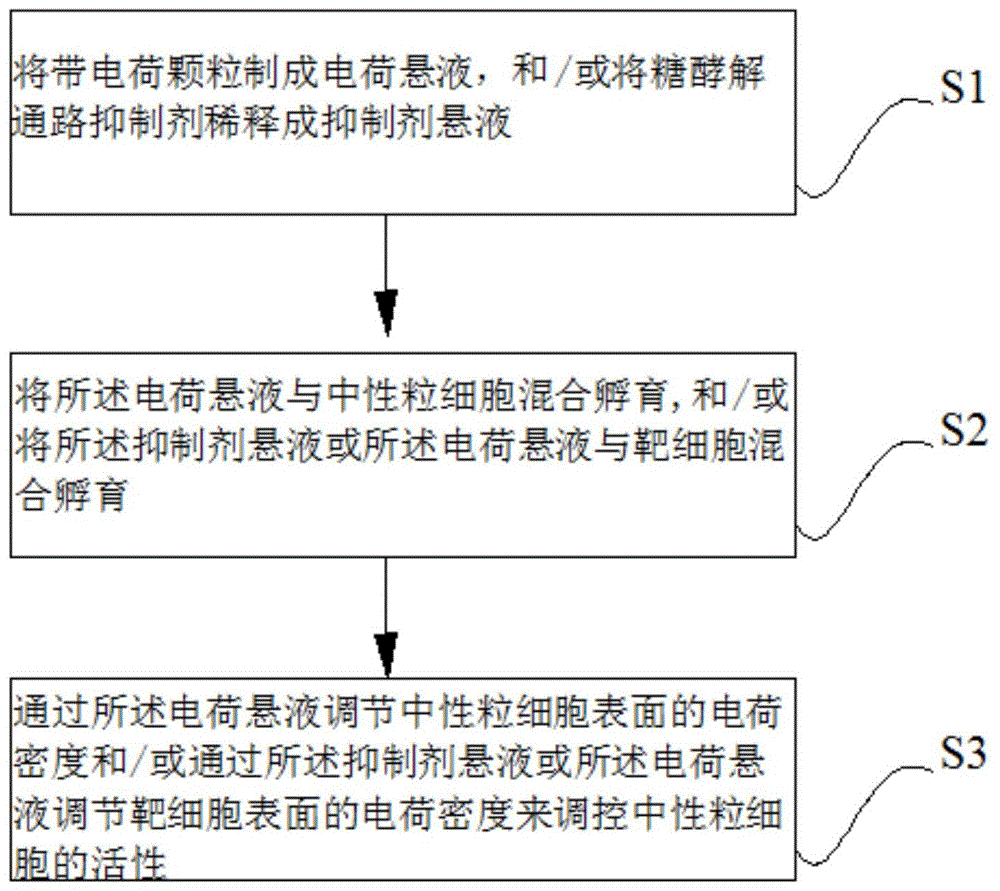
如图1所述,本发明提供一种通过调节中性粒细胞和/或靶细胞表面的电荷密度来调控中性粒细胞的活性的方法,具体过程包括:
s1、将带电荷颗粒制成电荷悬液,和/或将糖酵解通路抑制剂稀释成抑制剂悬液;
s2、将所述电荷悬液与中性粒细胞混合孵育,和/或将所述抑制剂悬液或所述电荷悬液与靶细胞混合孵育;
s3、通过所述电荷悬液调节中性粒细胞表面的电荷密度和/或通过所述抑制剂悬液或所述电荷悬液调节靶细胞表面的电荷密度来调控中性粒细胞的活性。
具体的,在s1步骤中,所述电荷悬液的制备过程包括:将所述带电荷颗粒分散于磷酸盐缓冲溶液中,获得所述电荷悬液。所述带电荷颗粒为正电纳米颗粒或者负电纳米颗粒。所述带电荷颗粒包括经过表面修饰的四氧化三铁颗粒、金颗粒、多孔硅颗粒、二氧化硅颗粒和硅量子点中的一种或多种组合。所述电荷悬液的浓度为0μg/ml-500μg/ml。所述糖酵解通路抑制剂例如为3-溴丙酮酸或者二氯乙酸;所述抑制剂悬液的制备过程为:称取糖酵解通路抑制剂粉末例如3-溴丙酮酸粉末,用细胞培养基稀释,获得所述抑制剂悬液,稀释浓度例如为0、20、40、80g/ml。
具体的,在s2步骤中,获取中性粒细胞的步骤包括:配制若干组浓度梯度的淋巴细胞分离液;将所述若干组浓度梯度淋巴细胞分离液按照浓度从大到小的顺序加入到离心管中,使浓度最小的淋巴细胞分离液位于所述离心管的最上层;采集1-4ml外周血并稀释1-3倍,获得稀释后的外周血;取1-4ml所述稀释后的外周血加入到所述浓度最小的淋巴细胞分离液上;利用所述若干组浓度梯度的淋巴细胞分离液,通过离心分离提取步骤获得所述中性粒细胞。
具体的,在s3步骤中,通过所述电荷悬液调节中性粒细胞表面的电荷密度来调控中性粒细胞的活性的具体步骤包括:将所述电荷悬液与中性粒细胞混合孵育,获得调控后的中性粒细胞;将所述调控后的中性粒细胞作用于孵育在细胞培养板上的待测靶细胞;在所述细胞培养板中加入检测试剂,细胞培养板例如为96孔细胞培养板;检测所述细胞培养板中吸光度的变化;根据所述吸光度的变化判断所述中性粒细胞的活性。所述调控后的中性粒细胞与所述待测靶细胞之间的效靶比为(3-20):1。
具体的,在s3步骤中,通过所述抑制剂悬液或所述电荷悬液调节靶细胞表面的电荷来调控中性粒细胞的活性的具体步骤包括:提供培养板,例如96孔细胞培养板;在所述培养板上接种靶细胞;向所述培养板中加入所述抑制剂悬液或所述电荷悬液,获得调控后的靶细胞;将待测中性粒细胞加入到所述调控后的靶细胞中共孵育;向所述培养板中添加检测试剂;检测所述培养板中吸光度的变化;根据所述吸光度的变化判断所述待测中性粒细胞的活性。所述检测试剂为细胞增殖/毒性检测试剂、噻唑蓝试剂或台盼蓝试剂中的一种。
在一实施例中,包括以下步骤:
接种靶细胞的步骤包括:将例如人肺癌细胞a549,以8000-12000细胞/孔的密度,接种于96孔细胞培养板,于35-37℃培养12-24小时。
获取中性粒细胞的步骤包括:配制5种不同密度的percoll淋巴细胞分离液,例如ⅰ(80%-70%percoll)、ⅱ(68%-58%percoll)、ⅲ(55%-45%percoll)、ⅳ(43%-33%percoll)、ⅴ(30%-20%percoll);分别吸取1-2ml分离液ⅰ、1-2ml分离液ⅱ、1-2ml分离液ⅲ、1-2ml分离液ⅳ、1-2ml分离液ⅴ,依次加入离心管中;采集健康人外周血1-4ml,用pbs稀释1-3倍;吸取1-4ml稀释后的外周血,加于分离液ⅴ之上;将加有稀释后的外周血的分离液以500×g的转速,离心30-60分钟,获得上层和下层;吸取中性粒细胞层即下层,分别加入10-20倍体积的改良伊格尔细胞培养基,然后以500×g至800×g的转速,离心5-10分钟;向人外周血中性粒细胞中,分别加入1-4ml含10%胎牛血清的改良伊格尔细胞培养基,吹打混悬中性粒细胞,并用countstar细胞计数仪计数。
正电纳米颗粒调控癌细胞表面电荷的步骤包括:称取适量正电纳米颗粒,分散于磷酸盐缓冲溶液(ph=7.2)中,以高糖改良伊格尔细胞培养基(ph=7.2~7.4)稀释并配制成不同浓度的悬液,例如为0μg/ml、1.4μg/ml、7μg/ml、35μg/ml的正电荷悬液;吸弃96孔细胞培养板中的培氧基,用磷酸盐缓冲液pbs洗2-3次;向癌细胞例如人肺癌细胞a549中加入不同浓度正电纳米颗粒悬液100-200μl,室温孵育10-15分钟。
中性粒细胞与调控后的癌细胞共孵育的步骤包括:吸弃96孔细胞培养板中的培养基及正电荷悬液,用pbs洗2-3次;将所得人外周血中性粒细胞,以效靶比(3-20):1的比例加入到例如人肺癌细胞a549中,于35-37℃培养12-24小时。
检测并判断中性粒细胞的活性的步骤包括:吸弃96孔培养板细胞培养基及人外周血中性粒细胞,并用pbs洗2-3次;将检测试剂例如cck-8试剂以1:10的比例,加入含10%胎牛血清的改良伊格尔细胞培养基中,吹打混匀;将稀释后的cck-8溶液加入96孔细胞培养板中,每孔110μl,并于35-37℃培养1-4小时;利用酶标仪,于420-450nm处,检测光密度值,并计算癌细胞的存活率。癌细胞存活率的计算方法包括:例如,接种了癌细胞及中性粒细胞的实验孔的吸光度以字母a表示;只接种癌细胞的实验孔的吸光度以字母b表示;只接种中性粒细胞的实验孔的吸光度以字母c表示;不接种任何细胞的空白对照孔的吸光度以字母d表示;则癌细胞的存活率=(a-c)/(b-d)×100%,癌细胞存活率也反映出中性粒细胞消灭癌细胞的效率。
以图2所示结果为例,正电纳米颗粒屏蔽癌细胞表面负电荷后,可显著降低来源于不同受试者的中性粒细胞的作用效果。癌细胞表面负电程度降低,中性粒细胞的作用效果也降低。
在另一个实施例中,包括以下步骤:
接种靶细胞的步骤包括:将例如人肺癌细胞a549,以8000-12000细胞/孔的密度,接种于96孔细胞培养板,于35-37℃培养12-24小时。
获取中性粒细胞的步骤包括:配制5种不同密度的percoll淋巴细胞分离液,例如ⅰ(80%-70%percoll)、ⅱ(68%-58%percoll)、ⅲ(55%-45%percoll)、ⅳ(43%-33%percoll)、ⅴ(30%-20%percoll);分别吸取1-2ml分离液ⅰ、1-2ml分离液ⅱ、1-2ml分离液ⅲ、1-2ml分离液ⅳ、1-2ml分离液ⅴ,依次加入离心管中;采集健康人外周血1-4ml,用pbs稀释1-3倍;吸取1-4ml稀释后的外周血,加于分离液ⅴ之上;将加有稀释后的外周血的分离液以500×g的转速,离心30-60分钟,获得上层和下层;吸取中性粒细胞层即下层,分别加入10-20倍体积的改良伊格尔细胞培养基,然后以500×g至800×g的转速,离心5-10分钟;向人外周血中性粒细胞中,分别加入1-4ml含10%胎牛血清的改良伊格尔细胞培养基,吹打混悬中性粒细胞,并用countstar细胞计数仪计数。
负电纳米颗粒调控中性粒细胞表面电荷的步骤包括:称取适量负电纳米颗粒,分散于磷酸盐缓冲溶液pbs(ph=7.2)中,以高糖改良伊格尔细胞培养基(ph=7.2~7.4)稀释并配制成不同浓度的悬液,例如0μg/ml、1.4μg/ml、7μg/ml、35μg/ml的负电纳米颗粒悬液;将负电纳米颗粒悬液加入本实施例所得中性粒细胞中,室温孵育10-15分钟,获得调控后的中性粒细胞。
调控后的中性粒细胞与靶细胞共同孵育的步骤包括:吸弃本实施例中96孔细胞培养板中的培养基,用pbs洗2-3次;调控后的中性粒细胞以效靶比(3-20):1的比例加入人肺癌细胞a549中,于35-37℃培养12-24小时。
检测并判断调控后的中性粒细胞的活性的步骤包括:吸弃96孔培养板细胞培养基及人外周血中性粒细胞,并用pbs洗2-3次;将检测试剂例如cck-8试剂以1:10的比例,加入含10%胎牛血清的改良伊格尔细胞培养基中,吹打混匀;将稀释后的cck-8溶液加入96孔细胞培养板中,每孔加入100-110μl,并于35-37℃培养1-4小时;利用酶标仪,于420-450nm处,检测光密度值,并计算癌细胞的存活率。癌细胞存活率的计算方法包括:例如,接种了癌细胞及中性粒细胞的实验孔的吸光度以字母a表示;只接种癌细胞的实验孔的吸光度以字母b表示;只接种中性粒细胞的实验孔的吸光度以字母c表示;不接种任何细胞的空白对照孔的吸光度以字母d表示;则癌细胞的存活率=(a-c)/(b-d)×100%,癌细胞存活率也反映出中性粒细胞消灭癌细胞的效率。
以图3所示结果为例,负电纳米颗粒屏蔽中性粒细胞表面正电荷后,可显著降低来源于不同受试者的中性粒细胞的作用效果。中性粒细胞表面正电程度降低,其作用效果也随之降低,即中性粒细胞的活性受到影响。
在另一个实施例中,包括以下步骤:
接种靶细胞的步骤包括:将例如人肺癌细胞a549,以8000-12000细胞/孔的密度,接种于96孔细胞培养板,于35-37℃培养12-24小时。
获取中性粒细胞的步骤包括:配制5种不同密度的percoll淋巴细胞分离液,例如ⅰ(80%-70%percoll)、ⅱ(68%-58%percoll)、ⅲ(55%-45%percoll)、ⅳ(43%-33%percoll)、ⅴ(30%-20%percoll);分别吸取1-2ml分离液ⅰ、1-2ml分离液ⅱ、1-2ml分离液ⅲ、1-2ml分离液ⅳ、1-2ml分离液ⅴ,依次加入离心管中;采集健康人外周血1-4ml,用pbs稀释1-3倍;吸取1-4ml稀释后的外周血,加于分离液ⅴ之上;将加有稀释后的外周血的分离液以500×g的转速,离心30-60分钟,获得上层和下层;吸取中性粒细胞层即下层,分别加入10-20倍体积的改良伊格尔细胞培养基,然后以500×g至800×g的转速,离心5-10分钟;向人外周血中性粒细胞中,分别加入1-4ml含10%胎牛血清的改良伊格尔细胞培养基,吹打混悬中性粒细胞,并用countstar细胞计数仪计数。
糖酵解通路抑制剂与靶细胞共同孵育的步骤以3-溴丙酮酸与肺癌细胞a549共孵育步骤为例进行说明:吸弃本实施例中的96孔细胞培养板板内的细胞培养基,用pbs洗2-3次;称取适量3-溴丙酮酸粉末,用细胞培养基稀释至0μg/ml、20μg/ml、40μg/ml、80μg/ml,并加入到肺癌细胞a549中,35-37℃孵育12-24小时,获得经3-溴丙酮酸调控后的肺癌细胞a549。
检测经3-溴丙酮酸孵育过的人肺癌细胞a549的存活率步骤包括:吸弃本实施例中的96孔细胞培养板板内细胞培养基,用pbs洗2-3次;将检测试剂例如cck-8试剂与细胞培养基以1:10的比例混合均匀,每孔加入100-110μl,置于35-37℃孵育1-4小时;用酶标仪,检测420-450nm处的吸光度;其中a549细胞存活率=(a-c)/(b-d)×100%,其中,a:接种了a549细胞并加入3-溴丙酮酸孵育的实验孔的吸光度;b:仅接种a549细胞的对照孔的吸光度;c:仅加入3-溴丙酮酸的对照孔的吸光度;d:仅加入细胞培养基的对照孔的吸光度。
以图4所示结果为例,本实施例4个实验浓度下的3-溴丙酮酸对人肺癌细胞a549的生存率无显著影响,细胞生存率均>87%,可用于后续实验中。
中性粒细胞与经3-溴丙酮酸孵育过的人肺癌细胞a549共孵育的过程包括:将本实施例中96孔细胞培养板中的细胞培养基吸弃,用pbs洗2-3次;将获得的中性粒细胞以(3-20):1的比例加入癌细胞例如人肺癌细胞a549中,于35-37℃孵育12-24小时;吸弃细胞培养基及悬浮的细胞,用pbs洗2-3次。
检测并判断本实施例的中性粒细胞的活性的步骤包括:将检测试剂例如cck-8试剂与细胞培养基按1:10的比例混合均匀,按照每孔100-110μl加于癌细胞例如人肺癌细胞a549中,于35-37℃孵育1-4小时;用酶标仪于420-450nm检测吸光度;癌细胞的存活率=(a-c)/(b-d)×100%其中,a:同时接种癌细胞及中性粒细胞的实验孔的吸光度;b:只接种癌细胞的对照孔的吸光度;c:只接种中性粒细胞的对照孔的吸光度;d:不接种任何细胞的对照孔的吸光度。
以图5所示结果为例,经3-溴丙酮酸孵育过的肺癌细胞a549经中性粒细胞作用后,存活率显著升高。同时,3-溴丙酮酸的浓度越大,中性粒细胞的活性降低程度越显著。
考察3-溴丙酮酸对a549乳酸分泌量的影响,采用乳酸检测试剂盒检测,过程如下:吸取本实施例中的96孔细胞培养板中每各孔的上清作为后续检测样本;向空白管中,加入15-20μl双蒸水;向标准管中,加入15-20μl标准品(浓度为3mmol/l);向测定管中,加入15-20μl待测样本;向空白管、标准管及测定管中,加入1-2ml酶工作液;向空白管、标准管及测定管中,加入150-200μl显色剂,均匀后,于35-37℃水浴反应10-15分钟;加入2-3ml终止液后,混匀,于530-540nm处,检测吸光度;则乳酸浓度(mmol/l)=(测定管吸光度值-空白管吸光度值)/(标准管吸光度值-空白管吸光度值)×标准品浓度(3mmol/l)。
以图6所示结果为例,20、40、80μm的3-溴丙酮酸均可显著抑制肺癌细胞a549乳酸的分泌。此外,3-溴丙酮酸浓度越大,对乳酸分泌的抑制程度越强。以上结果表明,经3-溴丙酮酸孵育后的肺癌细胞a549,其糖酵解通路被显著抑制。
考察3-溴丙酮酸对正电纳米颗粒捕获a549细胞效率的影响,过程如下:将人肺癌细胞a549细胞,以1×106-1×107细胞/孔的密度,接种于例如6孔细胞培养板,于35-37℃孵育12-24小时;吸弃6孔细胞培养板中的培养基,用pbs洗2-3次;每孔加入1-2ml胰酶,置于35-37℃下孵育5-10分钟;每孔加入5-10ml含10%胎牛血清的细胞培养基,终止消化,并将细胞转移至离心管中,以800-1000rpm的转速离心5-10分钟,吸弃上清,沉淀以pbs稀释至浓度约为3×105-5×105细胞/毫升的细胞悬液,细胞浓度记为a;向1ml细胞悬液中,加入正电纳米颗粒,使纳米颗粒的浓度为35-70ug/ml;置于4-5℃冰箱中,孵育10-15分钟;用磁力架,于4-5℃下,磁分离10-15分钟;吸弃上清,用1mlpbs重悬沉淀,细胞浓度记为b;则正电纳米颗粒的捕获效率=b/a×100%。
以图7所示结果为例,经3-溴丙酮酸孵育后的肺癌细胞a549,其正电纳米颗粒捕获效率显著降低。3-溴丙酮酸浓度越大,正电纳米颗粒的捕获效率降低越显著。以上结果表明,经3-溴丙酮酸孵育后的肺癌细胞a549,其糖酵解通路被抑制,细胞表面负电程度显著降低,进而导致其正电纳米颗粒捕获效率下降。
在本发明中,癌细胞为所有种类的癌细胞,例如肺癌细胞、肝癌细胞、乳腺癌细胞、前列腺癌细胞、膀胱癌细胞、宫颈癌细胞、甲状腺癌细胞、卵巢癌细胞、淋巴癌细胞、肾癌细胞、胃癌细胞、肠癌细胞、胰腺癌细胞、骨癌细胞、黑色素瘤细胞、白血病细胞等。
在本发明中,调控靶细胞表面的电荷密度的物质还包括葡萄糖,因为提高细胞培养基中葡萄糖的浓度,会导致癌细胞糖酵解功能增强,进而导致癌细胞的乳酸分泌量增多,细胞表面负电程度增加,中性粒细胞对癌细胞的识别功能增强,最终导致中性粒细胞对癌细胞的作用效果升高。
本发明提出的一种调控中性粒活性的方法,在体外通过调节细胞表面电荷强弱,从而调控中性粒细胞作用于癌细胞的效果,以这个结果作为参考依据,为未来药物的研发、对于抵抗癌细胞的手段的完善以及中性粒细胞作用于癌细胞的效果的提升等提供新的思路。
此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!