一种酮、醛加氢还原制备醇类化合物的方法与流程
本发明属于医药和天然化合物化工中间体及相关化学技术领域,涉及一种酮、醛加氢还原制备醇类化合物的方法。
背景技术:
醇作为重要的有机化工原料,同时也是合成许多精细化学品的中间体,在染料、医药、农药、表面活性剂、纺织助剂、螯合剂、高分子材料等行业中具有广泛的应用,因此醇类化合物的合成占非常重要的地位。正是由于它的重要性,人们对合成醇类化合物的研究十分重视,研究重点以改变反应过程中催化剂的种类及氢源为主,从而提高合成醇类化合物的性能。
虽然存在许多合成途径来产生醇,但羰基化合物的还原操作简便、原料易得,正因为以上的优势,开发一种更为绿色、经济的羰基化合物还原反应,以便来合成醇类化合物更具有现实意义。传统由酮、醛还原制备醇的方法主要分为两大类,一是由ru、ir、co以及其它过渡金属与配体结合的均相催化剂,该类催化剂虽然活性较高,但需要较高的温度和压力(t>80℃andh2>10bar),还有催化剂价格昂贵等。[aloiceo,stepheno,etal.dal.trans.,2014,1228-1237;hel-p,chent,etal.joc.,2011,202-206];二是研究较多的非均相催化剂,此类催化剂包括pd/c等,但是催化剂分离回收困难、不可重复使用,而且因为过度还原,产率较低,限制了工业化应用。[shlomie,arkadiv,etal.adv.synth.catal.,2009,1499-1504]。纳米多孔钯催化剂(pdnpore)是一种新型的纳米催化剂,具有独特的双连续三维多孔结构,孔道直径约为1-50nm,比表面积大,结构稳定,不仅容易制取、回收,而且可以重复使用,克服了传统纳米结构催化剂的不足[tanakas,kanekot,asaon,yamamotoy,chenm-w,zhangw,inouea.chem.commun.,2011,47,5985-5987;kanekot,tanakas,asaon,yamamotoy,etal.adv.synth.catal.,2011,353,2927–2932.]。
技术实现要素:
本发明提供了一种酮、醛加氢还原制备醇类化合物的方法,该方法反应条件非常温和,最高产率可达到99%,所使用的催化剂具有活性高、稳定性好等优点,多次重复使用其催化活性基本不变。
本发明的技术方案:
一种酮、醛加氢还原制备醇类化合物的方法,以酮、醛及其衍生物为原料,纳米多孔钯(pdnpore)为催化剂,氢气为氢源,在有机溶剂中高效地加氢还原酮、醛及其衍生物生成醇,反应路线如下:
反应温度为30℃~80℃,反应时间为12h~36h;
r1选自氢、烷基、甲氧基、卤素、羟基、芳基中的一种;
r2选自氢、烷基、芳基中的一种;
催化剂的孔径为1-50nm之间;
酮、醛及其衍生物与催化剂的摩尔比为1:0.01~1:0.5;
氢气的压力为0.1~0.5mpa;
酮、醛及其衍生物在有机溶剂中的摩尔浓度为0.01~2mmol/ml。
所述的有机溶剂为乙腈、甲醇、三乙胺、四氢呋喃、甲苯、乙醇、二氯甲烷、1,4-二氧六环、乙酸乙酯、丙酮、n,n-二甲基甲酰胺的一种或两种以上混合。
分离方法使用柱层析法,硅胶或碱性氧化铝作为固定相,展开剂为极性与非极性的的混合溶剂,如乙酸乙酯-石油醚、乙酸乙酯-正己烷、二氯甲烷-石油醚、甲醇-石油醚。
本发明的有益效果:该反应的条件非常温和,产物产率高,操作和后处理简单,催化剂重复性好,且重复利用多次催化效果没有明显降低,为其实现工业化提供可能。
附图说明
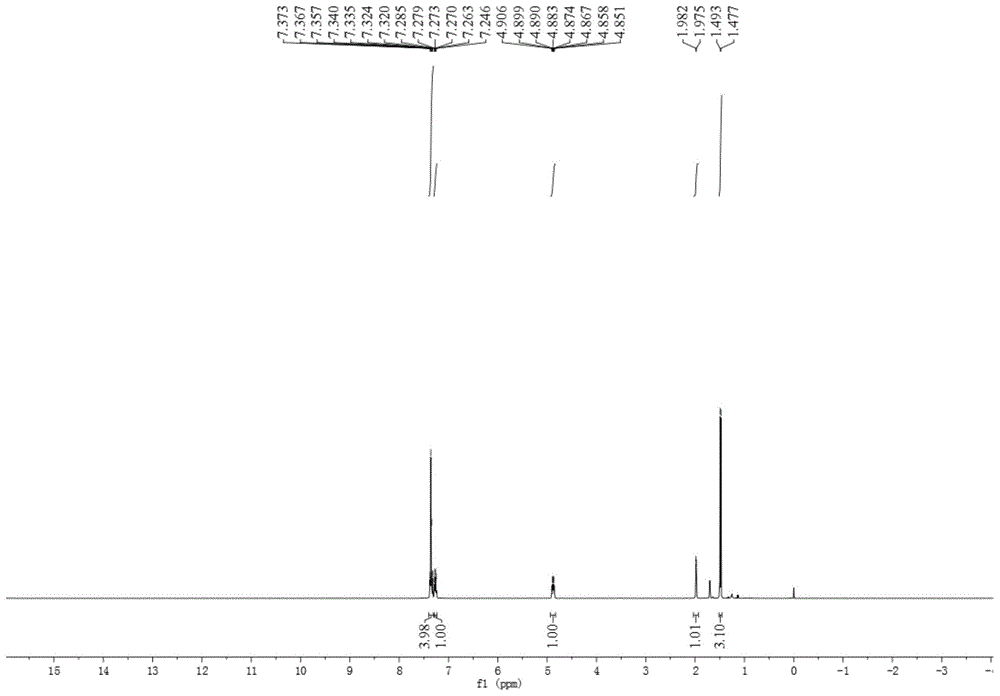
图1是实施例1中1-苯乙醇的1h核磁谱图。
图2是实施例1中1-苯乙醇的13c核磁谱图。
图3是实施例2中1-(4-甲基苯基)-1-乙醇的1h核磁谱图。
图4是实施例2中1-(4-甲基苯基)-1-乙醇的13c核磁谱图。
图5是实施例3中1-(4-甲氧基苯基)乙醇的1h核磁谱图。
图6是实施例3中1-(4-甲氧基苯基)乙醇的13c核磁谱图。
图7是实施例4中1-(4-羟基苯基)乙醇的1h核磁谱图。
图8是实施例4中1-(4-羟基苯基)乙醇的13c核磁谱图。
图9是实施例5中二苯甲醇的1h核磁谱图。
图10是实施例5中二苯甲醇的13c核磁谱图。
图11是实施例6中3,4-二甲基二苯甲醇的1h核磁谱图。
图12是实施例6中3,4-二甲基二苯甲醇的13c核磁谱图。
图13是实施例7中1-(2-萘基)乙醇的1h核磁谱图。
图14是实施例7中1-(2-萘基)乙醇的13c核磁谱图。
图15是实施例8中1-(6-甲氧基-2-萘甲基)乙醇的1h核磁谱图。
图16是实施例8中1-(6-甲氧基-2-萘甲基)乙醇的13c核磁谱图。
图17是实施例9中1-(3-三氟甲基苯基)乙醇的1h核磁谱图。
图18是实施例9中1-(3-三氟甲基苯基)乙醇的13c核磁谱图。
图19是实施例10中9-羟基芴的1h核磁谱图。
图20是实施例10中9-羟基芴的13c核磁谱图。
具体实施方式
本发明所述的酮、醛加氢还原方法,最高反应产率达到99%,选用催化剂催化反应重复性好,操作和后处理简单,且重复利用多次催化效果没有明显降低,为其工业化生产提供了有利条件。
下面结合具体实施例,进一步阐述本发明。在本领域内的技术人员对本发明所做的简单替换或改进均属于本发明所保护的技术方案之内。
实施例1:1-苯乙醇的合成
向加有pdnpore(2.7mg,5mol%)催化剂的甲醇(2ml)溶剂中,加入底物苯乙酮(60.1mg,0.5mmol)、置于磁力搅拌器上30℃下反应20h,柱层析(硅胶,200–300目;展开剂,石油醚,乙酸乙酯)得到1-苯乙醇60.5mg,产率99%。
1-苯乙醇
无色液体;1hnmr(400mhz,cdcl3):δ1.43(d,j=6.5hz,3h),1.63(s,1h),4.84(q,j=6.4,1h),7.18–7.33(m,5h);13cnmr(100mhz,cdcl3)δ=25.2,70.5,125.4,127.5,128.5,145.8.
实施例2:1-(4-甲基苯基)-1-乙醇的合成
向加有pdnpore(2.7mg,5mol%)催化剂的甲醇(2ml)溶剂中,加入底物对甲基苯乙醛(60.1mg,0.5mmol)、置于磁力搅拌器上35℃下反应20h,柱层析(硅胶,200–300目;展开剂,石油醚,乙酸乙酯)得到1-(4-甲基苯基)-1-乙醇67.4mg,产率99%。
1-(4-甲基苯基)-1-乙醇
无色液体;1hnmr(400mhz,cdcl3)δ7.29(d,j=8hz,2h),7.19(d,j=8hz,2h),4.86(q,j=8hz,1h),2.39(s,3h).2.33(s,1h),1.50(d,j=8hz,3h).13cnmr(100mhz,cdcl3):δ142.9,137.1,129.1,125.4,70.2,25.1,21.1.
实施例3:1-(4-甲氧基苯基)乙醇的合成
向加有pdnpore(2.7mg,5mol%)催化剂的甲醇(2ml)溶剂中,加入底物对甲氧基苯乙醛(68.1mg,0.5mmol)、置于磁力搅拌器上40℃下反应20h,柱层析(硅胶,200–300目;展开剂,石油醚,乙酸乙酯),得到1-(4-甲氧基苯基)乙醇73.1mg,产率96%。
1-(4-甲氧基苯基)乙醇
黄色液体;1hnmr(400mhz,cdcl3)δ7.28(d,j=8.6hz,2h),6.87(d,j=8.6hz,2h),4.82(q,j=6.4hz,1h),3.78(s,3h),2.16(brs,1h),1.46(d,j=6.5hz,3h).13cnmr(100mhz,cdcl3)δ158.9,138.1,126.7,113.9,69.9,55.3,25.0.
实施例4:1-(4-羟基苯基)乙醇的合成
向加有pdnpore(2.7mg,5mol%)催化剂的甲醇(2ml)溶剂中,加入底物对羟基苯乙酮(68.1mg,0.5mmol)、置于磁力搅拌器上50℃下反应20h,柱层析(硅胶,200–300目;展开剂,石油醚,乙酸乙酯)得到1-(4-羟基苯基)乙醇65.6mg,产率95%。
1-(4-羟基苯基)乙醇
白色固体;1hnmr(400mhz,medh)δ7.19(d,2h),6.75(d,2h),4.72(q,1h),1.4(d,3h).13cnmr(100mhz,medh)δ156.2,136.9,126.4,114.6,69.2,24.1.
实施例5:二苯甲醇的合成
向加有pdnpore(2.7mg,5mol%)催化剂的乙酸乙酯(2ml)溶剂中,加入底物二苯甲酮(91.1mg,0.5mmol)、置于磁力搅拌器上60℃下反应20h,柱层析(硅胶,200–300目;展开剂,石油醚,乙酸乙酯)得到二苯甲醇91.2mg,产率99%。
二苯甲醇
白色固体;1hnmr(400mhz,cdcl3)δ7.34–7.22(m,8h),7.21–7.15(m,2h),5.75(s,1h),2.20(s,1h).13cnmr(100mhz,cdcl3)δ143.9,128.6,127.7,126.7,76.4.
实施例6:3,4-二甲基二苯甲醇的合成
向加有pdnpore(2.7mg,5mol%)催化剂的丙酮(2ml)溶剂中,加入底物3,4-二甲基二苯甲酮(105.1mg,0.5mmol)、置于磁力搅拌器上50℃下反应22h,柱层析(硅胶,200–300目;展开剂,石油醚,乙酸乙酯)得到3,4-二甲基二苯甲醇102.9mg,产率97%。
3,4-二甲基二苯甲醇
白色固体;1hnmr(400mhz,cdcl3)δ7.31-7.36(m,4h),7.24-7.28(m,1h),7.13(s,1h),7.08(s,1h),5.77(q,4h),2.23(s,6h),2.20(d,1h).13cnmr(100mhz,cdcl3)δ144.0,141.5,136.8,136.0,129.8,128.5,127.9,127.4,126.4,124.0,76.2,19.88,19.48.
实施例7:1-(2-萘基)乙醇的合成
向加有pdnpore(2.7mg,5mol%)催化剂的乙醇(2ml)溶剂中,加入底物萘乙酮(85.1mg,0.5mmol)、置于磁力搅拌器上70℃下反应20h,柱层析(硅胶,200–300目;展开剂,石油醚,乙酸乙酯)得到1-(2-萘基)乙醇82.7mg,产率96%。
1-(2-萘基)乙醇
白色液体;1hnmr(400mhz,cdcl3)δ1.58(d,j=6.4hz,3h),1.90(d,j=3.6hz,1h)5.05-5.10(m,1h),7.44-7.52(m,3h),7.82-7.85(m,4h).13cnmr(100mhz,cdcl3)δ141.4,133.8,129.0,128.0,126.1,125.5,123.2,122.0,67.2,24.4.
实施例8:1-(6-甲氧基-2-萘甲基)乙醇的合成
向加有pdnpore(2.7mg,5mol%)催化剂的甲苯(2ml)溶剂中,加入底物对甲氧基萘乙酮(100.1mg,0.5mmol)、置于磁力搅拌器上70℃下反应20h,柱层析(硅胶,200–300目;展开剂,石油醚,乙酸乙酯)得到1-(6-甲氧基-2-萘甲基)乙醇95.1mg,产率94%。
1-(6-甲氧基-2-萘甲基)乙醇
白色固体;1hnmr(400mhz,cdcl3)δ7.71(dd,j=8.2,5.9hz,3h),7.46(dd,j=8.6,1.5hz,1h),7.15–7.11(m,2h),5.01(q,j=6.4hz,1h),3.90(s,3h),2.03(s,1h),1.55(d,j=6.5hz,3h).13cnmr(100mhz,cdcl3)δ157.6,140.9,134.0,129.4,128.7,127.2,124.4,123.8,118.9,105.7,70.5,55.3,25.1.
实施例9:1-(3-三氟甲基苯基)乙醇的合成
向加有pdnpore(2.7mg,5mol%)催化剂的甲醇(2ml)溶剂中,加入底物间三氟甲基苯乙酮(94.1mg,0.5mmol)、置于磁力搅拌器上30℃下反应20h,柱层析(硅胶,200–300目;展开剂,石油醚,乙酸乙酯)得到1-(3-三氟甲基苯基)乙醇94.1mg,产率99%。
1-(3-三氟甲基苯基)乙醇
白色液体;1hnmr(400mhz,cdcl3)δ7.64(s,1h),7.54(t,j=7.6hz,2h),7.46(t,j=7.6hz,1h),4.95(q,j=6.4hz,1h),2.06(brs,1h),1.50(d,j=6.4hz,3h).13cnmr(100mhz,cdcl3)δ146.7,130.9(q,jc-f=31.8hz),128.8(q,jc-f=16.3hz),125.5,124.2(q,jc-f=3.8hz),122.8,122.2(q,jc-f=3.8hz),69.8,25.4.
实施例10:9-羟基芴的合成
向加有pdnpore(2.7mg,5mol%)催化剂的甲醇(2ml)溶剂中,加入底物9-芴酮(90.1mg,0.5mmol)、置于磁力搅拌器上50℃下反应20h,柱层析(硅胶,200–300目;展开剂,石油醚,乙酸乙酯)得到9-羟基芴89.3mg,产率98%。
9-羟基芴
白色液体;1hnmr(400mhz,cdcl3)δ7.68–7.58(m,4h),7.38(t,2h),7.31(t,2h),5.56(d,j=9.0hz,1h),1.82(d,1h).13cnmr(100mhz,cdcl3)δ145.7,140.0,129.1,127.8,125.2,119.9,75.2.
对比例1:与实施例2反应条件除了催化剂改成5mol%的pd/c,其余保持一致。得到1-苯乙醇0mg,产率0%,全部过度还原为1-(4-甲基环己基)-1-乙醇。
1-(4-甲基环己基)-1-乙醇
对比例2:与实施例2反应条件除了催化剂改成5mol%的pd/c,温度变为室温,其余保持一致。得到1-苯乙醇0mg,产率0%,全部过度还原为1-(4-甲基环己基)-1-乙醇。
对比例3:与实施例2反应条件除了催化剂改成5mol%的pd/c,温度变为0℃,其余保持一致。得到1-苯乙醇0mg,产率0%,全部过度还原为1-(4-甲基环己基)-1-乙醇。
对比例4:与实施例5反应条件除了催化剂改成5mol%的pd/c,其余保持一致。得到二苯甲醇0mg,产率0%,全部过度还原为二环己基甲醇。
二环己基甲醇
对比例5:与实施例5反应条件除了催化剂改成5mol%的pd/c,温度变为室温,其余保持一致。得到二苯甲醇0mg,产率0%,全部过度还原为二环己基甲醇。对比例6:与实施例5反应条件除了催化剂改成5mol%的pd/c,温度变为0℃,其余保持一致。得到二苯甲醇18.2mg,产率20%,其余全部过度还原为二环己基甲醇。
通过这些对比例可见,在本设计反应中,pd/c催化剂很难被控制,发生苯环的过度还原,难以得到预期产物,而纳米多孔钯体现了良好的选择性。
- 还没有人留言评论。精彩留言会获得点赞!