制备生物表面活性剂的方法与流程
本发明属于生物技术领域,更具体地,涉及一种制备生物表面活性剂的方法。
背景技术:
生物表面活性剂(biosurfactants)是微生物在代谢过程中分泌的具有表面活性,同时含有亲水基和疏水基的两性化合物。生物表面活性剂包括糖脂、脂肽、脂蛋白、磷脂以及中性类脂衍生物等。与化学合成的表面活性剂相比,生物表面活性剂有许多明显的优势:(1)低临界胶束浓度和高表界面活性;(2)对离子强度的稳定性;(3)较高的生物降解性和低毒性;(4)逐步吸附和持久的活性;(5)优良的破乳性能。
目前,石油污染是世界各国面临的一个突出的环境难题,各国都在研究如何运用生物修复技术进行石油污染土壤的修复,而生物表面活性剂的应用是生物修复的一个关键因素。除此之外,生物表面活性剂,例如鼠李糖脂在重金属污染治理、生物农药与生物肥料、治疗皮肤瘢痕、食品防腐剂和能源应用等领域都有较好的应用前景。
如公开号为cn102373258a的专利文献公开一种脂肽生物表面活性剂的工业化制备方法。该制备方法大致步骤为,将斜面固体枯草芽孢杆菌accc01430菌种接入摇瓶培养,温度为35±2℃、120rpm震荡培养12~16小时,得到摇瓶菌种;将制得的摇瓶菌种转接入装有培养基的一级发酵罐中,制得一级发酵菌种;依次转接入三级发酵罐中培养24~26小时,即制得脂肽生物表面活性剂。其脂肽含量达到7~10g/l,并取得了工业化生产实验的成功,发酵周期缩短到48小时,大大降低了生产成本。并首次将其应用现场,注入地下油层,使难以注水的区块水顺利注入,并且使原油采收率提高了5~12%。
又如公开号为cn104830708a的专利文献公开一株原油降解菌株及其应用。直接从原油中筛选得到一株原油降解菌株cgmcc10287,具有分泌鼠李糖脂和降解原油的能力,并且少量甘油的添加能大幅促进原油的降解。利用30g/l的甘油或菜籽油分别可以获得11.5g/l和18.4g/l鼠李糖脂,菌株在1g/l原油的培养基中培养10d,原油的降解率为35.6%,在原油培养基中添加0.5g/l甘油,将原油降解率提高到了72.5%,弥补了目前物理方法处理石油的不彻底性和化学法处理石油的污染性的缺陷。
再如公开号为cn108823250a的发明专利公开一种提高生物表面活性剂产率的工业发酵生产工艺。该工艺包括:在生物表面活性剂生产菌培养过程中采用溢流发酵与ph阶段性调控相结合。与现有技术相比,其基于生产菌种的生理生长特性,通过溢流分离生物表面活性剂,消除了产物对代谢的抑制;通过ph阶段性控制,优化了细菌生长和代谢环境条件,由此提高生产效率和生物表面活性剂产量。
目前合成生物表面活性剂的成本依然比化学表面活性剂的成本高,并且铜绿假单胞菌生物危害程度较高,也是制约其生产的一大难题。因此有效地降低生产成本,采用低成本原料,开发适宜地发酵方法依然是该行业亟须解决的问题。
技术实现要素:
本发明的目的是一种制备生物表面活性剂的方法,以提高生物表面活性剂的产量。
为了实现上述目的,本发明提供一种制备生物表面活性剂的方法,该方法包括以下步骤:
(1)对铜绿假单胞菌(p.aeruginosa)cgmccno1.10452进行活化培养,得到种子液;
(2)将所述种子液接种于发酵培养基,进行发酵培养,获得发酵液,从所述发酵液中提取所述生物表面活性剂;
其中所述发酵培养基包括以下浓度的组分:
20~50g/l的甘油;
3~10g/l的酵母膏;
5~10g/l的磷酸一氢盐;
1~5g/l的磷酸二氢盐;
0.04~0.1g/l的cacl2;
0.02~0.1g/l的feso4;以及
0.10~0.5g/l的mgso4·7h2o。
本发明提供的制备生物表面活性剂的方法所使用的菌种为铜绿假单胞菌(p.aeruginosa),保藏编号为cgmccno1.10452。本发明中的发酵培养基所使用的磷酸一氢盐可以为磷酸一氢钠和/或磷酸一氢钾,磷酸二氢盐可以为磷酸二氢钠和/或磷酸二氢钾。
在本发明中,对于铜绿假单胞菌(p.aeruginosa)的活化培养所使用的培养基可以为本领域常用的lb固体培养基和lb液体培养基。该lb固体培养基的配方为:5~10g/l的胰蛋白胨,1~5g/l的酵母提取物,5~10g/l的nacl,15~20g/l的琼脂,ph7.0~7.2,用去离子水定容。lb液体培养基与lb固体培养基的区别在于不含琼脂。活化培养具体操作可以为,将lb固体培养基制成斜面培养基,将铜绿假单胞菌(p.aeruginosa)接种于该斜面培养基上,于35~37℃培养箱中培养18~24h;之后将斜面培养基培养的菌种接种于lb液体培养基中,lb液体培养基即为种子培养基,大约每100ml种子培养基接种一环铜绿假单胞菌(p.aeruginosa),于温度为35~37℃,转速为120~150rpm的条件下,培养12~16h。
在本发明的一种优选实施方式中,所述发酵培养在发酵罐中进行,所述发酵罐的通气量为1.5~2.5l/min,发酵温度为30~37℃。所述发酵罐的装液量为所述发酵罐容积的40%~80%,例如40%、60%、70%和80%。
在本发明的步骤(2)中,所述从所述发酵液中提取所述生物表面活性剂的步骤包括以下步骤:
利用第一膜分离组件对所述发酵液进行抽滤,去除所述发酵液中的所述铜绿假单胞菌(p.aeruginosa),获得无菌发酵液;
利用第二膜分离组件对所述无菌发酵液进行抽滤,分离所述无菌发酵液中的水相与油相,获得含有所述生物表面活性剂的油相。
在本发明的一种更优选的实施方式中,所述步骤(2)在发酵系统中进行,所述发酵系统包括:发酵罐、第一接收池、第二接收池、所述第一膜分离组件、所述第二膜分离组件、第一真空抽滤泵、第二真空抽滤泵、取样管路、以及分离管路;
所述发酵罐与所述第一接收池通过所述取样管路连通;
所述第一真空抽滤泵设置在所述取样管路上;
所述第一接收池与所述第二接收池通过所述分离管路连通;
所述第二真空抽滤泵设置在所述分离管路上;
所述第一膜分离组件位于所述发酵罐的内部,并且与所述取样管路的进液端连通;
所述第二膜分离组件位于所述第一接收池的内部,并且与所述分离管路的进液端连通。
本发明中的发酵系统还包括反冲系统,冲洗管路以及实现第一膜分离组件和第二膜分离组件的重复利用,降低生产生物表面活性剂的成本。
当本发明提供的制备生物表面活性剂的方法在上述的发酵系统中进行时,所述步骤(2)包括以下步骤:
将所述种子液接种于所述发酵罐内的发酵培养基,进行发酵培养,获得发酵液;
开启所述第一真空抽滤泵,通过所述第一膜分离组件对所述发酵液进行过滤,所述发酵液中的所述铜绿假单胞菌滞留在所述发酵罐内,其余部分经过所述第二膜分离组件和所述取样管路导入到所述第一接收池内,获得所述无菌发酵液;
开启所述第二真空抽滤泵,通过所述第二膜分离组件对所述无菌发酵液进行过滤,所述无菌发酵液中的水相滞留在所述第一接收池内,油相经过所述第二膜分离组件和所述分离管路导入到所述第二接收池,从而获得所述含有所述生物表面活性剂的油相。
在本发明的一种具体实施方式中,所述第一膜分离组件与所述取样管路连接为一体;所述第二膜分离组件与所述分离管路连接为一体。
在本发明的一种具体实施方式中,所述第一膜分离组件中的滤膜为亲水性膜;
所述第二膜分离组件中的滤膜为疏水性膜。
具体地,所述亲水性膜选自纤维素膜、聚醚砜膜和尼龙膜中的至少一种。
具体地,所述疏水性膜选自陶瓷超滤膜、聚丙烯膜和聚四氟乙烯(ptfe)膜中的至少一种。
由于第一膜分离组件的作用是分离菌种,因而所述第一膜分离组件中的滤膜的孔径为0.1~0.5μm。
由于第二膜分离组件的作用是分离油相和水相,将表面活性剂从无菌的发酵液中分离出来,因而所述第二膜分离组件中的滤膜的截留分子量为300~1000da。
本发明不对第一膜分离组件和第二膜分离组件的结构形式进行限定,只要实现上述的分离目的即可。为了提高分离效率和加强分离效果,所述第一膜分离组件和所述第二膜分离组件均为筛网与滤膜上下叠层结构,可以设置3-8层筛网与滤膜上下叠层,最下方也设置筛网,以防止最下方的滤膜破碎。
在本发明的制备生物表面活性剂的方法中,所述第一真空抽滤泵的压力为0.1~1.0mpa;所述第二真空抽滤泵的压力为0.1~1.0mpa。
本发明提供的制备生物表面活性剂的方法,通过筛选铜绿假单胞菌(p.aeruginosa)cgmccno1.10452和发酵培养基的配方,发现当该铜绿假单胞菌(p.aeruginosa)在配方为20~50g/l的甘油,3~10g/l的酵母膏,5~10g/l的磷酸一氢盐,1~5g/l的磷酸二氢盐,0.04~0.1g/l的cacl2,0.02~0.1g/l的feso4,以及0.10~0.5g/l的mgso4·7h2o的发酵培养基中培养时,生物表面活性剂的产量显著升高。
本发明提供的制备生物表面活性剂的方法,采用膜分离技术分离产物中的生物表面活性剂,相对于酸沉淀和有机溶剂萃取,不会造成环境污染问题,适合工业化推广应用。
本发明提供的制备生物表面活性剂的方法,优化了发酵条件,采用本发酵系统一体化进行生产和分离生物表面活性剂,降低了生物表面活性剂的生产和处理成本,使生物表面活性剂的提取率比现有的方法提高约20%。
本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。
附图说明
通过结合附图对本发明示例性实施方式进行更详细的描述,本发明的上述以及其它目的、特征和优势将变得更加明显,其中,在本发明示例性实施方式中,相同的参考标号通常代表相同部件。
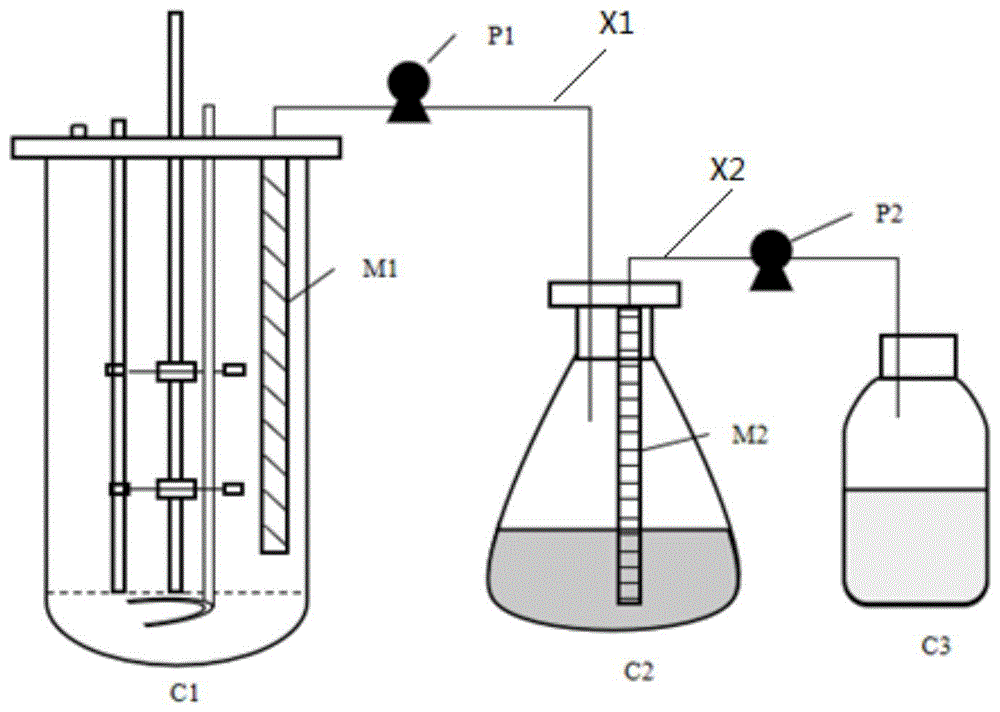
图1示出了本发明提供的制备生物表面活性剂的方法所使用的发酵系统的示意图。
图2示出了鼠李糖的标准曲线的示意图。
具体实施方式
下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。
实施例1
本实施例提供一种制备生物表面活性剂的方法。该方法包括以下步骤:
将干粉铜绿假单胞菌(p.aeruginosa)cgmcc1.10452用0.2mllb液体培养基混匀后全部取出接种至2支斜面培养基中,于35℃培养箱中培养18h;所述斜面培养基配方为(g/l):胰蛋白胨10,酵母提取物1,nacl5,琼脂15,ph7.2,用去离子水定容至1l。
将斜面菌种接入摇瓶培养,每100mllb液体培养基(种子培养基)接入一环菌种,温度为35℃,120rpm震荡培养16h,得到种子液。
该糖脂生物表面活性剂是由铜绿假单胞菌(p.aeruginosa)cgmcc1.10452经发酵获得,发酵培养基为(g/l):甘油20、酵母膏3、kh2po45、na2hpo41、cacl20.04、feso40.02、以及mgso4·7h2o0.10。
将如图1所示的发酵系统进行高压蒸汽灭菌。灭菌条件为121℃,20min。
将活化后的铜绿假单胞菌(p.aeruginosa)接种于5l发酵罐c1内的发酵培养基中,装液量为40%,通气量为1.5l/min,发酵温度为30℃,发酵时间18h。发酵培养基为(g/l):甘油20、酵母膏3、kh2po45、na2hpo41、cacl20.04、feso40.02、以及mgso4·7h2o0.10。
所用第一膜分离组件m1位于发酵罐c1内部,用于过滤菌体,使菌体留在发酵罐c1中,通过第一真空抽滤泵p1和取样管路x1将发酵液导入至第一接收池c2,获得无菌发酵液。第一膜分离组件m1与取样管路x1连接为一体。采用的第一膜分离组件m1的滤膜为混合纤维素膜,过滤孔径为0.1μm,由上至下依次为筛网、滤膜、筛网,滤膜的层数为1,筛网的层数为2。第一真空抽滤泵p1压力为1.0mpa。
所用第二膜分离组件m2位于第一接收池c2,通过第二真空抽滤泵p2和分离管路x2将无菌发酵液中的水相与油相分开,获得含有所述生物表面活性剂的油相。第二膜分离组件m2与分离管路x2连接为一体。第二膜分离组件m2的滤膜为陶瓷超滤膜,截留分子量为300da,由上至下为筛网、滤膜、筛网,滤膜的层数为1,筛网的层数为2。第二真空抽滤泵p2压力为1.0mpa。
从第二接收池c3中取100ml过滤产物,蒸发浓缩后,进行真空干燥,即得生物表面活性剂(鼠李糖脂样品)。称量样品重量计算产量。
实施例2
本实施例提供一种制备生物表面活性剂的方法。该方法包括以下步骤:
1)、将干粉铜绿假单胞菌cgmcc1.10452用0.2mllb液体培养基混匀后全部取出接种至2支斜面培养基中,于37℃培养箱中培养20h;所述斜面培养基配方为(g/l):胰蛋白胨8,酵母提取物3,nacl5,琼脂15,ph7.2,用去离子水定容至1l。
将斜面菌种接入摇瓶培养,每100mllb液体培养基(种子培养基)接入一环菌种,温度为37℃,120rpm震荡培养12h,得到种子液。
该糖脂生物表面活性剂是由铜绿假单胞菌(p.aeruginosa)cgmcc1.10452经发酵获得,发酵培养基为(g/l):甘油20、酵母膏3、kh2po45、na2hpo41、cacl20.04、feso40.02、以及mgso4·7h2o0.10。
将如图1所示的发酵系统进行高压蒸汽灭菌。灭菌条件为121℃,20min。
将活化后的铜绿假单胞菌(p.aeruginosa)接种于5l发酵罐c1内的发酵培养基中,装液量为60%,通气量为2.0l/min,发酵温度为35℃,发酵时间24h。发酵培养基为(g/l):甘油40、酵母膏5、kh2po410、na2hpo43、cacl20.04、feso40.02、mgso4·7h2o0.10。
所用第一膜分离组件m1位于发酵罐c1内部,用于过滤菌体,使菌体留在发酵罐c1中,通过第一真空抽滤泵p1和取样管路x1将发酵液导入至第一接收池c2,获得无菌发酵液。第一膜分离组件m1与取样管路x1连接为一体。采用的第一膜分离组件m1的滤膜为聚醚砜膜,过滤孔径为0.1μm,由上至下依次为筛网、滤膜、筛网,滤膜的层数为5,筛网的层数为6。第一真空抽滤泵p1压力为1.0mpa。
所用第二膜分离组件m2位于第一接收池c2,通过第二真空抽滤泵p2和分离管路x2将无菌发酵液中的水相与油相分开,获得含有所述生物表面活性剂的油相。第二膜分离组件m2与分离管路x2连接为一体。第二膜分离组件m2的滤膜为ptfe膜,截留分子量为500da,由上至下依次为筛网、滤膜、筛网,滤膜的层数为5,筛网的层数为6。第二真空抽滤泵p2压力为1.0mpa。
从第二接收池c3中取100ml含有所述生物表面活性剂的油相,蒸发浓缩后,进行真空干燥,即得生物表面活性剂(鼠李糖脂样品)。称量样品重量计算产量。
实施例3
本实施例提供一种制备生物表面活性剂的方法。该方法包括以下步骤:
1)、将干粉铜绿假单胞菌cgmcc1.10452用0.2mllb液体培养基混匀后全部取出接种至2支斜面培养基中,于37℃培养箱中培养20h;所述斜面培养基配方为(g/l):胰蛋白胨10,酵母提取物5,nacl10,琼脂20,ph7.0,用去离子水定容至1l。
将斜面菌种接入摇瓶培养,每100mllb液体培养基(种子培养基)接入一环菌种,温度为37℃,150rpm震荡培养14h,得到种子液。
该糖脂生物表面活性剂是由铜绿假单胞菌(p.aeruginosa)cgmcc1.10452经发酵获得,发酵培养基为(g/l):甘油50、酵母膏5、kh2po45、na2hpo45、cacl20.1、feso40.05、mgso4·7h2o0.10。
将如图1所示的发酵系统进行高压蒸汽灭菌。灭菌条件为121℃,20min。
将活化后的铜绿假单胞菌(p.aeruginosa)接种于10l发酵罐c1内的发酵培养基中,装液量为70%,通气量为2.5l/min,发酵温度为28℃,发酵时间36h。发酵培养基为(g/l):甘油40、酵母膏5、kh2po410、na2hpo43、cacl20.04、feso40.02、mgso4·7h2o0.10。
所用第一膜分离组件m1位于发酵罐c1内部,用于过滤菌体,使菌体留在发酵罐c1中,通过第一真空抽滤泵p1和取样管路x1将发酵液导入至第一接收池c2,获得无菌发酵液。第一膜分离组件m1与取样管路x1连接为一体。采用的第一膜分离组件m1的滤膜为尼龙膜,过滤孔径为0.22μm,由上至下依次为筛网、滤膜、筛网,滤膜的层数为3,筛网的层数为4。第一真空抽滤泵p1压力为1.0mpa。
所用第二膜分离组件m2位于第一接收池c2,通过第二真空抽滤泵p2和分离管路x2将无菌发酵液中的水相与油相分开,获得含有所述生物表面活性剂的油相。第二膜分离组件m2与分离管路x2连接为一体。第二膜分离组件m2的滤膜为聚丙烯膜,截留分子量为1000da,由上至下依次为筛网、滤膜、筛网,滤膜的层数为3,筛网的层数为4。第二真空抽滤泵p2压力为1.0mpa。
从第二接收池c3中取100ml含有所述生物表面活性剂的油相,蒸发浓缩后,进行真空干燥,即得生物表面活性剂(鼠李糖脂样品)。称量样品重量计算产量。
对比例1
对比例1与实施例1的不同之处仅在于发酵培养基配方为(g/l):胰蛋白胨5~10,酵母提取物1~5,nacl5~10。
对比例2
对比例2与实施例3的不同之处在于,分离获得生物表面活性剂不是采用第一膜分离组件和第二膜分离组件,即膜分离法,而是采用有机溶剂萃取法,具体步骤如下:
将200ml发酵液离心(8000r/min,20min,4℃),取上清液100ml用等体积氯仿反复萃取3次,合并有机相。再进行旋转蒸发,得棕色黏稠物,将黏稠物冷冻干燥,即得生物表面活性剂(鼠李糖脂样品)。称量样品重量计算产量。
对比例3
对比例3与实施例3的不同之处在于,分离获得生物表面活性剂不是采用第一膜分离组件和第二膜分离组件,即膜分离法,而是采用酸沉淀法,具体步骤如下:
将200ml发酵液离心(8000r/min,20min,4℃),取100ml上清液用浓盐酸调至ph为2,4℃下静置过夜,酸化后的溶液经8000r/min离心20min后收集沉淀,用ph=2.0的hcl洗涤3次,沉淀溶于无菌水中,用naoh调节溶液ph为7,此为生物表面活性剂粗品溶液。使用等体积的氯仿/甲醇(2:1)萃取15min,萃取两次,合并萃取液,水浴旋转蒸干有机溶剂,将抽提后得到的油状物在真空干燥后即可得到生物表面活性剂(鼠李糖脂样品)。称量样品重量计算产量。
测试例1
对实施例1~3以及对比例1~3获得的鼠李糖脂进行含量测定。
采用半胱氨酸-硫酸分光光度法测定发酵液中鼠李糖脂含量,鼠李糖脂含量按鼠李糖含量3倍计。具体步骤如下:将试样调至中性,适当稀释。移取样品于试管中,放置在冰浴里,加入硫酸溶液,在冰浴中振荡,冷却5min。沸水浴振荡10min后取出,冷却。加入半胱胺酸的盐酸溶液,振荡。测量前放置2h显色,400nm处测定吸光度,对照鼠李糖标准曲线计算鼠李糖、以及鼠李糖脂的含量x。
式中:x表示鼠李糖脂的含量(g/l);c表示采用比色法测得样品的吸光度;m2表示100ml提取液冻干后得到的鼠李糖脂的质量。
标准曲线绘制:准确称取鼠李糖标准品,配制不同浓度的标准溶液,线性范围为2-99mg/l,以纯水为参比,取1ml于试管中,放置在冰浴里,加入硫酸溶液,在冰浴中振荡,冷却5min。沸水浴振荡10min后取出,冷却。加入半胱胺酸的盐酸溶液,振荡。测量前放置2h显色,400nm处测定吸光度。标准曲线方程为y=0.0066x+0.0084r2=0.9829,请参见如图2。
计算实施例1~3和对比例1~3获得的发酵液中鼠李糖脂的产量及得率结果如表1所示。
表1不同发酵条件及后处理方式鼠李糖脂产量及得率对比
注:与实施例3相比,“**”差异极显著(p<0.01)。
由实施例1和对比例1比较可以看出,发酵优化后的菌株产鼠李糖脂能力比优化前高出5倍左右,虽然产量较低,但是由于采用了膜分离技术,得率较对比例2和3相比也有较大提高,高出15%左右;实施例3和对比例2和3比较可以看出,经过膜分离所得的产品比酸沉淀、溶剂萃取所得产品得率有显著性提高(p<0.001),且一定程度上节省了有机试剂,经济环保。由此证明,膜分级分离是实现鼠李糖脂与菌体、发酵残液分离的有效方法。
测试例2
对实施例1~3以及对比例1~3获得的鼠李糖脂处理原油,并且处理后的原油进行粘度测定。
选择不同发酵条件下的鼠李糖脂生物表面活性剂,将其配置成相同浓度的溶液(10g/l),以相同体积平稳加入到装有200ml原油的烧杯中,搅拌均匀,室温下静置30min,以brookfieldii+型粘度计测量添加前后混合物的黏度,测量结果如下表2所示。
表2不同发酵条件下生物表面活性剂降低原油黏度能力比较
注:“***”表示与空白对照组比较差异极显著(p<0.001)。
结果显示,上述3种发酵条件下所得的生物表面活性剂均有显著降低原油黏度的技术效果,并且与酸提取法和有机溶剂提取法得到的鼠李糖脂相比,具有相同的功效,表明本发明的膜分离法是一种有效的提取生物表面活性剂的方法。
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
- 还没有人留言评论。精彩留言会获得点赞!