一种能检测多种真菌基因组DNA的微阵列芯片及其制备方法与流程
本发明涉及生物
技术领域:
,尤其涉及一种能检测多种真菌基因组dna的微阵列芯片及其制备方法。
背景技术:
:真菌性感染是临床最常见和最严重的感染性疾病,如:中枢神经系统、呼吸系统、血液系统等真菌感染的病死率和致残率高,严重威胁患者的生命。随着分子生物技术的发展、核酸杂交以及芯片检测技术的广泛应用,可以采用基因芯片检测技术实现dna检测。基因芯片检测技术可将不同探针排列于固相载体上形成探针的微阵列,利用双链dna分子在一定条件下可以实现变性-复性的特点,探针与待测dna分子特异性结合,再通过后续的显色及检测过程对发生结合的探针进行识别。基因芯片检测通量高,在进行高通量多种基因联合检测方面具有优势,可以一次检测测定几种直至上百种不同基因。但这类检测技术一般需要昂贵的基因芯片以及专业的芯片配套设备,因此主要用于对真核细胞的基因组dna进行检测,如:用于肿瘤检测、遗传变异检测、优生优育检测等方面。芯片微阵列上的特异性探针包括寡核苷酸探针,寡核苷酸探针是根据数据库中特定基因序列的保守序列部分设计并由人工合成的。通常要在寡核苷酸的5'末端进行修饰,以使其与芯片上的修饰基团进行化学反应,从而实现在固相载体表面固定探针分子。但是,探针分子在与固相载体固定后,探针分子在与dna特异性结合时由于存在空间位阻效应,仍需要进一步提高探针与dna结合的能力,尤其是针对长链dna的结合。同时,现有芯片大部分为科研用途,仅适用于对少量芯片或者芯片样品进行操作,难以满足批量芯片生产或者芯片应用。公开于该
背景技术:
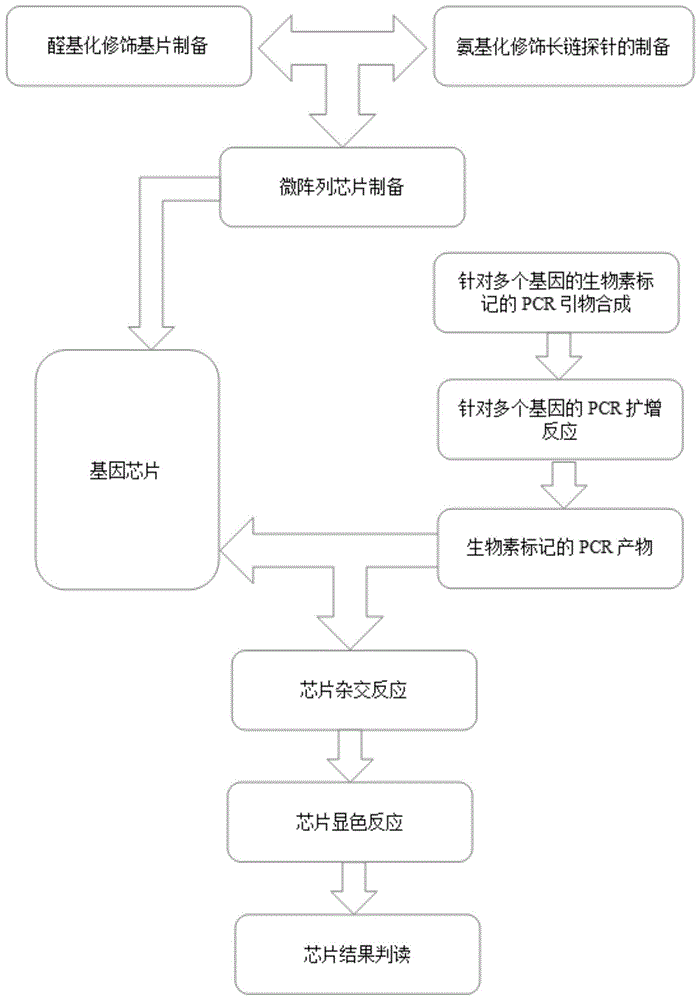
部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。技术实现要素:发明目的本发明的目的在于提供一种能检测多种真菌基因组dna的微阵列芯片及其制备方法,本发明的目的还在于提供一种使用该微阵列芯片的检测方法。相比于单独采用cn或polydt对探针进行修饰的方式,本发明实施例微阵列芯片中经过修饰的基因芯片探针通过采用cn和polydt共同修饰的方式,有效减少了探针与pcr产物在特异性结合时的空间位阻效应,2种修饰方式的结合起到了协同作用,可以很好地检测多种真菌的基因组dna。本发明实施例使用该微阵列芯片的检测方法,无需对样本进行体外培养,整体检测时间段、灵敏度高。解决方案为实现本发明目的,本发明实施例提供了以下技术方案:一种能检测多种真菌基因组dna的微阵列芯片,其包括:经过修饰的芯片固相载体;和,经过修饰的基因芯片探针,所述经过修饰的基因芯片探针以阵列的方式分布并通过共价键连接于经过修饰的芯片固相载体的修饰基团上,所述经过修饰的基因芯片探针按照5’-3’的方向包括以下结构:5’修饰基团-cn-(dt)m-寡核苷酸链3’,其中:所述寡核苷酸链表示基因芯片探针的核苷酸序列本体,(dt)m表示m个dt,所述cn表示具有n个碳原子的直链烷基,所述5’修饰基团能与芯片固相载体本体表面修饰的基团发生化学反应形成共价键连接,8≤m≤15,5≤n≤15;可选的,m=10,n=12;所述寡核苷酸链选自白色念珠菌、光滑念珠菌、近平滑念珠菌、曲霉菌、热带念珠菌和隐球菌中的两种或两种以上真菌的基因组dna特异性区域的核苷酸序列或其互补序列。在另一种可能的实现方式中,所述经过修饰的基因芯片探针有16种,这16种经过修饰的基因芯片探针中的寡核苷酸链分别为白色念珠菌、光滑念珠菌、近平滑念珠菌、曲霉菌、热带念珠菌和隐球菌的基因组dna特异性区域的核苷酸序列或其互补序列。在另一种可能的实现方式中,芯片固相载体本体为二氧化硅载玻片。在另一种可能的实现方式中,芯片固相载体本体的修饰为醛基化修饰,基因芯片探针上的修饰基团为氨基。在另一种可能的实现方式中,还包括以阵列的方式分布的阳性质控探针、阴性质控探针和真菌通用型探针。一种能检测多种真菌基因组dna的微阵列芯片的制备方法,其包括以下步骤:1)修饰芯片固相载体本体使其能与经过修饰的基因芯片探针的修饰基团发生化学反应形成共价键连接;2)合成经过修饰的基因芯片探针,所述经过修饰的基因芯片探针,按照5’-3’的方向包括以下结构:5’修饰基团-cn-(dt)m-寡核苷酸链3’,其中:所述寡核苷酸链表示基因芯片探针的核苷酸序列本体,(dt)m表示m个dt,所述cn表示具有n个碳原子的直链烷基,所述5’修饰基团能与芯片固相载体本体表面修饰的基团发生化学反应形成共价键连接,8≤m≤15,5≤n≤15;可选的,m=10,n=12;所述寡核苷酸链选自白色念珠菌、光滑念珠菌、近平滑念珠菌、曲霉菌、热带念珠菌和隐球菌中的两种或两种以上真菌的基因组dna特异性区域的核苷酸序列或其互补序列;3)配制检测探针点样液并将检测探针点样液涡旋震荡混匀后,于芯片点样仪上以阵列的方式向经过修饰的芯片固相载体进行点样。在另一种可能的实现方式中,所述经过修饰的基因芯片探针有6种,这6种经过修饰的基因芯片探针中的寡核苷酸链分别为白色念珠菌、光滑念珠菌、近平滑念珠菌、曲霉菌、热带念珠菌和隐球菌的特异性区域的核苷酸序列或其互补序列。在另一种可能的实现方式中,芯片固相载体本体为二氧化硅载玻片。在另一种可能的实现方式中,芯片固相载体本体的修饰为醛基化修饰,基因芯片探针上的修饰基团为氨基。在另一种可能的实现方式中,还包括以下步骤:配制阳性质控探针、阴性质控探针、和真菌通用型探针的点样液,于芯片点样仪上以阵列的方式向经过修饰的芯片固相载体进行点样。在另一种可能的实现方式中,在修饰芯片固相载体本体前,包括对芯片固相载体本体进行清洗和/或酸碱处理的步骤,在进行清洗和/或酸碱处理时使用了载玻片夹具,所述载玻片夹具包括:第一载玻片固定托座,其上下表面之间开设有螺纹通孔,并且其上下表面之间开设有载玻片固定通口;第二载玻片固定托座,其上表面开设有与载玻片固定通口位置相对应的载玻片固定槽;和,连接杆,所述连接杆的一端固定连接于第二载玻片固定托座的上表面使连接杆与第二载玻片固定托座相垂直,所述连接杆外表面设置有与螺纹通孔的螺纹相匹配的螺纹,连接杆的另一端穿过螺纹通孔将第一、第二载玻片固定托座固定连接;所述载玻片夹具的材质为耐酸、耐碱的材质。在另一种可能的实现方式中,所述检测探针点样液含0.1-1.0%聚乙烯醇、0.1-10mm经过修饰的基因芯片探针、其余为pbs缓冲液。一种使用微阵列芯片的检测方法,其包括以下步骤:1)样本中真菌基因组dna的提取:处理样本获得真菌沉淀浓缩物;加入溶菌酶、溶壁酶和玻璃珠,破坏真菌的细胞壁成分,然后使蛋白变性降解以充分释放真菌的基因组dna,分离真菌基因组dna;2)带有生物素标记的pcr引物制备,所述带有生物素标记的pcr引物根据步骤1)中的真菌基因组dna特异性区域进行设计;3)带有生物素标记的pcr产物制备:以步骤1)中的真菌基因组dna为模板,以步骤2中的引物为引物进行pcr反应;4)带有生物素标记的pcr产物与权利要求1所述的微阵列芯片或权利要求2所述的制备方法制备的微阵列芯片进行杂交;5)对微阵列芯片上的杂交产物进行显色;6)对显色结果进行检测;所述生物素标记的pcr引物与基因芯片探针中的寡核酸链的碱基互补。在另一种可能的实现方式中,所述带有生物素标记的pcr引物为真菌18s-28s保守区通用型pcr引物。在另一种可能的实现方式中,真菌18s-28s保守区通用型pcr引物中普通的上游引物:atcaataagfggaggaaag;生物素标记的下游引物本体:ctctggcttcaccctattc。在另一种可能的实现方式中,带有生物素标记的pcr引物进行pcr反应以获得带有生物素标记的pcr产物时的模板为白色念珠菌、光滑念珠菌、近平滑念珠菌、曲霉菌、热带念珠菌或隐球菌的基因组dna。在另一种可能的实现方式中,所述样本为未经过体外培养的样本,所述样本包括血液,泪液,脑脊液,胸腔积水,腹腔积水,肺泡灌洗液,尿液,鼻咽拭子,脓液,脓液或精液。有益效果(1)相比于单独采用cn或polydt对探针进行修饰的方式,本发明实施例微阵列芯片中经过修饰的基因芯片探针通过采用cn和polydt共同修饰的方式,有效减少了探针与pcr产物在特异性结合时的空间位阻效应,2种修饰方式的结合起到了协同作用,可以很好地检测6种真菌的基因组dna。(2)本发明实施例微阵列芯片中经过修饰的基因芯片探针既适用于短链pcr产物,也适用于长链pcr产物。当然,由于长链pcr产物与探针进行特异性结合时存在更大的空间位阻,采用一般的修饰方式时,探针与长链pcr产物的结合不理想,而本发明实施例经过cn和polydt共同修饰的基因芯片探针则十分适用于长链pcr产物,这样检测人员就可以实现对同一pcr产物的更多位点进行检测,即只进行一次pcr获得长链pcr产物,就可以对多个位点进行检测;而无需进行多次pcr获得多个短链pcr产物,才能对多个位点进行检测。(3)本发明实施例微阵列芯片中采用普通的载玻片以及常规化学试剂为材料,经过加工,所制备的芯片成本远低于市售价格,并且片间性能差异较小。(4)本发明实施例微阵列芯片中经过修饰的基因芯片探针上的修饰基团氨基与芯片固相载体本体上的醛基形成共价键,反应简单容易,可以使探针更紧密的与玻片表面结合,并且为探针的结合以及后续的杂交反应提供了较大的空间,适合于分子量较大的长链pcr产物的检测。(5)本发明实施例微阵列芯片的制备方法中,可以实现同时对多个玻片进行表面处理,因为本发明实施例中提出了一种对载玻片进行批量浸泡处理的载玻片浸泡用夹具,本夹具采用2个载玻片固定托座固定载玻片两端而不是一端的方法,有利于克服多个载玻片不稳定的问题,解决了多个载玻片固定的问题。(6)本发明实施例微阵列芯片的制备方法中,采用0.5-1%pva作为芯片点样液,从而在玻片表面形成了网状结构,从而增大了探针和待测dna的杂交空间。(7)本发明通过对各种原材料以及对众多工艺过程进行筛选比较,并进行了优化,最终建立了一整套采用普通玻片为起始材料,通过一系列技术处理,制备成针对多基因位点的低密度基因芯片,并建立了芯片杂交,显色以及结果识别的完整方法及工艺。本发明的优点在于可以对芯片的点样以及检测过程进行有效质量控制。本方法设计合成并设计了芯片阳性质控系统,从而对芯片点样过程,以及芯片检测过程进行质量控制。并确定了芯片阳性质控系统的点样探针的工作模式。本发明的优点在于检测结果稳定,芯片以及检测设备成本较低。本方法使用生物素-亲和素-碱性磷酸酶-tcib/nbt的显色系统,该系统显色信号稳定,信号值不会发生衰减降低,芯片检测结果可反复重现,不需要使用成本较高的荧光法的芯片检测设备,而仅需要可识别可见光普通芯片阅读仪即可识别,实验室使用成本更低。(8)本发明实施例使用该微阵列芯片的检测方法,直接从临床样本中提取真菌基因组dna,并进行芯片检测,无需对样本进行体外培养,从而整体检测时间短、能快速检测体内异常的真菌感染,并且其检查结果也不取决于标本培养的成功与否,准确性好、灵敏度高。同时该方法中破坏真菌细胞壁时不仅加入了溶壁酶,还加入了溶菌酶,溶菌酶的加入不会影响真菌细胞壁的破坏效果,同时还使该方法能适用于细菌,从而方便检测人员并且降低出错概率。附图说明一个或多个实施例通过与之对应的附图中的图片进行示例性说明,这些示例性说明并不构成对实施例的限定。在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。图1是本发明实施例1-2的试验流程图。图2是本发明实施例1-2中载玻片夹具的结构示意图。图3是本发明实施例1-2中阳性质控系统形成的杂交体的示意图。图4是本发明实施例1-2中pcr引物及探针所需满足的相对位置结构示意图。图5-1至图5-6是本发明实施例2中分别检测6种真菌标准样品的结果照片。具体实施方式为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。另外,为了更好的说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在一些实施例中,对于本领域技术人员熟知的原料、元件、方法、手段等未作详细描述,以便于凸显本发明的主旨。除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。基因芯片:以同时检测多个基因片段为目的的固相检测技术,一般将大量探针分子固定于支持物上(硅片,玻片,尼龙膜等),并形成探针的分子点阵,探针与带荧光标记或者带生物素标记的dna分子进行杂交后再进行显色反应,通过检测每个探针分子杂交后的显色信号强度进而获取样本中包含的基因片段信息。载玻片:一种广泛使用的以二氧化硅为成分的玻璃制品。载玻片表面修饰:载玻片表面一般为sio2分子,本身没有生物活性。使用一系列实验室化学试剂处理,可以使载玻片表面携带特定化学反应基团,如羧基(-cooh)、氨基(-nh3)、醛基(-cho)等,这些修饰后的化学反应基团,可以参与后续的与探针的分子结合中。载玻片表面的醛基化修饰:通过使用一系列化学试剂对载玻片表面进行处理,在载玻片表面形成醛基基团,醛基基团并不一定必须直接与载玻片连接,中间可以有其他接枝,只要其远离载玻片的末端为醛基即可。醛基基团可以与探针上的氨基进行化学反应,形成共价键,从而实现在载玻片表面捕获固定探针分子的作用。微阵列:在核酸杂交的基础上发展起来的一项技术,通过在固相介质(玻片,硅片,尼龙膜等)表面将大量的已知基因探针,按照一定排列固定在载玻片表面,通过检测相应位置的杂交探针,实现基因信息的快速检测。dna探针:为长度在几十到上百碱基的单链或双链dna,在适当的ph值、温度和离子强度下,dna探针通过分子的变性、复性以及碱基互补配对,能与待测样本中的互补单链dna或rna以氢键结合,形成双链复合体。将未配对结合的物质洗去后,可用显色检测系统检测杂交反应结果。pcr:其是指聚合酶链反应,一种基因组dna的快速扩增富集技术,通过使用一对特异性的寡核苷酸片段,扩增反应用酶及体系,可以将一个dna分子快速放大,从而满足后续的基因组dna的检测需要。杂交:根据碱基互补配对原理,在一定条件下,固定在芯片表面的寡核苷酸dna探针与杂交液中的pcr产物链的序列进行特异性碱基配对结合。空间位阻:生物大分子的相互作用均需要一定的反应空间,当分子较大,以及反应空间较小时,生物分子的相互作用即受到抑制,表现为反应速率降低,反应时间延长,反应产物降低。碱性磷酸酶催化的斑点法显色反应:本发明中,碱性磷酸酶-链霉亲和素与带有生物素的pcr产物结合,进行显色反应。临床样本:本发明中是指医疗机构按照国家相关法规及操作规范要求,从患者体内或体表采集的少量标本,用于检测是否含有特定的致病性物质。临床检验用标本包括血液,尿液,粪便,鼻咽拭子,肺泡灌洗液,胸腔腹腔积水等。细菌、真菌:本发明中的含义具有其通常的含义。在本领域中,尤其会关注正常自然环境和人体中存在的微生物在某些特定的诱发条件下,如手术、使用呼吸机插管、人群间传播等情况下会导致特定的细菌、真菌感染。细菌基因组dna、真菌基因组dna:本发明中的含义具有其通常的含义。基因组dna是细胞的组成成分,是病原体感染的标志物,一般作为临床细菌、真菌感染基因检测的靶物质。核酸提取:本发明中的含义具有其通常的含义。尤其是指将细菌或者真菌的基因组dna从细菌细胞、真菌细胞中分离出来,所获得的基因组dna具有一定纯度和含量,以满足后续的检测试验的需要。pcr:本发明中的含义具有其通常的含义,即是指聚合酶链反应,一种基因组dna的快速扩增富集技术,通过使用一对特异性的寡核苷酸片段,扩增反应用酶及体系,可以将一个dna分子快速放大,从而满足后续的基因组dna的检测需要。磁珠:本发明中是指一种表面携带有硅羟基或者羧基基团的磁性微球,其在具有磁吸性质的同时可以选择性结合和释放dna物质。实施例11.醛基化修饰微阵列芯片载体的制备在本实施例中使用市售的常规二氧化硅载玻片作为微阵列芯片的芯片固相载体本体,其为普通的显微镜镜检用载玻片。该载玻片经过:清洗,酸碱处理,表面硅烷化处理,醛基化处理,清洗,形成表面带有醛基基团的微阵列芯片载体。具体制备过程如下:将普通载玻片(76mm×25mm×1.2mm)用去离子水清洗3遍晾干,去除吸附在载玻片表面的水溶性杂质。将载玻片浸入铬酸洗液浸泡过夜,取出后用去离子水冲洗干净,晾干,进一步去除载玻片表面的有机物等杂质。将载玻片浸入10mnaoh中浸泡过夜,取出后用去离子水冲洗干净,晾干。将载玻片浸入含有5%3-氨丙基三乙氧基硅烷(apes,硅烷化剂)的乙醇溶液中30-120分钟,取出后用去离子水冲洗干净,晾干。将载玻片浸入5%戊二醛的pbs溶液(ph7.4)中60分钟,取出用pbs溶液清洗并晾干。将制备的载玻片于2-8℃真空避光保存,即为醛基化修饰的微阵列芯片。载玻片浸泡时,应避免载玻片相互黏连,可以将载玻片放置于专用的载玻片夹具中,载玻片的夹具应耐酸,耐碱。在本发明实施例的上述步骤中,使用的是特氟龙材料制备的专用载玻片夹具。如图2所示,本发明实施例使用的载玻片夹具包括:第一载玻片固定托座1,其上下表面之间开设有螺纹通孔11,并且其上下表面之间开设有载玻片固定通口12;第二载玻片固定托座2,其上表面开设有与载玻片固定通口12位置相对应的载玻片固定槽21;和,连接杆3,所述连接杆3的一端固定连接于第二载玻片固定托座2的上表面使连接杆3与第二载玻片固定托座2相垂直,所述连接杆3外表面设置有与螺纹通孔11的螺纹相匹配的螺纹,连接杆3的另一端穿过螺纹通孔11将第一、第二载玻片固定托座固定连接;所述载玻片夹具的材质为耐酸、耐碱的材质。在本发明实施例的载玻片夹具中,第一载玻片固定托座1通过转动可以在连接杆3上下旋动以调节第一、第二载玻片固定托座的间距,从而使多组玻片能够被稳固的固定;并且还能调节载玻片固定通孔的相对位置。通过设计第一、第二载玻片固定托座的大小以及载玻片固定通口的数量,可以一次对大量的载玻片进行批量浸泡。在上述实施例中,可选地,所述耐酸、耐碱的材质为特氟龙材质。在本发明实施例的载玻片夹具中,选用的特氟龙材质为耐酸、耐碱材质中最常被使用到的材质。在上述实施例中,可选地,第二载玻片固定托座2的下表面设置有支撑部4。在本发明实施例的载玻片夹具中,支撑部的设置4使得第二载玻片固定托座2与桌面保持一定距离,防止载玻片被桌面上的物品污染。2.氨基化修饰长链探针的设计与合成本发明实施例中所使用的探针修饰方式具有更好的杂交效果,探针采用5'氨基-c12-dt(n=10)–探针寡核苷酸链-3’的方式进行修饰,修饰的氨基通过一个具有10个dttp(三磷酸胸腺嘧啶脱氧核苷酸)的长链和12个碳原子的长链(直链烷基)与探针核苷酸序列本体进行桥联,从而形成一个长链探针,以消除杂交时存在的空间位阻效应。长链探针由于具有较长的臂能与载玻片表面固定连接,对于克服长链pcr产物的杂交以及酶促显色时产生的空间位阻有一定的优势,信号值明显提高。基因芯片探针中的寡核酸链部分,要求与待杂交的带有生物素标记的pcr产物链碱基互补,长度一般为15-30核苷酸左右,退火温度为40-60℃之间,且应该属于基因序列的保守区域,合成的探针应为page纯或者hplc纯。探针的合成可以按照上述设计,委托探针合成公司根据现有技术进行合成。在上述实施例中,将氨基修饰的基因芯片探针设计为正链dna或者负链dna均可以实现基因芯片的检测功能。3.微阵列芯片的制备以反向杂交为例说明微阵列芯片的制备:配制检测探针点样液并将检测探针点样液涡旋震荡混匀后,于芯片点样仪上以阵列的方式向经过修饰的芯片固相载体进行点样,所述检测探针点样液含0.5-1.0%(g/v)聚乙烯醇(pva)、5mm上述经过修饰的基因芯片探针、其余为pbs缓冲液。点样结束后,将载玻片放置于饱和kci溶液中,室温密封过夜固定,使检测探针与载玻片充分结合,可以将固定后的载玻片真空封口,能于2-8℃避光保存6-12个月。每个芯片上除了上述待检的探针点样位置,还应分别设置阳性质控探针点样位置和阴性质控样品点样位置,形成一个低密度芯片的微阵列。芯片的一个微阵列杂交区域为(5-8)×(5-8)mm2,其中待检探针每个探针占用3个位点,即相当于设置3个平行。芯片的微阵列杂交区域,并不局限于(5-8)×(5-8)mm2,而是可以根据所检测的基因数量或者目标物数量的具体需要而设计。4.芯片的阳性质控系统和阴性质控:阳性质控系统由芯片阳性质控的点样探针以及生物素修饰的dna模板组成,其中dna模板的寡核苷酸链序列应与探针的寡核苷酸链序列为碱基互补配对,且探针的寡核苷酸链序列与待检测的基因不发生非特异性结合,例如人临床样本检验用的芯片,可以使用来自植物基因组的保守序列或者使用随机设计的寡核苷酸序列。本发明实施例中选用的阳性质控的点样探针序列和dna模板的序列如下:其中,阳性质控的点样探针为:5’nh3-ttttttttttccacatcaggttatgccttgc,其中,阳性质控对应的dna模板序列为:5’biotin-gcaaggcataacctgatgtgg,dna模板采用生物素修饰,寡核苷酸序列与探针碱基序列互补。阳性质控的点样探针序列和dna模板序列都要经过修饰,但由于本发明实施例中选用的阳性质控的点样探针序列和dna模板的结合能力强,信号值强,因此无需像检测待测样品的探针那样进行修饰,桥联部分相对短也可以,具体修饰的方式为:5'氨基-dt(n=10)-探针寡核苷酸链-3’,通过5’氨基基团使探针与芯片表面的醛基基团结合。阳性质控的dna模板结构为:5'生物素-寡核苷酸链。在芯片杂交反应时,则形成载玻片-寡核苷酸双链-生物素的杂交体,可以进行后续显色反应。阳性质控系统形成的杂交体的示意图如图3所示。本方法所述的芯片的阳性质控系统的结构及组成,不仅仅适用于酶促显色的生物芯片,同样适用于采用荧光信号检测技术的生物芯片。本方法所述的阴性质控品,为采用不含探针的无核酸酶水,或者0.1%bsa,配制成点样缓冲液。5.不同类型的临床样本中真菌基因组dna的提取1)处理临床样本获得真菌沉淀浓缩物通过对不同临床样本进行处理,以实现真菌与体细胞、体液组分的有效分离,从而使菌体浓缩以提高真菌的单位有效浓度。以下给出针对不同特点的临床样本的处理方法:对于全血标本,由于标本中含有大量红细胞,红细胞裂解后释放的血红素对后续dna分析存在一定的抑制,因此对于全血标本,本发明的操作为:取500μl抗凝血,加入450μl红细胞裂解液(红细胞裂解液的组成为:0.15mnh4cl,10mmkhco3,0.1mmedta,水,ph7.2-8.0)颠倒混匀后静置5分钟以裂解红细胞,再以12000rpm离心5分钟,吸取抛弃上清,沉淀物中含有真菌沉淀浓缩物。对于无细胞的体液标本或者仅有少量细胞的体液标本,如:脑脊液,肺泡灌洗液,胸腹腔积水等,本发明的操作为:取500μl标本12000rpm离心5分钟,吸取抛弃上清,使标本中存在的真菌沉淀浓缩,获得真菌沉淀浓缩物。对于真菌含量较低的标本,如尿液,本发明的操作为:取1-5ml尿液,12000rpm离心5分钟,吸取抛弃上清,使标本中存在的真菌沉淀浓缩,获得真菌沉淀浓缩物。本步骤对不同临床样本进行不同的处理,并且最后通过离心法将真菌以沉淀物的形式进行浓缩,提高基因组dna的回收率;同时去除大部分与真菌无关的人体液体成分以降低来自人体的组分对后续可能产生的干扰作用。2)裂解真菌以释放基因组dna采用酶降解和机械破碎相结合的方法,破碎真菌的细胞壁,释放真菌的基因组dna。具体操作为:在步骤1获得的真菌沉淀浓缩物中,加入200μl溶菌酶(200mg/ml),10μl溶壁酶(10u/μl)以及100mg玻璃珠(直径分布为0.1-3mm),37℃旋涡震荡30分钟,破坏真菌的细胞壁成分。在被破坏了真菌细胞壁成分的上述标本中,加入200μl含0.1-5.0%sds的te缓冲液、1.0-10mg蛋白酶k,充分混匀,56℃孵育10分钟,以使蛋白组分变性及降解,充分释放真菌的基因组dna,获得混合液。本步骤中采用了溶壁酶,对真菌的细胞壁进行有效地分解破坏,并且还加入玻璃珠,提高了真菌的细胞壁破坏效率,提高了真菌的基因组dna回收率。另外,所加入的用于裂解细菌细胞壁的溶菌酶不会影响真菌基因组dna的提取,所加入的用于裂解真菌细胞壁的溶壁酶不会影响细菌基因组dna的提取,采用该试剂的目的是,当化验人员需要对临床样本中的菌株进行基因组dna提取时,无需区分其是细菌还是真菌,都可以采用本发明基因组dna提取方法,即该方法既方便了化验人员,也降低了其出错的可能性。另外,加入变性剂以及蛋白酶k不仅促进真菌细胞膜的破坏,而且促进真菌细胞中的大部分蛋白质成分变性及降解为小分子量的可溶性物质,从而使蛋白质与基因组dna分离,并释放出基因组dna。3)从混合液中分离真菌的基因组dna的步骤,可以采用常规的步骤,如使用硅胶膜柱、磁珠对真菌基因组dna进行分离,以下采用磁珠的方法进行说明。a.真菌基因组dna结合至磁珠在经过步骤2处理后的标本中,加入600μl结合液(结合液中含1.0-5.0m高氯酸钠,0.1-4.0m乙酸钠和水)和10mg硅羟基磁珠(直径分布为50-500nm),混合均匀使dna与硅羟基磁珠表面的硅羟基结合,从而使dna与磁珠结合。将装有磁珠的标本试剂管放置于强磁力装置上(如磁力架,磁棒,全自动核酸提取仪)1-5分钟,使磁珠聚集至标本液体透明无色时,小心去除磁珠以外的液体部分。本步骤中向标本中加入带有低ph值、高盐的溶液(即结合液)使真菌细胞中的蛋白质、膜类物质进一步裂解,也使基因组dna更容易从溶液状态被析出并容易和磁珠中的硅羟基基团相结合。其他成分如:蛋白质降解物,无机盐等不会和磁珠结合,仍然存在于溶液状态中。而通过使用磁力装置如磁力架等,利用磁性将磁珠吸附在一起,而含有大部分杂质的非dna成分则在溶液状态下,可以很容易的被吸弃。b.洗涤磁珠,去除无机杂质与有机杂质使用400-600μl洗液a(含0.1-5.0m高氯酸钠,0.1-4.0m乙酸钠,以及60-80%乙醇),将液体与磁珠充分混合均匀,将装有磁珠的试剂管放置于强磁力装置上(如磁力架,磁棒,全自动核酸提取仪)1-5分钟,使磁珠聚集,小心去除磁珠以外的液体部分。使用400-600μl洗液b(含60-80%乙醇),将液体与磁珠充分混合均匀,将装有磁珠的试剂管放置于强磁力装置上(如磁力架,磁棒,全自动核酸提取仪),使磁珠聚集,小心去除磁珠以外的液体部分。使用洗液b重复操作一次。通过以上洗涤过程,标本中的残留蛋白杂质及降解产物,干扰性盐离子,可溶性抑制物质,均可以有效去除。本发明采用两种不同的洗液,先后对结合有dna的磁珠进行洗涤,以除去非特异粘附在磁珠表面的变性蛋白降解物,盐离子,以及会对dna检测存在干扰作用的物质如药物,胆红素等,进一步提高dna-磁珠的纯度。c.真菌基因组dna的洗脱在上述洗涤过的磁珠中,加入适量(30-100ul)无核酸酶水(ph6.5-8.5),浸泡磁珠1-5分钟,使基因组dna从磁珠上释放洗脱。洗脱物即含有高纯度的真菌基因组dna,可用于后续的核酸分析。6.带有生物素标记的pcr引物以及pcr产物制备针对真菌基因组dna靶片段的pcr扩增,既可以扩增及检测每种真菌特有的基因片段,也可以针对真菌特有的18s-28s保守区进行扩增识别。真菌18s-28s保守区是在所有真菌基因组中具有高度保守性,同时不同种类的真菌又存在着特异性的区域。因此通过检测真菌18s-28s保守区是对真菌进行分类鉴定的一种常见的方法。本发明即采用针对真菌18s-28s保守区的通用引物对不同真菌的基因组dna进行扩增,获得6种真菌的18s-28spcr产物,pcr产物大小为1000bp左右。本发明在真菌通用引物的下游引物5-末端碱基位置添加了生物素分子修饰。经过生物素修饰的pcr引物,通过后续的pcr扩增反应,形成了带有生物素修饰的pcr产物,并作为芯片杂交的检测靶物质参与后续的芯片杂交反应。pcr引物的生物素标记:本方法对6种真菌均采用了真菌的18s-28s通用型pcr引物(普通的上游引物:atcaataagfggaggaaag;生物素标记的下游引物本体:ctctggcttcaccctattc),pcr产物长度为1000bp左右。其中在下游引物的5'末端,采用生物素标记。引物的合成及标记可以由大多数商业合成公司完成,要求为page或者hplc纯化。将生物素标记的pcr引物与配对的另一侧pcr引物配制成常规pcr反应体系,pcr扩增条件为:预变性,95℃,5分钟;pcr循环,变性95℃30秒,退火50-60℃30秒,延伸72℃10-120秒,共30-35个循环;pcr循环结束后,延伸72℃5分钟。推荐的pcr扩增条件为:预变性95℃5分钟;pcr循环:变性95℃10秒,退火55℃15-30秒,延伸72℃10-120秒,共30-35个循环;pcr循环结束后,延伸72℃5分钟。对临床样本中提取的dna产物进行pcr扩增,所制备的pcr产物带有生物素标记。7.pcr产物与微阵列芯片的杂交反应不同的真菌基因组dna模板通过同一组pcr引物及反应条件,会形成各自不同的pcr产物,其长度在1000bp左右,其中含有6种真菌特有的保守序列,其保守区序列可以和芯片反应区域不同对应的探针特异性结合。取出芯片后,室温平衡5-10分钟,去除载玻片表面残留的水汽后进行芯片的杂交。芯片的杂交过程可使用商品化的玻片专用的杂交围栏作为杂交池进行杂交反应,也可以使用商品化的全自动化的芯片杂交仪进行,也可以使用常规实验室设备(载玻片离心机,恒温振荡器)进行杂交操作。以下提供了芯片杂交反应需要涉及的试剂与反应条件:将100微升预杂交液(含有50mm乙醇胺的tbst缓冲液)滴加到载玻片的微阵列杂交区域,浸泡10分钟;芯片杂交:将100微升步骤5所得pcr产物与杂交液(含有25%甲酰胺的2-5×ssc缓冲液)充分混合,混合液滴加于芯片表面的杂交区域上,55℃杂交60分钟,杂交时间长短取决于pcr产物的长度,pcr产物的片段越长,需要的时间越长。芯片清洗:使用80-500微升磷酸缓冲液对对芯片杂交区域进行清洗2-3次以对芯片表面进行清洗。8.碱性磷酸酶催化的斑点法显色反应在芯片的杂交反应区域,加入100μl碱性磷酸酶标记的链霉亲和素(1:1000体积稀释),37℃孵育15分钟,再加入200微升磷酸缓冲液清洗1-3次去除未结合的酶。加入100μl含0.03%bcip/0.015%nbt,2%dmf的显色液,37℃孵育5-30分钟,酶与显色液反应,在结合位置形成一种不溶于水的深紫色沉淀物。碱性磷酸酶-链霉亲和素与带有生物素的pcr产物结合,进行显色反应。加入200μl磷酸缓冲液清洗1-2次,终止显色反应。本方法所述的pcr产物与芯片的杂交及显色反应,并非唯一的杂交及显色方式,采用其他的杂交及显色系统如使用不同的化学试剂以及对用量进行优化,均可实现基因芯片的检测目的。9.检测结果的识别方法使用具有识别紫色斑点的全自动或者半自动化的芯片阅读装置,即可对反应结果进行判读。本方法所述的检测结果的识别方法,并不指定特定厂家的检测设备,具有一定的实验室常规设备如保温设备,混匀设备,放大镜,相机等即可实施。使用全自动化的设备可以更高效的完成芯片结果的判断。实施例26种病原菌芯片的检测结果示例1.采用实施例1中的具体方式完成醛基化修饰微阵列芯片载体的制备。2.氨基化修饰长链探针的设计与合成。在本实施例检测了6种常见病原菌,这6种病原菌是基于对历年不同临床真菌发病率情况进行总结归纳得出的,与其他发明或方法所检测的真菌总数量以及种类,可能存在着一定的交叉,但不完全重合。所检测的6种常见病原菌及临床可能的关联症状,以及针对6种真菌均采用本方法中的c12-dt(n=10)的长链探针,未经修饰的dna探针序列本体如下所示。3.微阵列芯片的制备配制检测探针点样液并将检测探针点样液涡旋震荡混匀后,于芯片点样仪上以阵列的方式向经过修饰的芯片固相载体进行点样,所述检测探针点样液含0.5%(g/v)聚乙烯醇(pva)、5mm上述经过修饰的基因芯片探针、其余为pbs缓冲液。点样结束后,将载玻片放置于饱和kci溶液中,室温密封过夜固定,使检测探针与载玻片充分结合,可以将固定后的载玻片真空封口,能于2-8℃避光保存6-12个月。每个芯片上除了上述待检的探针点样位置,还应分别设置阳性质控探针点样位置和阴性质控样品点样位置,形成一个低密度芯片的微阵列,以表1中的示例进行解释说明。芯片的一个微阵列杂交区域为(5-8)×(5-8)mm2,其中待检探针每个探针占用3个位点,即相当于设置3个平行。表16种真菌dna芯片的探针微阵列点样布局:123456789ap1p1p1①①①②②②bp1p1p1③③③④④④cp1p1p1⑤⑤⑤⑥⑥⑥dp1p1p1nnnp2p2p2其中不同编号对应的项目:其中:p1为芯片阳性质控探针位点;p2为真菌通用探针位点(序列为atgggtggtaattccatctaagc);n为阴性质控探针位点;1-6分别为上表所列真菌种类的dna探针。4.芯片的质控系统:除了实施例1中的阳性质控和阴性质控,本实施例中还设置了真菌通用探针。1)阳性质控的点样探针为:5’nh3-ttttttttttccacatcaggttatgccttgc,其中,阳性质控对应的dna模板序列为:5’biotin-gcaaggcataacctgatgtgg,dna模板采用生物素修饰,寡核苷酸序列与探针碱基序列互补。2)阴性质控品,为采用不含探针的无核酸酶水,或者0.1%bsa,配制成点样缓冲液。3)真菌通用型:本方法采用真菌18s-28s基因通用探针,对所检测的真菌进行初步分类。探针位点位于真菌18s-28s基因保守区,可作为所有真菌的特异性探针。其中真菌通用型位点p2的探针及修饰方式如下:5-nh3-c12-tttttttttt-atgggtggtaattccatctaagc。5.不同类型的样本中真菌基因组dna的提取病原菌来源检测浓度白色念珠菌脑脊液1.90×104光滑念珠菌尿液1.10×104近平滑念珠菌脑脊液1.02×104曲霉菌肺泡灌洗液1.86×104热带念珠菌血液1.70×104新生隐球菌肺泡灌洗液2.70×104按照样本来源根据实施例1中的内容对样本进行处理,获得相应真菌的dna基因组。6.带有生物素标记的pcr引物以及pcr产物制备按照实施例1步骤6中所述条件进行制备。7.pcr产物与微阵列芯片的杂交反应按照实施例1步骤7中所述条件进行制备。8.碱性磷酸酶催化的斑点法显色反应按照实施例1步骤8中所述条件进行制备。9.检测结果的识别方法将芯片水平放入芯片识读仪(型号:bd-2.0,厂家:上海百傲科技股份有限公司)芯片槽内,条码一面朝上,运行芯片扫描程序,对芯片各位点的结果进行扫描,信号值分别如下。1)白色念珠菌193197189185179174000205199189000000203195184000000175183178000187197195如上表所示,所有的阳性质控探针位点、真菌通用探针位点以及白色念珠菌特异性探针位点显示信号值,其他位点不显示信号值,与实际情况相符。2)光滑念珠菌207209181000211213201192195181000000186188199000000197212193000209203204如上表所示,所有的阳性质控探针位点、真菌通用探针位点以及光滑念珠菌特异性探针位点显示信号值,其他位点不显示信号值,与实际情况相符。3.近平滑念珠菌187210210000000197182200209191216000201188183000000187199193000203209193如上表所示,所有的阳性质控探针位点、真菌通用探针位点以及近平滑念珠菌特异性探针位点显示信号值,其他位点不显示信号值,与实际情况相符。4.曲霉菌191183188000000183191182000182202188216201216000000206215219000211205219如上表所示,所有的阳性质控探针位点、真菌通用探针位点以及曲霉菌特异性探针位点显示信号值,其他位点不显示信号值,与实际情况相符。5.热带念珠菌184190188000000188186191000000189194190182185185000196193197000189192187如上表所示,所有的阳性质控探针位点、真菌通用探针位点以及热带念珠菌特异性探针位点显示信号值,其他位点不显示信号值,与实际情况相符。6.隐球菌215204173000000208215199000000203206217000200201188216215207000198217221如上表所示,所有的阳性质控探针位点、真菌通用探针位点以及隐球菌特异性探针位点显示信号值,其他位点不显示信号值,与实际情况相符。实施例3在醛基化的二氧化硅载玻片上,采用4×9微阵列形式按照实施例1中的方法制备真菌芯片,将白色念珠菌探针、芯片阳性内控探针、真菌通用探针,点样于对应的微阵列位置上。白色念珠菌探针分别采用3种形式,i为常规的5’氨基-dt(n=10)-寡核苷酸链探针,ii为5’氨基-c12-寡核苷酸链探针,iii为本发明设计的5’氨基-c12-dt(n=10)修饰的白色念珠菌特异性探针。具体为白色念珠菌特异性探针:i:5-nh3-dt(n=10)-gcatgctgctctctcggg;ii:5-nh3-c12-gcatgctgctctctcggg;iii:5-nh3-c12-dt(n=10)-gcatgctgctctctcggg。分别将三种不同的探针点样及固定,加入经生物素标记的白色念珠菌长片段pcr扩增产物(1500bp,该产物pcr扩增时使用的是普通上游引物atcaataagfggaggaaag和生物素标记的下游引物本体ctctggcttcaccctattc,在常规pcr体系中进行)进行芯片杂交,按照实施例1中的方式进行碱性磷酸酶促反应显色后,将芯片水平放入芯片识读仪(型号:bd-2.0,厂家:上海百傲科技股份有限公司)芯片槽内,条码一面朝上,运行芯片扫描程序,对芯片各位点的结果进行扫描,对2种探针产生信号值进行测试比较。在芯片阳性内控探针、真菌通用探针的结果均相符的情况下,采用5’氨基-dt(n=10)-寡核苷酸链探针(i)的白色念珠菌芯片检测结果,其中白色念珠菌特异性探针的信号值分别为87,85,72。采用5’氨基-c12-寡核苷酸链探针(ii)的白色念珠菌芯片检测结果,其中白色念珠菌特异性探针的信号值分别为49,54,51。采用5’氨基-c12-dt(n=10)-寡核苷酸链探针(iii)的白色念珠菌芯片检测结果,其中白色念珠菌特异性探针的信号值分别为187,197,195,信号值比探针i和ii的检测结果高1-2倍。因此本发明所采用的探针修饰方法对于长链pcr产物的芯片杂交信号要优于常规的探针修饰方式。最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1