一种噻嗪荧光衍生物的制备方法及其应用与流程
本发明属于抗肿瘤药物技术领域,涉及一种噻嗪荧光衍生物的制备方法及其应用。
背景技术:
噻嗪类药物已被广泛应用于医药领域,主要用于精神药理学领域,为抗精神病药物,治疗效果良好。噻嗪类药物具有硫氮杂蒽母核结构,按侧链结构不同,又可分为三类:①脂肪族(例如氯丙嗪);②哌啶类(如甲硫达嗪);③哌嗪类(如奋乃静、氟奋乃静、三氟拉嗪)。其中氯丙嗪、奋乃静及癸氟奋乃静是国家基本药物。这些化合物能够有效抑制多巴胺、组胺、血清素、乙酰胆碱和α-肾上腺素能受体。
线粒体是真核细胞中重要的细胞器,是细胞的“能量工厂”,在线粒体生产能量的同时,线粒体向外泵出质子。因此,线粒体在内膜和外膜之间会存在电势差。亲脂性阳离子是一类具有正电荷的有机小分子。能根据线粒体的膜电势差异,选择性的聚集于线粒体。研究表明,癌细胞线粒体的膜电势(δψm)远高于正常细胞线粒体,亲脂性阳离子受癌细胞线粒体膜电势驱动,可穿过细胞膜和线粒体膜的疏水屏障,选择性聚集到肿瘤细胞线粒体中。以此为靶点的药物能富集于癌细胞线粒体,药物在癌细胞中浓度比正常细胞高近千倍。
因此,使用线粒体靶向基团对细胞活性小分子进行修饰,使其能够在线粒体内富集,可以极大的提高药物对肿瘤细胞的活性,而降低对正常细胞的影响,从而达到低毒高效的治疗效果。
技术实现要素:
本发明的目的是针对现有的技术存在的上述问题,提供一种噻嗪荧光衍生物的制备方法及其应用,本发明所要解决的技术问题是如何制备一种能够诱导肿瘤细胞凋亡的化合物。
本发明的目的可通过下列技术方案来实现:一种噻嗪荧光衍生物的制备方法,其分子结构通式如下:
其中,r1、r2为:h、f、cl、br、i、no2、oh、cooh、so3h、cho、sh、cn、-och3、-sch3、-n(ch3)2、烷烃、烯烃、炔烃、芳香烃;r3、r4、r5、r6可以是h、f、cl、br、i、no2、oh、cho、ar;n=1-19;
本发明包括化合物1、化合物2和化合物3。
所述化合物1的制备方法为:15ml干燥乙腈置于50ml圆底烧瓶中,芦竹碱2mmol加入上述反应瓶中,再取4-醛基吡啶4mmol和正三丁基膦4mmol常温下加入上述反应瓶中,80℃加热回流反应8h。薄层色谱监控反应进程,待反应结束后。使用旋转蒸发仪旋干有机溶剂,得褐色油状物质,经硅胶柱层析分离纯化,得淡黄色固体,产率为51%。
在上述的一种噻嗪荧光衍生物的制备方法中,所述化合物1制备中芦竹碱:4-醛基吡啶:正三丁基膦的摩尔比为1:2:2。
所述化合物2制备方法为:量取15ml干燥dmf置于25ml圆底烧瓶中,称取1,4-二溴丁烷5mmol和氢化钠5mmol加入上述反应瓶中,氮气保护,再取二氯吩噻嗪1mmol在0.5h内滴加入上述反应瓶中,常温反应3h,薄层色谱监控反应进程,待反应结束后。用二氯甲烷萃取,取有机溶剂层,使用旋转蒸发仪旋干有机溶剂,得少量淡粉色液体,经硅胶柱层析分离纯化,得无色油状液体,产率为85%。
在上述的一种噻嗪荧光衍生物的制备方法中,所述化合物2制备中二氯噻嗪:1,4-二溴丁烷:氢化钠的摩尔比为1:5:5。
所述化合物3制备方法为:5ml干燥dmf置于10ml圆底烧瓶中,称取化合物1、化合物2各1mmol加入上述反应瓶中,氮气保护,常温反应过夜,薄层色谱监控反应进程。反应液直接使用中性氧化铝柱层析分离纯化,得橙红色固体,产率为63%。
在上述的一种噻嗪荧光衍生物的制备方法中,所述化合物3制备中化合物1:化合物2的摩尔比为1:1。
在上述的一种噻嗪荧光衍生物的制备方法中,所述噻嗪类衍生物包含一种或多种药学上可以接受的载体和赋形剂。
在上述的一种噻嗪荧光衍生物的制备方法中,所述噻嗪类衍生物包含固体给药制剂或胃肠外给药制剂。
在上述的一种噻嗪荧光衍生物的制备方法中,所述噻嗪类衍生物为片剂、分散片、肠溶片、咀嚼片、口崩片、胶囊、糖衣剂、颗粒剂、干粉剂、口服溶液剂、注射用小水针、注射用冻干粉针、大输液或小输液。
在上述的一种噻嗪荧光衍生物的应用中,所述噻嗪类衍生物对(人胃癌细胞sgc-7901、大鼠乳腺癌细胞mrmt-1、人神经胶质瘤细胞u87、人宫颈癌细胞hela),均具有较强的抑制作用。
通过和正常细胞(人正常肝细胞wrl68,人脐静脉内皮细胞huvec)进行对比,发现所述的噻嗪类衍生物具有较好的选择性。
在上述的一种噻嗪荧光衍生物的应用中,所述噻嗪类衍生物具有绿色的荧光。
通过激光共聚焦显微成像进行共定位实验发现,所述的噻嗪类衍生物能特异性的靶向肿瘤细胞线粒体。
通过流式细胞实验发现:所述噻嗪类衍生物能够诱导细胞内活性氧水平明显升高,以及导致线粒体膜电势的坍塌。上述实验均能有效的证明所述噻嗪类衍生物能够诱导细胞凋亡的发生,具有较好的抗肿瘤活性。
本发明还提供上述噻嗪类衍生物在制备抗肿瘤药物中的用途。
与现有技术相比,本发明的有益效果是:本发明所提供的实验条件是温和的,实验中用廉价易得的原料来修饰噻嗪类化合物,产物的选择性和收率都很高,具有良好的工业应用前景。通过对噻嗪类进行修饰,得到具有细胞线粒体靶向的衍生物,该噻嗪类衍生物以癌细胞线粒体为靶点,以噻嗪类衍生物为有效成分制得的抗肿瘤活性先导化合物,能富集于癌细胞线粒体。所合成的化合物具有良好的荧光特性,可实现对肿瘤细胞可视化治疗。在使用此类药物进行治疗时,可以极大的提高药物对肿瘤细胞的活性,而降低对正常细胞的影响,可达到低毒高效的治疗效果。
附图说明
图1是本发明分子结构通式
图2是化合物1分子结构通式
图3是化合物2分子结构通式
图4是化合物3分子结构通式
图5是本发明合成路线
图6是化合物3的核磁图谱(氢谱)
图7是化合物3的核磁图谱(碳谱)
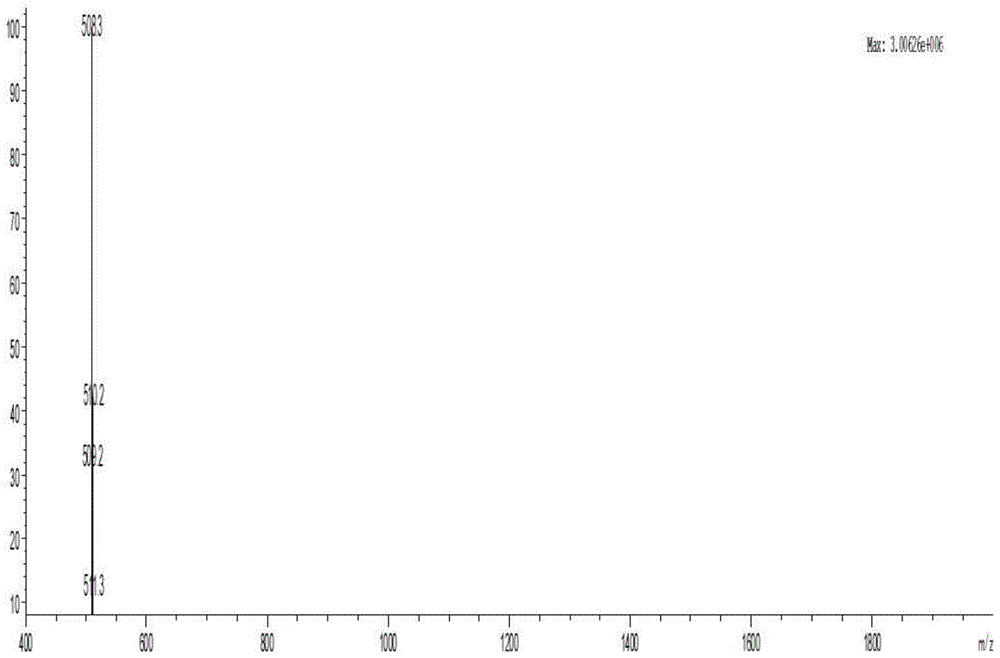
图8是化合物3的质谱
图9是化合物2对人胃癌细胞sgc7901、大鼠乳腺癌细胞mrmt-1的抗肿瘤活性效果图
图10是化合物3对人胃癌细胞sgc7901的抗肿瘤活性效果图
图11是化合物3对大鼠乳腺癌细胞mrmt-1的抗肿瘤活性效果图
图12是化合物3对人神经胶质瘤细胞u87的抗肿瘤活性效果图
图13是化合物3对人宫颈癌细胞hela的抗肿瘤活性效果图
图14是化合物3对人正常肝细胞wrl68的抗肿瘤活性效果图
图15是化合物3对人脐静脉内皮细胞huvec的抗肿瘤活性效果图
图16是化合物3对四种肿瘤细胞系即人宫颈癌细胞hela、人胃癌细胞sgc-7901、大鼠乳腺癌细胞mrmt-1、人神经胶质瘤细胞u87,两种正常细胞系即人正常肝细胞wrl68,人脐静脉内皮细胞huvec的ic50条形图
图17是化合物2(dichlorophenothiazine)和化合物3(pcp)对人胃癌细胞sgc7901的抗肿瘤活性效果对比图
图18是化合物2(dichlorophenothiazine)和化合物3(pcp)对大鼠乳腺癌细胞mrmt-1的抗肿瘤活性效果对比图
图19是化合物3对人胃癌细胞sgc7901是否处理细胞形态对比图(左图:处理前,右图:处理后)
图20是化合物3的紫外吸收和荧光发射光谱
图21是化合物3的人宫颈癌细胞hela的细胞线粒体定位图。
图22是化合物3对人胃癌细胞sgc7901的细胞凋亡图
图23是化合物3诱导人宫颈癌细胞hela线粒体跨膜电位(δψm)坍塌说明图
图24是化合物3诱导人宫颈癌细胞hela细胞内活性氧水平升高说明图。
具体实施方式
以下是本发明的具体实施例并结合附图,对本发明的技术方案作进一步的描述,但本发明并不限于这些实施例。
实施例一:
如图2所示,一种噻嗪荧光衍生物的制备方法,化合物1的制备方法:量取15ml干燥乙腈置于50ml圆底烧瓶中,称取芦竹碱2mmol溶解入上述反应瓶中,再取4-醛基吡啶4mmol和正三丁基膦4mmol常温下加入上述反应瓶中,80℃加热回流反应8h。薄层色谱监控反应进程。旋干有机溶剂,得褐色油状物质,经硅胶柱层析分离纯化,得淡黄色液体,旋干得淡黄色固体1,产率为51%。其中芦竹碱:4-醛基吡啶:正三丁基膦的摩尔比为1:2:2。
实施例二:
如图3所示,一种噻嗪荧光衍生物的制备方法,化合物2制备方法:量取15ml干燥dmf置于25ml圆底烧瓶中,称取1,4-二溴丁烷5mmol和氢化钠5mmol加入上述反应瓶中,氮气保护,再取二氯噻嗪1mmol在0.5h内滴加入上述反应瓶中,常温反应3h,薄层色谱监控反应进程。用二氯甲烷萃取,取有机溶剂层,旋干,得少量淡粉色液体,经硅胶柱层析分离纯化,得无色液体,旋干得无色油状液体2,产率为85%。其中二氯噻嗪:1,4-二溴丁烷:氢化钠的摩尔比为1:5:5。
实施例三:
如图4所示,一种噻嗪荧光衍生物的制备方法,化合物3备方法:5ml干燥dmf置于10ml圆底烧瓶中,称取步骤一所得化合物1mmol和步骤二所得化合物1mmol加入上述反应瓶中,氮气保护,常温反应过夜,薄层色谱监控反应进程。中性氧化铝柱层析分离纯化,得橙红色液体,旋干得橙红色固体,产率为63%。其中化合物1:化合物2的摩尔比为1:1。
1hnmr(400mhz,dmso):δ12.13(s,1h),8.72(d,j=6.7hz,2h),8.25(d,j=16.2hz,1h),8.20–8.11(m,1h),8.06(d,j=6.7hz,2h),7.99(s,1h),7.56–7.46(m,1h),7.29–7.12(m,6h),7.02–6.91(m,4h),4.44(t,j=6.7hz,2h),3.90(t,j=6.5hz,2h),1.98(dd,j=14.4,6.9hz,2h),1.72–1.55(m,2h).
13cnmr(101mhz,dmso):δ155.02(s),146.58(s),144.37(s),143.60(s),138.04(s),137.09(s),132.96(d,j=2.9hz),128.67(s),128.26(s),127.80(s),125.37(s),124.10(s),123.58(s),123.37(s),122.73(s),122.25(s),121.63(s),120.94(s),117.27(s),116.88(s),116.34(s),114.09(s),113.13(s),58.91(s),46.32(s),40.60(s),40.40(s),40.19(s),39.98(s),39.79(s),39.67(d,j=21.0hz),39.35(s),28.15(s),23.04(s).
lc-ms(fi+)(m/z):[m+h]+calcdfor,508.1614;found,508.3。
实施例四:
如图9所示,一种噻嗪荧光衍生物的应用,发明人研究了化合物2对人胃癌细胞sgc7901、大鼠乳腺癌细胞mrmt-1的抗肿瘤活性。发现,化合物2在未连接线粒体靶向基团前,细胞毒性较小,抗增殖活性较差。
采用mtt法测定本实施例所制得的化合物2给药梯度为0、6、10、14、17.5、20、25、30、40、60μmol/l对人胃癌细胞sgc7901、大鼠乳腺癌细胞mrmt-1的抗肿瘤活性。所用细胞均来自武汉大学细胞库。
采用mtt分析法,分别测定本实施例所制得的化合物2对人胃癌细胞sgc7901、大鼠乳腺癌细胞mrmt-1的抗肿瘤活性,孵育24h。酶联免疫监测仪490nm测定od值,以给药浓度为横坐标,吸光值比率为纵坐标绘制细胞生长曲线。本实施例所制得的化合物2对人胃癌细胞sgc7901、大鼠乳腺癌细胞mrmt-1不具有较好的细胞活性。说明,本实施例所制得的化合物2对肿瘤细胞毒性不大,抗增殖活性较差。
实施例五:
如图10-16所示,一种噻嗪荧光衍生物的应用,化合物3对肿瘤细胞与正常细胞抗肿瘤活性对比。采用mtt法测定本实施例所制得的化合物3对四种肿瘤细胞系即人胃癌细胞sgc7901、大鼠乳腺癌细胞mrmt-1、人神经胶质瘤细胞u87、人宫颈癌细胞hela和对两种正常细胞系即人正常肝细胞wrl68,人脐静脉内皮细胞huvec的抗肿瘤活性对比。所用细胞均来自武汉大学细胞库。
采用mtt分析法,分别测定本实施例所制得的化合物3给药梯度0、0.5、1、2、4、6、8、10、12、14μmol/l对四种肿瘤细胞系即人胃癌细胞sgc7901、大鼠乳腺癌细胞mrmt-1、人神经胶质瘤细胞u87、人宫颈癌细胞hela和对两种正常细胞系即人正常肝细胞wrl68,人脐静脉内皮细胞huvec的抗肿瘤活性对比,孵育24h。酶联免疫监测仪490nm测定od值,以给药浓度为横坐标,吸光值比率为纵坐标绘制细胞生长曲线,本实施例所制得的化合物3对四种肿瘤细胞系即人胃癌细胞sgc-7901、大鼠乳腺癌细胞mrmt-1、人神经胶质瘤细胞u87、人宫颈癌细胞hela和对两种正常细胞系即人正常肝细胞wrl68,人脐静脉内皮细胞huvec的抗肿瘤活性有显著差异。说明,化合物3具有广谱抗癌作用,对癌细胞株的选择性优于对正常细胞株,且严重影响肿瘤细胞增殖,对肿瘤细胞毒性较大。
实施例六:
如图17、18所示,一种噻嗪荧光衍生物的应用,为研究化合物结构和抗肿瘤效果之间的关系,发明人把化合物2和化合物3给药梯度0、6、10、14μmol/l对人胃癌细胞sgc7901、大鼠乳腺癌细胞mrmt-1的抗肿瘤活性进行了对比,化合物2在未连接线粒体靶向基团前,细胞毒性较小,抗增殖活性较差。而连接线粒体靶向基团后的化合物3严重影响肿瘤细胞增殖,具有较大的细胞毒性。
实施例七:
如图19所示,一种噻嗪荧光衍生物的应用,对人胃癌细胞sgc7901使用化合物3进行处理前后细胞形态对比。
采用显微镜拍照对比化合物3给药0、5μmol/l对人胃癌细胞sgc7901处理后24h后的细胞形态,所用细胞来自武汉大学细胞库。
使用化合物3处理的人胃癌细胞sgc7901,细胞体积明显小于无处理的细胞系,细胞形态异常,提示细胞死亡或处于凋亡晚期,这一结果与mtt实验结果一致。说明本实施例所制得的化合物3对人胃癌细胞sgc7901具有较好的抗增殖作用。
实施例八:
如图20所示,一种噻嗪荧光衍生物的应用,为进一步研究化合物的光物理性质,为后续共聚焦荧光成像做准备,使用紫外和荧光分光光度计研究了化合物3的光学性质。
在浓度为10μmol/l的化合物3甲醇溶液中,研究化合物3的光学性质。其紫外最大吸收波长为443nm,荧光最大发射波长为534。化合物3具有良好的荧光特性。
实施例九:
如图21所示,一种噻嗪荧光衍生物的应用,通过激光共聚焦显微成像,研究化合物3的线粒体定位能力。
采用共焦激光扫描显微镜检测化合物3的线粒体定位能力。首先使用化合物3给药5μmol/l与人宫颈癌细胞hela共孵育0.5h,随后使用线粒体商品染料
实施例十:
如图22所示,一种噻嗪荧光衍生物的应用,采用annexinv-fitc/pi细胞凋亡检测试剂盒检测给药0.3.5μmol/l的化合物3对人胃癌细胞sgc7901的细胞凋亡情况。用fitc标记的annexinv作为探针,来检测早期凋亡的细胞。用碘化丙啶(pi),检测晚期凋亡的细胞。在荧光显微镜下用爬片观察。检测早期凋亡细胞的annexinv-fitc荧光信号呈绿色,检测晚期凋亡细胞的pi荧光信号呈红色。化合物3在不同浓度(0μm、3μm、5μm)下与人胃癌细胞sgc7901孵育24h,检测化合物3诱导sgc-7901人胃癌细胞凋亡情况良好,化合物3可较好的诱导肿瘤细胞凋亡。
实施例十一:
如图23所示,一种噻嗪荧光衍生物的应用,可诱导癌细胞线粒体跨膜电位(ψm)坍塌。
采用罗丹明123(rhodamine123)来检测线粒体膜电位的变化,罗丹明123是一种可以通透细胞膜的选择性染色活细胞线粒体的阳离子黄绿色荧光染料,广泛用作检测线粒体膜电位的荧光探针。在正常细胞中,rhodamine123能够依赖线粒体跨膜电位选择性进入线粒体基质,荧光强度减弱或消失;在凋亡发生时,线粒体膜完整性被破坏,线粒体膜通透性转运孔开放,从而引起线粒体跨膜电位的崩溃,罗丹明123从线粒体基质中释放出来,黄绿色荧光增强。利用流式细胞仪检测该荧光,通过荧光信号的强弱来确定线粒体膜电位的变化。化合物3在不同浓度(0μm、1μm、2μm)下与人宫颈癌细胞hela孵育24h,流式细胞仪显示荧光强度。当同时加入化合物3与罗丹明123(200μm)后,荧光强度较单独加罗丹明123(200μm)明显增强,且随化合物3的浓度升高,荧光增强也有显著增强。说明,化合物3可以很好的诱导癌细胞线粒体跨膜电位坍塌,诱导癌细胞凋亡。
实施例十二:
如图24所示,一种噻嗪荧光衍生物的应用,化合物3可使癌细胞细胞内活性氧水平升高。
采用活性氧检测试剂盒(荧光探针dcfh-da)进行活性氧检测。dcfh-da本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成dcfh。而dcfh不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的dcfh生成有荧光的dcf。检测dcf的荧光就可以知道细胞内活性氧的水平。化合物3在不同浓度(0μm、1μm、2μm)下与人宫颈癌细胞hela孵育24h,流式细胞仪显示荧光强度。当同时加入化合物3与dcfh-da(1μm)后,荧光强度较只加荧光探针dcfh-da(1μm)明显增强,且随化合物3的浓度升高,荧光增强也有显著增强。说明,化合物3可以很好的使活性氧水平明显升高,提示癌细胞线粒体受损或严重紊乱。
本文中所描述的具体实施例仅仅是对本发明精神作举例说明。本发明所属技术领域的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,但并不会偏离本发明的精神或者超越所附权利要求书所定义的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 6-(取代的)亚甲基青霉烷酸类;6-(取代的)羟甲基青霉素烷酸类及其衍生物的制法的制作方法
- 6-(取代的)亚甲基青霉烷酸类;6-(取代的)羟甲基青霉素烷酸类及其衍生物的制法的制作方法
- 一种制备4-(n-吩噻嗪-)-羰基-2-丁烯酸的方法
- 制备用于糠醛液相加氢制环戊醇的负载型催化剂的方法
- 一种吩噻嗪衍生物双光子生物显影材料的制作方法
- 一种制备3
- 吩噻嗪类染料修饰的磁性微粒的制备方法和用途的制作方法
- 2-(R<sup>2</sup>-硫代)-10-[3-(4-R<sup>1</sup>-哌嗪-1-基)丙基]-10H-吩噻嗪用于治疗β-淀粉样病或α-共核 ...的制作方法
- 一种2-乙酰基吩噻嗪的制备方法
- 光致变色的螺构噁嗪