药品质量控制中常见产毒真菌的特征序列鉴定方法与流程
本发明涉及真菌鉴定领域,尤其涉及药品质量控制中常见产毒真菌的特征序列鉴定方法。
背景技术:
医药产业发展迅速,相关产品发生微生物污染的事件也在增加,污染微生物不仅包括细菌也包括真菌,其中部分真菌还会产生毒性强烈的真菌毒素,因此一旦发生真菌污染尤其是产毒真菌污染会对药品质量以及患者的用药安全造成极大风险。为控制药品质量,避免对患者的健康造成危害,《中国药典》(2015年版)、《美国药典》(usp41)、《欧洲药典》(ep9.0)和《日本药典》(jp17)规定需要检查药品中金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌等致病菌,同时明确除限度标准中所列的致病菌外,其他具有潜在危害的微生物也需检查和评估。因此药品生产和检验过程中分离的致病菌需被准确鉴定。同时通过对中药材和饮片中产毒真菌的检测、鉴定,能从源头上提示真菌毒素存在的可能性,避免不合格药材饮片流入生产、使用环节,对提升药材饮片及中药制剂的安全性具有更为突出的效果。
相对于细菌,真菌形态简单,传统的形态鉴定难度大。采用分子生物学方法对真菌进行鉴定,结果将更加准确。利用特征核酸片段进行分子鉴定已成为分子生物学研究的热点,该技术通过选择一段公认、易扩增、且相对较短的dna片断,以核酸测序技术为基础,以不同微生物核酸序列的差异实现对微生物进行经济、快捷、准确的鉴定。
现有特征序列的鉴定方法的研究主要对真菌的某一个属或特定某一类别进行鉴定,特征序列的种类比较多且繁杂,尚无征对药品领域常见产毒真菌的系统特征序列鉴定方法。为了实现对药材中产毒真菌的快速准确鉴定和真菌毒素的早期风险预警,需要一种药品质量控制中真菌的特征序列鉴定方法。
技术实现要素:
本发明为解决现有技术中的上述问题提出的药品质量控制中常见产毒真菌的特征序列鉴定方法,该方法提供的两种特征序列广谱性好,既可以分别进行鉴定而且可以联合使用,不必要研究更换其他特征序列,具备操作简单,鉴定准确的特点,适用于药品质量控制中常见的所有产毒真菌鉴定,适用性强。
为实现上述目的,本发明采用以下技术方案:
本发明的第一个方面是提供一种药品质量控制中常见产毒真菌的特征序列鉴定方法,采用的特征序列为its和lsu。
进一步地,its特征序列的扩增引物序列如seqidno.1~seqidno.2所示;
正向引物(its5f):5′-ggaagtaaaagtcgtaacaagg-3′(seqidno.1);
反向引物(its4r):5′-tcctccgcttattgatatgc-3′(seqidno.2)。
进一步地,lsu特征序列的扩增引物序列如seqidno.3~seqidno.4所示;
正向引物(lsuf):5′-acccgctgaacttaagc-3′(seqidno.3);
反向引物(lsur):5′-tcctgagggaaacttcg-3′(seqidno.4)。
进一步地,该方法包括如下步骤:
步骤一,对菌株进行分离纯化;
步骤二,提取核酸:取菌体置于离心管中,研磨,然后加入ctab缓冲液和2-巯基乙醇;水浴0.5-1.5h,然后加入饱和苯酚-氯仿-异戊醇溶液,充分颠倒混匀,-20℃冰箱放置;室温离心,取上清液置于新的离心管中;若上清液混浊,可再加入等体积饱和苯酚-氯仿-异戊醇溶液,室温离心,取上清液置于新的离心管中;再加入等体积的异丙醇溶液,颠倒使之充分混匀,室温放置2~3分钟,室温离心,弃上清;漂洗并风干加入te缓冲液,混匀后作为核酸提取溶液(模板dna),置4℃冰箱中备用。
步骤三,扩增特征序列;
步骤四,检测核酸扩增产物:采用琼脂糖凝胶电泳法检测核酸扩增产物;
步骤五,纯化核酸扩增产物:将步骤四中获得的琼脂糖凝胶中的核酸扩增产物切下,置于离心管中,加入te缓冲液,水浴至凝胶块完全溶解;分别加入乙酸钠溶液和乙二胺四乙酸二钠溶液,混匀;加入无水乙醇,静置;离心,弃去上清液;加入适量75%乙醇(v/v)溶液洗涤,离心,弃去上清液,室温风干至乙醇挥发完全;加入50~200μl的te缓冲溶液溶解,作为核酸扩增产物的纯化溶液,置4℃冰箱中备用;
步骤六,对核酸进行测序和比对分析序列:以步骤五获得的扩增引物作为测序引物,使用核酸测序仪对纯化后的核酸扩增产物进行双向测序,获得目标核酸序列,双向测序峰图采用有峰图拼接功能的软件,以正、反向核酸序列叠加的方式进行序列拼接,并去除两端引物区序列;将获得的真菌dna特征序列进行比对分析,得到判定结果。
进一步地,步骤二中的ctab缓冲液的组成成分包括50mmol/ltris-hclph8,0.7mol/lnacl,10mmol/ledtaph8和2%ctab。
进一步地,步骤二中的苯酚-氯仿-异戊醇溶液中的苯酚、氯仿和异戊醇的体积比为25:24:1。
进一步地,步骤二中离心所采用的转速为每分钟12000转。
进一步地,步骤三中的扩增体系包括:pcr反应缓冲液2.5μl,脱氧核糖核苷三磷酸(dntps,2.5mmol/l)2μl,正向和反向引物(2.5μmol/l)各2μl,模板dna1μl,taqdna聚合酶(1u/μl)1μl,加灭菌的纯化水至25μl。
进一步地,步骤三中的扩增程序为94℃预变性10分钟;94℃变性30秒,55℃退火30秒,72℃延伸30秒,29个循环;72℃继续延伸5分钟。
进一步地,步骤四中采用的琼脂糖凝胶中加入的核酸凝胶染色剂为溴化乙锭或吖啶橙。
本发明采用上述技术方案,与现有技术相比,具有如下技术效果:
本发明采用的特征序列长度适中,符合特征序列的长度要求;通用性好,可以适用于常见产毒真菌;区分度强,能有效区分真菌在“属”或“种”水平的序列差异;准确性高,两段特征序列不仅可以分别用于真菌鉴定,同时两段特征序列联用的方式还可以进一步提高菌株的鉴定水平,结果稳定可靠。
附图说明
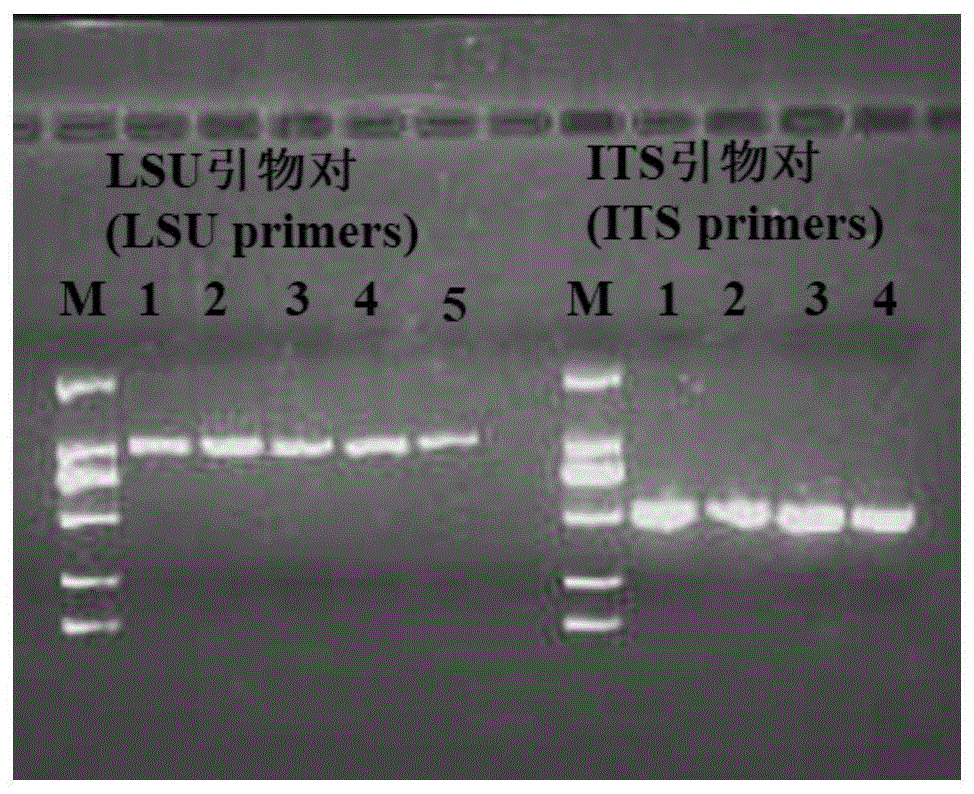
图1为本发明一实施例中代表性菌株特征序列的电泳图;
图2为本发明一实施例中产毒真菌its特征序列的进化分析图;
图3为本发明一实施例中产毒真菌lsu特征序列的进化分析图;
图4为本发明一实施例中产毒真菌its和lsu特征序列联用的进化分析图。
具体实施方式
本发明提供了一种药品质量控制中常见产毒真菌的特征序列鉴定方法。
下面通过具体实施例对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
以下实施例中采用的仪器包括abi3500核酸测序仪(abi公司)、琼脂糖凝胶电泳仪(bio-rad公司)、凝胶成像系统(bio-rad公司)、光学显微镜(zeiss公司)、核酸浓度测定仪(eppendorf公司)等。
采用的菌株如表1所示。
表1真菌菌株列表
实施例一
本发明提供测定8个属30余种真菌的特征序列鉴定方法,其中采用的真菌的种类如表1所示,具体的鉴定步骤如下:
步骤一、菌株的分离纯化
将适宜的固体培养基平板倒转,用接种环取待检菌菌体或其供试液,向上接种1~3点,然后正置平板培养。
步骤二、核酸提取
取约20mg菌体置于离心管中,研磨,然后加入400μl的ctab缓冲液(50mmol/ltris-hclph8,0.7mol/lnacl,10mmol/ledtaph8,2%ctab)和4μl2-巯基乙醇;65℃水浴1h,水浴期间每隔10分钟,震荡1次;加入200μl饱和苯酚-氯仿-异戊醇(25:24:1,v/v/v)溶液,充分颠倒混匀,-20℃冰箱放置5分钟;室温离心(转速为每分钟12000转)5分钟,取上清液置于新的离心管中;若上清液混浊,可再加入等体积饱和苯酚-氯仿-异戊醇(25:24:1,v/v/v)溶液,室温离心(转速为每分钟12000转)5分钟,取上清液置于新的离心管中;再加入等体积的异丙醇溶液,颠倒5~8次使之充分混匀,室温放置2~3分钟,室温离心(转速为每分钟12000转)5分钟,弃上清;加入1ml75%乙醇,颠倒漂洗1~3分钟,室温离心(转速为每分钟12000转)2分钟,弃上清,重复操作1次;室温风干至残留的乙醇完全挥发;加入50~200μl的te缓冲液,混匀后作为核酸提取溶液(模板dna),置4℃冰箱中备用。
步骤三、特征序列的扩增
1.扩增引物
正向引物(its5f):5′-ggaagtaaaagtcgtaacaagg-3′;
反向引物(its4r):5′-tcctccgcttattgatatgc-3′。
或/和
正向引物(lsuf):5′-acccgctgaacttaagc-3′;
反向引物(lsur):5′-tcctgagggaaacttcg-3′。
2.pcr反应体系为25μl:取pcr反应缓冲液2.5μl,脱氧核糖核苷三磷酸(dntps,2.5mmol/l)2μl,正向和反向引物(2.5μmol/l)各2μl,模板dna1μl,taqdna聚合酶(1u/μl)1μl,加灭菌的纯化水至25μl。
3.采用的扩增程序为:94℃预变性10分钟;94℃变性30秒,55℃退火30秒,72℃延伸30秒,29个循环;72℃继续延伸5分钟。
步骤四、核酸扩增产物的检测
采用琼脂糖凝胶电泳法检测核酸扩增产物。使用电泳缓冲液配制1.5%琼脂糖凝胶,其中加入溴化乙锭(ethidiumbromide,eb)、吖啶橙(acridineorange,ao)等适宜的核酸凝胶染色剂。取核酸扩增产物5μl、上样缓冲液1μl,混匀后上样,于100~150v电压下电泳,溴酚蓝条带移动至凝胶片的1/2~2/3处结束电泳。取凝胶片在紫外凝胶成像仪上检视,核酸扩增产物应在约500~800bp的位置出现一条目的条带。核酸扩增产物检测时应选择适宜的dna分子量标记(marker),目的条带的大小应包括在marker的范围内。
步骤五、核酸扩增产物的纯化
将琼脂糖凝胶中的核酸扩增产物切下,置于离心管中,加入适量体积的te缓冲液,水浴至凝胶块完全溶解;分别加入1/10体积乙酸钠溶液(3mol/l,ph5.2)和乙二胺四乙酸二钠溶液(125mmol/l,ph8.0),混匀;加入2倍体积无水乙醇,-20℃静置30分钟;离心(转速为每分钟12000转)10分钟,弃去上清液;加入适量75%乙醇(v/v)溶液洗涤,离心(转速为每分钟12000转)10分钟,弃去上清液,室温风干至乙醇挥发完全;加入50~100μl的te缓冲溶液溶解,作为核酸扩增产物的纯化溶液,置4℃冰箱中备用。
步骤六、核酸测序与序列比对分析
以扩增引物作为测序引物,使用核酸测序仪对纯化后的核酸扩增产物进行双向测序,获得目标核酸序列。双向测序峰图采用有峰图拼接功能的软件,以正、反向核酸序列叠加的方式进行序列拼接,并去除两端引物区序列。拼接后得到的核酸序列方向与核酸扩增正向引物方向一致。将获得的真菌dna特征序列进行比对分析,得到判定结果。
结果
由图1可知,its和lsu序列的引物都能将产毒真菌(1.cmcc98003黑曲霉(aspergillusniger);2.atcc16404巴西曲霉(aspergillusbrasiliensis);3.cicc40673橘青霉(penicilliumcitrinum);4.cicc13003长枝木霉(trichodermalongibrachiatum);5.cicc2620腐皮镰孢(fusariumsolani))成功扩增出1条清晰的条带,its序列长度约500bp,lsu序列长度约900bp。
由图2可知,试验菌株的its特征序列分析中可知葡萄糖穗霉属、木霉属、镰孢属、单端孢属、节菱孢霉属和链格孢属中的菌株在“属”水平能够很好地聚类成簇,大部分菌株在不同的“种”水平能够各自独立区分。青霉属和曲霉属各菌株在“种”内序列一致性较高,但个别菌株在“种”间进化距离近。另外,查阅资料表明,青霉属内皱褶青霉等种已归类至篮状菌属(talaromyces),通过序列分析明确将皱褶青霉与属内其他菌株区分开。
由图3可知,试验菌株的lsu特征序列分析中,不仅葡萄糖穗霉属、木霉属、镰孢属、单端孢属、节菱孢霉属和链格孢属中的菌株在“属”水平能够很好地聚类成簇,青霉属和曲霉属菌株也能在“属”水平很好地区分。但青霉属和曲霉属在“种”水平的区分度低于its序列,如未能将鲜绿青霉和rubens青霉很好区分。与its序列的进化分析结果一致,皱褶青霉(篮状菌)在lsu序列与青霉属内其他菌株的进化距离也较远。
进一步将its序列和lsu序列进行串联,由图4可知,青霉属和曲霉属中菌株的序列在“属”水平聚类成簇,在“种”水平也能很好区分。
综上所述,本发明实施例提供的方法,特征序列通用不仅分别可以用于产毒真菌鉴定,同时可以通过特征序列串联的方式将青霉和曲霉菌鉴定至“种”水平,具有方法稳定可靠的优点。
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
序列表
<110>上海市食品药品检验所
<120>药品质量控制中常见产毒真菌的特征序列鉴定方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>22
<212>dna
<213>its5f
<400>1
ggaagtaaaagtcgtaacaagg22
<210>2
<211>20
<212>dna
<213>its4r
<400>2
tcctccgcttattgatatgc20
<210>3
<211>17
<212>dna
<213>lsuf
<400>3
acccgctgaacttaagc17
<210>4
<211>17
<212>dna
<213>lsur
<400>4
tcctgagggaaacttcg17
- 还没有人留言评论。精彩留言会获得点赞!