一种利用深共熔溶剂提取菰米中黄酮类化合物的方法与流程
本发明涉及天然物质提取技术领域,具体涉及一种利用深共熔溶剂提取菰米中黄酮类化合物的方法。
背景技术:
菰米是禾本科稻亚科稻族菰属的中国菰的颖果,是一种营养丰富的全谷物,在中国的食用历史至少有3500年。它主要生长在湖泊边缘的潜水沼泽、池塘、沼泽、水田边及湖泊浅水区域;在东北、华北、华中、华南、西南、中南部等地区均有较多的分布。菰米中含有蛋白质、矿物质、维生素、酚类、皂苷、植物甾醇和花青素等多种植物化学成分。而且菰米有丰富的生物活性功能,包括抗氧化、抗炎、抗肥胖和抗过敏作用,引起国内外研究学者的广泛关注。
目前,从菰米中分离得到的黄酮类化合物主要有槲皮素、儿茶素、原花青素,能够改善胰岛素敏感性和血糖稳态,抑制肿瘤细胞的增殖,并显示抗氧化活性。目前,菰米中黄酮类化合物的提取方法主要为有机溶剂提取法,采用的有机溶剂主要有甲醇、乙醇、丙酮或氯仿。然而在提取过程中有机溶剂有毒、蒸气压低、易挥发、易燃,容易对环境造成污染。
技术实现要素:
本发明的目的在于提供一种利用深共熔溶剂提取菰米中黄酮类化合物的方法,本发明采用的深共熔溶剂无毒、可生物降解、可回收重复利用、绿色环保,对菰米中黄酮类化合物的提取率效高、检测限低。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种利用深共熔溶剂提取菰米中黄酮类化合物的方法,包括以下步骤:
将菰米进行预处理,得到菰米粉末;
利用深共熔溶剂对所述菰米粉末进行提取后固液分离,得到黄酮提取液;
将所述黄酮提取液进行液相色谱分离,得到黄酮类化合物;
所述深共熔溶剂包括氯化胆碱、氢键给体和水;
所述氢键给体包括1,4-丁二醇、甘油或乳酸;
优选的,所述菰米粉末的粒径为40~100目。
优选的,所述深共熔溶剂中氯化胆碱和氢键给体的摩尔比为1:(0.5~7);
所述深共熔溶剂中水的含量为10~50wt%。
优选的,所述菰米粉末和深共熔溶剂的料液比为10~100mg/ml。
优选的,所述提取的方式为超声提取。
优选的,所述超声提取的功率为120~600w,频率为20~25khz。
优选的,所述提取的温度为30~60℃,时间为1~20min。
优选的,所述液相色谱分离前还包括将所述酚酸物提取液用甲醇稀释后过滤。
优选的,所述酚酸物提取液和甲醇的体积比为1:(1~4);所述过滤用滤膜的孔径为0.22μm。
优选的,所述液相色谱分离的条件包括:流动相包括流动相a和流动相b,其中,流动相a为乙腈-乙酸混合溶液,所述乙酸的体积分数为0.1%;流动相b为乙酸的水溶液,所述乙酸的体积分数为0.1%;
梯度淋洗程序:0~5min,流动相a的体积百分数从5%增加至10%;5~7min,流动相a的体积百分数从10%增加至20%;7~8min,流动相a的体积百分数从20%增加至60%;8~9min,流动相a的体积百分数从60%增加至100%;9~10min,流动相a的体积百分数从100%降低至5%;10~12min,流动相a的体积百分数保持为95%;流动相的流速为0.3ml/min;进样量为1μl;色谱柱温度为25℃。
本发明提供了一种利用深共熔溶剂提取菰米中黄酮类化合物的方法,包括以下步骤:将菰米进行预处理,得到菰米粉末;利用深共熔溶剂对所述菰米粉末进行提取后固液分离,得到黄酮提取液;将所述黄酮提取液进行液相色谱分离,得到黄酮类化合物;所述深共熔溶剂包括氯化胆碱、氢键给体和水;所述氢键给体包括1,4-丁二醇、甘油或乳酸。本发明采用的深共熔溶剂极性强,能高效破除菰米细胞壁,促进菰米黄酮类化合物的溶解,而且深共熔溶剂无毒、可生物降解、不产生二次污染,绿色环保,而且可回收重复利用,大大降低了提取成本。本发明提供的方法对菰米中黄酮类化合物的提取率效高、检测限低。
附图说明
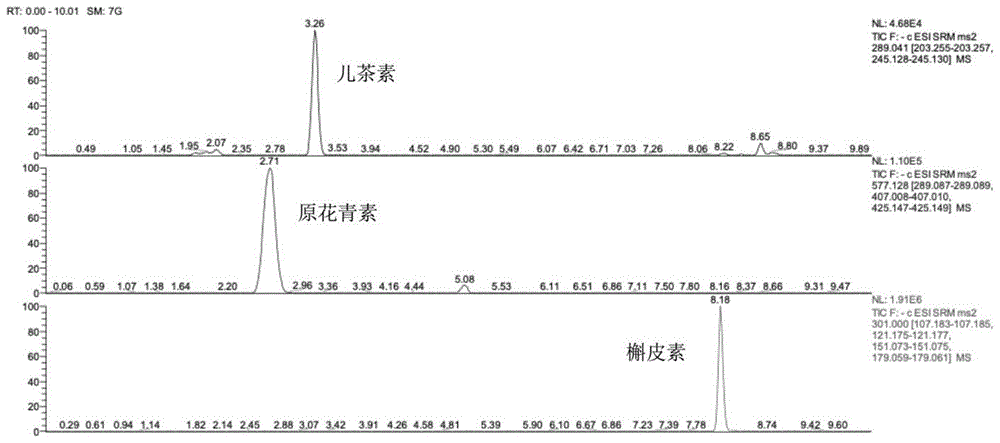
图1为儿茶素、原花青素和槲皮素的液相质谱图;
图2为实施例1~3提取的黄酮类化合物对dpph自由基清除能力图;
图3为实施例1~3提取的黄酮类化合物对abts自由基清除能力图;
图4为实施例4~8和对照例4提取的菰米中总黄酮提取量图;
图5为实施例9~12提取的菰米中总黄酮提取量图;
图6为实施例13~17提取的菰米中总黄酮提取量图;
图7为实施例18~27提取的菰米中总黄酮提取量图。
具体实施方式
本发明提供了一种利用深共熔溶剂提取菰米中黄酮类化合物的方法,包括以下步骤:
将菰米进行预处理,得到菰米粉末;
利用深共熔溶剂对所述菰米粉末进行提取后固液分离,得到黄酮提取液;
将所述黄酮提取液进行液相色谱分离,得到黄酮类化合物;
所述深共熔溶剂包括氯化胆碱、氢键给体和水;
所述氢键给体包括1,4-丁二醇、甘油或乳酸。
本发明将菰米进行预处理,得到菰米粉末。
在本发明中,所述预处理优选包括将所述菰米依次进行粉碎和干燥。本发明对于所述粉碎的方式没有特殊限定,采用本领域熟知的粉碎方式即可,具体如研磨。在本发明中,所述菰米粉末的粒径优选为40~100目,更优选为60~80目。在本发明中,所述干燥的温度优选为30~40℃,更优选为40℃;本发明对于所述干燥的时间没有特殊限定,干燥至粉碎后的菰米颗粒至恒重即可。在本发明中,所述菰米粉末优选为在-10~-20℃条件下避光保存。
得到菰米粉末后,本发明利用深共熔溶剂对所述菰米粉末进行提取后固液分离,得到黄酮提取液;所述深共熔溶剂包括氯化胆碱、氢键给体和水;所述氢键给体包括1,4-丁二醇、甘油或乳酸,更优选为1,4-丁二醇或甘油、最优选为1,4-丁二醇。
在本发明中,所述深共熔溶剂中氯化胆碱和氢键给体的摩尔比优选为1:(0.5~7),更优选为1:(1~6),最优选为1:(5.5~6.8)。在本发明中,所述深共熔溶剂中水的含量为10~50wt%,更优选为20~50wt%,最优选为30wt%或40wt%。本发明对于所述水没有特殊限定,采用本领域熟知的水即可,具体如去离子水、蒸馏水、超纯水或高纯水。
在本发明中,所述深共熔溶剂的制备方法优选包括以下步骤:将氯化胆碱和氢键给体进行第一混合,然后加入水进行第二混合,得到深共熔溶剂。在本发明中,所述第一混合和第二混合的方式优选为搅拌混合;所述搅拌混合的转速优选为200~800rpm,更优选为350~550rpm;所述第一混合的温度优选为45~80℃,更优选为60~80℃,最优选为80℃;所述第一混合的时间优选为30~360min,更优选为60~240min;所述第二混合的温度优选为25~35℃,时间优选为10~60min。在本发明中,所述深共熔溶剂为稳定、均匀且透明的液体。本发明提供的深共熔溶剂为极性强的提取剂,能高效破除菰米细胞壁,促进菰米黄酮类化合物的溶解,而且深共熔溶剂无毒、可生物降解、不产生二次污染,绿色环保,而且可回收重复利用,大大降低了提取成本,以该提取剂对菰米中黄酮类化合物的提取率效高、检测限低。
在本发明中,所述搅拌优选采用ika磁力搅拌器(ika公司,德国)进行。
在本发明中,所述菰米粉末和深共熔溶剂的料液比优选为10~100mg/ml,更优选为20~100mg/ml,最优选为30mg/ml、40mg/ml、50mg/ml、60mg/ml、70mg/ml或80mg/ml。
在本发明中,称质量采用的天平优选为bsa124s-cw电子天平(感率0.0001g,赛多利斯科学仪器北京有限公司,中国)。
在本发明中,所述提取的方式为优选超声提取。在本发明中,所述提取的温度优选为30~60℃,更优选为40~60℃,最优选为50℃;所述提取的时间优选为1~20min,更优选为5~15min,最优选为10min。在本发明中,所述超声提取的功率优选为120~600w,更优选为150~500w,最优选为200w、300w或400w;所述超声提取的频率优选为20~25khz,更优选为21~25khz,最优选为22khz、23khz或24khz。在本发明中,所述超声提取优选在kq-500gvdv型双拼恒温数控超声波发生器(昆山市超声仪器有限公司,中国)中进行。
在本发明中,所述固液分离的方式优选为离心分离,所述离心分离的转速优选为2500~3000rpm,更优选为2600~3000rpm,最优选为3000rpm;所述离心分离的时间优选为5~10min,更优选为10min。
得到黄酮提取液后,本发明将所述黄酮提取液进行液相色谱分离,得到黄酮类化合物。
在本发明中,所述黄酮类化合物优选包括儿茶素、原花青素和槲皮素。
本发明优选将所述黄酮提取液用甲醇稀释,过滤后再进行液相色谱分离。
在本发明中,所述黄酮提取液和甲醇的体积比优选为1:(1~4),更优选为1:(2~4),最优选为1:(3~4)。在本发明中,所述过滤用滤膜的孔径优选为0.22μm。
在本发明中,所述液相色谱的检测条件包括:流动相a优选为乙腈-乙酸混合溶液,所述乙腈-乙酸混合溶液中乙酸的体积分数优选为0.1%;流动相b优选为乙酸的水溶液,所述乙酸的水溶液中乙酸的体积分数优选为0.1%;梯度淋洗程序优选为:梯度淋洗程序:0~5minn内流动相a的体积百分数从5%增加至10%,5~7min内流动相a的体积百分数从10%增加至20%,7~8min内流动相a的体积百分数从20%增加60%,8~9min内流动相a的体积百分数从60%增加至100%,9~10min内流动相a的体积百分数从100%降低至5%,10~12min内流动相a的体积百分数保持为95%;流速为0.3ml/min;进样量为1μl;色谱柱温度为25℃;流速优选为0.3ml/min;进样量优选为1μl;色谱柱优选为acquityuplcbehc18column(50mm×2.1mm,1.7μm),色谱柱温度优选为25℃。
在本发明中,为了便于确认分离得到的上述5种黄酮类化合物的结构,优选采用质谱进行检测;进一步优选采用液相色谱-质谱联用(hplc-ms)进行分离和检测,采用的仪器优选为waters液相质谱联用仪(waters公司,美国)。
在本发明中,所述质谱的检测条件包括:优选为负离子化方式esi(-),质量扫描范围优选为m/z105~1500,毛细管电压优选为3000v,锥孔电压优选为25v,离子源温度优选为100℃,雾化气温度优选为200℃,锥孔气流速优选为50l/h,雾化气流速优选为400l/h。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
(1)深共熔溶剂的制备
将氯化胆碱和1,4-丁二醇按照摩尔比为1:6加入到圆底烧瓶中,在圆底烧瓶中加入磁子,采用ika磁力搅拌器在80℃条件下磁力搅拌60min,得到氯化胆碱-1,4-丁二醇混合液,在所得混合液中加入30wt%的水,得到深共熔溶剂(简写为des-1)。
(2)菰米预处理
将菰米用粉碎机研磨,在40℃条件下干燥直至恒重,将所得菰米粉末在-20℃下避光保存,备用。
(3)菰米粉末分析
采用bsa124s-cw电子天平称取菰米粉末500mg,加入10ml深共熔溶剂充分混匀,置于kq-500gvdv型双拼恒温数控超声波发生器中,在50℃、超声功率为200w、超声频率为25khz条件下超声提取15min,得到获得固液混合物,将所述固液混合物冷却至室温后置于离心机中,以3000rpm的速度离心10min,所得上清液即为黄酮类化合物提取液,将1ml所述黄酮类化合物提取液和4ml甲醇混合,将所得混合液通过0.22μm滤膜过滤,得到黄铜提取液。
(4)hplc-ms分离和检测
将所述黄铜提取液进行hplc-ms检测。
其中,液相色谱条件:流动相a(乙腈中添加0.1%乙酸,v/v)和流动相b(0.1%乙酸水溶液,v/v);梯度淋洗程序如下:0~5min,5~10%流动相a;5~7min,10~20%流动相a;7~8min,20~60%流动相a;9~10min,100~5%流动相a;10~12min,95%流动相a;流速优选为0.3ml/min;进样量优选为1μl;色谱柱为acquityuplcbehc18column(50mm×2.1mm,1.7μm),色谱柱温度为25℃;所述hplc-ms分离和检测采用的仪器优选为waters液相质谱联用仪(waters公司,美国);
质谱条件:负离子化方式esi(-);质量扫描范围m/z为105~1500;毛细管电压为3000v;锥孔电压为25v;离子源温度为100℃;雾化气温度为200℃;锥孔气流速为50l/h;雾化气流速为400l/h。
(5)标准溶液的配制
将儿茶素和甲醇混合,配制为浓度为0.5~25μg/ml的标准溶液;
将原花青素和甲醇混合,配制为浓度为0.5~20μg/ml的标准溶液;
将槲皮素和甲醇混合,配制为浓度为0.5~20μg/ml的标准溶液;
将标准溶液置于4℃条件下冷藏保存备用。
黄酮类化合物提取液中儿茶素、原花青素和槲皮素的液相质谱图如图1所示,儿茶素、原花青素和槲皮素的质谱参数结果如表1所示。
表1黄酮类化合物的质谱参数
由图1和表1可知,原花青素,儿茶素,槲皮素的保留时间分别为2.65min、3.2min和8.18min,三种物质分离度高;而且3种黄酮母离子以及子离子与标准物一致,证明分离得到原花青素,儿茶素和槲皮素。
儿茶素、原花青素和槲皮素这5种的黄酮类化合物检测结果如表2所示。
表2黄酮类化合物的检测结果
由表2可知,儿茶素的线性范围为0.5~25μg/g,原花青素和槲皮素的线性范围为0.5~20μg/g,儿茶素、原花青素和槲皮素的检出限分别为9.747ng/ml、4.360ng/ml和0.479ng/ml,三种黄酮类物质线性范围宽、检出限低、线性良好,r2均大于0.99,方法可信,重现性好。
实施例2~3
按照实施例1的方法提取黄酮类化合物和检测,与实施例1的区别在于深共熔溶剂不同,实施例1~3中深共熔溶剂组成如表3所示,儿茶素、原花青素和槲皮素这3种的黄酮类化合物的提取量如表4所示。
表3实施例1~7中深共熔溶剂组成
对照例1
按照实施例1的方法提取黄酮类化合物和采用和hplc-ms检测,与实施例1的区别在于水代替深共熔溶剂。儿茶素、原花青素和槲皮素这3种黄酮类化合物的提取量如表4所示。
对照例2
按照实施例1的方法提取黄酮类化合物和采用和hplc-ms检测,与实施例1的区别在于用无水乙醇代替深共熔溶剂。儿茶素、原花青素和槲皮素这3种的黄酮类化合物的提取量如表4所示。
对照例3
按照实施例1的方法提取黄酮类化合物和采用和hplc-ms检测,与实施例1的区别在于用70%乙醇水溶液(v/v)代替深共熔溶剂。对香儿茶素、原花青素和槲皮素这3种的黄酮类化合物的提取量如表4所示。
表4实施例1~3和对照例1~3对3种的黄酮类化合物的提取量(μg/g)
由表4可知,儿茶素的提取过程中,氯化胆碱:1,4-丁二醇深共熔溶剂、氯化胆碱:甘油深共熔溶剂和氯化胆碱:乳酸深共熔溶剂的提取效果均优于70%甲醇、70%丙酮和70%乙醇。
原花青素的提取过程中,氯化胆碱:1,4-丁二醇深共熔溶剂和氯化胆碱:甘油深共熔溶剂和氯化胆碱:乳酸深共熔溶剂的提取效果均优于70%甲醇、70%丙酮和70%乙醇。氯化胆碱:乳酸深共熔溶剂的提取效果与70%乙醇相当。
槲皮素的提取过程中,氯化胆碱:1,4-丁二醇深共熔溶剂、氯化胆碱:甘油深共熔溶剂和氯化胆碱:乳酸深共熔溶剂的提取效果均优于70%甲醇、70%丙酮和70%乙醇。
实施例1~3提取的黄酮类化合物对dpph自由基清除能力如图2所示。从图2可知,实施例1~3提取的黄酮类化合物对dpph自由基清除率分别为89±3.1%、75±2.5%和46±1.7%。表明本发明提供的方法提取的黄酮类化合物对dpph自由基清除能力优异。
实施例1~3提取的黄酮类化合物对abts自由基清除能力如图3所示。从图3可知,实施例1~3提取的黄酮类化合物对abts自由基清除率分别为85±2.9%、67±2.5%和43±1.7%。表明本发明提供的方法提取的黄酮类化合物对abts自由基清除能力优异。
实施例4~8
按照实施例1的方法提取黄酮类化合物,实施例4~8的提取条件如表5所示。
对照例4
按照实施例1的方法提取黄酮类化合物,与实施例1的不同之处在于深共熔溶剂的含水率为0%,对照例4的提取条件如表5所示。
表5实施例4~8和对照例4的提取条件
实施例4~8和对照例4提取的菰米中总黄酮提取量如图4所示。由图4可知,深共熔溶剂(des)的含水率在0wt%~50wt%范围内增加时,菰米中总黄酮提取量呈先升高后降低的趋势,含水率在30wt%时菰米中总黄酮提取量达到最高值,此时菰米中总黄酮提取量为(6.61±0.01)mg/g。
实施例9~12
按照实施例1的方法提取黄酮类化合物,实施例9~12的提取条件如表6所示。
表6实施例9~12的提取条件
实施例9~12提取的菰米中总黄酮提取量如图5所示。由图5可知,提取温度在30~50℃范围内增加时,菰米中总黄酮提取量呈上升的趋势,50℃时菰米中总黄酮提取量达到最大值,此时菰米中总黄酮提取量为(6.38±0.10)mg/g;而之后随着温度升高,菰米中总黄酮提取量略有下降,但差异并不显著(p>0.05)。
实施例13~17
按照实施例1的方法提取黄酮类化合物,实施例13~17的提取条件如表7所示。
表7实施例13~17的提取条件
实施例13~17提取的菰米中总黄酮提取量如图6所示。由图6可知,提取时间在1~10min范围内增加时,总黄酮提取量呈上升趋势,提取时间为10min时总黄酮提取量达到最大值为(7.64±0.10)mg/g;之后随着时间的延长,总黄酮提取量略有下降,但差异并不显著(p>0.05)。
实施例18~27
按照实施例1的方法提取黄酮类化合物,实施例18~27的提取条件如表8所示。
表8实施例18~27的提取条件
实施例18~27提取的菰米中总黄酮提取量如图7所示。由图7可知,料液比在10~40mg/ml范围内,总黄酮提取量呈上升趋势;料液比在40~100mg/ml范围内增加时,总黄酮提取量呈下降趋势。从节约溶剂、控制提取成本等方面考虑,选择料液比为40mg/ml,此时总黄酮提取量为(4.25±0.13)mg/g。
综上所述,本发明所采用深共熔溶剂,可以替代传统提取的甲醇、氯仿等有毒有机溶剂,有效减少提取过程中的环境污染,绿色环保,大幅降低了提取成本,适合工业化大生产。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!