一种吲哚类化合物及其制备方法和用途
本发明涉及药物化学领域,具体涉及一种吲哚类化合物及其制备方法和用途。
背景技术:
良性前列腺增生(benignprostatichyperplasia,bph)是中老年男性的常见疾病。前列腺位于膀胱的出口处,包裹着尿道,一旦增生,便会压迫尿道,从而引起尿频、尿急、尿潴留、尿失禁以及血尿等症状。
bph的治疗药物有α1-肾上腺素受体(α1-ar)拮抗剂及5α-还原酶抑制剂。
αl-ar拮抗剂适用于中低程度bph,起效快,缓解症状效果好,但只能缓解并不能从根本上解决前列腺的增生症状,αl-ar分为αla-,αlb-,αld-三种亚型,选择性αla-/αld-亚型抑制剂广泛用于抗bph,选择性抑制αlb-ar会带来心血管方面的副作用。5α-还原酶抑制剂可以显著缩小前列腺体积,但起效慢,服药周期长,患者需服用5α-还原酶抑制剂3-6个月后才能见效,1年后才有明显疗效。从作用机制、起效时间来看,两者的互补性很强,因此α1-ar和5α-还原酶双靶点抗bph药物的研究开发越来越受到重视。如多沙唑嗪和非那雄胺的联合用药已在临床广泛应用。双靶点抗bph药物的研究开发以联合用药和复方制剂为主,但同时作用于5α-还原酶和α1-ar的单一化合物却只有日本zeria制药公司有报道。
本发明公开了一种吲哚类双靶点抗良性前列腺增生化合物,如式ⅰ所示,该化合物同时作用于5α-还原酶和α1-ar,
技术实现要素:
本发明的目的在于提供一种新的吲哚类化合物及其制备方法和用途。
本发明一方面提供了一种吲哚类化合物或其药学上可接受的盐,其结构如式ⅰ所示,
其中,r1选自och3或cl,n为3、4、5或6。
本发明另一个方面提供了式i所示的吲哚类化合物或其药学上可接受的盐的制备方法,包括如下步骤:
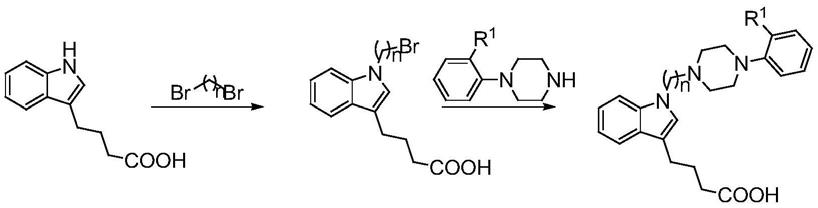
1)以3-吲哚丁酸为原料,与α,ω-二溴烷烃发生取代反应,得中间体
2)将1)所得中间体和
其中,r1选自och3或cl,n为3、4、5或6。
实验方法详述如下:
1)以无水丙酮为溶剂,碳酸钾为缚酸剂,回流条件下3-吲哚丁酸与过量α,ω-二溴烷烃反应,得中间体
2)以无水丙酮为溶剂,碳酸钾为缚酸剂,回流条件下1)所得中间体和
其中,r1选自och3或cl,n为3、4、5或6。
本发明另一个方面提供了式i所示的吲哚类化合物或其药学上可接受的盐在制备双靶点抗良性前列腺增生药物中的用途。
进一步地,所述双靶点为5α-还原酶和α1-ar。
本发明另一个方面提供了一种双靶点抗良性前列腺增生药物组合物,其中包含作为活性物质的式i所示吲哚类化合物或其药学上可接受的盐。
进一步地,所述药物剂型选自片剂。
本发明的有益效果是:吲哚类化合物或其药学上可接受的盐对前列腺增生引起的尿频、尿急、排尿踌躇不畅等症状的治疗有显著作用。
具体实施方式
为了更好地理解本发明的内容,下面结合具体实施方式对本发明内容作进一步说明,但本发明的保护内容不局限以下实施例。
实施例1
本发明所保护的吲哚类化合物的制备方法如下所示,
以3-吲哚丁酸为原料,与α,ω-二溴烷烃发生取代反应,得n11-n14,再分别和不同的取代苯基哌嗪反应,生成b1系列目标物b11-b18,如下表1所示。
表1b1系列目标物b11-b18
实施例2中间体n11-n14的合成
2.14-[1-(3-溴丙基)-1h-吲哚-3-基]-丁酸(n11)
4-[1-(3-bromo-propyl)-1h-indol-3-yl]-butyricacid
取3-吲哚丁酸305mg(1.50mmol),1,3-二溴丙烷387mg(1.92mmol),无水碳酸钾600mg于20ml无水丙酮中,回流搅拌24h。柱层析[洗脱剂v(石油醚):v(乙酸乙酯)=16:1],得浅黄色油状液体162mg,收率33%。1hnmr(400mhz,cdcl3)δ8.06(s,1h,cooh),7.65-7.00(m,5h,indole-h),4.24(t,j=6.4hz,2h,nch2),3.47(t,j=6.6hz,2h,brch2),2.86(t,j=7.4hz,2h,ch2ch2ch2cooh),2.44(t,j=7.4hz,2h,ch2cooh),2.23-2.05(m,4h,ch2ch2cooh,brch2ch2).esims:m/z=346.6[m+na]+.
2.24-[1-(4-溴丁基)-1h-吲哚-3-基]-丁酸(n12)
4-[1-(4-bromo-butyl)-1h-indol-3-yl]-butyricacid
取3-吲哚丁酸250mg(1.23mmol),1,4-二溴丁烷291mg(1.35mmol),合成方法同n11,得浅黄色油状液体133mg,收率31.9%。1hnmr(400mhz,cdcl3)δ8.01(s,1h,cooh),7.64-7.00(m,5h,indole-h),4.12(t,j=6.4hz,2h,nch2),3.45(t,j=6.6hz,2h,brch2),2.85(t,j=7.4hz,2h,ch2ch2ch2cooh),2.42(t,j=7.4hz,2h,ch2cooh),2.14-1.75(m,6h,ch2ch2cooh,brch2ch2ch2).esims:m/z=360.9[m+na]+.
2.34-[1-(5-溴戊基)-1h-吲哚-3-基]-丁酸(n13)
4-[1-(5-bromo-pentyl)-1h-indol-3-yl]-butyricacid
取3-吲哚丁酸300mg(1.48mmol),1,5-二溴戊烷372mg(1.62mmol),合成方法同n11,得浅黄色油状液体267mg,收率51.3%。1hnmr(400mhz,cdcl3)δ8.38(s,1h,cooh),7.69-6.98(m,5h,indole-h),4.15(t,j=6.5hz,2h,nch2),3.44(t,j=6.8hz,2h,brch2),2.90(t,j=7.4hz,2h,ch2ch2ch2cooh),2.49(t,j=7.4,3.0hz,2h,ch2cooh),2.18-1.47(m,8h,ch2ch2cooh,brch2ch2ch2-ch2).esims:m/z=374.5[m+na]+.
2.44-[1-(6-溴己基)-1h-吲哚-3-基]-丁酸(n14)
4-[1-(6-bromo-hexyl)-1h-indol-3-yl]-butyricacid
取3-吲哚丁酸300mg(1.48mmol),1,6-二溴己烷392mg(1.62mmol),合成方法同n11,得浅黄色油状液体217mg,收率40.2%。1hnmr(400mhz,cdcl3)δ8.00(s,1h,cooh),7.63-7.02(m,5h,indole-h),4.08(t,j=6.6hz,2h,nch2),3.42(t,j=6.8hz,2h,brch2),2.84(t,j=7.4hz,2h,ch2ch2ch2cooh),2.41(t,j=7.4hz,2h,ch2cooh),2.13-1.36(m,10h,ch2ch2cooh,brch2ch2ch2ch2-ch2).esims:m/z=389.1[m+na]+.
实施例3目标物b11-b18的合成
3.14-(1-{3-[4-(2-甲氧基-苯基)-哌嗪-1-基]-丙基}-1h-吲哚-3-基)-丁酸(b11)
4-(1-{3-[4-(2-methoxy-phenyl)-piperazin-1-yl]-propyl}-1h-indol-3-yl)-butyricacid
取4-[1-(3-溴丙基)-1h-吲哚-3-基]-丁酸n1150mg(0.154mmol),邻甲氧基苯基哌嗪58mg(0.302mmol),无水碳酸钾100mg于15ml无水丙酮中,回流搅拌24h。滤液柱层析[洗脱剂v(石油醚):v(乙酸乙酯)=2:1],得黄色黏稠液体41mg,收率63.1%。1hnmr(400mhz,cdcl3)δ8.27(s,1h,cooh),7.64-6.85(m,9h,arh,indole-h),4.17(t,j=6.4hz,2h,ch2-indolen),3.89(s,3h,och3),3.14(brs,4h,piperazine-h),2.85(t,j=7.4hz,2h,ch2ch2ch2cooh),2.70(brs,4h,piperazine-h),2.52(t,j=7.2hz,2h,piperazine-ch2),2.42(t,j=7.4hz,2h,ch2cooh),2.14-1.85(m,4h,ch2ch2cooh,piperazine-ch2ch2).esims:m/z=436.6[m+h]+,458.6[m+na]+.
3.24-(1-{3-[4-(2-氯-苯基)-哌嗪-1-基]-丙基}-1h-吲哚-3-基)-丁酸(b12)
4-(1-{3-[4-(2-chloro-phenyl)-piperazin-1-yl]-propyl}-1h-indol-3-yl)-butyricacid
取4-[1-(3-溴丙基)-1h-吲哚-3-基]-丁酸n1150mg(0.154mmol),邻氯苯基哌嗪59mg(0.301mmol),合成方法同b11。得黄色黏稠液体54mg,收率81.8%。1hnmr(400mhz,cdcl3)δ8.07(s,1h,cooh),7.64-6.96(m,9h,arh,indole-h),4.16(t,j=6.5hz,2h,ch2-indolen),3.11(brs,4h,piperazine-h),2.85(t,j=7.4hz,2h,ch2ch2ch2cooh),2.67(brs,4h,piperazine-h),2.53(t,j=7.2hz,2h,piperazine-ch2),2.42(t,j=7.4hz,2h,ch2cooh),2.16-1.81(m,4h,ch2ch2-cooh,piperazine-ch2ch2).esims:m/z=440.4[m+h]+,462.4[m+na]+.
3.34-(1-{4-[4-(2-甲氧基-苯基)-哌嗪-1-基]-丁基}-1h-吲哚-3-基)-丁酸(b13)
4-(1-{4-[4-(2-methoxy-phenyl)-piperazin-1-yl]-butyl}-1h-indol-3-yl)-butyricacid
取4-[1-(4-溴丁基)-1h-吲哚-3-基]-丁酸n1251mg(0.151mmol),邻甲氧基苯基哌嗪58mg(0.302mmol),合成方法同b11。得黄色黏稠液体33mg,收率48.5%。1hnmr(400mhz,cdcl3)δ8.15(s,1h,cooh),7.63-6.86(m,9h,arh,indole-h),4.11(t,j=6.4hz,2h,ch2-indolen),3.88(s,3h,och3),3.12(brs,4h,piperazine-h),2.84(t,j=7.4hz,2h,ch2ch2ch2cooh),2.67(brs,4h,piperazine-h),2.45(t,j=7.2hz,2h,piperazine-ch2),2.40(t,j=7.4hz,2h,ch2cooh),2.13-1.58(m,6h,ch2ch2cooh,piperazine-ch2ch2ch2).esims:m/z=450.6[m+h]+.
3.44-(1-{4-[4-(2-氯-苯基)-哌嗪-1-基]-丁基}-1h-吲哚-3-基)-丁酸(b14)
4-(1-{4-[4-(2-chloro-phenyl)-piperazin-1-yl]-butyl}-1h-indol-3-yl)-butyricacid
取4-[1-(4-溴丁基)-1h-吲哚-3-基]-丁酸n1251mg(0.151mmol),邻氯苯基哌嗪59mg(0.301mmol),合成方法同b11。得黄色黏稠液体39mg,收率57.4%。1hnmr(400mhz,cdcl3)δ8.07(s,1h,cooh),7.63-6.95(m,9h,arh,indole-h),4.12(t,j=6.5hz,2h,ch2-indolen),3.11(brs,4h,piperazine-h),2.84(t,j=7.4hz,2h,ch2ch2ch2cooh),2.66(brs,4h,piperazine-h),2.46(t,j=7.2hz,2h,piperazine-ch2),2.41(t,j=7.4hz,2h,ch2cooh),2.14-1.57(m,6h,ch2ch2cooh,piperazine-ch2ch2ch2).esims:m/z=455.3[m+h]+.
3.54-(1-{5-[4-(2-甲氧基-苯基)-哌嗪-1-基]-戊基}-1h-吲哚-3-基)-丁酸(b15)
4-(1-{5-[4-(2-methoxy-phenyl)-piperazin-1-yl]-pentyl}-1h-indol-3-yl)-butyricacid
取4-[1-(5-溴戊基)-1h-吲哚-3-基]-丁酸n1353mg(0.151mmol),邻甲氧基苯基哌嗪58mg(0.302mmol),合成方法同b11。得黄色黏稠液体47mg,收率67.1%。1hnmr(400mhz,cdcl3)δ8.30(s,1h,cooh),7.64-6.84(m,9h,arh,indole-h),4.10(t,j=6.4hz,2h,ch2-indolen),3.89(s,3h,och3),3.15(brs,4h,piperazine-h),2.85(t,j=7.4hz,2h,ch2ch2ch2cooh),2.70(brs,4h,piperazine-h),2.48-2.38(m,4h,piperazine-ch2,ch2cooh),2.15-1.38(m,8h,ch2ch2cooh,piperazine-ch2ch2ch2ch2).negativeesims:m/z=462.3[m-h]-.
3.64-(1-{5-[4-(2-氯-苯基)-哌嗪-1-基]戊基}-1h-吲哚-3-基)-丁酸(b16)
4-(1-{5-[4-(2-chloro-phenyl)-piperazin-1-yl]-pentyl}-1h-indol-3-yl)-butyricacid
取4-[1-(5-溴戊基)-1h-吲哚-3-基]-丁酸n1353mg(0.151mmol),邻氯苯基哌嗪59mg(0.301mmol),合成方法同b11。得黄色黏稠液体41mg,收率58.6%。1hnmr(400mhz,cdcl3)δ8.11(s,1h,cooh),7.63-6.95(m,9h,arh,indole-h),4.09(t,j=6.4hz,2h,ch2-indolen),3.11(brs,4h,piperazine-h),2.84(t,j=7.4hz,2h,ch2ch2ch2cooh),2.67(brs,4h,piperazine-h),2.49-2.36(m,4h,piperazine-ch2,ch2cooh),2.13-1.37(m,8h,ch2ch2cooh,piperazine-ch2ch2-ch2ch2).esims:m/z=468.6[m+h]+.
3.74-(1-{6-[4-(2-甲氧基-苯基)-哌嗪-1-基]-己基}-1h-吲哚-3-基)-丁酸(b17)
4-(1-{6-[4-(2-methoxy-phenyl)-piperazin-1-yl]-hexyl}-1h-indol-3-yl)-butyricacid
取4-[1-(6-溴己基)-1h-吲哚-3-基]-丁酸n1455mg(0.149mmol),邻甲氧基苯基哌嗪58mg(0.302mmol),合成方法同b11。得黄色黏稠液体53mg,收率73.6%。1hnmr(400mhz,cdcl3)δ8.29(s,1h,cooh),7.63-6.84(m,9h,arh,indole-h),4.09(t,j=6.4hz,2h,ch2-indolen),3.88(s,3h,och3),3.21(brs,4h,piperazine-h),2.84(t,j=7.4hz,2h,ch2ch2ch2cooh),2.80(brs,4h,piperazine-h),2.52(t,j=7.2hz,2h,piperazine-ch2),2.41(t,j=7.4hz,2h,ch2cooh),2.13-1.33(m,10h,ch2ch2cooh,piperazine-ch2ch2ch2ch2ch2).esims:m/z=477.4[m+h]+.
3.84-(1-{6-[4-(2-氯-苯基)-哌嗪-1-基]-己基}-1h-吲哚-3-基)-丁酸(b18)
4-(1-{6-[4-(2-chloro-phenyl)-piperazin-1-yl]-hexyl}-1h-indol-3-yl)-butyricacid
取4-[1-(6-溴己基)-1h-吲哚-3-基]-丁酸n1455mg(0.149mmol),邻氯苯基哌嗪59mg(0.301mmol),合成方法同b11。得黄色黏稠液体58mg,收率79.5%。
1hnmr(400mhz,cdcl3)δ8.10(s,1h,cooh),7.63-6.96(m,9h,arh,indole-h),4.09(t,j=6.4hz,2h,ch2-indolen),3.12(brs,4h,piperazine-h),2.84(t,j=7.4hz,2h,ch2ch2ch2cooh),2.67(brs,4h,piperazine-h),2.48-2.38(m,4h,piperazine-ch2,ch2cooh),2.13-1.53(m,10h,ch2ch2cooh,piperazine-ch2-ch2ch2ch2ch2).esims:m/z=481.1[m+h]+.
实施例4生物活性研究
4.1α1-ar抑制活性测定
4.1.1检测原理简述
α1-ar是一类g蛋白偶联受体,可以通过检测受体激动后细胞内钙离子和下游产物一磷酸肌醇浓度的定量变化进行活性筛选。α1-ar有α1a、α1b、α1d三种亚型,前列腺中主要存在的是α1a及α1d亚型,α1b-ar的含量很少,因此,选择性α1a-及α1d-ar拮抗剂具有更为显著的疗效。
g蛋白偶联受体中的gq分类,级联激活过程中磷脂酶c(plc)激活会触发磷酸肌醇(ip)通路。但是用氯化锂阻断降解途径后,三磷酸肌醇(ip3)会转化为一磷酸肌醇(ip1)堆积于细胞中,可以作为定量检测受体激活程度的标志物。本实验采用均相时间分辨荧光的方法,通过定量检测α1a、α1b、α1d稳转细胞株中ip1的变化情况,来计算待测样品的抑制活性。
4.1.2材料和方法
α1a–cho、α1b–cho、α1d–cho细胞株
1)细胞培养
细胞的贴壁度要达到80%,达到对数生长期,用温和的pbs冲洗细胞一次,用0.5mmedta消化细胞。用1000rpm离心5分钟。停止后用完全培养基轻吹制细胞悬液。对细胞计数,取细胞悬液到5ml培养基中,使细胞浓度达到7.5×105cells/ml,将此细胞悬液加入到t25培养瓶中,让细胞在37℃/5%co2下过夜以进行培养。
2)加样和检测
以11μm为最高终浓度ip1溶液按4倍梯度稀释10μl/孔加入384孔的白色浅孔板中,用于制备标准曲线。
最高终浓度为10μm的供试品按4倍梯度依次稀释成8个浓度,供试品溶液按每个浓度3个复孔,5μl/孔分别加入384白色浅孔板中,接着加入配制好的的细胞稀释液5μl(20000cells/well)。将384白色浅孔板在500rpm下离心1min,使试剂混合均匀以充分反应。激动剂肾上腺素终浓度为40μm(ec80),每孔2.5μl加入上述对应的含供试品和细胞悬液的384孔板中。为防止试剂蒸发造成损失,将topseal-a膜贴于板面并将板放于37℃,5%co2下使之孵育60min。
向以上各孔中加入10μl的ip1-d2/anti-ip1混合液终止反应,将384白色浅孔板在500rpm下离心1min使试剂混合均匀以充分反应。重新贴上topseal-a膜并将板放于室温下继续孵育60min。揭去topseal-a膜,将板放于设定好程序的paradigm检测仪上检测,测定获得每个孔的荧光强度值,求得复孔的平均值,以荧光强度值-供试品浓度半对数作图,拟合曲线以graphpadprism5软件计算得到ic50,结果见表3。
4.25α-还原酶抑制率测定
4.2.1活性测试主要试剂
睾酮t(sigma),用dmso(sigma)溶解配成20mm母液,再用pbs稀释至500μmol/l还原性辅酶nadph(loche)用ph8.5tris-hcl缓冲液配至12mmol/l
酶反应缓冲液(buffer):tris-hcl(10mmol/l),edta(1.5mmol/l),mgcl2(5mmol/l),dtt(0.5mmol/l)
非那雄胺(sigma)
4.2.2活性测试主要仪器
玻璃匀浆器,酶标仪(safire,tecan)
sovell高速低温离心机(modest21,美国索福公司)
beckman超速低温离心机;旋涡混合器(mvs-1,北京北德科学器材有限公司)
生化培养箱;电子天平(bs210s,北京赛多利斯有限公司)
4.2.3活性测试方法
(一)甾体5α-还原酶的制备
取3只雌性sd大鼠(体重300g左右),禁食一夜后取肝脏,静脉灌流并浸入pbs液(ph7.2)中,洗净后每份lg左右,在冰台上剪碎(3mm大小),加3倍体积的pbs液,冰浴中用玻璃匀浆器在冰水浴中匀浆。操作过程中应保持低温,所用试剂和用品也须低温。将匀浆液用高速离心机10000g×30min离心,小心提取上清液。将清液用超速离心机100000g×lh离心,倒掉上清,将沉淀重悬于pbs(含30%甘油),得微粒体悬浊液。置于-80℃冰箱保存备用,如此可保存六个月。
(二)酶活性的测定
5α-还原酶体外筛选模型的体系组成如表2所示,以96孔板进行测定。5α-还原酶提取自大鼠的肝脏,浓度为1mg/ml,加样量为30μl/孔;供试品最高终浓度为20μm,按10倍梯度依次稀释成8个浓度后分别加样,5μl/孔,阳性对照非那雄胺终浓度为590nm,所有样品作3个平行孔用于检测;nadph终浓度为80μm,6μl/孔;睾酮终浓度为20μm,6μl/孔;最后一缓冲液至150μl,96孔板震荡均匀后,放入酶标仪中37℃反应10min,检测条件为激发波长340nm,发射波长460nm,37℃。测定10min内荧光衰减速率,将各孔荧光衰减速率δf/min减去无睾酮孔,即阳性对照孔,可得该各个检测孔的反应速率(velocity);再用无供试品孔的反应速率减去供试品孔的反应速率,该差值除以无供试品孔的反应速率即为各供试品的抑制百分率。以抑制百分率-供试品浓度半对数作图,拟合曲线以graphpadprism5软件计算得到ic50。
表25α-还原酶筛选体系
4.2.4实验结果
采用上述方法对8个目标化合物进行了5α-还原酶体外抑制率的测定。ic50越小,表明对5α-还原酶的抑制能力越强,结果见表3。
表3目标化合物的ic50
从表3活性数据可看出,目标化合物b1-4-och3、b1-5-cl具有较好的双靶点活性,它们对5α-还原酶的抑制剂活性(ic50分别为567.9nm,612.3nm)与非那雄胺对5α-还原酶的抑制剂活性相当(ic50分别为590.0nm);而且它们对α1a-ar具有良好的选择性拮抗作用(ic50分别为20.8nm,32.9nm)。从以上数据可看出,b1-4-och3、b1-5-cl是良好的α1-ar及5α-还原酶双靶点抑制剂。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!