用于筛选对内皮糖萼相关疾病具有预防和治疗活性的化合物的方法和装置与流程
相关专利的交叉引用
本申请要求2018年12月12日提交的美国临时申请号62/778,776的优先权,出于所有目的将所述临时申请以引用的方式全部并入本文。
背景技术:
心血管疾病(cvs)仍是人类的头号杀手,因此也是世界上对人类健康最大的威胁。cvs的根本原因之一是动脉粥样硬化。动脉粥样硬化的标志是由于对内皮损伤的炎症反应导致动脉壁上形成动脉粥样化或动脉粥样化斑块。最新研究表明,内皮糖萼的损害是动脉粥样硬化发病机理中最早的事件。
内皮糖萼是位于包括动脉、静脉和毛细血管在内的所有血管的内表面上的薄凝胶层。内皮糖萼包含蛋白聚糖、糖胺聚糖、糖蛋白和一些对接的血清蛋白。内皮糖萼起着重要作用,并有助于维持血管稳态和健康。内皮糖萼可以调节血管通透性,维持正常血管张力,为内皮提供保护性屏障,抑制细胞粘附和血栓形成,并介导血流剪切应力以用于信号转导。
内皮糖萼通常在cvs中受损,尤其是在危重病人中。其后果包括内皮糖萼的屏障功能减弱或丧失,以及内皮通透性增加,水、电解质和胶体平衡异常。低密度脂蛋白(ldl)粘附在内皮细胞表面并渗入内皮下间隙。内皮糖萼的损害也会改变一些抗凝因子的粘附性和活性,从而促进血栓形成。这些变化会增加发生cvs和与cvs相关联的急性事件的风险。可以认识到,维持内皮糖萼的完整性可以是预防和治疗cvs的创新方法。
技术实现要素:
在一个实例中,微流控芯片可以包括至少一个多室流动组件,所述至少一个多室流动组件包括多个微通道。多个微通道可以包括第一微通道,所述第一微通道包括:第一入口;第一出口;以及与第一入口和第一出口流体连接的第一腔室。多个微通道可以包括第二微通道,所述第二微通道包括:第二入口;第二出口;以及与第二入口和第二出口流体连接的第二腔室。至少一个多室流动组件可以包括沿第一微通道和第二微通道之间的纵向界面定向的多孔生物相容性膜。多孔生物相容性膜是可渗透的,以用于使生物分子通过多孔生物相容性膜从第一腔室向第二腔室运动。
在一个实例中,使具有内皮糖萼的内皮细胞生长的方法可以使用微流控芯片。所述方法可以包括将内皮细胞接种在多孔生物相容性膜上。所述方法可以包括在co2细胞培养箱中,在低流速的泵送细胞培养基情况下,使内皮细胞在多孔生物相容性膜表面上生长至融合度为80%或更高。所述方法可以包括将细胞培养基的流速增加至高流速,以模拟体内的血流剪切应力,从而增加内皮细胞上的内皮糖萼生长。所述方法可以包括测量内皮糖萼的厚度和完整性中的至少一种。
因此,已经相当广泛地概述了本发明的更重要的特征,以使得可以更好地理解以下的详细描述,并且可以更好地理解本发明对本领域的贡献。通过以下结合附图和权利要求书对本发明的详细描述,本发明的其他特征将变得更加清楚,或者可以通过本发明的实施而获悉。
附图说明
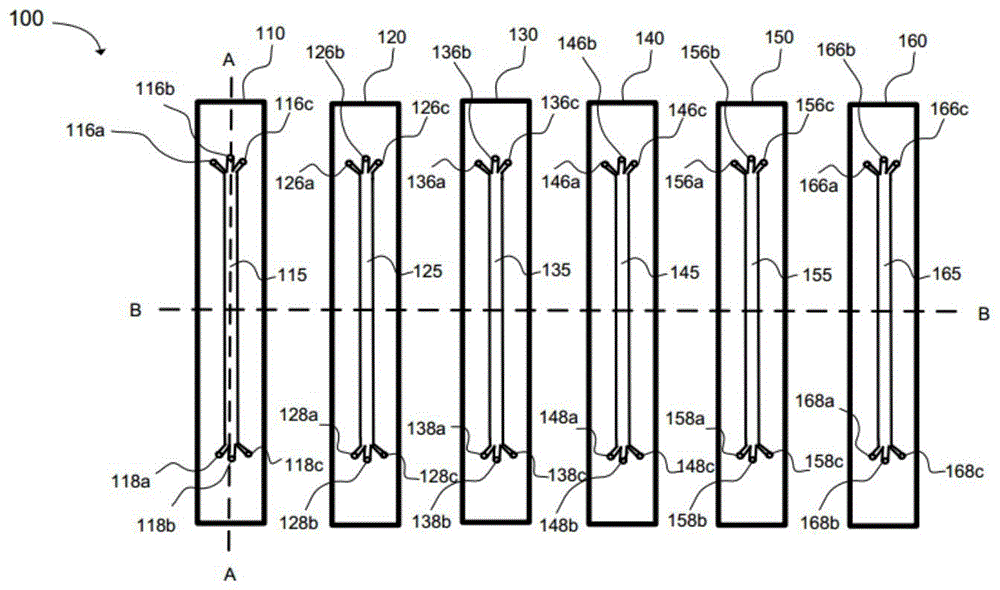
图1示出了根据一个实例的包括多室流动组件的微流控芯片的微结构;
图2示出了根据图1的包括多室流动组件的微流控芯片的沿a-a的侧面剖视图;
图3示出了根据图1的包括多室流动组件的微流控芯片的沿b-b的侧面剖视图;
图4示出了根据一个实例的包括多室流动组件的微流控芯片的微结构;
图5示出了根据一个实例的包括多室流动组件的微流控芯片的微结构,所述多室流动组件包含内皮细胞;
图6a和6b示出了:根据一个实例的在正常共聚焦显微镜下的人脐静脉内皮细胞(huvec)形态(a);和根据一个实例的内皮细胞核(蓝色)和糖萼(绿色)的荧光染色(b);
图7描绘了根据一个实例的3种葡聚糖穿过具有糖萼的内皮的渗透率;
图8a-8f示出了:根据一个实例的在共聚焦显微镜下具有正常葡萄糖水平的人脐静脉内皮细胞(huvec)形态(a);根据一个实例的在共聚焦显微镜下具有正常葡萄糖水平的细胞核(b);根据一个实例的在共聚焦显微镜下具有正常葡萄糖水平的糖萼(c);根据一个实例的在共聚焦显微镜下具有高葡萄糖水平的huvec形态(d);根据一个实例的在共聚焦显微镜下具有高葡萄糖水平的细胞核(e);以及根据一个实例的在共聚焦显微镜下具有高葡萄糖水平的糖萼(f);
图9描绘了根据一个实例的在正常葡萄糖条件和高葡萄糖条件下,内皮糖萼的小麦胚芽凝集素异硫氰酸酯缀合物(wga-fitc)的平均荧光强度;
图10a-10i示出了:根据一个实例的在共聚焦显微镜下具有正常葡萄糖水平的人脐静脉内皮细胞(huvec)形态(a);根据一个实例的在共聚焦显微镜下具有正常葡萄糖水平的细胞核(b);根据一个实例的在共聚焦显微镜下具有正常葡萄糖水平的糖萼(c);根据一个实例的在共聚焦显微镜下具有高葡萄糖水平的huvec形态(d);根据一个实例的在共聚焦显微镜下具有高葡萄糖水平的细胞核(e);以及根据一个实例的在共聚焦显微镜下具有高葡萄糖水平的糖萼(f);根据一个实例的在共聚焦显微镜下在硫酸乙酰肝素存在下具有高葡萄糖水平的huvec形态(g);根据一个实例的在共焦显微镜下在硫酸乙酰肝素存在下具有高葡萄糖水平的细胞核(h);以及根据一个实例的在共焦显微镜下在硫酸乙酰肝素存在下具有高葡萄糖水平的糖萼(i);
图11描绘了根据一个实例的在正常葡萄糖条件、高葡萄糖条件和高葡萄糖与异硫氰酸酯条件下,内皮糖萼的异硫氰酸酯缀合物(fitc)葡聚糖的平均荧光强度;
图12描绘了根据一个实例的包括多室流动组件的微流控芯片的结构;并且
图13描绘了根据一个实例的使用微流控芯片使具有内皮糖萼的内皮细胞生长的方法。
提供这些附图是为了说明本发明的各个方面,而不意图在尺寸、材料、构造、布置或比例方面限制范围,除非权利要求另有限制。
具体实施方式
尽管充分详细地描述了这些示例性实施方案以使本领域技术人员能够实施本发明,但是应当理解,可以实现其他实施方案并且可以对本发明进行各种改变而不背离本发明的精神和范围。因此,本发明的实施方案的以下更详细的描述并非旨在限制所要求保护的本发明的范围,而是仅出于说明的目的并非限于描述本发明的特征和特点而提出,以阐明本发明的最佳操作方式,并使本领域技术人员充分地实施本发明。因此,本发明的范围仅由所附权利要求书限定。
定义
在描述和要求保护本发明时,将使用以下术语。
除非上下文另外明确指出,否则单数形式“一个/种(a/an)”和“所述(the)”包括复数的提及对象。因此,例如,提及“颗粒”包括提及一种或多种这样的材料,并且提及“流动”是指一个或多个这样的步骤。
如本文所使用,术语“约”用于提供与给定术语、度量或值相关联的灵活性和不精确性。本领域技术人员可以容易地确定具体变量的灵活性程度。然而,除非另有说明,否则术语“约”通常表示灵活性小于2%,最通常小于1%,在一些情况下小于0.01%。
如本文中所使用的关于所标识的特性或情况,“基本上”是指足够小的偏差程度以至于不能可测量地减损所标识的特性或情况。在一些情况下,允许的精确偏差程度可取决于特定的上下文。
如本文所使用,“相邻”是指两个结构或元件接近。具体地说,被标识为“相邻”的元件可以邻接或连接。此类元件也可以彼此靠近或接近而不必彼此接触。在一些情况下,接近的精确程度可取决于特定的上下文。
如本文所使用,“融合”是指被粘附细胞覆盖的细胞培养室的界面表面的百分比。在一个实例中,如果细胞培养室的界面的表面积为10个平方厘米,并且细胞培养室的界面的约8个平方厘米被粘附细胞覆盖,则细胞培养室的融合度为约80%。
如本文所使用,“完整性”或“膜完整性”是指通过直接测试或间接测试测量的膜完整性。通过直接测试测量的膜完整性可以是指粘附到膜上的内皮层的健康程度或损害程度。通过间接测试测量的膜完整性可以是指膜的通透性的量、糖萼的长度、厚度(密度)和/或总体积(例如,通过荧光光谱法)。
如本文所使用,为了方便起见,可以在共同的列表中呈现多个项目、结构要素、组成要素和/或材料。然而,这些列表应当被解释为好像列表中的每个成员都被单独识别为单独的且唯一的成员。因此,在没有相反指示的情况下,仅基于它们出现在共同群组中,这样的列表中的任何单个成员都不应当被解释为实际上等同于同一列表的任何其他成员。
如本文所使用,术语“......中的至少一个”旨在与“......中的一个或多个”同义。例如,“a、b和c中的至少一个”明确包括仅a、仅b、仅c以及它们各自的组合。
浓度、量和其他数值数据可以在本文中以范围格式呈现。应当理解,这样的范围格式仅是为了方便和简洁而使用,并且应当灵活地解释为不仅包括明确叙述为范围极限的数值,而且还包括涵盖在所述范围内的所有单独的数值或子范围,就好像每个数值和子范围都被明确叙述一样。例如,约1至约4.5的数值范围应当被解释为不仅包括明确叙述的1至约4.5的极限值,而且还包括单独的数字(诸如2、3、4)和子范围(诸如1至3、2至4等)。相同的原理适用于仅叙述一个数值的范围,诸如“小于约4.5”,应当将其解释为包括所有上述的值和范围。此外,无论所描述的范围或特征的广度如何,都应当适用这种解释。
任何方法或过程权利要求中所述的任何步骤可以以任何顺序执行,并且不限于权利要求中提出的顺序。仅在特定权利要求限制中存在以下所有条件的情况下,才采用方法+功能(means-plus-function)或步骤+功能(step-plus-function)的限制:a)明确叙述“用于......的方法”或“用于......的步骤”;b)明确叙述相应的功能。在本文的描述中明确叙述了支持方法+功能的结构、材料或动作。因此,本发明的范围应当仅由所附权利要求及其合法等同物来确定,而不是由本文给出的描述和实例来确定。
下面提供本发明实施方案的初步概述,然后进一步详细描述具体实施方案。该初步概述旨在帮助读者更快地理解技术概念,但是既不旨在标识其关键或必要特征,也不旨在限制所要求保护的主题的范围。
对内皮糖萼的研究使用了体内和体外模型。体内研究涉及局部内皮糖萼完整性的成像以及全身内皮糖萼体积的确定。通过体内研究技术获得的结果被认为反映了内皮糖萼的真实情况。然而,用于研究的内皮糖萼的体内测量依赖于复杂的技术以高成本处理复杂的生物环境。这些复杂技术的侵入性质也可使得难以获得大量样本进行研究。
另一方面,体外细胞培养可以是简单的,并且易于大批量、多迭代且跨多个实验室进行。然而,细胞培养实验通常是在静态条件下进行的,并不能准确模拟内皮糖萼正常生长的动态流动条件。因此,在体外细胞培养条件下生长的内皮糖萼可以与体内观察到的内皮糖萼明显不同。这种限制会阻碍内皮糖萼研究和cvs治疗药物产品的开发。
在一个实例中,微流控芯片或芯片实验室(loc)可以在包括微米级微通道的厘米级微芯片上集成各种化学和生物学过程,诸如样品制备、反应、分离、检测、细胞培养、细胞操控、dna纯化、基因分离、抗原-抗体相互作用、药物递送、生物传感、诊断等。微流控芯片是一种微型平台,其可用于通过流量控制来执行化学和生物实验室的常规功能。微流控芯片可以包括各种特性,诸如小规模、可集成性、高通量、低能耗和减少的测试时间。
在另一个实例中,微流控芯片可以具有一些用于细胞生物学研究的独特特征。首先,微流控芯片上的微通道大小(例如,横截面宽度为10-100微米(μm))可以类似于单个细胞的微通道大小(例如,10-20μm)以简化细胞操控。第二,微流控芯片上的微通道的多维网络可以提供相对隔离的环境,这可以模拟正常生理条件下活细胞的环境。第三,微流控芯片通过并行获取大量生物信息,可以满足高通量分析的需求。第四,微流控芯片的扁平配置可以简化观察。
因此,微流控芯片可以为哺乳动物细胞培养和操控提供有用的体外平台模型,因为它可以模拟实验的生理条件。然而,使用微流控芯片来模拟内皮糖萼的变化以及所产生的血管内皮功能变化是欠缺的。可以模拟生理条件的小型化研究平台对于以下方面可以是有价值的:(a)研究内皮糖萼介导的发病机理,以及(b)筛选用于治疗目的的内皮糖萼保护和再生化合物(egprc)。
在一个实例中,微流控芯片可以包括至少一个多室流动组件,所述至少一个多室流动组件包括多个微通道。多个微通道可以包括第一微通道,所述第一微通道可以包括:第一入口;第一出口;以及与第一入口和第一出口流体连接的第一腔室。多个微通道可以包括第二微通道,所述第二微通道包括:第二入口;第二出口;以及与第二入口和第二出口流体连接的第二腔室。多室流动组件可以包括沿第一微通道和第二微通道之间的纵向界面定向的多孔生物相容性膜,其中多孔生物相容性膜是可渗透的,以用于使生物分子通过多孔生物相容性膜从第一腔室向第二腔室运动。在一些情况下,生物分子还可以基于孔隙率和相对浓度梯度或扩散驱动因素(即渗透压、温度梯度、流速等)进一步从第二腔室向第一腔室运动。
在一个实例中,可制造微流控芯片以培养形成健康内皮糖萼层的内皮细胞。所述方法可以包括使用制造的芯片作为模型来测量不同病理生理条件下内皮糖萼的动态变化和相关的生物学功能。所述模型可以被配置为充分模拟内皮细胞有效性和内皮渗透。所述模型可以被配置为筛选药理学活性化合物以保护和再生内皮糖萼(egprc)。
在一个实例中,如图1所示,微流控芯片100可以包括至少一个多室流动组件(例如,110、120、130、140、150和160)。各多室流动组件110、120、130、140、150和160可以包括多个微通道(例如,115、125、135、145、155和165)和多孔生物相容性膜(例如,参见图2和3的特征件113、123、133、143、153和163)。多个微通道可以各自包括平行的细胞培养室(例如,如图3所示的112和114;122和124;132和134;142和144;152和154;以及162和164),所述多个微通道可以各自具有至少一个入口(116a-c、126a-c、136a-c、146a-c、156a-c和166a-c)、至少一个细胞培养室(例如,112和114;122和124;132和134;142和144;152和154;以及162和164)和至少一个出口(118a-c、128a-c、138a-c、148a-c、158a-c和168a-c)。
在另一个实例中,细胞培养室112和114与入口端上的入口(116a、116b和116c)和出口端上的出口(118a、118b和118c)流体连接。如图2所示,多孔生物相容性膜可以沿多个微通道中的至少两个细胞培养室(例如,多室流动组件110中的112和114)之间的纵向界面定向,其中多孔生物相容性膜113可以是可渗透的,以允许生物分子通过多孔生物相容性膜113在至少两个细胞培养室(例如,多室流动组件110中的112和114)之间运动。当细胞以100%融合度覆盖多孔生物相容性膜113时,可以通过细胞层控制液体或生物组分的穿过。尽管设备配置可以变化,但是通道宽度通常可以在约100μm至2cm的范围内,最常见在约800μm至1cm的范围内。类似地,通道长度可以在约0.5cm至约30cm之间变化,并且通常为约1cm至10cm。
在另一个实例中,微流控芯片100可以具有包括多个板(例如,细胞培养室114的顶板和细胞培养室112的底板)的逐层结构。多个微通道可以由多室流动组件110的细胞培养室114的顶板和细胞培养室112的底板形成。互补的细胞培养室112的底板和细胞培养室114的顶板可以形成多个微通道。
在另一个实例中,尽管各种材料可以用于互补的细胞培养室114的顶板和细胞培养室112的底板,但是用于互补的细胞培养室112的底板和细胞培养室114的顶板的材料可以是透明的(例如,透明的透气聚二甲基硅氧烷(pdms))以允许对细胞培养室112和114进行光拾取(opticalinterrogation)。然而,可以使用任何生物相容性材料,只要可以维持微通道的结构完整性即可。生物相容性材料的非限制性实例可以包括聚碳酸酯、聚甲基丙烯酸甲酯(pmma)、聚丙烯酰胺(paam)、水凝胶等。
在另一个实例中,细胞培养室114的顶板和细胞培养室112的底板可以用多孔生物相容性膜113密封在一起,所述多孔生物相容性膜113位于两个细胞培养室112和114之间并将其隔开。所述密封可以是具有可拆卸组件的可逆密封,从而允许清洁或重复使用。所述密封还可以是不可逆的,例如用于一次性使用或有限次使用。可以使用各种结合方法进行密封,所述方法包括但不限于部分固化、变化的固化率、未固化的pdms粘合剂、氧等离子体和电晕放电中的至少一种。
在另一个实例中,多孔生物相容性膜113可以由生物相容性的任何合适的多孔材料形成。在一个实例中,生物相容性多孔膜113可以包含聚碳酸酯、胶原处理的聚四氟乙烯(ptfe)、聚酯等中的至少一种。多孔生物相容性膜可以包括直径为0.1至10μm范围内的孔。在另一个实例中,多孔生物相容性膜可以包括直径为0.2至1.0μm范围内的孔。尽管可以改变膜界面面积以适应所需的培养体积,但是实际表面积趋于在0.005至60cm2范围内,最常见为0.08至10cm2范围内。膜的厚度还可以基于材料和所需的孔隙率而变化。然而,作为一般准则,膜厚度可以在约10μm至约1mm的范围内,并且最常见在50μm至约500μm的范围内。
再次参考图1,至少一个多室流动组件110、120、130、140、150和160可以包括专用接种入口(例如116b、126b、136b、146b、156b或166b)和专用接种出口(例如118b、128b、138b、148b、158b或168b)。例如,可以在多个细胞培养室112或114中的至少一个中设置接种入口116b和接种出口118b,并位于入口端和出口端处。
在另一个实例中,尽管可以使用单个多室流动组件110,但是也可以希望获取多个数据点,增加通量并允许测试多种候选材料。因此,多于一个的多室流动组件110、120、130、140、150和160可以集成到每个微流控芯片100上。常见的微流控芯片100(即,基板)上的多室流动组件的数量不受物理限制;但是,通常可以在一至三个的范围内,在一些情况下为至少两个流动组件。在另一个实例中,可以通过将多个微流控芯片连接在一起来提供多个多室流动组件,使得可以连接各自具有一个或多个流动组件的多个基板以形成更大的复合设备。
在另一个实例中,微流控芯片100可以包括具有多个微通道115的多个多室流动组件110、120、130、140、150和160。第一多室流动组件110可以包括三个入口116a、116b和116c以及三个出口118a、118b和118c。第一多室流动组件110可以包括底部细胞培养室112和顶部细胞培养室114,所述底部细胞培养室112和顶部细胞培养室114由包括多孔生物相容性膜113的界面113隔开。
在另一个实例中,第二多室流动组件120可以包括三个入口126a、126b和126c以及三个出口128a、128b和128c。第二多室流动组件120可以包括底部细胞培养室122和顶部细胞培养室124,所述底部细胞培养室122和顶部细胞培养室124由多个微通道125中的包括多孔生物相容性膜123的界面123隔开。
在另一个实例中,第三多室流动组件130可以包括三个入口136a、136b和136c以及三个出口138a、138b和138c。第三多室流动组件130可以包括底部细胞培养室132和顶部细胞培养室134,所述底部细胞培养室132和顶部细胞培养室134由多个微通道135中的包括多孔生物相容性膜133的界面133隔开。
在另一个实例中,第四多室流动组件140可以包括三个入口146a、146b和146c以及三个出口148a、148b和148c。第四多室流动组件140可以包括底部细胞培养室142和顶部细胞培养室144,所述底部细胞培养室142和顶部细胞培养室144由多个微通道145中的包括多孔生物相容性膜143的界面143隔开。
在另一个实例中,第五多室流动组件150可以包括三个入口156a、156b和156c以及三个出口158a、158b和158c。第五多室流动组件150可以包括底部细胞培养室152和顶部细胞培养室154,所述底部细胞培养室152和顶部细胞培养室154由多个微通道155中的包括多孔生物相容性膜153的界面153隔开。
在另一个实例中,第六多室流动组件160可以包括三个入口166a、166b和166c以及三个出口168a、168b和168c。第六多室流动组件160可以包括底部细胞培养室162和顶部细胞培养室164,所述底部细胞培养室162和顶部细胞培养室164由多个微通道165中的包括多孔生物相容性膜163的界面163隔开。
参考图3,多孔膜(113、123、133、143、153、163)可以接种有各种类型的内皮细胞,所述内皮细胞包括但不限于,粘附在多孔生物相容性膜(113、123、133、143、153、163)上的人脐带内皮细胞(huvec)、人动脉内皮细胞(haec)、牛主动脉内皮细胞(baec)、肺微血管内皮细胞(pmvec)、肺动脉内皮细胞(paec)、人皮肤微血管内皮细胞(hdmec)等。可以将细胞接种并粘附到膜113、123、133、143、153、163的单面(例如,正面或反面)上或膜的两面(例如,正面和反面)上。在一些情况下,可以将膜的相对面上接种有不同类型细胞。
在另一个实例中,泵可以与入口(例如116a-c,126a-c、136a-c、146a-c、156a-c和166a-c)和出口(118a-c、128a-c、138a-c、148a-c、158a-c和168a-c)流体连接,以使细胞培养基通过多个细胞培养室(例如112、114、122、124、132、134、142、144、152、154、162和164)中的至少一个进行循环。所述泵可以维持模拟生物条件的跨越内皮细胞的基本连续的流动。
在另一个实例中,如图4所示,微流控芯片400的横截面可以包括:第一多室流动组件415、第二多室流动组件425、第三多室流动组件435、第四多室流动组件445、第五多室流动组件455和第六多室流动组件465。在这种情况下,入口区和出口区的通道横截面积小于主通道的横截面积(即,每个细胞培养室的合并面积)。
与图1一样,图4的每个多腔室流动组件可以包括由多孔生物相容性膜隔开的第一细胞培养室和第二细胞培养室。此外,微流控芯片400可以包括多个多室流动组件。第一多室流动组件可以包括三个入口416a、416b和416c以及三个出口418a、418b和418c。第二多室流动组件可以包括三个入口426a、426b和426c以及三个出口428a、428b和428c。第三多室流动组件可以包括三个入口436a、436b和436c以及三个出口438a、438b和438c。第四多室流动组件可以包括三个入口446a、446b和446c以及三个出口448a、448b和448c。第五多室流动组件可以包括三个入口456a、456b和456c以及三个出口458a、458b和458c。第六多室流动组件可以包括三个入口466a、466b和466c以及三个出口468a、468b和468c。
从另一个角度看,如图5所示,微流控芯片500的横截面可以包括多个微通道515,所述多个微通道515具有第一层512、第二层514和界面513,所述界面513沿纵向界面513将第一层512与第二层514隔开。界面513可以在界面513的顶面或界面513的底面上或界面的两面上包括多个内皮细胞(例如,519)。界面513可以是具有多个孔(例如,513a、513b等)的多孔生物相容性膜513。
使具有健康内皮糖萼的内皮细胞生长的方法可以包括使用本文所述的任何微流控芯片。在一个实例中,可以通过将内皮细胞519接种在多孔生物相容性膜513上来使用微流控芯片500。内皮细胞519可以在低流速泵送的培养基条件下在多孔生物相容性膜513的表面上生长到至少80%的融合度。在一些情况下,生长可以产生至少90%的融合度,并且在一些情况下,可以产生约100%的融合度。在一些情况下,生长阶段可以在co2细胞培养箱中进行。例如,腔室可以具有co2控制系统,所述系统监视并调节腔室内的co2水平。生长之后,可以将培养基的流速加速至高流速以模拟体内血流剪切应力,以用于在内皮细胞519上生长和维持内皮糖萼。内皮糖萼的厚度和完整性可以通过结合到糖萼上的小麦胚芽凝集素(wga)荧光素异硫氰酸酯缀合物(fitc)(wga-fitc)的荧光强度来测量。
在另一个实例中,接种可以在接种培养基中产生范围为1-9×104–1-9×106个细胞/毫升(ml)的细胞密度。尽管其他流速可能是合适的,但是低流速的范围可以在1-60μl/分钟之间。在另一个实例中,高流速可能足以模拟血流和血压。在一个实例中,对于16mm×10mm×0.1mm的腔室,高流速的范围可以在250-300μl/min之间。在一个实例中,可以选择流动速度以在细胞表面处实现范围为10-23达因(dyn)/平方厘米(cm2)之间的细胞剪切应力。
在另一个实例中,可以在范围为60-250μl/min之间的中等流速下用常见的细胞培养基灌注多个微通道。可以将fitc-dextrans插入多个微通道中,持续一定时间段。可以在下部通道中测量荧光强度以计算每种葡聚糖的渗透率(papp(cm/s))。内皮糖萼的厚度和完整性可以基于fitc-dextrans的渗透率来测量。
在另一个实例中,可以使用各种测量方法来测量内皮糖萼的完整性。wga-fitc是一种测量内皮糖萼完整性的直接方法,因为wga-fitc可以与糖萼中的多糖结合,并且可以用于基于3-d荧光强度确定糖萼的长度、厚度(密度)和/或总体积。然而,fitc-dextrans是一种测量糖萼完整性的间接方法,因为fitc-dextrans可以穿过糖萼,因此能够基于不同大小fitc-dextrans的通透性来测量糖萼的厚度,但不能测量糖萼的长度。
在另一个实例中,为了模拟特定条件,所述方法可以包括向细胞培养基中添加一定水平的葡萄糖,并维持高流速以模拟糖尿病性高血糖条件以产生应激糖萼。随后,可以测量内皮糖萼的应激厚度和应激完整性。可以改变特定的葡萄糖条件,但是在一种情况下,可以在范围为25-75毫摩尔(mm)之间的浓度下引入葡萄糖,并且可以将高流速维持范围为24-72小时之间的一段时间。
在另一个实例中,可以将各种浓度的不同测试化合物引入细胞培养基中。在给定的时间段内维持此类测试化合物流过细胞腔室之后,可以测量对内皮糖萼的影响。例如,可以测量测试渗透率以计算内皮糖萼的测试厚度和测试完整性,以便测量对内皮糖萼的保护性影响和/或损害。该方法可以用于筛选候选治疗化合物。
在另一个实例中,可以基于下部微通道中的荧光强度来计算不同大小的葡聚糖的渗透率,并将其与空白、阴性对照和阳性对照的渗透率进行比较。基于特定渗透率的变化,可以评估引入上部微通道中的每种化合物在保护内皮糖萼中的有效性。
在另一个实例中,筛选用于再生和恢复内皮糖萼的药理学活性化合物的方法还可以包括用不同细胞培养基灌注微通道(例如,细胞培养室),所述不同细胞培养基具有各种浓度的不同化合物但在高血糖条件下孵育huvec持续24-72小时之后不再添加葡萄糖。与其他实例一样,可以基于下部微通道中的荧光强度来计算不同葡聚糖的渗透率,并将其与空白、阴性对照和阳性对照的渗透率进行比较。基于特定渗透率的变化,可以评估引入上部微通道中的每种化合物在再生和恢复内皮糖萼中的有效性。
在另一个实例中,白细胞可以被引入细胞培养物中以允许与内皮表面接触。可以使用共聚焦显微镜来观察并确定在内皮细胞层上巡逻并粘附到内皮细胞层上的白细胞数。
在另一个实例中,可以确定白细胞的巡逻速度。作为对糖萼介导的内皮炎症的响应,对内皮糖萼的损害可以增加细胞粘附并降低细胞滚动。白细胞渗透穿过内皮细胞层也可以发生在血细胞渗出中。
在另一个实例中,平滑肌细胞可以在第二腔室中生长。可以使用微流控芯片来确定平滑肌细胞的rna表达、dna表达或蛋白质合成的变化。
因此,已经相当广泛地概述了本发明的更重要的特征,以使得可以更好地理解以下的详细描述,并且可以更好地理解本发明对本领域的贡献。通过以下结合附图和权利要求书对本发明的详细描述,本发明的其他特征将变得更加清楚,或者可以通过本发明的实施而获悉。
实施例
实施例1:逐层微流控芯片的设计
在一个实例中,微流控芯片可以具有逐层结构。顶层和底层均可以包含透明且透气的聚二甲基硅氧烷(pdms)。两个微通道板之间可以用多孔生物相容性膜可逆地密封,所述多孔生物相容性膜将两个细胞培养室隔开。多孔膜可以由任何生物相容性材料制成,诸如聚碳酸酯,并且孔的大小可以包括在0.1-10微米(μm)之间的范围。
在另一个实例中,如先前参考图1-5所讨论的,可以将至少六个多室流动组件(例如110、120、130、140、150和160)被铸在微流控芯片(例如,100)中。各多室流动组件(例如,110)可以包括:3个入口(例如116a、116b和116c);2个细胞培养室(顶部细胞培养室114和底部细胞培养室112);和3个出口(例如118a、118b和118c),尽管入口数和出口数可以变化。细胞培养室(112和114)可以与一侧面上的入口(例如,116a、116b和116c)以及另一侧面上的出口(118a、118b和118c)连接。左入口(例如,116a)和出口(例如,118a)可以连接到顶部细胞培养室114。右入口(例如,116c)和出口(例如,118c)可以连接到底部细胞培养室112。中间入口(例如,116b)和出口(例如,118b)可以连接到顶部细胞培养室114,以将内皮细胞递送到多孔生物相容性膜113上用于在静态条件下进行接种。在本实例中,可以通过与入口(例如116a、116b和116c)和出口(例如118a、118b和118b)流体相关联的阀门或其他流量控制机构来控制穿过顶部细胞培养室114和底部细胞培养室112每一个中的流量。
实施例2:芯片内部内皮细胞的接种和培养
在一个实例中,接种和培养内皮细胞的方法可以包括用移液管消化人脐静脉内皮细胞(huvec),并将细胞密度调节至适当水平(例如1-9×104–1-9×106个细胞/毫升(ml))。接种和培养内皮细胞的方法还可以包括通过中间入口(例如,116b)用芯片内部的多孔生物相容性膜113将huvec递送至上部细胞培养室114,并将芯片移动到co2细胞培养箱内部。接种和培养内皮细胞的方法还可以包括孵育4-6小时,将芯片入口(例如116a和116c)和出口(例如118a和118c)连接到泵送的细胞培养基,并在低流速(例如1-60μl/min)情况下使细胞生长至80%融合度。接种和培养内皮细胞的方法还可以包括增加细胞培养基的流速以模拟血流的高剪切应力(例如,在这种情况下为250-300μl/min)。流速可以基于通道的大小和所需的高剪切条件而改变。可以关闭下部细胞培养室112,直到在上部细胞培养室114中引入高流速为止,并且可以在相同的高流速下用相同的细胞培养基灌注。
在另一个实例中,可以使用两种方法来评估融合内皮细胞层表面上的糖萼情况。如图6所示,一种方法可以包括使用小麦胚芽凝集素荧光素异硫氰酸酯缀合物(wga-fitc)结合糖萼凝胶层并且通过3维荧光强度测量糖萼凝胶层的长度和厚度。
在另一个实例中,另一种方法可以包括通过测量不同分子量或大小的荧光素异硫氰酸酯缀合物(fitc)葡聚糖(fitc-dextrans)的渗透率来评估内皮糖萼层的密度和完整性。在正常的生理条件下,内皮可以基于化合物的大小、电荷等选择性地通过化合物。内皮选择性可以随着厚而健康的糖萼层而增加。当内皮糖萼损害或去除时,内皮的选择性和屏障功能会受损和丧失。内皮糖萼的厚度和完整性可以通过确定不同大小的fitc-dextrans的内皮渗透,使用内皮糖萼保护和再生化合物(egprc)来进行评估和筛选。如图7所示,可以评估三种葡聚糖穿过具有健康糖萼层的内皮的渗透率。
实施例3:内皮糖萼的病理学条件的模拟
在另一个实例中,模拟内皮糖萼的病理学条件的方法可以包括在高流速(例如,在这种情况下为250-300μl/min)情况下将芯片入口(例如116a、116b和116c)连接到葡萄糖浓度范围在25-75毫摩尔(mm)之间的细胞培养基。模拟内皮糖萼的病理学条件的方法还可以包括模拟损害内皮糖萼的高血糖条件,持续24-72小时。如图8所示,可以通过wga-fitc来评估内皮糖萼层,并且如图9所描绘,可以通过fitc-dextran渗透来评估内皮糖萼层。
实施例4:内皮糖萼保护和再生化合物(egpgc)的筛选
在另一个实例中,如图10所示,筛选gprc的方法可以包括在相同的高流速(例如,在这种情况下为250-300μl/min)下通过微流控芯片100中的上部细胞培养室114和下部细胞培养室112泵送细胞培养基。筛选gprc的方法还可以包括针对上部细胞培养室114,在病理学条件(即高血糖)下,向具有fitc-dextrans的细胞培养基中添加候选内皮糖萼保护和再生化合物(egprc)。筛选gprc的方法还可以包括在24小时之后,从下部细胞培养室112收集细胞培养基并测量其荧光强度。筛选gprc的方法还可以包括计算不同fitc-dextrans的渗透率(渗透系数(papp)(厘米(cm)/秒(s)))。如图11所描绘,筛选gprc的方法还可以包括将处理组的渗透率与空白(正常血糖)、阴性对照组(高血糖)和阳性对照(具有硫酸乙酰肝素)进行比较,以确定渗透率是否增加、降低或保持不变。这些结果可以用于确定特定化合物是否保护内皮糖萼。
在另一个实例中,在高血糖条件下,可以将huvec维持高流速(例如,在这种情况下为250-300μl/min),持续24-72小时。在正常血糖条件下(细胞培养基中的葡萄糖水平正常),可以用具有其它候选egprc的新细胞培养基灌注细胞持续不同的时间段。之后,可以从下部细胞培养室112收集细胞培养基,并且可以测量细胞的荧光强度。可以计算出不同fitc-dextrans的渗透率(papp(cm/s))。可以将处理组的渗透率与空白(正常血糖)、阴性对照组(高血糖)和阳性对照(具有硫酸乙酰肝素)进行比较,以确定渗透率是否增加、降低或保持不变。前述结果可以用于确定特定化合物是否有助于内皮糖萼的再生或恢复。
实施例5:在逐层微流控芯片中评估糖萼介导的内皮功能
在另一个实例中,使用逐层微流控芯片,可以将huvec细胞接种并生长在上部细胞培养室114中的多孔生物相容性膜113的表面上。在融合度为80%之后,可以以高流速(例如,在这种情况下为250-300μl/min)将适当的细胞培养基泵送通过微通道(即细胞培养室)。可以通过添加损害内皮糖萼的已知成分来模拟不同的病理学条件,诸如添加高水平的葡萄糖来模拟糖尿病的高血糖条件。24-72小时后,可以在生理学相关的流速或流动应力下用适当的细胞培养基中的人白细胞灌注微通道。在共聚焦显微镜下可以观察到白细胞与内皮细胞之间的相互作用,诸如单核细胞粘附。可以将荧光标记的人ldl和hdl添加到灌注液中。可以观察和测量内皮糖萼和内皮细胞层的ldl和hdl粘附和渗透。下部细胞培养室112可以维持在与原始细胞培养基相同的条件下。
在另一个实例中,在不同的实验中,可以将平滑肌细胞诸如来自人胎盘的动脉平滑肌细胞接种并生长在微流控芯片100的下层细胞培养室112中。可以在与顶部细胞培养室114上相同的低流速和适当流速下,将适当的细胞培养基泵送通过微通道。内皮糖萼的变化可以引起内皮对不同化合物诸如ldl胆固醇的渗透变化。内皮细胞层也可以经历响应于内皮糖萼损害而发生的内部变化。例如,内皮糖萼可以充当流动剪切应力的信号转换器,以触发内皮细胞通过内皮一氧化氮合酶(enos)合成一氧化氮(no)。no可以扩散到平滑肌细胞中以激活可溶性鸟苷酸环化酶(sgc),从而可以导致体内平滑肌松弛。可以在共聚焦显微镜下观察到平滑肌细胞的形态变化。可以从微通道中收获平滑肌细胞以用于生物测定或原位裂解。可以使用针对蛋白质的荧光标记单克隆抗体来确定平滑肌细胞蛋白质上的内皮渗透变化,包括酶合成。可以在下部腔室中定量平滑肌细胞中的dna或rna表达的变化。
如图12所示,另一个实例提供了一种微流控芯片,所述微流控芯片包括至少一个多室流动组件,所述至少一个多室流动组件包括多个微通道。如在方框1210中,微流控芯片可以包括多个微通道中的第一微通道,所述第一微通道包括:第一入口;第一出口;以及与第一入口和第一出口流体连接的第一腔室。如在方框1220中,微流控芯片还可以包括多个微通道中的第二微通道,所述第二微通道包括:第二入口;第二出口;以及与第二入口和第二出口流体连接的第二腔室。如在方框1230中,微流控芯片还可以包括沿第一微通道和第二微通道之间的纵向界面定向的多孔生物相容性膜,其中多孔生物相容性膜是可渗透的,以用于使生物分子通过多孔生物相容性膜从第一腔室向第二腔室运动。
如图13所示,另一个实例提供了一种使用微流控芯片使具有内皮糖萼的内皮细胞生长的方法。如在方框1310中,所述方法可以包括将内皮细胞接种在多孔生物相容性膜上。如在方框1320中,所述方法可以包括在co2细胞培养箱中,在低流速的泵送细胞培养基情况下,使内皮细胞在多孔生物相容性膜表面上生长至融合度为80%或更高。如在方框1330中,所述方法可以包括将细胞培养基的流速增加至高流速,以模拟体内的血流剪切应力,从而增加内皮细胞上的内皮糖萼生长。如在方框1340中,所述方法可以包括测量内皮糖萼的厚度和完整性中的至少一种。
前面的详细描述参考具体的示例性实施方案描述了本发明。然而,将理解的是,在不背离所附权利要求书所阐述的本发明的范围的情况下,可以做出各种修改和改变。详细描述和附图应当被视为仅是说明性的,而不是限制性的,并且所有此类修改或改变(如果有的话)均旨在落入本文所描述和阐述的本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!