一种埃博霉素B发酵液的预处理方法与流程
本发明属于生物分离
技术领域:
,具体涉及一种大环内酯类抗肿瘤药物埃博霉素b发酵液的预处理方法。
背景技术:
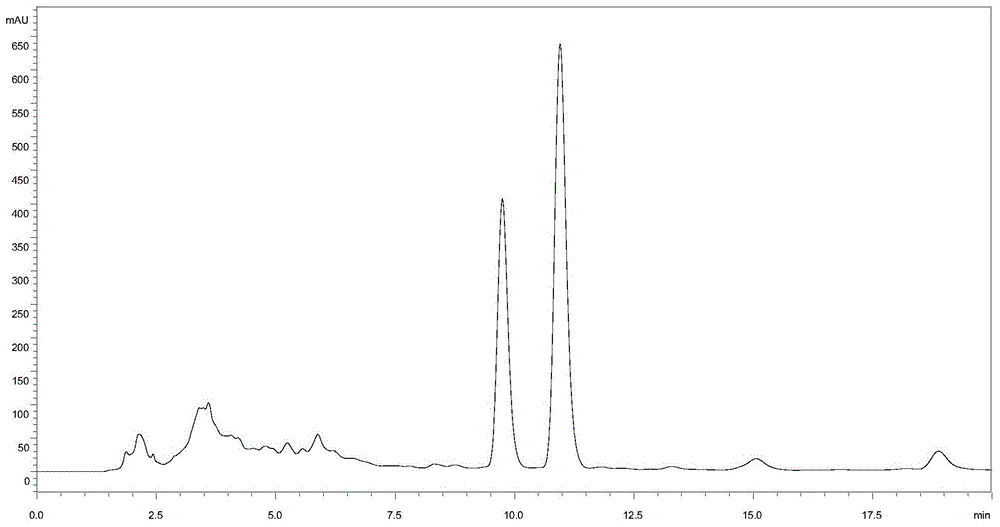
:埃博霉素(epotuilones)是1993年在黏细菌纤维堆囊菌sorangiumcellulosum的次级代谢产物中发现的,其结构以十六元内酯大环为中心体、噻唑环配基为侧链的一类细胞毒化合物,是一种具有类似紫杉醇微管蛋白聚合和微管稳定作用的抗肿瘤药物。紫杉醇在20世纪末取得了巨大的成功,然而其来源极其匮乏,本身毒副作用及多药耐药性细胞系等因素也限制了其使用。埃博霉素与紫杉醇相比,没有植物来源的制约,没有紫杉醇的复杂结构、水不溶性等缺点,也没有紫杉醇临床应用中的中性粒细胞减少症、外周神经病变、脱发、过敏等严重副作用,因此埃博霉素是一个很有发展潜力的抗肿瘤药物或中间体物质。2007年,埃博霉素b的衍生物伊沙匹隆在美国批准上市,激发了人们对埃博霉素类化合物研究的热潮,目前已有多种埃博霉素类化合物进入不同阶段的临床评估,如bms-247550、bms310705、kos-862以及zk-epo等,他们都为埃博霉素类或其衍生物。在埃博霉素b发酵过程中,由于纤维堆囊菌形态多变,次级代谢产物复杂,产量低,而且不稳定,自身的次级代谢终产物能够抑制或阻遏它们自身的生物合成酶,从而影响埃博霉素b的产量。因此,hecht等研究发现在培养液发酵时,加入吸附树脂,可以及时有效地分离出发酵产物,能够阻止对自身生物合成的负反馈和产生菌的生长抑制,这是埃博霉素工业化发酵生产的重要环节。一般在埃博霉素b发酵过程中加入xad-16n、x-5、ab-8、hz-8166、d101或hz-835等树脂来有效吸附埃博霉素b,使得埃博霉素b的产量得到很大的提高。发酵结束后收集树脂,进行提取。常规的提取纯化过程主要包括极性有机溶剂浸提,减压浓缩后加入乙酸乙酯萃取,萃取液浓缩后一般要进行硅胶柱层析、然后再进行反相色谱纯化。在发酵结束后收集树脂过程中,一般需要将发酵液经板框过滤或离心来进行固液分离,但板框过滤或离心操作繁琐,发明人尝试不经过板框过滤,直接将发酵液放置一段时间后,倒掉发酵清液,将剩余菌体及树脂装柱进行下一步的分离纯化;然而,这种方式很容易堵塞树脂柱筛板,难以进行下一步的纯化过程。经板框过滤或离心所收集的固体中包含菌体和吸附有埃博霉素b的树脂,菌体中不含埃博霉素b但含有与其结构相似的杂质,该杂质的保留时间在埃博霉素a和埃博霉素b之间,在后续的纯化过程中难以除去,以至于影响到埃博霉素b终产品的质量;另外此类方法收集到的是树脂与菌体,菌体量较大,后续浸提所使用的有机溶剂量大。因此需要寻找一种操作简单、树脂和菌体有效分离的方法、浸提过程有机溶剂使用量较少的埃博霉素b发酵液的预处理方法。技术实现要素:基于现有技术中存在的缺陷,本发明的目的在于提供一种操作简单、树脂和菌体能有效分离,后续浸提有机溶剂使用量少的埃博霉素b发酵液的预处理方法。本发明的技术方案如下:在含吸附有埃博霉素b树脂的发酵液中加入无机盐,搅拌溶解后静置分层,放出下层菌体相,收集上层树脂进行装柱,纯化水和有机溶剂水溶液冲洗树脂柱,收集含有埃博霉素b的流出液。优选地,所述的无机盐为氯化钠、氯化钾、硫酸锌、硫酸镁中的一种或几种;优选氯化钠。优选地,所述的无机盐的加入量为足以使得树脂与菌体实现分层,树脂在上层,菌体沉积在下层,例如可调节发酵体系密度不低于1.10g/cm3,在一些实施方式中,调节发酵体系密度为1.10~1.20g/cm3,在一些优选的实施方式中调节发酵体系密度为1.14~1.16g/cm3。优选地,可以在加入无机盐前静置10~30min,使得树脂和菌体沉淀后,去除发酵上清液,以减少无机盐的使用量;进一步优选地,去除发酵上清液体积的80~90%。优选地,所述的层析柱为聚丙烯柱或不锈钢柱。优选地,树脂装柱后先用纯化水和/或体积分数为10~20%有机溶剂水溶液洗杂,再用体积分数为90~100%有机溶剂水溶液洗脱至流出液中不含埃博霉素b。优选地,所述的有机溶剂为乙醇、异丙醇或甲醇。在另一个实施方案中,树脂装柱后先用纯化水冲洗层析柱,再用乙酸乙酯洗脱至流出液中不含埃博霉素b。优选地,树脂柱冲洗过程流速为2~3bv/h,bv是指树脂柱床体积。需要说明的是,本发明不限制埃博霉素b发酵液的来源,现有技术方法得到的埃博霉素b发酵液均可适用于本发明。同样也不限制发酵液中吸附埃博霉素b的树脂类型,用于吸附埃博霉素b的大孔树脂均可适用于本发明。本领域技术人员可以预知,本发明的方法同样可适用于其他产品在发酵过程中添加大孔树脂吸附目的产物、提取时需将菌体和树脂分离的工艺步骤中,不仅仅限于埃博霉素b产品。与现有技术相比,本发明取得了如下的优势:本发明在发酵液中加入无机盐,使得树脂和菌体彻底分离,除去菌体后只剩树脂相,后续浸提物减少到原来的1/3,节省了进一步浸提所用的有机溶剂,也避免了菌体内杂质引入到后续的纯化过程中,从源头上去除与埃博霉素b保留时间相近的杂质。另外,经过分离后的树脂相不需要离心或板框过滤,直接装柱,不堵塞筛板,节省过柱时间。本发明所述的埃博霉素b发酵液的预处理方法,使得菌体与树脂较好的分离,简化了后续提取步骤,减少了后续浸提有机溶剂的使用量,提高了提取效率及收率,通用性强,工业化成本较低。附图说明图1:实施例1树脂柱收集液的hplc图谱,埃博霉素a保留时间为9.746min,埃博霉素b保留时间为10.954min。图2:实施例1hplc色谱峰积分表,与图1对应。图3:对比实施例1树脂柱收集液的hplc图谱,埃博霉素a保留时间为9.587min,埃博霉素b杂质保留时间为10.070min,埃博霉素b保留时间为10.765min。图4:对比实施例1hplc色谱峰积分表,与图3对应。具体实施方式下面结合具体实施例来对本发明的技术方案进一步详细说明,但本发明不限于以下实施例。以下实施例中埃博霉素b发酵液可参照现有技术的方法制备,例如可参照cn103276028a、cn106834377a或王娜,埃博霉素b的发酵工艺研究,2014年,陕西科技大学,所公开的方法或现有技术的其他方法制备埃博霉素b发酵液。以下实施例中所使用的试剂、材料等如非特别说明均可通过商业途径获得。以下实施例中所使用的埃博霉素b发酵液经过如下的方法制备:埃博霉素b生产菌为纤维堆囊菌atcc25532。培养方法(2m3发酵罐)为:1)固体平板培养:其固体培养基成份为,葡萄糖0.1%、蛋白胨0.2%、硫酸镁0.1%、氯化钙0.2%、磷酸氢二钾0.2%、酵母提取物0.3%。调节ph至7.2,于121℃灭菌30分钟,菌种涂布于固体平板培养基上,30℃倒置培养6-7天。2)摇瓶扩培:平板接种于摇瓶中,摇瓶培养基的组份为葡萄糖0.1%、可溶性淀粉2%、硫酸镁0.1%、氯化钙0.2%、磷酸氢二钾0.2%、酵母提取物0.3%。调节ph至7.2,于121℃灭菌30分钟,30℃,200rpm培养4-5天。3)种子培养:将摇瓶接种于种子罐中,培养基与摇瓶培养基相同,121℃蒸汽灭菌30分钟,灭菌后接种,培养温度为30℃,转速为200rpm,通气量为0.5vvm,罐压为0.04kg/cm2,并流加氨水使ph维持在7.2,当溶氧下降变缓时,进行移种。4)发酵培养:发酵培养基组份为可溶性淀粉0.3%、硫酸镁0.2%、氯化钙0.3%、磷酸氢二钾0.2%、酵母提取物0.3%,花生粉0.5%。121℃蒸汽灭菌30分钟,灭菌后压差接种于2吨发酵罐中,培养温度为30℃,转速为200rpm,通气量为0.5vvm,罐压为0.04kg/cm2,流加氨水或丙酸使ph维持在7.2。为了提高埃博霉素的产量,在培养48小时后,加入1%(w/v)大孔树脂xad-16n,x-5,ab-8,hz-8166,d101或hz-835,这样既让菌体在发酵前期得到了充分生长,又能够避免发酵后期的产物抑制。发酵96小时开始测定效价,直至效价不再明显增加时结束发酵,测定埃博霉素b含量,结果见表1。表1不同发酵批次埃博霉素发酵情况发酵液批次大孔树脂埃博霉素b含量1xad-16n86.5mg/l2xad-16n85.7mg/l3x-544.6mg/l4ab-842.3mg/l5hz-81675.4mg/l6d10164.7mg/l7hz-83580.1mg/l8xad-16n85.4mg/l产品hplc检测分析条件如下:色谱柱:agieintzorbaxsb-aq,规格为4.6×250mm,填料粒径5mm;流动相:乙腈-水(45:55);检测波长:249nm;流速:1ml/min;进样量:20μl。实施例11.2m3发酵液(埃博霉素b含量86.5mg/l)静置30min,待xad-16n树脂和菌体沉淀后,从上层放出发酵清液1m3,剩余200l,加入氯化钠固体40g,缓慢搅拌10min,待氯化钠固体全部溶解后取样检测剩余发酵液密度1.150g/cm3,静置10~20min,菌体沉积在下层,xad-16n树脂漂浮在上层,从下层放出带有菌体的发酵液,收集树脂12kg,装入不锈钢层析柱。用50l纯化水冲洗不锈钢柱,然后再用75l体积分数为15%乙醇水溶液冲洗不锈钢层析柱,最后用无水乙醇冲洗至流出液中不含埃博霉素b,冲洗和洗脱流速为2bv/h,收集含有埃博霉素b的洗脱液40l,hplc检测埃博霉素b的含量为2.38g/l,收率91.7%,hplc色谱图见图1,埃博霉素a出峰时间为9.746min,埃博霉素b出峰时间为10.954min,没有检测到埃博霉素a和b之间的杂质峰。乙醇用量共75l。实施例21.2m3发酵液(埃博霉素b含量85.7mg/l)静置30min,待xad-16n树脂和菌体沉淀后,从上层放出发酵清液1m3,剩余200l,加入七水硫酸锌固体50g,缓慢搅拌10min,待七水硫酸锌固体全部溶解后取样检测剩余发酵液密度1.159g/cm3,静置10~20min,菌体沉积在下层,xad-16n树脂漂浮在上层,从下层放出带有菌体的发酵液,收集树脂12kg,装入聚丙烯层析柱。用50l纯化水冲洗聚丙烯层析柱,然后再用100l体积分数为10%乙醇水溶液冲洗聚丙烯层析柱,最后用体积分数90%乙醇水溶液冲洗至流出液中不含埃博霉素b,冲洗和洗脱流速为3bv/h,收集含有埃博霉素b的洗脱液60l,hplc检测埃博霉素b的含量为1.56g/l,收率91.0%,没有检测到埃博霉素a和b之间的杂质峰。乙醇用量共82l。实施例31.2m3发酵液(埃博霉素b含量44.6mg/l)静置30min,待x-5树脂和菌体沉淀后,从上层放出发酵清液1m3,剩余200l,加入七水硫酸镁固体60g,缓慢搅拌10min,待七水硫酸镁固体全部溶解后取样检测剩余发酵液密度1.145g/cm3,静置10~20min,菌体沉积在下层,x-5树脂漂浮在上层,从下层放出带有菌体的发酵液,收集树脂12kg,装入聚丙烯层析柱。用50l纯化水冲洗聚丙烯层析柱,然后再用70l体积分数为20%甲醇水溶液冲洗聚丙烯层析柱,最后用无水甲醇冲洗至流出液中不含埃博霉素b,冲洗和洗脱流速为2bv/h,收集含有埃博霉素b的洗脱液42l,hplc检测埃博霉素b的含量为1.15g/l,收率90.2%,没有检测到埃博霉素a和b之间的杂质峰。甲醇用量共76l。实施例41.2m3发酵液(埃博霉素b含量42.3mg/l)静置30min,待ab-8树脂和菌体沉淀后,从上层放出发酵清液1m3,剩余200l,加入氯化钾固体50g,缓慢搅拌10min,待氯化钾固体全部溶解后取样检测剩余发酵液密度1.158g/cm3,静置10~20min,菌体沉积在下层,ab-8树脂漂浮在上层,从下层放出带有菌体的发酵液,收集树脂12kg,装入不锈钢层析柱。用50l纯化水冲洗不锈钢层析柱,然后再用75l体积分数为15%异丙醇水溶液冲洗不锈钢层析柱,最后用体积分数90%异丙醇水溶液冲洗至流出液中不含埃博霉素b,冲洗和洗脱流速为2bv/h,收集含有埃博霉素b的洗脱液45l,hplc检测埃博霉素b的含量为0.99g/l,收率87.7%,没有检测到埃博霉素a和b之间的杂质峰。异丙醇用量共76l。实施例51.2m3发酵液(埃博霉素b含量75.4mg/l)静置30min,待hz-816树脂和菌体沉淀后,从上层放出发酵清液1m3,剩余200l,加入氯化钠固体40g,缓慢搅拌10min,待氯化钠固体全部溶解后取样检测剩余发酵液密度1.149g/cm3,静置10~20min,菌体沉积在下层,hz-816树脂漂浮在上层,从下层放出带有菌体的发酵液,收集树脂12kg,装入不锈钢层析柱。用50l纯化水冲洗不锈钢层析柱,然后用乙酸乙酯冲洗至流出液中不含埃博霉素b,冲洗和洗脱流速为2bv/h,收集含有埃博霉素b的洗脱液(分层后的乙酸乙酯相)72l,hplc检测埃博霉素b的含量为1.13g/l,收率89.9%,没有检测到埃博霉素a和b之间的杂质峰。乙酸乙酯用量共90l。实施例61.2m3发酵液(埃博霉素b含量64.7mg/l)静置30min,待d101树脂和菌体沉淀后,从上层放出发酵清液1m3,剩余200l,加入氯化钠固体40g,缓慢搅拌10min,待氯化钠固体全部溶解后取样检测剩余发酵液密度1.151g/cm3,10~20min,菌体沉积在下层,d101树脂漂浮在上层,从下层放出带有菌体的发酵液,收集树脂12kg,装入不锈钢层析柱。用50l纯化水冲洗不锈钢柱,然后再用100l体积分数为15%乙醇水溶液冲洗不锈钢层析柱,最后用无水乙醇冲洗至流出液中不含埃博霉素b,冲洗和洗脱流速为2bv/h,收集含有埃博霉素b的洗脱液37l,hplc检测埃博霉素b的含量为1.93g/l,收率92.0%,没有检测到埃博霉素a和b之间的杂质峰。乙醇用量共72l。实施例71.2m3发酵液(埃博霉素b含量80.1mg/l)静置10min,待hz-835树脂和菌体沉淀后,从上层放出发酵清液0.9m3,剩余300l,加入氯化钠固体60g,缓慢搅拌10min,待氯化钠固体全部溶解后取样检测剩余发酵液密度1.151g/cm3,静置10~20min,菌体沉积在下层,hz-835树脂漂浮在上层,从下层放出带有菌体的发酵液,收集树脂12kg,装入不锈钢层析柱。用50l纯化水冲洗不锈钢柱,然后再用100l体积分数为10%乙醇水溶液冲洗不锈钢层析柱,最后用90%乙醇水溶液冲洗至流出液中不含埃博霉素b,冲洗和洗脱流速为3bv/h,收集含有埃博霉素b的洗脱液58l,hplc检测埃博霉素b的含量为1.52g/l,收率91.7%,没有检测到埃博霉素a和b之间的杂质峰。乙醇用量共80l。对比实施例11.2m3发酵液(埃博霉素b含量85.4mg/l)加入2kg硅藻土,缓慢搅拌经板框过滤,收集固体物46kg,装入不锈钢层析柱体积约60l;用180l纯化水冲洗不锈钢柱,然后再用200l体积分数为15%乙醇水溶液冲洗不锈钢层析柱,最后用无水乙醇冲洗至流出液中不含埃博霉素b,由于菌体堵塞层析柱滤板,冲洗和洗脱流速根据柱压调整在0.5-1bv/h,收集含有埃博霉素b的洗脱液95l,hplc检测埃博霉素b的含量为0.89g/l,收率82.5%,hplc色谱图见图2,埃博霉素a出峰时间为9.587min,埃博霉素b出峰时间为10.765min,埃博霉素a和b之间的杂质峰出峰时间为10.070min。乙醇用量共195l。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1